Zink
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zink | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Erscheinungsbild | silbergrau | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Zn) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zink im Periodensystem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | Gruppe 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | Periode 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-Block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Argon|Ar]]] 3d10 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase bei STP | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 692,68 K (419,53 °C, 787,15 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1180 K (907 °C, 1665 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 7,14 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 6,57 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 7,32 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 115 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molare Wärmekapazität | 25.470 J/(mol-K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Verdampfungsdruck
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationsstufen | -2, 0, +1, +2 (ein amphoteres Oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 1.65 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionisierungsenergien |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | empirisch: 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 122±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spektrallinien von Zink | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Andere Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natürliches Vorkommen | Ursprünglich | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal dicht gepackt (hcp) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | 3850 m/s (bei r.t.) (gewalzt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermische Ausdehnung | 30,2 µm/(m⋅K) (bei 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 116 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifischer elektrischer Widerstand | 59,0 nΩ⋅m (bei 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -11,4×10-6 cm3/mol (298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 108 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schermodul | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 70 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs-Härte | 2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell-Härte | 327-412 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-66-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Geschichte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entdeckung | Indische Metallurgen (vor 1000 v. Chr.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erste Isolierung | Andreas Sigismund Marggraf (1746) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Anerkannt als ein einzigartiges Metall von | Rasaratna Samuccaya (1300) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hauptisotope von Zink | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zink ist ein chemisches Element mit dem Symbol Zn und der Ordnungszahl 30. Zink ist bei Raumtemperatur ein leicht sprödes Metall und hat ein silbrig-graues Aussehen, wenn die Oxidation entfernt wird. Es ist das erste Element der Gruppe 12 (IIB) des Periodensystems. In mancher Hinsicht ist Zink dem Magnesium chemisch ähnlich: Beide Elemente weisen nur eine normale Oxidationsstufe (+2) auf, und die Zn2+- und Mg2+-Ionen haben eine ähnliche Größe. Zink ist das am 24. häufigsten vorkommende Element in der Erdkruste und hat fünf stabile Isotope. Das am häufigsten vorkommende Zinkerz ist Sphalerit (Zinkblende), ein Zinksulfidmineral. Die größten abbauwürdigen Erzlagerstätten befinden sich in Australien, Asien und den Vereinigten Staaten. Zink wird durch Schaumflotation des Erzes, Rösten und abschließende Extraktion mit Hilfe von Strom (Elektrolyse) aufbereitet. ⓘ
Messing, eine Legierung aus Kupfer und Zink in verschiedenen Anteilen, wurde bereits im dritten Jahrtausend v. Chr. im ägäischen Raum und in der Region, die heute den Irak, die Vereinigten Arabischen Emirate, Kalmückien, Turkmenistan und Georgien umfasst, verwendet. Im zweiten Jahrtausend v. Chr. wurde es in den Regionen verwendet, die heute Westindien, Usbekistan, Iran, Syrien, Irak und Israel umfassen. In Indien wurde Zinkmetall erst im 12. Jahrhundert in großem Umfang hergestellt, obwohl es schon den alten Römern und Griechen bekannt war. In den Minen von Rajasthan gibt es eindeutige Belege für die Zinkproduktion, die bis ins 6. Jahrhundert vor Christus zurückreichen. Der bisher älteste Nachweis für reines Zink stammt aus Zawar in Rajasthan aus dem 9. Jahrhundert n. Chr., als ein Destillationsverfahren zur Herstellung von reinem Zink eingesetzt wurde. Alchemisten verbrannten Zink an der Luft, um das zu erhalten, was sie "Philosophenwolle" oder "weißen Schnee" nannten. ⓘ
Das Element wurde wahrscheinlich von dem Alchemisten Paracelsus nach dem deutschen Wort Zinke (Zacke, Zahn) benannt. Dem deutschen Chemiker Andreas Sigismund Marggraf wird die Entdeckung von reinem metallischem Zink im Jahr 1746 zugeschrieben. Luigi Galvani und Alessandro Volta entdeckten um 1800 die elektrochemischen Eigenschaften von Zink. Die korrosionsbeständige Verzinkung von Eisen (Feuerverzinkung) ist die wichtigste Anwendung für Zink. Weitere Anwendungen finden sich in elektrischen Batterien, kleinen nicht-strukturellen Gussteilen und Legierungen wie Messing. Eine Vielzahl von Zinkverbindungen wird häufig verwendet, z. B. Zinkcarbonat und Zinkgluconat (als Nahrungsergänzungsmittel), Zinkchlorid (in Deodorants), Zinkpyrithion (Anti-Schuppen-Shampoos), Zinksulfid (in Leuchtfarben) und Dimethylzink oder Diethylzink im organischen Labor. ⓘ
Zink ist ein essentieller Mineralstoff, der für die pränatale und postnatale Entwicklung notwendig ist. Zinkmangel betrifft etwa zwei Milliarden Menschen in den Entwicklungsländern und wird mit zahlreichen Krankheiten in Verbindung gebracht. Bei Kindern führt der Mangel zu Wachstumsverzögerungen, verzögerter sexueller Reifung, Infektionsanfälligkeit und Durchfallerkrankungen. Enzyme mit einem Zinkatom im reaktiven Zentrum sind in der Biochemie weit verbreitet, wie beispielsweise die Alkoholdehydrogenase beim Menschen. Der Verzehr von überschüssigem Zink kann zu Ataxie, Lethargie und Kupfermangel führen. ⓘ
Zink ist ein chemisches Element mit dem Elementsymbol Zn und der Ordnungszahl 30. Zink wird zu den Übergangsmetallen gezählt, nimmt aber darin eine Sonderstellung ein, da es wegen der abgeschlossenen d-Schale in seinen Eigenschaften eher den Erdalkalimetallen ähnelt. Nach der veralteten Zählung wird die Zinkgruppe als 2. Nebengruppe bezeichnet (analog zu den Erdalkalimetallen als 2. Hauptgruppe), nach der aktuellen IUPAC-Nomenklatur bildet Zink mit Cadmium, Quecksilber und dem ausschließlich in der Forschung relevanten Copernicium die Gruppe 12. Es ist ein bläulich-weißes sprödes Metall und wird unter anderem zum Verzinken von Eisen und Stahlteilen sowie für Regenrinnen verwendet. Zink ist für alle Lebewesen essentiell und Bestandteil wichtiger Enzyme. Der Name Zink kommt von Zinke, Zind („Zahn, Zacke“), da Zink zackenförmig erstarrt. ⓘ
Eigenschaften
Physikalische Eigenschaften
Zink ist ein bläulich-weißes, glänzendes, diamagnetisches Metall, obwohl die meisten handelsüblichen Qualitäten des Metalls eine matte Oberfläche aufweisen. Es hat eine etwas geringere Dichte als Eisen und eine hexagonale Kristallstruktur mit einer verzerrten Form der hexagonalen dichten Packung, bei der jedes Atom sechs nächste Nachbarn (bei 265,9 pm) in seiner eigenen Ebene und sechs weitere in einem größeren Abstand von 290,6 pm hat. Das Metall ist bei den meisten Temperaturen hart und spröde, wird aber zwischen 100 und 150 °C verformbar. Über 210 °C wird das Metall wieder spröde und kann durch Schlagen pulverisiert werden. Zink ist ein guter elektrischer Leiter. Für ein Metall hat Zink relativ niedrige Schmelz- (419,5 °C) und Siedepunkte (907 °C). Der Schmelzpunkt ist der niedrigste aller d-Block-Metalle, abgesehen von Quecksilber und Kadmium; unter anderem aus diesem Grund werden Zink, Kadmium und Quecksilber oft nicht als Übergangsmetalle wie die übrigen d-Block-Metalle betrachtet. ⓘ
Viele Legierungen enthalten Zink, darunter auch Messing. Andere Metalle, von denen seit langem bekannt ist, dass sie binäre Legierungen mit Zink bilden, sind Aluminium, Antimon, Wismut, Gold, Eisen, Blei, Quecksilber, Silber, Zinn, Magnesium, Kobalt, Nickel, Tellur und Natrium. Obwohl weder Zink noch Zirkonium ferromagnetisch sind, zeigt ihre Legierung ZrZn
2 weist unterhalb von 35 K Ferromagnetismus auf. ⓘ
Vorkommen
Zink macht etwa 75 ppm (0,0075 %) der Erdkruste aus und ist damit das am 24. häufigsten vorkommende Element. Typische Hintergrundkonzentrationen von Zink übersteigen nicht 1 μg/m3 in der Atmosphäre, 300 mg/kg im Boden, 100 mg/kg in der Vegetation, 20 μg/L im Süßwasser und 5 μg/L im Meerwasser. Das Element kommt normalerweise in Verbindung mit anderen unedlen Metallen wie Kupfer und Blei in Erzen vor. Zink ist ein Chalkophil, d. h. das Element kommt in Mineralien eher zusammen mit Schwefel und anderen schweren Chalkogenen vor als mit dem leichten Chalkogen Sauerstoff oder mit nicht-chalcogenen elektronegativen Elementen wie den Halogenen. Sulfide bildeten sich, als sich die Kruste unter den reduzierenden Bedingungen der frühen Erdatmosphäre verfestigte. Sphalerit, eine Form von Zinksulfid, ist das am meisten abgebaute zinkhaltige Erz, da sein Konzentrat 60-62 % Zink enthält. ⓘ
Andere Zinkmineralien sind Smithsonit (Zinkkarbonat), Hemimorphit (Zinksilikat), Wurtzit (ein weiteres Zinksulfid) und manchmal Hydrozinkit (basisches Zinkkarbonat). Mit Ausnahme von Wurtzit sind alle diese Minerale durch Verwitterung der ursprünglichen Zinksulfide entstanden. ⓘ
Die weltweit nachgewiesenen Zinkvorkommen belaufen sich auf insgesamt 1,9 bis 2,8 Milliarden Tonnen. Große Vorkommen befinden sich in Australien, Kanada und den Vereinigten Staaten, wobei die größten Reserven im Iran liegen. Die jüngste Schätzung der Zinkreserven (die bestimmte physikalische Mindestkriterien in Bezug auf die derzeitigen Bergbau- und Produktionspraktiken erfüllen) stammt aus dem Jahr 2009 und beläuft sich auf etwa 480 Mio. Tonnen. Bei den Zinkreserven hingegen handelt es sich um geologisch identifizierte Erzkörper, deren Eignung zur Gewinnung zum Zeitpunkt der Bestimmung wirtschaftlich begründet ist (Lage, Gehalt, Qualität und Quantität). Da die Exploration und die Erschließung von Minen ein fortlaufender Prozess ist, ist die Menge der Zinkreserven keine feste Zahl, und die Nachhaltigkeit der Zinkerzvorräte kann nicht einfach durch Extrapolation der Gesamtlebensdauer der heutigen Zinkminen beurteilt werden. Dieses Konzept wird durch Daten des United States Geological Survey (USGS) untermauert, aus denen hervorgeht, dass die veredelte Zinkproduktion zwischen 1990 und 2010 zwar um 80 % gestiegen ist, die Lebensdauer der Zinkreserven jedoch unverändert geblieben ist. Im Laufe der Geschichte wurden bis 2002 etwa 346 Millionen Tonnen abgebaut, und Wissenschaftler schätzen, dass etwa 109-305 Millionen Tonnen in Gebrauch sind. ⓘ

Große Lagerstätten existieren in Nordamerika (Vereinigte Staaten, Kanada), Australien, der Volksrepublik China und Kasachstan. Auch in Deutschland gab es Zinkerzlagerstätten, beispielsweise in Brilon, im Raum Eschweiler-Stolberg im Rheinland, am Rammelsberg im Harz, Freiberg oder bei Ramsbeck im Sauerland. Oberirdisch kann man in diesen Gebieten seltene Pflanzen finden, die auf zinkhaltigen Böden besonders gut wachsen, wie das gelbe Galmeiveilchen, das nach dem alten Namen für das Zinkerz Smithsonit (Galmei) benannt ist. ⓘ
Isotope
In der Natur kommen fünf stabile Isotope von Zink vor, wobei 64Zn das häufigste Isotop ist (49,17 % natürliche Häufigkeit). Die anderen in der Natur vorkommenden Isotope sind 66
Zn (27,73 %), 67
Zn (4,04 %), 68
Zn (18,45%) und 70
Zn (0,61 %). ⓘ
Mehrere Dutzend Radioisotope sind charakterisiert worden. 65
Zn, das eine Halbwertszeit von 243,66 Tagen hat, ist das am wenigsten aktive Radioisotop, gefolgt von 72
Zn mit einer Halbwertszeit von 46,5 Stunden. Zink hat 10 Kernisomere. 69mZn hat mit 13,76 Stunden die längste Halbwertszeit. Das hochgestellte m steht für ein metastabiles Isotop. Der Kern eines metastabilen Isotops befindet sich in einem angeregten Zustand und kehrt in den Grundzustand zurück, indem er ein Photon in Form eines Gammastrahls aussendet. 61
Zn hat drei angeregte metastabile Zustände und 73
Zn hat zwei. Die Isotope 65
Zn, 71
Zn, 77
Zn und 78
Zn haben jeweils nur einen angeregten metastabilen Zustand. ⓘ
Der häufigste Zerfallsmodus eines Radioisotops von Zink mit einer Massenzahl kleiner als 66 ist der Elektroneneinfang. Das aus dem Elektroneneinfang resultierende Zerfallsprodukt ist ein Kupferisotop. ⓘ
- n
30Zn
+
e-
→ n
29Cu ⓘ
Der häufigste Zerfallsmodus eines Radioisotops von Zink mit einer Massenzahl über 66 ist der Betazerfall (β-), bei dem ein Isotop von Gallium entsteht.
- n
30Zn
→ n
31Ga
+
e-
+
ν
e ⓘ
→ Liste der Zink-Isotope ⓘ
Verbindungen und Chemie
Reaktivität
Zink hat eine Elektronenkonfiguration von [Ar]3d104s2 und gehört zur Gruppe 12 des Periodensystems. Es ist ein mäßig reaktives Metall und ein starkes Reduktionsmittel. Die Oberfläche des reinen Metalls läuft schnell an und bildet schließlich eine schützende Passivierungsschicht aus dem basischen Zinkcarbonat Zn
5(OH)
6(CO3)
2, durch Reaktion mit atmosphärischem Kohlendioxid. ⓘ
Zink verbrennt an der Luft mit einer hellen bläulich-grünen Flamme, wobei Zinkoxiddämpfe entstehen. Zink reagiert leicht mit Säuren, Laugen und anderen Nichtmetallen. Hochreines Zink reagiert bei Raumtemperatur nur langsam mit Säuren. Starke Säuren, wie Salz- oder Schwefelsäure, können die Passivierungsschicht entfernen, und bei der anschließenden Reaktion mit der Säure wird Wasserstoffgas freigesetzt. ⓘ
Die Chemie des Zinks wird von der Oxidationsstufe +2 beherrscht. Bei der Bildung von Verbindungen in dieser Oxidationsstufe gehen die Elektronen der äußeren Schale verloren, so dass ein blankes Zinkion mit der Elektronenkonfiguration [Ar]3d10 entsteht. In wässriger Lösung entsteht ein oktaedrischer Komplex, [Zn(H
2O)6]2+
ist die vorherrschende Spezies. Die Verflüchtigung von Zink in Verbindung mit Zinkchlorid bei Temperaturen über 285 °C zeigt die Bildung von Zn
2Cl
2, eine Zinkverbindung mit der Oxidationsstufe +1. Es sind keine Zinkverbindungen in anderen positiven Oxidationsstufen als +1 oder +2 bekannt. Berechnungen zeigen, dass die Existenz einer Zinkverbindung mit der Oxidationsstufe +4 unwahrscheinlich ist. Es wird vorhergesagt, dass Zn(III) in Anwesenheit von stark elektronegativen Trianionen existiert; es bestehen jedoch einige Zweifel an dieser Möglichkeit. Im Jahr 2021 wurde jedoch eine weitere Verbindung mit der Oxidationsstufe +3 mit der Formel ZnBeB11(CN)12 gemeldet, für die mehr Beweise vorliegen. ⓘ
Die Chemie des Zinks ähnelt der Chemie der späten Übergangsmetalle der ersten Reihe, Nickel und Kupfer, obwohl es eine gefüllte d-Schale hat und die Verbindungen diamagnetisch und meist farblos sind. Die Ionenradien von Zink und Magnesium sind fast identisch. Aus diesem Grund haben einige der äquivalenten Salze die gleiche Kristallstruktur, und in anderen Fällen, in denen der Ionenradius ein entscheidender Faktor ist, hat die Chemie des Zinks viel mit der des Magnesiums gemeinsam. In anderer Hinsicht gibt es wenig Ähnlichkeiten mit den späten Übergangsmetallen der ersten Reihe. Zink neigt dazu, Bindungen mit einem höheren Grad an Kovalenz und viel stabilere Komplexe mit N- und S-Donatoren zu bilden. Zinkkomplexe sind meist 4- oder 6-koordiniert, obwohl auch 5-koordinierte Komplexe bekannt sind. ⓘ
Chemisch zählt Zink zu den unedlen Metallen (Redoxpotential −0,763 Volt). Das kann beispielsweise dafür ausgenutzt werden, edlere Metalle aus ihren Salzen durch Reduktion elementar abzuscheiden, wie hier am Beispiel der Umsetzung eines Kupfersalzes gezeigt wird:
In Pulverform ist Zink ein selbstentzündlicher (pyrophorer) Feststoff. Er kann sich bei Raumtemperatur an der Luft ohne Energiezufuhr erhitzen und schließlich entzünden. Die Zündbereitschaft hängt unter anderem sehr stark von der Korngröße und dem Verteilungsgrad ab. Bei Kontakt mit Wasser bildet Zinkpulver entzündliche Gase, die sich spontan entzünden können. ⓘ
Zink(I)-Verbindungen
Zink(I)-Verbindungen sind selten und benötigen sperrige Liganden zur Stabilisierung des niedrigen Oxidationszustands. Die meisten Zink(I)-Verbindungen enthalten formal den [Zn2]2+-Kern, der analog zum dimeren [Hg2]2+-Kation in Quecksilber(I)-Verbindungen ist. Die diamagnetische Natur des Ions bestätigt seine dimere Struktur. Die erste Zink(I)-Verbindung mit einer Zn-Zn-Bindung, (η5-C5Me5)2Zn2, ist auch das erste Dimetallocen. Das [Zn2]2+-Ion disproportioniert schnell in Zinkmetall und Zink(II) und wurde nur in einem gelben diamagnetischen Glas durch Abkühlen einer Lösung von metallischem Zink in geschmolzenem ZnCl2 erhalten. ⓘ
Zink(II)-Verbindungen


Binäre Verbindungen von Zink sind für die meisten Metalloide und alle Nichtmetalle außer den Edelgasen bekannt. Das Oxid ZnO ist ein weißes Pulver, das in neutralen wässrigen Lösungen fast unlöslich ist, aber amphoter ist und sich sowohl in stark basischen als auch sauren Lösungen auflöst. Die anderen Chalkogenide (ZnS, ZnSe und ZnTe) finden vielfältige Anwendung in der Elektronik und Optik. Pnictogenide (Zn
3N
2, Zn
3P
2, Zn
3As
2 und Zn
3Sb
2), das Peroxid (ZnO
2), das Hydrid (ZnH
2), und das Karbid (ZnC
2) sind ebenfalls bekannt. Von den vier Halogeniden hat ZnF
2 den stärksten ionischen Charakter, während die anderen (ZnCl
2, ZnBr
2 und ZnI
2) haben relativ niedrige Schmelzpunkte und gelten als eher kovalent. ⓘ
In schwach basischen Lösungen, die Zn2+
Ionen, bildet sich das Hydroxid Zn(OH)
2 als weißer Niederschlag. In stärkeren alkalischen Lösungen löst sich dieses Hydroxid und bildet Zinkate ([Zn(OH)4]2-
). Das Nitrat Zn(NO3)
2, Chlorat Zn(ClO3)
2, Sulfat ZnSO
4, Phosphat Zn
3(PO4)
2, Molybdat ZnMoO
4, Cyanid Zn(CN)
2, Arsenit Zn(AsO2)
2, Arsenat Zn(AsO4)
2-8H
2O und das Chromat ZnCrO
4 (eine der wenigen farbigen Zinkverbindungen) sind einige Beispiele für andere häufige anorganische Zinkverbindungen. ⓘ
Zinkorganische Verbindungen sind Verbindungen, die kovalente Zink-Kohlenstoff-Bindungen enthalten. Diethylzink ((C
2H5)
2Zn) ist ein Reagenz in der synthetischen Chemie. Es wurde erstmals 1848 durch die Reaktion von Zink und Ethyliodid beschrieben und war die erste bekannte Verbindung, die eine Metall-Kohlenstoff-Sigma-Bindung enthielt. ⓘ
Test auf Zink
Kobaltcyanidpapier (Rinnmann-Test für Zn) kann als chemischer Indikator für Zink verwendet werden. 4 g K3Co(CN)6 und 1 g KClO3 werden in 100 ml Wasser aufgelöst. Ein Papier wird in die Lösung getaucht und bei 100 °C getrocknet. Ein Tropfen der Probe wird auf das trockene Papier getropft und erhitzt. Eine grüne Scheibe zeigt das Vorhandensein von Zink an. ⓘ
Geschichte
Verwendung in der Antike
In der Charaka Samhita, die vermutlich zwischen 300 und 500 n. Chr. verfasst wurde, wird ein Metall erwähnt, das bei Oxidation Pushpanjan erzeugt, bei dem es sich vermutlich um Zinkoxid handelt. Die Zinkminen in Zawar, in der Nähe von Udaipur in Indien, sind seit der Maurya-Zeit (ca. 322 und 187 v. Chr.) aktiv. Die Verhüttung von metallischem Zink scheint jedoch um das 12. Jahrhundert n. Chr. begonnen zu haben. Einer Schätzung zufolge wurden an diesem Ort zwischen dem 12. und 16. Jahrhundert schätzungsweise eine Million Tonnen metallisches Zink und Zinkoxid hergestellt. Eine andere Schätzung geht von einer Gesamtproduktion von 60.000 Tonnen metallischem Zink in diesem Zeitraum aus. Im Rasaratna Samuccaya, das etwa im 13. Jahrhundert n. Chr. verfasst wurde, werden zwei Arten von zinkhaltigen Erzen erwähnt: eine für die Metallgewinnung und eine andere für medizinische Zwecke. ⓘ

Für die Verwendung von unreinem Zink in der Antike sind verschiedene Einzelbeispiele entdeckt worden. Schon Tausende von Jahren vor der Entdeckung des Zinks als eigenständiges Element wurden Zinkerze zur Herstellung der Zink-Kupfer-Legierung Messing verwendet. Judäisches Messing aus dem 14. bis 10. Jahrhundert v. Chr. enthält 23 % Zink. ⓘ
Das Wissen um die Herstellung von Messing verbreitete sich bis zum 7. Jahrhundert v. Chr. im antiken Griechenland, aber es wurden nur wenige Sorten hergestellt. Es wurden 2 500 Jahre alte Ornamente aus Legierungen gefunden, die 80-90 % Zink und den Rest Blei, Eisen, Antimon und andere Metalle enthalten. Eine möglicherweise prähistorische Statuette mit 87,5 % Zink wurde in einer archäologischen Stätte in Dakien gefunden. ⓘ
Die ältesten bekannten Pillen wurden aus den Zinkkarbonaten Hydrozinkit und Smithsonit hergestellt. Sie wurden an Bord des römischen Schiffes Relitto del Pozzino gefunden, das 140 v. Chr. gesunken war und gegen Augenschmerzen eingesetzt wurde. ⓘ
Die Herstellung von Messing war den Römern bereits um 30 v. Chr. bekannt. Sie stellten Messing her, indem sie pulverisiertes Galmei (Zinksilikat oder -karbonat), Holzkohle und Kupfer zusammen in einem Tiegel erhitzten. Das so entstandene Galmei-Messing wurde dann entweder gegossen oder für die Verwendung in Waffen in Form gehämmert. Einige Münzen, die von den Römern in der christlichen Zeit geprägt wurden, bestehen wahrscheinlich aus Galmeimessing. ⓘ
Strabo, der im 1. Jahrhundert v. Chr. schrieb (aber ein heute verlorenes Werk des Historikers Theopompus aus dem 4. Jahrhundert v. Chr. zitiert), erwähnt "Tropfen von falschem Silber", die, mit Kupfer vermischt, Messing ergeben. Dies könnte sich auf kleine Mengen Zink beziehen, die als Nebenprodukt bei der Verhüttung von sulfidischen Erzen anfallen. Das in den Schmelzöfen anfallende Zink wurde gewöhnlich weggeworfen, da es als wertlos galt. ⓘ
Die Berner Zinktafel ist eine Votivtafel aus dem römischen Gallien, die aus einer Legierung besteht, die hauptsächlich aus Zink besteht. ⓘ
Bereits im Altertum war Zink als Legierungsbestandteil von Messing in Gebrauch. Als eigenständiges Metall wurde Zink jedoch erst im 14. Jahrhundert in Indien und Messing ab dem 17. Jahrhundert entdeckt und verarbeitet. In dem 1679 erbauten Messinghof in Kassel wurde Galmei verhüttet. Im Jahre 1743 wurde in Bristol eine erste Zinkhütte in Betrieb genommen. Weitere entstanden im 19. Jahrhundert in Oberschlesien, z. B. Georg von Giesche bzw. deren Nachfolgefirma, im Aachen-Lütticher Raum sowie in Obersachsen und in Westfalen. Im Ruhrgebiet entstanden die ersten Hütten 1845 in Mülheim an der Ruhr und 1847 in Borbeck (heute Essen). Im Nordharz stellte die Zinkhütte Harlingerode in Harlingerode (heute Bad Harzburg) in der Mitte des 20. Jahrhunderts der größte Industriebetrieb zur Zinkverhüttung in Westdeutschland. ⓘ
Frühe Studien und Namensgebung
Zink wurde unter der Bezeichnung Yasada oder Jasada im medizinischen Lexikon des Hindu-Königs Madanapala (aus der Taka-Dynastie), das um das Jahr 1374 verfasst wurde, eindeutig als Metall anerkannt. Die Verhüttung und Gewinnung von unreinem Zink durch Reduktion von Galmei mit Wolle und anderen organischen Substanzen wurde im 13. Die Chinesen lernten diese Technik erst im 17. Jahrhundert kennen. ⓘ
Alchemisten verbrannten Zinkmetall an der Luft und sammelten das entstehende Zinkoxid in einem Kondensator. Einige Alchemisten nannten dieses Zinkoxid lana philosophica, lateinisch für "Philosophenwolle", weil es sich in wolligen Büscheln sammelte, während andere meinten, es sähe aus wie weißer Schnee und nannten es nix album. ⓘ
Der Name des Metalls wurde wahrscheinlich erstmals von Paracelsus, einem in der Schweiz geborenen deutschen Alchemisten, dokumentiert, der das Metall in seinem Buch Liber Mineralium II im 16. Das Wort leitet sich wahrscheinlich vom deutschen zinke ab und bedeutet angeblich "zahnartig, spitz oder gezackt" (metallische Zinkkristalle haben ein nadelartiges Aussehen). Zink könnte auch "zinnähnlich" bedeuten, da es mit dem deutschen Wort zinn verwandt ist, das Zinn bedeutet. Eine weitere Möglichkeit ist, dass das Wort vom persischen Wort سنگ seng abgeleitet ist, das Stein bedeutet. Das Metall wurde auch indisches Zinn, tutanego, calamine und spinter genannt. ⓘ
Der deutsche Metallurge Andreas Libavius erhielt im Jahr 1596 von einem von den Portugiesen gekaperten Frachtschiff eine Menge dessen, was er "Calay" von Malabar nannte. Libavius beschrieb die Eigenschaften der Probe, bei der es sich um Zink gehandelt haben könnte. Zink wurde im 17. und frühen 18. Jahrhundert regelmäßig aus dem Orient nach Europa importiert, war aber zeitweise sehr teuer. ⓘ
Isolierung

Metallisches Zink wurde bereits 1300 n. Chr. in Indien isoliert, viel früher als im Westen. Bevor es in Europa isoliert wurde, wurde es um 1600 n. Chr. aus Indien eingeführt. In Postlewayts Universal Dictionary, einer zeitgenössischen Quelle für technologische Informationen in Europa, wird Zink erst ab 1751 erwähnt, doch wurde das Element schon vorher untersucht. ⓘ
Der flämische Metallurge und Alchemist P. M. de Respour berichtete, dass er 1668 metallisches Zink aus Zinkoxid gewonnen habe. Zu Beginn des 18. Jahrhunderts beschrieb Étienne François Geoffroy, wie sich Zinkoxid als gelbe Kristalle auf Eisenstangen niederschlägt, die über dem Zinkerz liegen, das gerade verhüttet wird. In Großbritannien soll John Lane vor seinem Bankrott im Jahr 1726 Versuche zur Verhüttung von Zink durchgeführt haben, wahrscheinlich in Landore. ⓘ
1738 patentierte William Champion in Großbritannien ein Verfahren zur Gewinnung von Zink aus Galmei in einem vertikalen Retortenschmelzofen. Seine Technik ähnelte der in den Zawar-Zinkminen in Rajasthan angewandten, aber es gibt keine Hinweise darauf, dass er den Orient besuchte. Das Verfahren von Champion wurde bis 1851 verwendet. ⓘ
Die Entdeckung von reinem metallischem Zink wird normalerweise dem deutschen Chemiker Andreas Marggraf zugeschrieben, obwohl der schwedische Chemiker Anton von Swab vier Jahre zuvor Zink aus Galmei destilliert hatte. In seinem Experiment von 1746 erhitzte Marggraf eine Mischung aus Galmei und Holzkohle in einem geschlossenen Gefäß ohne Kupfer, um ein Metall zu erhalten. Dieses Verfahren wurde ab 1752 kommerziell nutzbar. ⓘ
Spätere Arbeiten

Der Bruder von William Champion, John, patentierte 1758 ein Verfahren zur Kalzinierung von Zinksulfid zu einem Oxid, das im Retortenverfahren verwendet werden konnte. Zuvor konnte nur Galmei zur Herstellung von Zink verwendet werden. 1798 verbesserte Johann Christian Ruberg das Schmelzverfahren durch den Bau der ersten horizontalen Retortenschmelze. Jean-Jacques Daniel Dony baute in Belgien eine andere Art von horizontaler Zinkhütte, die noch mehr Zink verarbeitete. Der italienische Arzt Luigi Galvani entdeckte 1780, dass die Verbindung des Rückenmarks eines frisch sezierten Frosches mit einer Eisenschiene, an der ein Messinghaken befestigt war, dazu führte, dass das Bein des Frosches zuckte. Er glaubte fälschlicherweise, eine Fähigkeit von Nerven und Muskeln zur Erzeugung von Elektrizität entdeckt zu haben, und nannte den Effekt "tierische Elektrizität". Die galvanische Zelle und der Prozess der Galvanisierung wurden beide nach Luigi Galvani benannt, und seine Entdeckungen ebneten den Weg für elektrische Batterien, die Galvanisierung und den kathodischen Schutz. ⓘ
Galvanis Freund, Alessandro Volta, erforschte den Effekt weiter und erfand im Jahr 1800 die Voltasche Säule. Voltas Pfahl bestand aus einem Stapel vereinfachter galvanischer Zellen, die jeweils aus einer Kupfer- und einer Zinkplatte bestanden und durch einen Elektrolyten verbunden waren. Durch die Aneinanderreihung dieser Einheiten wies der Volta'sche Stapel (oder die "Batterie") als Ganzes eine höhere Spannung auf, die leichter genutzt werden konnte als bei einzelnen Zellen. Der Strom wird erzeugt, weil das Volta-Potenzial zwischen den beiden Metallplatten Elektronen vom Zink zum Kupfer fließen lässt und das Zink korrodiert. ⓘ
Da Zink nicht magnetisch ist und in Lösung keine Farbe hat, wurde seine Bedeutung für die Biochemie und Ernährung erst spät erkannt. Dies änderte sich 1940, als nachgewiesen wurde, dass die Kohlensäureanhydrase, ein Enzym, das Kohlendioxid aus dem Blut entfernt, Zink in seinem aktiven Zentrum enthält. Das Verdauungsenzym Carboxypeptidase wurde 1955 das zweite bekannte zinkhaltige Enzym. ⓘ
Herstellung
Bergbau und Verarbeitung
| Rang | Land | Tonnen |
|---|---|---|
| 1 | China | 4,210,000 |
| 2 | Peru | 1,400,000 |
| 3 | Australien | 1,330,000 |
| 5 | Vereinigte Staaten | 753,000 |
| 4 | Indien | 720,000 |
| 6 | Mexiko | 677,000 |
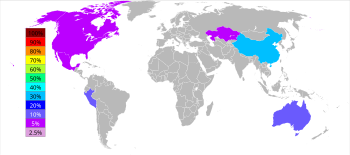
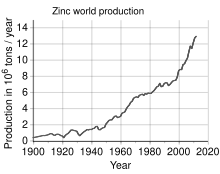
Mit einer Jahresproduktion von etwa 13 Millionen Tonnen ist Zink das am vierthäufigsten verwendete Metall, noch vor Eisen, Aluminium und Kupfer. Der weltweit größte Zinkproduzent ist Nyrstar, ein Zusammenschluss der australischen OZ Minerals und der belgischen Umicore. Etwa 70 % des weltweit produzierten Zinks stammen aus dem Bergbau, während die restlichen 30 % aus dem Recycling von Sekundärzink stammen. Kommerziell reines Zink wird als Special High Grade (SHG) bezeichnet und ist zu 99,995 % rein. ⓘ
Weltweit werden 95 % des neuen Zinks aus sulfidischen Erzlagerstätten gewonnen, in denen Sphalerit (ZnS) fast immer mit Sulfiden von Kupfer, Blei und Eisen vermischt ist. Die Zinkminen sind über die ganze Welt verstreut, wobei die wichtigsten Gebiete China, Australien und Peru sind. China produzierte im Jahr 2014 38 % der weltweiten Zinkproduktion. ⓘ
Zinkmetall wird durch extraktive Metallurgie gewonnen. Das Erz wird fein gemahlen und dann einer Schaumflotation unterzogen, um die Mineralien vom Ganggestein zu trennen (aufgrund der Eigenschaft der Hydrophobie), um ein Zinksulfiderzkonzentrat zu erhalten, das aus etwa 50 % Zink, 32 % Schwefel, 13 % Eisen und 5 % SiO
2. ⓘ
Durch Röstung wird das Zinksulfidkonzentrat in Zinkoxid umgewandelt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{2ZnS + 3O2 ->[t^o] 2ZnO + 2SO2 <span title="Aus: Englische Wikipedia, Abschnitt "Mining and processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Zinc#Mining_and_processing <span style="color:#dddddd">ⓘ</span>]</span>}}
Das Schwefeldioxid wird für die Herstellung von Schwefelsäure verwendet, die für den Laugungsprozess erforderlich ist. Werden zur Zinkgewinnung Lagerstätten aus Zinkkarbonat, Zinksilikat oder Zinkspinell (wie die Skorpionlagerstätte in Namibia) genutzt, kann das Rösten entfallen. ⓘ
Für die Weiterverarbeitung gibt es zwei grundlegende Verfahren: die Pyrometallurgie und die elektrolytische Gewinnung. Bei der Pyrometallurgie wird Zinkoxid mit Kohlenstoff oder Kohlenmonoxid bei 950 °C (1.740 °F) zu dem Metall reduziert, das als Zinkdampf destilliert wird, um es von anderen Metallen zu trennen, die bei diesen Temperaturen nicht flüchtig sind. Der Zinkdampf wird in einem Kondensator aufgefangen. Die folgenden Gleichungen beschreiben diesen Prozess:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ZnO + CO ->[950^oC] Zn + CO2 <span title="Aus: Englische Wikipedia, Abschnitt "Mining and processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Zinc#Mining_and_processing <span style="color:#dddddd">ⓘ</span>]</span>}}
Bei der elektrolytischen Gewinnung wird das Zink mit Schwefelsäure aus dem Erzkonzentrat ausgelaugt und die Verunreinigungen werden ausgefällt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ZnO + H2SO4 -> ZnSO4 + H2O <span title="Aus: Englische Wikipedia, Abschnitt "Mining and processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Zinc#Mining_and_processing <span style="color:#dddddd">ⓘ</span>]</span>}}
Schließlich wird das Zink durch Elektrolyse reduziert. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{2ZnSO4 + 2H2O -> 2Zn + O2 + 2H2SO4 <span title="Aus: Englische Wikipedia, Abschnitt "Mining and processing"" class="plainlinks">[https://en.wikipedia.org/wiki/Zinc#Mining_and_processing <span style="color:#dddddd">ⓘ</span>]</span>}}
Die Schwefelsäure wird regeneriert und der Laugungsstufe wieder zugeführt. ⓘ
Wenn das verzinkte Ausgangsmaterial einem Lichtbogenofen zugeführt wird, wird das Zink durch verschiedene Verfahren aus dem Staub zurückgewonnen, vor allem durch das Waelz-Verfahren (90 %, Stand 2014). ⓘ
Umweltauswirkungen
Bei der Veredelung von sulfidischen Zinkerzen entstehen große Mengen an Schwefeldioxid und Cadmiumdampf. Hüttenschlacke und andere Rückstände enthalten erhebliche Mengen an Metallen. Zwischen 1806 und 1882 wurden in den belgischen Städten La Calamine und Plombières etwa 1,1 Millionen Tonnen metallisches Zink und 130 Tausend Tonnen Blei abgebaut und verhüttet. Die Abraumhalden der früheren Bergwerke laugen Zink und Kadmium aus, und die Sedimente des Flusses Geul enthalten nicht unerhebliche Mengen an Metallen. Vor etwa zweitausend Jahren beliefen sich die Emissionen von Zink aus dem Bergbau und der Verhüttung auf 10 000 Tonnen pro Jahr. Nach einem Anstieg um das Zehnfache ab 1850 erreichten die Zinkemissionen in den 1980er Jahren einen Höchststand von 3,4 Millionen Tonnen pro Jahr und gingen in den 1990er Jahren auf 2,7 Millionen Tonnen zurück, obwohl eine 2005 durchgeführte Untersuchung der arktischen Troposphäre ergab, dass die dortigen Konzentrationen den Rückgang nicht widerspiegeln. Vom Menschen verursachte und natürliche Emissionen stehen in einem Verhältnis von 20 zu 1. ⓘ
Zink in Flüssen, die durch Industrie- und Bergbaugebiete fließen, kann bis zu 20 ppm betragen. Durch eine wirksame Abwasserbehandlung wird dieser Wert erheblich gesenkt; die Behandlung entlang des Rheins beispielsweise hat die Zinkkonzentration auf 50 ppb gesenkt. Zinkkonzentrationen von nur 2 ppm wirken sich nachteilig auf die Sauerstoffmenge aus, die Fische in ihrem Blut aufnehmen können. ⓘ
Böden, die durch Bergbau, Raffination oder Düngung mit zinkhaltigen Schlämmen mit Zink kontaminiert sind, können mehrere Gramm Zink pro Kilogramm trockenen Bodens enthalten. Ein Zinkgehalt von mehr als 500 ppm im Boden beeinträchtigt die Fähigkeit der Pflanzen, andere wichtige Metalle wie Eisen und Mangan aufzunehmen. In einigen Bodenproben wurden Zinkgehalte von 2000 ppm bis 180.000 ppm (18 %) festgestellt. ⓘ
Anwendungen
Zu den wichtigsten Anwendungen von Zink gehören (die Zahlen beziehen sich auf die USA)
Korrosionsschutz und Batterien

Zink wird am häufigsten als Korrosionsschutzmittel verwendet, und die Verzinkung (Beschichtung von Eisen oder Stahl) ist die bekannteste Form. Im Jahr 2009 wurden in den Vereinigten Staaten 55 % oder 893.000 Tonnen Zinkmetall für die Verzinkung verwendet. ⓘ
Zink ist reaktionsfreudiger als Eisen oder Stahl und zieht daher fast alle lokale Oxidation an, bis es vollständig korrodiert. Eine schützende Oberflächenschicht aus Oxid und Karbonat (Zn
5(OH)
6(CO
3)
2) bildet sich, wenn das Zink korrodiert. Dieser Schutz bleibt auch dann bestehen, wenn die Zinkschicht zerkratzt wird, baut sich aber mit der Zeit ab, wenn das Zink wegkorrodiert. Das Zink wird elektrochemisch oder als geschmolzenes Zink durch Feuerverzinken oder Spritzen aufgebracht. Die Verzinkung wird bei Maschendrahtzäunen, Leitplanken, Hängebrücken, Lichtmasten, Metalldächern, Wärmetauschern und Autokarosserien verwendet. ⓘ
Die relative Reaktivität von Zink und seine Fähigkeit, Oxidation auf sich zu ziehen, machen es zu einer effizienten Opferanode für den kathodischen Schutz (KKS). Der kathodische Schutz einer erdverlegten Rohrleitung kann beispielsweise durch den Anschluss von Anoden aus Zink an das Rohr erreicht werden. Zink wirkt als Anode (negativer Endpunkt), indem es langsam korrodiert, während es elektrischen Strom an die Stahlrohrleitung weiterleitet. Zink wird auch zum kathodischen Schutz von Metallen verwendet, die dem Meerwasser ausgesetzt sind. Eine Zinkscheibe, die am eisernen Ruder eines Schiffes befestigt ist, korrodiert langsam, während das Ruder intakt bleibt. In ähnlicher Weise bietet ein Zinkpfropfen, der an einer Schiffsschraube oder an der Metallschutzvorrichtung des Schiffskiels angebracht ist, einen vorübergehenden Schutz. ⓘ
Mit einem Standardelektrodenpotential (SEP) von -0,76 Volt wird Zink als Anodenmaterial für Batterien verwendet. (Das reaktivere Lithium (SEP -3,04 V) wird für Anoden in Lithiumbatterien verwendet). Zinkpulver wird auf diese Weise in Alkalibatterien verwendet, und das Gehäuse (das auch als Anode dient) von Zink-Kohle-Batterien wird aus Zinkblech hergestellt. Zink wird als Anode oder Brennstoff in der Zink-Luft-Batterie/Brennstoffzelle verwendet. Die Zink-Cerium-Redox-Flow-Batterie basiert ebenfalls auf einer negativen Halbzelle auf Zinkbasis. ⓘ
Legierungen
Eine weit verbreitete Zinklegierung ist Messing, bei der Kupfer je nach Art des Messings mit 3 bis 45 % Zink legiert wird. Messing ist im Allgemeinen dehnbarer und fester als Kupfer und hat eine höhere Korrosionsbeständigkeit. Diese Eigenschaften machen es zu einem nützlichen Werkstoff für Kommunikationsgeräte, Hardware, Musikinstrumente und Wasserventile. ⓘ

Weitere weit verbreitete Zinklegierungen sind Neusilber, Schreibmaschinenmetall, Weich- und Aluminiumlot sowie Handelsbronze. Zink wird auch in modernen Pfeifenorgeln als Ersatz für die traditionelle Blei-Zinn-Legierung in Pfeifen verwendet. Legierungen aus 85-88 % Zink, 4-10 % Kupfer und 2-8 % Aluminium werden in begrenztem Umfang für bestimmte Arten von Maschinenlagern verwendet. Zink ist seit 1982 das Hauptmetall in amerikanischen Ein-Cent-Münzen (Pennies). Der Zinkkern ist mit einer dünnen Kupferschicht überzogen, um das Aussehen einer Kupfermünze zu erreichen. Im Jahr 1994 wurden in den Vereinigten Staaten 33.200 Tonnen (36.600 kurze Tonnen) Zink für die Herstellung von 13,6 Milliarden Pennys verwendet. ⓘ
Legierungen aus Zink mit geringen Anteilen von Kupfer, Aluminium und Magnesium werden sowohl im Druckguss als auch im Schleuderguss verwendet, insbesondere in der Automobil-, Elektro- und Eisenwarenindustrie. Diese Legierungen werden unter dem Namen Zamak vermarktet. Ein Beispiel hierfür ist Zinkaluminium. Der niedrige Schmelzpunkt in Verbindung mit der niedrigen Viskosität der Legierung ermöglicht die Herstellung kleiner und komplizierter Formen. Die niedrige Arbeitstemperatur führt zu einer raschen Abkühlung der Gusserzeugnisse und einer schnellen Produktion für die Montage. Eine andere Legierung, die unter dem Markennamen Prestal vermarktet wird, enthält 78 % Zink und 22 % Aluminium und ist Berichten zufolge fast so fest wie Stahl, aber so formbar wie Kunststoff. Diese Superplastizität der Legierung ermöglicht es, sie mit Gussformen aus Keramik und Zement zu formen. ⓘ
Ähnliche Legierungen mit einem geringen Bleianteil können zu Blechen kaltgewalzt werden. Eine Legierung aus 96 % Zink und 4 % Aluminium wird zur Herstellung von Stanzformen für Anwendungen mit geringen Stückzahlen verwendet, für die Formen aus Eisenmetall zu teuer wären. Für Gebäudefassaden, Bedachungen und andere Anwendungen von Blechen, die durch Tiefziehen, Walzprofilieren oder Biegen geformt werden, werden Zinklegierungen mit Titan und Kupfer verwendet. Unlegiertes Zink ist für diese Herstellungsverfahren zu spröde. ⓘ
Als dichtes, preiswertes und leicht zu bearbeitendes Material wird Zink als Ersatz für Blei verwendet. Im Zuge der Sorge um Blei wird Zink in Gewichten für verschiedene Anwendungen von der Fischerei bis hin zu Reifenwaagen und Schwungrädern verwendet. ⓘ
Kadmium-Zink-Tellurid (CZT) ist eine halbleitende Legierung, die in eine Reihe von kleinen Sensoren unterteilt werden kann. Diese Bauelemente ähneln integrierten Schaltkreisen und können die Energie der eintreffenden Gammastrahlenphotonen erkennen. Hinter einer absorbierenden Maske kann die CZT-Sensoranordnung die Richtung der Strahlen bestimmen. ⓘ

Zinkdruckguss ist die gebräuchliche Bezeichnung für im Druckgießverfahren hergestellte Teile aus Feinzink-Gusslegierungen. Diese Legierungen erbringen weitaus bessere Werte der Gussteile, als es beim Vergießen von reinem Zink möglich ist. Die Legierungen sind genormt. Viel verwendet wird die Legierung GD ZnAl4Cu1 (Z 410). Zinkdruckguss ermöglicht – wie jedes Druckgießverfahren – die Fertigung großer Stückzahlen. Die Gussteile zeichnen sich durch hohe Maßhaltigkeit aus, besitzen sehr gute mechanische Werte und sind für eine Oberflächenbehandlung wie Vernickeln oder Verchromen gut geeignet. Das Spektrum der Anwendungen umfasst Automobil-Zubehörteile und solche im Maschinen- und Apparatebau, ferner Beschläge aller Art, Teile für die Sanitärindustrie, für Feingeräte- und Elektrotechnik, für Metallspielwaren und viele Gebrauchsgegenstände im Haushalt. ⓘ


Im Jahr 2018 wurden über 13,5 Millionen Tonnen Zink produziert. Davon wurden 47 % für den Korrosionsschutz von Eisen- und Stahlprodukten durch Verzinken genutzt. Nach Verbrauchsmengen bedeutendstes Einsatzgebiet sind dessen Legierungen, vorzugsweise solche mit Kupfer, wie Messing, oder mit Aluminium, entweder als AlZn-Legierung oder mit deutlich höheren Zinkgehalten als AlZn, das für im Sandguss und Kokillenguss hergestellte Teile verwendet wird. Auch in den genormten Magnesiumlegierungen ist Zink mit bis zu 5 % enthalten. Ungleich bedeutender sind die genormten Feinzink-Gusslegierungen, die überwiegend im Druckgießverfahren, aber auch in Sand und Kokille vergossen werden. Auch zu Walzmaterial wie Zinkblechen werden Zinklegierungen verarbeitet. ⓘ
Andere industrielle Verwendungen

Etwa ein Viertel der gesamten Zinkproduktion in den Vereinigten Staaten im Jahr 2009 wurde in Form von Zinkverbindungen verbraucht, von denen eine Vielzahl industriell genutzt wird. Zinkoxid wird häufig als Weißpigment in Farben und als Katalysator bei der Herstellung von Kautschuk verwendet, um die Wärme zu verteilen. Zinkoxid wird verwendet, um Gummipolymere und Kunststoffe vor ultravioletter Strahlung (UV) zu schützen. Die Halbleitereigenschaften von Zinkoxid machen es nützlich für Varistoren und Fotokopiergeräte. Der Zink-Zink-Oxid-Zyklus ist ein zweistufiger thermochemischer Prozess auf der Grundlage von Zink und Zinkoxid zur Erzeugung von Wasserstoff. ⓘ
Zinkchlorid wird häufig Holz als Feuerschutzmittel und manchmal auch als Holzschutzmittel zugesetzt. Es wird bei der Herstellung anderer Chemikalien verwendet. Zinkmethyl (Zn(CH3)
2) wird in einer Reihe von organischen Synthesen verwendet. Zinksulfid (ZnS) wird in Leuchtpigmenten verwendet, z. B. auf Zeigern von Uhren, Röntgen- und Fernsehbildschirmen sowie in Leuchtfarben. ZnS-Kristalle werden in Lasern verwendet, die im mittleren Infrarotbereich des Spektrums arbeiten. Zinksulfat ist eine Chemikalie in Farbstoffen und Pigmenten. Zinkpyrithion wird in Antifouling-Farben verwendet. ⓘ
Zinkpulver wird manchmal als Treibstoff in Modellraketen verwendet. Wenn eine komprimierte Mischung aus 70% Zink- und 30% Schwefelpulver entzündet wird, kommt es zu einer heftigen chemischen Reaktion. Dabei entsteht Zinksulfid, zusammen mit großen Mengen an heißem Gas, Wärme und Licht. ⓘ
Zinkblech wird zur Herstellung von Zinkbarren verwendet. ⓘ
64
Zn, das am häufigsten vorkommende Isotop von Zink, ist sehr anfällig für Neutronenaktivierung und wird in das hochradioaktive 65
Zn umgewandelt, das eine Halbwertszeit von 244 Tagen hat und intensive Gammastrahlung erzeugt. Aus diesem Grund enthält Zinkoxid, das in Kernreaktoren als Korrosionsschutzmittel verwendet wird, nur noch 64
Zn vor der Verwendung, wird dies als abgereichertes Zinkoxid bezeichnet. Aus demselben Grund wurde Zink auch als Salz für Kernwaffen vorgeschlagen (Kobalt ist ein anderes, bekannteres Salz). Ein Mantel aus isotopisch angereichertem 64
Zn würde durch den intensiven, hochenergetischen Neutronenfluss einer explodierenden thermonuklearen Waffe bestrahlt werden, wobei sich eine große Menge 65
Zn bilden, die die Radioaktivität des Fallouts der Waffe erheblich erhöht. Es ist nicht bekannt, dass eine solche Waffe jemals gebaut, getestet oder eingesetzt wurde. ⓘ
65
Zn wird als Tracer verwendet, um zu untersuchen, wie sich zinkhaltige Legierungen abnutzen, oder um den Weg und die Rolle von Zink in Organismen zu erforschen. ⓘ
Zinkdithiocarbamatkomplexe werden als Fungizide in der Landwirtschaft eingesetzt; dazu gehören Zineb, Metiram, Propineb und Ziram. Zinknaphthenat wird als Holzschutzmittel verwendet. Zink in Form von ZDDP wird als Antiverschleiß-Zusatz für Metallteile in Motorenöl verwendet. ⓘ
Zinkoxid bildet farblose, hexagonale Kristalle. Es wird als Pigment, in Farben, Kautschuk, Fotokopierpapier und Chemikalien verwendet. Weitere Verwendungen finden sich in Bodenbelägen, Gläsern, Emails, Geweben, Kunststoffen, Schmiermitteln, bei der Herstellung von Kunstseide und in Arzneimitteln. ⓘ


Zinksulfid kommt in der Natur als Sphalerit (Zinkblende) und als Wurtzit vor. Es wird als Pigment für Farben, Öltücher, Linoleum, Leder und Zahngummi, in weißem und opakem Glas, Kunststoffen, Fungiziden, als Halbleiter, Fotoleiter für Solarzellen, als Leuchtstoff in Fernseh- und Röntgenbildschirmen sowie in Leuchtzifferblättern von Uhren verwendet. ⓘ
Zinksulfat wird als Reagens in der analytischen Chemie, zum Bleichen von Papier, bei der Herstellung von Kunstseide, als Brandschutzmittel, in Düngemitteln und als Nahrungsergänzungsmittel benutzt. ⓘ
Zinkcarbonat wird als feuerfester Füllstoff für Kautschuk- und Kunststoffzusammensetzungen, als Futtermittelzusatz, als Pigment, in Kosmetika und bei der Herstellung von Zinksalzen, Porzellan, Keramik und Kautschuk eingesetzt. ⓘ
Zinkcyanid ist giftig und umweltschädlich. Es wird zum Plattieren, zur Herstellung von Insektiziden, zum Galvanisieren, zum Entfernen von Ammoniak aus dem Produktionsgas, zur Goldgewinnung, als chemisches Reagens, in der Medizin und in der chemischen Analyse verwendet. ⓘ
Organische Chemie
In der Organischen Synthese dient Zink verschiedenen Zwecken. So fungiert es als Reduktionsmittel und kann als solches in unterschiedlicher Weise aktiviert sein. Ein Beispiel ist die Clemmensen-Reduktion von Carbonylverbindungen mit amalgamiertem Zink. Des Weiteren lassen sich Allylalkohole zu Alkenen reduzieren, Acyloine zu Ketonen. Die Reduktion der aromatischen Nitrogruppe kann in Abhängigkeit von den Reaktionsbedingungen zu unterschiedlichen Produkten führen: Arylamin, Arylhydroxylamin, Azoaren, N,N’-Diarylhydrazin. ⓘ
Im metallorganischen Bereich bieten Zinkorganyle gegenüber Grignard-Verbindungen Selektivitätsvorteile, da sie in der Regel weniger reaktiv sind und mehr funktionelle Gruppen tolerieren – ein Umstand, von dem die Reformatzki-Reaktion Gebrauch macht. Die Organyle lassen sich auf direkte Weise oder durch Transmetallierung herstellen. In Gegenwart asymmetrisch komplexierender Auxiliare, von denen mitunter katalytische Mengen ausreichen, ist eine stereoselektive Addition möglich. Der Effekt der Chiralitätsverstärkung wurde beobachtet. ⓘ
Nicht zuletzt ist die Halogeneliminierung und Dehalogenierung möglich. Die Simmons-Smith-Reaktion zählt zu den selteneren Präparationsmethoden. Die Zeitschrift Organic Syntheses verzeichnet eine Reihe von Synthesen, in denen elementares Zink als Reagenz dient. ⓘ

Die Organozinkchemie ist die Wissenschaft von Verbindungen, die Kohlenstoff-Zink-Bindungen enthalten, und beschreibt die physikalischen Eigenschaften, die Synthese und die chemischen Reaktionen. Viele zinkorganische Verbindungen sind von Bedeutung. Wichtige Anwendungen sind unter anderem
- Die Frankland-Duppa-Reaktion, bei der ein Oxalsäureester (ROCOCOOR) mit einem Alkylhalogenid R'X, Zink und Salzsäure unter Bildung der α-Hydroxycarbonsäureester RR'COHCOOR reagiert
- Nachteilig ist, dass Organozinkverbindungen viel weniger nucleophil sind als Grignards, und dass sie teuer und schwierig zu handhaben sind. Kommerziell erhältliche Diorganozinkverbindungen sind Dimethylzink, Diethylzink und Diphenylzink. In einer Studie wurde die aktive Organozinkverbindung aus viel billigeren Organobromvorläufern gewonnen. ⓘ
Zink hat als Katalysator in der organischen Synthese, einschließlich der asymmetrischen Synthese, viele Verwendungen gefunden, da es eine billige und leicht verfügbare Alternative zu Edelmetallkomplexen darstellt. Die mit chiralen Zinkkatalysatoren erzielten Ergebnisse (Ausbeute und enantiomerer Überschuss) sind mit denen vergleichbar, die mit Palladium, Ruthenium, Iridium und anderen Metallen erzielt werden, und Zink wird zum Metallkatalysator der Wahl. ⓘ
Nahrungsergänzungsmittel

Die meisten rezeptfreien Vitamin- und Mineralstoffpräparate zur täglichen Einnahme in Einzeltabletten enthalten Zink in Form von Zinkoxid, Zinkacetat, Zinkgluconat oder Zinkaminosäurechelat. ⓘ
Im Allgemeinen wird die Einnahme von Zinkergänzungsmitteln dort empfohlen, wo ein hohes Risiko für Zinkmangel besteht (z. B. in Ländern mit niedrigem und mittlerem Einkommen), und zwar als vorbeugende Maßnahme. Obwohl Zinksulfat die am häufigsten verwendete Zinkform ist, können auch Zinkcitrat, -gluconat und -picolinat eine gute Wahl sein. Diese Formen werden besser absorbiert als Zinkoxid. ⓘ
Gastroenteritis
Zink ist ein preiswerter und wirksamer Bestandteil der Behandlung von Durchfallerkrankungen bei Kindern in den Entwicklungsländern. Durch eine 10- bis 14-tägige Behandlung kann die Dauer und der Schweregrad von Durchfallerkrankungen verringert und künftigen Anfällen bis zu drei Monate lang vorgebeugt werden, wenn Zink im Körper abgebaut wird. Die Gastroenteritis wird durch die Einnahme von Zink stark abgeschwächt, möglicherweise durch die direkte antimikrobielle Wirkung der Ionen im Magen-Darm-Trakt oder durch die Absorption des Zinks und die Wiederfreisetzung aus den Immunzellen (alle Granulozyten sezernieren Zink) oder durch beides. ⓘ
Gewichtszunahme
Zinkmangel kann zu Appetitlosigkeit führen. Die Verwendung von Zink zur Behandlung von Anorexie wird seit 1979 befürwortet. Mindestens 15 klinische Studien haben gezeigt, dass Zink die Gewichtszunahme bei Anorexie verbessert. Eine Studie aus dem Jahr 1994 zeigte, dass Zink die Zunahme der Körpermasse bei der Behandlung von Anorexia nervosa verdoppelte. Ein Mangel an anderen Nährstoffen wie Tyrosin, Tryptophan und Thiamin könnte zu diesem Phänomen der "durch Mangelernährung verursachten Unterernährung" beitragen. Eine Meta-Analyse von 33 prospektiven Interventionsstudien zur Zinksupplementierung und ihren Auswirkungen auf das Wachstum von Kindern in vielen Ländern ergab, dass die Zinksupplementierung allein eine statistisch signifikante Wirkung auf das lineare Wachstum und die Körpergewichtszunahme hatte, was darauf hindeutet, dass andere möglicherweise vorhandene Mängel nicht für die Wachstumsverzögerung verantwortlich waren. ⓘ
Andere
In einer Cochrane-Review wurde festgestellt, dass Menschen, die Zinkpräparate einnehmen, mit geringerer Wahrscheinlichkeit eine altersbedingte Makuladegeneration erleiden. Eine Zinkergänzung ist eine wirksame Behandlung für Acrodermatitis enteropathica, eine genetische Störung, die die Zinkabsorption beeinträchtigt und früher für die betroffenen Säuglinge tödlich war. Zinkmangel wurde mit schweren depressiven Störungen in Verbindung gebracht, und Zinkpräparate können eine wirksame Behandlung darstellen. ⓘ
Topische Anwendung
Zu den topischen Zinkpräparaten gehören solche, die auf der Haut angewendet werden, häufig in Form von Zinkoxid. Zinkpräparate können im Sommer vor Sonnenbrand und im Winter vor Windbrand schützen. Wird es bei jedem Windelwechsel dünn auf den Windelbereich (Perineum) eines Babys aufgetragen, kann es vor Windelausschlag schützen. ⓘ
Chelatisiertes Zink wird in Zahnpasten und Mundspülungen verwendet, um Mundgeruch vorzubeugen; Zinkzitrat hilft, die Bildung von Zahnstein zu verringern. ⓘ
Zinkpyrithion wird häufig in Shampoos zur Vorbeugung von Schuppen eingesetzt. ⓘ
Es hat sich gezeigt, dass die topische Anwendung von Zink eine wirksame Behandlung von Herpes genitalis ermöglicht und die Remission verlängert. ⓘ
Biologische Rolle
Zink ist ein essentielles Spurenelement für Menschen und andere Tiere, für Pflanzen und für Mikroorganismen. Zink ist für die Funktion von über 300 Enzymen und 1000 Transkriptionsfaktoren erforderlich und wird in Metallothioneinen gespeichert und übertragen. Es ist nach Eisen das zweithäufigste Spurenmetall im Menschen und das einzige Metall, das in allen Enzymklassen vorkommt. ⓘ
In Proteinen sind Zinkionen häufig an die Aminosäureseitenketten von Asparaginsäure, Glutaminsäure, Cystein und Histidin koordiniert. Die theoretische und rechnerische Beschreibung dieser Zinkbindung in Proteinen (wie auch die der anderen Übergangsmetalle) ist schwierig. ⓘ
Ungefähr 2-4 Gramm Zink sind im menschlichen Körper verteilt. Das meiste Zink befindet sich im Gehirn, in den Muskeln, in den Knochen, in den Nieren und in der Leber, mit den höchsten Konzentrationen in der Prostata und in Teilen des Auges. Sperma ist besonders reich an Zink, einem Schlüsselfaktor für die Funktion der Prostata und das Wachstum der Fortpflanzungsorgane. ⓘ
Die Zinkhomöostase des Körpers wird hauptsächlich durch den Darm gesteuert. Hier wurden ZIP4 und insbesondere TRPM7 mit der intestinalen Zinkaufnahme in Verbindung gebracht, die für das postnatale Überleben wichtig ist. ⓘ
Beim Menschen sind die biologischen Funktionen von Zink allgegenwärtig. Es interagiert mit einer breiten Palette organischer Liganden" und spielt eine Rolle im RNA- und DNA-Stoffwechsel, bei der Signalübertragung und der Genexpression. Außerdem reguliert es die Apoptose. Eine Übersichtsarbeit aus dem Jahr 2015 zeigte, dass etwa 10 % der menschlichen Proteine (~ 3000) Zink binden, zusätzlich zu Hunderten von Proteinen, die Zink transportieren und weiterleiten; eine ähnliche In-silico-Studie in der Pflanze Arabidopsis thaliana fand 2367 zinkbezogene Proteine. ⓘ
Im Gehirn wird Zink in spezifischen synaptischen Vesikeln von glutamatergen Neuronen gespeichert und kann die neuronale Erregbarkeit modulieren. Es spielt eine Schlüsselrolle bei der synaptischen Plastizität und damit beim Lernen. Die Zinkhomöostase spielt auch eine entscheidende Rolle bei der funktionellen Regulierung des zentralen Nervensystems. Es wird angenommen, dass eine Dysregulation der Zinkhomöostase im Zentralnervensystem, die zu überhöhten synaptischen Zinkkonzentrationen führt, Neurotoxizität durch mitochondrialen oxidativen Stress (z. B. durch Störung bestimmter Enzyme, die an der Elektronentransportkette beteiligt sind, einschließlich Komplex I, Komplex III und α-Ketoglutarat-Dehydrogenase), die Dysregulation der Kalziumhomöostase, glutamaterge neuronale Exzitotoxizität und Störungen der intraneuronalen Signaltransduktion hervorruft. L- und D-Histidin erleichtern die Aufnahme von Zink im Gehirn. SLC30A3 ist der wichtigste Zink-Transporter, der an der zerebralen Zink-Homöostase beteiligt ist. ⓘ
Enzyme


Zink ist eine effiziente Lewis-Säure, die es zu einem nützlichen Katalysator bei der Hydroxylierung und anderen enzymatischen Reaktionen macht. Das Metall hat außerdem eine flexible Koordinationsgeometrie, die es den Proteinen, die es verwenden, ermöglicht, ihre Konformationen schnell zu ändern, um biologische Reaktionen durchzuführen. Zwei Beispiele für zinkhaltige Enzyme sind die Kohlensäureanhydrase und die Carboxypeptidase, die für die Prozesse der Kohlendioxid (CO
2)-Regulierung bzw. für die Verdauung von Proteinen wichtig sind. ⓘ
Im Blut von Wirbeltieren wandelt die Kohlensäureanhydrase CO
2 in Bikarbonat um, und dasselbe Enzym wandelt das Bikarbonat wieder in CO
2 für die Ausatmung durch die Lunge um. Ohne dieses Enzym würde diese Umwandlung bei einem normalen Blut-pH-Wert von 7 etwa eine Million Mal langsamer erfolgen oder einen pH-Wert von 10 oder mehr erfordern. Die nicht verwandte β-Carbonsäureanhydrase wird in Pflanzen für die Blattbildung, die Synthese von Indolessigsäure (Auxin) und die alkoholische Gärung benötigt. ⓘ
Carboxypeptidase spaltet Peptidbindungen bei der Verdauung von Proteinen. Zwischen dem endständigen Peptid und einer an Zink gebundenen C=O-Gruppe wird eine koordinative kovalente Bindung gebildet, die dem Kohlenstoff eine positive Ladung verleiht. Dadurch entsteht auf dem Enzym eine hydrophobe Tasche in der Nähe des Zinks, die den unpolaren Teil des zu verdauenden Proteins anzieht. ⓘ
Signalisierung
Zink ist als Botenstoff bekannt, der Signalwege aktivieren kann. Viele dieser Wege sind die treibende Kraft für das abnorme Krebswachstum. Sie können durch ZIP-Transporter gezielt angegangen werden. ⓘ
Andere Proteine
Zink hat eine rein strukturelle Funktion in Zinkfingern, -drillingen und -clustern. Zinkfinger sind Bestandteil einiger Transkriptionsfaktoren, d. h. von Proteinen, die bei der Replikation und Transkription der DNA Basensequenzen erkennen. Jedes der neun oder zehn Zn2+
Ionen in einem Zinkfinger trägt zur Aufrechterhaltung der Struktur des Fingers bei, indem es koordiniert an vier Aminosäuren im Transkriptionsfaktor bindet. ⓘ
Im Blutplasma wird Zink durch Albumin (60 %, niedrige Affinität) und Transferrin (10 %) gebunden und transportiert. Da Transferrin auch Eisen transportiert, verringert ein Überschuss an Eisen die Zinkabsorption und vice versa. Ein ähnlicher Antagonismus besteht bei Kupfer. Die Konzentration von Zink im Blutplasma bleibt unabhängig von der Zinkaufnahme relativ konstant. Zellen der Speicheldrüse, der Prostata, des Immunsystems und des Darms nutzen Zink als Signalgeber, um mit anderen Zellen zu kommunizieren. ⓘ
Zink kann in Metallothionein-Reserven in Mikroorganismen oder im Darm oder in der Leber von Tieren gespeichert werden. Metallothionein in den Darmzellen ist in der Lage, die Aufnahme von Zink um 15-40 % zu regulieren. Eine unzureichende oder übermäßige Zinkzufuhr kann jedoch schädlich sein; ein Zinküberschuss beeinträchtigt insbesondere die Kupferabsorption, da Metallothionein beide Metalle absorbiert. ⓘ
Der menschliche Dopamintransporter enthält eine extrazelluläre Zinkbindungsstelle mit hoher Affinität, die nach der Zinkbindung die Wiederaufnahme von Dopamin hemmt und den Amphetamin-induzierten Dopamin-Efflux in vitro verstärkt. Der menschliche Serotonintransporter und der Noradrenalin-Transporter enthalten keine Zinkbindungsstellen. Einige EF-Hand-Calciumbindungsproteine wie S100 oder NCS-1 sind ebenfalls in der Lage, Zink-Ionen zu binden. ⓘ
Ernährung
Empfehlungen für die Ernährung
Das U.S. Institute of Medicine (IOM) aktualisierte 2001 den geschätzten durchschnittlichen Bedarf (Estimated Average Requirements, EARs) und die empfohlenen Tagesdosen (Recommended Dietary Allowances, RDAs) für Zink. Die aktuellen EARs für Zink für Frauen und Männer ab 14 Jahren betragen 6,8 bzw. 9,4 mg/Tag. Die RDAs liegen bei 8 und 11 mg/Tag. Die RDAs sind höher als die EARs, um Mengen festzulegen, die den überdurchschnittlichen Bedarf von Menschen decken. Die RDA für die Schwangerschaft beträgt 11 mg/Tag. Die RDA für die Stillzeit beträgt 12 mg/Tag. Für Säuglinge bis zu 12 Monaten beträgt die RDA 3 mg/Tag. Für Kinder im Alter von 1-13 Jahren steigt die RDA mit dem Alter von 3 auf 8 mg/Tag. Was die Sicherheit anbelangt, so legt die IOM bei ausreichender Evidenz tolerierbare Höchstmengen (UL) für Vitamine und Mineralien fest. Im Falle von Zink beträgt die UL für Erwachsene 40 mg/Tag (für Kinder niedriger). Die EARs, RDAs, AIs und ULs werden zusammen als Dietary Reference Intakes (DRIs) bezeichnet. ⓘ
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) bezeichnet die Gesamtheit der Informationen als Referenzwerte für die Ernährung, wobei die Bevölkerungsreferenzzufuhr (PRI) anstelle der RDA und der durchschnittliche Bedarf anstelle der EAR steht. AI und UL sind genauso definiert wie in den Vereinigten Staaten. Für Menschen ab 18 Jahren sind die PRI-Berechnungen komplex, da die EFSA immer höhere Werte festlegt, je höher der Phytatgehalt der Nahrung ist. Für Frauen steigen die PRI von 7,5 auf 12,7 mg/Tag, wenn die Phytataufnahme von 300 auf 1200 mg/Tag ansteigt; für Männer liegt die Spanne bei 9,4 bis 16,3 mg/Tag. Diese PRIs sind höher als die RDAs in den USA. Die EFSA überprüfte dieselbe Sicherheitsfrage und setzte ihren UL auf 25 mg/Tag fest, was wesentlich niedriger ist als der US-Wert. ⓘ
Bei der Kennzeichnung von Lebensmitteln und Nahrungsergänzungsmitteln in den USA wird die Menge in einer Portion als Prozentsatz des Tageswertes (%DV) angegeben. Für die Kennzeichnung von Zink betrug 100 % des Tageswerts 15 mg, aber am 27. Mai 2016 wurde er auf 11 mg geändert. Eine Tabelle mit den alten und neuen Tageswerten für Erwachsene finden Sie unter Reference Daily Intake. ⓘ
Aufnahme über die Nahrung

Tierische Produkte wie Fleisch, Fisch, Schalentiere, Geflügel, Eier und Milchprodukte enthalten Zink. Die Zinkkonzentration in Pflanzen variiert mit dem Zinkgehalt im Boden. Bei ausreichendem Zinkgehalt im Boden enthalten Weizen (Keim und Kleie) und verschiedene Samen, darunter Sesam, Mohn, Luzerne, Sellerie und Senf, am meisten Zink. Zink findet sich auch in Bohnen, Nüssen, Mandeln, Vollkornprodukten, Kürbiskernen, Sonnenblumenkernen und schwarzen Johannisbeeren. ⓘ
Weitere Quellen sind angereicherte Lebensmittel und Nahrungsergänzungsmittel in verschiedenen Formen. Eine Übersichtsarbeit aus dem Jahr 1998 kam zu dem Schluss, dass Zinkoxid, eines der am häufigsten verwendeten Nahrungsergänzungsmittel in den Vereinigten Staaten, und Zinkcarbonat nahezu unlöslich sind und vom Körper nur schlecht aufgenommen werden. In diesem Bericht wurden Studien zitiert, in denen bei Probanden, die Zinkoxid und Zinkcarbonat zu sich nahmen, niedrigere Plasmazinkkonzentrationen festgestellt wurden als bei denen, die Zinkacetat- und -sulfatsalze zu sich nahmen. Für die Anreicherung empfahl eine Studie aus dem Jahr 2003 jedoch Getreide (mit Zinkoxid) als billige, stabile Quelle, die ebenso leicht absorbiert werden kann wie die teureren Formen. Eine Studie aus dem Jahr 2005 ergab, dass verschiedene Zinkverbindungen, einschließlich Oxid und Sulfat, keine statistisch signifikanten Unterschiede in der Absorption aufwiesen, wenn sie als Anreicherungsstoffe zu Maistortillas gegeben wurden. ⓘ
Zinkmangel
Fast zwei Milliarden Menschen in den Entwicklungsländern leiden an Zinkmangel. Zu den gefährdeten Gruppen gehören Kinder in Entwicklungsländern und ältere Menschen mit chronischen Krankheiten. Bei Kindern führt er zu einer Zunahme von Infektionen und Durchfallerkrankungen und trägt zum Tod von etwa 800.000 Kindern weltweit pro Jahr bei. Die Weltgesundheitsorganisation befürwortet eine Zinksupplementierung bei schwerer Unterernährung und Durchfallerkrankungen. Zinkpräparate tragen dazu bei, Krankheiten vorzubeugen und die Sterblichkeitsrate zu senken, insbesondere bei Kindern mit niedrigem Geburtsgewicht oder verkümmertem Wachstum. Zinkpräparate sollten jedoch nicht allein verabreicht werden, da viele Menschen in den Entwicklungsländern an mehreren Mangelerscheinungen leiden und Zink mit anderen Mikronährstoffen in Wechselwirkung steht. Zinkmangel ist in der Regel auf eine unzureichende Nahrungsaufnahme zurückzuführen, kann aber auch mit Malabsorption, Acrodermatitis enteropathica, chronischen Lebererkrankungen, chronischen Nierenerkrankungen, Sichelzellenanämie, Diabetes, bösartigen Erkrankungen und anderen chronischen Krankheiten einhergehen. ⓘ
In den Vereinigten Staaten wurde in einer bundesweiten Erhebung über den Lebensmittelkonsum festgestellt, dass der durchschnittliche Konsum bei Frauen und Männern über 19 Jahren bei 9,7 bzw. 14,2 mg/Tag lag. Bei den Frauen nahmen 17 % weniger als den EAR zu sich, bei den Männern 11 %. Die Prozentsätze unterhalb der EAR nahmen mit dem Alter zu. Die jüngste veröffentlichte Aktualisierung der Erhebung (NHANES 2013-2014) meldete niedrigere Durchschnittswerte - 9,3 und 13,2 mg/Tag -, wobei die Aufnahme ebenfalls mit dem Alter abnahm. ⓘ
Die Symptome eines leichten Zinkmangels sind vielfältig. Zu den klinischen Folgen gehören Wachstumsstörungen, Durchfall, Impotenz und verzögerte sexuelle Reifung, Alopezie, Augen- und Hautläsionen, Appetitlosigkeit, veränderte kognitive Fähigkeiten, beeinträchtigte Immunfunktionen, Störungen der Kohlenhydratverwertung und reproduktive Teratogenese. Zinkmangel beeinträchtigt die Immunität, aber auch ein Überschuss an Zink tut dies. ⓘ
Trotz einiger Bedenken leiden westliche Vegetarier und Veganer nicht mehr unter offenkundigem Zinkmangel als Fleischesser. Zu den wichtigsten pflanzlichen Zinkquellen gehören gekochte getrocknete Bohnen, Meeresgemüse, angereichertes Getreide, Sojalebensmittel, Nüsse, Erbsen und Samen. Die in vielen Vollkornprodukten und Ballaststoffen enthaltenen Phytate können jedoch die Zinkaufnahme beeinträchtigen, und die Auswirkungen einer geringen Zinkzufuhr sind kaum bekannt. Der Zinkchelator Phytat, der in Samen und Getreidekleie vorkommt, kann zur Zinkmalabsorption beitragen. Einiges deutet darauf hin, dass diejenigen, die sich phytatreich ernähren, wie z. B. einige Vegetarier, möglicherweise mehr als die US-amerikanische RDA (8 mg/Tag für erwachsene Frauen; 11 mg/Tag für erwachsene Männer) benötigen. Die Leitlinien der Europäischen Behörde für Lebensmittelsicherheit (EFSA) versuchen, dies auszugleichen, indem sie eine höhere Zinkzufuhr empfehlen, wenn die Phytataufnahme in der Nahrung höher ist. Diese Überlegungen müssen gegen den Mangel an geeigneten Zink-Biomarkern abgewogen werden, und der am häufigsten verwendete Indikator, das Plasmazink, hat eine geringe Empfindlichkeit und Spezifität. ⓘ
In den USA nehmen die meisten Säuglinge, Kinder, und Erwachsenen genügend Zink zu sich. Vereinzelt gibt es Hinweise, dass bei älteren Menschen die Zufuhr geringer ausfällt. ⓘ
Laut Nationaler Verzehrstudie II liegt der Median der Zinkzufuhr in Deutschland in allen Altersgruppen über dem Referenzwert. 32 % der Männer und 21 % der Frauen liegen unter der empfohlenen täglichen Zufuhr. ⓘ
Bodensanierung
Calluna-, Erica- und Vaccinium-Arten können in zinkhaltigen Böden wachsen, da die Verlagerung toxischer Ionen durch die Wirkung erikoidaler Mykorrhizapilze verhindert wird. ⓘ
Landwirtschaft
Zinkmangel scheint der häufigste Mikronährstoffmangel bei Kulturpflanzen zu sein; er tritt besonders häufig in Böden mit hohem pH-Wert auf. Zinkarme Böden werden in etwa der Hälfte der Türkei und Indiens, einem Drittel Chinas und dem größten Teil von Westaustralien als Ackerland genutzt. In diesen Gebieten wurde über beträchtliche Reaktionen auf Zinkdüngung berichtet. Pflanzen, die in Böden mit Zinkmangel wachsen, sind anfälliger für Krankheiten. Zink wird dem Boden in erster Linie durch die Verwitterung von Gestein zugeführt, aber auch der Mensch hat Zink durch die Verbrennung fossiler Brennstoffe, Minenabfälle, Phosphatdünger, Pestizide (Zinkphosphid), Kalkstein, Gülle, Klärschlamm und Partikel von verzinkten Oberflächen hinzugefügt. Überschüssiges Zink ist für Pflanzen giftig, obwohl die Zinktoxizität weit weniger verbreitet ist. ⓘ
Vorsichtsmaßnahmen
Toxizität
Obwohl Zink eine wesentliche Voraussetzung für eine gute Gesundheit ist, kann ein Überschuss an Zink schädlich sein. Eine übermäßige Aufnahme von Zink unterdrückt die Aufnahme von Kupfer und Eisen. Das freie Zinkion in Lösung ist für Pflanzen, wirbellose Tiere und sogar Wirbeltiere hochgiftig. Das Aktivitätsmodell für freie Ionen ist in der Literatur gut etabliert und zeigt, dass bereits mikromolare Mengen des freien Ions einige Organismen töten. Ein aktuelles Beispiel zeigt, dass 6 mikromolare Mengen 93 % aller Daphnien im Wasser abtöten. ⓘ
Das freie Zinkion ist eine starke Lewis-Säure bis hin zur Ätzwirkung. Die Magensäure enthält Salzsäure, in der sich metallisches Zink leicht auflöst und ätzendes Zinkchlorid bildet. Das Verschlucken eines amerikanischen Ein-Cent-Stücks aus der Zeit nach 1982 (97,5 % Zink) kann aufgrund der hohen Löslichkeit des Zink-Ions im sauren Magen zu Schäden an der Magenschleimhaut führen. ⓘ
Es ist erwiesen, dass Menschen, die täglich 100-300 mg Zink einnehmen, unter einem induzierten Kupfermangel leiden können. In einer Studie aus dem Jahr 2007 wurde beobachtet, dass ältere Männer, die täglich 80 mg Zink einnahmen, häufiger wegen Komplikationen beim Wasserlassen ins Krankenhaus eingeliefert wurden als diejenigen, die ein Placebo einnahmen. Zinkmengen von 100-300 mg können die Verwertung von Kupfer und Eisen beeinträchtigen oder sich negativ auf den Cholesterinspiegel auswirken. Ein Zinkgehalt von mehr als 500 ppm im Boden beeinträchtigt die Aufnahme anderer essenzieller Metalle wie Eisen und Mangan durch die Pflanzen. Das Einatmen von Zinkdämpfen beim Löten oder Schweißen von verzinkten Materialien kann einen Zustand hervorrufen, der als Zinkschüttelfrost" bezeichnet wird. Zink ist ein häufiger Bestandteil von Prothesencreme, die zwischen 17 und 38 mg Zink pro Gramm enthalten kann. Es gibt Berichte über Invalidität und sogar Todesfälle infolge der übermäßigen Verwendung dieser Produkte. ⓘ
Die US-amerikanische Food and Drug Administration (FDA) erklärt, dass Zink die Nervenrezeptoren in der Nase schädigt und Anosmie verursacht. Berichte über Anosmie wurden auch in den 1930er Jahren beobachtet, als Zinkpräparate bei einem gescheiterten Versuch, Polio-Infektionen zu verhindern, eingesetzt wurden. Am 16. Juni 2009 ordnete die FDA an, intranasale Erkältungspräparate auf Zinkbasis aus den Verkaufsregalen zu entfernen. Die FDA erklärte, dass der Verlust des Geruchsinns lebensbedrohlich sein kann, da Menschen mit beeinträchtigtem Geruchssinn austretendes Gas oder Rauch nicht erkennen können und nicht wissen, ob Lebensmittel verdorben sind, bevor sie sie essen. ⓘ
Jüngste Forschungsergebnisse deuten darauf hin, dass das topische antimikrobielle Zinkpyrithion eine starke Hitzeschockreaktion auslöst, die die genomische Integrität durch Induktion einer PARP-abhängigen Energiekrise in kultivierten menschlichen Keratinozyten und Melanozyten beeinträchtigen kann. ⓘ
Vergiftungen
1982 begann die US-Münzanstalt mit der Prägung von Pfennigen, die mit Kupfer beschichtet sind, aber hauptsächlich Zink enthalten. Zinkpfennige bergen das Risiko einer Zinkvergiftung, die tödlich sein kann. In einem gemeldeten Fall führte die chronische Einnahme von 425 Pfennigen (über 1 kg Zink) zum Tod aufgrund einer bakteriellen und pilzbedingten Sepsis im Magen-Darm-Trakt. Ein anderer Patient, der 12 Gramm Zink zu sich genommen hatte, zeigte lediglich Lethargie und Ataxie (grober Mangel an Koordination der Muskelbewegungen). In mehreren anderen Fällen wurde von Menschen berichtet, die durch den Verzehr von Zinkmünzen eine Zinkvergiftung erlitten. ⓘ
Pfennige und andere kleine Münzen werden manchmal von Hunden verschluckt, so dass die Fremdkörper tierärztlich entfernt werden müssen. Der Zinkgehalt mancher Münzen kann eine Zinkvergiftung verursachen, die bei Hunden in der Regel durch schwere hämolytische Anämie und Leber- oder Nierenschäden tödlich verläuft; Erbrechen und Durchfall sind mögliche Symptome. Bei Papageien ist Zink hochgiftig und eine Vergiftung kann oft tödlich sein. Der Verzehr von Fruchtsäften, die in verzinkten Dosen gelagert wurden, hat zu massenhaften Vergiftungen von Papageien mit Zink geführt. ⓘ
Zinkblech im Bauwesen

Wichtige Zinkprodukte sind auch Halbzeuge, meist in Form von Blechen aus legiertem Zink / Titanzink. Titanzinkblech wird als Werkstoff im Bauwesen verwendet. Heute kommt fast ausschließlich Titanzink zum Einsatz, das korrosionsfester, weniger spröde und dadurch mechanisch deutlich belastbarer ist als unlegiertes Zink bzw. das bis in die 1960er Jahre übliche Zinkblech, das im sogenannten Paketwalzverfahren hergestellt wurde. Gewalztes, massives Titanzinkblech wird hauptsächlich zur Dacheindeckung, als Fassadenbekleidung, für die Dachentwässerung (Regenrinnen, Fallrohre), für Abdeckungen z. B. von Gesimsen oder Außenfensterbänken oder für Anschlüsse und Dachkehlen eingesetzt. Es hält bis zu 100 Jahre und muss in dieser Zeit weder gewartet noch repariert werden, wenn es fachgerecht verarbeitet wurde. Die Verarbeitung erfolgt durch das Klempnerhandwerk. ⓘ
Zinkblech sollte nicht verwechselt werden mit feuerverzinktem Stahlblech, das fälschlicherweise auch des Öfteren Zinkblech oder Weißblech genannt wird. ⓘ
Legiertes Zinkblech wird in Coils oder in Tafeln geliefert. Für die Dachdeckung werden oft Metallbahnen (Schare) verwendet, die zwischen 40 und 60 Zentimeter breit sind und bis zu 16 Meter lang sein können. Die Materialdicke ist unterschiedlich, meist beträgt sie 0,7 Millimeter. Die Verbindung der einzelnen Blechteile erfolgt bei kleinteiligen Elementen meist durch Löten, bei Dachdeckungen meist durch doppeltes Falzen (Doppelstehfalzdeckung). Aufgrund der Wärmeausdehnung von legiertem Zink von 22·10−6/K müssen die Verbindungen und Anschlüsse der Zinkprofile Materialbewegungen zulassen. ⓘ
Moderne Architekten verwirklichen mit Titanzink extravagante Ideen. Daniel Libeskind hat z. B. das Jüdische Museum Berlin oder die Libeskind-Villa in Datteln mit einer Fassade aus Bauzink ausgestattet. Zaha Haddid wählte den Werkstoff für das Transport Museum in Glasgow, das die Verformungseigenschaften des Werkstoffes eindrucksvoll zeigt. ⓘ
Münzprägung
Da Zink als Münzmetall vergleichsweise wenig kostet, wurde es in Notzeiten, zuletzt in den beiden Weltkriegen, in Form von Zinklegierungen zur Münzprägung verwendet, teilte sich diese Verwendung als sog. „Kriegsmetall“ aber mit Münzen aus einer Aluminiumlegierung. Seit 1982 besteht auch der US-Cent (Penny) im Kern aus Zink. ⓘ
Analytik
Analysenreines Zinkpulver dient als Urtitersubstanz nach Arzneibuch zur Einstellung von EDTA-Maßlösungen. ⓘ
Herstellung von Wasserstoff
Zink wird im sogenannten Solzinc-Verfahren zur Herstellung von Wasserstoff genutzt. Dafür wird in einem ersten Schritt Zinkoxid thermisch durch Sonnenenergie in Zink und Sauerstoff aufgespalten, und in einem zweiten Schritt wird das so gewonnene Zink mit Wasser zu Zinkoxid und Wasserstoff umgesetzt. ⓘ
Mangel
Wenn die Zink-Zufuhr unter dem Referenzwert liegt, ist dies nicht mit einem Mangel gleichzusetzen, sie erhöht jedoch die Wahrscheinlichkeit für eine Unterversorgung. ⓘ
Zinkmangel führt zu einer Unterfunktion der Keimdrüsen, Wachstumsstörungen und Blutarmut. Ein niedriger Zinkspiegel äußert sich oft auch durch eine verringerte Abwehrfunktion, Haarausfall, trockene Haut und brüchige Nägel. Zinkmangel kann zu Unfruchtbarkeit beim Mann führen. „Bei einem Mangel an Zink kommt es [..] zu einer reduzierten Geruchs- und Geschmacksempfindung.“ Zinkmangel wird häufig durch einen hohen Kupferspiegel verursacht (z. B. bei reichlichem Trinkwassergenuss aus häuslichen Kupferrohrnetzen), da Zink und Kupfer Antagonisten sind. Selbiges gilt für Eisen, z. B. durch eine sehr eisenreiche Ernährung oder die Einnahme von eisenhaltigen Medikamenten. Die Aufnahme von Zink (wie auch anderen Metallionen) aus dem Darm wird ebenfalls durch phytinsäurehaltige Nahrungsmittel vermindert. ⓘ
Bei Haushunden treten zink-reaktive Dermatosen auf. ⓘ
Zinkgehalt in Lebensmitteln

Folgende Nahrungsmittel sind gute Zinkquellen:
- Rote Fleischsorten
- Käse
- Haferkleie und Haferflocken
- Sonnenblumenkerne
- Kürbiskerne
- Weizenkeime (Weizen)
- Walnüsse und Pekannüsse
- Pilze und Hefen
- Linsen
- Meeresfrüchte und Schalentiere ⓘ
Daneben gibt es Nahrungsmittel, die viel Zink enthalten, bei denen die Bioverfügbarkeit von Zink jedoch geringer ist, da Phytat die Aufnahme verringert. Durch Zubereitungsmethoden wie Einweichen, Keimung oder Sauerteiggärung kann Phytat abgebaut und die Bioverfügbarkeit erhöht werden. Daher gibt die Deutsche Gesellschaft für Ernährung bei Ernährungsformen mit hohem Phytatgehalt einen erhöhten Zinkbedarf an. Vollkornprodukte und Hülsenfrüchte enthalten zwar viel Phytat allerdings ist auch ihr Zinkgehalt hoch, so dass ihr Konsum nicht zu Zinkmangel führt. ⓘ
Tabelle für Lebensmittel mit
ⓘsehr viel Zink pro 100 g viel Zink pro 100 g durchschnittlich viel Zink pro 100 g wenig Zink pro 100 g Austern 7,0–160,0 mg Paranüsse 4,0 mg Hirse 3,4 mg Huhn 1,0 mg Leber (Kalb, Schwein, Rind) bis zu 6,3 mg (Schwein) Lamm 2,3–6,0 mg Knäckebrot 3,1 mg Fisch 0,4–1,1 mg Sojamehl 5,7 mg Linsen (getrocknet) 3,7 mg Nudeln (ungekocht) 3,1 mg Gemüse 0,2–1,0 mg Emmentaler 30 % o. 45 % F.i.Tr. 4,6 mg Sojabohnen (getrocknet) 0,7–4,2 mg Walnuss 2,7 mg Joghurt 0,3–0,5 mg Haferflocken 4,0–4,5 mg Mais 2,5–3,5 mg Vollkornkekse 2,7 mg Kartoffel 0,4–0,6 mg Butterkäse, Tilsiter, Gouda, Edamer 3,5–4,0 mg Erdnüsse (geröstet) 3,0–3,5 mg Camembert 2,7 mg Vollmilch 0,4 mg Rindfleisch 3,0–4,4 mg Weizenmischbrot 3,5 mg Bohnen (weiß) 2,6 mg Obst 0,1–0,5 mg
Zink als Heilmittel
Zinkhaltige Salben werden bei der Wundheilung und Hautausschlägen (Ekzeme) angewendet. Beispiele für pharmazeutisch genutzte Zinksalze sind Zinkacetat, Zinkacexamat, Zinkchlorid, Zinkgluconat, Zinkoxid, Zinkstearat, Zinksulfat, Zinkundecylenat. ⓘ
Zink wirkt auf den Stoffwechsel der Darmzellen dahingehend, dass weniger Kupfer resorbiert wird. Zinksalze (z. B. Zinksulfat, Zinkacetat) eignen sich daher als Arzneistoffe in der Behandlung des Morbus Wilson, einer Erkrankung, bei der der Kupferstoffwechsel in der Leber gestört ist und es dadurch zu einer vermehrten Ansammlung von Kupfer in der Leber, dem Auge, dem Zentralnervensystem und anderen Organen kommt. ⓘ
Eine oft zitierte Metastudie des indischen Institute of Medical Education and Research, die belegen sollte, dass Zink bei Erkältungskrankheiten eine mildernde und die Krankheitsdauer verkürzende Wirkung habe, wies so schwerwiegende Mängel auf, dass sie durch die Cochrane Collaboration zurückgezogen wurde. Eine Metastudie aus dem Jahr 2021 enthält Hinweise darauf, dass Zink Atemwegsinfektions-Symptomen vorbeugen und die Krankheitsdauer verkürzen könne. Allerdings gebe es große Unsicherheiten im Hinblick auf die Wirksamkeit verschiedener Formulierungen und Dosierungen und auch unterscheiden sich die vorliegenden Studien in Qualität, Umfang und Design deutlich. Ältere Untersuchungen konnten eine positive Wirkung allerdings nicht nachweisen. ⓘ
2004 gaben die World Health Organization (WHO) und die United Nations Children’s Fund (UNICEF) eine Stellungnahme zur Behandlung akuter Diarrhöe (Durchfall) ab, in der sie die gemeinsame Behandlung mit Zink und oraler Rehydrationslösung (ORS) empfahlen. Auch eine Meta-Analyse der Cochrane Collaboration stellte eine positive Wirkung von Zink bei der Behandlung von Diarrhöe bei Kindern fest, eingeschränkt auf Kinder über sechs Jahren und aus Regionen mit potenzieller Zink-Unterversorgung. ⓘ
Sicherheitshinweise
Zink reizt die Augenschleimhäute und die Haut. Beim Einatmen reizt es die Schleimhäute, was zu Trockenheit und Kratzen in Nase und Rachenraum, Husten und Hustenreiz führen kann. Jedoch sind keine schwerwiegenden akuten Wirkungen von Zink bekannt. ⓘ
Beim Arbeiten mit Zinkschmelzen oder Erhitzung (z. B. Schweißen) von zinkhaltigen Materialien kann sich Zinkdampf bilden, der sich sofort in Zinkoxidrauch umwandelt. Das Einatmen kann zu Metalldampffieber führen. Es ist daher auf gute Lüftung und Atemschutz zu achten. ⓘ
Nachweis
Ein einfacher Zinknachweis beruht auf dem Erhitzen einer Probe mit wenigen Tropfen einer verdünnten Lösung eines Cobaltsalzes auf einer Magnesiarinne im Bunsenbrenner. Ist Zink zugegen, ist nach kurzer Zeit das so genannte Rinmans Grün zu erkennen. ⓘ
Die quantitative Bestimmung kann mittels Komplexometrie mit einer EDTA-Maßlösung erfolgen. Zur Spurenbestimmung kommen die verschiedenen Methoden der Polarographie in Frage. Im Ultraspurenbereich setzt man die Graphitrohr-AAS ein. Zink ist ein relativ leicht flüchtiges Element, weshalb Matrixmodifizierer wie Palladium- und Magnesiumnitrat von Bedeutung sind, weil sie die mögliche Pyrolysetemperatur heraufsetzen. Alternativ bieten sich die Inversvoltammetrie oder die ICP-MS als äußerst empfindliche instrumentelle Methoden an. ⓘ
Verbindungen
Organische Verbindungen


Zinkacetat ist ein farbloser Feststoff und wird in der Holzkonservierung, als Beizmittel beim Färben, als Lebensmittelzusatz, als Futtermittelzusatz, als Bestandteil von Klebstoffen, als Glasur für Porzellan und als Reagens für die Prüfung auf Albumin, Tannin und Phosphat verwendet. ⓘ
Zinkstearat ist das Zinksalz der Stearinsäure und gehört zu den Metallseifen. Es besteht aus einem Zink-Ion und zwei langkettigen Stearat-Ionen. ⓘ



![{\displaystyle {\ce {ZnO + C ->[950^oC] Zn + CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1592f63fc0ae67a24850c33381264f5ca6bd1f55)
