Ordnungszahl
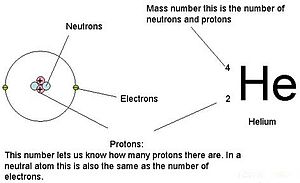

Die Ordnungszahl oder Kernladungszahl (Symbol Z) eines chemischen Elements ist die Ladungszahl eines Atomkerns. Bei gewöhnlichen Kernen ist sie gleich der Protonenzahl (np) oder der Anzahl der Protonen, die sich bei jedem Atom dieses Elements im Kern befinden. Die Ordnungszahl kann zur eindeutigen Identifizierung gewöhnlicher chemischer Elemente verwendet werden. Bei einem gewöhnlichen ungeladenen Atom ist die Ordnungszahl auch gleich der Anzahl der Elektronen. ⓘ
Bei einem gewöhnlichen Atom ergibt die Summe aus der Ordnungszahl Z und der Neutronenzahl N die Atommassenzahl A des Atoms. Da Protonen und Neutronen annähernd die gleiche Masse haben (und die Masse der Elektronen für viele Zwecke vernachlässigbar ist) und der Massendefekt der Nukleonenbindung im Vergleich zur Nukleonenmasse immer klein ist, liegt die Atommasse eines jeden Atoms, wenn sie in einheitlichen Atommasseneinheiten ausgedrückt wird (wodurch eine Größe entsteht, die als "relative Isotopenmasse" bezeichnet wird), innerhalb von 1 % der ganzen Zahl A. ⓘ
Atome mit der gleichen Ordnungszahl, aber unterschiedlichen Neutronenzahlen und damit unterschiedlichen Massenzahlen werden als Isotope bezeichnet. Etwas mehr als drei Viertel der natürlich vorkommenden Elemente liegen als Isotopengemisch vor (siehe monoisotopische Elemente), und die durchschnittliche Isotopenmasse eines Isotopengemischs für ein Element (die sogenannte relative Atommasse) in einer bestimmten Umgebung auf der Erde bestimmt das Standard-Atomgewicht des Elements. Historisch gesehen waren diese Atomgewichte der Elemente (im Vergleich zu Wasserstoff) die von Chemikern im 19. Jahrhundert messbaren Größen. ⓘ
Das herkömmliche Symbol Z leitet sich vom deutschen Wort Zahl" ab, das vor der modernen Synthese von Ideen aus der Chemie und der Physik lediglich den numerischen Platz eines Elements im Periodensystem bezeichnete, dessen Reihenfolge damals ungefähr, aber nicht vollständig, mit der Reihenfolge der Elemente nach Atomgewichten übereinstimmte. Erst nach 1915, mit dem Hinweis und dem Nachweis, dass diese Z-Zahl auch die Kernladung und eine physikalische Eigenschaft der Atome ist, wurde das Wort Atomzahl (und seine englische Entsprechung atomic number) in diesem Zusammenhang allgemein verwendet. ⓘ
Geschichte
Das Periodensystem und eine natürliche Zahl für jedes Element

Vereinfacht ausgedrückt ergibt sich aus der Existenz oder dem Aufbau eines Periodensystems der Elemente eine Ordnung der Elemente, so dass sie in einer bestimmten Reihenfolge nummeriert werden können. ⓘ
Dmitri Mendelejew behauptete, er habe sein erstes Periodensystem (erstmals veröffentlicht am 6. März 1869) nach dem Atomgewicht geordnet. In Anbetracht der beobachteten chemischen Eigenschaften der Elemente änderte er die Reihenfolge jedoch geringfügig und platzierte Tellur (Atomgewicht 127,6) vor Jod (Atomgewicht 126,9). Diese Platzierung entspricht der heutigen Praxis, die Elemente nach der Protonenzahl Z zu ordnen, aber diese Zahl war damals noch nicht bekannt oder wurde vermutet. ⓘ

Eine einfache Nummerierung auf der Grundlage der Position im Periodensystem war jedoch nie ganz zufriedenstellend. Neben dem Fall von Jod und Tellur wurden später mehrere andere Elementpaare (z. B. Argon und Kalium, Kobalt und Nickel) bekannt, die nahezu identische oder umgekehrte Atomgewichte aufwiesen, so dass ihre Platzierung im Periodensystem durch ihre chemischen Eigenschaften bestimmt werden musste. Die allmähliche Identifizierung von immer mehr chemisch ähnlichen Lanthanidenelementen, deren Ordnungszahl nicht eindeutig war, führte jedoch zumindest ab Lutetium (Element 71) (Hafnium war zu diesem Zeitpunkt noch nicht bekannt) zu Unstimmigkeiten und Unsicherheiten bei der periodischen Nummerierung der Elemente. ⓘ
Das Rutherford-Bohr-Modell und van den Broek
1911 stellte Ernest Rutherford ein Modell des Atoms vor, bei dem ein zentraler Kern den größten Teil der Masse des Atoms und eine positive Ladung trägt, die in Einheiten der Elektronenladung ungefähr der Hälfte des Atomgewichts, ausgedrückt in der Anzahl der Wasserstoffatome, entsprechen sollte. Diese zentrale Ladung würde also ungefähr der Hälfte des Atomgewichts entsprechen (obwohl sie fast 25 % von der Ordnungszahl des Goldes (Z = 79, A = 197) abweicht, dem einzigen Element, aus dem Rutherford seine Vermutung ableitete). Trotz Rutherfords Schätzung, dass Gold eine zentrale Ladung von etwa 100 hatte (aber das Element Z = 79 im Periodensystem war), schlug Antonius van den Broek einen Monat nach dem Erscheinen von Rutherfords Arbeit zum ersten Mal formell vor, dass die zentrale Ladung und die Anzahl der Elektronen in einem Atom genau mit seinem Platz im Periodensystem übereinstimmen (auch bekannt als Elementnummer, Ordnungszahl und symbolisiert mit Z). Dies erwies sich schließlich als zutreffend. ⓘ
Moseleys Experiment von 1913

Die experimentelle Lage verbesserte sich nach den Forschungen von Henry Moseley im Jahr 1913 dramatisch. Nach Gesprächen mit Bohr, der im selben Labor arbeitete (und Van den Broeks Hypothese in seinem Bohr'schen Atommodell verwendet hatte), beschloss Moseley, Van den Broeks und Bohrs Hypothese direkt zu testen, indem er herausfand, ob die von angeregten Atomen emittierten Spektrallinien der Bohr'schen Theorie entsprachen, wonach die Frequenz der Spektrallinien proportional zum Quadrat von Z ist. ⓘ
Zu diesem Zweck maß Moseley die Wellenlängen der innersten Photonenübergänge (K- und L-Linien), die von Elementen von Aluminium (Z = 13) bis Gold (Z = 79) erzeugt wurden, die als bewegliche anodische Targets in einer Röntgenröhre verwendet wurden. Die Quadratwurzel der Frequenz dieser Photonen (Röntgenstrahlen) nahm von einem Target zum nächsten in einer arithmetischen Progression zu. Dies führte zu der Schlussfolgerung (Moseleys Gesetz), dass die Ordnungszahl (mit einem Versatz von einer Einheit für K-Linien, in Moseleys Arbeit) eng mit der berechneten elektrischen Ladung des Kerns, d. h. der Elementzahl Z, übereinstimmt. Unter anderem zeigte Moseley, dass die Lanthanidenreihe (von Lanthan bis einschließlich Lutetium) 15 Mitglieder haben muss - nicht weniger und nicht mehr -, was aus der damals bekannten Chemie keineswegs offensichtlich war. ⓘ
Fehlende Elemente
Nach Moseleys Tod im Jahr 1915 wurden die Ordnungszahlen aller bekannten Elemente von Wasserstoff bis Uran (Z = 92) nach seiner Methode untersucht. Es gab sieben Elemente (mit Z < 92), die nicht gefunden wurden und daher als noch unentdeckt galten, entsprechend den Ordnungszahlen 43, 61, 72, 75, 85, 87 und 91. Von 1918 bis 1947 wurden alle sieben dieser fehlenden Elemente entdeckt. Zu diesem Zeitpunkt waren auch die ersten vier Transurane entdeckt worden, so dass das Periodensystem bis zum Curium (Z = 96) lückenlos war. ⓘ
Das Proton und die Idee der Kernelektronen
Im Jahr 1915 war der Grund für die Quantisierung der Kernladung in Einheiten von Z, die nun als gleichwertig mit der Elementzahl anerkannt wurden, noch nicht klar. Eine alte Idee, die so genannte Prout-Hypothese, hatte postuliert, dass alle Elemente aus Resten (oder "Protylen") des leichtesten Elements Wasserstoff bestehen, das im Bohr-Rutherford-Modell ein einziges Elektron und eine Kernladung von eins hatte. Doch bereits 1907 hatten Rutherford und Thomas Royds gezeigt, dass Alphateilchen, die eine Ladung von +2 hatten, die Kerne von Heliumatomen waren, die eine vierfache und nicht eine zweifache Masse von Wasserstoff hatten. Wenn die Hypothese von Prout zutraf, musste etwas die Ladung der Wasserstoffkerne in den Kernen der schwereren Atome neutralisieren. ⓘ
1917 gelang es Rutherford, durch eine Kernreaktion zwischen Alphateilchen und Stickstoffgas Wasserstoffkerne zu erzeugen, und er glaubte, das Prout'sche Gesetz bewiesen zu haben. Er nannte die neuen schweren Kernteilchen 1920 Protonen (alternative Bezeichnungen sind Proutonen und Protyle). Aus den Arbeiten von Moseley war sofort ersichtlich, dass die Kerne schwerer Atome mehr als doppelt so viel Masse haben, wie man erwarten würde, wenn sie aus Wasserstoffkernen bestünden, und so wurde eine Hypothese für die Neutralisierung der zusätzlichen Protonen benötigt, die in allen schweren Kernen vermutet wurden. Man nahm an, dass ein Heliumkern aus vier Protonen plus zwei "Kernelektronen" (im Kern gebundene Elektronen) besteht, um zwei der Ladungen zu neutralisieren. Am anderen Ende des Periodensystems ging man davon aus, dass ein Goldkern mit der 197-fachen Masse des Wasserstoffs 118 Kernelektronen im Kern enthält, um ihm eine Restladung von +79 zu verleihen, was seiner Ordnungszahl entsprach. ⓘ
Mit der Entdeckung des Neutrons wird Z zur Protonenzahl
Mit der Entdeckung des Neutrons durch James Chadwick im Jahr 1932 endeten alle Überlegungen zu Kernelektronen. Ein Goldatom enthielt nun nicht mehr 118 Kernelektronen, sondern 118 Neutronen, und seine positive Kernladung stammte nun ausschließlich aus einem Gehalt von 79 Protonen. Da Moseley zuvor gezeigt hatte, dass die Ordnungszahl Z eines Elements dieser positiven Ladung entspricht, war nun klar, dass Z mit der Anzahl der Protonen des Kerns identisch ist. ⓘ
Chemische Eigenschaften
Jedes Element hat eine Reihe spezifischer chemischer Eigenschaften, die sich aus der Anzahl der Elektronen im neutralen Atom ergeben, die Z (die Ordnungszahl) ist. Die Konfiguration dieser Elektronen ergibt sich aus den Grundsätzen der Quantenmechanik. Die Anzahl der Elektronen in den Elektronenschalen der einzelnen Elemente, insbesondere in der äußersten Valenzschale, ist der wichtigste Faktor für das chemische Bindungsverhalten. Daher bestimmt allein die Ordnungszahl die chemischen Eigenschaften eines Elements, und aus diesem Grund kann ein Element als eine beliebige Mischung von Atomen mit einer bestimmten Ordnungszahl definiert werden. ⓘ
Neue Elemente
Die Suche nach neuen Elementen wird in der Regel anhand der Ordnungszahlen beschrieben. Bis zum Jahr 2023 wurden alle Elemente mit den Ordnungszahlen 1 bis 118 beobachtet. Die Synthese neuer Elemente erfolgt durch den Beschuss von Zielatomen schwerer Elemente mit Ionen, so dass die Summe der Ordnungszahlen von Ziel- und Ionenelement gleich der Ordnungszahl des entstehenden Elements ist. Im Allgemeinen wird die Halbwertszeit eines Nuklids mit zunehmender Ordnungszahl kürzer, obwohl unentdeckte Nuklide mit bestimmten "magischen" Protonen- und Neutronenzahlen relativ lange Halbwertszeiten haben und eine Insel der Stabilität darstellen können. ⓘ
Ein hypothetisches Element, das nur aus Neutronen besteht, wurde ebenfalls vorgeschlagen und hätte die Ordnungszahl 0. ⓘ
Kennzahl der Elemente
Die Ordnungszahl ist gleichwertig mit dem Namen des chemischen Elements, d. h., alle Atome mit gleicher Ordnungszahl gehören zum selben Element. Die Ordnungszahl beschreibt die Einordnung des jeweiligen Elements in das Periodensystem und wird gewöhnlich links unten neben dem Elementsymbol angegeben. ⓘ
So weist z. B. das Kohlenstoffatom sechs Protonen auf:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{^{12}_{6}C <span title="Aus: Deutsche Wikipedia, Abschnitt "Kennzahl der Elemente"" class="plainlinks">[https://de.wikipedia.org/wiki/Ordnungszahl#Kennzahl_der_Elemente <span style="color:#dddddd">ⓘ</span>]</span>}}
Nur beim Element mit der niedrigsten Ordnungszahl (, Wasserstoff) sind für seine einzelnen natürlich vorkommenden Isotope eigene Namen üblich: Deuterium (Massenzahl ), Tritium (), zur Unterscheidung gelegentlich auch Protium (). Historisch gab es beispielsweise auch bei Radon spezielle Bezeichnungen für seine Isotope, etwa „Thoron“. ⓘ
Zusammenhang mit Neutronen- und Massenzahl
Die Neutronenzahl eines Atomkerns lässt sich mit Kenntnis der Anzahl der Protonen und der Massenzahl berechnen:
oder aufgelöst nach der Massenzahl:
Wertebereich und Bedeutung
Ordnungszahlen sind natürliche Zahlen. Sie laufen von 1 (Wasserstoff) bis (Stand 2020) 118. Zu jeder dieser Zahlen ist heute lückenlos ein Element bekannt. Im Bereich höchster Ordnungszahlen (ehemals über 92 (Transurane), später über 100) kam es wiederholt vor, dass bei der Entdeckung, der Erzeugung und dem Nachweis der Elemente eine Lücke verblieb, die erst später geschlossen werden konnte. Tendenziell haben Atome von Elementen mit höherer Ordnungszahl (= Protonenzahl) auch mehr Neutronen im Kern. ⓘ
Gase haben überwiegend zweiatomige Moleküle. Ideale-Gas-Eigenschaft vorausgesetzt, steigt mit der Ordnungszahl auch die zur Molekülmasse proportionale Dichte. So ist Radon bei Normalbedingungen für Druck und Temperatur 55,5-mal so dicht wie Helium – bei () 43-fach höherer Ordnungszahl. Beides sind Edelgase; für den Vergleich wurde jeweils das häufigste natürliche Isotop, in beiden Fällen häufiger als 90 %, herangezogen. ⓘ
Bei Festkörpern (samt den seltenen ebenfalls auf Druck volumsstabilen Flüssigkeiten) ist der Zusammenhang weniger scharf ausgeprägt, da die Atomdurchmesser und damit die Atomabstände verschiedener Elemente stark variieren. Innerhalb jeder einzelnen Gruppe (= Spalte) des Periodensystems ist der Zusammenhang größere Ordnungszahl (⇒ größere Massenzahl) ⇒ größere Dichte schon erkennbar: Natrium Na, eine Position unter Lithium, ist schwerer als Li. Zink Zn, zwei Positionen über Quecksilber Hg ist leichter. In der Gruppe Kohlenstoff C, Silizium Si, Germanium Ge, Wismut Bi, zuunterst Blei Pb steigen nach unten die Dichten – von etwa 2 g/cm3 auf etwa 14 g/cm3 – klar an. ⓘ
Elemente mit sehr großen Ordnungszahlen, etwa Transurane (), haben (tendenziell) nur instabile, also radioaktive Isotope. Die drei natürlichen Zerfallsreihen laufen abwärts bis zu drei verschiedenen Bleiisotopen (), die vierte Zerfallsreihe zu einem Thalliumnuklid (). Das Nuklid mit der niedrigsten Ordnungszahl in diesen Reihen ist ein Quecksilberisotop (). Durch Kernreaktionen entstehen mitunter auch radioaktive Nuklide mit niedrigen Ordnungszahlen, etwa C-14 aus N-14 in der hohen Atmosphäre. ⓘ
Höchste Ordnungszahlen
Prinzipiell stellt die Ordnungszahl Z=137 eine natürliche rechnerische Grenze dar, da die Geschwindigkeit des Elektrons auf der innersten Bahn nach dem Bohrschen Modell gegeben ist durch v=Z·α·c, was spätestens für Z>137 eine höhere Geschwindigkeit als c erfordern würde. ⓘ
Die bisher höchste nachgewiesene Ordnungszahl hat Oganesson mit 118 (Stand: Mai 2020). Neue Elemente mit höheren Ordnungszahlen nachzuweisen ist wegen des typisch raschen Zerfalls schwierig. ⓘ
Für die provisorische Benennung von hypothetischen oder noch nicht bestätigten Elementen werden systematische Elementnamen vergeben, die im Wesentlichen eine Umschreibung der Ziffern der Ordnungszahl mit Silben aus lateinischen und griechischen Zahlwörtern ist. ⓘ
Beispiele:
- Unununium (Uuu) – bestätigt und nunmehr Roentgenium (Rg) benannt
- Unbitrium (Ubt) – bislang hypothetisch ⓘ


















