Xenon
 Eine mit Xenon gefüllte Entladungsröhre, die hellblau leuchtet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xenon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erscheinungsbild | farbloses Gas, das in einem elektrischen Feld blau leuchtet | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Xe) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xenon im Periodensystem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | Gruppe 18 (Edelgase) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | Periode 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-Block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Krypton|Kr]]] 4d10 5s2 5p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase bei STP | Gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 161,40 K (-111,75 °C, -169,15 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 165,051 K (-108,099 °C, -162,578 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte (bei STP) | 5.894 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| in flüssigem Zustand (bei B.P.) | 2.942 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tripelpunkt | 161,405 K, 81,77 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritischer Punkt | 289,733 K, 5,842 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 2,27 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 12,64 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molare Wärmekapazität | 21,01 J/(mol-K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Verdampfungsdruck
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationsstufen | 0, +2, +4, +6, +8 (selten mehr als 0; ein schwach saures Oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 2,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionisierungsenergien |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 140±9 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 216 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spektrallinien von Xenon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Andere Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natürliches Vorkommen | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch-flächenzentriert (fcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | Gas: 178 m-s-1 Flüssigkeit: 1090 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 5,65×10-3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -43,9×10-6 cm3/mol (298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-63-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Geschichte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entdeckung und erste Isolierung | William Ramsay und Morris Travers (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hauptisotope von Xenon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Xenon ist ein chemisches Element mit dem Symbol Xe und der Ordnungszahl 54. Es ist ein farbloses, dichtes, geruchloses Edelgas, das in der Erdatmosphäre in Spuren vorkommt. Obwohl es im Allgemeinen nicht reaktionsfähig ist, kann es einige chemische Reaktionen eingehen, wie z. B. die Bildung von Xenonhexafluoroplatinat, der ersten synthetisch hergestellten Edelgasverbindung. ⓘ
Xenon wird in Blitzlampen und Bogenlampen sowie als allgemeines Anästhetikum verwendet. Der erste Excimer-Laser verwendete ein Xenon-Dimer-Molekül (Xe2) als Lasermedium, und die frühesten Laserdesigns verwendeten Xenon-Blitzlampen als Pumpen. Xenon wird auch für die Suche nach hypothetischen, schwach wechselwirkenden massiven Teilchen verwendet und als Treibstoff für Ionentriebwerke in Raumfahrzeugen. ⓘ
Natürlich vorkommendes Xenon besteht aus sieben stabilen Isotopen und zwei langlebigen radioaktiven Isotopen. Mehr als 40 instabile Xenon-Isotope unterliegen einem radioaktiven Zerfall, und die Isotopenverhältnisse von Xenon sind ein wichtiges Instrument zur Untersuchung der frühen Geschichte des Sonnensystems. Radioaktives Xenon-135 entsteht durch Betazerfall von Jod-135 (einem Produkt der Kernspaltung) und ist der wichtigste (und unerwünschte) Neutronenabsorber in Kernreaktoren. ⓘ
Xenon (![]() anhören?/i) ist ein chemisches Element mit dem Elementsymbol Xe und der Ordnungszahl 54. Im Periodensystem steht es in der 8. Hauptgruppe, bzw. der 18. IUPAC-Gruppe und zählt daher zu den Edelgasen. Wie die anderen Edelgase ist es ein farbloses, äußerst reaktionsträges, einatomiges Gas. In vielen Eigenschaften wie Schmelz- und Siedepunkt oder Dichte steht es zwischen dem leichteren Krypton und dem schwereren Radon. ⓘ
anhören?/i) ist ein chemisches Element mit dem Elementsymbol Xe und der Ordnungszahl 54. Im Periodensystem steht es in der 8. Hauptgruppe, bzw. der 18. IUPAC-Gruppe und zählt daher zu den Edelgasen. Wie die anderen Edelgase ist es ein farbloses, äußerst reaktionsträges, einatomiges Gas. In vielen Eigenschaften wie Schmelz- und Siedepunkt oder Dichte steht es zwischen dem leichteren Krypton und dem schwereren Radon. ⓘ
Xenon ist das seltenste nichtradioaktive Element auf der Erde und kommt in geringen Mengen in der Atmosphäre vor. Trotz seiner Seltenheit wird es vielfach eingesetzt, so als Füllgas von hochwertigen Isolierglaseinheiten, sowie Xenon-Gasentladungslampen, die unter anderem in Autoscheinwerfern (Xenonlicht) eingesetzt werden, und als Inhalationsanästhetikum. ⓘ
Das Edelgas wurde 1898 von William Ramsay und Morris William Travers durch fraktionierte Destillation von flüssiger Luft entdeckt. Xenon ist das Edelgas mit den meisten bekannten chemischen Verbindungen. Die stabilste ist dabei das Xenon(II)-fluorid, das als starkes Oxidations- und Fluorierungsmittel eingesetzt wird. ⓘ
Geschichte
Xenon wurde im September 1898 in England von dem schottischen Chemiker William Ramsay und dem englischen Chemiker Morris Travers entdeckt, kurz nachdem sie die Elemente Krypton und Neon entdeckt hatten. Sie fanden Xenon in den Rückständen, die beim Verdampfen von Bestandteilen der flüssigen Luft übrig blieben. Ramsay schlug für dieses Gas den Namen Xenon vor, abgeleitet vom griechischen Wort ξένον xénon, der Neutrumform von ξένος xénos, was so viel wie "fremd(er)", "seltsam(er)" oder "Gast" bedeutet. Im Jahr 1902 schätzte Ramsay den Anteil von Xenon in der Erdatmosphäre auf einen Teil in 20 Millionen. ⓘ
In den 1930er Jahren begann der amerikanische Ingenieur Harold Edgerton mit der Erforschung der Blitzlichttechnik für Hochgeschwindigkeitsaufnahmen. Dies führte ihn zur Erfindung der Xenon-Blitzlampe, bei der Licht erzeugt wird, indem ein kurzer elektrischer Strom durch eine mit Xenon-Gas gefüllte Röhre geleitet wird. Im Jahr 1934 konnte Edgerton mit dieser Methode Blitzlichter von bis zu einer Mikrosekunde erzeugen. ⓘ
1939 begann der amerikanische Arzt Albert R. Behnke Jr. mit der Erforschung der Ursachen der "Trunkenheit" bei Tiefseetauchern. Er testete die Auswirkungen unterschiedlicher Atemgemische auf seine Probanden und stellte fest, dass die Taucher dadurch eine Veränderung der Tiefe wahrnahmen. Aus seinen Ergebnissen schloss er, dass Xenon-Gas als Narkosemittel dienen könnte. Obwohl der russische Toxikologe Nikolay V. Lazarev die Xenon-Anästhesie offenbar 1941 untersuchte, wurde der erste veröffentlichte Bericht, der die Xenon-Anästhesie bestätigte, 1946 von dem amerikanischen Mediziner John H. Lawrence verfasst, der an Mäusen experimentierte. Als chirurgisches Anästhetikum wurde Xenon erstmals 1951 von dem amerikanischen Anästhesisten Stuart C. Cullen verwendet, der es erfolgreich bei zwei Patienten einsetzte. ⓘ

Xenon und die anderen Edelgase galten lange Zeit als chemisch völlig inert und unfähig, Verbindungen einzugehen. Während seiner Lehrtätigkeit an der University of British Columbia entdeckte Neil Bartlett jedoch, dass das Gas Platinhexafluorid (PtF6) ein starkes Oxidationsmittel ist, das Sauerstoffgas (O2) zu Dioxygenylhexafluoroplatinat (O+
2[PtF
6]−
). Da O2 (1165 kJ/mol) und Xenon (1170 kJ/mol) fast das gleiche erste Ionisierungspotenzial haben, erkannte Bartlett, dass Platinhexafluorid auch in der Lage sein könnte, Xenon zu oxidieren. Am 23. März 1962 mischte er die beiden Gase und stellte die erste bekannte Verbindung eines Edelgases her, Xenonhexafluoroplatinat. ⓘ
Bartlett vermutete, dass es sich um Xe+[PtF6]- handelte, aber spätere Arbeiten ergaben, dass es sich wahrscheinlich um ein Gemisch verschiedener xenonhaltiger Salze handelte. Seitdem wurden neben einigen Verbindungen der Edelgase Argon, Krypton und Radon viele weitere Xenonverbindungen entdeckt, darunter Argonfluorhydrid (HArF), Kryptondifluorid (KrF2) und Radonfluorid. Bis 1971 waren mehr als 80 Xenonverbindungen bekannt. ⓘ
Im November 1989 demonstrierten IBM-Wissenschaftler eine Technologie, mit der einzelne Atome manipuliert werden können. Das Programm mit der Bezeichnung IBM in Atomen nutzte ein Rastertunnelmikroskop, um 35 einzelne Xenonatome auf einem Substrat aus gekühltem Nickelkristall so anzuordnen, dass das Firmenkürzel aus drei Buchstaben entstand. Es war das erste Mal, dass Atome präzise auf einer ebenen Fläche positioniert wurden. ⓘ
Neil Bartlett entdeckte mit Xenonhexafluoroplatinat 1962 erstmals eine Xenonverbindung und damit die erste Edelgasverbindung überhaupt. Nur wenige Monate nach dieser Entdeckung konnten nahezu gleichzeitig im August 1962 Xenon(II)-fluorid von Rudolf Hoppe und Xenon(IV)-fluorid von einer Gruppe um die amerikanischen Chemiker C. L. Chernick und H. H. Claassen synthetisiert werden. ⓘ
Merkmale

Xenon hat die Ordnungszahl 54, das heißt, sein Kern enthält 54 Protonen. Bei Standardtemperatur und -druck hat reines Xenongas eine Dichte von 5,894 kg/m3, was etwa dem 4,5-fachen der Dichte der Erdatmosphäre auf Meereshöhe entspricht (1,217 kg/m3). Als Flüssigkeit hat Xenon eine Dichte von bis zu 3.100 g/ml, wobei das Dichtemaximum am Tripelpunkt liegt. Flüssiges Xenon hat aufgrund seines großen Atomvolumens eine hohe Polarisierbarkeit und ist daher ein ausgezeichnetes Lösungsmittel. Es kann Kohlenwasserstoffe, biologische Moleküle und sogar Wasser auflösen. Unter den gleichen Bedingungen ist die Dichte von festem Xenon, 3,640 g/cm3, größer als die durchschnittliche Dichte von Granit, 2,75 g/cm3. Unter einem Druck von einem Gigapascal bildet Xenon eine metallische Phase. ⓘ
Festes Xenon geht unter Druck von der kubisch-flächenzentrierten (fcc) in die hexagonal dicht gepackte (hcp) Kristallphase über und beginnt bei etwa 140 GPa metallisch zu werden, wobei die hcp-Phase keine nennenswerte Volumenänderung aufweist. Bei 155 GPa ist es vollständig metallisch. Wenn es metallisiert ist, erscheint Xenon himmelblau, da es rotes Licht absorbiert und andere sichtbare Frequenzen durchlässt. Ein solches Verhalten ist für ein Metall ungewöhnlich und wird durch die relativ geringe Breite der Elektronenbänder in diesem Zustand erklärt. ⓘ

(animierte Version) ⓘ
Flüssige oder feste Xenon-Nanopartikel können bei Raumtemperatur durch Implantation von Xe+-Ionen in eine feste Matrix gebildet werden. Viele Feststoffe haben kleinere Gitterkonstanten als festes Xe. Dies führt dazu, dass das implantierte Xe auf einen Druck komprimiert wird, der für seine Verflüssigung oder Verfestigung ausreichen kann. ⓘ
Xenon gehört zu den nullwertigen Elementen, die als Edel- oder Inertgase bezeichnet werden. Es ist inert gegenüber den meisten üblichen chemischen Reaktionen (wie z. B. Verbrennung), da die äußere Valenzschale acht Elektronen enthält. Dadurch entsteht eine stabile Konfiguration mit minimaler Energie, in der die äußeren Elektronen fest gebunden sind. ⓘ
In einer gasgefüllten Röhre gibt Xenon ein blaues oder lavendelfarbenes Leuchten ab, wenn es durch eine elektrische Entladung angeregt wird. Xenon emittiert eine Reihe von Emissionslinien, die sich über das gesamte sichtbare Spektrum erstrecken, wobei die intensivsten Linien im Bereich des blauen Lichts auftreten und die Färbung hervorrufen. ⓘ

Xenon ist bei Normalbedingungen ein einatomiges, farbloses und geruchloses Gas, das bei 165,1 K (−108 °C) kondensiert und bei 161,7 K (−111,45 °C) erstarrt. Wie die anderen Edelgase außer dem Helium kristallisiert Xenon in einer kubisch dichtesten Kugelpackung mit dem Gitterparameter a = 620 pm. ⓘ
Wie alle Edelgase besitzt Xenon nur abgeschlossene Schalen (Edelgaskonfiguration). Dadurch lässt sich erklären, dass das Gas stets einatomig vorliegt und die Reaktivität gering ist. Jedoch ist die Ionisierungsenergie der äußersten Elektronen so niedrig, dass sie sich im Gegensatz zu den Valenzelektronen der leichteren Edelgase auch chemisch abspalten lassen und Xenonverbindungen möglich sind. ⓘ
Die Wärmeleitfähigkeit ist sehr niedrig und liegt, je nach Temperatur, bei etwa 0,0055 W/mK. Unter hohem Druck von 33 GPa und bei einer Temperatur von 32 K verhält sich Xenon wie ein Metall, es ist elektrisch leitfähig. ⓘ
Vorkommen und Produktion
Xenon ist ein Spurengas in der Erdatmosphäre, das in einem Volumenanteil von 87±1 nL/L (Teile pro Milliarde), also etwa 1 Teil pro 11,5 Millionen, vorkommt. Es kommt auch als Bestandteil von Gasen vor, die aus einigen Mineralquellen austreten. Bei einer Gesamtmasse der Atmosphäre von 5,15×1018 Kilogramm (1,135×1019 lb) enthält die Atmosphäre insgesamt etwa 2,03 Gigatonnen (2,00×109 lange Tonnen; 2,24×109 kurze Tonnen) Xenon, wenn man die durchschnittliche molare Masse der Atmosphäre mit 28,96 g/mol ansetzt, was etwa 394 Massen-ppb entspricht. ⓘ
Kommerziell
Die Gewinnung von Xenon erfolgt ausschließlich durch das Linde-Verfahren aus Luft. Bei der Stickstoff-Sauerstoff-Trennung reichert es sich auf Grund der hohen Dichte zusammen mit Krypton im flüssigen Sauerstoff an, der sich im Sumpf der Kolonne befindet. Dieses Gemisch wird in eine Kolonne überführt, in der es auf etwa 0,3 % Krypton und Xenon angereichert wird. Dazu enthält das flüssige Krypton-Xenon-Konzentrat neben Sauerstoff noch größere Mengen Kohlenwasserstoffe wie Methan, fluorierte Verbindungen wie Schwefelhexafluorid oder Tetrafluormethan sowie Spuren an Kohlenstoffdioxid und Distickstoffmonoxid. Methan und Distickstoffmonoxid können über Verbrennung an Platin- oder Palladiumkatalysatoren bei 500 °C zu Kohlenstoffdioxid, Wasser und Stickstoff umgesetzt werden, die durch Adsorption an Molekularsieben entfernt werden können. Fluorverbindungen können dagegen nicht auf diese Weise aus dem Gemisch entfernt werden. Um diese zu zerlegen und aus dem Gemisch zu entfernen, kann das Gas mit Mikrowellen bestrahlt werden, wobei die Element-Fluor-Bindungen aufbrechen und die entstehenden Fluoratome in Natronkalk aufgefangen werden können oder über einen Titandioxid-Zirconiumdioxid-Katalysator bei 750 °C geleitet werden. Dabei reagieren die Fluorverbindungen zu Kohlenstoffdioxid und Fluorwasserstoff und anderen abtrennbaren Verbindungen. ⓘ
Anschließend werden Krypton und Xenon in einer weiteren Kolonne, die unten beheizt und oben gekühlt wird, getrennt. Während das Krypton und Sauerstoffreste am oberen Ende der Kolonne entweichen, sammelt sich Xenon am Boden und kann abgeschöpft werden. Auf Grund der Seltenheit bei gleichzeitig hoher Nachfrage ist Xenon das teuerste Edelgas. Die Gesamtproduktionsmenge 2017 lag bei 12.200 m3, was etwa 71,5 Tonnen entspricht. ⓘ
Die weltweite Produktion von Xenon im Jahr 1998 wurde auf 5.000-7.000 Kubikmeter geschätzt. Bei einer Dichte von 5,894 Gramm pro Liter (0,9452 oz/imp gal) entspricht dies etwa 30 bis 40 Tonnen (30 bis 39 long tons; 33 bis 44 short tons). Aufgrund seiner Knappheit ist Xenon wesentlich teurer als die leichteren Edelgase - die ungefähren Preise für den Kauf kleiner Mengen in Europa betrugen 1999 10 €/L (=~1,7€/g) für Xenon, 1 €/L (=~0,27€/g) für Krypton und 0,20 €/L (=~0,22€/g) für Neon, während das wesentlich reichhaltigere Argon, das mehr als 1 Volumenprozent der Erdatmosphäre ausmacht, weniger als einen Cent pro Liter kostet. ⓘ
Sonnensystem
Im Sonnensystem beträgt der Nukleonenanteil von Xenon 1,56 × 10-8, was einer Häufigkeit von etwa einem Teil in 630 Tausend der Gesamtmasse entspricht. Xenon ist in der Sonnenatmosphäre, auf der Erde und in Asteroiden und Kometen relativ selten. Die Häufigkeit von Xenon in der Atmosphäre des Planeten Jupiter ist ungewöhnlich hoch, etwa 2,6 Mal so hoch wie die der Sonne. Diese Häufigkeit ist nach wie vor ungeklärt, könnte aber durch eine frühe und schnelle Ansammlung von Planetesimalen - kleinen, subplanetaren Körpern - vor der Aufheizung der präsolaren Scheibe verursacht worden sein. (Andernfalls wäre Xenon nicht im Eis der Planetesimale eingeschlossen worden.) Das Problem des geringen irdischen Xenongehalts lässt sich möglicherweise durch die kovalente Bindung von Xenon an Sauerstoff im Quarz erklären, wodurch die Ausgasung von Xenon in die Atmosphäre verringert wird. ⓘ
Stellare
Im Gegensatz zu den massearmen Edelgasen entsteht Xenon nicht bei der normalen stellaren Nukleosynthese im Inneren eines Sterns. Elemente, die massereicher als Eisen-56 sind, verbrauchen Energie durch Kernfusion, und die Synthese von Xenon stellt für einen Stern keinen Energiegewinn dar. Stattdessen entsteht Xenon bei Supernovaexplosionen, bei klassischen Novaexplosionen, durch den langsamen Neutroneneinfangprozess (s-Prozess) in roten Riesensternen, die ihren Kernwasserstoff aufgebraucht haben und in den asymptotischen Riesenast eingetreten sind, und durch radioaktiven Zerfall, beispielsweise durch den Betazerfall von erloschenem Jod-129 und die spontane Spaltung von Thorium, Uran und Plutonium. ⓘ
Kernspaltung
Xenon-135 ist ein bemerkenswertes Neutronengift mit einer hohen Ausbeute an Spaltprodukten. Da es relativ kurzlebig ist, zerfällt es mit der gleichen Geschwindigkeit, mit der es im Dauerbetrieb eines Kernreaktors erzeugt wird. Wenn jedoch die Leistung reduziert oder der Reaktor abgeschaltet wird, wird weniger Xenon zerstört, als durch den Betazerfall seiner Ausgangsnuklide erzeugt wird. Dieses als Xenonvergiftung bezeichnete Phänomen kann erhebliche Probleme beim Wiederanfahren eines Reaktors nach einer Störung oder bei der Erhöhung der Leistung nach einer Leistungsreduzierung verursachen und war einer von mehreren Faktoren, die zum Reaktorunfall in Tschernobyl beitrugen. ⓘ
Stabile oder extrem langlebige Isotope von Xenon werden ebenfalls in nennenswerten Mengen bei der Kernspaltung erzeugt. Xenon-136 entsteht, wenn Xenon-135 einen Neutroneneinfang durchläuft, bevor es zerfallen kann. Das Verhältnis von Xenon-136 zu Xenon-135 (oder seinen Zerfallsprodukten) kann Hinweise auf die Leistungsgeschichte eines bestimmten Reaktors geben, und das Fehlen von Xenon-136 ist ein "Fingerabdruck" für Kernexplosionen, da Xenon-135 nicht direkt, sondern als Produkt aufeinander folgender Betazerfälle erzeugt wird und daher bei einer Kernexplosion, die in Sekundenbruchteilen stattfindet, keine Neutronen absorbieren kann. ⓘ
Das stabile Isotop Xenon-132 hat eine Spaltproduktausbeute von über 4 % bei der thermischen Neutronenspaltung von 235
U, was bedeutet, dass stabile oder nahezu stabile Xenon-Isotope in abgebrannten Kernbrennstoffen einen höheren Massenanteil haben (etwa 3 % Spaltprodukte) als in der Luft. Seit 2022 gibt es jedoch keine kommerziellen Bemühungen zur Gewinnung von Xenon aus abgebrannten Brennelementen bei der nuklearen Wiederaufbereitung. ⓘ
Isotope
Natürlich vorkommendes Xenon besteht aus sieben stabilen Isotopen: 126Xe, 128-132Xe und 134Xe. Für die Isotope 126Xe und 134Xe wird in der Theorie ein doppelter Betazerfall vorhergesagt, der jedoch nie beobachtet wurde, so dass sie als stabil gelten. Darüber hinaus wurden mehr als 40 instabile Isotope untersucht. Die langlebigsten dieser Isotope sind das primordiale 124Xe, das einen doppelten Elektroneneinfang mit einer Halbwertszeit von 1,8 × 1022 Jahren erfährt, und 136Xe, das einen doppelten Betazerfall mit einer Halbwertszeit von 2,11 × 1021 Jahren erfährt. 129Xe entsteht durch den Betazerfall von 129I, das eine Halbwertszeit von 16 Millionen Jahren hat. 131mXe, 133Xe, 133mXe und 135Xe sind einige der Spaltprodukte von 235U und 239Pu und werden zum Nachweis und zur Überwachung von Kernexplosionen verwendet. ⓘ
Kernspin
Die Kerne von zwei der stabilen Isotope von Xenon, 129Xe und 131Xe, haben Eigendrehimpulse ungleich Null (Kernspins, geeignet für die kernmagnetische Resonanz). Die Kernspins können mit Hilfe von zirkular polarisiertem Licht und Rubidiumdampf über das normale Polarisationsniveau hinaus ausgerichtet werden. Die sich daraus ergebende Spinpolarisation von Xenonkernen kann 50 % ihres maximal möglichen Wertes überschreiten und liegt damit weit über dem durch die paramagnetische Statistik vorgegebenen thermischen Gleichgewichtswert (typischerweise 0,001 % des Maximalwertes bei Raumtemperatur, selbst bei den stärksten Magneten). Eine solche Nicht-Gleichgewichtsausrichtung der Spins ist ein vorübergehender Zustand und wird als Hyperpolarisierung bezeichnet. Der Prozess der Hyperpolarisierung des Xenons wird als optisches Pumpen bezeichnet (obwohl sich der Prozess vom Pumpen eines Lasers unterscheidet). ⓘ
Da ein 129Xe-Kern einen Spin von 1/2 und damit ein elektrisches Quadrupolmoment von Null hat, erfährt der 129Xe-Kern bei Zusammenstößen mit anderen Atomen keine quadrupolaren Wechselwirkungen, und die Hyperpolarisation bleibt auch nach dem Entfernen des erzeugenden Lichts und des Dampfes noch lange Zeit bestehen. Die Spinpolarisation von 129Xe kann von einigen Sekunden bei in Blut gelösten Xenonatomen bis zu mehreren Stunden in der Gasphase und mehreren Tagen bei tiefgefrorenem festem Xenon anhalten. Im Gegensatz dazu hat 131Xe einen Kernspin von 3⁄2 und ein Quadrupolmoment ungleich Null, und seine t1-Relaxationszeiten liegen im Millisekunden- und Sekundenbereich. ⓘ
Durch Spaltung
Einige radioaktive Isotope von Xenon (z. B. 133Xe und 135Xe) werden durch Neutronenbestrahlung von spaltbarem Material in Kernreaktoren erzeugt. 135Xe ist von erheblicher Bedeutung für den Betrieb von Kernspaltungsreaktoren. 135Xe hat einen enormen Wirkungsquerschnitt für thermische Neutronen (2,6×106 Scheunen) und wirkt als Neutronenabsorber oder "Gift", das die Kettenreaktion nach einer gewissen Betriebszeit verlangsamen oder stoppen kann. Dies wurde in den ersten Kernreaktoren entdeckt, die im Rahmen des amerikanischen Manhattan-Projekts für die Plutoniumproduktion gebaut wurden. Die Konstrukteure hatten jedoch Vorkehrungen getroffen, um die Reaktivität des Reaktors zu erhöhen (die Anzahl der Neutronen pro Spaltung, die zur Spaltung anderer Atome des Kernbrennstoffs führen). Die Vergiftung des Reaktors mit 135Xe war ein wichtiger Faktor bei der Katastrophe von Tschernobyl. Eine Abschaltung oder Leistungsverringerung eines Reaktors kann zu einer Anhäufung von 135Xe führen, wobei der Reaktorbetrieb in einen Zustand übergeht, der als Jodgrube bekannt ist. Unter ungünstigen Bedingungen können relativ hohe Konzentrationen radioaktiver Xenon-Isotope aus gerissenen Brennstäben oder aus der Spaltung von Uran im Kühlwasser austreten. ⓘ
Das Isotopenverhältnis von Xenon, das in natürlichen Kernspaltungsreaktoren in Oklo in Gabun erzeugt wird, gibt Aufschluss über die Reaktoreigenschaften während einer Kettenreaktion, die vor etwa 2 Milliarden Jahren stattfand. ⓘ
Kosmische Prozesse
Da Xenon ein Tracer für zwei Elternisotope ist, sind Xenon-Isotopenverhältnisse in Meteoriten ein leistungsfähiges Instrument zur Untersuchung der Entstehung des Sonnensystems. Die Jod-Xenon-Methode zur Datierung gibt die Zeit an, die zwischen der Nukleosynthese und der Kondensation eines festen Objekts aus dem Sonnennebel verstrichen ist. Im Jahr 1960 entdeckte der Physiker John H. Reynolds, dass bestimmte Meteoriten eine isotopische Anomalie in Form eines Überschusses an Xenon-129 aufwiesen. Er schloss daraus, dass es sich um ein Zerfallsprodukt von radioaktivem Jod-129 handelt. Dieses Isotop entsteht langsam durch Spallation mit kosmischer Strahlung und Kernspaltung, wird aber nur bei Supernovaexplosionen in großen Mengen produziert. ⓘ
Da die Halbwertszeit von 129I auf einer kosmologischen Zeitskala vergleichsweise kurz ist (16 Millionen Jahre), zeigt dies, dass zwischen der Supernova und dem Zeitpunkt, an dem die Meteoriten erstarrt sind und das 129I eingeschlossen haben, nur eine kurze Zeitspanne vergangen ist. Diese beiden Ereignisse (Supernova und Verfestigung der Gaswolke) müssen in der Frühgeschichte des Sonnensystems stattgefunden haben, da das Isotop 129I wahrscheinlich kurz vor der Entstehung des Sonnensystems erzeugt wurde und die Gaswolke des Sonnensystems mit Isotopen aus einer zweiten Quelle versorgte. Diese Supernova-Quelle könnte auch den Kollaps der solaren Gaswolke verursacht haben. ⓘ
In ähnlicher Weise sind Xenon-Isotopenverhältnisse wie 129Xe/130Xe und 136Xe/130Xe ein leistungsfähiges Instrument zum Verständnis der planetarischen Differenzierung und frühen Ausgasung. Die Marsatmosphäre beispielsweise weist eine ähnliche Xenonhäufigkeit wie die Erde auf (0,08 Teile pro Million), aber der Mars weist eine größere Häufigkeit von 129Xe auf als die Erde oder die Sonne. Da dieses Isotop durch radioaktiven Zerfall erzeugt wird, könnte das Ergebnis darauf hindeuten, dass der Mars den größten Teil seiner ursprünglichen Atmosphäre verloren hat, möglicherweise innerhalb der ersten 100 Millionen Jahre nach der Entstehung des Planeten. In einem anderen Beispiel wurde ein Überschuss an 129Xe in Kohlendioxid-Quellgasen aus New Mexico gefunden, das vermutlich durch den Zerfall von Gasen aus dem Erdmantel kurz nach der Entstehung der Erde entstanden ist. ⓘ
Verbindungen
Nach der Entdeckung von Neil Bartlett im Jahr 1962, dass Xenon chemische Verbindungen bilden kann, wurde eine Vielzahl von Xenonverbindungen entdeckt und beschrieben. Fast alle bekannten Xenonverbindungen enthalten die elektronegativen Atome Fluor oder Sauerstoff. Die Chemie von Xenon ist in jeder Oxidationsstufe analog zu der des benachbarten Elements Jod in der unmittelbar niedrigeren Oxidationsstufe. ⓘ

Halogenide
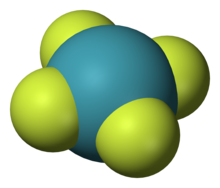

Es sind drei Fluoride bekannt: XeF
2, XeF
4 und XeF
6. XeF ist theoretisch instabil. Dies sind die Ausgangspunkte für die Synthese fast aller Xenonverbindungen. ⓘ
Das feste, kristalline Difluorid XeF
2 bildet sich, wenn ein Gemisch aus Fluor- und Xenongas ultraviolettem Licht ausgesetzt wird. Der ultraviolette Anteil des normalen Tageslichts ist ausreichend. Langfristiges Erhitzen von XeF
2 bei hohen Temperaturen unter einem NiF
2-Katalysator entsteht XeF
6. Die Pyrolyse von XeF
6 in Gegenwart von NaF erhält man hochreines XeF
4. ⓘ
Die Xenonfluoride verhalten sich sowohl als Fluoridakzeptoren als auch als Fluoriddonatoren und bilden Salze, die Kationen wie XeF+
und Xe
2F+
3, und Anionen wie XeF-
5, XeF-
7 und XeF2-
8. Das grüne, paramagnetische Xe+
2 entsteht bei der Reduktion von XeF
2 durch Xenon-Gas. ⓘ
XeF
2 bildet auch Koordinationskomplexe mit Übergangsmetall-Ionen. Mehr als 30 solcher Komplexe sind synthetisiert und charakterisiert worden. ⓘ
Während die Xenonfluoride, mit Ausnahme der Dichloride XeCl2 und XeCl4, gut charakterisiert sind, sind die anderen Halogenide nicht bekannt. Xenondichlorid, das durch Hochfrequenzbestrahlung eines Gemischs aus Xenon, Fluor und Silizium oder Tetrachlorkohlenstoff gebildet wird, ist Berichten zufolge eine endotherme, farblose, kristalline Verbindung, die sich bei 80 °C in die Elemente zersetzt. Allerdings könnte XeCl
2 ist jedoch möglicherweise nur ein Van-der-Waals-Molekül aus schwach gebundenen Xe-Atomen und Cl
2-Molekülen und nicht um eine echte Verbindung handeln. Theoretische Berechnungen zeigen, dass das lineare Molekül XeCl
2 weniger stabil ist als der van-der-Waals-Komplex. Xenon-Tetrachlorid ist so instabil, dass es nicht durch chemische Reaktionen synthetisiert werden kann. Es wurde durch radioaktive 129
ICl-
4-Zerfall. ⓘ
Oxide und Oxohalogenide
Es sind drei Oxide von Xenon bekannt: Xenontrioxid (XeO
3) und Xenon-Tetroxid (XeO
4), die beide gefährlich explosiv und starke Oxidationsmittel sind, und Xenon-Dioxid (XeO2), das 2011 mit einer Koordinationszahl von vier gemeldet wurde. XeO2 bildet sich, wenn Xenontetrafluorid über Eis gegossen wird. Aufgrund seiner Kristallstruktur kann es Silizium in Silikatmineralien ersetzen. Das XeOO+-Kation wurde durch Infrarotspektroskopie in festem Argon nachgewiesen. ⓘ
Xenon reagiert nicht direkt mit Sauerstoff; das Trioxyd entsteht durch die Hydrolyse von XeF
6:
- XeF
6 + 3 H
2O → XeO
3 + 6 HF ⓘ
XeO
3 ist schwach sauer und löst sich in Alkali unter Bildung instabiler Xenatsalze, die das HXeO-
4 Anion enthalten. Diese instabilen Salze disproportionieren leicht zu Xenongas und Perxenatsalzen, die das Anion XeO4-
6 Anion enthalten. ⓘ
Bei der Behandlung von Bariumperxenat mit konzentrierter Schwefelsäure entsteht gasförmiges Xenon-Tetroxid:
- Ba
2XeO
6 + 2 H
2SO
4 → 2 BaSO
4 + 2 H
2O + XeO
4 ⓘ
Um eine Zersetzung zu verhindern, wird das so gebildete Xenontetroxid schnell zu einem blassgelben Feststoff abgekühlt. Es explodiert oberhalb von -35,9 °C in Xenon- und Sauerstoffgas, ist aber ansonsten stabil. ⓘ
Es ist eine Reihe von Xenon-Oxyfluoriden bekannt, darunter XeOF
2, XeOF
4, XeO
2F
2 und XeO
3F
2. XeOF
2 wird gebildet durch Reaktion von OF
2 mit Xenongas bei niedrigen Temperaturen. Es kann auch durch partielle Hydrolyse von XeF
4. Es disproportioniert bei -20 °C in XeF
2 und XeO
2F
2. XeOF
4 entsteht durch die partielle Hydrolyse von XeF
6, oder durch Reaktion von XeF
6 mit Natriumperxenat, Na
4XeO
6. Bei der letztgenannten Reaktion entsteht auch eine kleine Menge XeO
3F
2. XeOF
4 reagiert mit CsF unter Bildung des Anions XeOF-
5-Anion, während XeOF3 mit den Alkalimetallfluoriden KF, RbF und CsF unter Bildung des XeOF-
4-Anion reagiert. ⓘ
Andere Verbindungen
Xenon kann direkt an ein weniger elektronegatives Element als Fluor oder Sauerstoff gebunden sein, insbesondere an Kohlenstoff. Zur Stabilisierung dieser Verbindungen sind elektronenziehende Gruppen, wie z. B. Gruppen mit Fluorsubstitution, erforderlich. Zahlreiche derartige Verbindungen sind charakterisiert worden, darunter:
- C
6F
5-Xe+
-N≡C-CH
3, wobei C6F5 die Pentafluorphenylgruppe ist. - [C
6F
5]
2Xe - C
6F
5-Xe-C≡N - C
6F
5-Xe-F - C
6F
5-Xe-Cl - C
2F
5-C≡C-Xe+ - [CH
3]
3C-C≡C-Xe+ - C
6F
5-XeF+
2 - (C
6F
5Xe)
2Cl+ ⓘ
Andere Verbindungen, die Xenon in Bindung an ein weniger elektronegatives Element enthalten, sind F-Xe-N(SO
2F)
2 und F-Xe-BF
2. Letzteres wird aus Dioxygenyltetrafluoroborat, O
2BF
4, bei -100 °C synthetisiert. ⓘ
Ein ungewöhnliches xenonhaltiges Ion ist das Tetraxenonogold(II)-Kation, AuXe2+
4, das Xe-Au-Bindungen enthält. Dieses Ion kommt in der Verbindung AuXe
4(Sb
2F
11)
2 vor und zeichnet sich dadurch aus, dass es direkte chemische Bindungen zwischen zwei notorisch unreaktiven Atomen, Xenon und Gold, aufweist, wobei Xenon als Übergangsmetall-Ligand fungiert. ⓘ
Die Verbindung Xe
2Sb
2F
11 enthält eine Xe-Xe-Bindung, die längste bekannte Element-Element-Bindung (308,71 pm = 3,0871 Å). ⓘ
1995 gaben M. Räsänen und seine Mitarbeiter, Wissenschaftler an der Universität Helsinki in Finnland, die Herstellung von Xenon-Dihydrid (HXeH) und später von Xenon-Hydrid-Hydroxid (HXeOH), Hydroxenoacetylen (HXeCCH) und anderen Xe-haltigen Molekülen bekannt. Im Jahr 2008 berichteten Khriachtchev et al. über die Herstellung von HXeOXeH durch Photolyse von Wasser in einer kryogenen Xenon-Matrix. Auch deuterierte Moleküle, HXeOD und DXeOH, wurden bereits hergestellt. ⓘ
Clathrate und Exzimere
Neben Verbindungen, in denen Xenon eine chemische Bindung eingeht, kann Xenon auch Clathrate bilden - Stoffe, bei denen Xenonatome oder -paare im Kristallgitter einer anderen Verbindung eingeschlossen sind. Ein Beispiel ist Xenonhydrat (Xe-5+3⁄4H2O), bei dem Xenonatome Leerstellen in einem Gitter aus Wassermolekülen besetzen. Dieses Clathrat hat einen Schmelzpunkt von 24 °C. Die deuterierte Version dieses Hydrats ist ebenfalls hergestellt worden. Ein weiteres Beispiel ist Xenonhydrid (Xe(H2)8), bei dem Xenonpaare (Dimere) in festem Wasserstoff eingeschlossen sind. Solche Clathrathydrate können unter hohem Druck natürlich vorkommen, wie zum Beispiel im Wostoksee unter dem antarktischen Eisschild. Die Clathratbildung kann zur fraktionierten Destillation von Xenon, Argon und Krypton genutzt werden. ⓘ
Xenon kann auch endohedrale Fulleren-Verbindungen bilden, bei denen ein Xenon-Atom im Inneren eines Fulleren-Moleküls eingeschlossen ist. Das im Fulleren eingeschlossene Xenonatom kann durch 129Xe-Kernspinresonanzspektroskopie (NMR) beobachtet werden. Durch die empfindliche chemische Verschiebung des Xenon-Atoms gegenüber seiner Umgebung können chemische Reaktionen am Fulleren-Molekül analysiert werden. Diese Beobachtungen sind jedoch nicht unbedenklich, da das Xenonatom einen elektronischen Einfluss auf die Reaktivität des Fullerens hat. ⓘ
Wenn sich Xenonatome im energetischen Grundzustand befinden, stoßen sie sich gegenseitig ab und gehen keine Bindung ein. Wenn Xenonatome jedoch angeregt werden, können sie ein Excimer (angeregtes Dimer) bilden, bis die Elektronen in den Grundzustand zurückkehren. Dieses Gebilde entsteht, weil das Xenonatom dazu neigt, die äußerste Elektronenschale zu vervollständigen, indem es ein Elektron von einem benachbarten Xenonatom hinzufügt. Die typische Lebensdauer eines Xenon-Excimers beträgt 1-5 Nanosekunden, und beim Zerfall werden Photonen mit Wellenlängen von etwa 150 und 173 nm freigesetzt. Xenon kann auch mit anderen Elementen wie den Halogenen Brom, Chlor und Fluor Excimere bilden. ⓘ
Fluorverbindungen
Drei Verbindungen des Xenons mit Fluor sind bekannt: Xenon(II)-fluorid, Xenon(IV)-fluorid und Xenon(VI)-fluorid. Die stabilste hiervon und gleichzeitig die stabilste Xenonverbindung überhaupt, ist das linear aufgebaute Xenon(II)-fluorid. Es wird als einzige Xenonverbindung in geringen Mengen auch technisch genutzt. In Laborsynthesen dient es als starkes Oxidations- und Fluorierungsmittel, etwa zur direkten Fluorierung aromatischer Verbindungen. ⓘ
Während Xenon(II)-fluorid sich ohne Zersetzung in Wasser und Säuren löst und nur langsam hydrolysiert, hydrolysieren das quadratisch-planar aufgebaute Xenon(IV)-fluorid und das oktaedrische Xenon(VI)-fluorid schnell. Sie sind sehr reaktiv, so reagiert Xenon(VI)-fluorid mit Siliciumdioxid und kann daher nicht in Glasgefäßen aufbewahrt werden. ⓘ
Sauerstoffverbindungen und Oxidfluoride
Mit Sauerstoff erreicht Xenon die höchstmögliche Oxidationsstufe +8 im Xenon(VIII)-oxid und dem Oxifluorid Xenondifluoridtrioxid XeO3F2 sowie in Perxenaten der Form XeO64−. Weiterhin sind Xenon(VI)-oxid und die Oxifluoride XeO2F2 und XeOF4 in der Oxidationsstufe +6 sowie Xenon(IV)-oxid und das Oxifluorid XeOF2 mit vierwertigem Xenon bekannt. Alle Xenonoxide und -oxifluoride sind instabil und viele explosiv. ⓘ
Weitere Xenonverbindungen
Als weitere Xenon-Halogenverbindung ist Xenon(II)-chlorid bekannt; sie ist aber sehr instabil und nur bei tiefen Temperaturen spektroskopisch nachweisbar. Ähnlich konnten auch gemischte Wasserstoff-Halogen-Xenon-Verbindungen und die Wasserstoff-Sauerstoff-Xenonverbindung HXeOXeH durch Photolyse in der Edelgasmatrix hergestellt und spektroskopisch nachgewiesen werden. ⓘ
Organische Xenonverbindungen sind mit verschiedenen Liganden bekannt, etwa mit fluorierten Aromaten oder Alkinen. Ein Beispiel für eine Stickstoff-Fluor-Verbindung ist FXeN(SO2F)2. ⓘ
Xenon ist unter supersauren Bedingungen in der Lage, mit Metallen wie Gold oder Quecksilber Komplexe zu bilden. Das Gold kommt dabei vorwiegend in der Oxidationsstufe +2 vor, auch Gold(I)- und Gold(III)-Komplexe sind bekannt. ⓘ
Einen Überblick über Xenonverbindungen gibt die :Kategorie:Xenonverbindung. ⓘ
Anwendungen
Xenon wirkt narkotisierend und kann als Inhalationsanästhetikum verwendet werden. Es ist seit 2005 für den Einsatz bei ASA 1 und 2-Patienten in Deutschland, seit 2007 in elf weiteren Ländern zugelassen. Aufgrund der hohen Kosten (200–300 € anstelle 80–100 € bei einer zweistündigen Operation) konnte es sich bis zum Jahr 2015 noch nicht im täglichen Narkosebetrieb durchsetzen. ⓘ
Um mit dem 15 €/Liter teuren Xenon sparsam umzugehen, wird es mit dem Ausatemgas wie bei einem Kreislauftauchgerät im Kreis geführt, indem das abgeatmete CO2 chemisch entfernt und Sauerstoff hinzugefügt wird. ⓘ
Aufgrund seines sehr niedrigen Blut-Gas-Verteilungskoeffizienten flutet es sehr schnell an und ab. Beim Abfluten kann wie beim Distickstoffmonoxid eine Diffusionshypoxie entstehen, es muss also mit reinem Sauerstoff ausgewaschen werden. Gegenüber dem häufig verwendeten Distickstoffmonoxid besitzt es einige Vorteile, so ist es ungefährlich im Umgang und kein Treibhausgas. Auch die Hämodynamik ist bei Xenon stabiler als bei anderen volatilen Anästhetika, d. h., es kommt nicht zum Blutdruckabfall, die Herzfrequenz steigt eher etwas an. Nachteilig ist, dass mit Xenon, weil es eine relativ hohe Konzentration in den Lungenbläschen braucht, um narkotisch zu wirken (MAC-Wert im Bereich von 60 bis 70 %), nur noch höchstens 30 oder 40 % Sauerstoff im Atemgasgemisch gegeben werden kann. Der größte Nachteil des Xenons ist sein hoher Preis. ⓘ
Obwohl Xenon selten und relativ teuer in der Gewinnung aus der Erdatmosphäre ist, hat es eine Reihe von Anwendungen. ⓘ
Beleuchtung und Optik
Gasentladungslampen
Xenon wird in lichtemittierenden Vorrichtungen, den so genannten Xenon-Blitzlampen, für fotografische Blitzlichter und Stroboskoplampen, zur Anregung des aktiven Mediums in Lasern, die dann kohärentes Licht erzeugen, und gelegentlich in bakterientötenden Lampen verwendet. Der erste Festkörperlaser, der 1960 erfunden wurde, wurde von einer Xenon-Blitzlampe gepumpt, und Laser, die für die Trägheitsfusion verwendet werden, werden ebenfalls von Xenon-Blitzlampen gepumpt. ⓘ



Xenon-Kurzbogenlampen mit kontinuierlichem Hochdruck haben eine Farbtemperatur, die der des Mittagssonnenlichts sehr nahe kommt, und werden in Sonnensimulatoren verwendet. Das heißt, die Farbtemperatur dieser Lampen kommt einem beheizten Schwarzkörperstrahler mit der Temperatur der Sonne sehr nahe. Diese Lampen wurden erstmals in den 1940er Jahren eingeführt und ersetzten die kurzlebigeren Kohlebogenlampen in Filmprojektoren. Sie werden auch in typischen 35-mm-, IMAX- und digitalen Filmprojektionssystemen eingesetzt. Sie sind eine ausgezeichnete Quelle für kurzwellige ultraviolette Strahlung und haben intensive Emissionen im nahen Infrarotbereich, die in einigen Nachtsichtsystemen verwendet werden. Xenon wird als Startergas in Metallhalogenidlampen für HID-Scheinwerfer in Kraftfahrzeugen und in hochwertigen "taktischen" Taschenlampen verwendet. ⓘ
Die einzelnen Zellen eines Plasmabildschirms enthalten ein Gemisch aus Xenon und Neon, das durch Elektroden ionisiert wird. Durch die Wechselwirkung dieses Plasmas mit den Elektroden werden ultraviolette Photonen erzeugt, die dann die Phosphorbeschichtung auf der Vorderseite des Displays anregen. ⓘ
Xenon wird als "Startergas" in Natriumhochdrucklampen verwendet. Es hat die niedrigste Wärmeleitfähigkeit und das niedrigste Ionisierungspotenzial aller nicht radioaktiven Edelgase. Als Edelgas stört es nicht die chemischen Reaktionen, die im Betrieb der Lampe ablaufen. Die niedrige Wärmeleitfähigkeit minimiert die Wärmeverluste in der Lampe im Betriebszustand, und das niedrige Ionisierungspotenzial bewirkt, dass die Durchbruchspannung des Gases im kalten Zustand relativ niedrig ist, wodurch die Lampe leichter gestartet werden kann. ⓘ
Laser
1962 entdeckte eine Gruppe von Forschern in den Bell Laboratories die Laserwirkung von Xenon und stellte später fest, dass die Laserverstärkung durch Hinzufügen von Helium zum Lasermedium verbessert wurde. Der erste Excimer-Laser verwendete ein Xenon-Dimer (Xe2), das durch einen Elektronenstrahl angeregt wurde, um eine stimulierte Emission bei einer ultravioletten Wellenlänge von 176 nm zu erzeugen. Xenonchlorid und Xenonfluorid wurden ebenfalls in Excimer-Lasern (oder genauer gesagt Exciplex-Lasern) verwendet. ⓘ
Medizinische
Anästhesie
Xenon wurde als allgemeines Anästhetikum verwendet, ist aber teurer als herkömmliche Anästhetika. ⓘ
Xenon interagiert mit vielen verschiedenen Rezeptoren und Ionenkanälen, und wie bei vielen theoretisch multimodalen Inhalationsanästhetika sind diese Interaktionen wahrscheinlich komplementär. Xenon ist ein NMDA-Rezeptor-Antagonist mit hoher Affinität zu Glycin. Xenon unterscheidet sich jedoch von bestimmten anderen NMDA-Rezeptor-Antagonisten dadurch, dass es nicht neurotoxisch ist und die Neurotoxizität von Ketamin und Distickstoffoxid (N2O) hemmt, während es gleichzeitig neuroprotektive Wirkungen entfaltet. Anders als Ketamin und Distickstoffoxid stimuliert Xenon keinen Dopamin-Efflux im Nucleus accumbens. ⓘ
Wie Distickstoffoxid und Cyclopropan aktiviert Xenon den Zwei-Poren-Kaliumkanal TREK-1. Ein verwandter Kanal TASK-3, der ebenfalls an den Wirkungen von Inhalationsanästhetika beteiligt ist, ist unempfindlich gegenüber Xenon. Xenon hemmt nikotinische Acetylcholin-α4β2-Rezeptoren, die zur spinal vermittelten Analgesie beitragen. Xenon ist ein wirksamer Inhibitor der Ca2+ ATPase der Plasmamembran. Xenon hemmt die Ca2+-ATPase, indem es sich an eine hydrophobe Pore innerhalb des Enzyms bindet und das Enzym daran hindert, aktive Konformationen einzunehmen. ⓘ
Xenon ist ein kompetitiver Inhibitor des Serotonin-5-HT3-Rezeptors. Obwohl es weder ein Anästhetikum noch ein Antinozizeptivum ist, reduziert es die Übelkeit und das Erbrechen, die durch die Anästhesie ausgelöst werden. ⓘ
Xenon hat eine minimale alveoläre Konzentration (MAC) von 72 % im Alter von 40 Jahren und ist damit als Anästhetikum 44 % wirksamer als N2O. Daher kann es zusammen mit Sauerstoff in Konzentrationen verwendet werden, die ein geringeres Hypoxie-Risiko bergen. Anders als Distickstoffoxid ist Xenon kein Treibhausgas und gilt als umweltfreundlich. Obwohl es in modernen Systemen recycelt wird, kehrt Xenon, wenn es in die Atmosphäre entlassen wird, nur zu seiner ursprünglichen Quelle zurück, ohne die Umwelt zu belasten. ⓘ
Neuroprotektive Wirkung
Xenon bewirkt durch eine Reihe von Mechanismen eine robuste Kardioprotektion und Neuroprotektion. Durch seinen Einfluss auf Ca2+, K+, KATP\HIF und NMDA-Antagonismus ist Xenon neuroprotektiv, wenn es vor, während und nach ischämischen Insulten verabreicht wird. Xenon ist ein hochaffiner Antagonist an der Glycinstelle des NMDA-Rezeptors. Xenon wirkt unter Ischämie-Reperfusionsbedingungen kardioprotektiv, indem es eine pharmakologische nicht-ischämische Vorkonditionierung auslöst. Xenon wirkt kardioprotektiv durch Aktivierung von PKC-Epsilon und der nachgeschalteten p38-MAPK. Xenon imitiert die neuronale ischämische Präkonditionierung durch Aktivierung ATP-sensitiver Kaliumkanäle. Xenon reduziert allosterisch die ATP-vermittelte Kanalaktivierungshemmung unabhängig von der Sulfonylharnstoff-Rezeptor1-Untereinheit und erhöht die KATP-Kanalöffnungszeit und -frequenz. ⓘ
Sportliches Doping
Im Umfeld der Olympischen Winterspiele 2014 in Sotschi erregte eine Recherche des WDR über den Missbrauch von Xenon als Dopingmittel die öffentliche Aufmerksamkeit. Demnach sollen russische Athleten seit den Sommerspielen 2004 in Athen versuchen, ihre Leistungsfähigkeit zu steigern, indem sie während des Trainings die Hälfte des Luftsauerstoffs durch Xenongas ersetzen. Eine entsprechende Studie der Forschungs- und Entwicklungseinrichtung namens Atom-Med-Zentrum sei vom russischen Staat in Auftrag gegeben worden. Laut dieser Institution regt Xenongas im Körper die Produktion von EPO an. In Tierversuchen sei die EPO-Produktion innerhalb eines Tages auf 160 Prozent angestiegen. Ähnliche Effekte vermutet man beim Menschen. Im Mai 2014 setzte die WADA deshalb Xenon, ebenso wie Argon, auf die Dopingliste. Diese Dopingmethode hinterlässt allerdings keine derzeit im Blut nachweisbare Spuren. ⓘ
Die Inhalation eines Xenon-Sauerstoff-Gemischs aktiviert die Produktion des Transkriptionsfaktors HIF-1-alpha, was zu einer erhöhten Produktion von Erythropoietin führen kann. Das letztgenannte Hormon ist dafür bekannt, dass es die Produktion roter Blutkörperchen und die sportliche Leistung steigert. Berichten zufolge wird in Russland seit 2004 und möglicherweise schon früher mit Xenon-Inhalation gedopt. Am 31. August 2014 nahm die Welt-Anti-Doping-Agentur (WADA) Xenon (und Argon) in die Liste der verbotenen Substanzen und Methoden auf, obwohl noch keine zuverlässigen Dopingtests für diese Gase entwickelt worden sind. Darüber hinaus sind die Auswirkungen von Xenon auf die Erythropoetinproduktion beim Menschen bisher nicht nachgewiesen worden. ⓘ
Bildgebung
Die Gammastrahlung des Xenon-Radioisotops 133Xe kann zur Darstellung von Herz, Lunge und Gehirn verwendet werden, z. B. mit Hilfe der Einzelphotonen-Emissions-Computertomographie. 133Xe wurde auch zur Messung des Blutflusses verwendet. ⓘ
Xenon, insbesondere hyperpolarisiertes 129Xe, ist ein nützliches Kontrastmittel für die Magnetresonanztomographie (MRT). In der Gasphase kann es Hohlräume in einer porösen Probe, Alveolen in der Lunge oder den Gasfluss in der Lunge darstellen. Da Xenon sowohl in Wasser als auch in hydrophoben Lösungsmitteln löslich ist, kann es verschiedene weiche lebende Gewebe abbilden. ⓘ
Xenon-129 wird derzeit als Visualisierungsmittel bei MRT-Scans eingesetzt. Wenn ein Patient hyperpolarisiertes Xenon-129 einatmet, können Belüftung und Gasaustausch in der Lunge abgebildet und quantifiziert werden. Im Gegensatz zu Xenon-133 ist Xenon-129 nicht ionisierend und kann gefahrlos eingeatmet werden, ohne dass es zu nachteiligen Auswirkungen kommt. ⓘ
Chirurgie
Der Xenonchlorid-Excimer-Laser wird in der Dermatologie eingesetzt. ⓘ
NMR-Spektroskopie
Aufgrund der großen, flexiblen äußeren Elektronenhülle des Xenon-Atoms verändert sich das NMR-Spektrum in Abhängigkeit von den Umgebungsbedingungen und kann zur Überwachung der chemischen Umgebungsbedingungen verwendet werden. So lassen sich beispielsweise in Wasser gelöstes Xenon, in hydrophoben Lösungsmitteln gelöstes Xenon und mit bestimmten Proteinen assoziiertes Xenon durch NMR unterscheiden. ⓘ
Hyperpolarisiertes Xenon kann von Oberflächenchemikern verwendet werden. Normalerweise ist es schwierig, Oberflächen mit NMR zu charakterisieren, da die Signale von der Oberfläche von den Signalen der Atomkerne in der Masse der Probe überlagert werden, die viel zahlreicher sind als die Oberflächenkerne. Die Kernspins auf Festkörperoberflächen können jedoch selektiv polarisiert werden, indem die Spinpolarisation von hyperpolarisiertem Xenongas auf sie übertragen wird. Dadurch werden die Oberflächensignale stark genug, um sie zu messen und von den Massensignalen zu unterscheiden. ⓘ
Andere
In der Kernenergieforschung wird Xenon in Blasenkammern, Sonden und in anderen Bereichen verwendet, in denen ein hohes Molekulargewicht und eine inerte Chemie wünschenswert sind. Ein Nebenprodukt von Kernwaffentests ist die Freisetzung von radioaktivem Xenon-133 und Xenon-135. Diese Isotope werden überwacht, um die Einhaltung der Verträge über das Verbot von Kernwaffentests zu gewährleisten und um Atomtests von Staaten wie Nordkorea zu bestätigen. ⓘ

Flüssiges Xenon wird in Kalorimetern zur Messung von Gammastrahlen und als Detektor für hypothetische schwach wechselwirkende massive Teilchen (WIMPs) verwendet. Wenn ein WIMP mit einem Xenon-Kern kollidiert, wird es theoretisch genug Energie abgeben, um Ionisierung und Szintillation zu verursachen. Flüssiges Xenon ist für diese Experimente nützlich, da seine Dichte eine Wechselwirkung mit dunkler Materie wahrscheinlicher macht und es durch Selbstabschirmung einen leisen Detektor ermöglicht. ⓘ
Xenon ist das bevorzugte Treibmittel für den Ionenantrieb von Raumfahrzeugen, da es ein geringes Ionisierungspotenzial pro Atomgewicht aufweist und als Flüssigkeit bei nahezu Raumtemperatur (unter hohem Druck) gelagert werden kann, aber dennoch leicht verdampft, um das Triebwerk zu speisen. Xenon ist inert, umweltfreundlich und weniger korrosiv für ein Ionentriebwerk als andere Brennstoffe wie Quecksilber oder Cäsium. Xenon wurde erstmals in den 1970er Jahren für Satelliten-Ionentriebwerke verwendet. Später wurde es als Treibstoff für die JPL-Sonde Deep Space 1, die europäische Raumsonde SMART-1 und für die drei Ionentriebwerke der NASA-Raumsonde Dawn verwendet. ⓘ
Chemisch gesehen werden die Perxenatverbindungen als Oxidationsmittel in der analytischen Chemie verwendet. Xenondifluorid wird als Ätzmittel für Silizium verwendet, insbesondere bei der Herstellung von mikroelektromechanischen Systemen (MEMS). Das Krebsmedikament 5-Fluorouracil kann durch Reaktion von Xenondifluorid mit Uracil hergestellt werden. Xenon wird auch in der Proteinkristallografie verwendet. Wird Xenon bei einem Druck von 0,5 bis 5 MPa (5 bis 50 atm) auf einen Proteinkristall aufgebracht, binden sich die Xenonatome in überwiegend hydrophoben Hohlräumen, wodurch häufig ein hochwertiges, isomorphes Derivat mit schweren Atomen entsteht, das zur Lösung des Phasenproblems verwendet werden kann. ⓘ
Vorsichtsmaßnahmen
| Gefahren | |
|---|---|
| NFPA 704 (Feuerdiamant) | |
Xenon-Gas kann in normalen versiegelten Glas- oder Metallbehältern bei Standardtemperatur und -druck sicher aufbewahrt werden. Es löst sich jedoch leicht in den meisten Kunststoffen und Gummi und entweicht allmählich aus einem mit solchen Materialien verschlossenen Behälter. Xenon ist ungiftig, löst sich jedoch im Blut und gehört zu einer ausgewählten Gruppe von Stoffen, die die Blut-Hirn-Schranke durchdringen und eine leichte bis vollständige chirurgische Anästhesie verursachen, wenn sie in hohen Konzentrationen mit Sauerstoff eingeatmet werden. ⓘ
Die Schallgeschwindigkeit von Xenongas (169 m/s) ist geringer als die von Luft, da die mittlere Geschwindigkeit der schweren Xenonatome geringer ist als die der Stickstoff- und Sauerstoffmoleküle in der Luft. Daher schwingt Xenon in den Stimmbändern langsamer, wenn es ausgeatmet wird, und erzeugt tiefere Töne (mit niedrigeren Frequenzen angereicherte Töne, aber die Grundfrequenz oder Tonhöhe ändert sich nicht), ein Effekt, der im Gegensatz zu den hohen Tönen steht, die in Helium erzeugt werden. Wenn der Vokaltrakt mit Xenongas gefüllt ist, wird seine natürliche Resonanzfrequenz niedriger als bei Luft. Dadurch werden die tiefen Frequenzen der Schallwelle, die durch dieselbe direkte Vibration der Stimmbänder erzeugt werden, verstärkt, was zu einer Veränderung der Klangfarbe des vom Vokaltrakt verstärkten Tons führt. Wie Helium deckt Xenon nicht den Sauerstoffbedarf des Körpers und ist sowohl ein einfaches Erstickungsmittel als auch ein stärkeres Narkosemittel als Distickstoffoxid; daher und weil Xenon teuer ist, haben viele Universitäten den Stimmprotest als allgemeine Chemievorführung verboten. Das Gas Schwefelhexafluorid hat ein ähnliches Molekulargewicht wie Xenon (146 gegenüber 131), ist preiswerter und, obwohl es ein Erstickungsmittel ist, nicht giftig oder betäubend; es wird bei diesen Demonstrationen oft ersetzt. ⓘ
Dichte Gase wie Xenon und Schwefelhexafluorid können sicher eingeatmet werden, wenn sie mit mindestens 20 % Sauerstoff gemischt werden. Xenon in einer Konzentration von 80 % in Verbindung mit 20 % Sauerstoff führt schnell zur Bewusstlosigkeit einer Vollnarkose (und wurde, wie oben beschrieben, zu diesem Zweck verwendet). Beim Atmen werden Gase unterschiedlicher Dichte sehr effektiv und schnell gemischt, so dass die schwereren Gase zusammen mit dem Sauerstoff ausgeatmet werden und sich nicht am Boden der Lunge ansammeln. Allerdings birgt jedes schwere Gas in großen Mengen eine Gefahr in sich: Es kann sich unsichtbar in einem Behälter befinden, und eine Person, die einen mit einem geruchlosen, farblosen Gas gefüllten Raum betritt, kann ohne Vorwarnung erstickt werden. Xenon wird nur selten in so großen Mengen verwendet, dass dies ein Problem darstellt, obwohl die Gefahr immer dann besteht, wenn ein Tank oder Behälter mit Xenon in einem unbelüfteten Raum aufbewahrt wird. ⓘ
Wasserlösliche Xenonverbindungen wie Mononatriumxenat sind mäßig giftig, haben aber eine sehr kurze Halbwertszeit im Körper - intravenös injiziertes Xenat wird in etwa einer Minute zu elementarem Xenon abgebaut. ⓘ
Biologische Bedeutung
Wie die anderen Edelgase geht Xenon auf Grund der Reaktionsträgheit keine kovalenten Bindungen mit Biomolekülen ein und wird auch nicht verstoffwechselt. Über induzierte Dipole können Atome des Gases jedoch mit biologischen Systemen wechselwirken. So wirkt es beispielsweise durch einen noch nicht vollständig geklärten Mechanismus unter Beteiligung von Glutamat-Rezeptoren narkotisierend. ⓘ
Neuere Forschungen legen nahe, dass unter dem Einfluss von Xenon auch neuroprotektive und analgetische Wirkungen beobachtet werden können. ⓘ




