Dampfdruck


Der Dampfdruck (oder Dampfdruck in englischsprachigen Ländern mit Ausnahme der USA; siehe Unterschiede in der Schreibweise) oder Gleichgewichtsdampfdruck ist definiert als der Druck, der von einem Dampf im thermodynamischen Gleichgewicht mit seinen kondensierten Phasen (fest oder flüssig) bei einer bestimmten Temperatur in einem geschlossenen System ausgeübt wird. Der Gleichgewichtsdampfdruck ist ein Indikator für die Verdampfungsrate einer Flüssigkeit. Er bezieht sich auf die Tendenz der Teilchen, aus der Flüssigkeit (oder einem Feststoff) zu entweichen. Ein Stoff, der bei normalen Temperaturen einen hohen Dampfdruck aufweist, wird oft als flüchtig bezeichnet. Der Druck, den der Dampf über der Oberfläche einer Flüssigkeit ausübt, wird als Dampfdruck bezeichnet. Wenn die Temperatur einer Flüssigkeit steigt, nimmt auch die kinetische Energie ihrer Moleküle zu. Da die kinetische Energie der Moleküle zunimmt, steigt auch die Anzahl der Moleküle, die in Dampf übergehen, wodurch der Dampfdruck zunimmt. ⓘ
Der Dampfdruck einer Substanz steigt gemäß der Clausius-Clapeyron-Beziehung nichtlinear mit der Temperatur. Der Siedepunkt einer Flüssigkeit bei Atmosphärendruck (auch als normaler Siedepunkt bezeichnet) ist die Temperatur, bei der der Dampfdruck gleich dem atmosphärischen Druck ist. Bei jeder schrittweisen Erhöhung dieser Temperatur reicht der Dampfdruck aus, um den atmosphärischen Druck zu überwinden und die Flüssigkeit anzuheben, so dass sich in der Masse der Substanz Dampfblasen bilden. Für die Blasenbildung in größerer Tiefe ist aufgrund des höheren Flüssigkeitsdrucks eine höhere Temperatur erforderlich, da der Flüssigkeitsdruck mit zunehmender Tiefe über dem atmosphärischen Druck liegt. In geringer Tiefe ist die höhere Temperatur, die für den Beginn der Blasenbildung erforderlich ist, wichtiger. Die Oberflächenspannung der Blasenwand führt zu einem Überdruck in den sehr kleinen, ersten Blasen. ⓘ
Der Dampfdruck, den eine einzelne Komponente in einem Gemisch zum Gesamtdruck im System beiträgt, wird als Partialdruck bezeichnet. Beispielsweise weist Luft auf Meereshöhe, die bei 20 °C mit Wasserdampf gesättigt ist, Partialdrücke von etwa 2,3 kPa Wasser, 78 kPa Stickstoff, 21 kPa Sauerstoff und 0,9 kPa Argon auf, insgesamt also 102,2 kPa, was die Grundlage für den atmosphärischen Standarddruck bildet. ⓘ

A: Methan siedet bei 1 bar bei −160 °C.
B: Bei −100 °C entwickelt Methan einen Dampfdruck von 25 bar.
C: Bei −170 °C (etwa bei Kühlung durch Flüssigstickstoff) wird Methan bei 1 bar vollständig verflüssigt. ⓘ

Messung und Einheiten
Der Dampfdruck wird in den Standardeinheiten des Drucks gemessen. Das Internationale Einheitensystem (SI) erkennt den Druck als eine abgeleitete Einheit mit der Dimension Kraft pro Fläche an und bezeichnet das Pascal (Pa) als Standardeinheit. Ein Pascal ist ein Newton pro Quadratmeter (N-m-2 oder kg-m-1-s-2). ⓘ
Die experimentelle Messung des Dampfdrucks ist ein einfaches Verfahren für übliche Drücke zwischen 1 und 200 kPa. Die genauesten Ergebnisse werden in der Nähe des Siedepunkts von Substanzen erzielt, und bei Messungen unter 1 kPa ergeben sich große Fehler. Die Verfahren bestehen häufig darin, die Prüfsubstanz zu reinigen, sie in einem Behälter zu isolieren, alle Fremdgase zu evakuieren und dann den Gleichgewichtsdruck der gasförmigen Phase der Substanz im Behälter bei verschiedenen Temperaturen zu messen. Eine bessere Genauigkeit wird erreicht, wenn darauf geachtet wird, dass die gesamte Substanz und ihr Dampf die vorgeschriebene Temperatur haben. Dies geschieht häufig, wie bei der Verwendung eines Isoteniskops, indem der Einschlussbereich in ein Flüssigkeitsbad getaucht wird. ⓘ
Sehr niedrige Dampfdrücke von Feststoffen können mit der Methode der Knudsen-Effusionszelle gemessen werden. ⓘ
In der Medizin wird der Dampfdruck manchmal in anderen Einheiten angegeben, insbesondere in Millimeter Quecksilber (mmHg). Dies ist wichtig für flüchtige Anästhetika, von denen die meisten bei Körpertemperatur flüssig sind, aber einen relativ hohen Dampfdruck haben. ⓘ
Abschätzung der Dampfdrücke mit der Antoine-Gleichung
Die Antoine-Gleichung ist ein pragmatischer mathematischer Ausdruck für die Beziehung zwischen dem Dampfdruck und der Temperatur von reinen flüssigen oder festen Substanzen. Sie wird durch Kurvenanpassung gewonnen und trägt der Tatsache Rechnung, dass der Dampfdruck als Funktion der Temperatur in der Regel ansteigt und konkav ist. Die Grundform der Gleichung lautet:
und kann in diese temperatur-explizite Form umgewandelt werden:
wobei:
- der absolute Dampfdruck einer Substanz ist
- die Temperatur des Stoffes ist
- , und stoffspezifische Koeffizienten (d. h. Konstanten oder Parameter) sind
- ist typischerweise entweder oder ⓘ
Eine einfachere Form der Gleichung mit nur zwei Koeffizienten wird manchmal verwendet:
die in umgewandelt werden kann:
Sublimationen und Verdampfungen derselben Substanz haben getrennte Sätze von Antoine-Koeffizienten, ebenso wie die Komponenten in Gemischen. Jeder Parametersatz für eine bestimmte Verbindung ist nur innerhalb eines bestimmten Temperaturbereichs anwendbar. Im Allgemeinen werden die Temperaturbereiche so gewählt, dass die Genauigkeit der Gleichung bei einigen bis zu 8-10 Prozent liegt. Für viele flüchtige Stoffe stehen mehrere verschiedene Parametersätze zur Verfügung, die für unterschiedliche Temperaturbereiche verwendet werden. Die Antoine-Gleichung hat eine schlechte Genauigkeit mit einem einzigen Parametersatz, wenn sie vom Schmelzpunkt einer Verbindung bis zu ihrer kritischen Temperatur verwendet wird. Die Genauigkeit ist in der Regel auch gering, wenn der Dampfdruck unter 10 Torr liegt, da die zur Ermittlung der Antoine-Parameterwerte verwendeten Geräte nur begrenzt geeignet sind. ⓘ
Die Wagner-Gleichung bietet eine der besten Anpassungen an experimentelle Daten, ist jedoch recht komplex. Sie drückt den reduzierten Dampfdruck als eine Funktion der reduzierten Temperatur aus. ⓘ
Die Berechnung des Sättigungsdampfdrucks kann bspw. über die Methoden nach Lee-Kesler und Ambrose-Walton erfolgen. Beide Methoden basieren auf dem Korrespondenzprinzip, bei dem kritische Daten und der azentrische Faktor benutzt werden. ⓘ
Beziehung zum Siedepunkt von Flüssigkeiten

Im Allgemeinen steigt der Dampfdruck von Flüssigkeiten bei Umgebungstemperatur mit abnehmendem Siedepunkt. Dies wird in der Dampfdrucktabelle (siehe rechts) veranschaulicht, die für eine Reihe von Flüssigkeiten die Dampfdrücke in Abhängigkeit von der Temperatur darstellt. Beim normalen Siedepunkt einer Flüssigkeit entspricht der Dampfdruck dem Standardatmosphärendruck, definiert als 1 Atmosphäre, 760 Torr, 101,325 kPa oder 14,69595 psi. ⓘ
So hat beispielsweise Methylchlorid bei einer bestimmten Temperatur den höchsten Dampfdruck aller in der Tabelle aufgeführten Flüssigkeiten. Es hat auch den niedrigsten normalen Siedepunkt (-24,2 °C), an dem sich die Dampfdruckkurve von Methylchlorid (die blaue Linie) mit der horizontalen Drucklinie von einer Atmosphäre (atm) absoluten Dampfdrucks schneidet. ⓘ
Obwohl die Beziehung zwischen Dampfdruck und Temperatur nicht linear ist, verwendet das Diagramm eine logarithmische vertikale Achse, um leicht gekrümmte Linien zu erzeugen, so dass ein Diagramm viele Flüssigkeiten darstellen kann. Eine nahezu gerade Linie ergibt sich, wenn der Logarithmus des Dampfdrucks gegen 1/(T + 230) aufgetragen wird, wobei T die Temperatur in Grad Celsius ist. Der Dampfdruck einer Flüssigkeit an ihrem Siedepunkt ist gleich dem Druck der Umgebung. ⓘ
In einer Flüssigkeit haben die Teilchen bei einer Temperatur über dem absoluten Nullpunkt das Bestreben, den Flüssigkeitsverband zu verlassen. Dem entgegen wirken die Oberflächenspannung und der äußere, auf die Flüssigkeit einwirkende Druck. Die Oberflächenspannung verringert sich mit steigender Temperatur, wodurch der Dampfdruck steigt. Am kritischen Punkt ist die Oberflächenspannung Null und der Dampfdruck gleich dem kritischen Druck. ⓘ
Flüssigkeitsgemische: Raoultsches Gesetz
Das Raoultsche Gesetz liefert eine Annäherung an den Dampfdruck von Flüssigkeitsgemischen. Es besagt, dass die Aktivität (Druck oder Fugazität) eines einphasigen Gemischs gleich der molfraktionsgewichteten Summe der Dampfdrücke der Komponenten ist:
wobei der Dampfdruck des Gemisches ist, der Molenbruch der Komponente in der flüssigen Phase und der Molenbruch der Komponente in der Dampfphase ist. der Dampfdruck der Komponente . Das Raoultsche Gesetz gilt nur für Nichtelektrolyte (ungeladene Spezies); es eignet sich am besten für unpolare Moleküle mit nur schwachen zwischenmolekularen Anziehungskräften (z. B. Londoner Kräfte). ⓘ
Bei Systemen, deren Dampfdruck höher ist als in der obigen Formel angegeben, spricht man von einer positiven Abweichung. Eine solche Abweichung deutet auf eine schwächere zwischenmolekulare Anziehung hin als bei den reinen Komponenten, so dass die Moleküle in der flüssigen Phase weniger stark "gehalten" werden als in der reinen Flüssigkeit. Ein Beispiel ist das Azeotrop aus etwa 95 % Ethanol und Wasser. Da der Dampfdruck des Azeotrops höher ist als nach dem Raoultschen Gesetz vorhergesagt, siedet es bei einer Temperatur, die unter der der beiden reinen Komponenten liegt. ⓘ
Es gibt auch Systeme mit negativen Abweichungen, bei denen der Dampfdruck niedriger ist als erwartet. Eine solche Abweichung ist ein Beweis für eine stärkere intermolekulare Anziehung zwischen den Bestandteilen des Gemischs als bei den reinen Komponenten. Die Moleküle werden also stärker in der Flüssigkeit "gehalten", wenn ein zweites Molekül vorhanden ist. Ein Beispiel ist ein Gemisch aus Trichlormethan (Chloroform) und 2-Propanon (Aceton), das oberhalb des Siedepunkts der beiden reinen Komponenten siedet. ⓘ
Die negativen und positiven Abweichungen können zur Bestimmung der thermodynamischen Aktivitätskoeffizienten der Komponenten von Gemischen verwendet werden. ⓘ
Wasserdampfdruck in der Meteorologie
In der Meteorologie wird unter der Bezeichnung Dampfdruck meist der Dampfdruck des Wasserdampfs (Wasserdampfdruck) und somit sein Partialdruck verstanden. Die Dampfdichte entspricht der absoluten Luftfeuchtigkeit. ⓘ
Der Dampfdruck nach Definition der Meteorologie, also der Partialdruck eines Gases innerhalb eines Gasgemisches, kann durch Umstellung der allgemeinen Gasgleichung mit folgender Formel näherungsweise berechnet werden:
Die einzelnen Formelzeichen stehen für folgende Größen:
- e – Dampfdruck,
- ρi – Dampfdichte (absolute Luftfeuchtigkeit),
- Ri – individuelle Gaskonstante (für Wasserdampf: 461,5 J/(kg K)),
- T – Absolute Temperatur. ⓘ
Bei einer Lufttemperatur von 20 °C (T = 293,15 K) und maximaler Luftfeuchtigkeit bei dieser Temperatur und Normaldruck (ρi = 0,017 kg/m³) beträgt der so berechnete Dampfdruck etwa 23,39 hPa. ⓘ
Da der Wasserdampfpartialdruck nur einen kleinen Teil des Luftdrucks ausmacht, ergibt sich nur nach einem recht langen Zeitraum ein thermodynamisches Gleichgewicht, wodurch wesentliche Untersättigungen in der Erdatmosphäre möglich sind, ohne dass das vorhandene flüssige Wasser sofort siedet. Aus diesem Grund und der hohen Dynamik in der Atmosphäre sind thermodynamisch stabile Zustände in der Regel selten oder nur kurz anzutreffen, insbesondere in sehr wetteraktiven Zonen der Erdatmosphäre. Aufgrund des lokal relativ höheren Dampfdrucks über der flüssigen Phase wachsen bei gleichzeitigem Vorhandensein von Wasser und Eis in einer Wolke die Eispartikel auf Kosten der Wassertröpfchen. ⓘ
Über einer nichtüberhitzten festen Phase ist der Dampfdruck geringer als über einer flüssigen Phase gleicher Temperatur. Stehen beide Phasen über die sie umgebenden Gase miteinander in Kontakt, so wächst daher der Anteil des Feststoffes auf Kosten der Flüssigkeit. Dies liegt darin begründet, dass die stärkere Bindung der Teilchen im Feststoff und die daraus resultierende Schmelzwärme im Falle der Sublimation, also des Phasenübergangs fest-gasförmig, zusätzlich überwunden bzw. aufgebracht werden muss. Dies hat zur Folge, dass es leichter und damit häufiger zur Verdunstung bzw. Verdampfung von Teilchen der flüssigen Phase kommt als zur Sublimation von Teilchen über der festen Phase. Es sind also über der Flüssigkeit mehr Teilchen im gasförmigen Zustand anzutreffen als über dem Feststoff, was den Dampfdruck lokal erhöht und zum Anwachsen der festen Phase führt. ⓘ
Der Gleichgewichtsdampfdruck kann als der Druck definiert werden, der erreicht wird, wenn sich eine kondensierte Phase im Gleichgewicht mit ihrem eigenen Dampf befindet. Im Falle eines Gleichgewichtsfeststoffes, z. B. eines Kristalls, kann dies als der Druck definiert werden, bei dem die Sublimationsrate eines Feststoffes der Ablagerungsrate seiner Dampfphase entspricht. Für die meisten Feststoffe ist dieser Druck sehr niedrig, aber einige bemerkenswerte Ausnahmen sind Naphthalin, Trockeneis (der Dampfdruck von Trockeneis beträgt 5,73 MPa (831 psi, 56,5 atm) bei 20 °C, was die meisten versiegelten Behälter zum Bersten bringt) und Eis. Alle festen Stoffe haben einen Dampfdruck. Aufgrund ihrer oft extrem niedrigen Werte kann die Messung jedoch recht schwierig sein. Typische Verfahren sind die Thermogravimetrie und die Gastranspiration. ⓘ
Es gibt eine Reihe von Methoden zur Berechnung des Sublimationsdrucks (d. h. des Dampfdrucks) eines Feststoffs. Eine Methode besteht darin, den Sublimationsdruck aus extrapolierten Flüssigkeitsdampfdrücken (der unterkühlten Flüssigkeit) zu schätzen, wenn die Schmelzwärme bekannt ist, indem man diese besondere Form der Clausius-Clapeyron-Beziehung verwendet:
wobei:
- ist der Sublimationsdruck der festen Komponente bei der Temperatur .
- ist der extrapolierte Dampfdruck der flüssigen Komponente bei der Temperatur .
- ist die Schmelzwärme.
- ist die Gaskonstante.
- ist die Sublimationstemperatur.
- ist die Schmelzpunkttemperatur. ⓘ
Bei dieser Methode wird davon ausgegangen, dass die Schmelzwärme temperaturunabhängig ist, zusätzliche Übergangstemperaturen zwischen verschiedenen festen Phasen werden ignoriert, und sie liefert eine angemessene Schätzung für Temperaturen, die nicht allzu weit vom Schmelzpunkt entfernt sind. Sie zeigt auch, dass der Sublimationsdruck niedriger ist als der extrapolierte Flüssigkeitsdampfdruck (ΔfusH > 0) und die Differenz mit zunehmender Entfernung vom Schmelzpunkt wächst. ⓘ
In Physik und Chemie bezeichnet der Dampfdruck den Partialdruck eines Gases (Mehrkomponentensystem), das im thermodynamischen Gleichgewicht mit seiner flüssigen oder festen Phase steht, er lässt sich über das Raoultsche Gesetz berechnen. Im Einkomponentensystem wird dieser Druck als Gleichgewichtsdruck bezeichnet. ⓘ
Siedepunkt von Wasser
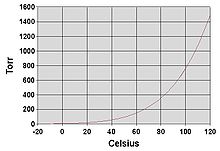
Wie alle Flüssigkeiten siedet Wasser, wenn sein Dampfdruck den Umgebungsdruck erreicht. In der Natur ist der atmosphärische Druck in höheren Lagen niedriger, und das Wasser siedet bei einer niedrigeren Temperatur. Die Siedetemperatur von Wasser für atmosphärische Drücke kann durch die Antoine-Gleichung angenähert werden:
oder in diese temperatur-explizite Form umgewandelt werden:
wobei die Temperatur der Siedepunkt in Grad Celsius ist und der Druck in Torr ist. ⓘ
Dühringsche Regel
Die Dühringsche Regel besagt, dass eine lineare Beziehung zwischen den Temperaturen besteht, bei denen zwei Lösungen den gleichen Dampfdruck ausüben. ⓘ
Beispiele
Die folgende Tabelle enthält eine Reihe von Stoffen, geordnet nach steigendem Dampfdruck (in absoluten Einheiten). ⓘ
| Substanz | Dampfdruck | Temperatur (°C) ⓘ | ||
|---|---|---|---|---|
| (Pa) | (bar) | (mmHg) | ||
| Octaethylenglykol | 9,2×10-8 Pa | 9.2×10−13 | 6.9×10−10 | 89.85 |
| Glycerin | 0,4 Pa | 0.000004 | 0.003 | 50 |
| Quecksilber | 1 Pa | 0.00001 | 0.0075 | 41.85 |
| Wolfram | 1 Pa | 0.00001 | 0.0075 | 3203 |
| Xenondifluorid | 600 Pa | 0.006 | 4.50 | 25 |
| Wasser (H2O) | 2,3 kPa | 0.023 | 17.5 | 20 |
| Propanol | 2,4 kPa | 0.024 | 18.0 | 20 |
| Methylisobutylketon | 2,66 kPa | 0.0266 | 19.95 | 25 |
| Ethanol | 5,83 kPa | 0.0583 | 43.7 | 20 |
| Freon 113 | 37,9 kPa | 0.379 | 284 | 20 |
| Acetaldehyd | 98,7 kPa | 0.987 | 740 | 20 |
| Butan | 220 kPa | 2.2 | 1650 | 20 |
| Formaldehyd | 435,7 kPa | 4.357 | 3268 | 20 |
| Propan | 997,8 kPa | 9.978 | 7584 | 26.85 |
| Carbonylsulfid | 1.255 MPa | 12.55 | 9412 | 25 |
| Distickstoffoxid | 5.660 MPa | 56.60 | 42453 | 25 |
| Kohlendioxid | 5,7 MPa | 57 | 42753 | 20 |
Schätzung des Dampfdrucks anhand der Molekülstruktur
Es gibt mehrere empirische Methoden zur Schätzung des Dampfdrucks aus der Molekularstruktur organischer Moleküle. Einige Beispiele sind die SIMPOL.1 Methode, die Methode von Moller et al. und EVAPORATION (Estimation of VApour Pressure of ORganics, Accounting for Temperature, Intramolecular, and Non-additivity effects). ⓘ
Bedeutung in der Meteorologie
In der Meteorologie wird der Begriff Dampfdruck verwendet, um den Partialdruck von Wasserdampf in der Atmosphäre zu bezeichnen, auch wenn er sich nicht im Gleichgewicht befindet, und der Gleichgewichtsdampfdruck wird anders angegeben. Meteorologen verwenden auch den Begriff Sättigungsdampfdruck für den Gleichgewichtsdampfdruck von Wasser oder Sole über einer ebenen Fläche, um ihn vom Gleichgewichtsdampfdruck zu unterscheiden, der die Form und Größe von Wassertröpfchen und Partikeln in der Atmosphäre berücksichtigt. ⓘ
Wasserdampfdruck
Praktische Bedeutung
In einem offenen Topf siedet erhitztes Wasser dann, wenn sein Dampfdruck den Luftdruck der Umgebung übersteigt. Die Siedetemperatur des Wassers ist also vom Luftdruck abhängig und nimmt mit zunehmender Höhe ab, da der natürliche Luftdruck der Erde mit zunehmender Entfernung vom Meeresspiegel kleiner wird. In 2000 m Höhe siedet Wasser bei 93 °C, in 8000 m Höhe bereits bei 74 °C. ⓘ
Die physikalischen Gesetze zu Dampfdruck und Verdampfung (Dampfdruckkurve, Clausius-Clapeyron-Gleichung etc.) wurden zuerst im Zusammenhang mit der Dampfmaschine untersucht und formuliert. Auch hier gibt es eine Koexistenz von Flüssigkeit und Gas. Man machte sich bei der Dampfmaschine die Tatsache zunutze, dass der Dampfdruck unabhängig von dem Volumen ist, solange man sich im Zweiphasensystem „Flüssigkeit-Gas“ bewegt. Das einzige, was sich bei konstanter Temperatur ändert, ist das Mengenverhältnis „Flüssigkeit-Gas“. Der Druck im Kessel, der den Kolben bewegt, verändert sich also nicht durch die Kolbenbewegung (Kolbenbewegung Volumenänderung im Zylinder). Die Kolbenposition darf jedoch nicht so weit verändert werden, dass eine der Phasen verschwinden würde. ⓘ






























