Germanium
 | |||||||||||||||||||||||||||||||||||||||||
| Germanium | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /dʒɜːrˈmeɪniəm/ (jur-MAY-nee-əm) | ||||||||||||||||||||||||||||||||||||||||
| Erscheinungsbild | gräulich-weiß | ||||||||||||||||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Ge) |
| ||||||||||||||||||||||||||||||||||||||||
| Germanium im Periodensystem | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 32 | ||||||||||||||||||||||||||||||||||||||||
| Gruppe | Gruppe 14 (Kohlenstoffgruppe) | ||||||||||||||||||||||||||||||||||||||||
| Periode | Periode 4 | ||||||||||||||||||||||||||||||||||||||||
| Block | p-Block | ||||||||||||||||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Argon|Ar]]] 3d10 4s2 4p2 | ||||||||||||||||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 4 | ||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||
| Phase bei STP | fest | ||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1211,40 K (938,25 °C, 1720,85 °F) | ||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3106 K (2833 °C, 5131 °F) | ||||||||||||||||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 5,323 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 5,60 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 36,94 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 334 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Molare Wärmekapazität | 23.222 J/(mol-K) | ||||||||||||||||||||||||||||||||||||||||
Verdampfungsdruck
| |||||||||||||||||||||||||||||||||||||||||
| Atomare Eigenschaften | |||||||||||||||||||||||||||||||||||||||||
| Oxidationsstufen | -4 -3, -2, -1, 0, +1, +2, +3, +4 (ein amphoteres Oxid) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 2,01 | ||||||||||||||||||||||||||||||||||||||||
| Ionisierungsenergien |
| ||||||||||||||||||||||||||||||||||||||||
| Atomradius | empirisch: 122 pm | ||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 122 pm | ||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 211 pm | ||||||||||||||||||||||||||||||||||||||||
| Spektrallinien von Germanium | |||||||||||||||||||||||||||||||||||||||||
| Andere Eigenschaften | |||||||||||||||||||||||||||||||||||||||||
| Natürliches Vorkommen | primordial | ||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | flächenzentriert diamantkubisch | ||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | 5400 m/s (bei 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Thermische Ausdehnung | 6,0 µm/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| Thermische Leitfähigkeit | 60,2 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| Elektrischer Widerstand | 1 Ω⋅m (bei 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Bandlücke | 0,67 eV (bei 300 K) | ||||||||||||||||||||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | ||||||||||||||||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -76,84×10-6 cm3/mol | ||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 103 GPa | ||||||||||||||||||||||||||||||||||||||||
| Schermodul | 41 GPa | ||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 75 GPa | ||||||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0.26 | ||||||||||||||||||||||||||||||||||||||||
| Mohs-Härte | 6.0 | ||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-56-4 | ||||||||||||||||||||||||||||||||||||||||
| Geschichte | |||||||||||||||||||||||||||||||||||||||||
| Benennung | nach Deutschland, dem Heimatland des Entdeckers | ||||||||||||||||||||||||||||||||||||||||
| Vorhersage | Dmitri Mendelejew (1869) | ||||||||||||||||||||||||||||||||||||||||
| Entdeckung | Clemens Winkler (1886) | ||||||||||||||||||||||||||||||||||||||||
| Hauptisotope von Germanium | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Germanium ist ein chemisches Element mit dem Symbol Ge und der Ordnungszahl 32. Es ist ein glänzendes, hart-sprödes, gräulich-weißes Metalloid in der Kohlenstoffgruppe, das chemisch seinen Nachbarn Silizium und Zinn ähnelt. Reines Germanium ist ein Halbleiter mit einem ähnlichen Aussehen wie elementares Silizium. Wie Silizium reagiert Germanium in der Natur mit Sauerstoff und bildet mit ihm Komplexe. ⓘ
Da es nur selten in hoher Konzentration vorkommt, wurde Germanium erst relativ spät in der Geschichte der Chemie entdeckt. In der relativen Häufigkeit der Elemente in der Erdkruste rangiert Germanium etwa an fünfzigster Stelle. Im Jahr 1869 sagte Dmitri Mendelejew seine Existenz und einige seiner Eigenschaften anhand seiner Position im Periodensystem voraus und nannte das Element Ekasilizium. Fast zwei Jahrzehnte später, im Jahr 1886, fand Clemens Winkler das neue Element zusammen mit Silber und Schwefel in einem ungewöhnlichen Mineral namens Argyrodit. Obwohl das neue Element in seinem Aussehen etwas an Arsen und Antimon erinnerte, stimmten die Kombinationsverhältnisse in den Verbindungen mit Mendelejews Vorhersagen für einen Verwandten des Siliziums überein. Winkler benannte das Element nach seinem Land, Deutschland. Heute wird Germanium hauptsächlich aus Sphalerit (dem Haupterz von Zink) gewonnen, aber auch aus Silber-, Blei- und Kupfererzen wird Germanium kommerziell gewonnen. ⓘ
Elementares Germanium wird als Halbleiter in Transistoren und verschiedenen anderen elektronischen Geräten verwendet. Historisch gesehen basierte das erste Jahrzehnt der Halbleiterelektronik vollständig auf Germanium. Die wichtigsten Endanwendungen sind derzeit Glasfasersysteme, Infrarotoptik, Solarzellenanwendungen und Leuchtdioden (LEDs). Germaniumverbindungen werden auch als Polymerisationskatalysatoren eingesetzt und haben in jüngster Zeit Verwendung bei der Herstellung von Nanodrähten gefunden. Dieses Element bildet eine große Anzahl von Organogermaniumverbindungen, wie z. B. Tetraethylgermanium, die in der metallorganischen Chemie verwendet werden. Germanium gilt als ein technologiekritisches Element. ⓘ
Germanium gilt nicht als essentielles Element für lebende Organismen. Einige komplexe organische Germaniumverbindungen werden als mögliche Pharmazeutika erforscht, allerdings hat sich bisher noch keine als erfolgreich erwiesen. Ähnlich wie Silizium und Aluminium sind natürlich vorkommende Germaniumverbindungen in der Regel unlöslich in Wasser und haben daher eine geringe orale Toxizität. Synthetische lösliche Germaniumsalze sind jedoch nephrotoxisch, und synthetische chemisch reaktive Germaniumverbindungen mit Halogenen und Wasserstoff sind reizend und giftig. ⓘ
Germanium (von lateinisch Germania ‚Deutschland‘, nach dem Land, in dem es zuerst gefunden wurde) ist ein chemisches Element mit dem Elementsymbol Ge und der Ordnungszahl 32. Im Periodensystem steht es in der 4. Periode und in der 4. Hauptgruppe (14. IUPAC-Gruppe, p-Block und Kohlenstoffgruppe). Es wurde erstmals 1886 im Mineral Argyrodit nachgewiesen. ⓘ
Geschichte

In seinem Bericht über das Periodensystem der chemischen Elemente von 1869 sagte der russische Chemiker Dmitri Mendelejew die Existenz mehrerer unbekannter chemischer Elemente voraus, darunter eines, das eine Lücke in der Kohlenstofffamilie zwischen Silizium und Zinn füllen würde. Aufgrund seiner Position im Periodensystem nannte Mendelejew es Ekasilicium (Es) und schätzte sein Atomgewicht auf 70 (später 72). ⓘ
Mitte 1885 wurde in einem Bergwerk in der Nähe von Freiberg (Sachsen) ein neues Mineral entdeckt und wegen seines hohen Silbergehalts Argyrodit genannt. Der Chemiker Clemens Winkler analysierte dieses neue Mineral, das sich als eine Kombination aus Silber, Schwefel und einem neuen Element herausstellte. Winkler konnte das neue Element 1886 isolieren und stellte fest, dass es dem Antimon ähnelt. Er hielt das neue Element zunächst für Eka-Antimon, war aber bald überzeugt, dass es sich stattdessen um Eka-Silizium handelte. Bevor Winkler seine Ergebnisse über das neue Element veröffentlichte, beschloss er, sein Element Neptunium zu nennen, da der jüngsten Entdeckung des Planeten Neptun im Jahr 1846 ebenfalls mathematische Vorhersagen über seine Existenz vorausgegangen waren. Der Name "Neptunium" war jedoch bereits für ein anderes vorgeschlagenes chemisches Element vergeben worden (wenn auch nicht für das Element, das heute den Namen Neptunium trägt, das 1940 entdeckt wurde). Stattdessen nannte Winkler das neue Element Germanium (nach dem lateinischen Wort Germania für Deutschland) zu Ehren seines Heimatlandes. Argyrodit erwies sich empirisch als Ag8GeS6.
Da dieses neue Element einige Ähnlichkeiten mit den Elementen Arsen und Antimon aufwies, wurde sein richtiger Platz im Periodensystem in Erwägung gezogen, aber seine Ähnlichkeiten mit dem von Dmitri Mendelejew vorhergesagten Element "Ekasilizium" bestätigten diesen Platz im Periodensystem. Mit weiterem Material aus 500 kg Erz aus den sächsischen Bergwerken bestätigte Winkler 1887 die chemischen Eigenschaften des neuen Elements. Außerdem bestimmte er das Atomgewicht von 72,32 durch die Analyse von reinem Germaniumtetrachlorid (GeCl
4), während Lecoq de Boisbaudran durch einen Vergleich der Linien im Funkenspektrum des Elements auf 72,3 kam. ⓘ
Winkler gelang es, mehrere neue Germaniumverbindungen herzustellen, darunter Fluoride, Chloride, Sulfide, Dioxide und Tetraethylgerman (Ge(C2H5)4), das erste Organogerman. Die physikalischen Daten dieser Verbindungen, die gut mit Mendelejews Vorhersagen übereinstimmten, machten die Entdeckung zu einer wichtigen Bestätigung von Mendelejews Idee der Elementperiodizität. Hier ist ein Vergleich zwischen der Vorhersage und Winklers Daten:
| Eigenschaft | Ekasilizium Mendelejew Vorhersage (1871) |
Germanium Winkler Entdeckung (1887) ⓘ |
|---|---|---|
| Atommasse | 72.64 | 72.63 |
| Dichte (g/cm3) | 5.5 | 5.35 |
| Schmelzpunkt (°C) | hoch | 947 |
| Farbe | grau | grau |
| Oxidtyp | feuerfestes Dioxid | feuerfestes Dioxid |
| Oxiddichte (g/cm3) | 4.7 | 4.7 |
| Oxid-Aktivität | schwach basisch | schwach basisch |
| Chlorid Siedepunkt (°C) | unter 100 | 86 (GeCl4) |
| Chlorid Dichte (g/cm3) | 1.9 | 1.9 |
Bis in die späten 1930er Jahre hielt man Germanium für ein schlecht leitendes Metall. Wirtschaftliche Bedeutung erlangte Germanium erst nach 1945, als seine Eigenschaften als elektronischer Halbleiter erkannt wurden. Während des Zweiten Weltkriegs wurden kleine Mengen Germanium in einigen speziellen elektronischen Geräten, vor allem Dioden, verwendet. Die erste größere Verwendung waren die Punktkontakt-Schottky-Dioden für die Radarimpulserkennung während des Krieges. Die ersten Silizium-Germanium-Legierungen wurden 1955 hergestellt. Vor 1945 wurden jährlich nur einige hundert Kilogramm Germanium in Schmelzhütten hergestellt, aber Ende der 1950er Jahre erreichte die Jahresproduktion weltweit 40 Tonnen (44 kurze Tonnen). ⓘ
Die Entwicklung des Germaniumtransistors im Jahr 1948 öffnete die Tür zu unzähligen Anwendungen der Festkörperelektronik. Von 1950 bis in die frühen 1970er Jahre gab es in diesem Bereich einen wachsenden Markt für Germanium, doch dann begann hochreines Silizium, Germanium in Transistoren, Dioden und Gleichrichtern zu ersetzen. Das Unternehmen, aus dem Fairchild Semiconductor hervorging, wurde beispielsweise 1957 mit dem ausdrücklichen Ziel gegründet, Siliziumtransistoren herzustellen. Silizium hat bessere elektrische Eigenschaften, erfordert aber eine viel größere Reinheit, die in den Anfangsjahren der Halbleiterelektronik kommerziell nicht erreicht werden konnte. ⓘ
In der Zwischenzeit stieg die Nachfrage nach Germanium für faseroptische Kommunikationsnetze, Infrarot-Nachtsichtsysteme und Polymerisationskatalysatoren drastisch an. Auf diese Endanwendungen entfielen im Jahr 2000 85 % des weltweiten Germaniumverbrauchs. Die US-Regierung stufte Germanium sogar als strategisches und kritisches Material ein und forderte 1987 einen Vorrat von 146 Tonnen (132 Tonnen) in den nationalen Verteidigungsvorräten. ⓘ
Germanium unterscheidet sich von Silizium dadurch, dass der Vorrat durch die Verfügbarkeit von abbaubaren Quellen begrenzt ist, während der Vorrat an Silizium nur durch die Produktionskapazität begrenzt ist, da Silizium aus gewöhnlichem Sand und Quarz gewonnen wird. Während Silizium 1998 für weniger als 10 $ pro kg gekauft werden konnte, lag der Preis für Germanium bei fast 800 $ pro kg. ⓘ

Oben: Die zur Weltausstellung 1904 in St. Louis gezeigten Präparate
Unten: Germaniumsulfid vom 6. Februar 1886 ⓘ
Eigenschaften
Unter Standardbedingungen ist Germanium ein sprödes, silbrig-weißes, halbmetallisches Element. Diese Form bildet ein als α-Germanium bekanntes Allotrop, das metallisch glänzt und eine diamantkubische Kristallstruktur aufweist, die der des Diamanten entspricht. In der Kristallform hat Germanium eine Verschiebungsenergie von . Bei Drücken über 120 kbar wird Germanium zum Allotrop β-Germanium mit der gleichen Struktur wie β-Zinn. Wie Silizium, Gallium, Wismut, Antimon und Wasser gehört Germanium zu den wenigen Stoffen, die sich beim Erstarren (d. h. Gefrieren) aus dem geschmolzenen Zustand ausdehnen. ⓘ
Germanium ist ein Halbleiter. Durch Zonenveredelungstechniken konnte kristallines Germanium für Halbleiter hergestellt werden, das nur einen Anteil von einem Teil in 1010 hat, Das macht es zu einem der reinsten Materialien, die je gewonnen wurden. Das erste (2005) entdeckte metallische Material, das in Gegenwart eines extrem starken elektromagnetischen Feldes zum Supraleiter wurde, war eine Legierung aus Germanium, Uran und Rhodium. ⓘ
Von reinem Germanium ist bekannt, dass es spontan sehr lange Schraubenversetzungen, so genannte Germanium-Whisker, ausbildet. Das Wachstum dieser Whisker ist einer der Hauptgründe für das Versagen älterer Dioden und Transistoren aus Germanium, da sie, je nachdem, was sie schließlich berühren, zu einem elektrischen Kurzschluss führen können. ⓘ

Germanium steht im Periodensystem in der Serie der Halbmetalle, wird aber nach neuerer Definition als Halbleiter klassifiziert. Elementares Germanium ist sehr spröde und an der Luft bei Raumtemperatur sehr beständig. Erst bei starkem Glühen in einer Sauerstoff-Atmosphäre wird es zu Germanium(IV)-oxid (GeO2) oxidiert. GeO2 ist dimorph und wird bei 1033 °C von der Rutil-Modifikation (CN = 6) in die β-Quarz-Struktur (CN = 4) überführt. In Pulverform kann es leicht entzündet werden und brennt nach Entfernen der Zündquelle weiter. In kompakter Form ist es nicht brennbar. ⓘ
Germanium kann zwei- oder vierwertig sein. Germanium(IV)-Verbindungen sind am beständigsten. Von Salzsäure, Kalilauge und verdünnter Schwefelsäure wird Germanium nicht angegriffen. In alkalischen Wasserstoffperoxid-Lösungen, konzentrierter heißer Schwefelsäure und konzentrierter Salpetersäure wird es dagegen unter Bildung von Germaniumdioxidhydrat aufgelöst. Gemäß seiner Stellung im Periodensystem steht es in seinen chemischen Eigenschaften zwischen Silicium und Zinn. ⓘ
Germanium zeigt als einer von wenigen Stoffen eine Dichteanomalie. Seine Dichte in festem Zustand ist niedriger als in flüssigem. Seine Bandlücke beträgt bei Zimmertemperatur ca. 0,67 eV. ⓘ
Wafer aus Germanium sind erheblich zerbrechlicher als Wafer aus Silicium. ⓘ
Chemie
Elementares Germanium beginnt an der Luft bei etwa 250 °C langsam zu oxidieren und bildet dabei GeO2 . Germanium ist in verdünnten Säuren und Laugen unlöslich, löst sich jedoch langsam in heißen konzentrierten Schwefel- und Salpetersäuren und reagiert heftig mit geschmolzenen Laugen unter Bildung von Germanaten ([GeO
3]2−
). Germanium kommt meist in der Oxidationsstufe +4 vor, obwohl viele +2-Verbindungen bekannt sind. Andere Oxidationsstufen sind selten: +3 findet sich in Verbindungen wie Ge2Cl6, und +3 und +1 finden sich an der Oberfläche von Oxiden oder negativen Oxidationsstufen in Germaniden, wie -4 in Mg
2Ge. Germanium-Cluster-Anionen (Zintl-Ionen) wie Ge42-, Ge94-, Ge92-, [(Ge9)2]6- wurden durch Extraktion aus Legierungen, die Alkalimetalle und Germanium enthalten, in flüssigem Ammoniak in Gegenwart von Ethylendiamin oder einem Kryptanden hergestellt. Die Oxidationsstufen des Elements in diesen Ionen sind nicht ganzzahlig, ähnlich wie bei den Ozoniden O3-. ⓘ
Zwei Oxide des Germaniums sind bekannt: Germaniumdioxid (GeO
2, Germania) und Germaniummonoxid (GeO). Das Germaniumdioxid (GeO2) kann durch Rösten von Germaniumdisulfid (GeS
2) gewonnen werden und ist ein weißes Pulver, das in Wasser nur wenig löslich ist, aber mit Alkalien unter Bildung von Germanaten reagiert. Das Monoxid, Germaniumoxid, kann durch die Hochtemperaturreaktion von GeO2 mit Ge-Metall gewonnen werden. Das Dioxid (und die verwandten Oxide und Germanate) weist die ungewöhnliche Eigenschaft auf, einen hohen Brechungsindex für sichtbares Licht zu haben, ist aber für infrarotes Licht durchlässig. Bismutgermanat, Bi4Ge3O12, (BGO) wird als Szintillator verwendet. ⓘ
Es sind auch binäre Verbindungen mit anderen Chalkogenen bekannt, wie z. B. Disulfid (GeS
2), Diselenid (GeSe
2), Monosulfid (GeS), Selenid (GeSe) und Tellurid (GeTe). GeS2 bildet sich als weißer Niederschlag, wenn Schwefelwasserstoff durch stark saure Lösungen geleitet wird, die Ge(IV) enthalten. Das Disulfid ist gut löslich in Wasser und in Lösungen von Alkalilaugen oder Alkalisulfiden. In saurem Wasser ist es jedoch nicht löslich, was Winkler die Entdeckung des Elements ermöglichte. Erhitzt man das Disulfid in einem Wasserstoffstrom, so bildet sich das Monosulfid (GeS), das in dünnen Platten von dunkler Farbe und metallischem Glanz sublimiert und in Laugen löslich ist. Beim Schmelzen mit alkalischen Karbonaten und Schwefel bilden Germaniumverbindungen Salze, die als Thiogermanate bekannt sind. ⓘ

Es sind vier Tetrahalogenide bekannt. Unter normalen Bedingungen ist GeI4 ein Feststoff, GeF4 ein Gas und die anderen sind flüchtige Flüssigkeiten. Germaniumtetrachlorid, GeCl4, wird beispielsweise durch Erhitzen des Metalls mit Chlor als farblose rauchende Flüssigkeit gewonnen, die bei 83,1 °C siedet. Alle Tetrahalogenide lassen sich leicht zu hydratisiertem Germaniumdioxid hydrolysieren. GeCl4 wird für die Herstellung von Organogermaniumverbindungen verwendet. Alle vier Dihalogenide sind bekannt und im Gegensatz zu den Tetrahalogeniden sind sie polymere Feststoffe. Außerdem sind Ge2Cl6 und einige höhere Verbindungen der Formel GenCl2n+2 bekannt. Die ungewöhnliche Verbindung Ge6Cl16 wurde hergestellt, die die Einheit Ge5Cl12 mit einer Neopentanstruktur enthält. ⓘ
Germane (GeH4) ist eine Verbindung, die in ihrer Struktur dem Methan ähnelt. Es sind Polygermane - Verbindungen, die Alkanen ähneln - mit der Formel GenH2n+2 bekannt, die bis zu fünf Germaniumatome enthalten. Die Germane sind weniger flüchtig und reaktionsfreudig als ihre entsprechenden Silizium-Analoga. GeH4 reagiert mit Alkalimetallen in flüssigem Ammoniak unter Bildung von weißem, kristallinem MGeH3, das das Anion GeH3- enthält. Die Germaniumhydrohalogenide mit einem, zwei und drei Halogenatomen sind farblose reaktive Flüssigkeiten. ⓘ

Die erste Organogermaniumverbindung wurde 1887 von Winkler synthetisiert; die Reaktion von Germaniumtetrachlorid mit Diethylzink ergab Tetraethylgerman (Ge(C
2H
5)
4). Organogermanen des Typs R4Ge (wobei R ein Alkyl ist) wie Tetramethylgerman (Ge(CH
3)
4) und Tetraethylgerman werden durch das billigste verfügbare Germaniumvorprodukt Germaniumtetrachlorid und Alkylnukleophile erreicht. Organische Germaniumhydride wie Isobutylgerman ((CH
3)
2CHCH
2GeH
3) haben sich als weniger gefährlich erwiesen und können als flüssiger Ersatz für giftiges Germaniumgas in Halbleiteranwendungen verwendet werden. Es sind viele reaktive Germanium-Zwischenprodukte bekannt: freie Germyl-Radikale, Germylene (ähnlich den Carbenen) und Germyne (ähnlich den Carbinen). Über die Organogermaniumverbindung 2-Carboxyethylgermasesquioxan wurde erstmals in den 1970er Jahren berichtet; sie wurde eine Zeit lang als Nahrungsergänzungsmittel verwendet und sollte möglicherweise tumorhemmende Eigenschaften haben. ⓘ
Mit Hilfe eines Liganden namens Eind (1,1,3,3,5,5,7,7-Octaethyl-s-hydrindacen-4-yl) ist Germanium in der Lage, eine Doppelbindung mit Sauerstoff (Germanon) zu bilden. Germaniumhydrid und Germaniumtetrahydrid sind hochentzündlich und in Verbindung mit Luft sogar explosiv. ⓘ
Isotope
Germanium kommt in 5 natürlichen Isotopen vor: 70
Ge
, 72
Ge
, 73
Ge
, 74
Ge
und 76
Ge
. Von diesen Isotopen ist 76
Ge
ist sehr schwach radioaktiv und zerfällt durch doppelten Betazerfall mit einer Halbwertszeit von 1,78×1021 Jahren. 74
Ge
ist das häufigste Isotop mit einer natürlichen Häufigkeit von etwa 36 %. 76
Ge
ist das am wenigsten häufige Isotop mit einer natürlichen Häufigkeit von etwa 7 %. Beim Beschuss mit Alphateilchen erzeugt das Isotop 72
Ge
das stabile 77
Se
und setzt dabei hochenergetische Elektronen frei. Aus diesem Grund wird es in Kombination mit Radon für Kernbatterien verwendet. ⓘ
Außerdem wurden mindestens 27 Radioisotope mit einer Atommasse zwischen 58 und 89 synthetisiert. Das stabilste unter ihnen ist 68
Ge
das durch Elektroneneinfang mit einer Halbwertszeit von 270,95 Tagen zerfällt. Das am wenigsten stabile ist 60
Ge
mit einer Halbwertszeit von 30 ms. Während die meisten Radioisotope des Germaniums durch Betazerfall zerfallen, sind 61
Ge
und 64
Ge
zerfallen durch
β+
verzögerte Protonenemission. 84
Ge
bis 87
Ge
Isotope weisen ebenfalls geringe
β−
Zerfallswege mit verzögerter Neutronenemission. ⓘ
Vorkommen

Germanium wird durch stellare Nukleosynthese erzeugt, hauptsächlich durch den s-Prozess in asymptotischen Riesensternen. Der s-Prozess ist ein langsamer Neutroneneinfang leichterer Elemente in pulsierenden roten Riesensternen. Germanium wurde in einigen der am weitesten entfernten Sterne und in der Atmosphäre des Jupiters nachgewiesen. ⓘ
Die Häufigkeit von Germanium in der Erdkruste beträgt etwa 1,6 ppm. Nur wenige Mineralien wie Argyrodit, Briartit, Germanit, Renierit und Sphalerit enthalten nennenswerte Mengen an Germanium. Nur wenige von ihnen (vor allem Germanit) werden in sehr seltenen Fällen in abbaubaren Mengen gefunden. Einige Zink-Kupfer-Blei-Erzkörper enthalten genügend Germanium, um eine Gewinnung aus dem endgültigen Erzkonzentrat zu rechtfertigen. Ein ungewöhnlicher natürlicher Anreicherungsprozess führt zu einem hohen Germaniumgehalt in einigen Kohleflözen, der von Victor Moritz Goldschmidt bei einer umfassenden Suche nach Germaniumvorkommen entdeckt wurde. Die höchste jemals gefundene Konzentration war in Hartley-Kohlenasche mit bis zu 1,6 % Germanium. Die Kohlevorkommen in der Nähe von Xilinhaote, Innere Mongolei, enthalten schätzungsweise 1600 Tonnen Germanium. ⓘ
Germanium ist weit verbreitet, kommt aber nur in sehr geringen Konzentrationen vor. Der Clarke-Wert, also der Durchschnittsgehalt in der Erdkruste beträgt etwa 1,5 g/t. In der Natur kommt es meist in Form von Sulfiden bzw. Thiogermanaten vor und wird oft als Begleiter in Kupfer- und Zinkerzen gefunden, unter anderem im Mansfelder Kupferschiefer. Die wichtigsten Minerale sind Argyrodit (Ag8GeS6), Canfieldit, Germanit (Cu6FeGe2S8) und Renierit. Einige Pflanzen reichern Germanium an. Diese Eigenschaft führt zu höchst umstrittenen Thesen bezüglich der Physiologie von Pflanzen („pflanzlicher Abwehrstoff gegen Viren“), mit denen auch Anwendungen in der Homöopathie begründet werden. ⓘ
Produktion
Im Jahr 2011 wurden weltweit etwa 118 Tonnen Germanium produziert, hauptsächlich in China (80 t), Russland (5 t) und den Vereinigten Staaten (3 t). Germanium wird als Nebenprodukt aus Sphalerit-Zinkerzen gewonnen, wo es in Mengen von bis zu 0,3 % konzentriert ist, insbesondere in sedimentgebundenen, massiven Zn-Pb-Cu(-Ba)-Lagerstätten mit niedriger Temperatur und in karbonatgebundenen Zn-Pb-Lagerstätten. Eine kürzlich durchgeführte Studie ergab, dass mindestens 10.000 t extrahierbares Germanium in den bekannten Zinkvorkommen enthalten sind, insbesondere in den Lagerstätten des Mississippi-Valley-Typs, während mindestens 112.000 t in den Kohlevorkommen zu finden sein werden. Im Jahr 2007 wurden 35 % des Bedarfs durch recyceltes Germanium gedeckt. ⓘ
| Jahr | Kosten ($/kg) |
|---|---|
| 1999 | 1,400 |
| 2000 | 1,250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1,240 |
| 2008 | 1,490 |
| 2009 | 950 |
| 2010 | 940 |
| 2011 | 1,625 |
| 2012 | 1,680 |
| 2013 | 1,875 |
| 2014 | 1,900 |
| 2015 | 1,760 |
| 2016 | 950 |
| 2017 | 1,358 |
| 2018 | 1,300 |
| 2019 | 1,240 |
| 2020 | 1,000 |
Germanium wird hauptsächlich aus Sphalerit gewonnen, ist aber auch in Silber-, Blei- und Kupfererzen enthalten. Eine weitere Quelle für Germanium ist Flugasche aus Kraftwerken, die mit germaniumhaltiger Kohle befeuert werden. Russland und China nutzen dies als Quelle für Germanium. Die russischen Vorkommen befinden sich im äußersten Osten der Insel Sachalin und nordöstlich von Wladiwostok. Die Vorkommen in China befinden sich hauptsächlich in den Braunkohlegruben bei Lincang, Yunnan; Kohle wird auch bei Xilinhaote, Innere Mongolei, abgebaut. ⓘ
Die Erzkonzentrate sind meist sulfidisch und werden durch Erhitzen an der Luft in die Oxide umgewandelt (Röstung):
- GeS2 + 3 O2 → GeO2 + 2 SO2 ⓘ
Ein Teil des Germaniums verbleibt im entstehenden Staub, während der Rest in Germanate umgewandelt wird, die dann (zusammen mit Zink) durch Schwefelsäure aus der Schlacke ausgelaugt werden. Nach der Neutralisation bleibt nur das Zink in Lösung, während Germanium und andere Metalle ausfallen. Nachdem ein Teil des Zinks im Niederschlag durch das Waelz-Verfahren entfernt wurde, wird das zurückbleibende Waelz-Oxid ein zweites Mal ausgelaugt. Das Dioxid wird als Niederschlag gewonnen und mit Chlorgas oder Salzsäure in Germaniumtetrachlorid umgewandelt, das einen niedrigen Siedepunkt hat und durch Destillation isoliert werden kann:
- GeO2 + 4 HCl → GeCl4 + 2 H2O
- GeO2 + 2 Cl2 → GeCl4 + O2 ⓘ
Germaniumtetrachlorid wird entweder zum Oxid (GeO2) hydrolysiert oder durch fraktionierte Destillation gereinigt und anschließend hydrolysiert. Das hochreine GeO2 ist nun für die Herstellung von Germaniumglas geeignet. Es wird durch Reaktion mit Wasserstoff zum Element reduziert, wobei Germanium entsteht, das für die Infrarotoptik und die Halbleiterproduktion geeignet ist:
- GeO2 + 2 H2 → Ge + 2 H2O ⓘ
Das Germanium für die Stahlherstellung und andere industrielle Prozesse wird normalerweise mit Kohlenstoff reduziert:
- GeO2 + C → Ge + CO2 ⓘ
Laut United States Geological Survey lag die Jahresproduktion 2014 bei geschätzten 165 t, davon 120 t in China, 2020 betrug die Raffinerieproduktion von Germanium weltweit ca. 140 t, wobei die USA ihre Produktionsmengen als Geschäftsgeheimnis nicht veröffentlichen. Der Preis für 1 kg Germanium betrug 2021 ca. 1.315 USD. Laut EU lag der Preis 2003 bei 300 USD je kg und stieg bis 2009 auf 1.000 USD. ⓘ
Die weltweiten Produktionsmengen verteilen sich wie folgt:
| Land | 2019 | 2020 ⓘ |
|---|---|---|
| (Raffinerieproduktion in Tonnen) | ||
| 86 | 95 | |
| 5 | 5 | |
| unbek. | unbek. | |
| Andere Länder | 40 | 40 |
| Gesamt (gerundet) | 131 | 140 |
Anwendungen
Die wichtigsten Endverwendungszwecke für Germanium wurden im Jahr 2007 weltweit auf folgende Bereiche geschätzt 35 % für die Faseroptik, 30 % für die Infrarotoptik, 15 % für Polymerisationskatalysatoren und 15 % für elektronische und solarelektrische Anwendungen. Die verbleibenden 5 % wurden unter anderem für Leuchtstoffe, in der Metallurgie und in der Chemotherapie verwendet. ⓘ
Optik
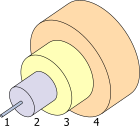
- Kern 8 µm
- Ummantelung 125 µm
- Puffer 250 µm
- Mantel 400 µm ⓘ
Die bemerkenswerten Eigenschaften von Germaniumoxid (GeO2) sind sein hoher Brechungsindex und seine geringe optische Dispersion. Dadurch eignet es sich besonders gut für Weitwinkel-Kameraobjektive, Mikroskopie und als Kernstück von Glasfasern. Es hat Titandioxid als Dotierstoff für Siliziumdioxidfasern ersetzt, wodurch die anschließende Wärmebehandlung, die die Fasern spröde macht, entfällt. Ende 2002 verbrauchte die faseroptische Industrie 60 % des jährlichen Germaniumverbrauchs in den Vereinigten Staaten, was jedoch weniger als 10 % des weltweiten Verbrauchs entspricht. GeSbTe ist ein Phasenwechselmaterial, das aufgrund seiner optischen Eigenschaften verwendet wird, wie z. B. in wiederbeschreibbaren DVDs. ⓘ
Da Germanium im infraroten Wellenlängenbereich transparent ist, ist es ein wichtiges optisches Material für den Infrarotbereich, das sich leicht zu Linsen und Fenstern schneiden und polieren lässt. Es wird vor allem als Frontoptik in Wärmebildkameras verwendet, die im Bereich von 8 bis 14 Mikrometern für die passive Wärmebildtechnik und für die Erkennung von Hotspots bei militärischen und mobilen Nachtsichtgeräten sowie bei der Brandbekämpfung arbeiten. Es wird in Infrarotspektroskopen und anderen optischen Geräten verwendet, die extrem empfindliche Infrarotdetektoren erfordern. Es hat einen sehr hohen Brechungsindex (4,0) und muss mit Antireflexionsmitteln beschichtet werden. Eine sehr harte Spezial-Antireflexionsbeschichtung aus diamantähnlichem Kohlenstoff (DLC) mit einem Brechungsindex von 2,0 ist besonders gut geeignet und erzeugt eine diamantharte Oberfläche, die vielen Umwelteinflüssen standhalten kann. ⓘ
Elektronik
Silizium-Germanium-Legierungen entwickeln sich rasch zu einem wichtigen Halbleitermaterial für integrierte Hochgeschwindigkeitsschaltungen. Schaltkreise, die die Eigenschaften von Si-SiGe-Verbindungen nutzen, können viel schneller sein als solche, die nur Silizium verwenden. Silizium-Germanium beginnt, Galliumarsenid (GaAs) in drahtlosen Kommunikationsgeräten zu ersetzen. Die SiGe-Chips mit ihren Hochgeschwindigkeitseigenschaften können mit den kostengünstigen, gut etablierten Produktionstechniken der Siliziumchipindustrie hergestellt werden. ⓘ
Solarzellen sind eine wichtige Anwendung von Germanium. Germanium ist das Substrat der Wafer für hocheffiziente photovoltaische Mehrfachzellen für Weltraumanwendungen. LEDs mit hoher Helligkeit, die in Autoscheinwerfern und zur Hintergrundbeleuchtung von LCD-Bildschirmen verwendet werden, sind eine wichtige Anwendung. ⓘ
Da Germanium und Galliumarsenid sehr ähnliche Gitterkonstanten haben, können Germanium-Substrate zur Herstellung von Galliumarsenid-Solarzellen verwendet werden. Die Mars Exploration Rover und mehrere Satelliten verwenden Galliumarsenid-Germanium-Zellen mit Dreifachübergang. ⓘ
Germanium-auf-Isolator (GeOI)-Substrate werden als potenzieller Ersatz für Silizium auf miniaturisierten Chips angesehen. Kürzlich wurde über CMOS-Schaltungen auf der Grundlage von GeOI-Substraten berichtet. Weitere Anwendungen in der Elektronik sind Leuchtstoffe in Leuchtstofflampen und Festkörper-Leuchtdioden (LEDs). Germaniumtransistoren werden immer noch in einigen Effektpedalen von Musikern verwendet, die den unverwechselbaren Klangcharakter des "Fuzz"-Tons aus der frühen Rock'n'Roll-Ära reproduzieren wollen, vor allem im Dallas Arbiter Fuzz Face. ⓘ
Andere Verwendungen
Germaniumdioxid wird auch in Katalysatoren für die Polymerisation bei der Herstellung von Polyethylenterephthalat (PET) verwendet. Der hohe Glanz dieses Polyesters wird vor allem für die in Japan vermarkteten PET-Flaschen bevorzugt. In den Vereinigten Staaten wird Germanium nicht für Polymerisationskatalysatoren verwendet. ⓘ
Aufgrund der Ähnlichkeit zwischen Kieselsäure (SiO2) und Germaniumdioxid (GeO2) kann die stationäre Phase aus Kieselsäure in einigen Gaschromatographiesäulen durch GeO2 ersetzt werden. ⓘ
In den letzten Jahren wurde Germanium zunehmend in Edelmetalllegierungen verwendet. In Sterlingsilberlegierungen verringert es zum Beispiel den Feuerkalk, erhöht die Anlaufbeständigkeit und verbessert die Ausscheidungshärtung. Eine anlaufsichere Silberlegierung mit dem Markennamen Argentium enthält 1,2 % Germanium. ⓘ
Halbleiterdetektoren aus hochreinem Germanium-Einkristall können Strahlungsquellen präzise identifizieren - zum Beispiel in der Flughafensicherheit. Germanium ist nützlich für Monochromatoren für Beamlines, die in der Einkristall-Neutronenstreuung und der Synchrotron-Röntgenbeugung eingesetzt werden. Das Reflexionsvermögen hat bei Neutronen- und Hochenergie-Röntgenanwendungen Vorteile gegenüber Silizium. Kristalle aus hochreinem Germanium werden in Detektoren für die Gammaspektroskopie und die Suche nach dunkler Materie verwendet. Germaniumkristalle werden auch in Röntgenspektrometern für die Bestimmung von Phosphor, Chlor und Schwefel verwendet. ⓘ
Germanium entwickelt sich zu einem wichtigen Material für die Spintronik und spinbasierte Quantencomputeranwendungen. Im Jahr 2010 wiesen Forscher den Spintransport bei Raumtemperatur nach, und vor kurzem wurde gezeigt, dass Donorelektronenspins in Germanium sehr lange Kohärenzzeiten haben. ⓘ
Germanium und Gesundheit
Germanium gilt nicht als wesentlich für die Gesundheit von Pflanzen oder Tieren. Germanium in der Umwelt hat nur geringe oder gar keine Auswirkungen auf die Gesundheit. Dies liegt vor allem daran, dass es in der Regel nur als Spurenelement in Erzen und kohlenstoffhaltigen Materialien vorkommt und bei den verschiedenen industriellen und elektronischen Anwendungen nur sehr geringe Mengen verwendet werden, die wahrscheinlich nicht verschluckt werden. Aus ähnlichen Gründen hat Germanium in der Endanwendung nur geringe Auswirkungen auf die Umwelt als biologische Gefahr. Einige reaktive Germanium-Zwischenverbindungen sind giftig (siehe Vorsichtsmaßnahmen, unten). ⓘ
Germanium-Präparate, die sowohl aus organischem als auch anorganischem Germanium hergestellt werden, sind als alternative Medizin zur Behandlung von Leukämie und Lungenkrebs vermarktet worden. Es gibt jedoch keine medizinischen Beweise für einen Nutzen; einige Beweise deuten darauf hin, dass solche Ergänzungsmittel aktiv schädlich sind. ⓘ
Einige Germaniumverbindungen wurden von Heilpraktikern als nicht von der FDA zugelassene injizierbare Lösungen verabreicht. Die anfangs verwendeten löslichen anorganischen Formen von Germanium, insbesondere das Citrat-Lactat-Salz, führten bei Personen, die sie über einen längeren Zeitraum einnahmen, zu einigen Fällen von Nierenfunktionsstörungen, Lebersteatose und peripheren Neuropathien. Die Germaniumkonzentrationen im Plasma und Urin dieser Personen, von denen mehrere starben, lagen um mehrere Größenordnungen über den endogenen Werten. Eine neuere organische Form, Beta-Carboxyethylgermanium-Sesquioxyd (Propermanium), wies nicht das gleiche Spektrum an toxischen Wirkungen auf. ⓘ
Untersuchungen der US-amerikanischen Food and Drug Administration haben ergeben, dass anorganisches Germanium bei Verwendung als Nahrungsergänzungsmittel eine potenzielle Gefahr für die menschliche Gesundheit darstellt". ⓘ
Bestimmte Germaniumverbindungen haben eine geringe Toxizität für Säugetiere, aber eine toxische Wirkung auf bestimmte Bakterien. ⓘ
Vorsichtsmaßnahmen bei chemisch reaktiven Germaniumverbindungen
Einige der künstlich hergestellten Germaniumverbindungen sind sehr reaktiv und stellen bei Exposition eine unmittelbare Gefahr für die menschliche Gesundheit dar. Germaniumchlorid und German (GeH4) beispielsweise sind flüssig bzw. gasförmig und können Augen, Haut, Lunge und Rachen stark reizen. ⓘ
Verwendung
Gläser und Fasern
Germanium wird für Infrarotoptiken in Form von Fenstern und Linsen aus monokristallinem Germanium eingesetzt. Einsatzgebiete für Germaniumlinsen sind Nachtsichtgeräte und Wärmebildkameras. Die früher übliche Verwendung als Fokussierlinse für die Laser-Materialbearbeitung mittels Kohlendioxid-Lasern sowie deren Austrittsfenster ist jedoch durch Zinkselenid abgelöst worden. Mit seinem hohen Brechungsindex von etwa 4 wird einkristallines Germanium auch in der FTIR/ATR-Spektroskopie (ATR-Infrarotspektroskopie) eingesetzt. Optische Gläser mit Infrarotdurchlässigkeit (Chalkogenidglas für Lichtwellenleiter) sind eine weitere Anwendung für Germanium als Bestandteil. ⓘ
Eine weitere Verwendung ist die Herstellung von Lichtwellenleitern: mit Hilfe von Germaniumtetrachlorid wird bei der chemischen Gasphasenabscheidung eine Anreicherung von Germaniumdioxid im inneren Faserkern erzeugt, wodurch im Vergleich zum Fasermantel ein höherer Brechungsindex im Kern gewährleistet wird. ⓘ
Bei der Polyester-Herstellung kommt Germaniumdioxid als Katalysator bei der Fertigung von Polyesterfasern und -granulaten zum Einsatz, speziell für PET-Flaschen. ⓘ
Nuklearmedizin und Kerntechnik
68Ge wird beim Gallium-68-Generator als Mutternuklid zur Herstellung von Gallium-68 verwendet. Ebenso findet 68Ge als Quelle zur Detektorkalibration bei der Positronen-Emissions-Tomographie Anwendung. ⓘ
Als hochreiner Einkristall wird Germanium als Strahlendetektor eingesetzt. ⓘ
Germanium in Nahrungsergänzungsmitteln
Die Substanz Bis(carboxyethyl)germaniumsesquioxid (Ge-132) ist als Nahrungsergänzungsmittel zur Anwendung bei einer Reihe von Erkrankungen einschließlich Krebs, chronischem Müdigkeitssyndrom, Immunschwäche, AIDS, Bluthochdruck, Arthritis und Lebensmittelallergien angepriesen worden. Positive Wirkungen auf den Krankheitsverlauf wurden bisher wissenschaftlich nicht nachgewiesen. ⓘ
Gemäß der europäischen Richtlinie 2002/46/EG zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Nahrungsergänzungsmittel soll Germanium nicht in Nahrungsergänzungsmitteln verwendet werden. In vielen Ländern der EU, die ihre nationalen Rechtsvorschriften bereits angeglichen haben, so auch Deutschland und Österreich, ist daher der Zusatz von Germanium als Mineralstoffquelle in Nahrungsergänzungsmitteln nicht erlaubt. ⓘ
Die zuständigen Behörden warnen ausdrücklich vor dem Verzehr von Ge-132, da schwere Gesundheitsschäden und Todesfälle nicht auszuschließen sind. ⓘ
Arzneiliche Verwendung von Germanium
Eine therapeutische Wirksamkeit der antineoplastischen Substanz Spirogermanium bei Krebserkrankungen wurde nicht nachgewiesen. Zugelassene Fertigarzneimittel mit dem Wirkstoff Spirogermanium gibt es nicht. In Deutschland gelten germaniumhaltige Arzneimittelanfertigungen (Rezepturen), abgesehen von homöopathischen Verdünnungen ab D4, als bedenklich. Ihre Herstellung und ihre Abgabe sind daher verboten. Germanium metallicum gibt es in Form homöopathischer Arzneimittel. Als Bestandteil homöopathischer Zubereitungen wird di-Kalium-Germanium-citrat-lactat beschrieben. ⓘ
Physiologie
Germanium und seine Verbindungen weisen eine relative geringe akute Toxizität auf. Spuren von Germanium sind in den folgenden Nahrungsmitteln enthalten: Bohnen, Tomatensaft, Austern, Thunfisch und Knoblauch. Es ist nach dem Stand der Wissenschaft kein essentielles Spurenelement. Es ist keine biologische Funktion für Germanium bekannt. Es sind keine Germanium-Mangelerkrankungen bekannt. ⓘ
Toxizität
Gesundheitsschäden durch Germanium traten bei Menschen mehrfach nach längerer Einnahme von Germaniumverbindungen als Nahrungsergänzungsmittel auf. Dabei kommt es zu Funktionsstörungen der Niere bis hin zum (irreversiblen) Nierenversagen, das für den Patienten letal sein kann. Periphere Neuropathie und andere neurologische Schäden als Folgeerkrankung sind ebenfalls berichtet. ⓘ
Aus Tierversuchen ist bekannt, dass Germanium eine geringe akute orale Toxizität hat. Bei Ratten liegt der LD50-Wert (die Dosis, bei der die Hälfte der Versuchstiere sterben) bei 3700 mg pro Kilogramm Körpergewicht. ⓘ
Nach derzeit vorliegenden Daten aus Tierversuchen ist Germanium nicht fruchtschädigend oder kanzerogen. ⓘ
Der Mechanismus der Toxizität von Germanium ist noch nicht vollständig geklärt. Spezifische pathologische Effekte an den Mitochondrien von verschiedenen Zellen wurden jedoch beobachtet. ⓘ
Wechselwirkungen
Es wird ebenfalls diskutiert, ob Germanium evtl. Wechselwirkungen mit Silicium im Knochen-Metabolismus zeigt. Es kann die Wirkung von Diuretika blockieren und die Aktivität einer Reihe von Enzymen herabsetzen bzw. blockieren, wie beispielsweise Dehydrogenasen. Im Tierversuch zeigen Mäuse eine erhöhte Hexabarbital-induzierte Schlafdauer, wenn sie zusätzlich mit Germaniumverbindungen behandelt wurden. Dies lässt darauf schließen, dass die Cytochrom-P450-Aktivität ebenfalls eingeschränkt wird. Es gibt Berichte über organische Germaniumverbindungen, welche das Entgiftungsenzym Glutathion-S-Transferase blockieren. ⓘ
Bioverfügbarkeit und Metabolismus
Germanium wird bei oraler Aufnahme sehr leicht vom Körper aufgenommen. Es verteilt sich dabei über das gesamte Körpergewebe, vornehmlich in den Nieren und der Schilddrüse. Organogermane akkumulieren dabei im Gegensatz zu anorganischen Germaniumverbindungen nicht im menschlichen Körper. Allerdings gibt es nur wenige Studien über den Germanium-Metabolismus. ⓘ
Es wird im Wesentlichen über den Urin ausgeschieden. Ausscheidung über Galle und Fäzes findet ebenso statt. ⓘ


