Elektron
 Wasserstoff-Atomorbitale auf verschiedenen Energieniveaus. In den undurchsichtigeren Bereichen ist es am wahrscheinlichsten, dass sich zu einem bestimmten Zeitpunkt ein Elektron befindet. | |
| Zusammensetzung | Elementarteilchen |
|---|---|
| Statistik | Fermionisch |
| Familie | Lepton |
| Generation | Erste |
| Wechselwirkungen | Schwerkraft, elektromagnetisch, schwach |
| Symbol | e- , β− |
| Antiteilchen | Positron |
| Theoretisch | Richard Laming (1838-1851), G. Johnstone Stoney (1874) und andere. |
| Entdeckt | J. J. Thomson (1897) |
| Masse | 9,1093837015(28)×10-31 kg 5,48579909070(16)×10-4 Da [1822.8884845(14)]-1 Da 0,51099895000(15) MeV/c2 |
| Mittlere Lebensdauer | stabil ( > 6,6×1028 Jahre) |
| Elektrische Ladung | -1 e -1.602176634×10-19 C -4,80320451(10)×10-10 esu |
| Magnetisches Moment | -1,00115965218091(26) µB |
| Spin | 1 /2 |
| Schwacher Isospin | LH: - 1 /2, RH: 0 |
| Schwache Hyperladung | LH: -1, RH: -2 |
| Standardmodell der Teilchenphysik ⓘ |
|---|
Das Elektron ist ein subatomares Teilchen (bezeichnet mit dem Symbol
e-
oder
β−
oder ), dessen elektrische Ladung eine negative Elementarladung ist.
Elektronen gehören zur ersten Generation der Leptonteilchenfamilie,
und werden im Allgemeinen als Elementarteilchen betrachtet, da sie keine bekannten Komponenten oder Substrukturen haben. Die Masse des Elektrons ist etwa 1836-mal kleiner als die des Protons. Zu den quantenmechanischen Eigenschaften des Elektrons gehört ein Eigendrehimpuls (Spin) mit einem halbzahligen Wert, ausgedrückt in Einheiten der reduzierten Planck-Konstante ħ. Da es sich um Fermionen handelt, können gemäß dem Pauli-Ausschlussprinzip keine zwei Elektronen denselben Quantenzustand einnehmen. Wie alle Elementarteilchen weisen Elektronen sowohl Teilchen- als auch Welleneigenschaften auf: Sie können mit anderen Teilchen zusammenstoßen und wie Licht gebeugt werden. Die Welleneigenschaften von Elektronen lassen sich mit Experimenten leichter beobachten als die anderer Teilchen wie Neutronen und Protonen, da Elektronen eine geringere Masse und damit eine größere de Broglie-Wellenlänge bei einer bestimmten Energie haben. ⓘ
Elektronen spielen eine wesentliche Rolle bei zahlreichen physikalischen Phänomenen wie Elektrizität, Magnetismus, Chemie und Wärmeleitfähigkeit, und sie sind auch an der Gravitation, den elektromagnetischen und schwachen Wechselwirkungen beteiligt. Da ein Elektron eine Ladung hat, umgibt es ein elektrisches Feld, und wenn sich dieses Elektron relativ zu einem Beobachter bewegt, wird dieser beobachten, dass es ein Magnetfeld erzeugt. Elektromagnetische Felder, die von anderen Quellen erzeugt werden, beeinflussen die Bewegung eines Elektrons gemäß dem Lorentz-Kraftgesetz. Elektronen strahlen Energie in Form von Photonen ab oder absorbieren sie, wenn sie beschleunigt werden. Laborgeräte sind in der Lage, sowohl einzelne Elektronen als auch Elektronenplasma mit Hilfe elektromagnetischer Felder einzufangen. Spezielle Teleskope können Elektronenplasmen im Weltraum aufspüren. Elektronen werden in vielen Bereichen eingesetzt, z. B. in der Tribologie oder Reibungsaufladung, der Elektrolyse, der Elektrochemie, der Batterietechnologie, der Elektronik, dem Schweißen, in Kathodenstrahlröhren, der Photoelektrizität, in photovoltaischen Solarzellen, in Elektronenmikroskopen, in der Strahlentherapie, in Lasern, in Gasionisationsdetektoren und in Teilchenbeschleunigern. ⓘ
Die Wechselwirkungen zwischen Elektronen und anderen subatomaren Teilchen sind in Bereichen wie der Chemie und der Kernphysik von Interesse. Die Coulomb-Kraft-Wechselwirkung zwischen den positiven Protonen in den Atomkernen und den negativen Elektronen außerhalb der Kerne ermöglicht die Zusammensetzung der beiden als Atome bekannten Elemente. Durch Ionisierung oder unterschiedliche Anteile negativer Elektronen und positiver Kerne ändert sich die Bindungsenergie eines atomaren Systems. Der Austausch oder die gemeinsame Nutzung von Elektronen zwischen zwei oder mehr Atomen ist die Hauptursache für chemische Bindungen. 1838 stellte der britische Naturphilosoph Richard Laming erstmals die Hypothese einer unteilbaren elektrischen Ladungsmenge auf, um die chemischen Eigenschaften der Atome zu erklären. Der irische Physiker George Johnstone Stoney gab dieser Ladung 1891 den Namen "Elektron", und J. J. Thomson und sein Team britischer Physiker wiesen sie 1897 beim Experiment mit der Kathodenstrahlröhre als Teilchen nach. Elektronen können auch an Kernreaktionen teilnehmen, z. B. an der Nukleosynthese in Sternen, wo sie als Betateilchen bekannt sind. Elektronen können durch den Betazerfall radioaktiver Isotope und bei hochenergetischen Kollisionen entstehen, z. B. wenn kosmische Strahlen in die Atmosphäre eindringen. Das Antiteilchen des Elektrons wird Positron genannt; es ist mit dem Elektron identisch, trägt aber eine elektrische Ladung mit umgekehrtem Vorzeichen. Wenn ein Elektron mit einem Positron zusammenstößt, können beide Teilchen vernichtet werden, wobei Gammastrahlenphotonen entstehen. ⓘ
Das Elektron (IPA: [ˈeːlɛktrɔn, eˈlɛk-, elɛkˈtroːn], ![]() anhören?/i,
anhören?/i, ![]() anhören?/i,
anhören?/i, ![]() anhören?/i; von altgriechisch ἤλεκτρον élektron „Bernstein“, an dem Elektrizität schon in der Antike untersucht wurde; 1874 von Stoney und Helmholtz geprägt) ist ein negativ geladenes Elementarteilchen. Sein Symbol ist e−. Die alternative Bezeichnung Negatron (aus negative Ladung und Elektron) wird kaum noch verwendet und ist allenfalls in der Beta-Spektroskopie gebräuchlich. ⓘ
anhören?/i; von altgriechisch ἤλεκτρον élektron „Bernstein“, an dem Elektrizität schon in der Antike untersucht wurde; 1874 von Stoney und Helmholtz geprägt) ist ein negativ geladenes Elementarteilchen. Sein Symbol ist e−. Die alternative Bezeichnung Negatron (aus negative Ladung und Elektron) wird kaum noch verwendet und ist allenfalls in der Beta-Spektroskopie gebräuchlich. ⓘ
Beim Beta-Minus-Zerfall eines Atomkerns wird ein Elektron neu erzeugt und ausgesandt. ⓘ
Der experimentelle Nachweis des Elektrons gelang erstmals Emil Wiechert im Jahre 1897 und wenig später Joseph John Thomson. ⓘ
Geschichte
Entdeckung der Wirkung der elektrischen Kraft
Die alten Griechen stellten fest, dass Bernstein kleine Gegenstände anzieht, wenn er mit einem Fell gerieben wird. Zusammen mit dem Blitz gehört dieses Phänomen zu den frühesten aufgezeichneten Erfahrungen der Menschheit mit Elektrizität. In seiner Abhandlung De Magnete aus dem Jahr 1600 prägte der englische Wissenschaftler William Gilbert den neulateinischen Begriff electrica, um jene Substanzen zu bezeichnen, die ähnliche Eigenschaften wie Bernstein haben und kleine Gegenstände anziehen, wenn sie an ihnen gerieben werden. Sowohl Elektro als auch Elektrizität leiten sich vom lateinischen ēlectrum (auch die Wurzel der gleichnamigen Legierung) ab, das aus dem griechischen Wort für Bernstein, ἤλεκτρον (ēlektron), stammt. ⓘ
Entdeckung von zwei Arten von Ladungen
Anfang des 17. Jahrhunderts stellte der französische Chemiker Charles François du Fay fest, dass ein geladenes Blattgold von Glas, das mit Seide gerieben wird, abgestoßen wird, während dasselbe geladene Blattgold von Bernstein, der mit Wolle gerieben wird, angezogen wird. Aus diesem und anderen Ergebnissen ähnlicher Experimente schloss du Fay, dass Elektrizität aus zwei elektrischen Flüssigkeiten besteht, der glasartigen Flüssigkeit von mit Seide geriebenem Glas und der harzartigen Flüssigkeit von mit Wolle geriebenem Bernstein. Diese beiden Flüssigkeiten können sich gegenseitig neutralisieren, wenn sie kombiniert werden. Der amerikanische Wissenschaftler Ebenezer Kinnersley kam später unabhängig davon ebenfalls zu diesem Schluss. Ein Jahrzehnt später schlug Benjamin Franklin vor, dass Elektrizität nicht aus verschiedenen Arten elektrischer Flüssigkeiten besteht, sondern aus einer einzigen elektrischen Flüssigkeit, die einen Überschuss (+) oder ein Defizit (-) aufweist. Er gab ihnen die modernen Bezeichnungen für die Ladungen: positiv und negativ. Franklin dachte, dass der Ladungsträger positiv sei, aber er erkannte nicht richtig, welche Situation ein Überschuss des Ladungsträgers und welche ein Defizit war. ⓘ
Zwischen 1838 und 1851 entwickelte der britische Naturphilosoph Richard Laming die Idee, dass ein Atom aus einem Materiekern besteht, der von subatomaren Teilchen mit einheitlichen elektrischen Ladungen umgeben ist. Ab 1846 stellte der deutsche Physiker Wilhelm Eduard Weber die Theorie auf, dass sich die Elektrizität aus positiv und negativ geladenen Flüssigkeiten zusammensetzt, deren Wechselwirkung durch das Gesetz des umgekehrten Quadrats bestimmt wird. Nach der Untersuchung des Phänomens der Elektrolyse im Jahr 1874 schlug der irische Physiker George Johnstone Stoney vor, dass es eine "einzige definitive Elektrizitätsmenge" gibt, die Ladung eines einwertigen Ions. Er war in der Lage, den Wert dieser Elementarladung e mit Hilfe der Faradayschen Elektrolysegesetze zu schätzen. Stoney glaubte jedoch, dass diese Ladungen dauerhaft an die Atome gebunden seien und nicht entfernt werden könnten. Im Jahr 1881 vertrat der deutsche Physiker Hermann von Helmholtz die Ansicht, dass sowohl positive als auch negative Ladungen in elementare Teile unterteilt sind, die sich jeweils "wie Atome der Elektrizität" verhalten. ⓘ
Stoney prägte 1881 zunächst den Begriff Elektrolion. Zehn Jahre später wechselte er zu Elektron, um diese Elementarladungen zu beschreiben, und schrieb 1894: "... es wurde eine Schätzung der tatsächlichen Menge dieser höchst bemerkenswerten Grundeinheit der Elektrizität vorgenommen, für die ich seither den Namen Elektron vorzuschlagen gewagt habe". Ein Vorschlag aus dem Jahr 1906, den Namen in Elektron zu ändern, scheiterte, weil Hendrik Lorentz es vorzog, Elektron zu behalten. Das Wort Elektron ist eine Kombination aus den Wörtern electric und ion. Die Endung -on, die heute zur Bezeichnung anderer subatomarer Teilchen wie Proton oder Neutron verwendet wird, leitet sich wiederum von Elektron ab. ⓘ
Entdeckung der freien Elektronen außerhalb der Materie

Bei der Untersuchung der elektrischen Leitfähigkeit in verdünnten Gasen beobachtete der deutsche Physiker Julius Plücker 1859, dass die von der Kathode ausgehende Strahlung ein phosphoreszierendes Licht an der Röhrenwand in der Nähe der Kathode hervorrief und dass der Bereich des phosphoreszierenden Lichts durch Anlegen eines Magnetfelds bewegt werden konnte. 1869 stellte Plückers Schüler Johann Wilhelm Hittorf fest, dass ein fester Körper zwischen der Kathode und dem phosphoreszierenden Licht einen Schatten auf den phosphoreszierenden Bereich der Röhre warf. Hittorf schloss daraus, dass von der Kathode gerade Strahlen ausgehen und dass die Phosphoreszenz durch das Auftreffen dieser Strahlen auf die Röhrenwände verursacht wird. 1876 wies der deutsche Physiker Eugen Goldstein nach, dass die Strahlen senkrecht zur Kathodenoberfläche emittiert werden, was eine Unterscheidung zwischen den Strahlen, die von der Kathode ausgehen, und dem Glühlicht ermöglichte. Goldstein bezeichnete die Strahlen als Kathodenstrahlen. Die jahrzehntelange experimentelle und theoretische Forschung im Bereich der Kathodenstrahlen war wichtig für J. J. Thomsons spätere Entdeckung der Elektronen. ⓘ
In den 1870er Jahren entwickelte der englische Chemiker und Physiker Sir William Crookes die erste Kathodenstrahlröhre mit einem Hochvakuum im Inneren. Er zeigte 1874, dass die Kathodenstrahlen ein kleines Schaufelrad in Bewegung setzen können, wenn sie sich in ihrem Weg befinden. Daraus schloss er, dass die Strahlen eine Eigendynamik haben. Außerdem konnte er durch Anlegen eines Magnetfeldes die Strahlen ablenken und so zeigen, dass sich der Strahl so verhielt, als sei er negativ geladen. 1879 schlug er vor, diese Eigenschaften dadurch zu erklären, dass Kathodenstrahlen aus negativ geladenen gasförmigen Molekülen in einem vierten Aggregatzustand bestehen, in dem die mittlere freie Weglänge der Teilchen so lang ist, dass Zusammenstöße vernachlässigt werden können. ⓘ
Der in Deutschland geborene britische Physiker Arthur Schuster erweiterte die Experimente von Crookes, indem er Metallplatten parallel zu den Kathodenstrahlen anordnete und zwischen den Platten ein elektrisches Feld anlegte. Das Feld lenkte die Strahlen in Richtung der positiv geladenen Platte ab und lieferte einen weiteren Beweis dafür, dass die Strahlen negativ geladen waren. Durch die Messung der Ablenkung bei einer bestimmten Stromstärke konnte Schuster 1890 das Verhältnis von Ladung zu Masse der Strahlenkomponenten schätzen. Allerdings ergab sich ein Wert, der mehr als das Tausendfache dessen betrug, was man erwartet hatte, so dass man seinen Berechnungen damals wenig Glauben schenkte. Denn man ging davon aus, dass es sich bei den Ladungsträgern um viel schwerere Wasserstoff- oder Stickstoffatome handelte. Später stellte sich heraus, dass Schusters Schätzungen weitgehend korrekt waren. ⓘ
1892 schlug Hendrik Lorentz vor, dass die Masse dieser Teilchen (Elektronen) eine Folge ihrer elektrischen Ladung sein könnte. ⓘ

Bei der Untersuchung von natürlich fluoreszierenden Mineralien entdeckte der französische Physiker Henri Becquerel 1896, dass sie Strahlung aussenden, ohne dass sie einer externen Energiequelle ausgesetzt sind. Diese radioaktiven Stoffe erregten das Interesse vieler Wissenschaftler, darunter auch des neuseeländischen Physikers Ernest Rutherford, der entdeckte, dass sie Teilchen aussenden. Er bezeichnete diese Teilchen aufgrund ihrer Fähigkeit, Materie zu durchdringen, als Alpha und Beta. Im Jahr 1900 wies Becquerel nach, dass die von Radium ausgesandten Betastrahlen durch ein elektrisches Feld abgelenkt werden können und dass ihr Masse-Ladungs-Verhältnis dasselbe ist wie bei Kathodenstrahlen. Dieser Beweis bestärkte die Ansicht, dass Elektronen als Bestandteile von Atomen existieren. ⓘ
1897 führte der britische Physiker J. J. Thomson zusammen mit seinen Kollegen John S. Townsend und H. A. Wilson Experimente durch, die zeigten, dass es sich bei Kathodenstrahlen tatsächlich um einzelne Teilchen handelt und nicht um Wellen, Atome oder Moleküle, wie bisher angenommen wurde. Thomson schätzte sowohl die Ladung e als auch die Masse m und stellte fest, dass die Kathodenstrahlteilchen, die er "Korpuskel" nannte, vielleicht ein Tausendstel der Masse des am wenigsten massereichen bekannten Ions hatten: Wasserstoff. Er zeigte, dass ihr Verhältnis von Ladung zu Masse, e/m, unabhängig vom Kathodenmaterial war. Außerdem zeigte er, dass die negativ geladenen Teilchen, die von radioaktiven Materialien, von erhitzten Materialien und von beleuchteten Materialien erzeugt werden, universell sind. Der Name Elektron wurde von der wissenschaftlichen Gemeinschaft für diese Teilchen übernommen, vor allem auf Anregung von G. F. FitzGerald, J. Larmor und H. A. Lorentz. Im selben Jahr berechneten auch Emil Wiechert und Walter Kaufmann das Verhältnis e/m, scheiterten jedoch an der Interpretation ihrer Ergebnisse, während J. J. Thomson 1899 ebenfalls Schätzungen für die Elektronenladung und -masse abgab: e~6,8×10-10 esu und m~3×10-26 g ⓘ

Die Ladung des Elektrons wurde von den amerikanischen Physikern Robert Millikan und Harvey Fletcher in ihrem Öltropfen-Experiment von 1909 genauer gemessen, dessen Ergebnisse 1911 veröffentlicht wurden. Bei diesem Experiment wurde ein elektrisches Feld verwendet, um zu verhindern, dass ein geladener Öltropfen aufgrund der Schwerkraft herunterfällt. Dieses Gerät konnte die elektrische Ladung von nur 1-150 Ionen mit einer Fehlerquote von weniger als 0,3 % messen. Vergleichbare Experimente waren zuvor von Thomsons Team mit Wolken geladener Wassertröpfchen durchgeführt worden, die durch Elektrolyse erzeugt wurden, und 1911 von Abram Ioffe, der unabhängig das gleiche Ergebnis wie Millikan mit geladenen Mikropartikeln aus Metallen erzielte und seine Ergebnisse 1913 veröffentlichte. Öltropfen waren jedoch stabiler als Wassertropfen, da sie langsamer verdampften, und daher für präzise Experimente über längere Zeiträume besser geeignet. ⓘ
Jahrhunderts fand man heraus, dass ein sich schnell bewegendes geladenes Teilchen unter bestimmten Bedingungen eine Kondensation von übersättigtem Wasserdampf entlang seiner Bahn verursacht. Charles Wilson nutzte dieses Prinzip 1911, um seine Nebelkammer zu entwickeln, mit der er die Spuren geladener Teilchen, wie z. B. sich schnell bewegende Elektronen, fotografieren konnte. ⓘ
Atomtheorie

Bis 1914 hatten die Experimente der Physiker Ernest Rutherford, Henry Moseley, James Franck und Gustav Hertz die Struktur eines Atoms als einen dichten Kern mit positiver Ladung, der von Elektronen mit geringerer Masse umgeben ist, weitgehend bestätigt. 1913 postulierte der dänische Physiker Niels Bohr, dass sich die Elektronen in quantisierten Energiezuständen befinden, deren Energie durch den Drehimpuls des Elektrons auf seiner Umlaufbahn um den Kern bestimmt wird. Die Elektronen können sich durch die Emission oder Absorption von Photonen bestimmter Frequenzen zwischen diesen Zuständen bzw. Bahnen bewegen. Mit Hilfe dieser quantisierten Bahnen konnte er die Spektrallinien des Wasserstoffatoms genau erklären. Allerdings konnte Bohrs Modell die relativen Intensitäten der Spektrallinien nicht erklären, und es war nicht in der Lage, die Spektren komplexerer Atome zu erklären. ⓘ
Chemische Bindungen zwischen Atomen wurden von Gilbert Newton Lewis erklärt, der 1916 vorschlug, dass eine kovalente Bindung zwischen zwei Atomen durch ein gemeinsames Elektronenpaar aufrechterhalten wird. Später, im Jahr 1927, erklärten Walter Heitler und Fritz London die Bildung von Elektronenpaaren und chemische Bindungen vollständig mit Hilfe der Quantenmechanik. 1919 entwickelte der amerikanische Chemiker Irving Langmuir das statische Lewis-Modell des Atoms weiter und schlug vor, dass alle Elektronen in aufeinanderfolgenden "konzentrischen (fast) kugelförmigen Schalen, die alle gleich dick sind", verteilt seien. Er unterteilte die Schalen wiederum in eine Reihe von Zellen, die jeweils ein Elektronenpaar enthielten. Mit diesem Modell konnte Langmuir die chemischen Eigenschaften aller Elemente im Periodensystem qualitativ erklären, von denen bekannt war, dass sie sich weitgehend nach dem Periodengesetz wiederholen. ⓘ
Im Jahr 1924 stellte der österreichische Physiker Wolfgang Pauli fest, dass die schalenartige Struktur des Atoms durch eine Reihe von vier Parametern erklärt werden kann, die jeden Quantenenergiezustand definieren, solange jeder Zustand nur von einem einzigen Elektron besetzt ist. Dieses Verbot, dass mehr als ein Elektron den gleichen Quantenenergiezustand einnimmt, wurde als Pauli-Ausschlussprinzip bekannt. Der physikalische Mechanismus zur Erklärung des vierten Parameters, der zwei unterschiedliche Werte annehmen konnte, wurde von den niederländischen Physikern Samuel Goudsmit und George Uhlenbeck entwickelt. Im Jahr 1925 schlugen sie vor, dass ein Elektron zusätzlich zum Drehimpuls seiner Bahn einen Eigendrehimpuls und ein magnetisches Dipolmoment besitzt. Dies ist vergleichbar mit der Drehung der Erde um ihre Achse, während sie die Sonne umkreist. Der Eigendrehimpuls wurde als Spin bekannt und erklärte die zuvor rätselhafte Aufspaltung der Spektrallinien, die mit einem hochauflösenden Spektrographen beobachtet wurde; dieses Phänomen ist als Feinstrukturaufspaltung bekannt. ⓘ
Quantenmechanik
In seiner Dissertation Recherches sur la théorie des quanta (Forschungen zur Quantentheorie) aus dem Jahr 1924 stellte der französische Physiker Louis de Broglie die Hypothese auf, dass sich alle Materie nach dem Vorbild des Lichts als de Broglie-Welle darstellen lässt. Das heißt, dass Elektronen und andere Materie unter den entsprechenden Bedingungen entweder die Eigenschaften von Teilchen oder von Wellen aufweisen würden. Die korpuskularen Eigenschaften eines Teilchens zeigen sich, wenn es entlang seiner Flugbahn zu einem bestimmten Zeitpunkt eine lokalisierte Position im Raum einnimmt. Der Wellencharakter des Lichts zeigt sich zum Beispiel, wenn ein Lichtstrahl durch parallele Schlitze geleitet wird und dabei Interferenzmuster erzeugt. Im Jahr 1927 entdeckte George Paget Thomson den Interferenzeffekt, wenn ein Elektronenstrahl durch dünne Metallfolien geleitet wurde, und die amerikanischen Physiker Clinton Davisson und Lester Germer entdeckten ihn bei der Reflexion von Elektronen an einem Nickelkristall. ⓘ

De Broglies Vorhersage eines Wellencharakters für Elektronen führte Erwin Schrödinger dazu, eine Wellengleichung für Elektronen zu postulieren, die sich unter dem Einfluss des Atomkerns bewegen. Im Jahr 1926 beschrieb diese Gleichung, die Schrödinger-Gleichung, erfolgreich die Ausbreitung von Elektronenwellen. Diese Wellengleichung lieferte nicht nur eine Lösung, die den Aufenthaltsort eines Elektrons im Laufe der Zeit bestimmte, sondern konnte auch zur Vorhersage der Wahrscheinlichkeit verwendet werden, ein Elektron in der Nähe einer Position zu finden, insbesondere einer Position in der Nähe des Ortes, an dem das Elektron im Raum gebunden war, für den sich die Elektronenwellengleichungen zeitlich nicht veränderten. Dieser Ansatz führte zu einer zweiten Formulierung der Quantenmechanik (die erste stammt von Heisenberg aus dem Jahr 1925), und die Lösungen der Schrödinger-Gleichung lieferten ebenso wie die von Heisenberg Ableitungen der Energiezustände eines Elektrons in einem Wasserstoffatom, die denen entsprachen, die zuerst von Bohr 1913 abgeleitet worden waren und von denen bekannt war, dass sie das Wasserstoffspektrum reproduzieren. Sobald der Spin und die Wechselwirkung zwischen mehreren Elektronen beschreibbar waren, ermöglichte die Quantenmechanik die Vorhersage der Elektronenkonfiguration in Atomen mit einer höheren Ordnungszahl als Wasserstoff. ⓘ
Aufbauend auf den Arbeiten von Wolfgang Pauli erstellte Paul Dirac 1928 ein Modell des Elektrons - die Dirac-Gleichung -, das mit der Relativitätstheorie vereinbar ist, indem er relativistische und Symmetrieüberlegungen auf die hamiltonsche Formulierung der Quantenmechanik des elektromagnetischen Feldes anwandte. Um einige Probleme innerhalb seiner relativistischen Gleichung zu lösen, entwickelte Dirac 1930 ein Modell des Vakuums als unendliches Meer von Teilchen mit negativer Energie, das später als Dirac-Meer bezeichnet wurde. Dies führte ihn zur Vorhersage der Existenz eines Positrons, des antimateriellen Gegenstücks des Elektrons. Dieses Teilchen wurde 1932 von Carl Anderson entdeckt, der vorschlug, das Standardelektron als Negatron zu bezeichnen und das Elektron als Oberbegriff zu verwenden, um sowohl die positiv als auch die negativ geladenen Varianten zu beschreiben. ⓘ
1947 stellte Willis Lamb in Zusammenarbeit mit seinem Doktoranden Robert Retherford fest, dass bestimmte Quantenzustände des Wasserstoffatoms, die eigentlich die gleiche Energie haben sollten, gegeneinander verschoben waren; dieser Unterschied wurde als Lamb-Verschiebung bezeichnet. Etwa zur gleichen Zeit entdeckte Polykarp Kusch in Zusammenarbeit mit Henry M. Foley, dass das magnetische Moment des Elektrons etwas größer ist als in der Dirac-Theorie vorhergesagt. Dieser kleine Unterschied wurde später als anomales magnetisches Dipolmoment des Elektrons bezeichnet. Dieser Unterschied wurde später durch die Theorie der Quantenelektrodynamik erklärt, die von Sin-Itiro Tomonaga, Julian Schwinger und Richard Feynman in den späten 1940er Jahren entwickelt wurde. ⓘ
Teilchenbeschleuniger
Mit der Entwicklung von Teilchenbeschleunigern in der ersten Hälfte des 20. Jahrhunderts begannen die Physiker, die Eigenschaften subatomarer Teilchen genauer zu erforschen. Der erste erfolgreiche Versuch, Elektronen durch elektromagnetische Induktion zu beschleunigen, wurde 1942 von Donald Kerst unternommen. Sein erstes Betatron erreichte Energien von 2,3 MeV, während spätere Betatrons 300 MeV erreichten. 1947 wurde die Synchrotronstrahlung mit einem 70 MeV-Elektronensynchrotron bei General Electric entdeckt. Diese Strahlung wurde durch die Beschleunigung von Elektronen durch ein Magnetfeld verursacht, während sie sich nahe der Lichtgeschwindigkeit bewegten. ⓘ
Mit einer Strahlenergie von 1,5 GeV war der erste Hochenergie Der erste Hochenergie-Teilchenbeschleuniger war ADONE, der 1968 seinen Betrieb aufnahm. Diese Anlage beschleunigte Elektronen und Positronen in entgegengesetzte Richtungen und verdoppelte damit die Energie ihrer Kollision im Vergleich zum Aufprall eines Elektrons auf ein statisches Ziel. Der Large Electron-Positron Collider (LEP) am CERN, der von 1989 bis 2000 in Betrieb war, erreichte Kollisionsenergien von 209 GeV und führte wichtige Messungen für das Standardmodell der Teilchenphysik durch. ⓘ
Einschluss von einzelnen Elektronen
Einzelne Elektronen lassen sich heute problemlos in ultrakleinen (L = 20 nm, B = 20 nm) CMOS-Transistoren einschließen, die bei kryogener Temperatur in einem Bereich von -269 °C (4 K) bis etwa -258 °C (15 K) betrieben werden. Die Elektronenwellenfunktion breitet sich in einem Halbleitergitter aus und interagiert kaum mit den Valenzbandelektronen, so dass sie im Einzelteilchenformalismus behandelt werden kann, indem ihre Masse durch den effektiven Massentensor ersetzt wird. ⓘ
Eigenschaften

In der Kathodenstrahlröhre (Braunsche Röhre) treten Elektronen aus einer beheizten Glühkathode aus und werden im Vakuum durch ein elektrisches Feld in Feldrichtung (in Richtung der positiven Anode) beschleunigt. Durch Magnetfelder werden die Elektronen senkrecht zur Feldrichtung und senkrecht zur augenblicklichen Flugrichtung abgelenkt (Lorentzkraft). Diese Eigenschaften der Elektronen haben erst die Entwicklung des Oszilloskops, des Fernsehers und des Computermonitors ermöglicht. ⓘ
Weitere Anwendungen freier Elektronen sind z. B. die Röntgenröhre, das Elektronenmikroskop, das Elektronenstrahlschweißen, physikalische Grundlagenforschung mittels Teilchenbeschleunigern und die Erzeugung von Synchrotronstrahlung für Forschungs- und technische Zwecke. Siehe dazu Elektronenstrahltechnik. ⓘ
Klassifizierung

Im Standardmodell der Teilchenphysik gehören Elektronen zur Gruppe der subatomaren Teilchen, die Leptonen genannt werden und als fundamentale Teilchen oder Elementarteilchen gelten. Elektronen haben die geringste Masse aller geladenen Leptonen (oder elektrisch geladenen Teilchen jeglicher Art) und gehören zur ersten Generation der fundamentalen Teilchen. Die zweite und dritte Generation umfasst geladene Leptonen, das Myon und das Tau, die in Bezug auf Ladung, Spin und Wechselwirkungen mit dem Elektron identisch sind, aber eine höhere Masse haben. Leptonen unterscheiden sich von den anderen Grundbausteinen der Materie, den Quarks, dadurch, dass sie keine starke Wechselwirkung haben. Alle Mitglieder der Leptonengruppe sind Fermionen, da sie alle einen halbzahligen Spin haben; das Elektron hat den Spin 1/2. ⓘ
Grundlegende Eigenschaften
Die unveränderliche Masse eines Elektrons beträgt etwa 9,109×10-31 Kilogramm oder 5,489×10-4 atomare Masseneinheiten. Aufgrund der Masse-Energie-Äquivalenz entspricht dies einer Ruheenergie von 0,511 MeV. Das Verhältnis zwischen der Masse eines Protons und der eines Elektrons beträgt etwa 1836. Astronomische Messungen zeigen, dass das Verhältnis zwischen Protonen- und Elektronenmasse seit mindestens der Hälfte des Alters des Universums den gleichen Wert hat, wie es das Standardmodell vorhersagt. ⓘ
Elektronen haben eine elektrische Ladung von -1,602176634×10-19 Coulomb, die als Standardeinheit für die Ladung subatomarer Teilchen verwendet und auch als Elementarladung bezeichnet wird. Innerhalb der Grenzen der experimentellen Genauigkeit ist die Elektronenladung identisch mit der Ladung eines Protons, allerdings mit umgekehrtem Vorzeichen. Da das Symbol e für die Elementarladung verwendet wird, wird das Elektron üblicherweise durch folgende Formel dargestellt
e-
symbolisiert, wobei das Minuszeichen für die negative Ladung steht. Das Positron wird symbolisiert durch
e+
symbolisiert, weil es die gleichen Eigenschaften wie das Elektron hat, aber eine positive statt einer negativen Ladung. ⓘ
Das Elektron hat einen Eigendrehimpuls oder Spin von 1/2. Diese Eigenschaft wird in der Regel durch die Bezeichnung des Elektrons als Spin-1/2-Teilchen ausgedrückt. Für solche Teilchen ist die Spingröße ħ/2, während das Ergebnis der Messung einer Projektion des Spins auf eine beliebige Achse nur ±ħ/2 sein kann. Zusätzlich zum Spin hat das Elektron ein intrinsisches magnetisches Moment entlang seiner Spinachse. Es ist ungefähr gleich einem Bohr-Magneton, einer physikalischen Konstante von 9,27400915(23)×10-24 Joule pro Tesla. Die Ausrichtung des Spins in Bezug auf den Impuls des Elektrons definiert die Eigenschaft von Elementarteilchen, die als Helizität bezeichnet wird. ⓘ
Das Elektron hat keine bekannte Substruktur. In der Physik der kondensierten Materie kann es jedoch in einigen Materialien zu einer Trennung von Spin und Ladung kommen. In solchen Fällen "spalten" sich die Elektronen in drei unabhängige Teilchen, das Spinon, das Orbiton und das Holon (oder Chargon). Das Elektron kann theoretisch immer als ein gebundener Zustand der drei betrachtet werden, wobei das Spinon den Spin des Elektrons, das Orbiton den orbitalen Freiheitsgrad und das Chargon die Ladung trägt, aber unter bestimmten Bedingungen können sie sich als unabhängige Quasiteilchen verhalten. ⓘ
Die Frage nach dem Radius des Elektrons ist ein schwieriges Problem der modernen theoretischen Physik. Die Annahme eines endlichen Radius des Elektrons ist mit den Prämissen der Relativitätstheorie unvereinbar. Andererseits führt ein punktförmiges Elektron (Radius Null) zu ernsthaften mathematischen Schwierigkeiten, da die Eigenenergie des Elektrons gegen unendlich tendiert. Die Beobachtung eines einzelnen Elektrons in einer Penning-Falle legt nahe, dass die Obergrenze des Radius des Teilchens bei 10-22 Metern liegt. Die Obergrenze des Elektronenradius von 10-18 Metern lässt sich mit Hilfe der Unschärferelation für die Energie ableiten. Es gibt auch eine physikalische Konstante, die als "klassischer Elektronenradius" bezeichnet wird und mit einem Wert von 2,8179×10-15 m viel größer ist als der Radius des Protons. Diese Bezeichnung beruht jedoch auf einer vereinfachten Berechnung, die die Auswirkungen der Quantenmechanik außer Acht lässt; in Wirklichkeit hat der so genannte klassische Elektronenradius nur wenig mit der tatsächlichen Grundstruktur des Elektrons zu tun. ⓘ
Es gibt Elementarteilchen, die spontan in weniger massive Teilchen zerfallen. Ein Beispiel ist das Myon mit einer mittleren Lebensdauer von 2,2×10-6 Sekunden, das in ein Elektron, ein Myon-Neutrino und ein Elektron-Antineutrino zerfällt. Das Elektron hingegen gilt aus theoretischen Gründen als stabil: Das Elektron ist das masseloseste Teilchen mit einer elektrischen Ladung ungleich Null, so dass sein Zerfall die Ladungserhaltung verletzen würde. Die experimentelle untere Grenze für die mittlere Lebensdauer des Elektrons liegt bei 6,6×1028 Jahren, bei einem Vertrauensniveau von 90 %. ⓘ
Quanteneigenschaften
Wie alle Teilchen können sich auch Elektronen als Wellen verhalten. Dies wird als Welle-Teilchen-Dualismus bezeichnet und kann mit Hilfe des Doppelspaltexperiments nachgewiesen werden. ⓘ
Der Wellencharakter des Elektrons ermöglicht es ihm, zwei parallele Spaltöffnungen gleichzeitig zu passieren und nicht nur einen Spalt, wie es bei einem klassischen Teilchen der Fall wäre. In der Quantenmechanik kann die wellenartige Eigenschaft eines Teilchens mathematisch als komplexwertige Funktion beschrieben werden, die Wellenfunktion, die üblicherweise mit dem griechischen Buchstaben psi (ψ) bezeichnet wird. Wenn der Absolutwert dieser Funktion quadriert wird, ergibt sich die Wahrscheinlichkeit, dass ein Teilchen in der Nähe eines Ortes beobachtet wird - die Wahrscheinlichkeitsdichte. ⓘ
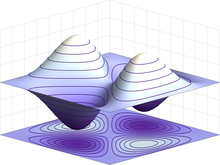
Elektronen sind identische Teilchen, weil sie sich durch ihre intrinsischen physikalischen Eigenschaften nicht voneinander unterscheiden lassen. In der Quantenmechanik bedeutet dies, dass ein Paar wechselwirkender Elektronen in der Lage sein muss, die Positionen zu tauschen, ohne dass sich der Zustand des Systems merklich ändert. Die Wellenfunktion von Fermionen, zu denen auch Elektronen gehören, ist antisymmetrisch, d. h. sie wechselt das Vorzeichen, wenn zwei Elektronen vertauscht werden, d. h. ψ(r1, r2) = -ψ(r2, r1), wobei die Variablen r1 und r2 dem ersten bzw. zweiten Elektron entsprechen. Da der Absolutwert durch einen Vorzeichentausch nicht verändert wird, entspricht dies gleichen Wahrscheinlichkeiten. Bosonen, wie z. B. das Photon, haben dagegen symmetrische Wellenfunktionen. ⓘ
Im Falle von Antisymmetrie führen Lösungen der Wellengleichung für wechselwirkende Elektronen zu einer Wahrscheinlichkeit von Null, dass jedes Paar denselben Ort oder Zustand einnimmt. Dies ist der Grund für das Pauli-Ausschlussprinzip, das es ausschließt, dass zwei Elektronen denselben Quantenzustand einnehmen. Dieses Prinzip erklärt viele der Eigenschaften von Elektronen. Es führt beispielsweise dazu, dass Gruppen von gebundenen Elektronen verschiedene Orbitale in einem Atom besetzen und sich nicht alle im selben Orbit überlagern. ⓘ
Virtuelle Teilchen
In einer vereinfachten Darstellung, die oft eine falsche Vorstellung vermittelt, aber zur Veranschaulichung einiger Aspekte dienen kann, verbringt jedes Photon einige Zeit als Kombination aus einem virtuellen Elektron und seinem Antiteilchen, dem virtuellen Positron, die sich kurz darauf gegenseitig vernichten. Die Kombination aus der Energieänderung, die zur Erzeugung dieser Teilchen erforderlich ist, und der Zeit, in der sie existieren, fällt unter die Schwelle der Nachweisbarkeit, die durch die Heisenbergsche Unschärferelation ΔE - Δt ≥ ħ ausgedrückt wird. Die zur Erzeugung dieser virtuellen Teilchen benötigte Energie, ΔE, kann für eine Zeitspanne, Δt, aus dem Vakuum "geliehen" werden, so dass ihr Produkt nicht mehr als die reduzierte Planck-Konstante, ħ ≈ 6,6×10-16 eV-s, beträgt. Somit beträgt Δt für ein virtuelles Elektron höchstens 1,3×10-21 s. ⓘ

Während ein virtuelles Elektron-Positron-Paar existiert, bewirkt die Coulomb-Kraft des elektrischen Feldes, das ein Elektron umgibt, dass ein erzeugtes Positron von dem ursprünglichen Elektron angezogen wird, während ein erzeugtes Elektron abgestoßen wird. Dies verursacht die so genannte Vakuumpolarisation. In der Tat verhält sich das Vakuum wie ein Medium mit einer Dielektrizitätskonstante von mehr als eins. Die effektive Ladung eines Elektrons ist also kleiner als ihr tatsächlicher Wert, und die Ladung nimmt mit zunehmendem Abstand vom Elektron ab. Diese Polarisierung wurde 1997 mit dem japanischen Teilchenbeschleuniger TRISTAN experimentell bestätigt. Virtuelle Teilchen bewirken einen vergleichbaren Abschirmeffekt für die Masse des Elektrons. ⓘ
Die Wechselwirkung mit virtuellen Teilchen erklärt auch die geringe (etwa 0,1 %) Abweichung des intrinsischen magnetischen Moments des Elektrons vom Bohr-Magneton (das anomale magnetische Moment). Die außerordentlich genaue Übereinstimmung dieser vorhergesagten Differenz mit dem experimentell ermittelten Wert wird als eine der großen Errungenschaften der Quantenelektrodynamik angesehen. ⓘ
Das scheinbare Paradoxon der klassischen Physik, dass ein Punktteilchen Elektron einen Eigendrehimpuls und ein magnetisches Moment besitzt, lässt sich durch die Bildung virtueller Photonen in dem vom Elektron erzeugten elektrischen Feld erklären. Diese Photonen können heuristisch betrachtet dazu führen, dass sich das Elektron auf unruhige Weise bewegt (bekannt als Zitterbewegung), was zu einer Nettokreisbewegung mit Präzession führt. Diese Bewegung erzeugt sowohl den Spin als auch das magnetische Moment des Elektrons. In Atomen erklärt diese Erzeugung virtueller Photonen die in Spektrallinien beobachtete Lamb-Verschiebung. Die Compton-Wellenlänge zeigt, dass die Unsicherheit der Energie in der Nähe von Elementarteilchen wie dem Elektron die Entstehung virtueller Teilchen in der Nähe des Elektrons ermöglicht. Diese Wellenlänge erklärt die "Statik" virtueller Teilchen in der Nähe von Elementarteilchen in geringem Abstand. ⓘ
Wechselwirkung
Ein Elektron erzeugt ein elektrisches Feld, das eine anziehende Kraft auf ein Teilchen mit einer positiven Ladung, wie das Proton, und eine abstoßende Kraft auf ein Teilchen mit einer negativen Ladung ausübt. Die Stärke dieser Kraft wird in nichtrelativistischer Näherung durch das Coulombsche Gesetz zum Quadrat bestimmt. Wenn ein Elektron in Bewegung ist, erzeugt es ein Magnetfeld. Das Ampère-Maxwell-Gesetz setzt das Magnetfeld in Beziehung zur Massenbewegung der Elektronen (dem Strom) in Bezug auf einen Beobachter. Diese Eigenschaft der Induktion liefert das Magnetfeld, das einen Elektromotor antreibt. Das elektromagnetische Feld eines beliebig bewegten geladenen Teilchens wird durch die Liénard-Wiechert-Potentiale ausgedrückt, die auch dann gelten, wenn die Geschwindigkeit des Teilchens nahe der Lichtgeschwindigkeit liegt (relativistisch). ⓘ
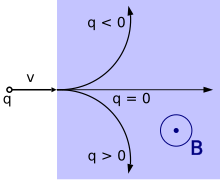
Wenn sich ein Elektron durch ein Magnetfeld bewegt, unterliegt es der Lorentz-Kraft, die senkrecht zur Ebene wirkt, die durch das Magnetfeld und die Geschwindigkeit des Elektrons definiert ist. Diese Zentripetalkraft bewirkt, dass das Elektron eine spiralförmige Bahn durch das Feld mit einem Radius, dem so genannten Gyroradius, beschreibt. Die Beschleunigung dieser gekrümmten Bewegung veranlasst das Elektron, Energie in Form von Synchrotronstrahlung abzustrahlen. Diese Energieabstrahlung wiederum verursacht einen Rückstoß des Elektrons, der als Abraham-Lorentz-Dirac-Kraft bekannt ist und eine Reibung erzeugt, die das Elektron verlangsamt. Diese Kraft wird durch eine Rückwirkung des eigenen Feldes des Elektrons auf sich selbst verursacht. ⓘ
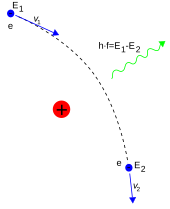
In der Quantenelektrodynamik vermitteln Photonen die elektromagnetischen Wechselwirkungen zwischen Teilchen. Ein isoliertes Elektron mit konstanter Geschwindigkeit kann kein reales Photon aussenden oder absorbieren; dies würde gegen die Energie- und Impulserhaltung verstoßen. Stattdessen können virtuelle Photonen den Impuls zwischen zwei geladenen Teilchen übertragen. Dieser Austausch virtueller Photonen erzeugt zum Beispiel die Coulomb-Kraft. Zu einer Energieabgabe kann es kommen, wenn ein sich bewegendes Elektron von einem geladenen Teilchen, z. B. einem Proton, abgelenkt wird. Die Beschleunigung des Elektrons führt zur Emission von Bremsstrahlung. ⓘ
Ein unelastischer Zusammenstoß zwischen einem Photon (Licht) und einem einzelnen (freien) Elektron wird als Compton-Streuung bezeichnet. Bei diesem Zusammenstoß kommt es zu einem Impuls- und Energietransfer zwischen den Teilchen, wodurch sich die Wellenlänge des Photons um einen Betrag ändert, der als Compton-Verschiebung bezeichnet wird. Der Maximalwert dieser Wellenlängenverschiebung ist h/mec, was als Compton-Wellenlänge bezeichnet wird. Für ein Elektron hat sie einen Wert von 2,43×10-12 m. Wenn die Wellenlänge des Lichts lang ist (z. B. beträgt die Wellenlänge des sichtbaren Lichts 0,4-0,7 μm), wird die Wellenlängenverschiebung vernachlässigbar. Diese Wechselwirkung zwischen dem Licht und den freien Elektronen wird als Thomson-Streuung oder lineare Thomson-Streuung bezeichnet. ⓘ
Die relative Stärke der elektromagnetischen Wechselwirkung zwischen zwei geladenen Teilchen, z. B. einem Elektron und einem Proton, ist durch die Feinstrukturkonstante gegeben. Dieser Wert ist eine dimensionslose Größe, die aus dem Verhältnis zweier Energien gebildet wird: der elektrostatischen Energie der Anziehung (oder Abstoßung) bei einem Abstand von einer Compton-Wellenlänge und der Ruheenergie der Ladung. Sie ist gegeben durch α ≈ 7,297353×10-3, was ungefähr 1/137 entspricht. ⓘ
Wenn Elektronen und Positronen zusammenstoßen, annihilieren sie sich gegenseitig, wobei zwei oder mehr Gammastrahlenphotonen entstehen. Wenn Elektron und Positron einen vernachlässigbaren Impuls haben, kann sich ein Positroniumatom bilden, bevor die Annihilation zu zwei oder drei Gammaphotonen von insgesamt 1,022 MeV führt. Andererseits kann sich ein hochenergetisches Photon durch einen als Paarbildung bezeichneten Prozess in ein Elektron und ein Positron umwandeln, allerdings nur in Anwesenheit eines geladenen Teilchens in der Nähe, z. B. eines Atomkerns. ⓘ
In der Theorie der elektroschwachen Wechselwirkung bildet die linkshändige Komponente der Elektronenwellenfunktion ein schwaches Isospin-Doublett mit dem Elektronenneutrino. Das bedeutet, dass sich Elektronenneutrinos bei schwachen Wechselwirkungen wie Elektronen verhalten. Jedes Mitglied dieses Dubletts kann eine Wechselwirkung mit geladenem Strom eingehen, indem es ein
W
emittieren oder absorbieren und in das andere Element umgewandelt werden. Die Ladung bleibt bei dieser Reaktion erhalten, da das W-Boson ebenfalls eine Ladung trägt, die jede Nettoveränderung während der Transmutation aufhebt. Geladene Stromwechselwirkungen sind für das Phänomen des Betazerfalls in einem radioaktiven Atom verantwortlich. Sowohl das Elektron als auch das Elektron-Neutrino können eine neutrale Stromwechselwirkung über eine
Z0
Austausch eine neutrale Wechselwirkung eingehen, die für die elastische Neutrino-Elektronen-Streuung verantwortlich ist. ⓘ
Atome und Moleküle
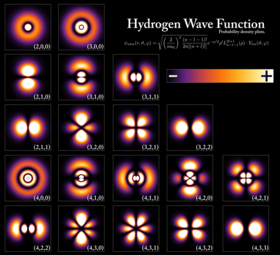
Ein Elektron kann durch die anziehende Coulomb-Kraft an den Kern eines Atoms gebunden werden. Ein System aus einem oder mehreren Elektronen, die an einen Kern gebunden sind, nennt man ein Atom. Wenn die Anzahl der Elektronen von der elektrischen Ladung des Kerns abweicht, nennt man ein solches Atom ein Ion. Das wellenförmige Verhalten eines gebundenen Elektrons wird durch eine Funktion beschrieben, die als Atomorbital bezeichnet wird. Jedes Orbital hat einen eigenen Satz von Quantenzahlen wie Energie, Drehimpuls und Projektion des Drehimpulses, und es gibt nur einen diskreten Satz dieser Orbitale um den Kern. Nach dem Pauli-Ausschlussprinzip kann jedes Orbital von bis zu zwei Elektronen besetzt werden, die sich in ihrer Spin-Quantenzahl unterscheiden müssen. ⓘ
Elektronen können durch die Emission oder Absorption von Photonen mit einer Energie, die dem Potenzialunterschied entspricht, zwischen verschiedenen Orbitalen wechseln. Andere Methoden des Orbitalwechsels sind Zusammenstöße mit Teilchen, wie z. B. Elektronen, und der Auger-Effekt. Um dem Atom zu entkommen, muss die Energie des Elektrons über seine Bindungsenergie an das Atom hinaus erhöht werden. Dies geschieht beispielsweise durch den photoelektrischen Effekt, bei dem ein einfallendes Photon, das die Ionisierungsenergie des Atoms überschreitet, vom Elektron absorbiert wird. ⓘ
Der Bahndrehimpuls von Elektronen ist quantisiert. Da das Elektron geladen ist, erzeugt es ein magnetisches Bahnmoment, das proportional zum Drehimpuls ist. Das magnetische Nettomoment eines Atoms ist gleich der Vektorsumme der Bahn- und Spinmomente aller Elektronen und des Kerns. Das magnetische Moment des Kerns ist im Vergleich zu dem der Elektronen vernachlässigbar. Die magnetischen Momente der Elektronen, die das gleiche Orbital besetzen (so genannte gepaarte Elektronen), heben sich gegenseitig auf. ⓘ
Die chemische Bindung zwischen Atomen entsteht durch elektromagnetische Wechselwirkungen, die durch die Gesetze der Quantenmechanik beschrieben werden. Die stärksten Bindungen entstehen durch den Austausch oder die Übertragung von Elektronen zwischen Atomen, wodurch die Bildung von Molekülen ermöglicht wird. Innerhalb eines Moleküls bewegen sich die Elektronen unter dem Einfluss mehrerer Kerne und besetzen Molekülorbitale, ähnlich wie sie in isolierten Atomen Atomorbitale besetzen können. Ein grundlegender Faktor in diesen Molekülstrukturen ist die Existenz von Elektronenpaaren. Dabei handelt es sich um Elektronen mit entgegengesetzten Spins, die dasselbe Molekülorbital besetzen können, ohne das Pauli-Ausschlussprinzip zu verletzen (ähnlich wie in Atomen). Verschiedene Molekülorbitale weisen eine unterschiedliche räumliche Verteilung der Elektronendichte auf. In gebundenen Paaren (d. h. in den Paaren, die die Atome tatsächlich miteinander verbinden) sind die Elektronen beispielsweise mit maximaler Wahrscheinlichkeit in einem relativ kleinen Volumen zwischen den Kernen zu finden. Im Gegensatz dazu sind die Elektronen bei nicht gebundenen Paaren in einem großen Volumen um die Kerne herum verteilt. ⓘ
Leitfähigkeit

Verfügt ein Körper über mehr oder weniger Elektronen, als zum Ausgleich der positiven Ladung der Kerne erforderlich sind, so hat das Objekt eine elektrische Nettoladung. Bei einem Überschuss an Elektronen wird das Objekt als negativ geladen bezeichnet. Wenn es weniger Elektronen als Protonen in den Kernen gibt, ist das Objekt positiv geladen. Wenn die Anzahl der Elektronen und der Protonen gleich ist, heben sich die Ladungen gegenseitig auf und das Objekt ist elektrisch neutral. Ein makroskopischer Körper kann durch Reibung eine elektrische Ladung erhalten, und zwar durch den triboelektrischen Effekt. ⓘ
Unabhängige Elektronen, die sich im Vakuum bewegen, werden als freie Elektronen bezeichnet. Auch die Elektronen in Metallen verhalten sich so, als ob sie frei wären. In Wirklichkeit handelt es sich bei den Teilchen, die in Metallen und anderen Festkörpern gemeinhin als Elektronen bezeichnet werden, um Quasi-Elektronen - Quasiteilchen, die dieselbe elektrische Ladung, denselben Spin und dasselbe magnetische Moment haben wie echte Elektronen, aber möglicherweise eine andere Masse aufweisen. Wenn sich freie Elektronen - sowohl im Vakuum als auch in Metallen - bewegen, erzeugen sie einen Nettoladungsfluss, den so genannten elektrischen Strom, der ein Magnetfeld erzeugt. Ebenso kann ein Strom durch ein wechselndes Magnetfeld erzeugt werden. Diese Wechselwirkungen werden mathematisch durch die Maxwellschen Gleichungen beschrieben. ⓘ
Bei einer bestimmten Temperatur hat jedes Material eine elektrische Leitfähigkeit, die den Wert des elektrischen Stroms bestimmt, wenn eine elektrische Spannung angelegt wird. Beispiele für gute Leiter sind Metalle wie Kupfer und Gold, während Glas und Teflon schlechte Leiter sind. In jedem dielektrischen Material bleiben die Elektronen an ihre jeweiligen Atome gebunden und das Material verhält sich wie ein Isolator. Die meisten Halbleiter haben einen variablen Leitfähigkeitsgrad, der zwischen den Extremen von Leitfähigkeit und Isolation liegt. Metalle hingegen haben eine elektronische Bandstruktur mit teilweise gefüllten Elektronenbändern. Das Vorhandensein solcher Bänder ermöglicht es den Elektronen in Metallen, sich so zu verhalten, als wären sie freie oder delokalisierte Elektronen. Diese Elektronen sind nicht mit bestimmten Atomen verbunden, so dass sie sich beim Anlegen eines elektrischen Feldes frei wie ein Gas (das so genannte Fermi-Gas) durch das Material bewegen können, ähnlich wie freie Elektronen. ⓘ
Aufgrund von Zusammenstößen zwischen Elektronen und Atomen liegt die Driftgeschwindigkeit von Elektronen in einem Leiter in der Größenordnung von Millimetern pro Sekunde. Die Geschwindigkeit, mit der eine Stromänderung an einem Punkt des Materials Änderungen der Ströme in anderen Teilen des Materials bewirkt, die Ausbreitungsgeschwindigkeit, beträgt jedoch in der Regel etwa 75 % der Lichtgeschwindigkeit. Dies ist darauf zurückzuführen, dass sich elektrische Signale als Wellen ausbreiten, wobei die Geschwindigkeit von der Dielektrizitätskonstante des Materials abhängt. ⓘ
Metalle sind relativ gute Wärmeleiter, vor allem weil die delokalisierten Elektronen frei sind, um Wärmeenergie zwischen den Atomen zu transportieren. Im Gegensatz zur elektrischen Leitfähigkeit ist die Wärmeleitfähigkeit eines Metalls jedoch nahezu unabhängig von der Temperatur. Dies wird mathematisch durch das Wiedemann-Franz-Gesetz ausgedrückt, das besagt, dass das Verhältnis der Wärmeleitfähigkeit zur elektrischen Leitfähigkeit proportional zur Temperatur ist. Die thermische Unordnung im Metallgitter erhöht den elektrischen Widerstand des Materials, wodurch eine Temperaturabhängigkeit des elektrischen Stroms entsteht. ⓘ
Bei Abkühlung unter einen Punkt, der als kritische Temperatur bezeichnet wird, können Materialien einen Phasenübergang durchlaufen, bei dem sie jeglichen Widerstand gegen elektrischen Strom verlieren, ein Prozess, der als Supraleitung bekannt ist. In der BCS-Theorie ist die Bewegung von Elektronenpaaren, den so genannten Cooper-Paaren, über Gitterschwingungen, die so genannten Phononen, an die benachbarte Materie gekoppelt, wodurch die Kollisionen mit Atomen vermieden werden, die normalerweise einen elektrischen Widerstand erzeugen. (Cooper-Paare haben einen Radius von etwa 100 nm, so dass sie sich gegenseitig überlappen können.) Der Mechanismus, nach dem Supraleiter bei höheren Temperaturen funktionieren, ist jedoch noch unklar. ⓘ
Elektronen in leitenden Festkörpern, die selbst Quasiteilchen sind, verhalten sich, wenn sie bei Temperaturen nahe dem absoluten Nullpunkt fest eingeschlossen sind, so, als hätten sie sich in drei andere Quasiteilchen aufgespalten: Spinonen, Orbitonen und Holonen. Das erste ist Träger von Spin und magnetischem Moment, das zweite trägt seine Orbitalposition und das dritte elektrische Ladung. ⓘ
Bewegung und Energie
Nach Einsteins Spezieller Relativitätstheorie nimmt die relativistische Masse eines Elektrons aus der Sicht eines Beobachters zu, je mehr es sich der Lichtgeschwindigkeit nähert, so dass es immer schwieriger wird, es innerhalb des Bezugssystems des Beobachters zu beschleunigen. Die Geschwindigkeit eines Elektrons kann sich der Lichtgeschwindigkeit c im Vakuum annähern, sie aber nie erreichen. Wenn jedoch relativistische Elektronen - d. h. Elektronen, die sich mit einer Geschwindigkeit nahe c bewegen - in ein dielektrisches Medium wie Wasser injiziert werden, in dem die lokale Lichtgeschwindigkeit deutlich unter c liegt, bewegen sich die Elektronen vorübergehend schneller als das Licht im Medium. Bei der Wechselwirkung mit dem Medium erzeugen sie ein schwaches Licht, die so genannte Cherenkov-Strahlung. ⓘ

Die Auswirkungen der Speziellen Relativitätstheorie beruhen auf einer Größe, die als Lorentz-Faktor bekannt ist und wie folgt definiert ist wobei v die Geschwindigkeit des Teilchens ist. Die kinetische Energie Ke eines Elektrons, das sich mit der Geschwindigkeit v bewegt, ist:
wobei me die Masse des Elektrons ist. Der Stanford-Linearbeschleuniger kann beispielsweise ein Elektron auf etwa 51 GeV beschleunigen. Da sich ein Elektron wie eine Welle verhält, hat es bei einer bestimmten Geschwindigkeit eine charakteristische de Broglie-Wellenlänge. Diese ist gegeben durch λe = h/p, wobei h die Planck-Konstante und p der Impuls ist. Für das obige 51-GeV-Elektron beträgt die Wellenlänge etwa 2,4×10-17 m, was klein genug ist, um Strukturen weit unterhalb der Größe eines Atomkerns zu erforschen. ⓘ
Bildung

Die Urknalltheorie ist die am weitesten akzeptierte wissenschaftliche Theorie zur Erklärung der frühen Phasen der Entwicklung des Universums. In der ersten Millisekunde des Urknalls herrschten Temperaturen von über 10 Milliarden Kelvin und Photonen hatten eine mittlere Energie von über einer Million Elektronenvolt. Diese Photonen waren so energiereich, dass sie miteinander reagieren und Elektronen- und Positronenpaare bilden konnten. Ebenso vernichteten sich Positron-Elektron-Paare gegenseitig und gaben energiereiche Photonen ab:
γ
+
γ
↔
e+
+
e-
In dieser Phase der Entwicklung des Universums herrschte ein Gleichgewicht zwischen Elektronen, Positronen und Photonen. Nach Ablauf von 15 Sekunden sank die Temperatur des Universums jedoch unter die Schwelle, bei der die Bildung von Elektronen und Positronen stattfinden konnte. Die meisten der überlebenden Elektronen und Positronen löschten sich gegenseitig aus und setzten dabei Gammastrahlung frei, die das Universum kurzzeitig wieder aufheizte. ⓘ
Aus noch ungeklärten Gründen kam es während des Annihilationsprozesses zu einem Überschuss an Teilchen gegenüber Antiteilchen. So überlebte etwa ein Elektron von einer Milliarde Elektron-Positron-Paaren. Dieser Überschuss entsprach dem Überschuss an Protonen gegenüber Antiprotonen, was als baryonische Asymmetrie bezeichnet wird und zu einer Nettoladung von Null für das Universum führte. Die überlebenden Protonen und Neutronen begannen, miteinander zu reagieren - ein Prozess, der als Nukleosynthese bekannt ist und Isotope von Wasserstoff und Helium sowie Spuren von Lithium bildete. Dieser Prozess erreichte nach etwa fünf Minuten seinen Höhepunkt. Die übrig gebliebenen Neutronen unterlagen einem negativen Betazerfall mit einer Halbwertszeit von etwa tausend Sekunden, wobei ein Proton und ein Elektron freigesetzt wurden,
n
→
p
+
e-
+
ν
e
Etwa 300000-400000 Jahre lang blieben die überschüssigen Elektronen zu energiereich, um sich mit den Atomkernen zu verbinden. Es folgte eine als Rekombination bekannte Periode, in der sich neutrale Atome bildeten und das expandierende Universum für Strahlung transparent wurde. ⓘ
Ungefähr eine Million Jahre nach dem Urknall begann die erste Generation von Sternen zu entstehen. Im Inneren eines Sterns werden bei der Nukleosynthese durch die Verschmelzung von Atomkernen Positronen erzeugt. Diese Antimaterieteilchen vernichten sich sofort mit Elektronen und setzen dabei Gammastrahlen frei. Das Ergebnis ist eine stetige Verringerung der Zahl der Elektronen und eine entsprechende Erhöhung der Zahl der Neutronen. Der Prozess der Sternentwicklung kann jedoch zur Synthese von radioaktiven Isotopen führen. Ausgewählte Isotope können anschließend einem negativen Betazerfall unterliegen, bei dem ein Elektron und ein Antineutrino aus dem Kern freigesetzt werden. Ein Beispiel dafür ist das Kobalt-60 (60Co)-Isotop, das zu Nickel-60 (60
Ni
). ⓘ

Am Ende seines Lebens kann ein Stern mit mehr als 20 Sonnenmassen durch die Schwerkraft kollabieren und ein Schwarzes Loch bilden. Nach der klassischen Physik üben diese massiven stellaren Objekte eine Anziehungskraft aus, die stark genug ist, um zu verhindern, dass irgendetwas, sogar elektromagnetische Strahlung, über den Schwarzschild-Radius hinaus entweicht. Es wird jedoch angenommen, dass quantenmechanische Effekte die Emission von Hawking-Strahlung in dieser Entfernung ermöglichen. Es wird angenommen, dass am Ereignishorizont dieser Sternüberreste Elektronen (und Positronen) entstehen. ⓘ
Wenn ein Paar virtueller Teilchen (z. B. ein Elektron und ein Positron) in der Nähe des Ereignishorizonts erzeugt wird, könnte eine zufällige räumliche Positionierung dazu führen, dass eines der beiden Teilchen außerhalb des Horizonts erscheint; dieser Vorgang wird als Quantentunneln bezeichnet. Das Gravitationspotenzial des Schwarzen Lochs kann dann die Energie liefern, die dieses virtuelle Teilchen in ein reales Teilchen umwandelt, so dass es in den Raum abstrahlen kann. Im Gegenzug erhält das andere Teilchen des Paares negative Energie, was zu einem Nettoverlust an Masse-Energie durch das Schwarze Loch führt. Die Hawking-Strahlung nimmt mit abnehmender Masse zu und führt schließlich dazu, dass das Schwarze Loch verdampft, bis es schließlich explodiert. ⓘ
Kosmische Strahlen sind Teilchen, die sich mit hoher Energie durch den Raum bewegen. Es wurden Ereignisse mit einer Energie von bis zu 3,0×1020 eV aufgezeichnet. Wenn diese Teilchen mit Nukleonen in der Erdatmosphäre zusammenstoßen, entsteht ein Schauer von Teilchen, darunter Pionen. Mehr als die Hälfte der kosmischen Strahlung, die von der Erdoberfläche aus beobachtet wird, besteht aus Myonen. Das so genannte Myon ist ein Lepton, das in der oberen Atmosphäre durch den Zerfall eines Pions entsteht.
π−
→
μ−
+
ν
μ
Ein Myon kann seinerseits in ein Elektron oder Positron zerfallen.
μ−
→
e-
+
ν
e +
ν
μ ⓘ
Beobachtung

Die Fernbeobachtung von Elektronen erfordert den Nachweis der von ihnen abgestrahlten Energie. In hochenergetischen Umgebungen wie der Korona eines Sterns beispielsweise bilden freie Elektronen ein Plasma, das Energie durch Bremsstrahlung abstrahlt. Elektronengas kann Plasmaschwingungen unterliegen, d. h. Wellen, die durch synchronisierte Schwankungen der Elektronendichte verursacht werden. ⓘ
Die Frequenz eines Photons ist proportional zu seiner Energie. Wenn ein gebundenes Elektron zwischen den verschiedenen Energieniveaus eines Atoms wechselt, absorbiert oder emittiert es Photonen mit charakteristischen Frequenzen. Werden Atome beispielsweise von einer Quelle mit einem breiten Spektrum bestrahlt, erscheinen im Spektrum der ausgesandten Strahlung deutliche dunkle Linien an den Stellen, an denen die entsprechende Frequenz von den Elektronen des Atoms absorbiert wird. Jedes Element oder Molekül weist eine charakteristische Reihe von Spektrallinien auf, wie z. B. die Wasserstoff-Spektralserie. Durch spektroskopische Messungen der Stärke und Breite dieser Linien lassen sich die Zusammensetzung und die physikalischen Eigenschaften einer Substanz bestimmen. ⓘ
Unter Laborbedingungen können die Wechselwirkungen einzelner Elektronen mit Hilfe von Teilchendetektoren beobachtet werden, die die Messung bestimmter Eigenschaften wie Energie, Spin und Ladung ermöglichen. Die Entwicklung der Paul-Falle und der Penning-Falle ermöglicht es, geladene Teilchen für lange Zeit in einem kleinen Bereich einzuschließen. Dies ermöglicht präzise Messungen der Teilcheneigenschaften. In einem Fall wurde beispielsweise eine Penning-Falle verwendet, um ein einzelnes Elektron für einen Zeitraum von 10 Monaten einzuschließen. Das magnetische Moment des Elektrons wurde mit einer Genauigkeit von elf Ziffern gemessen, was 1980 eine höhere Genauigkeit als für jede andere physikalische Konstante bedeutete. ⓘ
Die ersten Videobilder der Energieverteilung eines Elektrons wurden im Februar 2008 von einem Team der Universität Lund in Schweden aufgenommen. Die Wissenschaftler verwendeten extrem kurze Lichtblitze, so genannte Attosekundenpulse, mit denen sich die Bewegung eines Elektrons zum ersten Mal beobachten ließ. ⓘ
Die Verteilung der Elektronen in festen Materialien kann durch winkelaufgelöste Photoemissionsspektroskopie (ARPES) sichtbar gemacht werden. Diese Technik nutzt den photoelektrischen Effekt, um den reziproken Raum zu messen - eine mathematische Darstellung periodischer Strukturen, aus der auf die ursprüngliche Struktur geschlossen werden kann. Mit ARPES lassen sich die Richtung, die Geschwindigkeit und die Streuung der Elektronen im Material bestimmen. ⓘ
Plasma-Anwendungen
Teilchenstrahlen

Elektronenstrahlen werden beim Schweißen eingesetzt. Sie ermöglichen Energiedichten von bis zu 107 W-cm-2 über einen engen Fokusdurchmesser von 0,1-1,3 mm und erfordern in der Regel keinen Zusatzwerkstoff. Diese Schweißtechnik muss im Vakuum durchgeführt werden, um zu verhindern, dass die Elektronen mit dem Gas in Wechselwirkung treten, bevor sie ihr Ziel erreichen, und sie kann zum Verbinden von leitfähigen Materialien verwendet werden, die ansonsten als ungeeignet für das Schweißen gelten würden. ⓘ
Die Elektronenstrahllithografie (EBL) ist eine Methode zum Ätzen von Halbleitern mit einer Auflösung von weniger als einem Mikrometer. Diese Technik ist begrenzt durch hohe Kosten, langsame Leistung, die Notwendigkeit, den Strahl im Vakuum zu betreiben, und die Tendenz der Elektronen, in Festkörpern zu streuen. Das letzte Problem begrenzt die Auflösung auf etwa 10 nm. Aus diesem Grund wird das EBL-Verfahren vor allem für die Herstellung kleiner Stückzahlen spezieller integrierter Schaltungen eingesetzt. ⓘ
Die Elektronenstrahlverarbeitung wird zur Bestrahlung von Materialien eingesetzt, um deren physikalische Eigenschaften zu verändern oder medizinische Produkte und Lebensmittel zu sterilisieren. Elektronenstrahlen verflüssigen Gläser oder bringen sie zum Schmelzen, ohne dass sich die Temperatur bei intensiver Bestrahlung nennenswert erhöht: z. B. bewirkt intensive Elektronenbestrahlung eine Abnahme der Viskosität um mehrere Größenordnungen und eine schrittweise Verringerung der Aktivierungsenergie. ⓘ
Lineare Teilchenbeschleuniger erzeugen Elektronenstrahlen zur Behandlung von oberflächlichen Tumoren in der Strahlentherapie. Mit der Elektronentherapie können Hautläsionen wie Basalzellkarzinome behandelt werden, da ein Elektronenstrahl nur bis zu einer begrenzten Tiefe eindringt, bevor er absorbiert wird, in der Regel bis zu 5 cm bei Elektronenenergien im Bereich von 5-20 MeV. Ein Elektronenstrahl kann zur Ergänzung der Behandlung von Bereichen eingesetzt werden, die bereits mit Röntgenstrahlen bestrahlt wurden. ⓘ
Teilchenbeschleuniger nutzen elektrische Felder, um Elektronen und ihre Antiteilchen auf hohe Energien zu bringen. Diese Teilchen emittieren Synchrotronstrahlung, wenn sie Magnetfelder durchqueren. Durch die Abhängigkeit der Intensität dieser Strahlung vom Spin wird der Elektronenstrahl polarisiert - ein Prozess, der als Sokolov-Ternov-Effekt bekannt ist. Polarisierte Elektronenstrahlen können für verschiedene Experimente nützlich sein. Synchrotronstrahlung kann die Elektronenstrahlen auch kühlen, um die Impulsausbreitung der Teilchen zu verringern. Elektronen- und Positronenstrahlen werden bei der Beschleunigung der Teilchen auf die erforderlichen Energien zur Kollision gebracht; Teilchendetektoren beobachten die dabei entstehenden Energieemissionen, die in der Teilchenphysik untersucht werden. ⓘ
Bildgebung
Bei der niederenergetischen Elektronenbeugung (LEED) wird ein kristallines Material mit einem kollimierten Elektronenstrahl beschossen und die daraus resultierenden Beugungsmuster beobachtet, um die Struktur des Materials zu bestimmen. Die erforderliche Energie der Elektronen liegt in der Regel im Bereich von 20-200 eV. Bei der hochenergetischen Reflexionselektronenbeugung (RHEED) wird die Oberfläche kristalliner Materialien durch Reflexion eines Elektronenstrahls, der in verschiedenen niedrigen Winkeln abgefeuert wird, charakterisiert. Die Strahlenergie liegt typischerweise im Bereich von 8-20 keV und der Einfallswinkel beträgt 1-4°. ⓘ
Das Elektronenmikroskop lenkt einen fokussierten Elektronenstrahl auf eine Probe. Einige Elektronen ändern ihre Eigenschaften, z. B. die Bewegungsrichtung, den Winkel, die relative Phase und die Energie, wenn der Strahl auf das Material trifft. Mikroskopiker können diese Veränderungen des Elektronenstrahls aufzeichnen, um atomar aufgelöste Bilder des Materials zu erzeugen. Bei blauem Licht haben herkömmliche optische Mikroskope eine beugungsbegrenzte Auflösung von etwa 200 nm. Im Vergleich dazu ist die Auflösung von Elektronenmikroskopen durch die de Broglie-Wellenlänge des Elektrons begrenzt. Diese Wellenlänge beträgt beispielsweise 0,0037 nm für Elektronen, die durch ein Potential von 100.000 Volt beschleunigt werden. Das Transmissions-Elektronenmikroskop mit Aberrationskorrektur ermöglicht eine Auflösung von unter 0,05 nm, was mehr als genug ist, um einzelne Atome aufzulösen. Diese Fähigkeit macht das Elektronenmikroskop zu einem nützlichen Laborinstrument für die hochauflösende Bildgebung. Elektronenmikroskope sind jedoch teure und wartungsintensive Geräte. ⓘ
Es gibt zwei Haupttypen von Elektronenmikroskopen: Transmissions- und Rasterelektronenmikroskope. Transmissions-Elektronenmikroskope funktionieren wie Overhead-Projektoren, wobei ein Elektronenstrahl eine Materialscheibe durchdringt und dann von Linsen auf ein fotografisches Dia oder ein ladungsgekoppeltes Gerät projiziert wird. Rasterelektronenmikroskope rastern einen fein fokussierten Elektronenstrahl wie bei einem Fernsehgerät über die untersuchte Probe, um das Bild zu erzeugen. Die Vergrößerungen reichen bei beiden Mikroskoptypen von 100× bis 1.000.000× oder höher. Das Rastertunnelmikroskop nutzt das Quantentunneln der Elektronen von einer scharfen Metallspitze in das untersuchte Material und kann atomar aufgelöste Bilder von dessen Oberfläche erzeugen. ⓘ
Andere Anwendungen
Beim Freie-Elektronen-Laser (FEL) durchläuft ein relativistischer Elektronenstrahl ein Paar Undulatoren, die Anordnungen von Dipolmagneten enthalten, deren Felder in wechselnde Richtungen zeigen. Die Elektronen emittieren Synchrotronstrahlung, die mit denselben Elektronen kohärent wechselwirkt, um das Strahlungsfeld bei der Resonanzfrequenz stark zu verstärken. FEL können kohärente elektromagnetische Strahlung mit hoher Brillanz und einem breiten Frequenzspektrum aussenden, von Mikrowellen bis hin zu weicher Röntgenstrahlung. Diese Geräte werden in der Fertigung, der Kommunikation und in medizinischen Anwendungen wie der Weichteilchirurgie eingesetzt. ⓘ
Elektronen spielen eine wichtige Rolle in Kathodenstrahlröhren, die in großem Umfang als Anzeigegeräte in Laborgeräten, Computermonitoren und Fernsehgeräten verwendet werden. In einer Photomultiplier-Röhre löst jedes Photon, das auf die Photokathode trifft, eine Elektronenlawine aus, die einen nachweisbaren Stromimpuls erzeugt. Vakuumröhren nutzen den Elektronenfluss, um elektrische Signale zu manipulieren, und sie spielten eine entscheidende Rolle bei der Entwicklung der Elektroniktechnologie. Sie wurden jedoch weitgehend durch Festkörperbauelemente wie den Transistor verdrängt. ⓘ
Wirkungsquerschnitt
Von der (eventuellen) Ausdehnung des Elektrons zu unterscheiden ist sein Wirkungsquerschnitt für Wechselwirkungsprozesse. Bei der Streuung von Röntgenstrahlen an Elektronen erhält man z. B. einen Streuquerschnitt von etwa , was der Kreisfläche mit dem oben beschriebenen klassischen Elektronenradius entspräche. Im Grenzfall großer Wellenlängen, d. h. kleiner Photonenenergien, steigt der Streuquerschnitt auf (siehe Thomson-Streuung und Compton-Effekt). ⓘ







