Ethylendiamintetraessigsäure
| |
| Bezeichnungen | |
|---|---|
| Bevorzugter IUPAC-Name
2,2′,2′′,2′′′-(Ethan-1,2-diyldinitrilo)tetraessigsäure | |
Andere Namen
| |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| Abkürzungen | EDTA, H4EDTA |
Beilstein-Referenz
|
1716295 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
| EC-Nummer |
|
Gmelin Referenz
|
144943 |
| KEGG | |
| MeSH | Essig+Säure |
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII |
|
| UN-Nummer | 3077 |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
C10H16N2O8 |
| Molekulare Masse | 292,244 g-mol-1 |
| Erscheinungsbild | Farblose Kristalle |
| Dichte | 0,860 g cm-3 (bei 20 °C) |
| log P | −0.836 |
| Acidität (pKa) | 2.0, 2.7, 6.16, 10.26 |
| Thermochemie | |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-1765,4 bis -1758,0 kJ mol-1 |
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
-4461,7 bis -4454,5 kJ mol-1 |
| Pharmakologie | |
ATC-Code
|
S01XA05 (WHO) V03AB03 (WHO) (Salz) |
Wege der
Verabreichung |
|
| Gefahren | |
| GHS-Kennzeichnung: | |
Piktogramme
|

|
Signalwort
|
Warnhinweis |
Gefahrenhinweise
|
H319 |
Sicherheitshinweise
|
P305+P351+P338 |
| NFPA 704 (Feuerdiamant) | |
| Tödliche Dosis oder Konzentration (LD, LC): | |
LD50 (Mittlere Dosis)
|
1000 mg/kg (oral, Ratte) |
| Verwandte Verbindungen | |
Verwandte Alkansäuren
|
|
Verwandte Verbindungen
|
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
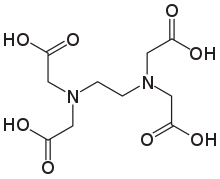
Ethylendiamintetraessigsäure (EDTA) ist eine Aminopolycarbonsäure mit der Formel [CH2N(CH2CO2H)2]2. Dieser weiße, wasserlösliche Feststoff wird häufig zur Bindung von Eisen- (Fe2+/Fe3+) und Kalzium-Ionen (Ca2+) verwendet. Er bindet diese Ionen als hexadentater ("sechszähniger") Chelatbildner. EDTA wird in Form verschiedener Salze hergestellt, vor allem als Dinatrium-EDTA, Natrium-Calcium-Edetat und Tetranatrium-EDTA. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylendiamintetraessigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H16N2O8 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
V03AB03 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 292,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,46 g·cm−3 (20 °C) | ||||||||||||||||||
| Schmelzpunkt |
245 °C (Zersetzung) | ||||||||||||||||||
| pKS-Wert |
| ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
4500 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ethylendiamintetraessigsäure bzw. Ethylendiamintetraacetat, das Tetraanion der Ethylendiamintetraessigsäure, ist ein sechszähniger Komplexbildner und bildet besonders stabile 1:1-Chelatkomplexe mit Kationen mit einer Ladungszahl von mindestens +2. Die Abkürzung EDTA steht sowohl für die deutsche Bezeichnung Ethylendiamintetraacetat als auch für die englische Bezeichnung Ethylenediaminetetraacetic acid. Pionierarbeit zu EDTA leistete Gerold Schwarzenbach in den 1940er-Jahren an der Universität Zürich. Die Erstsynthese von EDTA gelang 1935 Ferdinand Münz bei der IG Farben, der ein Verfahren hierzu auch patentieren ließ. ⓘ
Verwendungen
Textilindustrie
In der Industrie wird EDTA hauptsächlich dazu verwendet, Metallionen in wässriger Lösung zu sequestrieren (zu binden oder einzuschließen). In der Textilindustrie verhindert es, dass Verunreinigungen durch Metallionen die Farben von gefärbten Produkten verändern. In der Zellstoff- und Papierindustrie hemmt EDTA die Fähigkeit von Metallionen, insbesondere Mn2+, die Disproportionierung von Wasserstoffperoxid zu katalysieren, das bei der chlorfreien Bleiche verwendet wird. In ähnlicher Weise wird EDTA einigen Lebensmitteln als Konservierungsmittel oder Stabilisator zugesetzt, um die katalytische oxidative Entfärbung zu verhindern, die durch Metallionen katalysiert wird. In Erfrischungsgetränken, die Ascorbinsäure und Natriumbenzoat enthalten, mindert EDTA die Bildung von Benzol (einem Karzinogen). ⓘ
Wasserenthärter
Die Verringerung der Wasserhärte in Wäschereien und die Auflösung von Kesselstein in Heizkesseln beruhen beide auf EDTA und verwandten Komplexbildnern, die Ca2+, Mg2+ und andere Metallionen binden. Sobald diese Metallkomplexe an EDTA gebunden sind, ist es weniger wahrscheinlich, dass sie Niederschläge bilden oder die Wirkung von Seifen und Reinigungsmitteln beeinträchtigen. Aus ähnlichen Gründen enthalten Reinigungslösungen häufig EDTA. In ähnlicher Weise wird EDTA in der Zementindustrie zur Bestimmung von freiem Kalk und freier Magnesia in Zement und Klinkern verwendet. ⓘ
Die Solubilisierung von Fe3+-Ionen bei oder unterhalb des neutralen pH-Werts kann mit EDTA erreicht werden. Diese Eigenschaft ist in der Landwirtschaft, einschließlich Hydrokulturen, von Nutzen. Angesichts der pH-Abhängigkeit der Ligandenbildung ist EDTA jedoch nicht geeignet, die Eisenlöslichkeit in Böden über dem neutralen Bereich zu verbessern. Ansonsten bildet Eisen(III) bei nahezu neutralem pH-Wert und darüber unlösliche Salze, die für empfindliche Pflanzenarten weniger bioverfügbar sind. ⓘ
Scheuern
Wässriges [Fe(EDTA)]- wird zur Entfernung ("Wäsche") von Schwefelwasserstoff aus Gasströmen verwendet. Diese Umwandlung erfolgt durch Oxidation des Schwefelwasserstoffs zu elementarem Schwefel, der nicht flüchtig ist:
- 2 [Fe(EDTA)]- + H2S → 2 [Fe(EDTA)]2- + S + 2 H+
Bei dieser Anwendung wird das Eisen(III)-Zentrum zu seinem Eisen(II)-Derivat reduziert, das dann an der Luft reoxidiert werden kann. In ähnlicher Weise werden Stickoxide mit [Fe(EDTA)]2- aus Gasströmen entfernt. ⓘ
Die oxidierenden Eigenschaften von [Fe(EDTA)]- werden auch in der Fotografie ausgenutzt, wo es zur Auflösung von Silberpartikeln verwendet wird. ⓘ
Ionen-Austausch-Chromatographie
EDTA wurde für die Trennung der Lanthanidenmetalle durch Ionenaustauschchromatographie verwendet. Die 1954 von F. H. Spedding et al. perfektionierte Methode beruht auf dem stetigen Anstieg der Stabilitätskonstante der Lanthanoid-EDTA-Komplexe mit der Ordnungszahl. Unter Verwendung von sulfonierten Polystyrolkügelchen und Cu2+ als Rückhalteion bewirkt EDTA, dass die Lanthanoide die Harzsäule hinunterwandern und sich dabei in Banden reiner Lanthanoide trennen. Die Lanthanide eluieren in der Reihenfolge der abnehmenden Ordnungszahl. Da diese Methode im Vergleich zur Gegenstromextraktion mit Lösungsmitteln sehr teuer ist, wird der Ionenaustausch heute nur noch zur Gewinnung von Lanthaniden höchster Reinheit (in der Regel mehr als 99,99 %) eingesetzt. ⓘ
Medizin
Natrium-Calcium-Edetat, ein EDTA-Derivat, wird zur Bindung von Metallionen im Rahmen der Chelattherapie verwendet, beispielsweise zur Behandlung von Quecksilber- und Bleivergiftungen. In ähnlicher Weise wird es verwendet, um überschüssiges Eisen aus dem Körper zu entfernen. Diese Therapie wird eingesetzt, um die Komplikation wiederholter Bluttransfusionen zu behandeln, wie es bei der Behandlung der Thalassämie der Fall ist. ⓘ
Zahnmedizin
Zahnärzte und Endodontologen verwenden EDTA-Lösungen, um anorganische Ablagerungen (Schmierschicht) zu entfernen und die Wurzelkanäle in der Endodontie zu schmieren. Dieses Verfahren dient der Vorbereitung der Wurzelkanäle für die Obturation. Darüber hinaus lockern EDTA-Lösungen mit dem Zusatz eines Tensids Verkalkungen im Wurzelkanal auf und ermöglichen die Instrumentierung (Kanalformung) und erleichtern das apikale Vorschieben einer Feile in einem engen oder verkalkten Wurzelkanal zum Apex. ⓘ
Augentropfen
Es dient als Konservierungsmittel (in der Regel zur Verstärkung der Wirkung eines anderen Konservierungsmittels wie Benzalkoniumchlorid oder Thiomersal) in Augenpräparaten und Augentropfen. ⓘ
Analyse
Zur Beurteilung der Nierenfunktion wird der Chrom(III)-Komplex [Cr(EDTA)]- (als radioaktives Chrom-51 (51Cr)) intravenös verabreicht und seine Filtration in den Urin überwacht. Diese Methode ist nützlich für die Bewertung der glomerulären Filtrationsrate (GFR) in der Nuklearmedizin. ⓘ
EDTA wird häufig bei der Analyse von Blut verwendet. Es ist ein Antikoagulans für Blutproben für CBC/FBC, wobei das EDTA das in der Blutprobe vorhandene Kalzium chelatiert, den Gerinnungsprozess stoppt und die Morphologie der Blutzellen bewahrt. Röhrchen, die EDTA enthalten, sind mit einem lavendelfarbenen (violetten) oder rosa Deckel gekennzeichnet. EDTA ist auch in Röhrchen mit hellbraunem Deckel für Bleitests erhältlich und kann in Röhrchen mit königsblauem Deckel für Spurenelemente verwendet werden. ⓘ
EDTA ist ein Schleimlöser und hat sich bei der Verringerung des Bakterienwachstums während der Implantation von Intraokularlinsen (IOLs) als äußerst wirksam erwiesen. ⓘ
Alternative Medizin
Einige Heilpraktiker glauben, dass EDTA als Antioxidans wirkt und freie Radikale daran hindert, die Wände der Blutgefäße zu verletzen, wodurch die Atherosklerose verringert wird. Diese Vorstellungen werden nicht durch wissenschaftliche Studien gestützt und scheinen einigen derzeit anerkannten Grundsätzen zu widersprechen. Die amerikanische Arzneimittelbehörde FDA hat es nicht für die Behandlung von Atherosklerose zugelassen. Medizinische Fachverbände in den USA - darunter das American College for Advancement in Medicine (ACAM) - haben sich jedoch der Ausbildung von Ärzten in der Chelattherapie verschrieben, um Arterienverkalkung und andere chronische degenerative Erkrankungen zu verbessern. ⓘ
Kosmetika
In Shampoos, Reinigungsmitteln und anderen Körperpflegeprodukten werden EDTA-Salze als Komplexbildner verwendet, um ihre Stabilität an der Luft zu verbessern. ⓘ
Anwendungen im Labor
Im Labor wird EDTA häufig zum Abfangen von Metallionen verwendet: In der Biochemie und Molekularbiologie wird die Ionendepletion häufig zur Deaktivierung metallabhängiger Enzyme verwendet, entweder als Test für deren Reaktivität oder zur Unterdrückung von Schäden an DNA, Proteinen und Polysacchariden. EDTA wirkt auch als selektiver Inhibitor gegen dNTP-hydrolysierende Enzyme (Taq-Polymerase, dUTPase, MutT), Leber-Arginase und Meerrettich-Peroxidase unabhängig von der Metallionenchelation. Diese Ergebnisse fordern dazu auf, die Verwendung von EDTA als biochemisch inaktiver Metallionenfänger in enzymatischen Experimenten zu überdenken. In der analytischen Chemie wird EDTA bei komplexometrischen Titrationen und bei der Analyse der Wasserhärte oder als Maskierungsmittel verwendet, um Metallionen zu binden, die die Analysen stören würden. ⓘ
In den biomedizinischen Labors findet EDTA zahlreiche spezialisierte Verwendungen, z. B. in der veterinärmedizinischen Ophthalmologie als Antikollagenase, um die Verschlimmerung von Hornhautgeschwüren bei Tieren zu verhindern. In der Gewebekultur wird EDTA als Chelatbildner verwendet, der an Kalzium bindet und die Verbindung von Cadherinen zwischen Zellen verhindert, wodurch das Verklumpen von in flüssiger Suspension gezüchteten Zellen oder das Ablösen anhaftender Zellen für die Passage verhindert wird. In der Histopathologie kann EDTA als Entkalkungsmittel verwendet werden, das das Schneiden von Schnitten mit einem Mikrotom ermöglicht, sobald die Gewebeprobe demineralisiert ist. ⓘ
EDTA ist auch dafür bekannt, eine Reihe von Metallopeptidasen zu hemmen, wobei die Hemmung über die Chelatbildung des für die katalytische Aktivität erforderlichen Metallions erfolgt. EDTA kann auch verwendet werden, um die Bioverfügbarkeit von Schwermetallen in Sedimenten zu testen. Es kann jedoch die Bioverfügbarkeit von Metallen in Lösung beeinflussen, was angesichts seiner weit verbreiteten Verwendung und Anwendung zu Bedenken hinsichtlich seiner Auswirkungen auf die Umwelt führen kann. ⓘ
EDTA wird auch verwendet, um Rohmaterial (korrodierte Metalle) von Brennstäben in Kernreaktoren zu entfernen. ⓘ
Nebeneffekte
EDTA weist eine geringe akute Toxizität mit einer LD50 (Ratte) von 2,0 g/kg bis 2,2 g/kg auf. Es hat sich bei Labortieren als zytotoxisch und schwach genotoxisch erwiesen. Bei oraler Exposition wurden Auswirkungen auf die Fortpflanzung und Entwicklung festgestellt. Dieselbe Studie ergab auch, dass sowohl die dermale Exposition gegenüber EDTA in den meisten kosmetischen Formulierungen als auch die inhalative Exposition gegenüber EDTA in aerosolisierten kosmetischen Formulierungen zu Expositionswerten führen würde, die unter denen liegen, die in Studien zur oralen Verabreichung als toxisch angesehen wurden. ⓘ
Synthese
Die Verbindung wurde erstmals 1935 von Ferdinand Münz beschrieben, der sie aus Ethylendiamin und Chloressigsäure herstellte. Heute wird EDTA hauptsächlich aus Ethylendiamin (1,2-Diaminoethan), Formaldehyd und Natriumcyanid synthetisiert. Auf diese Weise erhält man Tetranatrium-EDTA, das in einem weiteren Schritt in die Säureformen umgewandelt wird:
Mit diesem Verfahren werden jährlich etwa 80.000 Tonnen EDTA hergestellt. Zu den Verunreinigungen, die bei diesem Verfahren entstehen, gehören Glycin und Nitrilotriessigsäure; sie stammen aus Reaktionen des Ammoniak-Coprodukts. ⓘ
Durch die Strecker-Synthese von Formaldehyd und Blausäure mit Ethylendiamin über das Tetranitril und anschließender alkalischer Hydrolyse. ⓘ
Nomenklatur
Um EDTA und seine verschiedenen protonierten Formen zu beschreiben, unterscheiden Chemiker zwischen EDTA4-, der konjugierten Base, die den Liganden darstellt, und H4EDTA, dem Vorläufer dieses Liganden. Bei sehr niedrigem pH-Wert (sehr sauren Bedingungen) überwiegt die vollständig protonierte Form H6EDTA2+, während bei sehr hohem pH-Wert oder sehr basischen Bedingungen die vollständig deprotonierte Form EDTA4- vorherrscht. In diesem Artikel wird der Begriff EDTA für H4-xEDTAx- verwendet, während in seinen Komplexen EDTA4- für den Tetraanion-Liganden steht. ⓘ
Grundsätze der Koordinationschemie


In der Koordinationschemie ist EDTA4- ein Mitglied der Familie der Aminopolycarbonsäure-Liganden. EDTA4- bindet sich in der Regel über seine zwei Amine und vier Carboxylate an ein Metallkation. Viele der entstehenden Koordinationsverbindungen weisen eine oktaedrische Geometrie auf. Diese oktaedrischen Komplexe sind chiral, auch wenn dies für ihre Anwendungen kaum von Bedeutung ist. Das Kobalt(III)-Anion [Co(EDTA)]- wurde in Enantiomere zerlegt. Viele Komplexe von EDTA4- nehmen komplexere Strukturen an, entweder durch die Bildung einer zusätzlichen Bindung an Wasser, d. h. siebenkoordinierte Komplexe, oder durch die Verdrängung eines Carboxylatarms durch Wasser. Der Eisen(III)-Komplex von EDTA ist siebenkoordiniert. Frühe Arbeiten zur Entwicklung von EDTA wurden von Gerold Schwarzenbach in den 1940er Jahren durchgeführt. EDTA bildet besonders starke Komplexe mit Mn(II), Cu(II), Fe(III), Pb(II) und Co(III). ⓘ
Mehrere Merkmale der EDTA-Komplexe sind für seine Anwendungen von Bedeutung. Erstens hat dieser Ligand aufgrund seiner hohen Dentizität eine hohe Affinität für Metallkationen:
- [Fe(H2O)6]3+ + H4EDTA ⇌ [Fe(EDTA)]- + 6 H2O + 4 H+ Keq = 1025,1 ⓘ
Der so geschriebene Gleichgewichtsquotient zeigt, dass Metallionen mit Protonen um die Bindung an EDTA konkurrieren. Da die Metallionen von EDTA weitgehend umhüllt werden, werden ihre katalytischen Eigenschaften oft unterdrückt. Da EDTA4-Komplexe anionisch sind, neigen sie dazu, in Wasser gut löslich zu sein. Aus diesem Grund ist EDTA in der Lage, Ablagerungen von Metalloxiden und Karbonaten aufzulösen. ⓘ
Die pKa-Werte von freiem EDTA sind 0, 1,5, 2, 2,66 (Deprotonierung der vier Carboxylgruppen) und 6,16, 10,24 (Deprotonierung der beiden Aminogruppen). ⓘ
Schicksal in der Umwelt
Abiotischer Abbau
EDTA ist so weit verbreitet, dass die Frage aufgeworfen wurde, ob es sich um einen persistenten organischen Schadstoff handelt. Obwohl EDTA viele positive Funktionen in verschiedenen industriellen, pharmazeutischen und anderen Bereichen erfüllt, kann die Langlebigkeit von EDTA in der Umwelt zu ernsten Problemen führen. Der Abbau von EDTA erfolgt langsam. Er findet hauptsächlich abiotisch in Gegenwart von Sonnenlicht statt. ⓘ
Der wichtigste Prozess für die Eliminierung von EDTA aus Oberflächengewässern ist die direkte Photolyse bei Wellenlängen unter 400 nm. Je nach den Lichtverhältnissen kann die Photolyse-Halbwertszeit von Eisen(III)-EDTA in Oberflächengewässern zwischen 11,3 Minuten und mehr als 100 Stunden liegen. Beim Abbau von FeEDTA, nicht aber von EDTA selbst, entstehen Eisenkomplexe des Triacetats (ED3A), Diacetats (EDDA) und Monoacetats (EDMA) - 92 % von EDDA und EDMA werden innerhalb von 20 Stunden biologisch abgebaut, während ED3A eine wesentlich höhere Beständigkeit aufweist. Viele in der Umwelt weit verbreitete EDTA-Spezies (wie Mg2+ und Ca2+) sind beständiger. ⓘ
Biologische Abbaubarkeit
In vielen industriellen Kläranlagen kann EDTA mit Hilfe von Mikroorganismen zu etwa 80 % abgebaut werden. Die dabei entstehenden Nebenprodukte sind ED3A und Iminodiessigsäure (IDA) - was darauf hindeutet, dass sowohl das Rückgrat als auch die Acetylgruppen angegriffen wurden. Einige Mikroorganismen haben sogar entdeckt, dass sie aus EDTA Nitrate bilden können, aber sie funktionieren optimal bei mäßig alkalischen Bedingungen von pH 9,0-9,5. ⓘ
Mehrere aus Kläranlagen isolierte Bakterienstämme bauen EDTA effizient ab. Zu diesen Stämmen gehören Agrobacterium radiobacter ATCC 55002 und die Unterzweige von Pseudomonadota wie BNC1, BNC2 und der Stamm DSM 9103. Die drei Stämme weisen ähnliche Eigenschaften der aeroben Atmung auf und werden als gramnegative Bakterien eingestuft. Anders als bei der Photolyse ist die chelatierte Spezies nicht auf Eisen(III) beschränkt, um abgebaut zu werden. Vielmehr verbraucht jeder Stamm auf einzigartige Weise unterschiedliche Metall-EDTA-Komplexe über mehrere enzymatische Wege. Agrobacterium radiobacter baut nur Fe(III)-EDTA ab, während BNC1 und DSM 9103 nicht in der Lage sind, Eisen(III)-EDTA abzubauen und sich eher für Calcium-, Barium-, Magnesium- und Mangan(II)-Komplexe eignen. EDTA-Komplexe müssen erst dissoziiert werden, bevor sie abgebaut werden können. ⓘ
Alternativen zu EDTA
Das Interesse an der Umweltsicherheit hat zu Bedenken hinsichtlich der biologischen Abbaubarkeit von Aminopolycarboxylaten wie EDTA geführt. Diese Bedenken veranlassen zur Erforschung alternativer Aminopolycarboxylate. Zu den in Frage kommenden Chelatbildnern gehören Nitrilotriessigsäure (NTA), Iminodibernsteinsäure (IDS), Polyasparaginsäure, S,S-Ethylendiamin-N,N′-bernsteinsäure (EDDS), Methylglycindiessigsäure (MGDA) und L-Glutaminsäure-N,N-Diessigsäure, Tetranatriumsalz (GLDA). ⓘ
Iminodibernsteinsäure (IDS)
Die seit 1998 kommerziell eingesetzte Iminodibernsteinsäure (IDS) wird nach nur 7 Tagen zu etwa 80 % biologisch abgebaut. IDS bindet außerordentlich gut an Kalzium und bildet stabile Verbindungen mit anderen Schwermetall-Ionen. IDS hat nicht nur eine geringere Toxizität nach der Chelatbildung, sondern wird auch von Agrobacterium tumefaciens (BY6) abgebaut, das in großem Maßstab geerntet werden kann. Die beteiligten Enzyme, IDS-Epimerase und C-N-Lyase, benötigen keine Cofaktoren. ⓘ
Polyasparaginsäure
Polyasparaginsäure bindet wie IDS an Kalzium- und andere Schwermetall-Ionen. Sie hat viele praktische Anwendungen, darunter Korrosionsinhibitoren, Abwasseradditive und Polymere für die Landwirtschaft. Ein auf Polyasparaginsäure basierendes Waschmittel war das erste Waschmittel der Welt, das das EU-Umweltzeichen für Blumen erhielt. Die Fähigkeit von Polyasparaginsäure, Kalzium zu binden, wurde genutzt, um arzneimittelbeladene Nanocarrier gezielt in Knochen zu platzieren. Die Herstellung von Hydrogelen auf der Grundlage von Polyasparaginsäure in verschiedenen physikalischen Formen - von Fasern bis hin zu Partikeln - kann möglicherweise eine einfache Abtrennung der chelatierten Ionen aus einer Lösung ermöglichen. Obwohl Polyasparaginsäure schwächer als EDTA ist, kann sie aufgrund dieser Eigenschaften sowie ihrer Biokompatibilität und biologischen Abbaubarkeit als Alternative angesehen werden. ⓘ
S,S-Ethylendiamin-N,N′-dibernsteinsäure (EDDS)
Ethylendiamin-N,N′-dibernsteinsäure (EDDS), ein Strukturisomer von EDTA, ist in seiner S,S-Form leicht und schnell biologisch abbaubar. ⓘ
Methylglycindiessigsäure (MGDA)
Trinatriumdicarboxymethylalaninat, auch bekannt als Methylglycindiessigsäure (MGDA), hat eine hohe biologische Abbaugeschwindigkeit von über 68 %, kann aber im Gegensatz zu vielen anderen Chelatbildnern ohne die Hilfe von angepassten Bakterien abgebaut werden. Außerdem kann MGDA im Gegensatz zu EDDS oder IDS höheren Temperaturen standhalten und dabei eine hohe Stabilität sowie den gesamten pH-Bereich beibehalten. MGDA hat sich als wirksamer Chelatbildner erwiesen, dessen Mobilisierungskapazität mit der von Nitrilotriessigsäure (NTA) vergleichbar ist und der in Wasser für industrielle Zwecke und zur Entfernung von Kalziumoxalat aus dem Urin von Patienten mit Nierensteinen eingesetzt wird. ⓘ
Methoden zum Nachweis und zur Analyse
Die empfindlichste Methode zum Nachweis und zur Messung von EDTA in biologischen Proben ist die Kapillarelektrophorese-Massenspektrometrie (SRM-CE/MS), die eine Nachweisgrenze von 7,3 ng/mL in menschlichem Plasma und eine Quantifizierungsgrenze von 15 ng/mL hat. Diese Methode funktioniert mit einem Probenvolumen von nur 7-8 nl. ⓘ
EDTA wurde auch in alkoholfreien Getränken mittels Hochleistungsflüssigkeitschromatographie (HPLC) in einer Konzentration von 2,0 μg/mL gemessen. ⓘ
In der Populärkultur
- In dem Film Blade (1998) wird EDTA als Waffe zur Tötung von Vampiren eingesetzt und explodiert, wenn es mit Vampirblut in Berührung kommt. ⓘ
Umweltverhalten
EDTA gelangt fast ausschließlich über das Abwasser in die Umwelt. Da EDTA unter normalen Bedingungen nur sehr langsam abgebaut wird, kann es in praktisch allen Wasserproben in niedrigen Konzentrationen nachgewiesen werden. EDTA-Konzentrationen in Flüssen liegen zwischen 10 und 100 µg/l, in Seen zwischen 1 und 10 µg/l. Im Grundwasser und Uferfiltrat kann EDTA in Konzentrationen zwischen 1 und 100 µg/l gefunden werden. Bei neutralen pH-Werten ist die Adsorption von EDTA an Mineraloberflächen gering, was zu einer hohen Mobilität im Grundwasser führt. Lediglich der FeIII-EDTA-Komplex wird sehr schnell durch Sonnenlicht abgebaut. Dies ist der wichtigste Eliminationsprozess für EDTA in der Umwelt. EDTA wird während der Ozonisierung oder Chlorung von Trinkwasser nur unvollständig entfernt. Negative Umweltauswirkungen von EDTA haben wenig mit dessen spezifischer Toxizität zu tun, sondern vielmehr mit den komplexierenden Eigenschaften, die in Wechselwirkung mit anderen Stoffen (insbesondere Schwermetalle, Härtebildner und Mikronährstoffe), auftreten, diese beispielsweise aus dem Sediment lösen und so bioverfügbar machen können. ⓘ
Das deutsche Umweltbundesamt empfiehlt: „Im Sinne einer vorsorgenden Stoffpolitik sollten EDTA und auch andere schwer abbaubare Komplexbildner wie Diethylentriaminpentaessigsäure (DTPA) oder Propylendiamintetraessigsäure (PDTA) durch Stoffe ersetzt werden, die möglichst leicht abbaubar sind und somit in Kläranlagen entfernt werden können.“ Mögliche Ersatzstoffe sind Nitrilotriessigsäure (NTA) und ihre Natriumsalze, Citrate, Gluconate, β-Alanindiessigsäure-Natriumsalz (ADA), Methylglycindiessigsäure (MGDA), u. a.m. In der Schweiz ist das Inverkehrbringen von Wasch- bzw. Reinigungs- und Desodorierungsmitteln mit einem Massengehalt von mehr als 0,5 % bzw. 1 % EDTA bzw. seiner Salze verboten. ⓘ
Ersatzstoffe
- Nitrilotriessigsäure (NTA)
- Ethylenglycol-bis(aminoethylether)-N,N,N′,N′-tetraessigsäure (EGTA)
- Ethylendiamindibernsteinsäure (EDDS)
- Citronensäure
- Polycarboxylate
- Zeolithe, insbesondere Zeolith A
- Phosphonsäuren, Phosphonate ⓘ



