Plutonium
 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Plutonium | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /pluːˈtoʊniəm/ (ploo-TOH-nee-əm) | |||||||||||||||||||||||||||||||||||||||||||||||
| Allotrope | siehe Allotrope des Plutoniums | |||||||||||||||||||||||||||||||||||||||||||||||
| Erscheinungsbild | silbrig-weiß, an der Luft dunkelgrau anlaufend | |||||||||||||||||||||||||||||||||||||||||||||||
| Massenzahl | [244] | |||||||||||||||||||||||||||||||||||||||||||||||
| Plutonium im Periodensystem | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 94 | |||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | Gruppe k.A. | |||||||||||||||||||||||||||||||||||||||||||||||
| Periode | Periode 7 | |||||||||||||||||||||||||||||||||||||||||||||||
| Block | f-Block | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Radon|Rn]]] 5f6 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 32, 24, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||
| Phase bei STP | fest | |||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 912,5 K (639,4 °C, 1182,9 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3505 K (3228 °C, 5842 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 19,85 (239Pu) g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 16,63 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 2,82 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 333,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Molare Wärmekapazität | 35,5 J/(mol-K) | |||||||||||||||||||||||||||||||||||||||||||||||
Verdampfungsdruck
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationsstufen | +2, +3, +4, +5, +6, +7, +8 (ein amphoteres Oxid) | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 1.28 | |||||||||||||||||||||||||||||||||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | empirisch: 159 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 187±1 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Spektrallinien von Plutonium | ||||||||||||||||||||||||||||||||||||||||||||||||
| Sonstige Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||
| Natürliches Vorkommen | aus Zerfall | |||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | monoklin | |||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2260 m/s | |||||||||||||||||||||||||||||||||||||||||||||||
| Thermische Ausdehnung | 46,7 µm/(m⋅K) (bei 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 6,74 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektrischer Widerstand | 1.460 µΩ⋅m (bei 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Magnetische Ordnung | paramagnetisch | |||||||||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 96 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Schermodul | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0.21 | |||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Geschichte | ||||||||||||||||||||||||||||||||||||||||||||||||
| Namensgebung | nach dem Zwergplaneten Pluto, der seinerseits nach dem klassischen Gott der Unterwelt Pluto benannt wurde | |||||||||||||||||||||||||||||||||||||||||||||||
| Entdeckung | Glenn T. Seaborg, Arthur Wahl, Joseph W. Kennedy, Edwin McMillan (1940-1941) | |||||||||||||||||||||||||||||||||||||||||||||||
| Hauptisotope von Plutonium | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Plutonium ist ein radioaktives chemisches Element mit dem Symbol Pu und der Ordnungszahl 94. Es ist ein Actinid-Metall von silbrig-grauem Aussehen, das an der Luft anläuft und bei Oxidation eine stumpfe Schicht bildet. Das Element weist normalerweise sechs Allotrope und vier Oxidationsstufen auf. Es reagiert mit Kohlenstoff, Halogenen, Stickstoff, Silizium und Wasserstoff. An feuchter Luft bildet es Oxide und Hydride, die die Probe um bis zu 70 % ihres Volumens ausdehnen können und als pyrophores Pulver abplatzen. Es ist radioaktiv und kann sich in Knochen anreichern, was den Umgang mit Plutonium gefährlich macht. ⓘ
Plutonium wurde erstmals Ende 1940 und Anfang 1941 synthetisch hergestellt und isoliert, und zwar durch Deuteronenbeschuss von Uran-238 im 1,5-Meter-Zyklotron der University of California, Berkeley. Zunächst wurde Neptunium-238 (Halbwertszeit 2,1 Tage) synthetisiert, das anschließend durch Betazerfall zu dem neuen Element mit der Ordnungszahl 94 und dem Atomgewicht 238 (Halbwertszeit 88 Jahre) zerfiel. Da Uran nach dem Planeten Uranus und Neptunium nach dem Planeten Neptun benannt worden war, wurde das Element 94 nach Pluto benannt, der damals ebenfalls als Planet angesehen wurde. Die Geheimhaltung während des Krieges hinderte das Team der University of California daran, seine Entdeckung bis 1948 zu veröffentlichen. ⓘ
Plutonium ist das Element mit der höchsten Ordnungszahl, das in der Natur vorkommt. Spurenmengen entstehen in natürlichen Uran-238-Lagerstätten, wenn Uran-238 Neutronen einfängt, die beim Zerfall anderer Uran-238-Atome entstehen. ⓘ
Sowohl Plutonium-239 als auch Plutonium-241 sind spaltbar, was bedeutet, dass sie eine nukleare Kettenreaktion auslösen können, was zu Anwendungen in Kernwaffen und Kernreaktoren führt. Plutonium-240 weist eine hohe Spontanspaltungsrate auf, wodurch sich der Neutronenfluss jeder Probe, die es enthält, erhöht. Das Vorhandensein von Plutonium-240 schränkt die Verwendbarkeit einer Plutoniumprobe für Waffen oder ihre Qualität als Reaktorbrennstoff ein, und der prozentuale Anteil von Plutonium-240 bestimmt ihre Qualität (waffentauglich, brennstofftauglich oder reaktortauglich). Plutonium-238 hat eine Halbwertszeit von 87,7 Jahren und sendet Alphateilchen aus. Es dient als Wärmequelle in radioisotopischen thermoelektrischen Generatoren, die zum Antrieb einiger Raumfahrzeuge verwendet werden. Plutoniumisotope sind teuer und schwer zu trennen, daher werden bestimmte Isotope normalerweise in speziellen Reaktoren hergestellt. ⓘ
Die erstmalige Herstellung von Plutonium in brauchbaren Mengen war ein wichtiger Teil des Manhattan-Projekts während des Zweiten Weltkriegs, in dessen Rahmen die ersten Atombomben entwickelt wurden. Die Fat-Man-Bomben, die beim Trinity-Atomtest im Juli 1945 und bei der Bombardierung von Nagasaki im August 1945 eingesetzt wurden, hatten Plutoniumkerne. Strahlungsexperimente am Menschen, bei denen Plutonium untersucht wurde, wurden ohne Einwilligung der Betroffenen durchgeführt, und nach dem Krieg ereigneten sich mehrere Kritikalitätsunfälle, von denen einige tödlich verliefen. Die Entsorgung von Plutoniumabfällen aus Kernkraftwerken und demontierten Kernwaffen, die während des Kalten Krieges gebaut wurden, ist ein Problem der nuklearen Weiterverbreitung und der Umwelt. Eine weitere Quelle für Plutonium in der Umwelt ist der Fallout zahlreicher oberirdischer Atomtests, die inzwischen verboten sind. ⓘ
Plutonium ist ein chemisches Element mit dem Elementsymbol Pu und der Ordnungszahl 94, der höchsten Ordnungszahl aller natürlich vorkommenden Elemente. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt zu den Transuranen. Benannt wurde es nach dem Zwergplaneten Pluto. ⓘ
Plutonium ist ein giftiges und radioaktives Schwermetall. Es wird in kleinsten Spuren in sehr alten Gesteinen gefunden. Größer ist die Menge, die künstlich in Kernkraftwerken erzeugt wird. ⓘ
Eigenschaften
Physikalische Eigenschaften
Wie die meisten Metalle hat Plutonium zunächst ein helles, silbriges Aussehen, ähnlich wie Nickel, aber es oxidiert sehr schnell zu einem stumpfen Grau, obwohl auch gelbe und olivgrüne Farben berichtet werden. Bei Raumtemperatur liegt Plutonium in seiner α-Form (Alpha) vor. Diese häufigste Strukturform des Elements (Allotrop) ist etwa so hart und spröde wie Grauguss, es sei denn, es wird mit anderen Metallen legiert, um es weich und dehnbar zu machen. Im Gegensatz zu den meisten Metallen ist es kein guter Wärme- oder Stromleiter. Es hat einen niedrigen Schmelzpunkt (640 °C, 1.184 °F) und einen ungewöhnlich hohen Siedepunkt (3.228 °C, 5.842 °F). Daraus ergibt sich ein großer Temperaturbereich (über 2.500 Kelvin), in dem Plutonium flüssig ist, der jedoch weder unter allen Aktiniden noch unter allen Metallen der größte ist. Der niedrige Schmelzpunkt sowie die Reaktivität des nativen Metalls im Vergleich zum Oxid führen dazu, dass Plutoniumoxide eine bevorzugte Form für Anwendungen wie Kernspaltungsreaktorbrennstoff (MOX-Brennstoff) sind. ⓘ
Der Alphazerfall, die Freisetzung eines hochenergetischen Heliumkerns, ist die häufigste Form des radioaktiven Zerfalls von Plutonium. Eine 5 kg schwere Masse von 239Pu enthält etwa 12,5×1024 Atome. Bei einer Halbwertszeit von 24.100 Jahren zerfallen etwa 11,5×1012 seiner Atome pro Sekunde unter Aussendung eines 5,157 MeV-Alphateilchens. Dies entspricht einer Leistung von 9,68 Watt. Die durch die Abbremsung dieser Alphateilchen erzeugte Wärme macht es handwarm. 238
Pu erwärmt sich aufgrund seiner viel kürzeren Halbwertszeit auf viel höhere Temperaturen und glüht rot mit Schwarzkörperstrahlung, wenn es ohne externe Heizung oder Kühlung belassen wird. Diese Wärme wird in thermoelektrischen Generatoren für Radioisotope genutzt (siehe unten). ⓘ
Der spezifische Widerstand ist ein Maß dafür, wie stark sich ein Material dem Fluss von elektrischem Strom widersetzt. Der spezifische Widerstand von Plutonium ist bei Raumtemperatur für ein Metall sehr hoch und steigt bei niedrigeren Temperaturen noch weiter an, was für Metalle ungewöhnlich ist. Diese Tendenz setzt sich bis zu 100 K fort, unterhalb derer der spezifische Widerstand bei frischen Proben rasch abnimmt. Bei etwa 20 K beginnt der Widerstand aufgrund von Strahlungsschäden mit der Zeit zu steigen, wobei die Geschwindigkeit von der Isotopenzusammensetzung der Probe abhängt. ⓘ
Aufgrund der Selbstbestrahlung ermüdet eine Plutoniumprobe in ihrer gesamten Kristallstruktur, d. h. die geordnete Anordnung der Atome wird mit der Zeit durch die Strahlung gestört. Die Selbstbestrahlung kann auch zu einer Glühung führen, die einigen Ermüdungseffekten entgegenwirkt, wenn die Temperatur über 100 K steigt. ⓘ
Im Gegensatz zu den meisten Werkstoffen nimmt die Dichte von Plutonium beim Schmelzen um 2,5 % zu, aber das flüssige Metall weist eine lineare Abnahme der Dichte mit der Temperatur auf. In der Nähe des Schmelzpunkts weist das flüssige Plutonium im Vergleich zu anderen Metallen eine sehr hohe Viskosität und Oberflächenspannung auf. ⓘ
Allotrope

Plutonium hat normalerweise sechs Allotrope und bildet bei hoher Temperatur innerhalb eines begrenzten Druckbereichs ein siebtes (Zeta, ζ). Diese Allotrope, bei denen es sich um verschiedene strukturelle Modifikationen oder Formen eines Elements handelt, haben sehr ähnliche innere Energien, aber deutlich unterschiedliche Dichten und Kristallstrukturen. Dadurch reagiert Plutonium sehr empfindlich auf Änderungen der Temperatur, des Drucks oder der chemischen Zusammensetzung und ermöglicht dramatische Volumenänderungen bei Phasenübergängen von einer allotropen Form zur anderen. Die Dichten der verschiedenen Allotrope variieren von 16,00 g/cm3 bis 19,86 g/cm3. ⓘ
Das Vorhandensein dieser vielen Allotrope macht die Bearbeitung von Plutonium sehr schwierig, da es sehr leicht seinen Zustand ändert. Die α-Form zum Beispiel liegt bei Raumtemperatur in unlegiertem Plutonium vor. Sie hat ähnliche Bearbeitungseigenschaften wie Gusseisen, geht aber bei etwas höheren Temperaturen in die plastische und verformbare β-Form (beta) über. Die Gründe für das komplizierte Phasendiagramm sind nicht ganz klar. Die α-Form hat eine monokline Struktur mit geringer Symmetrie, was zu Sprödigkeit, Festigkeit, Kompressibilität und schlechter Wärmeleitfähigkeit führt. ⓘ
Plutonium in der δ-(Delta-)Form liegt normalerweise im Temperaturbereich von 310 °C bis 452 °C vor, ist aber bei Raumtemperatur stabil, wenn es mit einem geringen Prozentsatz an Gallium, Aluminium oder Cer legiert wird, was die Verarbeitbarkeit verbessert und das Schweißen ermöglicht. Die δ-Form hat einen typischeren metallischen Charakter und ist in etwa so fest und verformbar wie Aluminium. In Spaltungswaffen bewirken die explosiven Schockwellen, die zur Komprimierung eines Plutoniumkerns eingesetzt werden, auch einen Übergang von der üblichen δ-Phase des Plutoniums zur dichteren α-Form, was wesentlich zur Erreichung der Überkritikalität beiträgt. Die ε-Phase, das feste Allotrop mit der höchsten Temperatur, weist im Vergleich zu anderen Elementen eine anomal hohe atomare Selbstdiffusion auf. ⓘ
Kernspaltung

Plutonium ist ein radioaktives Aktinidenmetall, dessen Isotop, Plutonium-239, eines der drei primären spaltbaren Isotope ist (Uran-233 und Uran-235 sind die beiden anderen); Plutonium-241 ist ebenfalls hoch spaltbar. Um als spaltbar zu gelten, muss der Atomkern eines Isotops in der Lage sein, auseinanderzubrechen oder zu spalten, wenn er von einem sich langsam bewegenden Neutron getroffen wird, und genügend zusätzliche Neutronen freizusetzen, um die nukleare Kettenreaktion durch Spaltung weiterer Kerne aufrechtzuerhalten. ⓘ
Reines Plutonium-239 kann einen Multiplikationsfaktor (keff) von mehr als eins aufweisen, was bedeutet, dass das Metall bei ausreichender Menge und geeigneter Geometrie (z. B. eine Kugel von ausreichender Größe) eine kritische Masse bilden kann. Bei der Spaltung wird ein Teil der nuklearen Bindungsenergie, die einen Kern zusammenhält, in Form einer großen Menge elektromagnetischer und kinetischer Energie freigesetzt (wobei ein Großteil der letzteren schnell in Wärmeenergie umgewandelt wird). Die Spaltung eines Kilogramms Plutonium-239 kann eine Explosion auslösen, die 21.000 Tonnen TNT (88.000 GJ) entspricht. Aufgrund dieser Energie wird Plutonium-239 in Kernwaffen und Reaktoren eingesetzt. ⓘ
Das Vorhandensein des Isotops Plutonium-240 in einer Probe schränkt ihr Atombombenpotenzial ein, da Plutonium-240 eine relativ hohe Spontanspaltungsrate hat (~440 Spaltungen pro Sekunde pro Gramm - über 1.000 Neutronen pro Sekunde pro Gramm), was die Hintergrundneutronenwerte erhöht und somit das Risiko einer Prädetonation steigert. Plutonium wird nach dem prozentualen Anteil an Plutonium-240 in waffenfähiges, brennstofffähiges oder reaktorfähiges Plutonium eingeteilt. Waffenfähiges Plutonium enthält weniger als 7 % Plutonium-240. Brennstofftaugliches Plutonium enthält zwischen 7 % und weniger als 19 % und reaktortaugliches Plutonium enthält 19 % oder mehr Plutonium-240. Supergrade-Plutonium mit einem Plutonium-240-Gehalt von weniger als 4 % wird aufgrund seiner geringeren Radioaktivität in Waffen der US-Marine verwendet, die in der Nähe von Schiffs- und U-Boot-Besatzungen gelagert werden. Das Isotop Plutonium-238 ist nicht spaltbar, kann aber sowohl mit schnellen Neutronen als auch durch Alphazerfall leicht gespalten werden. Alle Plutoniumisotope können durch eine oder mehrere Neutronenabsorptionen zu spaltbarem Material "gezüchtet" werden, unabhängig davon, ob ein Betazerfall folgt oder nicht. Dies macht die nicht spaltbaren Isotope des Plutoniums zu einem fruchtbaren Material. ⓘ
Isotope und Nukleosynthese
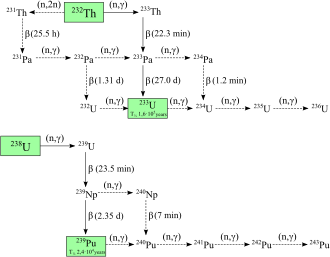
Zwanzig radioaktive Isotope des Plutoniums wurden charakterisiert. Die langlebigsten sind Plutonium-244 mit einer Halbwertszeit von 80,8 Millionen Jahren, Plutonium-242 mit einer Halbwertszeit von 373.300 Jahren und Plutonium-239 mit einer Halbwertszeit von 24.110 Jahren. Alle übrigen radioaktiven Isotope haben eine Halbwertszeit von weniger als 7.000 Jahren. Dieses Element hat auch acht metastabile Zustände, die jedoch alle eine Halbwertszeit von weniger als einer Sekunde haben. ⓘ
Die bekannten Isotope des Plutoniums haben eine Massenzahl zwischen 228 und 247. Die primären Zerfallsarten von Isotopen mit Massenzahlen unterhalb des stabilsten Isotops, Plutonium-244, sind Spontanspaltung und Alphastrahlung, wobei hauptsächlich Uran- (92 Protonen) und Neptunium-Isotope (93 Protonen) als Zerfallsprodukte entstehen (ohne Berücksichtigung der zahlreichen Tochterkerne, die durch Spaltungsprozesse entstehen). Der primäre Zerfallsmodus für Isotope mit höheren Massenzahlen als Plutonium-244 ist die Beta-Emission, wobei als Zerfallsprodukte hauptsächlich Americium-Isotope (95 Protonen) entstehen. Plutonium-241 ist das Hauptisotop der Neptunium-Zerfallsreihe und zerfällt durch Beta-Emission in Americium-241. ⓘ
Plutonium-238 und 239 sind die am häufigsten synthetisierten Isotope. Plutonium-239 wird durch die folgende Reaktion unter Verwendung von Uran (U) und Neutronen (n) durch Betazerfall (β-) mit Neptunium (Np) als Zwischenprodukt synthetisiert:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ {^{238}_{92}U} + {^{1}_{0}n} -> {^{239}_{92}U} ->[\beta^-] [23,5 \ \ce{min}] {^{239}_{93}Np} ->[\beta^-] [2.3565 \ \ce d] {^{239}_{94}Pu} <span title="Aus: Englische Wikipedia, Abschnitt "Isotopes and nucleosynthesis"" class="plainlinks">[https://en.wikipedia.org/wiki/Plutonium#Isotopes_and_nucleosynthesis <span style="color:#dddddd">ⓘ</span>]</span> }}
Neutronen aus der Spaltung von Uran-235 werden von Uran-238-Kernen eingefangen, um Uran-239 zu bilden; ein Betazerfall wandelt ein Neutron in ein Proton um, um Neptunium-239 zu bilden (Halbwertszeit 2,36 Tage) und ein weiterer Betazerfall bildet Plutonium-239. Diese Reaktion wurde 1940 von Egon Bretscher im Rahmen des britischen Projekts Tube Alloys theoretisch vorhergesagt. ⓘ
Plutonium-238 wird durch Beschuss von Uran-238 mit Deuteronen (D, die Kerne des schweren Wasserstoffs) in der folgenden Reaktion synthetisiert:
Bei diesem Prozess erzeugt ein Deuteron, das auf Uran-238 trifft, zwei Neutronen und Neptunium-238, das spontan unter Aussendung negativer Betateilchen zerfällt und Plutonium-238 bildet. Plutonium-238 kann auch durch Neutronenbestrahlung von Neptunium-237 erzeugt werden. ⓘ
Zerfallswärme und Spaltungseigenschaften
Plutoniumisotope unterliegen einem radioaktiven Zerfall, bei dem Zerfallswärme entsteht. Die verschiedenen Isotope erzeugen unterschiedliche Wärmemengen pro Masse. Die Zerfallswärme wird gewöhnlich in Watt/Kilogramm oder Milliwatt/Gramm angegeben. Bei größeren Plutoniumstücken (z. B. in einer Waffengrube) und unzureichender Wärmeabfuhr kann die daraus resultierende Selbsterhitzung erheblich sein. ⓘ
| Isotop | Zerfallsart | Halbwertszeit (Jahre) | Zerfallswärme (W/kg) | Spontane Spaltneutronen (1/(g-s)) | Bemerkung ⓘ |
|---|---|---|---|---|---|
| 238Pu | Alpha zu 234U | 87.74 | 560 | 2600 | Sehr hohe Zerfallswärme. Selbst in kleinen Mengen kann es zu erheblicher Selbsterhitzung kommen. Wird allein in thermoelektrischen Generatoren für Radioisotope verwendet. |
| 239Pu | Alpha zu 235U | 24100 | 1.9 | 0.022 | Das wichtigste spaltbare Isotop, das verwendet wird. |
| 240Pu | Alpha bis 236U, spontane Spaltung | 6560 | 6.8 | 910 | Die Hauptverunreinigung in Proben des Isotops 239Pu. Der Plutoniumgehalt wird gewöhnlich als Prozentsatz von 240Pu angegeben. Eine hohe Spontanspaltung verhindert die Verwendung in Kernwaffen. |
| 241Pu | Beta-Minus, bis 241Am | 14.4 | 4.2 | 0.049 | Zerfällt zu Americium-241; seine Anhäufung stellt in älteren Proben eine Strahlungsgefahr dar. |
| 242Pu | Alpha zu 238U | 376000 | 0.1 | 1700 | 242Pu zerfällt durch Alphazerfall zu 238U; kann auch durch Spontanspaltung zerfallen. |
Verbindungen und Chemie

Bei Raumtemperatur hat reines Plutonium eine silbrige Farbe, die sich jedoch bei Oxidation verfärbt. Das Element weist in wässriger Lösung vier übliche und eine seltene ionische Oxidationsstufe auf:
- Pu(III), als Pu3+ (lavendelblau)
- Pu(IV), als Pu4+ (gelbbraun)
- Pu(V), als PuO+
2 (hellrosa) - Pu(VI), als PuO2+
2 (rosa-orange) - Pu(VII), als PuO3-
5 (grün) - das heptavalente Ion ist selten. ⓘ
Die Farbe von Plutoniumlösungen hängt sowohl von der Oxidationsstufe als auch von der Art des Säureanions ab. Das Säureanion beeinflusst den Grad der Komplexbildung, d. h. die Art und Weise, wie sich die Atome mit dem Zentralatom der Plutoniumart verbinden. Darüber hinaus ist die formale Oxidationsstufe +2 von Plutonium im Komplex [K(2.2.2-cryptand)] [PuIICp″3], Cp″ = C5H3(SiMe3)2, bekannt. ⓘ
Eine Oxidationsstufe von +8 ist auch im flüchtigen Tetroxid PuO
4. Obwohl es sich leicht über einen Reduktionsmechanismus ähnlich wie FeO
4, kann PuO
4 kann in alkalischen Lösungen und Chloroform stabilisiert werden. ⓘ
Metallisches Plutonium wird durch Reaktion von Plutoniumtetrafluorid mit Barium, Calcium oder Lithium bei 1200 °C hergestellt. Metallisches Plutonium wird von Säuren, Sauerstoff und Dampf, nicht aber von Laugen angegriffen und löst sich leicht in konzentrierter Salz-, Jod- und Perchlorsäure. Geschmolzenes Metall muss im Vakuum oder in einer inerten Atmosphäre gehalten werden, um Reaktionen mit Luft zu vermeiden. Bei 135 °C entzündet sich das Metall an der Luft und explodiert, wenn es in Tetrachlorkohlenstoff gelegt wird. ⓘ

Plutonium ist ein reaktives Metall. In feuchter Luft oder feuchtem Argon oxidiert das Metall schnell und bildet eine Mischung aus Oxiden und Hydriden. Wenn das Metall lange genug einer begrenzten Menge Wasserdampf ausgesetzt wird, bildet sich eine pulverförmige Oberflächenbeschichtung aus PuO2. Es bildet sich auch Plutoniumhydrid, aber bei einem Überschuss an Wasserdampf entsteht nur PuO2. ⓘ
Plutonium zeigt eine enorme und reversible Reaktionsgeschwindigkeit mit reinem Wasserstoff und bildet Plutoniumhydrid. Es reagiert auch leicht mit Sauerstoff und bildet PuO und PuO2 sowie Zwischenoxide; Plutoniumoxid füllt 40 % mehr Volumen als Plutoniummetall. Das Metall reagiert mit den Halogenen, wobei Verbindungen mit der allgemeinen Formel PuX3 entstehen, wobei X F, Cl, Br oder I sein kann und auch PuF4 vorkommt. Die folgenden Oxyhalogenide werden beobachtet: PuOCl, PuOBr und PuOI. Mit Kohlenstoff reagiert es unter Bildung von PuC, mit Stickstoff unter Bildung von PuN und mit Silizium unter Bildung von PuSi2. ⓘ
Die organometallische Chemie von Plutoniumkomplexen ist typisch für Organoactinid-Spezies; ein charakteristisches Beispiel für eine Organoplutoniumverbindung ist Plutonocen. Methoden der Computerchemie weisen auf einen verstärkten kovalenten Charakter der Plutonium-Liganden-Bindung hin. ⓘ
Pulver von Plutonium, seinen Hydriden und bestimmten Oxiden wie Pu2O3 sind pyrophor, d. h. sie können sich bei Umgebungstemperatur spontan entzünden und werden daher in einer inerten, trockenen Atmosphäre aus Stickstoff oder Argon gehandhabt. Plutonium in loser Form entzündet sich erst bei einer Temperatur von über 400 °C. Pu2O3 erhitzt sich spontan und wandelt sich in PuO2 um, das in trockener Luft stabil ist, aber bei Erhitzung mit Wasserdampf reagiert. ⓘ
Tiegel, die Plutonium enthalten sollen, müssen dessen stark reduzierenden Eigenschaften standhalten können. Refraktärmetalle wie Tantal und Wolfram sowie die stabileren Oxide, Boride, Karbide, Nitride und Silizide können dies verkraften. Durch Schmelzen in einem Lichtbogenofen können kleine Barren des Metalls hergestellt werden, ohne dass ein Schmelztiegel erforderlich ist. ⓘ
Cerium wird als chemisches Plutoniumsimulanz für die Entwicklung von Einschluss-, Extraktions- und anderen Technologien verwendet. ⓘ
Elektronische Struktur
Plutonium ist ein Element, bei dem die 5f-Elektronen die Übergangsgrenze zwischen delokalisiert und lokalisiert bilden; es gilt daher als eines der komplexesten Elemente. Das anomale Verhalten von Plutonium ist auf seine elektronische Struktur zurückzuführen. Der Energieunterschied zwischen den 6d- und 5f-Unterschalen ist sehr gering. Die Größe der 5f-Schale reicht gerade aus, um den Elektronen die Bildung von Bindungen innerhalb des Gitters zu ermöglichen, genau an der Grenze zwischen lokalisiertem und bindendem Verhalten. Die Nähe der Energieniveaus führt zu mehreren niederenergetischen Elektronenkonfigurationen mit nahezu gleichen Energieniveaus. Dies führt zu konkurrierenden 5fn7s2- und 5fn-16d17s2-Konfigurationen, was die Komplexität des chemischen Verhaltens verursacht. Die stark gerichtete Natur der 5f-Orbitale ist verantwortlich für gerichtete kovalente Bindungen in Molekülen und Komplexen von Plutonium. ⓘ
Legierungen
Plutonium kann mit den meisten anderen Metallen Legierungen und Zwischenverbindungen bilden. Ausnahmen sind Lithium, Natrium, Kalium, Rubidium und Cäsium von den Alkalimetallen, Magnesium, Calcium, Strontium und Barium von den Erdalkalimetallen sowie Europium und Ytterbium von den Seltenerdmetallen. Teilweise ausgenommen sind die Refraktärmetalle Chrom, Molybdän, Niob, Tantal und Wolfram, die in flüssigem Plutonium löslich sind, in festem Plutonium jedoch unlöslich oder nur schwer löslich. Gallium, Aluminium, Americium, Scandium und Cerium können die δ-Phase von Plutonium bei Raumtemperatur stabilisieren. Silizium, Indium, Zink und Zirkonium ermöglichen die Bildung eines metastabilen δ-Zustands bei schneller Abkühlung. Hohe Mengen an Hafnium, Holmium und Thallium ermöglichen ebenfalls eine gewisse Beibehaltung der δ-Phase bei Raumtemperatur. Neptunium ist das einzige Element, das die α-Phase bei höheren Temperaturen stabilisieren kann. ⓘ
Plutoniumlegierungen können durch Zugabe eines Metalls zu geschmolzenem Plutonium hergestellt werden. Wenn das Legierungsmetall ausreichend reduktiv ist, kann Plutonium in Form von Oxiden oder Halogeniden hinzugefügt werden. Die δ-Phasen-Plutonium-Gallium- und Plutonium-Aluminium-Legierungen werden durch Zugabe von Plutonium(III)-Fluorid zu geschmolzenem Gallium oder Aluminium hergestellt, was den Vorteil hat, dass man nicht direkt mit dem hochreaktiven Plutoniummetall zu tun hat.
- Plutonium-Gallium wird zur Stabilisierung der δ-Phase von Plutonium verwendet, wodurch die mit der α-Phase und α-δ verbundenen Probleme vermieden werden. Es wird vor allem in den Gruben von Implosionskernwaffen verwendet.
- Plutonium-Aluminium ist eine Alternative zur Pu-Ga-Legierung. Ursprünglich war es das Element, das für die Stabilisierung der δ-Phase in Betracht gezogen wurde, aber seine Tendenz, mit den Alphateilchen zu reagieren und Neutronen freizusetzen, schränkt seine Verwendbarkeit für Kernwaffengruben ein. Die Plutonium-Aluminium-Legierung kann auch als Bestandteil von Kernbrennstoff verwendet werden.
- Die Plutonium-Gallium-Kobalt-Legierung (PuCoGa5) ist ein unkonventioneller Supraleiter, der unterhalb von 18,5 K eine Supraleitfähigkeit aufweist, die um eine Größenordnung höher ist als die höchste zwischen schweren Fermionensystemen, und der einen hohen kritischen Strom aufweist.
- Die Plutonium-Zirkonium-Legierung kann als Kernbrennstoff verwendet werden.
- Plutonium-Cerium- und Plutonium-Cerium-Cobalt-Legierungen werden als Kernbrennstoffe verwendet.
- Plutonium-Uran mit etwa 15-30 Mol-% Plutonium kann als Kernbrennstoff für schnelle Brutreaktoren verwendet werden. Sein pyrophorer Charakter und seine hohe Korrosionsanfälligkeit bis hin zur Selbstentzündung oder zum Zerfall an der Luft erfordern eine Legierung mit anderen Komponenten. Die Zugabe von Aluminium, Kohlenstoff oder Kupfer verbessert die Zersetzungsrate nicht merklich, Zirkonium- und Eisenlegierungen haben eine bessere Korrosionsbeständigkeit, zerfallen aber ebenfalls in mehreren Monaten an der Luft. Durch den Zusatz von Titan und/oder Zirkonium wird der Schmelzpunkt der Legierung deutlich erhöht.
- Plutonium-Uran-Titan und Plutonium-Uran-Zirkonium wurden für die Verwendung als Kernbrennstoffe untersucht. Der Zusatz des dritten Elements erhöht die Korrosionsbeständigkeit, verringert die Entflammbarkeit und verbessert die Duktilität, Verarbeitbarkeit, Festigkeit und Wärmeausdehnung. Plutonium-Uran-Molybdän hat die beste Korrosionsbeständigkeit, da es einen Schutzfilm aus Oxiden bildet, aber Titan und Zirkonium werden aus physikalischen Gründen bevorzugt.
- Thorium-Uran-Plutonium wurde als Kernbrennstoff für schnelle Brüterreaktoren untersucht. ⓘ
Biologische Aspekte
Eine biologische Funktion des Plutoniums ist nicht bekannt. Weitere Forschungen und Untersuchungen konzentrierten sich auf mikrobielle Wechselwirkungen mit Plutonium, um auf diesem Wege kontaminierte Deponien und Umgebungen zu sanieren. Enterobakterien der Gattung Citrobacter können durch die Phosphataseaktivität in ihrer Zellwand Pu(IV) aus wässriger Lösung ausfällen und als Lanthan-Phosphat-Komplex binden. ⓘ
Vorkommen

In der Natur sind Spuren von Plutonium-238, Plutonium-239, Plutonium-240 und Plutonium-244 zu finden. Geringe Spuren von Plutonium-239, einige Teile pro Billion, und seine Zerfallsprodukte sind in einigen konzentrierten Uranerzen natürlich vorhanden, z. B. im natürlichen Kernspaltungsreaktor in Oklo, Gabun. Das Verhältnis von Plutonium-239 zu Uran in der Uranlagerstätte Cigar Lake Mine reicht von 2,4×10-12 bis 44×10-12. Diese Spuren von 239Pu entstehen auf folgende Weise: In seltenen Fällen kommt es zu einer spontanen Spaltung von 238U, bei der der Kern ein oder zwei freie Neutronen mit einer gewissen kinetischen Energie aussendet. Wenn eines dieser Neutronen auf den Kern eines anderen 238U-Atoms trifft, wird es von diesem absorbiert und wird zu 239U. Mit einer relativ kurzen Halbwertszeit zerfällt 239U in 239Np, das wiederum in 239Pu zerfällt. Schließlich wurden in natürlichen Uranproben äußerst geringe Mengen von Plutonium-238 gefunden, die auf den extrem seltenen doppelten Betazerfall von Uran-238 zurückzuführen sind. ⓘ
Aufgrund seiner relativ langen Halbwertszeit von etwa 80 Millionen Jahren wurde vermutet, dass Plutonium-244 in der Natur als primordiales Nuklid vorkommt, aber frühe Berichte über seinen Nachweis konnten nicht bestätigt werden. Seine lange Halbwertszeit sorgte jedoch dafür, dass es vor seinem Aussterben im gesamten Sonnensystem zirkulierte, und in der Tat wurden in Meteoriten Hinweise auf die spontane Spaltung von erloschenem 244Pu gefunden. Das frühere Vorhandensein von 244Pu im frühen Sonnensystem wurde bestätigt, da es sich heute in Form eines Überschusses an seinen Töchtern, entweder 232Th (aus dem Alphazerfall) oder Xenon-Isotopen (aus der Spontanspaltung), manifestiert. Letztere sind im Allgemeinen nützlicher, da die chemische Zusammensetzung von Thorium und Plutonium recht ähnlich ist (beide sind überwiegend vierwertig) und daher ein Thoriumüberschuss kein eindeutiger Beweis dafür wäre, dass ein Teil davon als Plutoniumtochter gebildet wurde. 244Pu hat die längste Halbwertszeit aller transuranischen Nuklide und entsteht nur im r-Prozess in Supernovae und kollidierenden Neutronensternen; wenn die Kerne von diesen Ereignissen mit hoher Geschwindigkeit zur Erde geschleudert werden, hat nur 244Pu unter den transuranischen Nukliden eine ausreichend lange Halbwertszeit, um die Reise zu überleben, und daher wurden winzige Spuren von lebendem interstellarem 244Pu im Boden der Tiefsee gefunden. Da 240Pu auch in der Zerfallskette von 244Pu vorkommt, muss es also ebenfalls im säkularen Gleichgewicht vorhanden sein, wenn auch in noch geringeren Mengen. ⓘ
Aufgrund der 550 atmosphärischen und unterseeischen Atomtests und einiger weniger schwerer Nuklearunfälle finden sich in der Regel winzige Spuren von Plutonium im menschlichen Körper. Die meisten atmosphärischen und Unterwasser-Atomtests wurden 1963 durch den Vertrag über das begrenzte Verbot von Atomtests eingestellt, der von den Atommächten USA, Vereinigtes Königreich und Sowjetunion unterzeichnet und ratifiziert wurde. Frankreich setzte die atmosphärischen Kernwaffentests bis 1974 fort, und China setzte sie bis 1980 fort. Alle nachfolgenden Atomtests wurden unterirdisch durchgeführt. ⓘ
Von den Naturreaktoren von Oklo in Gabun sowie von einer benachbarten Uranlagerstätte ist bekannt, dass dort vor etwa 1,5 bis 2 Milliarden Jahren über mehrere Jahrtausende Kernspaltung als Kettenreaktion in natürlichem Umfeld auftrat. Durch die Anlagerung von Spaltungsneutronen an 238U entstanden dort etwa 2 bis 4 Tonnen 239Pu. In einigen Teilen der Oklo-Lagerstätte trug die auch direkte Spaltung von 239Pu nennenswert zur Gesamtkernspaltung bei. Etwa ein Drittel des insgesamt gespaltenen 235U soll aus dem Alphazerfall von 239Pu gestammt haben. Etwaige Reste des erzeugten Plutoniums sind mittlerweile komplett zerfallen. ⓘ
Mit verfeinerter Spurenanalytik gelang es, im Mineral Bastnäsit, das nach dem Fundort Bastnäs in Schweden benannt wurde, geringste Spuren des langlebigsten Plutoniumisotops 244Pu nachzuweisen. Dieses Plutonium stammt aus der Entstehungszeit des Sonnensystems, ist also ein primordiales Nuklid. Die gefundenen Mengen sind so gering, dass sie erst im Jahr 1971, also lange nach der künstlichen Erzeugung von Plutonium in Kernreaktoren, entdeckt wurden. ⓘ
Es wird berichtet, dass 244Pu in geringster Menge aus Sedimenten am Meeresboden isoliert wurde, die aus Sternenstaub kommen sollen. Hierfür werden als Urheber Verschmelzungen von Neutronensternen vermutet. ⓘ
Künstliches Vorkommen
Plutonium entsteht in Kernwaffen und in Kernreaktoren durch Transmutation von Uran. Mittlerweile (2016) haben die Nuklearmächte und andere Staaten, die Kernkraftwerke betreiben, ein Gesamtinventar von hunderten Tonnen auf diese Weise künstlich erzeugten Plutoniums, darunter Russland 180 Tonnen und USA 90 Tonnen separierten Plutoniums. ⓘ
Freisetzung durch anthropogene Ursachen
Anthropogen wurde Plutonium zwischen 1945 und 1980 durch oberirdische Kernwaffentests in einer Menge von drei bis fünf Tonnen freigesetzt, die in Spuren weltweit nachweisbar sind. Weitere Mengen wurden durch verschiedene unbeabsichtigte Ereignisse und Unfälle freigesetzt.
- Freisetzungen bei Kernwaffenunfällen und bei Unfällen in Kernwaffen-Laboratorien
- Fehlgeschlagene Weltraummissionen und Wiedereintritt von Satelliten mit Radionuklidbatterien, wie durch Transit 5BN-3, Kosmos 954 und Apollo 13
- Brand des Reaktors der Plutoniumfabrik von Sellafield (damals Windscale) im Jahre 1957
- Unfälle mit Atom-U-Booten
- im Abwasser von Kernforschungsanlagen und von Aufarbeitungsanlagen
- Mitunter erfolgte in der Vergangenheit legale und illegale Verklappung radioaktiver Abfälle in die Ozeane
- Der Großteil des bei der Reaktorkatastrophe von Tschernobyl entwichenen Plutoniums blieb in einem Umkreis von 100 Kilometer um den Reaktor. Auch 1957 beim Kyschtym-Unfall in der russischen Majakanlage entwichen erhebliche Mengen an Plutonium, die hauptsächlich lokal und regional abgelagert wurden. ⓘ
Geschichte
Entdeckung
Enrico Fermi und ein Team von Wissenschaftlern der Universität Rom meldeten 1934, dass sie das Element 94 entdeckt hätten. Fermi nannte das Element Hesperium und erwähnte es 1938 in seiner Nobelvorlesung. Die Probe enthielt tatsächlich Produkte der Kernspaltung, vor allem Barium und Krypton. Die 1938 in Deutschland von Otto Hahn und Fritz Strassmann entdeckte Kernspaltung war zu diesem Zeitpunkt noch unbekannt. ⓘ

Plutonium (insbesondere Plutonium-238) wurde erstmals zwischen Dezember 1940 und Februar 1941 von Glenn T. Seaborg, Edwin McMillan, Emilio Segrè, Joseph W. Kennedy und Arthur Wahl durch Deuteronenbeschuss von Uran im 60-Zoll-Zyklotron (150 cm) des Berkeley Radiation Laboratory der University of California, Berkeley, hergestellt, isoliert und chemisch identifiziert. Neptunium-238 wurde direkt durch den Beschuss erzeugt, zerfiel aber durch Betastrahlung mit einer Halbwertszeit von etwas mehr als zwei Tagen, was auf die Bildung des Elements 94 hindeutet. Der erste Beschuss fand am 14. Dezember 1940 statt, und das neue Element wurde erstmals in der Nacht vom 23. auf den 24. Februar 1941 durch Oxidation nachgewiesen. ⓘ
Das Team verfasste eine Arbeit, die die Entdeckung dokumentierte, und schickte sie im März 1941 an die Zeitschrift Physical Review, deren Veröffentlichung sich jedoch aufgrund von Sicherheitsbedenken bis ein Jahr nach Ende des Zweiten Weltkriegs verzögerte. Am Cavendish Laboratory in Cambridge erkannten Egon Bretscher und Norman Feather, dass ein langsamer Neutronenreaktor, der mit Uran betrieben wird, theoretisch erhebliche Mengen an Plutonium-239 als Nebenprodukt erzeugen würde. Sie berechneten, dass das Element 94 spaltbar wäre und den zusätzlichen Vorteil hätte, dass es sich chemisch von Uran unterscheidet und leicht von ihm abgetrennt werden könnte. ⓘ
McMillan hatte kürzlich das erste Transuran-Element Neptunium nach dem Planeten Neptun benannt und schlug vor, das Element 94 als nächstes Element der Reihe nach dem damals als nächsten Planeten geltenden Pluto zu benennen. Nicholas Kemmer vom Cambridge-Team schlug unabhängig davon denselben Namen vor, wobei er sich auf die gleichen Überlegungen wie das Berkeley-Team stützte. Seaborg hatte ursprünglich den Namen "Plutium" in Erwägung gezogen, fand aber später, dass er nicht so gut klang wie "Plutonium". Er wählte die Buchstaben "Pu" als Scherz, in Anlehnung an den Ausruf "P U" für einen besonders ekelhaften Geruch, der unbemerkt in das Periodensystem aufgenommen wurde. Alternative Namen, die Seaborg und andere in Erwägung zogen, waren "Ultimium" oder "Extremium", weil sie fälschlicherweise glaubten, das letzte mögliche Element im Periodensystem gefunden zu haben. ⓘ
Hahn und Strassmann sowie unabhängig davon Kurt Starke arbeiteten zu diesem Zeitpunkt in Berlin ebenfalls an transuranischen Elementen. Es ist wahrscheinlich, dass Hahn und Strassmann wussten, dass Plutonium-239 spaltbar sein sollte. Sie verfügten jedoch nicht über eine starke Neutronenquelle. Das Element 93 wurde 1942 von Hahn und Strassmann sowie von Starke gemeldet. Hahns Gruppe verfolgte das Element 94 nicht weiter, wahrscheinlich weil sie durch den mangelnden Erfolg von McMillan und Abelson bei der Isolierung des Elements entmutigt wurde, als sie das Element 93 gefunden hatten. Da Hahns Gruppe zu diesem Zeitpunkt jedoch Zugang zu dem stärkeren Zyklotron in Paris hatte, wäre sie wahrscheinlich in der Lage gewesen, Plutonium nachzuweisen, wenn auch nur in winzigen Mengen (einige Becquerel). ⓘ
Frühe Forschung
Die Chemie des Plutoniums ähnelte bereits nach einigen Monaten der ersten Untersuchungen der des Urans. Die frühen Forschungen wurden im geheimen metallurgischen Labor der Universität Chicago fortgesetzt. Am 20. August 1942 wurde zum ersten Mal eine Spurenmenge dieses Elements isoliert und gemessen. Es entstanden etwa 50 Mikrogramm Plutonium-239 in Verbindung mit Uran und Spaltprodukten, und nur etwa 1 Mikrogramm wurde isoliert. Dieses Verfahren ermöglichte den Chemikern die Bestimmung des Atomgewichts des neuen Elements. Am 2. Dezember 1942 gelang Forschern unter der Leitung von Enrico Fermi auf einem Racketplatz unter der Westtribüne des Stagg Field der University of Chicago die erste sich selbst erhaltende Kettenreaktion in einem Graphit- und Uranhaufen mit der Bezeichnung CP-1. Auf der Grundlage der theoretischen Informationen, die aus dem Betrieb von CP-1 gewonnen wurden, baute DuPont einen luftgekühlten experimentellen Produktionsreaktor, bekannt als X-10, und eine chemische Pilotanlage in Oak Ridge. In der Trennanlage wurde mit Hilfe von Methoden, die von Glenn T. Seaborg und einem Forscherteam am Met Lab entwickelt worden waren, Plutonium aus dem im X-10-Reaktor bestrahlten Uran entfernt. Die Informationen aus CP-1 waren auch für die Wissenschaftler des Met Lab nützlich, die die wassergekühlten Reaktoren für die Plutoniumproduktion in Hanford entwarfen. Die Bauarbeiten an der Anlage begannen Mitte 1943. ⓘ
Im November 1943 wurde etwas Plutoniumtrifluorid reduziert, um die erste Probe von Plutoniummetall herzustellen: einige Mikrogramm Metallkügelchen. Es wurde so viel Plutonium hergestellt, dass es das erste synthetisch hergestellte Element war, das mit bloßem Auge sichtbar war. ⓘ
Auch die nuklearen Eigenschaften von Plutonium-239 wurden untersucht; die Forscher fanden heraus, dass es bei einem Neutronentreffer auseinanderbricht (spaltet) und mehr Neutronen und Energie freisetzt. Diese Neutronen können in einer exponentiell schnellen Kettenreaktion auf andere Plutonium-239-Atome treffen und so weiter. Dies kann zu einer Explosion führen, die groß genug ist, um eine Stadt zu zerstören, wenn genug von dem Isotop konzentriert ist, um eine kritische Masse zu bilden. ⓘ
In der Anfangsphase der Forschung wurden Tiere verwendet, um die Auswirkungen radioaktiver Stoffe auf die Gesundheit zu untersuchen. Diese Studien begannen 1944 im Strahlungslabor der University of California in Berkeley und wurden von Joseph G. Hamilton durchgeführt. Hamilton suchte nach Antworten auf die Frage, wie sich Plutonium im Körper in Abhängigkeit von der Expositionsart (orale Aufnahme, Inhalation, Absorption durch die Haut) und den Retentionsraten verändern würde und wie Plutonium im Gewebe fixiert und auf die verschiedenen Organe verteilt würde. Hamilton begann damit, Ratten lösliche Mikrogramm-Portionen von Plutonium-239-Verbindungen zu verabreichen, wobei er verschiedene Wertigkeitsstufen und verschiedene Methoden der Plutoniumzufuhr (oral, intravenös usw.) verwendete. Schließlich führte auch das Labor in Chicago seine eigenen Plutoniuminjektionsversuche mit verschiedenen Tieren wie Mäusen, Kaninchen, Fischen und sogar Hunden durch. Die Ergebnisse der Studien in Berkeley und Chicago zeigten, dass sich das physiologische Verhalten von Plutonium deutlich von dem von Radium unterscheidet. Das alarmierendste Ergebnis war, dass sich Plutonium in erheblichem Umfang in der Leber und im "aktiv metabolisierenden" Teil der Knochen ablagerte. Außerdem unterschied sich die Ausscheidungsrate von Plutonium in den Ausscheidungen zwischen den einzelnen Tierarten um den Faktor fünf. Aufgrund dieser Unterschiede war es äußerst schwierig, die Ausscheidungsrate für den Menschen zu schätzen. ⓘ
Produktion während des Manhattan-Projekts
Während des Zweiten Weltkriegs richtete die US-Regierung das Manhattan-Projekt ein, dessen Aufgabe die Entwicklung einer Atombombe war. Die drei wichtigsten Forschungs- und Produktionsstätten des Projekts waren die Plutoniumproduktionsanlage am heutigen Standort Hanford, die Urananreicherungsanlagen in Oak Ridge, Tennessee, und das Labor für Waffenforschung und -entwicklung, das heute als Los Alamos National Laboratory bekannt ist. ⓘ


Der erste Produktionsreaktor, der Plutonium-239 herstellte, war der X-10 Graphitreaktor. Er ging 1943 in Betrieb und wurde in einer Anlage in Oak Ridge gebaut, die später zum Oak Ridge National Laboratory wurde. ⓘ
Im Januar 1944 legten Arbeiter das Fundament für das erste Gebäude zur chemischen Trennung, die T-Anlage in 200-West. Sowohl die T-Anlage als auch ihre Schwesteranlage in 200-West, die U-Anlage, wurden bis Oktober fertig gestellt. (Die Anlage U wurde während des Manhattan-Projekts nur zu Schulungszwecken genutzt.) Das Trenngebäude in 200-Ost, die Anlage B, wurde im Februar 1945 fertig gestellt. Die zweite für 200-Ost geplante Anlage wurde gestrichen. Die Separationsgebäude, die von den Arbeitern, die sie bauten, den Spitznamen Queen Marys erhielten, waren beeindruckende, schluchtartige Bauwerke, die 800 Fuß lang, 65 Fuß breit und 80 Fuß hoch waren und vierzig Prozessbecken enthielten. Das Innere hatte etwas Unheimliches an sich, da die Bediener hinter einer sieben Fuß hohen Betonabschirmung die Fernbedienungsgeräte bedienten, indem sie von einer oberen Galerie aus durch Fernsehmonitore und Periskope schauten. Selbst mit den massiven Betondeckeln auf den Prozessbecken waren Vorsichtsmaßnahmen gegen die Strahlenbelastung notwendig und beeinflussten alle Aspekte der Anlagenplanung. ⓘ
Am 5. April 1944 erhielt Emilio Segrè in Los Alamos die erste Probe von im Reaktor hergestelltem Plutonium aus Oak Ridge. Innerhalb von zehn Tagen stellte er fest, dass reaktorgezüchtetes Plutonium eine höhere Konzentration des Isotops Plutonium-240 aufwies als zyklotrongezüchtetes Plutonium. Plutonium-240 hat eine hohe Spontanspaltungsrate, wodurch sich der Gesamt-Hintergrundneutronenwert der Plutoniumprobe erhöht. Die ursprüngliche Plutoniumwaffe mit dem Codenamen "Thin Man" musste deshalb aufgegeben werden - die erhöhte Anzahl spontaner Neutronen bedeutete, dass eine nukleare Vordetonation (Fizzle) wahrscheinlich war. ⓘ
Die gesamte Plutoniumwaffenentwicklung in Los Alamos wurde bald auf die kompliziertere Implosionsvorrichtung mit dem Codenamen "Fat Man" umgestellt. Bei einer Implosionswaffe wird das Plutonium mit Hilfe von Sprenglinsen auf eine hohe Dichte komprimiert - eine technisch anspruchsvollere Aufgabe als die einfache Kanonenbauweise, aber notwendig, um Plutonium für Waffenzwecke zu verwenden. Angereichertes Uran hingegen kann mit beiden Methoden verwendet werden. ⓘ
Der Bau des Hanford-B-Reaktors, des ersten Kernreaktors im industriellen Maßstab für die Materialproduktion, wurde im März 1945 abgeschlossen. Der B-Reaktor produzierte das spaltbare Material für die im Zweiten Weltkrieg eingesetzten Plutoniumwaffen. B, D und F waren die ersten Reaktoren, die in Hanford gebaut wurden, und sechs weitere plutoniumproduzierende Reaktoren wurden später am Standort errichtet. ⓘ
Ende Januar 1945 wurde das hochgereinigte Plutonium im fertiggestellten Gebäude für die chemische Isolierung weiter konzentriert, wo die restlichen Verunreinigungen erfolgreich entfernt wurden. Am 2. Februar erhielt Los Alamos sein erstes Plutonium aus Hanford. Obwohl noch keineswegs klar war, dass bis Kriegsende genügend Plutonium für den Einsatz in Bomben produziert werden konnte, war Hanford Anfang 1945 in Betrieb. Nur zwei Jahre waren vergangen, seit Oberst Franklin Matthias sein provisorisches Hauptquartier am Ufer des Columbia River eingerichtet hatte. ⓘ
Kate Brown zufolge haben die Plutoniumproduktionsanlagen in Hanford und Majak in Russland über einen Zeitraum von vier Jahrzehnten "jeweils mehr als 200 Millionen Curies radioaktiver Isotope in die Umgebung freigesetzt - doppelt so viel wie bei der Katastrophe von Tschernobyl". Der größte Teil dieser radioaktiven Verseuchung im Laufe der Jahre war Teil des normalen Betriebs, aber es gab auch unvorhergesehene Unfälle, die von der Kraftwerksleitung geheim gehalten wurden, während die Verschmutzung unvermindert anhielt. ⓘ
Im Jahr 2004 wurde bei der Ausgrabung eines Grabens auf dem Gelände des Kernkraftwerks Hanford ein Safe entdeckt. In dem Tresor befanden sich verschiedene Gegenstände, darunter eine große Glasflasche mit einer weißlichen Aufschlämmung, die später als die älteste bekannte Probe von waffenfähigem Plutonium identifiziert wurde. Eine Isotopenanalyse des Pacific Northwest National Laboratory ergab, dass das Plutonium in der Flasche 1944 im X-10-Graphitreaktor in Oak Ridge hergestellt wurde. ⓘ
Trinity- und Fat-Man-Atombomben

Der erste Atombombentest mit dem Codenamen "Trinity", der am 16. Juli 1945 in der Nähe von Alamogordo, New Mexico, gezündet wurde, verwendete Plutonium als spaltbares Material. Bei der Implosionskonstruktion des "Gadgets", wie die Trinity-Bombe genannt wurde, wurden konventionelle Sprenglinsen verwendet, um eine Plutoniumkugel zu einer überkritischen Masse zu komprimieren, die gleichzeitig mit Neutronen aus dem "Urchin", einem Initiator aus Polonium und Beryllium, beschossen wurde (Neutronenquelle: (α, n)-Reaktion). Zusammen sorgten sie für eine unkontrollierte Kettenreaktion und eine Explosion. Die gesamte Waffe wog über 4 Tonnen, obwohl in ihrem Kern nur 6,2 kg Plutonium verwendet wurden. Etwa 20 % des in der Trinity-Waffe verwendeten Plutoniums wurde gespalten, was zu einer Explosion mit einer Energie führte, die etwa 20.000 Tonnen TNT entspricht. ⓘ
Eine identische Konstruktion wurde in der Atombombe "Fat Man" verwendet, die am 9. August 1945 auf Nagasaki, Japan, abgeworfen wurde und 35.000-40.000 Menschen tötete und 68%-80% der Kriegsproduktion in Nagasaki zerstörte. Erst nach der Ankündigung der ersten Atombombenabwürfe wurden die Existenz und der Name von Plutonium durch den Smyth-Bericht des Manhattan-Projekts der Öffentlichkeit bekannt gemacht. ⓘ
Verwendung und Abfälle im Kalten Krieg
Während des Kalten Krieges legten sowohl die Sowjetunion als auch die Vereinigten Staaten große Bestände an waffenfähigem Plutonium an. Die US-Reaktoren in Hanford und die Savannah River Site in South Carolina produzierten 103 Tonnen, und in der UdSSR wurden schätzungsweise 170 Tonnen waffenfähiges Plutonium hergestellt. Jedes Jahr werden immer noch etwa 20 Tonnen des Elements als Nebenprodukt der Kernkraftindustrie produziert. Möglicherweise lagern bis zu 1000 Tonnen Plutonium, von denen mehr als 200 Tonnen entweder in Kernwaffen enthalten sind oder aus diesen gewonnen wurden. Das SIPRI schätzte den weltweiten Plutoniumbestand im Jahr 2007 auf etwa 500 Tonnen, die sich zu gleichen Teilen auf Waffen und zivile Bestände verteilen. ⓘ
Die radioaktive Kontamination der Anlage in Rocky Flats ist hauptsächlich auf zwei große Plutoniumbrände in den Jahren 1957 und 1969 zurückzuführen. Während der gesamten Betriebszeit der Anlage von 1952 bis 1992 wurden wesentlich geringere Konzentrationen radioaktiver Isotope freigesetzt. Die von der Anlage ausgehenden Winde trugen die Kontamination durch die Luft nach Süden und Osten in die besiedelten Gebiete nordwestlich von Denver. Die Kontamination des Gebiets von Denver durch Plutonium aus den Bränden und anderen Quellen wurde erst in den 1970er Jahren öffentlich bekannt gegeben. In einer von Edward Martell mitverfassten Studie aus dem Jahr 1972 heißt es: "In den dichter besiedelten Gebieten von Denver ist die Pu-Kontamination in den Oberflächenböden um ein Vielfaches höher als die Fallout-Kontamination", und die Plutoniumkontamination "unmittelbar östlich der Anlage von Rocky Flats beträgt das Hundertfache der Kontamination durch Atomtests". Carl Johnson schreibt in Ambio: "Die Exposition einer großen Bevölkerungsgruppe in der Gegend von Denver gegenüber Plutonium und anderen Radionukliden in den Abgasen der Anlage geht auf das Jahr 1953 zurück." Die Waffenproduktion in der Anlage Rocky Flats wurde nach einer gemeinsamen Razzia von FBI und EPA im Jahr 1989 und jahrelangen Protesten gestoppt. Seitdem ist die Anlage stillgelegt, ihre Gebäude wurden abgerissen und vollständig vom Gelände entfernt. ⓘ
In den USA wird ein Teil des aus abgebauten Kernwaffen gewonnenen Plutoniums eingeschmolzen, um zwei Tonnen schwere Glasblöcke aus Plutoniumoxid herzustellen. Das Glas besteht aus Borsilikaten, die mit Cadmium und Gadolinium versetzt sind. Diese Stämme sollen mit rostfreiem Stahl ummantelt und bis zu 4 km unter der Erde in Bohrlöchern gelagert werden, die mit Beton verfüllt werden. Die USA planten, Plutonium auf diese Weise im Atommülllager Yucca Mountain zu lagern, das etwa 100 Meilen (160 km) nordöstlich von Las Vegas, Nevada, liegt. ⓘ
Am 5. März 2009 erklärte Energieminister Steven Chu bei einer Anhörung im Senat, dass der Standort Yucca Mountain nicht länger als Option für die Lagerung von Reaktorabfällen angesehen werde. Seit 1999 wird der vom Militär erzeugte Atommüll in der Waste Isolation Pilot Plant in New Mexico gelagert. ⓘ
In einem Memorandum des Präsidenten vom 29. Januar 2010 setzte Präsident Obama die Blue Ribbon Commission on America's Nuclear Future ein. In ihrem Abschlussbericht legte die Kommission Empfehlungen für die Entwicklung einer umfassenden Strategie vor, die verfolgt werden sollten, darunter:
- "Empfehlung Nr. 1: Die Vereinigten Staaten sollten ein integriertes Programm für die Entsorgung nuklearer Abfälle durchführen, das zur rechtzeitigen Entwicklung einer oder mehrerer permanenter geologischer Tiefenlager für die sichere Entsorgung abgebrannter Brennelemente und hochradioaktiver Abfälle führt". ⓘ
Medizinische Experimente
Während und nach Ende des Zweiten Weltkriegs führten Wissenschaftler, die am Manhattan-Projekt und anderen Kernwaffenforschungsprojekten arbeiteten, Studien über die Auswirkungen von Plutonium auf Labortiere und Menschen durch. Tierversuche ergaben, dass einige Milligramm Plutonium pro Kilogramm Gewebe eine tödliche Dosis darstellen. ⓘ
Bei Menschen wurden Lösungen mit (in der Regel) fünf Mikrogramm Plutonium in Krankenhauspatienten injiziert, von denen man annahm, dass sie entweder unheilbar krank waren oder aufgrund ihres Alters oder einer chronischen Krankheit eine Lebenserwartung von weniger als zehn Jahren hatten. Diese Dosis wurde im Juli 1945 auf ein Mikrogramm reduziert, nachdem Tierversuche ergeben hatten, dass die Art und Weise, wie sich Plutonium in den Knochen verteilt, gefährlicher ist als Radium. Die meisten der Versuchspersonen, so Eileen Welsome, waren arm, kraftlos und krank. ⓘ
Von 1945 bis 1947 wurde achtzehn menschlichen Versuchspersonen ohne deren Einwilligung Plutonium injiziert. Die Tests dienten der Entwicklung von Diagnoseinstrumenten zur Bestimmung der Plutoniumaufnahme im Körper, um Sicherheitsstandards für die Arbeit mit Plutonium zu entwickeln. Ebb Cade war ein unfreiwilliger Teilnehmer an medizinischen Experimenten, bei denen ihm am 10. April 1945 in Oak Ridge, Tennessee, 4,7 Mikrogramm Plutonium injiziert wurden. Dieses Experiment stand unter der Aufsicht von Harold Hodge. Weitere Experimente unter der Leitung der Atomenergiekommission der Vereinigten Staaten und des Manhattan-Projekts wurden bis in die 1970er Jahre fortgesetzt. The Plutonium Files beschreibt das Leben der Probanden des Geheimprogramms, indem es die Namen der beteiligten Personen nennt und die ethischen und medizinischen Forschungen der Wissenschaftler und Ärzte im Geheimen erörtert. Diese Episode wird heute als schwerwiegender Verstoß gegen die medizinische Ethik und den hippokratischen Eid angesehen. ⓘ
Die Regierung vertuschte die meisten dieser Strahlenpannen bis 1993, als Präsident Bill Clinton eine Änderung der Politik anordnete und die Bundesbehörden daraufhin die entsprechenden Unterlagen zugänglich machten. Die daraufhin eingeleitete Untersuchung wurde vom Beratungsausschuss des Präsidenten für Strahlenexperimente am Menschen durchgeführt, der einen Großteil des Materials über die Plutoniumforschung am Menschen aufdeckte. Der Ausschuss legte 1995 einen umstrittenen Bericht vor, in dem er feststellte, dass "Unrecht begangen wurde", ohne jedoch diejenigen zu verurteilen, die es begangen hatten. ⓘ
Anwendungen
Sprengstoffe

Das Isotop Plutonium-239 ist aufgrund seiner leichten Spaltbarkeit und Verfügbarkeit ein wichtiger spaltbarer Bestandteil von Kernwaffen. Die Umhüllung der Plutoniumgrube der Bombe mit einem Tamper (einer optionalen Schicht aus dichtem Material) verringert die Menge an Plutonium, die zum Erreichen der kritischen Masse benötigt wird, indem entweichende Neutronen zurück in den Plutoniumkern reflektiert werden. Dadurch verringert sich die Plutoniummenge, die zum Erreichen der kritischen Masse erforderlich ist, von 16 kg auf 10 kg, was einer Kugel mit einem Durchmesser von etwa 10 Zentimetern entspricht. Diese kritische Masse beträgt etwa ein Drittel derjenigen von Uran-235. ⓘ
Bei den Fat-Man-Plutoniumbomben wurde das Plutonium explosionsartig komprimiert, um eine wesentlich höhere Dichte als normal zu erreichen, kombiniert mit einer zentralen Neutronenquelle, um die Reaktion einzuleiten und die Effizienz zu erhöhen. So wurden nur 6,2 kg Plutonium für eine Sprengkraft benötigt, die 20 Kilotonnen TNT entspricht. Hypothetisch gesehen könnten sogar nur 4 kg Plutonium - und vielleicht sogar noch weniger - für den Bau einer einzigen Atombombe verwendet werden, wenn man eine sehr ausgeklügelte Bauweise verwendet. ⓘ
Mischoxid-Brennstoff
Abgebrannter Kernbrennstoff aus normalen Leichtwasserreaktoren enthält Plutonium, aber es handelt sich um ein Gemisch aus Plutonium-242, 240, 239 und 238. Das Gemisch ist nicht ausreichend angereichert für effiziente Kernwaffen, kann aber einmal als MOX-Brennstoff verwendet werden. Durch den zufälligen Neutroneneinfang wächst die Menge an Plutonium-242 und 240 jedes Mal, wenn das Plutonium in einem Reaktor mit langsamen "thermischen" Neutronen bestrahlt wird, so dass das Plutonium nach dem zweiten Zyklus nur noch von schnellen Neutronenreaktoren verbraucht werden kann. Stehen keine schnellen Neutronenreaktoren zur Verfügung (der Normalfall), wird überschüssiges Plutonium in der Regel entsorgt und bildet einen der langlebigsten Bestandteile des Atommülls. Der Wunsch, dieses Plutonium und andere transuranische Brennstoffe zu verbrauchen und die Radiotoxizität des Abfalls zu verringern, ist der übliche Grund, den Nuklearingenieure angeben, um schnelle Neutronenreaktoren zu bauen. ⓘ
Das gängigste chemische Verfahren, PUREX (Plutonium-URanium EXtraction), bereitet abgebrannten Kernbrennstoff auf, um Plutonium und Uran zu extrahieren, die zur Bildung eines Mischoxidbrennstoffs (MOX) zur Wiederverwendung in Kernreaktoren verwendet werden können. Dem Brennstoffgemisch kann waffenfähiges Plutonium beigemischt werden. MOX-Brennstoff wird in Leichtwasserreaktoren verwendet und besteht aus 60 kg Plutonium pro Tonne Brennstoff; nach vier Jahren sind drei Viertel des Plutoniums verbrannt (in andere Elemente umgewandelt). Brutreaktoren sind speziell dafür ausgelegt, mehr spaltbares Material zu erzeugen, als sie verbrauchen. ⓘ
MOX-Brennstoff ist seit den 1980er Jahren in Gebrauch und wird in Europa in großem Umfang verwendet. Im September 2000 unterzeichneten die Vereinigten Staaten und die Russische Föderation ein Abkommen über die Verwaltung und Entsorgung von Plutonium, in dem sich beide Seiten verpflichteten, 34 Tonnen waffenfähiges Plutonium zu entsorgen. Das US-Energieministerium plant, bis Ende 2019 34 Tonnen waffenfähiges Plutonium in den Vereinigten Staaten zu entsorgen, indem es das Plutonium in MOX-Brennstoff umwandelt, der in kommerziellen Kernkraftreaktoren verwendet werden soll. ⓘ
MOX-Brennstoff verbessert den Gesamtabbrand. Ein Brennstab wird nach drei Jahren wiederaufbereitet, um die Abfallprodukte zu entfernen, die zu diesem Zeitpunkt 3 % des Gesamtgewichts der Stäbe ausmachen. Alle Uran- oder Plutoniumisotope, die während dieser drei Jahre produziert werden, bleiben übrig, und der Stab wird wieder in Betrieb genommen. Das Vorhandensein von bis zu 1 % Gallium pro Masse in einer waffenfähigen Plutoniumlegierung kann den langfristigen Betrieb eines Leichtwasserreaktors beeinträchtigen. ⓘ
Das aus abgebrannten Reaktorbrennstoffen zurückgewonnene Plutonium stellt aufgrund der übermäßigen Kontamination mit nicht spaltbarem Plutonium-240 und Plutonium-242 ein geringes Proliferationsrisiko dar. Eine Abtrennung der Isotope ist nicht machbar. Ein spezieller Reaktor, der mit sehr niedrigem Abbrand betrieben wird (daher ist das neu gebildete Plutonium-239 nur minimal zusätzlichen Neutronen ausgesetzt, die eine Umwandlung in schwerere Plutoniumisotope bewirken), ist in der Regel erforderlich, um Material zu erzeugen, das für den Einsatz in wirksamen Kernwaffen geeignet ist. Während "waffenfähiges" Plutonium definitionsgemäß mindestens 92 % Plutonium-239 (vom Gesamtplutonium) enthält, ist es den Vereinigten Staaten gelungen, einen Sprengkörper mit weniger als 20 Kilotonnen Gewicht zu zünden, wobei Plutonium verwendet wurde, das nur etwa 85 % Plutonium-239 enthielt, so genanntes "brennstofffähiges" Plutonium. Das "reaktorfähige" Plutonium, das in einem regulären LWR-Abbrennzyklus erzeugt wird, enthält in der Regel weniger als 60 % Pu-239 mit bis zu 30 % parasitärem Pu-240/Pu-242 und 10-15 % spaltbarem Pu-241. Es ist nicht bekannt, ob ein Sprengsatz mit Plutonium aus wiederaufbereiteten zivilen Nuklearabfällen gezündet werden kann, doch könnte ein solcher Sprengsatz hypothetisch explodieren und radioaktive Stoffe über ein großes Stadtgebiet verteilen. Die IAEO stuft Plutonium aller Isotopen als Material für den direkten Gebrauch ein, d. h. als Kernmaterial, das ohne Transmutation oder weitere Anreicherung für die Herstellung von Kernsprengstoffkomponenten verwendet werden kann". ⓘ
Strom- und Wärmequelle


Das Isotop Plutonium-238 hat eine Halbwertszeit von 87,74 Jahren. Es emittiert eine große Menge thermischer Energie mit geringen Mengen an Gammastrahlen/Photonen und spontanen Neutronenstrahlen/Teilchen. Da es sich um einen Alphastrahler handelt, kombiniert es hochenergetische Strahlung mit geringer Durchdringung und erfordert daher nur minimale Abschirmung. Ein Blatt Papier kann als Abschirmung gegen die von Plutonium-238 emittierten Alphateilchen verwendet werden. Ein Kilogramm des Isotops kann eine Wärmeleistung von etwa 570 Watt erzeugen. ⓘ
Aufgrund dieser Eigenschaften eignet es sich gut zur Stromerzeugung für Geräte, die über einen Zeitraum, der in etwa einem Menschenleben entspricht, ohne direkte Wartung funktionieren müssen. Es wird daher in thermoelektrischen Radioisotopen-Generatoren und Radioisotopen-Heizgeräten verwendet, wie sie in den Raumsonden Cassini, Voyager, Galileo und New Horizons sowie in den Mars-Rovern Curiosity und Perseverance (Mars 2020) zum Einsatz kommen. ⓘ
Die beiden Voyager-Raumsonden wurden 1977 gestartet und enthielten jeweils eine 500-Watt-Plutonium-Stromquelle. Mehr als 30 Jahre später produziert jede Quelle immer noch etwa 300 Watt, was einen begrenzten Betrieb der beiden Raumfahrzeuge ermöglicht. Eine frühere Version der gleichen Technologie versorgte fünf Apollo-Mondoberflächenexperimentierpakete, beginnend mit Apollo 12 im Jahr 1969. ⓘ
Plutonium-238 wurde auch erfolgreich zum Antrieb von künstlichen Herzschrittmachern verwendet, um das Risiko wiederholter Operationen zu verringern. Er wurde weitgehend durch Primärzellen auf Lithiumbasis ersetzt, aber 2003 gab es in den Vereinigten Staaten noch zwischen 50 und 100 plutoniumbetriebene Herzschrittmacher, die bei lebenden Patienten implantiert waren und funktionierten. Ende 2007 soll die Zahl der plutoniumbetriebenen Herzschrittmacher auf nur noch neun gesunken sein. Plutonium-238 wurde als Mittel zur Erzeugung zusätzlicher Wärme beim Tauchen untersucht. Plutonium-238, gemischt mit Beryllium, wird zur Erzeugung von Neutronen für Forschungszwecke verwendet. ⓘ
Radionuklidbatterien werden wegen ihrer Langlebigkeit in der interplanetaren Raumfahrt eingesetzt, vor allem für Raumsonden, die das äußere Sonnensystem erreichen sollen. Denn Solarzellen liefern in großer Sonnenentfernung nicht mehr genug Energie. Eingebaut wurden solche Nuklearbatterien beispielsweise in die Voyager-Sonden, Cassini-Huygens (1997–2005 zu Saturn) oder New Horizons (2006–2015 zu Pluto); ebenso in Perseverance (2020 Marsrover). Früher wurden Radionuklidbatterien mit Plutonium 238Pu auch in erdumkreisenden Satelliten verwendet. ⓘ
1964 verglühte der Satellit Transit 5BN-3 der USA mit einer Radionuklidbatterie an Bord bei einem Fehlstart etwa 50 Kilometer über dem Pazifik. Der Satellit enthielt knapp ein Kilogramm Plutonium, welches sich anschließend messbar auf der gesamten Nordhalbkugel verteilte. ⓘ
1996 stürzte die russische Sonde Mars 96, an der Deutschland beteiligt war, mit 270 Gramm Plutonium an Bord ab – in den Pazifik oder auf das südamerikanische Festland. ⓘ
236Pu-freies 238Pu wurde in den 1970er Jahren in Herzschrittmachern verwendet, und wurde über den Umweg der wenig ergiebigen und deshalb teuren Erbrütung von Curium 242Cm produziert. Dieses entsteht durch einen Neutroneneinfang von Americium 241Am, das wiederum aus 241Pu gewonnen wird. ⓘ
- Die angegebenen Zeiten sind Halbwertszeiten. ⓘ
Vorsichtsmaßnahmen
Plutonium ist wie viele andere Schwermetalle giftig und schädigt besonders die Nieren. Es bindet ebenfalls an Proteine im Blutplasma und lagert sich unter anderem in den Knochen und der Leber ab. Die für einen Menschen tödliche Dosis liegt wahrscheinlich im zweistelligen Milligrammbereich, für Hunde beträgt die LD50-Dosis 0,32 mg/kg Körpergewicht. Die chemische Giftigkeit von Plutonium wird jedoch von vielen anderen Stoffen übertroffen. ⓘ
Viel gefährlicher als die chemische Wirkung ist – wegen der verschiedenen physikalischen Eigenschaften isotopenabhängig – seine hohe Radioaktivität, die Erbgutschäden und damit u. a. Krebs verursachen kann, aber auch Symptome wie bei einer normalen Schwermetallvergiftung. Bereits die Inhalation von 40 Nanogramm 239Pu reicht aus, um den Grenzwert der Jahres-Aktivitätszufuhr für Inhalation und Ingestion zu erreichen. Die von Plutonium 239Pu ausgesendete α-Strahlung wird zwar außerhalb des Körpers bereits durch die oberste Hautschicht aus abgestorbenen Zellen abgeschirmt, diesen Schutz gibt es aber nicht bei Inkorporation, beispielsweise durch Inhalation von Plutonium enthaltenden Staub, oder durch kontaminierte Nahrung. ⓘ
Nach Untersuchungen von Arnulf Seidel vom Institut für Strahlenbiologie des Kernforschungszentrum Karlsruhe führen kleine Dosen 239Pu im Langzeitversuch erst nach frühestens zehn Jahren bei Hunden zu Knochenkrebs, wobei es eine fünfmal größere Gefährlichkeit als Radium zeigt. Der Grund dafür kann eine ungleichmäßige Verteilung des Plutoniums im Skelett sein, die zu punktuell stark bestrahlten Stellen führt. ⓘ
Das wie auch 240Pu in Kernreaktoren immer miterbrütete 241Pu zerfällt mit etwa 14 Jahren Halbwertszeit in Americium 241Am, das große Mengen relativ weicher Gammastrahlung abgibt. In gelagertem Plutonium erreicht die Konzentration von 241Am nach etwa 70 Jahren ihren Höchststand. Weil die Plutoniumisotope selbst kaum Gammastrahlung abgeben, nimmt diese Strahlung (und damit die Dicke der benötigten Abschirmung) wegen des gebildeten Americiums zunächst deutlich zu, um dann nach etwa 70 Jahren Lagerung wieder abzunehmen. Wegen der längeren Halbwertzeit von 241Am (432 Jahre) erfolgt diese Abnahme deutlich langsamer als der Anstieg. ⓘ
Toxizität
Die schädlichen Auswirkungen von Plutonium haben zwei Aspekte: die Radioaktivität und die Schwermetallvergiftung. Isotope und Verbindungen von Plutonium sind radioaktiv und reichern sich im Knochenmark an. Die Kontamination durch Plutoniumoxid ist die Folge von Nuklearkatastrophen und radioaktiven Zwischenfällen, einschließlich militärischer Nuklearunfälle, bei denen Kernwaffen verbrannt wurden. Studien über die Auswirkungen dieser kleineren Freisetzungen sowie über die weit verbreitete Strahlenvergiftungskrankheit und den Tod nach den Atombombenabwürfen auf Hiroshima und Nagasaki haben beträchtliche Informationen über die Gefahren, Symptome und Prognosen von Strahlenvergiftungen geliefert, die im Falle der japanischen Überlebenden weitgehend nicht mit einer direkten Plutoniumexposition zusammenhingen. ⓘ
Beim Zerfall von Plutonium werden drei Arten von ionisierender Strahlung freigesetzt, nämlich Alpha-, Beta- und Gammastrahlung. Sowohl eine akute als auch eine längerfristige Exposition birgt die Gefahr schwerwiegender gesundheitlicher Folgen wie Strahlenkrankheit, genetische Schäden, Krebs und Tod. Die Gefahr nimmt mit der Höhe der Exposition zu. Alphastrahlung kann nur eine kurze Strecke zurücklegen und die äußere, tote Schicht der menschlichen Haut nicht durchdringen. Betastrahlung kann die menschliche Haut durchdringen, aber nicht den ganzen Körper durchdringen. Gammastrahlung kann den gesamten Körper durchdringen. Obwohl Alphastrahlung die Haut nicht durchdringen kann, bestrahlt verschlucktes oder eingeatmetes Plutonium die inneren Organe. Alphateilchen, die durch eingeatmetes Plutonium erzeugt werden, haben bei einer Kohorte europäischer Atomarbeiter Lungenkrebs verursacht. Das Skelett, in dem sich Plutonium anreichert, und die Leber, in der es sich sammelt und konzentriert, sind gefährdet. Plutonium wird bei der Einnahme nicht effizient in den Körper aufgenommen; nur 0,04 % des Plutoniumoxids wird nach der Einnahme absorbiert. Vom Körper aufgenommenes Plutonium wird nur sehr langsam ausgeschieden, mit einer biologischen Halbwertszeit von 200 Jahren. Plutonium passiert Zellmembranen und Darmgrenzen nur langsam, so dass die Absorption durch Verschlucken und der Einbau in die Knochenstruktur sehr langsam vonstatten geht. Donald Mastick verschluckte versehentlich eine kleine Menge Plutonium(III)-chlorid, das in den nächsten dreißig Jahren seines Lebens nachweisbar war, schien aber keine gesundheitlichen Folgen zu haben. ⓘ
Plutonium ist gefährlicher, wenn es eingeatmet wird, als wenn es eingenommen wird. Das Lungenkrebsrisiko steigt, sobald die Gesamt-Äquivalentdosis des eingeatmeten Plutoniums 400 mSv überschreitet. Das US-Energieministerium schätzt, dass das lebenslange Krebsrisiko beim Einatmen von 5.000 Plutoniumpartikeln, die jeweils etwa 3 µm groß sind, um 1 % über dem US-Hintergrunddurchschnitt liegt. Das Verschlucken oder Einatmen großer Mengen kann zu akuten Strahlenvergiftungen und möglicherweise zum Tod führen. Es ist jedoch kein Mensch bekannt, der aufgrund des Einatmens oder der Einnahme von Plutonium gestorben ist, und viele Menschen haben messbare Mengen von Plutonium in ihrem Körper. ⓘ
Die Theorie der "heißen Teilchen", wonach ein Plutoniumstaubteilchen eine örtlich begrenzte Stelle des Lungengewebes bestrahlt, wird durch die gängige Forschung nicht gestützt - solche Teilchen sind mobiler als ursprünglich angenommen und die Toxizität wird durch die Teilchenform nicht messbar erhöht. Wenn Plutonium eingeatmet wird, kann es in den Blutkreislauf gelangen. Sobald es in den Blutkreislauf gelangt ist, bewegt sich Plutonium durch den Körper und gelangt in die Knochen, die Leber oder andere Körperorgane. Plutonium, das in die Körperorgane gelangt, verbleibt in der Regel jahrzehntelang im Körper und setzt das umliegende Gewebe weiterhin der Strahlung aus, so dass es Krebs verursachen kann. ⓘ
Ein häufig zitiertes Zitat von Ralph Nader besagt, dass ein Pfund Plutoniumstaub, das in die Atmosphäre gelangt, ausreichen würde, um 8 Milliarden Menschen zu töten. Dies wurde von Bernard Cohen bestritten, einem Gegner des allgemein akzeptierten linearen Modells ohne Schwellenwert für die Strahlungstoxizität. Cohen schätzte, dass ein Pfund Plutonium nicht mehr als 2 Millionen Menschen durch Einatmen töten könnte, so dass die Toxizität von Plutonium ungefähr der von Nervengas entspricht. ⓘ
Mehrere Bevölkerungsgruppen, die Plutoniumstaub ausgesetzt waren (z. B. Menschen, die in der Nähe der Testanlagen in Nevada lebten, Überlebende von Nagasaki, Mitarbeiter von Kernkraftwerken und "todkranke" Patienten, denen 1945-46 Pu injiziert wurde, um den Pu-Stoffwechsel zu untersuchen), wurden sorgfältig beobachtet und analysiert. Cohen stellte fest, dass diese Studien nicht mit den hohen Schätzungen der Plutoniumtoxizität übereinstimmen, und zitierte Fälle wie Albert Stevens, der bis ins hohe Alter überlebte, nachdem ihm Plutonium injiziert worden war. "Es gab etwa 25 Arbeiter des Los Alamos National Laboratory, die in den 1940er Jahren eine beträchtliche Menge Plutoniumstaub eingeatmet haben; nach der Theorie der heißen Teilchen hat jeder von ihnen eine 99,5 %ige Chance, inzwischen an Lungenkrebs zu sterben, aber es ist kein einziger Lungenkrebs unter ihnen aufgetreten." ⓘ
Toxizität für das Meer
Die Untersuchung der Toxizität von Plutonium für den Menschen ist ebenso wichtig wie die Untersuchung der Auswirkungen auf die Meeresfauna. Es ist bekannt, dass Plutonium durch die Verklappung von Abfällen oder unbeabsichtigte Leckagen aus Kernkraftwerken in die Meeresumwelt gelangt. Obwohl die höchsten Konzentrationen von Plutonium in der Meeresumwelt in den Sedimenten zu finden sind, bedeutet der komplexe biogeochemische Kreislauf von Plutonium, dass es auch in allen anderen Kompartimenten vorkommt. So nehmen beispielsweise verschiedene Zooplanktonarten, die am Nährstoffkreislauf beteiligt sind, das Element täglich auf. Die vollständige Ausscheidung des aufgenommenen Plutoniums durch Zooplankton macht ihren Stuhlgang zu einem äußerst wichtigen Mechanismus für die Beseitigung von Plutonium aus den Oberflächengewässern. Zooplankton, das von größeren Organismen erbeutet wird, kann jedoch Plutonium auf Fische übertragen. ⓘ
Neben dem Verzehr können Fische auch durch ihre geografische Verteilung rund um den Globus mit Plutonium in Berührung kommen. In einer Studie wurden die Auswirkungen von Transuranen (Plutonium-238, Plutonium-239, Plutonium-240) auf verschiedene Fische untersucht, die in der Sperrzone von Tschernobyl (CEZ) leben. Die Ergebnisse zeigten, dass ein Teil der weiblichen Barsche in der CEZ entweder einen Ausfall oder eine verzögerte Reifung der Keimdrüsen aufweist. Ähnliche Studien ergaben große Anreicherungen von Plutonium in den Atmungs- und Verdauungsorganen von Kabeljau, Flunder und Hering. ⓘ
Die Plutoniumtoxizität ist für Fischlarven in Atommüllgebieten ebenso nachteilig. Unentwickelte Eier haben ein höheres Risiko als entwickelte erwachsene Fische, die dem Element in diesen Abfallgebieten ausgesetzt sind. Das Oak Ridge National Laboratory zeigte, dass Karpfen- und Elritzenembryonen, die in Lösungen mit Plutoniumisotopen aufgezogen wurden, nicht schlüpften; Eier, die schlüpften, wiesen im Vergleich zu den in der Kontrolle entwickelten Embryonen erhebliche Anomalien auf. Es zeigte sich, dass höhere Konzentrationen von Plutonium bei der Meeresfauna, die dem Element ausgesetzt ist, Probleme verursachen. ⓘ
Kritikalitätspotenzial

Es muss darauf geachtet werden, dass sich keine Plutoniummengen ansammeln, die sich der kritischen Masse nähern, insbesondere weil die kritische Masse von Plutonium nur ein Drittel der von Uran-235 beträgt. Eine kritische Masse an Plutonium setzt tödliche Mengen an Neutronen und Gammastrahlen frei. Bei gelöstem Plutonium ist die Wahrscheinlichkeit, dass sich eine kritische Masse bildet, größer als bei festem Plutonium, da es durch den Wasserstoff im Wasser gedämpft wird. ⓘ
In der Vergangenheit ist es zu kritischen Unfällen gekommen, von denen einige tödliche Folgen hatten. Ein unvorsichtiger Umgang mit Wolframkarbidsteinen um eine 6,2 kg schwere Plutoniumkugel führte am 21. August 1945 in Los Alamos zu einer tödlichen Strahlendosis, als der Wissenschaftler Harry Daghlian eine geschätzte Dosis von 5,1 Sievert (510 rems) erhielt und 25 Tage später starb. Neun Monate später starb ein anderer Wissenschaftler in Los Alamos, Louis Slotin, bei einem ähnlichen Unfall mit einem Berylliumreflektor und demselben Plutoniumkern (dem so genannten "Dämonenkern"), der zuvor Daghlian das Leben gekostet hatte. ⓘ
Im Dezember 1958 bildete sich während eines Plutonium-Reinigungsprozesses in Los Alamos eine kritische Masse in einem Mischgefäß, die zum Tod des Chemiearbeiters Cecil Kelley führte. Weitere nukleare Unfälle ereigneten sich in der Sowjetunion, in Japan, in den Vereinigten Staaten und in vielen anderen Ländern. ⓘ
Entflammbarkeit
Metallisches Plutonium stellt eine Brandgefahr dar, insbesondere wenn das Material fein verteilt ist. In feuchter Umgebung bildet Plutonium an seiner Oberfläche Hydride, die pyrophor sind und sich an der Luft bei Raumtemperatur entzünden können. Plutonium dehnt sich bei der Oxidation um bis zu 70 % seines Volumens aus und kann so seinen Behälter zerbrechen. Die Radioaktivität des brennenden Materials stellt eine zusätzliche Gefahr dar. Magnesiumoxidsand ist wahrscheinlich das wirksamste Material zum Löschen eines Plutoniumbrandes. Er kühlt das brennende Material, wirkt als Wärmesenke und sperrt außerdem den Sauerstoff ab. Besondere Vorsichtsmaßnahmen sind erforderlich, wenn Plutonium in irgendeiner Form gelagert oder gehandhabt wird; im Allgemeinen ist eine trockene Inertgasatmosphäre erforderlich. ⓘ
Transport
Auf dem Land- und Seeweg
Der übliche Transport von Plutonium erfolgt über das stabilere Plutoniumoxid in einer versiegelten Verpackung. Ein typischer Transport besteht aus einem Lkw mit einem geschützten Transportcontainer, der eine Reihe von Paketen mit einem Gesamtgewicht von 80 bis 200 kg Plutoniumoxid enthält. Ein Seetransport kann aus mehreren Containern bestehen, von denen jeder ein versiegeltes Versandstück enthält. Die US-Nuklearaufsichtsbehörde schreibt vor, dass das Plutonium nicht in Pulverform, sondern in fester Form transportiert werden muss, wenn der Inhalt mehr als 0,74 TBq (20 Curies) an radioaktiver Aktivität aufweist. Im Jahr 2016 transportierten die Schiffe Pacific Egret und Pacific Heron der Pacific Nuclear Transport Ltd. 331 kg Plutonium zu einer Anlage der US-Regierung in Savannah River, South Carolina. ⓘ
Luftverkehr
Die Lufttransportvorschriften der US-Regierung erlauben den Transport von Plutonium auf dem Luftweg, vorbehaltlich der Beschränkungen für andere gefährliche Stoffe, die auf demselben Flug befördert werden, der Verpackungsanforderungen und der Verstauung im hintersten Teil des Flugzeugs. ⓘ
Im Jahr 2012 wurde in den Medien bekannt, dass Plutonium mit kommerziellen Passagierflugzeugen aus Norwegen ausgeflogen wurde - etwa alle zwei Jahre -, darunter auch einmal im Jahr 2011. Die Vorschriften erlauben den Transport von 15 Gramm spaltbarem Material in einem Flugzeug. Einem leitenden Berater (seniorrådgiver) von Statens strålevern zufolge ist ein solcher Plutoniumtransport unproblematisch. ⓘ
Verwendung
Nur 238Pu und 239Pu werden in größeren Mengen verwendet. 238Pu ist, wenn es aus Neptunium erbrütet wird, mit anderen Plutoniumisotopen verunreinigt. Nur 238Pu, das über den Umweg von Curium 242Cm erbrütet wird, ist frei von 236Pu. ⓘ
239Pu ist immer mit 240Pu und noch geringeren Mengen von 241Pu und 242Pu verunreinigt. ⓘ
Militärische Verwendung
Für Kernwaffen geeignetes Waffenplutonium (englisch weapons grade Plutonium) muss möglichst viel 239Pu und möglichst wenig 240Pu enthalten. Ab einem Gehalt von etwa 92 % 239Pu gilt Plutonium als waffenfähig. Nach Ansicht der IAEO ist jedoch jedes Plutonium grundsätzlich geeignet für militärische Zwecke. Als Reaktorplutonium wird Plutonium bezeichnet, das im Normalbetrieb von Kernkraftwerken anfällt; es kann bis zu 31 % 240Pu enthalten. ⓘ
240Pu ist nicht durch thermische Neutronen spaltbar, zerfällt aber durch Spontanspaltung. Dabei werden Neutronen frei, die eine unerwünschte Frühzündung der Plutoniumbombe bewirken können und die Berechnung der Sprengkraft ungenau machen. Militärisch ist eine exakte Zündung und präzise Voraussage der Sprengkraft erwünscht. Auch die Zerfallswärme des Alphastrahlers 238Pu wirkt störend. ⓘ
Für die Produktion von Waffenplutonium in Kernreaktoren ist eine möglichst kurze Bestrahlungszeit erforderlich: je länger diese ist, desto mehr 240Pu entsteht aus 239Pu (siehe auch Kernreaktor#Brutreaktionen). Deshalb lässt sich aus einem Kernreaktor mit laufender Stromerzeugung Waffenplutonium sinnvoll nur gewinnen, wenn es sich um einen Druckröhrenreaktor handelt, denn nur bei ihm können einzelne Brennelemente bei laufendem Betrieb ausgetauscht werden (Reaktortypen z. B. CANDU, RBMK). Dagegen befinden sich bei den deutschen Kernkraftwerken alle Brennelemente zusammen im Reaktordruckbehälter, und eine Brennelemententnahme erfordert ein aufwändiges Herunterfahren („Abfahren“) der Anlage, was nicht geheim zu halten wäre (z. B. keine Wasserdampfwolken über den Kühltürmen mehr). ⓘ
Russland erzeugte sein Waffenplutonium in speziell dafür gebauten Reaktoren des Typs ADE; der letzte von ihnen wurde nach 46 Jahren Betrieb 2010 stillgelegt. ⓘ
Die USA und Russland haben sich 2010 im Plutonium Management and Disposition Agreement darauf geeinigt, ihre Bestände an Waffen-Plutonium um je 34 Tonnen zu verringern. Ein ergänzendes Protokoll unterzeichneten die Außenminister Hillary Clinton und Sergei Lawrow in Washington. Russland kostet dies 2,5 Mrd. Dollar; davon übernehmen die USA 400 Mio. Dollar. Beseitigt werden kann das Plutonium durch Endlagerung nach einer Vermischung mit anderen Nuklearabfällen oder durch eine Umarbeitung in MOX-Elemente. ⓘ

Neutronenquelle
Ferner wird 238Pu zusammen mit Beryllium als Neutronenquelle verwendet, wobei ein α-Teilchen aus dem Zerfall des Plutoniums den Berylliumkern trifft und unter Aussendung eines Neutrons in diesen eingebaut wird. ⓘ
Verbindungen

→ Kategorie Plutoniumverbindung ⓘ
Oxide
Die stabilste und wichtigste Sauerstoffverbindung ist Plutoniumdioxid (PuO2). Diese Verbindung ist ein Feststoff mit hoher Schmelztemperatur. Es ist gegenüber Wasser stabil und nicht in diesem löslich. Plutonium wird daher in Radionuklidbatterien und Kernkraftwerken in Form dieses Oxids verwendet. Neben Plutoniumdioxid sind auch Plutonium(III)-oxid Pu2O3 und Plutonium(II)-oxid PuO bekannt. ⓘ
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Plutonium zahlreiche Verbindungen. Von allen Halogenen ist eine entsprechende Plutoniumverbindung in der Oxidationsstufe +3 bekannt. Daneben existieren noch Plutonium(IV)-fluorid, Plutonium(IV)-chlorid und Plutonium(VI)-fluorid. ⓘ
| Oxidationszahl | F | Cl | Br | I ⓘ |
| +6 | Plutonium(VI)-fluorid PuF6 rotbraun |
|||
| +4 | Plutonium(IV)-fluorid PuF4 rotbraun |
Plutonium(IV)-chlorid PuCl4 |
||
| +3 | Plutonium(III)-fluorid PuF3 violett |
Plutonium(III)-chlorid PuCl3 grün |
Plutonium(III)-bromid PuBr3 grün |
Plutonium(III)-iodid PuI3 grün |
Boride
Es gibt vier bekannte Plutoniumboride. Sie werden genutzt, um die Neutronenemission von Plutoniummaterial und damit die Gefahr einer Kritikalität zu vermindern. ⓘ
Metallorganische Verbindungen
Analog zu Uranocen, einer Organometallverbindung in der Uran von zwei Cyclooctatetraen-Liganden komplexiert ist, wurden die entsprechenden Komplexe von Thorium, Protactinium, Neptunium, Americium und auch des Plutoniums, (η8-C8H8)2Pu, dargestellt. ⓘ
Analytik
Für Plutonium gibt es aufgrund seiner Seltenheit keine klassischen, nasschemischen Nachweismethoden. Deshalb werden nur instrumentelle Verfahren eingesetzt. ⓘ
Instrumentelle quantitative Analytik von Plutonium
α-Spektrometrie
Plutonium wird häufig über die α-Strahlung der Isotope 239(40)Pu und 238Pu nachgewiesen. Eine direkte Analyse ist oft nicht möglich, sodass vorangehende Separationstechniken durchgeführt werden müssen. Häufig kommt dabei die Ionenaustauschchromatographie zum Einsatz. Mit Hilfe der α-Spektrometrie konnte 239(40)Pu in maritimen Sedimenten mit einer Nachweisgrenze von 1 mBq/g bestimmt werden. ⓘ
Elementmassenspektrometrie (MS)
Für die Plutoniumbestimmung kommen in der Massenspektrometrie die ICP-Ionisierung (ICP, induktiv-gekoppeltes Plasma, Massenspektrometrie mit induktiv gekoppeltem Plasma) und die AMS (Beschleuniger-Massenspektrometrie) zum Einsatz. Im Vergleich zur ICP-MS ist die AMS sensitiver aber apparativ aufwändig und kostenintensiv, da ein Teilchenbeschleuniger zur Ionisierung verwendet werden muss. Mit der AMS konnte am VERA-System in Wien eine Nachweisgrenze von etwa 106 Atomen des Isotops 239Pu erreicht werden. Mit Hilfe der ICP-Technik konnte eine Nachweisgrenze von 108 Atomen 239Pu erzielt werden, was einer Aktivität von 0,1 mBq entspricht. ⓘ
Optische Emissionsspektrometrie (OES)
Plutonium kann auch mit einer laserbasierten Variante der optischen Emissionsspektrometrie (OES) nachgewiesen werden. Bei der Laser Induced Breakdown Spectroscopy (LIBS) nutzt man kurze Laserimpulse zur Verdampfung und Emissionsstimulation der Probe. Zur Emissionsmessung steht ein breites Spektrum an Linien zur Verfügung, wobei aufgrund der besten Intensitätswerte meist auf die Linien bei 295,16 nm, 300,06 nm und 363,22 nm zurückgegriffen wird. Mit dieser Technik konnte eine Nachweisgrenze von 10−8 g/mL erzielt werden. Die gleiche Nachweisgrenze konnte mit der optischen Emissionsspektrometrie mittels induktiv gekoppeltem Plasma (ICP-OES) erzielt werden. ⓘ
Laserinduzierte photoakustische Spektrometrie (LIPAS)
Bei der LIPAS-Technik wird ein hochenergetischer Laserimpuls in die Probelösung geschickt, welcher eine photoakustische Welle induziert. Mit Hilfe eines piezoelektrischen Detektors wird die Amplitude dieser Welle bestimmt. Mit dieser Technik konnte sechswertiges Plutonium mit einer Nachweisgrenze von 0,5 µg/mL nachgewiesen werden. ⓘ
Produktionsnachweis außerhalb des Reaktors
Forscher des Sandia National Laboratories wollen die beim Betazerfall von Spaltprodukten emittierten Antineutrinos dazu verwenden, die Produktion von Plutonium in Kernreaktoren zu messen, damit die IAEO nicht mehr auf Schätzungen angewiesen ist und kein Plutonium unbemerkt für den Bau von Atomwaffen abgezweigt werden kann. Wegen der extrem hohen Produktionsrate von Antineutrinos in Kernreaktoren würde schon ein Detektor mit 1 m3 Detektorflüssigkeit vor dem Kernkraftwerk reichen. ⓘ
![{\displaystyle {\begin{aligned}{\ce {{^{238}_{92}U}+{^{2}_{1}D}->}}&{\ce {{^{238}_{93}Np}+2_{0}^{1}n}}\\&{\ce {^{238}_{93}Np->[\beta ^{-}][2.117\ {\ce {d}}]{^{238}_{94}Pu}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b584c932e52212178b2befe7a512a7b28f87d35)

![{\displaystyle \mathrm {^{241}_{\ 94}Pu\ {\xrightarrow[{14,35\ a}]{\beta ^{-}}}\ _{\ 95}^{241}Am\ {\xrightarrow {(n,\gamma )}}\ _{\ 95}^{242}Am\ {\xrightarrow[{16,02\ h}]{\beta ^{-}}}\ _{\ 96}^{242}Cm\ \left({\xrightarrow[{162,8\ d}]{\alpha }}\ _{\ 94}^{238}Pu\right)} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6e05aaf59bc4d437fa8fa526b3d79bd33d12568)