Polonium
 | |||||||||||||||||||||||||
| Polonium | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /pəˈloʊniəm/ (pə-LOH-nee-əm) | ||||||||||||||||||||||||
| Allotrope | α, β | ||||||||||||||||||||||||
| Erscheinungsbild | silbrig | ||||||||||||||||||||||||
| Massenzahl | [209] | ||||||||||||||||||||||||
| Polonium im Periodensystem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ordnungszahl (Z) | 84 | ||||||||||||||||||||||||
| Gruppe | Gruppe 16 (Chalkogene) | ||||||||||||||||||||||||
| Periode | Periode 6 | ||||||||||||||||||||||||
| Block | p-Block | ||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Xenon|Xe]]] 4f14 5d10 6s2 6p4 | ||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 32, 18, 6 | ||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||
| Phase bei STP | fest | ||||||||||||||||||||||||
| Schmelzpunkt | 527 K (254 °C, 489 °F) | ||||||||||||||||||||||||
| Siedepunkt | 1235 K (962 °C, 1764 °F) | ||||||||||||||||||||||||
| Dichte (nahe r.t.) | α-Po: 9,196 g/cm3 β-Po: 9,398 g/cm3 | ||||||||||||||||||||||||
| Schmelzwärme | ca. 13 kJ/mol | ||||||||||||||||||||||||
| Verdampfungswärme | 102,91 kJ/mol | ||||||||||||||||||||||||
| Molare Wärmekapazität | 26,4 J/(mol-K) | ||||||||||||||||||||||||
Dampfdruck
| |||||||||||||||||||||||||
| Atomare Eigenschaften | |||||||||||||||||||||||||
| Oxidationsstufen | -2, +2, +4, +5, +6 (ein amphoteres Oxid) | ||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 2,0 | ||||||||||||||||||||||||
| Ionisierungsenergien |
| ||||||||||||||||||||||||
| Atomarer Radius | empirisch: 168 pm | ||||||||||||||||||||||||
| Kovalenter Radius | 140±4 pm | ||||||||||||||||||||||||
| Van-der-Waals-Radius | 197 pm | ||||||||||||||||||||||||
| Spektrallinien von Polonium | |||||||||||||||||||||||||
| Andere Eigenschaften | |||||||||||||||||||||||||
| Natürliches Vorkommen | durch Zerfall | ||||||||||||||||||||||||
| Kristallstruktur | kubisch α-Po | ||||||||||||||||||||||||
| Kristallstruktur | rhomboedrisch β-Po | ||||||||||||||||||||||||
| Thermische Ausdehnung | 23,5 µm/(m⋅K) (bei 25 °C) | ||||||||||||||||||||||||
| Thermische Leitfähigkeit | 20 W/(m⋅K) (?) | ||||||||||||||||||||||||
| Elektrischer Widerstand | α-Po: 0,40 µΩ⋅m (bei 0 °C) | ||||||||||||||||||||||||
| Magnetische Ordnung | nichtmagnetisch | ||||||||||||||||||||||||
| CAS-Nummer | 7440-08-6 | ||||||||||||||||||||||||
| Geschichte | |||||||||||||||||||||||||
| Namensgebung | nach Polonia, lateinisch für Polen, dem Heimatland von Marie Curie | ||||||||||||||||||||||||
| Entdeckung | Pierre und Marie Curie (1898) | ||||||||||||||||||||||||
| Erste Isolierung | Willy Marckwald (1902) | ||||||||||||||||||||||||
| Hauptisotope von Polonium | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Polonium ist ein chemisches Element mit dem Symbol Po und der Ordnungszahl 84. Polonium ist ein Chalkogen. Polonium ist ein seltenes und hochradioaktives Metall ohne stabile Isotope und ähnelt chemisch dem Selen und Tellur, obwohl sein metallischer Charakter dem seiner horizontalen Nachbarn im Periodensystem ähnelt: Thallium, Blei und Wismut. Aufgrund der kurzen Halbwertszeit aller seiner Isotope ist sein natürliches Vorkommen auf winzige Spuren des flüchtigen Polonium-210 (mit einer Halbwertszeit von 138 Tagen) in Uranerzen beschränkt, da es die vorletzte Tochter des natürlichen Uran-238 ist. Es gibt zwar etwas langlebigere Isotope, die aber sehr viel schwieriger zu produzieren sind. Polonium wird heute in der Regel durch Neutronenbestrahlung von Wismut in Milligramm-Mengen hergestellt. Aufgrund seiner starken Radioaktivität, die zur Radiolyse chemischer Bindungen und zur radioaktiven Selbsterhitzung führt, wurde die Chemie des Poloniums bisher meist nur im Spurenbereich untersucht. ⓘ
Polonium wurde im Juli 1898 von Marie Skłodowska-Curie und Pierre Curie entdeckt, als es aus dem Uranerz Pechblende extrahiert und allein durch seine starke Radioaktivität identifiziert wurde: Es war das erste Element, das auf diese Weise entdeckt wurde. Polonium wurde nach dem Heimatland von Marie Curie, Polen, benannt. Polonium hat nur wenige Anwendungen, die mit seiner Radioaktivität zusammenhängen: Heizelemente in Raumsonden, antistatische Vorrichtungen, Quellen von Neutronen und Alphateilchen und Gift. Für den Menschen ist es extrem gefährlich. ⓘ
Polonium ist ein radioaktives chemisches Element mit dem Elementsymbol Po und der Ordnungszahl 84. Im Periodensystem steht es in der 6. Hauptgruppe, bzw. der 16. IUPAC-Gruppe, wird also den Chalkogenen zugeordnet. ⓘ
Eigenschaften
210Po ist ein Alphastrahler mit einer Halbwertszeit von 138,4 Tagen; es zerfällt direkt in sein stabiles Tochterisotop 206Pb. Ein Milligramm (5 Curie) 210Po sendet pro Sekunde etwa so viele Alphateilchen aus wie 5 Gramm 226Ra. Einige Curies (1 Curie entspricht 37 Gigabecquerel, 1 Ci = 37 GBq) von 210Po geben ein blaues Leuchten ab, das durch Ionisierung der Umgebungsluft verursacht wird. ⓘ
Etwa eine von 100.000 Alphastrahlungen führt zu einer Anregung des Kerns, die dann zur Aussendung einer Gammastrahlung mit einer maximalen Energie von 803 keV führt. ⓘ
Form im festen Zustand
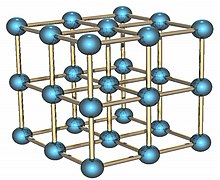
Polonium ist ein radioaktives Element, das in zwei metallischen Allotropen vorkommt. Die Alpha-Form ist das einzige bekannte Beispiel für eine einfache kubische Kristallstruktur auf Ein-Atom-Basis bei STP, mit einer Kantenlänge von 335,2 Pikometern; die Beta-Form ist rhomboedrisch. Die Struktur von Polonium wurde durch Röntgenbeugung und Elektronenbeugung charakterisiert. ⓘ
210Po (wie auch 238Pu) lässt sich leicht an der Luft verteilen: Wird eine Probe an der Luft auf 55 °C erhitzt, verdampfen 50 % davon innerhalb von 45 Stunden zu zweiatomigen Po2-Molekülen, obwohl der Schmelzpunkt von Polonium bei 254 °C und sein Siedepunkt bei 962 °C liegt. Es gibt mehr als eine Hypothese darüber, wie Polonium dies bewerkstelligt; eine Hypothese besagt, dass kleine Cluster von Poloniumatomen durch den Alphazerfall abgespalten werden. ⓘ
Chemie
Die Chemie von Polonium ähnelt der von Tellur, obwohl es aufgrund seines metallischen Charakters auch einige Ähnlichkeiten mit seinem Nachbarn Wismut aufweist. Polonium löst sich leicht in verdünnten Säuren, ist aber in Laugen nur schwach löslich. Poloniumlösungen sind zunächst durch die Po2+-Ionen rosa gefärbt, werden dann aber schnell gelb, weil die Alphastrahlung des Poloniums das Lösungsmittel ionisiert und Po2+ in Po4+ umwandelt. Da Polonium nach dem Zerfall auch Alphateilchen aussendet, wird dieser Prozess von Blasenbildung und Wärme- und Lichtemission durch Glasgeräte aufgrund der absorbierten Alphateilchen begleitet; daher sind Poloniumlösungen flüchtig und verdampfen innerhalb weniger Tage, wenn sie nicht versiegelt werden. Bei einem pH-Wert von etwa 1 werden Polonium-Ionen leicht hydrolysiert und von Säuren wie Oxalsäure, Zitronensäure und Weinsäure komplexiert. ⓘ
Polonium ist ein silberweiß glänzendes Metall. Als einziges Metall weist die α-Modifikation eine kubisch-primitive Kristallstruktur auf. Dabei sind nur die Ecken eines Würfels mit Polonium-Atomen besetzt. Diese Kristallstruktur findet man sonst nur noch bei den Hochdruckmodifikationen von Phosphor und Antimon. ⓘ
Die chemischen Eigenschaften sind vergleichbar mit denen seines linken Perioden-Nachbarn Bismut. Es ist metallisch leitend und steht mit seiner Redox-Edelheit zwischen Rhodium und Silber. ⓘ
Verbindungen
Polonium hat keine gewöhnlichen Verbindungen, und fast alle seine Verbindungen werden synthetisch hergestellt; mehr als 50 davon sind bekannt. Die stabilste Klasse von Poloniumverbindungen sind die Polonide, die durch direkte Reaktion von zwei Elementen hergestellt werden. Na2Po hat die Antifluorit-Struktur, die Polonide von Ca, Ba, Hg, Pb und den Lanthaniden bilden ein NaCl-Gitter, BePo und CdPo haben die Wurtzit- und MgPo die Nickel-Arsenid-Struktur. Die meisten Polonide zersetzen sich beim Erhitzen auf etwa 600 °C, mit Ausnahme von HgPo, das sich bei ~300 °C zersetzt, und den Lanthanidenpoloniden, die sich nicht zersetzen, sondern bei Temperaturen über 1000 °C schmelzen. Das Praseodym-Polonid (PrPo) zum Beispiel schmilzt bei 1250 °C, das Thulium-Polonid (TmPo) bei 2200 °C. PbPo ist eine der wenigen natürlich vorkommenden Poloniumverbindungen, da Polonium-Alpha unter Bildung von Blei zerfällt. ⓘ
Poloniumhydrid (PoH
2) ist bei Raumtemperatur eine flüchtige Flüssigkeit, die zur Dissoziation neigt; sie ist thermisch instabil. Wasser ist das einzige andere bekannte Wasserstoffchalcogenid, das bei Raumtemperatur flüssig ist; dies ist jedoch auf die Wasserstoffbrückenbindung zurückzuführen. Die drei Oxide PoO, PoO2 und PoO3 sind die Oxidationsprodukte von Polonium. ⓘ
Halogenide der Struktur PoX2, PoX4 und PoF6 sind bekannt. Sie sind in den entsprechenden Halogenwasserstoffen löslich, d. h. PoClX in HCl, PoBrX in HBr und PoI4 in HI. Poloniumdihalogenide werden durch direkte Reaktion der Elemente oder durch Reduktion von PoCl4 mit SO2 und PoBr4 mit H2S bei Raumtemperatur gebildet. Tetrahalogenide können durch Reaktion von Poloniumdioxid mit HCl, HBr oder HI gewonnen werden. ⓘ
Weitere Poloniumverbindungen sind Kaliumpolonit als Polonit, Polonat, Acetat, Bromat, Carbonat, Citrat, Chromat, Cyanid, Formiat, (II)- und (IV)-Hydroxide, Nitrat, Selenat, Selenit, Monosulfid, Sulfat, Disulfat und Sulfit. ⓘ
Es ist eine begrenzte Organopoloniumchemie bekannt, die sich hauptsächlich auf Dialkyl- und Diarylpolonide (R2Po), Triarylpoloniumhalogenide (Ar3PoX) und Diarylpoloniumdihalogenide (Ar2PoX2) beschränkt. Polonium bildet auch lösliche Verbindungen mit einigen Chelatbildnern, wie 2,3-Butandiol und Thioharnstoff. ⓘ
| Formel | Farbe | m.p. (°C) | Sublimation temp. (°C) |
Symmetrie | Pearson-Symbol | Raumgruppe | Nr. | a (pm) | b(pm) | c(pm) | Z | ρ (g/cm3) | ref |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PoO | schwarz | ||||||||||||
| PoO2 | blassgelb | 500 (dez.) | 885 | fcc | cF12 | Fm3m | 225 | 563.7 | 563.7 | 563.7 | 4 | 8.94 | |
| PoH2 | -35.5 | ||||||||||||
| PoCl2 | dunkel rubinrot | 355 | 130 | orthorhombisch | oP3 | Pmmm | 47 | 367 | 435 | 450 | 1 | 6.47 | |
| PoBr2 | violett-braun | 270 (dez.) | |||||||||||
| PoCl4 | gelb | 300 | 200 | monoklin | |||||||||
| PoBr4 | rot | 330 (dez.) | fcc | cF100 | Fm3m | 225 | 560 | 560 | 560 | 4 | |||
| PoI4 | schwarz |
|
Oxide
|
Hydride
|
Halogenide
|
Isotope
Polonium hat 42 bekannte Isotope, die alle radioaktiv sind. Ihre Atommassen reichen von 186 bis 227 u. 210Po (Halbwertszeit 138,376 Tage) ist das am weitesten verbreitete Isotop und wird durch Neutroneneinfang mit natürlichem Wismut hergestellt. Die langlebigeren 209Po (Halbwertszeit 125,2±3,3 Jahre, das langlebigste aller Poloniumisotope) und 208Po (Halbwertszeit 2,9 Jahre) können durch Alpha-, Protonen- oder Deuteronenbeschuss von Blei oder Wismut in einem Zyklotron hergestellt werden. ⓘ
Geschichte
Polonium wurde im Juli 1898 von Marie und Pierre Curie entdeckt und nach Marie Curies Heimatland Polen (lateinisch: Polonia) benannt. Polen war damals unter russischer, deutscher und österreichisch-ungarischer Herrschaft und existierte nicht als unabhängiges Land. Curie hoffte, dass die Benennung des Elements nach ihrem Heimatland dessen fehlende Unabhängigkeit bekannt machen würde. Polonium ist möglicherweise das erste Element, dessen Name auf eine politische Kontroverse hinweist. ⓘ
Es war das erste Element, das die Curies entdeckten, als sie die Ursache der Radioaktivität der Pechblende untersuchten. Pechblende war nach der Entfernung der radioaktiven Elemente Uran und Thorium radioaktiver als Uran und Thorium zusammen. Dies veranlasste die Curies, nach weiteren radioaktiven Elementen zu suchen. Im Juli 1898 trennten sie erstmals Polonium aus Pechblende ab, und fünf Monate später isolierten sie auch Radium. Dem deutschen Wissenschaftler Willy Marckwald gelang es 1902, 3 Milligramm Polonium zu isolieren, obwohl er damals glaubte, es handele sich um ein neues Element, das er "Radiotellurium" nannte, und erst 1905 wurde nachgewiesen, dass es mit Polonium identisch war. ⓘ
In den Vereinigten Staaten wurde Polonium im Rahmen des Dayton-Projekts des Manhattan-Projekts während des Zweiten Weltkriegs hergestellt. Polonium und Beryllium waren die Hauptbestandteile des "Urchin"-Zünders in der Mitte des kugelförmigen Bombenkastens. Urchin" löste die nukleare Kettenreaktion im kritischen Moment aus, um sicherzustellen, dass die Waffe nicht explodierte. Urchin" wurde in frühen US-Waffen verwendet; spätere US-Waffen nutzten für den gleichen Zweck einen Impulsneutronengenerator. ⓘ
Ein Großteil der physikalischen Grundlagen von Polonium war bis nach dem Krieg geheim. Die Tatsache, dass es als Initiator verwendet wurde, war bis in die 1960er Jahre geheim. ⓘ
Die Atomenergiekommission und das Manhattan-Projekt finanzierten zwischen 1943 und 1947 Experimente mit Polonium an fünf Personen an der Universität von Rochester. Den Personen wurden zwischen 9 und 22 Mikrocurie (330 und 810 kBq) Polonium verabreicht, um dessen Ausscheidung zu untersuchen. ⓘ
Vorkommen und Produktion
Polonium ist aufgrund der kurzen Halbwertszeiten aller seiner Isotope in der Natur ein sehr seltenes Element. Sieben Isotope kommen in Spuren als Zerfallsprodukte vor: 210Po, 214Po und 218Po treten in der Zerfallskette von 238U auf; 211Po und 215Po treten in der Zerfallskette von 235U auf; 212Po und 216Po treten in der Zerfallskette von 232Th auf. Davon ist 210Po das einzige Isotop mit einer Halbwertszeit von mehr als 3 Minuten. ⓘ
Polonium kommt in Uranerzen in einer Menge von etwa 0,1 mg pro Tonne (1 Teil in 1010) vor, was etwa 0,2 % der Radiumhäufigkeit entspricht. Die Mengen in der Erdkruste sind nicht schädlich. Polonium wurde im Tabakrauch von Tabakblättern gefunden, die mit Phosphatdünger angebaut wurden. ⓘ
Da es in geringen Konzentrationen vorkommt, ist die Isolierung von Polonium aus natürlichen Quellen ein langwieriger Prozess. Die größte jemals extrahierte Charge des Elements, die in der ersten Hälfte des 20. Jahrhunderts durchgeführt wurde, enthielt nur 40 Ci (1,5 TBq) (9 mg) Polonium-210 und wurde durch die Verarbeitung von 37 Tonnen Rückständen aus der Radiumproduktion gewonnen. Heute wird Polonium in der Regel durch die Bestrahlung von Wismut mit hochenergetischen Neutronen oder Protonen gewonnen. ⓘ
Im Jahr 1934 zeigte ein Experiment, dass beim Beschuss von natürlichem 209Bi mit Neutronen 210Bi entsteht, das dann durch Beta-Minus-Zerfall zu 210Po zerfällt. Die Endreinigung erfolgt pyrochemisch, gefolgt von Flüssig-Flüssig-Extraktionstechniken. Mit diesem Verfahren, bei dem hohe Neutronenflüsse wie in Kernreaktoren verwendet werden, kann Polonium nun in Milligramm-Mengen hergestellt werden. Jährlich werden nur etwa 100 Gramm hergestellt, praktisch ausschließlich in Russland, so dass Polonium äußerst selten ist. ⓘ
Dieses Verfahren kann in flüssigmetallgekühlten Kernreaktoren auf Blei-Wismut-Basis, wie sie im K-27 der sowjetischen Marine verwendet werden, Probleme verursachen. In diesen Reaktoren müssen Maßnahmen ergriffen werden, um die unerwünschte Möglichkeit der Freisetzung von 210Po aus dem Kühlmittel zu verhindern. ⓘ
Die langlebigeren Isotope des Poloniums, 208Po und 209Po, können durch Protonen- oder Deuteronenbeschuss von Wismut mit einem Zyklotron gebildet werden. Andere neutronenärmere und instabilere Isotope können durch die Bestrahlung von Platin mit Kohlenstoffkernen gebildet werden. ⓘ
Anwendungen
Quellen für Alphateilchen auf Poloniumbasis wurden in der ehemaligen Sowjetunion hergestellt. Diese Quellen wurden zur Messung der Dicke von industriellen Beschichtungen durch Abschwächung der Alphastrahlung eingesetzt. ⓘ
Aufgrund der intensiven Alphastrahlung erhitzt sich eine Ein-Gramm-Probe von 210Po spontan auf über 500 °C (932 °F) und erzeugt dabei eine Leistung von etwa 140 Watt. Daher wird 210Po als atomare Wärmequelle zum Betrieb von thermoelektrischen Generatoren aus Radioisotopen über thermoelektrische Materialien verwendet. So wurden beispielsweise 210Po-Wärmequellen in den Mondrovern Lunokhod 1 (1970) und Lunokhod 2 (1973) verwendet, um deren interne Komponenten während der Mondnächte warm zu halten, ebenso wie in den Satelliten Kosmos 84 und 90 (1965). ⓘ
Die von Polonium emittierten Alphateilchen können mit Hilfe von Berylliumoxid in Neutronen umgewandelt werden, und zwar mit einer Rate von 93 Neutronen pro Million Alphateilchen. Po-BeO-Gemische werden als passive Neutronenquellen mit einem Verhältnis von Gammastrahlung zu Neutronenproduktion von 1,13 ± 0,05 verwendet, was niedriger ist als bei Neutronenquellen auf der Basis von Kernspaltung. Beispiele für Po-BeO-Gemische oder -Legierungen, die als Neutronenquellen verwendet werden, sind ein Neutronenauslöser oder Initiator für Kernwaffen und für die Inspektion von Ölquellen. In der Sowjetunion wurden jährlich etwa 1500 Quellen dieser Art mit einer Einzelaktivität von 1.850 Ci (68 TBq) verwendet. ⓘ
Polonium war auch Bestandteil von Bürsten oder komplexeren Werkzeugen zur Beseitigung statischer Aufladungen in Fotoplatten, Textilfabriken, Papierrollen, Kunststoffplatten und auf Substraten (z. B. in der Automobilindustrie) vor dem Auftragen von Beschichtungen. Die von Polonium emittierten Alphateilchen ionisieren Luftmoleküle, die die Ladungen auf den nahe gelegenen Oberflächen neutralisieren. Einige Antistatikbürsten enthalten bis zu 500 Mikrocuries (20 MBq) 210Po als Quelle geladener Teilchen zur Neutralisierung statischer Elektrizität. In den USA können Geräte mit nicht mehr als 500 μCi (19 MBq) (versiegeltem) 210Po pro Einheit in beliebiger Menge unter einer "allgemeinen Lizenz" gekauft werden, was bedeutet, dass ein Käufer nicht bei einer Behörde registriert sein muss. Polonium muss in diesen Geräten wegen seiner kurzen Halbwertszeit fast jedes Jahr ausgetauscht werden; es ist außerdem hochradioaktiv und wurde daher meist durch weniger gefährliche Betateilchenquellen ersetzt. ⓘ
Winzige Mengen von 210Po werden manchmal im Labor und zu Lehrzwecken verwendet - typischerweise in der Größenordnung von 4-40 kBq (0,11-1,08 μCi), in Form von umschlossenen Quellen, bei denen das Polonium auf einem Substrat oder in einer Harz- oder Polymermatrix abgeschieden ist - und sind oft von der Genehmigung durch die NRC und ähnliche Behörden ausgenommen, da sie nicht als gefährlich gelten. Kleine Mengen von 210Po werden in den Vereinigten Staaten als "Nadelquellen" für Laborexperimente zum Verkauf an die Öffentlichkeit hergestellt und von wissenschaftlichen Versorgungsunternehmen vertrieben. Das Polonium ist mit einer Schicht überzogen, die wiederum mit einem Material wie Gold überzogen ist, das die Alphastrahlung (die in Experimenten wie Nebelkammern verwendet wird) durchlässt und gleichzeitig verhindert, dass das Polonium freigesetzt wird und eine toxische Gefahr darstellt. ⓘ
Polonium-Zündkerzen wurden von 1940 bis 1953 von Firestone vermarktet. Die von den Zündkerzen ausgehende Strahlung war zwar sehr gering und stellte keine Gefahr für den Verbraucher dar, doch ließen die Vorteile dieser Zündkerzen aufgrund der kurzen Halbwertszeit von Polonium und der Tatsache, dass Ablagerungen auf den Leitern die Strahlung, die die Motorleistung verbesserte, blockierten, nach etwa einem Monat schnell nach. (Die Polonium-Zündkerze sowie der Prototyp der Radium-Zündkerze von Alfred Matthew Hubbard, der ihr vorausging, beruhten auf der Annahme, dass die Strahlung die Ionisierung des Kraftstoffs im Zylinder verbessern und somit eine schnellere und effizientere Zündung des Motors ermöglichen würde). ⓘ
In manchen industriellen Ionisatoren wird 210Po eingesetzt, z. B. in Anlagen, in denen Papier, Textil oder synthetische Materialien gerollt werden, oder wenn optische Linsen von statischen Aufladungen befreit werden sollen. ⓘ
Die Zündstifte von Firestone-Zündkerzen enthielten um 1940 in den USA das radioaktive Schwermetall. Es sollte die Luft ionisieren und damit die Dauer des Zündfunkens verlängern. ⓘ
210Po entwickelt 140 Watt Wärme pro Gramm, daher wurde es in kurzlebigen Radionuklidbatterien, etwa für die sowjetischen Mondfahrzeuge Lunochod 1 und Lunochod 2 eingesetzt. Die Wärmeleistung genügt, um einen Poloniumkörper zum Schmelzen zu bringen. Heute kommen im Allgemeinen nur noch langlebigere Isotope anderer Elemente zum Einsatz. ⓘ
Der Alpha-Strahler Polonium wird in Verbindung mit Beryllium in transportablen Neutronenquellen benutzt. Dabei wird folgende Kernreaktion zur Erzeugung freier Neutronen genutzt:
Auch in Kernwaffen diente Polonium als Neutronenquelle. So wurden zum Beispiel in den amerikanischen Atombomben Little Boy und Fat Man, die auf Hiroshima und Nagasaki abgeworfen wurden, Initiatoren aus Polonium und Beryllium zum Start der Kettenreaktion verwendet. ⓘ
Biologie und Toxizität
Die größte Gefährdung stellt Polonium als Zerfallsprodukt des radioaktiven Edelgases Radon dar. Radon in der Atemluft erhöht das Risiko, an Lungenkrebs zu erkranken. Die eigentliche Ursache ist nicht Radon, sondern die Inhalation der kurzlebigen Radonzerfallsprodukte, die sich im Gegensatz zum gasförmigen Radon im Atemtrakt anreichern. Die unter den Zerfallsprodukten befindlichen Poloniumisotope 210Po, 212Po, 214Po, 216Po und 218Po haben die größte radiologische Wirkung, weil sie Alphateilchen aussenden. ⓘ
Während Alphastrahlung etwa bei äußerer Einwirkung bereits von der obersten Hautschicht aus abgestorbenen Zellen abgeschirmt wird, wirkt sie auf den Menschen stark schädigend, wenn Alpha-Strahler in den Körper gelangen. Über den Blutstrom verteilt sich das Polonium im Körpergewebe. Die zerstörerische Wirkung macht sich als Strahlenkrankheit zunächst an Zellen bemerkbar, die sich häufig teilen (z. B. Darmepithelien, Knochenmark). Zu den typischen Symptomen gehören neben Haarausfall und allgemeiner Schwäche auch Diarrhö, Anämie sowie Blutungen aus Nase, Mund, Zahnfleisch und Rektum. ⓘ
Polonium wird vom menschlichen Körper mit einer biologischen Halbwertszeit von ca. 50 Tagen ausgeschieden. Reste und Zerfallsprodukte finden sich größtenteils im Kot sowie zu rund 10 % im Urin. Darüber hinaus sind Inkorporationen von außen nur schwer zu entdecken und eine Diagnose schwierig, da kaum Gammastrahlung emittiert wird. ⓘ
Einer speziellen Polonium-Exposition sind Raucher ausgesetzt. Als mögliche Quellen kommen sowohl die im Tabakanbau eingesetzten Phosphatdüngemittel als auch eine Adsorption atmosphärischer Einträge durch die Tabakpflanzen in Frage. Die Anteile der Teer-Kanzerogene und der radioaktiven Exposition am Prozess der Krebsentstehung werden kontrovers diskutiert. Schätzungen gehen davon aus, dass bei Rauchern 9 bis 14 % der Bronchialkarzinome durch über Tabakrauch aufgenommene Radioaktivität verursacht werden. ⓘ
Überblick
Polonium kann gefährlich sein und hat keine biologische Bedeutung. Gemessen an der Masse ist Polonium-210 etwa 250.000 Mal giftiger als Blausäure (die LD50 für 210Po liegt bei weniger als 1 Mikrogramm für einen durchschnittlichen Erwachsenen (siehe unten), verglichen mit etwa 250 Milligramm für Blausäure). Die Hauptgefahr liegt in seiner starken Radioaktivität (als Alphastrahler), die eine sichere Handhabung erschwert. Selbst in Mikrogramm-Mengen ist der Umgang mit 210Po extrem gefährlich und erfordert eine spezielle Ausrüstung (eine Alpha-Handschuhbox mit Unterdruck und Hochleistungsfiltern), eine angemessene Überwachung und strenge Handhabungsverfahren, um jegliche Kontamination zu vermeiden. Die von Polonium emittierten Alphateilchen können organisches Gewebe leicht schädigen, wenn Polonium verschluckt, eingeatmet oder absorbiert wird, obwohl sie die Epidermis nicht durchdringen und daher nicht gefährlich sind, solange die Alphateilchen außerhalb des Körpers bleiben. Das Tragen von chemisch resistenten und intakten Handschuhen ist eine zwingende Vorsichtsmaßnahme, um die transkutane Diffusion von Polonium direkt durch die Haut zu vermeiden. In konzentrierter Salpetersäure geliefertes Polonium kann leicht durch ungeeignete Handschuhe (z. B. Latexhandschuhe) diffundieren, oder die Säure kann die Handschuhe beschädigen. ⓘ
Polonium hat keine toxischen chemischen Eigenschaften. ⓘ
Es wurde berichtet, dass einige Mikroben Polonium durch die Wirkung von Methylcobalamin methylieren können. Dies ist vergleichbar mit der Art und Weise, wie Quecksilber, Selen und Tellur in Lebewesen zu metallorganischen Verbindungen methyliert werden. Studien zum Metabolismus von Polonium-210 bei Ratten haben gezeigt, dass nur 0,002 bis 0,009 % des aufgenommenen Polonium-210 als flüchtiges Polonium-210 ausgeschieden werden. ⓘ
Akute Wirkungen
Die mittlere tödliche Dosis (LD50) bei akuter Strahlenexposition beträgt etwa 4,5 Sv. Die effektive Äquivalentdosis 210Po beträgt 0,51 µSv/Bq bei Einnahme und 2,5 µSv/Bq bei Einatmung. Eine tödliche Dosis von 4,5 Sv kann durch die Einnahme von 8,8 MBq (240 μCi), etwa 50 Nanogramm (ng), oder das Einatmen von 1,8 MBq (49 μCi), etwa 10 ng, verursacht werden. Ein Gramm 210Po könnte also theoretisch 20 Millionen Menschen vergiften, von denen 10 Millionen sterben würden. Die tatsächliche Toxizität von 210Po liegt unter diesen Schätzungen, da eine Strahlenbelastung, die sich über mehrere Wochen erstreckt (die biologische Halbwertszeit von Polonium beim Menschen beträgt 30 bis 50 Tage), etwas weniger schädlich ist als eine sofortige Dosis. Man schätzt, dass die mittlere tödliche Dosis von 210Po bei 15 Megacquerel (0,41 mCi) oder 0,089 Mikrogramm (μg) liegt, was immer noch eine extrem geringe Menge ist. Zum Vergleich: Ein Körnchen Kochsalz enthält etwa 0,06 mg = 60 μg. ⓘ
Langfristige (chronische) Auswirkungen
Zusätzlich zu den akuten Wirkungen birgt die Strahlenbelastung (sowohl innere als auch äußere) ein langfristiges Krebsrisiko von 5-10 % pro Sv. Die Allgemeinbevölkerung ist geringen Mengen Polonium als Radontochter in der Innenraumluft ausgesetzt; man geht davon aus, dass die Isotope 214Po und 218Po den Großteil der schätzungsweise 15 000 bis 22 000 Lungenkrebstodesfälle in den USA pro Jahr verursachen, die auf Innenraumradon zurückgeführt werden. Tabakrauchen verursacht eine zusätzliche Exposition gegenüber Polonium. ⓘ
Gesetzliche Expositionsgrenzwerte und Handhabung
Die maximal zulässige Körperbelastung für verschlucktes 210Po beträgt nur 1,1 kBq (30 nCi), was einer Partikelmasse von nur 6,8 Pikogramm entspricht. Die maximal zulässige Arbeitsplatzkonzentration von 210Po in der Luft beträgt etwa 10 Bq/m3 (3×10-10 µCi/cm3). Die Zielorgane für Polonium beim Menschen sind die Milz und die Leber. Da die Milz (150 g) und die Leber (1,3 bis 3 kg) viel kleiner sind als der übrige Körper, stellt die Konzentration von Polonium in diesen lebenswichtigen Organen eine größere Bedrohung für das Leben dar als die Dosis, die der gesamte Körper (im Durchschnitt) erleiden würde, wenn das Polonium wie Cäsium oder Tritium (als T2O) gleichmäßig über den Körper verteilt wäre. ⓘ
210Po ist in der Industrie weit verbreitet und leicht verfügbar, ohne dass es irgendwelche Vorschriften oder Einschränkungen gibt. In den USA wurde 2007 ein von der Nuclear Regulatory Commission betriebenes Rückverfolgungssystem eingeführt, um Käufe von mehr als 16 Curies (590 GBq) Polonium-210 (genug, um 5.000 tödliche Dosen zu erzeugen) zu registrieren. Die IAEO "erwägt angeblich strengere Vorschriften ... Es gibt Gerüchte, dass sie die Meldepflicht für Polonium um den Faktor 10 auf 1,6 Curies (59 GBq) verschärfen könnte." Seit 2013 ist dies immer noch das einzige Alphastrahlen emittierende Nebenprodukt, das als NRC Exempt Quantity ohne Lizenz für radioaktives Material gelagert werden darf. ⓘ
Polonium und seine Verbindungen müssen in einer Handschuhbox gehandhabt werden, die wiederum in einer anderen Box eingeschlossen ist, in der ein etwas höherer Druck herrscht als in der Handschuhbox, damit die radioaktiven Stoffe nicht austreten können. Handschuhe aus Naturkautschuk bieten keinen ausreichenden Schutz gegen die Strahlung von Polonium; es sind chirurgische Handschuhe erforderlich. Neoprenhandschuhe schirmen die Strahlung von Polonium besser ab als Naturkautschuk. ⓘ
Fälle von Vergiftungen
Trotz der hochgefährlichen Eigenschaften des Elements sind die Umstände, unter denen eine Poloniumvergiftung auftreten kann, selten. Die extreme Seltenheit des Elements in der Natur, die kurzen Halbwertszeiten aller Isotope, die speziellen Einrichtungen und Ausrüstungen, die zur Gewinnung größerer Mengen erforderlich sind, sowie die Sicherheitsvorkehrungen gegen Laborunfälle machen schädliche Expositionsereignisse unwahrscheinlich. Daher wurden nur wenige Fälle von Strahlenvergiftungen bestätigt, die speziell auf eine Poloniumexposition zurückzuführen sind. ⓘ
20. Jahrhundert
Als Reaktion auf die Besorgnis über die Risiken einer berufsbedingten Poloniumexposition wurden an der Universität von Rochester von 1944 bis 1947 fünf menschlichen Freiwilligen 210Po verabreicht, um das biologische Verhalten des Poloniums zu untersuchen. Diese Studien wurden durch das Manhattan-Projekt und die AEC finanziert. Es nahmen vier Männer und eine Frau teil, die alle an Krebs im Endstadium litten und zwischen Anfang dreißig und Anfang vierzig Jahre alt waren. Vier hospitalisierten Patienten wurde 210Po injiziert, einem fünften wurde es oral verabreicht. Keine der verabreichten Dosen (alle zwischen 0,17 und 0,30 μCi kg-1) erreichte annähernd tödliche Mengen. ⓘ
Der erste dokumentierte Todesfall, der direkt auf eine Poloniumvergiftung zurückzuführen ist, ereignete sich am 10. Juli 1954 in der Sowjetunion. Ein nicht identifizierter 41-jähriger Mann begab sich am 29. Juni mit starkem Erbrechen und Fieber in ärztliche Behandlung; am Vortag hatte er fünf Stunden lang in einem Bereich gearbeitet, in dem sich, ohne dass er es wusste, eine 210Po enthaltende Kapsel entleert und in Form eines Aerosols zu verteilen begonnen hatte. Während dieses Zeitraums nahm er schätzungsweise insgesamt 0,11 GBq 210Po über die Luft auf (fast das 25-fache der geschätzten LD50 durch Inhalation von 4,5 MBq). Trotz der Behandlung verschlechterte sich sein Zustand weiter und er starb 13 Tage nach dem Expositionsereignis. ⓘ
Es wurde auch vermutet, dass Irène Joliot-Curies Leukämie-Tod im Jahr 1956 auf die Strahlenwirkung von Polonium zurückzuführen ist. Sie wurde 1946 versehentlich verstrahlt, als eine versiegelte Kapsel des Elements auf ihrem Labortisch explodierte. ⓘ
Auch mehrere Todesfälle in Israel in den Jahren 1957-1969 sollen auf eine 210Po-Exposition zurückzuführen sein. Im Jahr 1957 wurde in einem Labor des Weizmann-Instituts ein Leck entdeckt. An den Händen von Professor Dror Sadeh, einem Physiker, der über radioaktive Materialien forschte, wurden Spuren von 210Po gefunden. Medizinische Tests ergaben keine Schäden, aber die Tests umfassten nicht das Knochenmark. Sadeh, einer seiner Studenten und zwei Kollegen starben in den folgenden Jahren an verschiedenen Krebsarten. Die Angelegenheit wurde im Geheimen untersucht, aber es gab nie ein offizielles Eingeständnis für einen Zusammenhang zwischen dem Leck und den Todesfällen. ⓘ
21. Jahrhundert
Die Ursache für den Tod von Alexander Litwinenko im Jahr 2006, einem ehemaligen russischen FSB-Agenten, der 2001 in das Vereinigte Königreich übergelaufen war, wurde als Vergiftung mit einer tödlichen Dosis von 210Po identifiziert. Später wurde festgestellt, dass ihm das 210Po wahrscheinlich absichtlich von zwei ehemaligen russischen Sicherheitsagenten, Andrej Lugowoj und Dmitrij Kowtun, verabreicht worden war. Litwinenkos Tod war somit der erste (und bisher einzige) bestätigte Fall, in dem die extreme Toxizität von Polonium in böser Absicht eingesetzt wurde. ⓘ
Im Jahr 2011 tauchte die Behauptung auf, dass der Tod des Palästinenserführers Jassir Arafat, der am 11. November 2004 aus ungeklärter Ursache starb, ebenfalls auf eine vorsätzliche Poloniumvergiftung zurückzuführen sei. Im Juli 2012 wurden vom Institut de Radiophysique in Lausanne (Schweiz) ungewöhnlich hohe Konzentrationen von 210Po in Arafats Kleidung und persönlichen Gegenständen nachgewiesen. Der Sprecher des Instituts betonte jedoch, dass Arafats medizinische Berichte trotz dieser Tests nicht mit einer 210Po-Vergiftung übereinstimmten, und die Wissenschaftsjournalistin Deborah Blum schlug vor, dass Tabakrauch dafür verantwortlich sein könnte, da sowohl Arafat als auch viele seiner Kollegen starke Raucher waren; spätere Tests sowohl durch französische als auch durch russische Teams ergaben, dass die erhöhten 210Po-Werte nicht das Ergebnis einer absichtlichen Vergiftung waren und nicht zu Arafats Tod führten. ⓘ
Behandlung
Es wurde vorgeschlagen, dass Chelatbildner wie British Anti-Lewisite (Dimercaprol) zur Dekontaminierung von Menschen verwendet werden können. In einem Versuch wurde Ratten eine tödliche Dosis von 1,45 MBq/kg (8,7 ng/kg) 210Po verabreicht; Alle unbehandelten Ratten waren nach 44 Tagen tot, aber 90 % der Ratten, die mit dem Chelatbildner HOEtTTC behandelten Ratten blieben 5 Monate lang am Leben. ⓘ
Nachweis in biologischen Proben
Polonium-210 kann in biologischen Proben mittels Alphateilchen-Spektrometrie quantifiziert werden, um die Diagnose einer Vergiftung bei hospitalisierten Patienten zu bestätigen oder um Beweise in einer gerichtsmedizinischen Todesfalluntersuchung zu liefern. Die Grundausscheidung von Polonium-210 im Urin liegt bei gesunden Personen aufgrund einer routinemäßigen Exposition gegenüber Umweltquellen normalerweise in einem Bereich von 5-15 mBq/Tag. Werte von mehr als 30 mBq/Tag deuten auf eine übermäßige Exposition gegenüber dem Radionuklid hin. ⓘ
Vorkommen im Menschen und in der Biosphäre
Aufgrund seiner Stellung in der Uran-238-Zerfallskette ist Polonium-210 in der Biosphäre weit verbreitet, auch im menschlichen Gewebe. Natürliches Uran-238 in der Erdkruste zerfällt über eine Reihe fester radioaktiver Zwischenprodukte, darunter Radium-226, in das radioaktive Edelgas Radon-222, von dem ein Teil während seiner Halbwertszeit von 3,8 Tagen in die Atmosphäre diffundiert. Dort zerfällt es in mehreren weiteren Schritten zu Polonium-210, von dem ein Großteil während seiner 138-tägigen Halbwertszeit wieder an die Erdoberfläche gespült wird und so in die Biosphäre gelangt, bevor es schließlich zu stabilem Blei-206 zerfällt. ⓘ
Bereits in den 1920er Jahren wies der französische Biologe Antoine Lacassagne [fr] anhand von Polonium, das ihm seine Kollegin Marie Curie zur Verfügung gestellt hatte, nach, dass das Element ein spezifisches Aufnahmemuster im Gewebe von Kaninchen aufweist, mit hohen Konzentrationen, insbesondere in Leber, Niere und Hoden. Neuere Erkenntnisse deuten darauf hin, dass dieses Verhalten darauf zurückzuführen ist, dass Polonium in schwefelhaltigen Aminosäuren oder verwandten Molekülen an die Stelle seines Artgenossen Schwefel, der ebenfalls zur Gruppe 16 des Periodensystems gehört, tritt, und dass ähnliche Verteilungsmuster im menschlichen Gewebe auftreten. Polonium ist in der Tat ein Element, das von Natur aus in allen Menschen vorkommt und erheblich zur natürlichen Hintergrunddosis beiträgt, mit großen geografischen und kulturellen Schwankungen und besonders hohen Werten beispielsweise bei Bewohnern der Arktis. ⓘ
Tabak
Das im Tabak enthaltene Polonium-210 trägt zu vielen der weltweiten Lungenkrebsfälle bei. Der größte Teil dieses Poloniums stammt von Blei-210, das sich aus der Atmosphäre auf den Tabakblättern ablagert; das Blei-210 ist ein Produkt von Radon-222-Gas, das zu einem großen Teil aus dem Zerfall von Radium-226 aus den auf den Tabakböden ausgebrachten Düngemitteln zu stammen scheint. ⓘ
Das Vorhandensein von Polonium im Tabakrauch ist seit den frühen 1960er Jahren bekannt. Einige der weltgrößten Tabakkonzerne haben 40 Jahre lang nach Möglichkeiten gesucht, die Substanz zu entfernen - ohne Erfolg. Die Ergebnisse wurden nie veröffentlicht. ⓘ
Lebensmittel
Polonium findet sich in der Nahrungskette, insbesondere in Meeresfrüchten. ⓘ
Gewinnung und Herstellung
Poloniumisotope sind Zwischenprodukte der Thorium-Reihe und der Uran-Radium-Reihe, wobei letztere das häufigste Isotop 210Po produziert. Polonium kann daher bei der Aufarbeitung von Pechblende gewonnen werden (1000 Tonnen Uranpechblende enthalten etwa 0,03 Gramm Polonium). Dabei reichert es sich zusammen mit Bismut an. Von diesem Element kann man es anschließend mittels fraktionierter Fällung der Sulfide trennen, da Poloniumsulfid schwerer löslich ist als Bismutsulfid. ⓘ
Heutzutage erfolgt die Herstellung von Polonium jedoch im Kernreaktor durch Neutronenbeschuss von Bismut:
Die Halbwertszeit t½ für den Betazerfall von 210Bi liegt bei 5,01 Tagen. Durch Destillation werden die beiden Elemente anschließend getrennt (Siedepunkt von Polonium: 962 °C; Siedepunkt von Bismut: 1564 °C). Eine andere Methode ist die Extraktion mit Hydroxidschmelzen bei Temperaturen um 400 °C. Die Weltjahresproduktion beträgt ca. 100 g. ⓘ
Verbindungen
Sauerstoffverbindungen
Polonium(IV)-oxid (PoO2)x ist wie das Oxid des Gruppennachbarn Tellur (Tellurdioxid, (TeO2)x) eine ionische Verbindung, die in einer gelben und einer roten Modifikation auftritt. Weiterhin kennt man das schwarze Polonium(II)-oxid (PoO) und Polonium(VI)-oxid (PoO3). ⓘ
Sulfide
Schwarzes Poloniummonosulfid (PoS) erhält man durch Fällung von in Säure gelöstem Polonium mit Schwefelwasserstoff. ⓘ
Wasserstoffverbindungen
Poloniumwasserstoff (H2Po) ist eine bei Raumtemperatur flüssige Wasserstoff-Verbindung, von der sich zahlreiche Polonide ableiten lassen. ⓘ
Halogenide
Poloniumhalogenide kennt man mit den Summenformeln PoX2, PoX4 und PoX6. Zu nennen sind Poloniumdifluorid, Poloniumdichlorid (rubinrot), Poloniumdibromid (purpurbraun) und Poloniumtetrafluorid, hellgelbes Poloniumtetrachlorid, rotes Poloniumtetrabromid sowie das schwarze Poloniumtetraiodid. Die Synthese von Poloniumhexafluorid (PoF6) wurde 1945 versucht, führte aber zu keinen eindeutigen Ergebnissen, der Siedepunkt wurde auf −40 °C geschätzt. ⓘ



