Enzym
| Teil einer Serie über ⓘ |
| Biochemie |
|---|
 |
|
|
Enzyme (/ˈɛnzaɪmz/) sind Proteine, die als biologische Katalysatoren (Biokatalysatoren) wirken. Katalysatoren beschleunigen chemische Reaktionen. Die Moleküle, auf die Enzyme wirken können, werden als Substrate bezeichnet, und das Enzym wandelt die Substrate in verschiedene Moleküle um, die als Produkte bezeichnet werden. Fast alle Stoffwechselprozesse in der Zelle benötigen die Katalyse durch Enzyme, damit sie schnell genug ablaufen können, um Leben zu erhalten. Stoffwechselwege sind auf Enzyme angewiesen, um einzelne Schritte zu katalysieren. Das Studium der Enzyme wird als Enzymologie bezeichnet, und der Bereich der Pseudoenzymanalyse erkennt an, dass einige Enzyme im Laufe der Evolution die Fähigkeit zur biologischen Katalyse verloren haben, was sich oft in ihren Aminosäuresequenzen und ungewöhnlichen "pseudokatalytischen" Eigenschaften widerspiegelt. ⓘ
Es ist bekannt, dass Enzyme mehr als 5.000 biochemische Reaktionstypen katalysieren können. Andere Biokatalysatoren sind katalytische RNA-Moleküle, so genannte Ribozyme. Die Spezifität von Enzymen beruht auf ihrer einzigartigen dreidimensionalen Struktur. ⓘ
Wie alle Katalysatoren erhöhen Enzyme die Reaktionsgeschwindigkeit, indem sie die Aktivierungsenergie der Reaktion senken. Einige Enzyme können die Umwandlung eines Substrats in ein Produkt um ein Vielfaches beschleunigen. Ein extremes Beispiel ist die Orotidin-5'-phosphat-Decarboxylase, die eine Reaktion, die sonst Millionen von Jahren dauern würde, in Millisekunden ablaufen lässt. Chemisch gesehen sind Enzyme wie jeder andere Katalysator und werden bei chemischen Reaktionen nicht verbraucht, noch verändern sie das Gleichgewicht einer Reaktion. Enzyme unterscheiden sich von den meisten anderen Katalysatoren dadurch, dass sie sehr viel spezifischer sind. Die Aktivität von Enzymen kann durch andere Moleküle beeinflusst werden: Inhibitoren sind Moleküle, die die Enzymaktivität verringern, und Aktivatoren sind Moleküle, die die Aktivität erhöhen. Viele therapeutische Medikamente und Gifte sind Enzyminhibitoren. Die Aktivität eines Enzyms nimmt außerhalb seiner optimalen Temperatur und seines optimalen pH-Werts deutlich ab, und viele Enzyme werden (dauerhaft) denaturiert, wenn sie übermäßiger Hitze ausgesetzt werden, wodurch sie ihre Struktur und katalytischen Eigenschaften verlieren. ⓘ
Einige Enzyme werden kommerziell genutzt, z. B. für die Synthese von Antibiotika. In einigen Haushaltsprodukten werden Enzyme eingesetzt, um chemische Reaktionen zu beschleunigen: Enzyme in biologischen Waschmitteln bauen Protein-, Stärke- oder Fettflecken auf der Kleidung ab, und Enzyme in Fleischzartmachern zerlegen Proteine in kleinere Moleküle, wodurch das Fleisch leichter zu kauen ist. ⓘ


Ein Enzym, früher Ferment, ist ein Stoff, der aus biologischen Riesenmolekülen besteht und als Katalysator eine chemische Reaktion beschleunigen kann. Die meisten Enzyme sind Proteine (Eiweißkörper), eine Ausnahme bildet die katalytisch aktive RNA (Ribozym), wie z. B. snRNA oder (natürlich nicht-vorkommende, künstlich hergestellte) katalytisch aktive DNA (Desoxyribozym). Ihre Bildung in der Zelle erfolgt daher, wie auch bei anderen Proteinen, über Proteinbiosynthese an den Ribosomen. Enzyme haben wichtige Funktionen im Stoffwechsel von Organismen: Sie steuern den überwiegenden Teil biochemischer Reaktionen – von der Verdauung bis hin zur Transkription (RNA-Polymerase) und Replikation (DNA-Polymerase) der Erbinformationen. ⓘ
Wortherkunft und Geschichte der Enzymforschung
Menschen nutzen seit mehreren tausend Jahren die Wirkung von Enzymen wie jener von Hefen und Bakterien; so ist bekannt, dass die Sumerer bereits 3000 v. Chr. Bier brauten, Brot backten und Käse herstellten. Für den Gebrauch von Bier- oder Backhefe, wie beim Maischen oder im Hefeteig, und die damit eingeleiteten Vorgänge der Gärung entstand die Bezeichnung „Fermentation“, noch ohne Kenntnis der Existenz von Bakterien (bzw. der mikrobiellen Hefepilze) und ihrer Wirkung durch Enzyme. ⓘ
Die Wörter Fermentation und Ferment hielten im 15. Jahrhundert Einzug in die deutsche Sprache, sie gehen auf das lateinische Wort fermentum zurück. Diesen Ausdruck verwendet Columella etwa 60 n. Chr. auch für das Auflockern und Quellen des Bodens, während Seneca etwa gleicher Zeit in seinen Epistulae damit einen Gärungsvorgang bezeichnet, den er für die Bildung von Honig als nötig ansah. Mit dieser Bedeutung als „Gärungsmittel“ oder „Sauerteig“ wurde das Wort Ferment aus dem Lateinischen entlehnt, und davon fermentieren, Fermentation sowie Fermenter abgeleitet. ⓘ
Die ersten Gärungsprozesse beschrieben Paracelsus und Andreas Libavius. Die ersten Versuche zur Erklärung kamen von Johann Baptist van Helmont und Georg Ernst Stahl. Nachdem René Réaumur 1752 die Verdauung bei Vögeln untersucht und herausgestellt hatte, dass Greifvögel keinen Körner zerkleinernden Muskelmagen haben, sondern im Magen eine Flüssigkeit absondern, konnte Lazzaro Spallanzani 1783 belegen, dass allein deren Magensaft schon hinreicht Fleisch zu verflüssigen. Damit war die Theorie eines nur mechanischen Verdauungsprozesses widerlegt. ⓘ
Die erste unmittelbare Nutzung von Enzymen ohne die Mitbeteiligung von Mikroorganismen erfolgte durch den deutschen Apotheker Constantin Kirchhoff im Jahre 1811, als er entdeckte, dass man durch Erhitzen von Stärke unter Beigabe von Schwefelsäure größere Mengen Zucker herstellen kann. Der französische Chemiker Anselme Payen verfeinerte 1833 den Prozess; da man zu dieser Zeit annahm, dass man den Zucker lediglich von der Stärke trenne, bezeichnete man diesen Prozess als „Diastase“ (griechisch für trennen); heute wird der Begriff „Diastase“ synonym zu Amylase verwendet. Es folgte die Entdeckung von Erhard Friedrich Leuchs im Jahre 1831, dass der menschliche Mundspeichel Stärke scheinbar verzuckere. 1833 wurde von Eilhard Mitscherlich der Begriff „Ferment“ im Zusammenhang mit einem Stoff gebraucht, der bei einer Reaktion nicht verwandelt wird, aber zum Kontakt für eine Reaktion erforderlich ist. 1835 wurde die Diastase vom schwedischen Chemiker Jöns Jakob Berzelius als chemischer Prozess mit der Einwirkung von katalytischen Kräften vermutet. ⓘ
1837 entdeckten die drei Wissenschaftler Charles Cagniard de la Tour, Theodor Schwann und Friedrich Traugott Kützing unabhängig voneinander, dass Hefe aus Mikroorganismen besteht. Louis Pasteur wies 1862 nach, dass Mikroorganismen für die Fermentation verantwortlich sind; er schlussfolgerte, dass die Fermentation durch eine vitale Kraft erfolge, die in der Schimmelzelle vorhanden sei, welche er „Fermente“ nannte, die nicht mit dem Tod der Schimmelzelle an Wirkung verlieren. ⓘ
1878 führte Wilhelm Friedrich Kühne das heutige neoklassische Kunstwort Enzym (altgriechisch ἔνζυμον énzymon) ein, abgeleitet von ἐν- en-, „in-“, und ζύμη zýmē, welches ebenfalls „der Sauerteig“ oder „die Hefe“ bedeutet, der Sinn ist daher „das in Sauerteig/Hefe Enthaltene“ (nämlich der die Gärung auslösende oder beeinflussende Stoff). Dieser Begriff hielt dann Einzug in die internationale Wissenschaft und ist nun auch Bestandteil der neugriechischen Sprache. ⓘ
Kühne grenzte den Begriff Enzyme als Bezeichnung für außerhalb lebender Zellen wirksame Biokatalysatoren jedoch von Fermenten ab, die ihre Wirkung nach Pasteurs Auffassung nur innerhalb lebender Zellen entfalten könnten. ⓘ
Einen weiteren Meilenstein stellen die Untersuchungen zur Enzymspezifität von Emil Fischer dar. Er postulierte um 1890, dass Enzyme und ihr Substrat sich wie ein Schloss und der passende Schlüssel verhalten. 1897 entdeckte Eduard Buchner anhand der alkoholischen Gärung, dass Enzyme auch ohne die lebende Zelle katalytisch wirken können; 1907 erhielt er für den Nachweis einer Zell-freien Fermentation den Nobelpreis. 1903 schafften Eduard Buchner und Jakob Meisenheimer es, Mikroorganismen, die Milch- und Essigsäuregärung auslösten, abzutöten, ohne ihre Enzymwirkung zu beeinflussen. Der deutsche Chemiker Otto Röhm isolierte 1908 erstmals Enzyme und entwickelte Verfahren zur enzymatischen Ledergerbung, Fruchtsaftreinigung sowie eine Reihe diagnostischer Anwendungen. ⓘ
Anfang des 20. Jahrhunderts war die chemische Komposition von Enzymen noch unbekannt. Man vermutete, dass Enzyme aus Protein bestehen und ihre enzymatische Aktivität mit ihrer Struktur assoziiert sei. Andere Wissenschaftler wie Richard Willstätter argumentierten jedoch, dass Proteine nur Träger der „echten Enzyme“ wären und von sich aus unfähig wären eine katalytische Reaktion einzuleiten. James B. Sumner zeigte 1926, dass das Enzym Urease ein pures Protein ist, und war fähig es zu kristallisieren. Die letzten Zweifel zur Komposition von Enzymen wurden von John H. Northop und Wendell M. Stanley ausgeräumt, als diese 1930 nachwiesen, dass Pepsin, Trypsin und Chymotrypsin aus purem Protein bestehen. Northrop und Stanley erhielten dafür 1946 den Nobelpreis für Chemie. ⓘ
Die Erkenntnis, wie man Enzyme kristallisiert, erlaubte es den Forschern nun durch Kristallstrukturanalyse die Struktur und die Funktionsweise von Enzymen auf atomarem Level aufzuklären. In den Jahren 1930 bis 1939 konnten die Kristallstrukturen von elf weiteren Enzymen aufgedeckt werden. Die erste Aminosäuresequenz, die von einem Enzym komplett entschlüsselt war, ist die der Ribonuklease. Dieser Schritt gelang Stanford Moore und William Howard Stein. 1969 synthetisierte Robert Bruce Merrifield dann die gesamte Sequenz der Ribonuklease mit der nach ihm benannten Technik (Merrifield-Synthese). Gleichzeitig schafften dies auch R. G. Denkewalter und R. Hirschmann. ⓘ
In den 1980er Jahren wurden katalytische Antikörper von Richard Lerner entdeckt, die eine Enzymaktivität aufwiesen, nachdem gegen ein dem Übergangszustand nachempfundenes Molekül immunisiert wurde. Linus Pauling hatte bereits 1948 vermutet, dass Enzyme dem Übergangszustand ähnliche Moleküle besonders gut binden. Ende der 1980er Jahre wurde entdeckt, dass auch RNA im Organismus katalytische (enzymatische) Aktivität entfalten kann (Ribozym). 1994 wurde das erste Desoxyribozym, GR-5, entwickelt. ⓘ
Forscher wie Leonor Michaelis und Maud Menten leisteten Pionierarbeit in der Erforschung der Enzymkinetik mit der Formulierung der Michaelis-Menten-Theorie. ⓘ
Im späten 17. und frühen 18. Jahrhundert waren die Verdauung von Fleisch durch Magensekrete und die Umwandlung von Stärke in Zucker durch Pflanzenextrakte und Speichel bekannt, aber die Mechanismen, durch die dies geschah, waren nicht bekannt. ⓘ
Der französische Chemiker Anselme Payen entdeckte 1833 als erster ein Enzym, die Diastase. Einige Jahrzehnte später kam Louis Pasteur bei der Untersuchung der Gärung von Zucker zu Alkohol durch Hefe zu dem Schluss, dass diese Gärung durch eine in den Hefezellen enthaltene Lebenskraft, die so genannten "Fermente", verursacht wird, von denen man annahm, dass sie nur in lebenden Organismen funktionieren. Er schrieb, dass "die alkoholische Gärung ein Akt ist, der mit dem Leben und der Organisation der Hefezellen zusammenhängt, nicht mit dem Tod oder der Fäulnis der Zellen". ⓘ
Die Entdeckung, dass Enzyme kristallisiert werden können, ermöglichte es schließlich, ihre Strukturen durch Röntgenkristallographie zu lösen. Dies geschah erstmals für Lysozym, ein Enzym, das in Tränen, Speichel und Eiklar vorkommt und die Hülle einiger Bakterien verdaut; die Struktur wurde von einer Gruppe unter der Leitung von David Chilton Phillips gelöst und 1965 veröffentlicht. Diese hochauflösende Struktur von Lysozym markierte den Beginn des Bereichs der Strukturbiologie und der Bemühungen, die Funktionsweise von Enzymen auf atomarer Ebene zu verstehen. ⓘ
Klassifizierung und Nomenklatur
Enzyme können nach zwei Hauptkriterien klassifiziert werden: entweder nach der Ähnlichkeit der Aminosäuresequenz (und damit der evolutionären Verwandtschaft) oder nach der enzymatischen Aktivität. ⓘ
Enzymaktivität. Der Name eines Enzyms wird oft von seinem Substrat oder der chemischen Reaktion, die es katalysiert, abgeleitet, wobei das Wort auf -ase endet. Beispiele hierfür sind Laktase, Alkoholdehydrogenase und DNA-Polymerase. Verschiedene Enzyme, die dieselbe chemische Reaktion katalysieren, werden als Isoenzyme bezeichnet. ⓘ
Die Internationale Union für Biochemie und Molekularbiologie hat eine Nomenklatur für Enzyme entwickelt, die EC-Nummern (für "Enzyme Commission"). Jedes Enzym wird mit "EC" beschrieben, gefolgt von einer Folge von vier Zahlen, die die Hierarchie der enzymatischen Aktivität (von sehr allgemein bis sehr spezifisch) darstellen. Das heißt, die erste Zahl klassifiziert das Enzym grob nach seinem Mechanismus, während die anderen Ziffern immer spezifischer werden. ⓘ
Die oberste Klassifizierung ist:
- EC 1, Oxidoreduktasen: katalysieren Oxidations-/Reduktionsreaktionen
- EC 2, Transferasen: übertragen eine funktionelle Gruppe (z. B. eine Methyl- oder Phosphatgruppe)
- EC 3, Hydrolasen: katalysieren die Hydrolyse von verschiedenen Bindungen
- EC 4, Lyasen: spalten verschiedene Bindungen auf andere Weise als durch Hydrolyse und Oxidation
- EC 5, Isomerasen: katalysieren Isomerisierungsänderungen innerhalb eines einzelnen Moleküls
- EC 6, Ligasen: verbinden zwei Moleküle mit kovalenten Bindungen.
- EC 7, Translokasen: katalysieren die Bewegung von Ionen oder Molekülen durch Membranen oder ihre Trennung innerhalb von Membranen. ⓘ
Diese Abschnitte sind durch weitere Merkmale wie Substrat, Produkte und chemischer Mechanismus untergliedert. Ein Enzym ist durch vier numerische Bezeichnungen vollständig spezifiziert. Hexokinase (EC 2.7.1.1) zum Beispiel ist eine Transferase (EC 2), die eine Phosphatgruppe (EC 2.7) an einen Hexosezucker, ein Molekül mit einer Alkoholgruppe (EC 2.7.1), anhängt. ⓘ
Sequenz-Ähnlichkeit. Die EC-Kategorien spiegeln nicht die Sequenzähnlichkeit wider. So können beispielsweise zwei Ligasen mit der gleichen EC-Nummer, die genau die gleiche Reaktion katalysieren, völlig unterschiedliche Sequenzen haben. Unabhängig von ihrer Funktion wurden Enzyme, wie alle anderen Proteine auch, anhand ihrer Sequenzähnlichkeit in zahlreiche Familien eingeteilt. Diese Familien sind in Dutzenden von verschiedenen Protein- und Proteinfamiliendatenbanken wie Pfam dokumentiert. ⓘ
Struktur

Enzyme sind im Allgemeinen globuläre Proteine, die allein oder in größeren Komplexen wirken. Die Sequenz der Aminosäuren legt die Struktur fest, die wiederum die katalytische Aktivität des Enzyms bestimmt. Obwohl die Struktur die Funktion bestimmt, lässt sich eine neue enzymatische Aktivität noch nicht allein aus der Struktur vorhersagen. Enzymstrukturen entfalten sich (denaturieren), wenn sie erhitzt oder chemischen Denaturierungsmitteln ausgesetzt werden, und diese Störung der Struktur führt in der Regel zu einem Verlust der Aktivität. Die Denaturierung von Enzymen ist in der Regel mit Temperaturen verbunden, die über dem normalen Niveau einer Spezies liegen. Daher werden Enzyme von Bakterien, die in vulkanischen Umgebungen wie heißen Quellen leben, von industriellen Anwendern wegen ihrer Fähigkeit, bei hohen Temperaturen zu funktionieren, geschätzt, so dass enzymkatalysierte Reaktionen mit einer sehr hohen Geschwindigkeit ablaufen können. ⓘ
Enzyme sind in der Regel viel größer als ihre Substrate. Die Größe reicht von nur 62 Aminosäureresten für das Monomer der 4-Oxalocrotonat-Tautomerase bis zu über 2.500 Resten in der tierischen Fettsäuresynthase. Nur ein kleiner Teil ihrer Struktur (etwa 2-4 Aminosäuren) ist direkt an der Katalyse beteiligt: die katalytische Stelle. Diese katalytische Stelle befindet sich neben einer oder mehreren Bindungsstellen, an denen die Reste die Substrate ausrichten. Die katalytische Stelle und die Bindungsstelle bilden zusammen die aktive Stelle des Enzyms. Der übrige Teil der Enzymstruktur dient dazu, die genaue Ausrichtung und Dynamik der aktiven Stelle aufrechtzuerhalten. ⓘ
Bei einigen Enzymen sind keine Aminosäuren direkt an der Katalyse beteiligt; stattdessen enthält das Enzym Stellen zur Bindung und Ausrichtung katalytischer Cofaktoren. Enzymstrukturen können auch allosterische Stellen enthalten, an denen die Bindung eines kleinen Moleküls eine Konformationsänderung bewirkt, die die Aktivität erhöht oder verringert. ⓘ
Es gibt eine kleine Anzahl von biologischen Katalysatoren auf RNA-Basis, die Ribozyme genannt werden, die wiederum allein oder im Komplex mit Proteinen wirken können. Das häufigste dieser Enzyme ist das Ribosom, ein Komplex aus Proteinen und katalytischen RNA-Komponenten. ⓘ
Mechanismus
Bindung des Substrats
Enzyme müssen ihre Substrate binden, bevor sie eine chemische Reaktion katalysieren können. Enzyme sind in der Regel sehr spezifisch hinsichtlich der Substrate, die sie binden, und der dann katalysierten chemischen Reaktion. Die Spezifität wird durch Bindungstaschen mit komplementärer Form, Ladung und hydrophilen/hydrophoben Eigenschaften zu den Substraten erreicht. Enzyme können daher zwischen sehr ähnlichen Substratmolekülen unterscheiden, um chemoselektiv, regioselektiv und stereospezifisch zu sein. ⓘ
Einige der Enzyme, die die höchste Spezifität und Genauigkeit aufweisen, sind an der Vervielfältigung und Expression des Genoms beteiligt. Einige dieser Enzyme verfügen über "Korrekturlese"-Mechanismen. Dabei katalysiert ein Enzym wie die DNA-Polymerase in einem ersten Schritt eine Reaktion und überprüft dann in einem zweiten Schritt, ob das Produkt korrekt ist. Dieser zweistufige Prozess führt zu durchschnittlichen Fehlerquoten von weniger als einem Fehler in 100 Millionen Reaktionen bei hochreinen Säugetierpolymerasen. Ähnliche Korrekturlesemechanismen finden sich auch in der RNA-Polymerase, den Aminoacyl-tRNA-Synthetasen und den Ribosomen. ⓘ
Umgekehrt weisen einige Enzyme eine Enzym-Promiskuität auf, d. h. sie haben eine breite Spezifität und wirken auf eine Reihe verschiedener physiologisch relevanter Substrate. Viele Enzyme besitzen kleine Nebenaktivitäten, die zufällig (d. h. neutral) entstanden sind und den Ausgangspunkt für die evolutionäre Selektion einer neuen Funktion bilden können. ⓘ

"Schloss und Schlüssel"-Modell
Um die beobachtete Spezifität von Enzymen zu erklären, schlug Emil Fischer 1894 vor, dass sowohl das Enzym als auch das Substrat spezifische komplementäre geometrische Formen besitzen, die genau ineinander passen. Dieses Modell wird oft als "Schloss und Schlüssel"-Modell bezeichnet. Dieses frühe Modell erklärt zwar die Enzymspezifität, nicht aber die Stabilisierung des Übergangszustands, die Enzyme erreichen. ⓘ
Induziertes Anpassungsmodell
1958 schlug Daniel Koshland eine Abwandlung des Schlüssel-Schloss-Modells vor: Da Enzyme recht flexible Strukturen sind, wird das aktive Zentrum durch Wechselwirkungen mit dem Substrat ständig umgestaltet, wenn das Substrat mit dem Enzym interagiert. Infolgedessen bindet das Substrat nicht einfach an eine starre aktive Stelle; die Aminosäureseitenketten, aus denen die aktive Stelle besteht, werden genau in die Positionen geformt, die es dem Enzym ermöglichen, seine katalytische Funktion zu erfüllen. In einigen Fällen, wie z. B. bei Glykosidasen, verändert das Substratmolekül auch leicht seine Form, wenn es in das aktive Zentrum eintritt. Die aktive Stelle verändert sich so lange, bis das Substrat vollständig gebunden ist; erst dann ist die endgültige Form und Ladungsverteilung festgelegt. Die induzierte Anpassung kann die Zuverlässigkeit der molekularen Erkennung in Gegenwart von Konkurrenz und Rauschen durch den Mechanismus der Konformationskorrektur verbessern. ⓘ
Katalyse
Enzyme können Reaktionen auf verschiedene Weise beschleunigen, die alle die Aktivierungsenergie (ΔG‡, Gibbssche freie Energie) senken
- Durch Stabilisierung des Übergangszustands:
- Schaffung einer Umgebung mit einer Ladungsverteilung, die komplementär zu der des Übergangszustands ist, um dessen Energie zu senken
- Durch Bereitstellung eines alternativen Reaktionsweges:
- Vorübergehende Reaktion mit dem Substrat unter Bildung eines kovalenten Zwischenprodukts, um einen Übergangszustand mit niedrigerer Energie zu schaffen
- Durch Destabilisierung des Grundzustands des Substrats:
- Verformung des/der gebundenen Substrats/Substrate in die Form des Übergangszustands, um die zum Erreichen des Übergangszustands erforderliche Energie zu verringern
- Durch die Ausrichtung der Substrate in einer produktiven Anordnung zur Verringerung der Reaktionsentropieänderung (der Beitrag dieses Mechanismus zur Katalyse ist relativ gering)
Enzyme können mehrere dieser Mechanismen gleichzeitig nutzen. Beispielsweise führen Proteasen wie Trypsin eine kovalente Katalyse mit Hilfe einer katalytischen Triade durch, stabilisieren die Ladungsbildung an den Übergangszuständen mit Hilfe eines Oxyanionenlochs und schließen die Hydrolyse mit Hilfe eines orientierten Wassersubstrats ab. ⓘ
Dynamik
Enzyme sind keine starren, statischen Strukturen, sondern weisen komplexe interne dynamische Bewegungen auf, d. h. Bewegungen von Teilen der Enzymstruktur wie einzelnen Aminosäureresten, Gruppen von Resten, die eine Proteinschleife oder eine Einheit der Sekundärstruktur bilden, oder sogar einer ganzen Proteindomäne. Diese Bewegungen führen zu einem Konformationsensemble aus leicht unterschiedlichen Strukturen, die sich im Gleichgewicht gegenseitig umwandeln. Verschiedene Zustände innerhalb dieses Ensembles können mit verschiedenen Aspekten der Funktion eines Enzyms verbunden sein. So sind beispielsweise verschiedene Konformationen des Enzyms Dihydrofolatreduktase mit den Schritten Substratbindung, Katalyse, Cofaktor-Freisetzung und Produktfreisetzung des katalytischen Zyklus verbunden, was mit der Theorie der katalytischen Resonanz übereinstimmt. ⓘ
Präsentation des Substrats
Die Substratpräsentation ist ein Prozess, bei dem das Enzym von seinem Substrat abgekapselt wird. Enzyme können an die Plasmamembran gebunden werden, weg von einem Substrat im Zellkern oder im Cytosol. Oder innerhalb der Membran kann ein Enzym in Lipid Rafts sequestriert werden, weg von seinem Substrat in der ungeordneten Region. Wenn das Enzym freigesetzt wird, vermischt es sich mit seinem Substrat. Alternativ kann das Enzym in der Nähe seines Substrats sequestriert werden, um das Enzym zu aktivieren. Das Enzym kann zum Beispiel löslich sein und sich bei Aktivierung an ein Lipid in der Plasmamembran binden und dann auf Moleküle in der Plasmamembran einwirken. ⓘ
Allosterische Modulation
Allosterische Stellen sind Taschen auf dem Enzym, die sich von der aktiven Stelle unterscheiden und an Moleküle in der zellulären Umgebung binden. Diese Moleküle bewirken dann eine Änderung der Konformation oder Dynamik des Enzyms, die auf die aktive Stelle übertragen wird und somit die Reaktionsgeschwindigkeit des Enzyms beeinflusst. Auf diese Weise können allosterische Wechselwirkungen Enzyme entweder hemmen oder aktivieren. Allosterische Wechselwirkungen mit Metaboliten, die dem Stoffwechselweg eines Enzyms vor- oder nachgeschaltet sind, bewirken eine Rückkopplungsregulierung, bei der sich die Aktivität des Enzyms entsprechend dem Fluss durch den Rest des Weges ändert. ⓘ
Kofaktoren
Enzyme lassen sich anhand ihres Aufbaus unterscheiden. Während viele Enzyme aus nur einer Polypeptidkette bestehen, so genannte Monomere, bestehen andere Enzyme, die Oligomere, aus mehreren Untereinheiten/Proteinketten. Einige Enzyme lagern sich mit weiteren Enzymen zu sogenannten Multienzymkomplexen zusammen und kooperieren oder regulieren sich gegenseitig. Umgekehrt gibt es auch einzelne Proteinketten, welche mehrere, verschiedene Enzymaktivitäten ausüben können (multifunktionelle Enzyme). Eine weitere mögliche Einteilung hinsichtlich ihres Aufbaus berücksichtigt das Vorhandensein von Kofaktoren:
- Reine Protein-Enzyme bestehen ausschließlich aus Proteinen. Das aktive Zentrum wird nur aus Aminosäureresten und dem Peptidrückgrat gebildet. Zu dieser Gruppe gehören beispielsweise das Verdauungsenzym Chymotrypsin und die Triosephosphatisomerase (TIM) der Glykolyse.
- Holoenzyme (altgr. ὅλος holos „ganz“, „vollständig“ und -enzym) bestehen aus einem Proteinanteil, dem Apoenzym, sowie aus einem Kofaktor, einem niedermolekularen Molekül (kein Protein). Beide zusammen sind für die Funktion des Enzyms wichtig. Organische Moleküle als Kofaktoren werden Koenzyme genannt. Sind sie kovalent an das Apoenzym gebunden, nennt man sie prosthetische Gruppen, andernfalls auch zutreffender Kosubstrat, da sie in äquivalenten Mengen bei der enzymatischen Reaktion mit dem Substrat umgesetzt werden. Kosubstrate sind zum Beispiel Adenosintriphosphat (ATP) und Nicotinamidadenindinukleotid (NAD). ATP wird oft als Energiequelle für die Reaktion von Proteinkinasen genutzt. NAD wird von Enzymen, wie der Alkoholdehydrogenase, als Elektronenakzeptor verwendet. Benötigt ein Enzym Metallionen (Eisen-, Zink- oder Kupferionen), spricht man von einem Metalloenzym. Die Lipoxygenase zum Beispiel enthält Eisen und die Carboanhydrase enthält Zink. ⓘ
Eine spezielle Gruppe bilden die Protein-RNA-Komplexe bzw. Protein-Ribozym-Komplexe, Beispiele hierfür sind die Telomerasen. Auch die Ribosomen sind solche Komplexe. ⓘ
Ein Beispiel für ein Enzym, das einen Cofaktor enthält, ist die Kohlensäureanhydrase, bei der ein Zink-Cofaktor als Teil des aktiven Zentrums gebunden ist. Diese fest gebundenen Ionen oder Moleküle befinden sich normalerweise im aktiven Zentrum und sind an der Katalyse beteiligt. Beispielsweise sind Flavin- und Häm-Cofaktoren häufig an Redoxreaktionen beteiligt. ⓘ
Koenzyme
Coenzyme sind kleine organische Moleküle, die lose oder fest an ein Enzym gebunden sein können. Coenzyme transportieren chemische Gruppen von einem Enzym zum anderen. Beispiele sind NADH, NADPH und Adenosintriphosphat (ATP). Einige Coenzyme, wie Flavinmononukleotid (FMN), Flavin-Adenin-Dinukleotid (FAD), Thiaminpyrophosphat (TPP) und Tetrahydrofolat (THF), werden aus Vitaminen gewonnen. Diese Coenzyme können vom Körper nicht de novo synthetisiert werden, und eng verwandte Verbindungen (Vitamine) müssen über die Nahrung aufgenommen werden. Zu den übertragenen chemischen Gruppen gehören:
- das Hydrid-Ion (H-), das von NAD oder NADP+ getragen wird
- die Phosphatgruppe, die von Adenosintriphosphat getragen wird
- die Acetylgruppe, die vom Coenzym A getragen wird
- die Formyl-, Methenyl- oder Methylgruppen, die von Folsäure getragen werden, und
- die Methylgruppe, die von S-Adenosylmethionin getragen wird ⓘ
Da Coenzyme als Folge der Enzymaktivität chemisch verändert werden, ist es sinnvoll, Coenzyme als eine besondere Klasse von Substraten oder zweiten Substraten zu betrachten, die vielen verschiedenen Enzymen gemeinsam sind. So ist zum Beispiel bekannt, dass etwa 1000 Enzyme das Coenzym NADH verwenden. ⓘ
Coenzyme werden in der Regel kontinuierlich regeneriert und ihre Konzentrationen in der Zelle auf einem konstanten Niveau gehalten. So wird beispielsweise NADPH über den Pentosephosphatweg und S-Adenosylmethionin durch die Methionin-Adenosyltransferase regeneriert. Diese kontinuierliche Regeneration bedeutet, dass kleine Mengen von Coenzymen sehr intensiv genutzt werden können. So setzt der menschliche Körper beispielsweise jeden Tag sein eigenes Gewicht an ATP um. ⓘ
Thermodynamik

Wie alle Katalysatoren verändern Enzyme nicht die Lage des chemischen Gleichgewichts der Reaktion. In Anwesenheit eines Enzyms läuft die Reaktion in der gleichen Richtung ab wie ohne das Enzym, nur schneller. So katalysiert beispielsweise die Kohlensäureanhydrase ihre Reaktion je nach Konzentration der Reaktanten in beide Richtungen:
-
(in Geweben; hohe CO2-Konzentration)
(1) ⓘ
Die Geschwindigkeit einer Reaktion hängt von der Aktivierungsenergie ab, die zur Bildung des Übergangszustands benötigt wird, der dann in Produkte zerfällt. Enzyme erhöhen die Reaktionsgeschwindigkeit, indem sie die Energie des Übergangszustands herabsetzen. Erstens wird durch die Bindung ein Enzym-Substrat-Komplex (ES) mit niedriger Energie gebildet. Zweitens stabilisiert das Enzym den Übergangszustand, so dass er im Vergleich zur unkatalysierten Reaktion weniger Energie erfordert (ES‡). Schließlich dissoziiert der Enzym-Produkt-Komplex (EP) und setzt die Produkte frei. ⓘ
Enzyme können zwei oder mehr Reaktionen koppeln, so dass eine thermodynamisch günstige Reaktion dazu verwendet werden kann, eine thermodynamisch ungünstige Reaktion "anzutreiben", so dass die kombinierte Energie der Produkte niedriger ist als die der Substrate. So wird zum Beispiel die Hydrolyse von ATP häufig als Antrieb für andere chemische Reaktionen genutzt. ⓘ
Kinetik
In der Enzymkinetik wird untersucht, wie Enzyme Substrate binden und in Produkte umwandeln. Die in kinetischen Analysen verwendeten Geschwindigkeitsdaten werden in der Regel aus Enzymtests gewonnen. Im Jahr 1913 schlugen Leonor Michaelis und Maud Leonora Menten eine quantitative Theorie der Enzymkinetik vor, die als Michaelis-Menten-Kinetik bezeichnet wird. Der wichtigste Beitrag von Michaelis und Menten bestand darin, dass sie die Enzymreaktionen in zwei Stufen betrachteten. In der ersten Phase bindet das Substrat reversibel an das Enzym und bildet den Enzym-Substrat-Komplex. Dieser Komplex wird ihnen zu Ehren manchmal als Michaelis-Menten-Komplex bezeichnet. Das Enzym katalysiert dann den chemischen Schritt der Reaktion und setzt das Produkt frei. Diese Arbeit wurde von G. E. Briggs und J. B. S. Haldane weiterentwickelt, die kinetische Gleichungen ableiteten, die auch heute noch weit verbreitet sind. ⓘ
Die Geschwindigkeit eines Enzyms hängt von den Lösungsbedingungen und der Substratkonzentration ab. Um die maximale Geschwindigkeit einer enzymatischen Reaktion zu ermitteln, wird die Substratkonzentration so lange erhöht, bis eine konstante Rate der Produktbildung erreicht ist. Dies ist in der Sättigungskurve auf der rechten Seite dargestellt. Die Sättigung tritt ein, weil mit steigender Substratkonzentration immer mehr des freien Enzyms in den substratgebundenen ES-Komplex umgewandelt wird. Bei der maximalen Reaktionsgeschwindigkeit (Vmax) des Enzyms sind alle aktiven Stellen des Enzyms an das Substrat gebunden, und die Menge des ES-Komplexes ist gleich der Gesamtmenge des Enzyms. ⓘ
Vmax ist nur einer von mehreren wichtigen kinetischen Parametern. Die Menge des Substrats, die benötigt wird, um eine bestimmte Reaktionsgeschwindigkeit zu erreichen, ist ebenfalls wichtig. Diese wird durch die Michaelis-Menten-Konstante (Km) angegeben, d. h. die Substratkonzentration, die ein Enzym benötigt, um die Hälfte seiner maximalen Reaktionsgeschwindigkeit zu erreichen; im Allgemeinen hat jedes Enzym eine charakteristische KM für ein bestimmtes Substrat. Eine weitere nützliche Konstante ist kcat, auch Umsatzzahl genannt, die die Anzahl der Substratmoleküle angibt, die von einer aktiven Stelle pro Sekunde verarbeitet werden. ⓘ
Die Effizienz eines Enzyms kann als kcat/Km ausgedrückt werden. Diese wird auch als Spezifitätskonstante bezeichnet und umfasst die Geschwindigkeitskonstanten für alle Reaktionsschritte bis einschließlich des ersten irreversiblen Schritts. Da die Spezifitätskonstante sowohl die Affinität als auch die katalytische Fähigkeit widerspiegelt, ist sie nützlich für den Vergleich verschiedener Enzyme untereinander oder desselben Enzyms mit verschiedenen Substraten. Der theoretische Höchstwert für die Spezifitätskonstante wird als Diffusionsgrenze bezeichnet und liegt bei etwa 108 bis 109 (M-1 s-1). An diesem Punkt führt jeder Zusammenstoß des Enzyms mit seinem Substrat zur Katalyse, und die Geschwindigkeit der Produktbildung wird nicht durch die Reaktionsgeschwindigkeit, sondern durch die Diffusionsgeschwindigkeit begrenzt. Enzyme mit dieser Eigenschaft werden als katalytisch perfekt oder kinetisch perfekt bezeichnet. Beispiele für solche Enzyme sind Triose-Phosphat-Isomerase, Kohlensäureanhydrase, Acetylcholinesterase, Katalase, Fumarase, β-Lactamase und Superoxid-Dismutase. Der Umsatz solcher Enzyme kann mehrere Millionen Reaktionen pro Sekunde erreichen. Die meisten Enzyme sind jedoch bei weitem nicht perfekt: Die Durchschnittswerte von und liegen bei etwa und . ⓘ
Die Michaelis-Menten-Kinetik beruht auf dem Massenwirkungsgesetz, das von den Annahmen der freien Diffusion und der thermodynamisch bedingten zufälligen Kollision abgeleitet ist. Viele biochemische oder zelluläre Prozesse weichen aufgrund von makromolekularem Gedränge und eingeschränkter Molekularbewegung erheblich von diesen Bedingungen ab. Neuere, komplexe Erweiterungen des Modells versuchen, diese Effekte zu korrigieren. ⓘ

Hemmung
Die Reaktionsgeschwindigkeit von Enzymen kann durch verschiedene Arten von Enzyminhibitoren verringert werden. ⓘ
Arten der Hemmung
Kompetitiv
Ein kompetitiver Inhibitor und ein Substrat können nicht gleichzeitig an das Enzym binden. Oft ähneln kompetitive Inhibitoren stark dem eigentlichen Substrat des Enzyms. So ist beispielsweise das Medikament Methotrexat ein kompetitiver Hemmstoff des Enzyms Dihydrofolatreduktase, das die Reduktion von Dihydrofolat zu Tetrahydrofolat katalysiert. Die Ähnlichkeit zwischen den Strukturen von Dihydrofolat und diesem Medikament ist in der nebenstehenden Abbildung dargestellt. Diese Art der Hemmung kann durch eine hohe Substratkonzentration überwunden werden. In einigen Fällen kann der Inhibitor an eine andere Stelle als die Bindungsstelle des üblichen Substrats binden und eine allosterische Wirkung ausüben, um die Form der üblichen Bindungsstelle zu verändern. ⓘ
Nicht-kompetitiv
Ein nicht-kompetitiver Inhibitor bindet an eine andere Stelle als das Substrat. Das Substrat bindet weiterhin mit seiner üblichen Affinität, so dass Km gleich bleibt. Der Inhibitor verringert jedoch die katalytische Effizienz des Enzyms, so dass Vmax reduziert wird. Im Gegensatz zur kompetitiven Hemmung kann die nicht-kompetitive Hemmung nicht durch eine hohe Substratkonzentration überwunden werden. ⓘ
Unkompetitiv
Ein nicht-kompetitiver Inhibitor kann sich nicht an das freie Enzym binden, sondern nur an den Enzym-Substrat-Komplex; daher sind diese Arten von Inhibitoren bei hohen Substratkonzentrationen am wirksamsten. In Gegenwart des Inhibitors ist der Enzym-Substrat-Komplex inaktiv. Diese Art der Hemmung ist selten. ⓘ
Gemischt
Ein gemischter Inhibitor bindet sich an eine allosterische Stelle, und die Bindung des Substrats und des Inhibitors beeinflussen sich gegenseitig. Die Funktion des Enzyms wird durch die Bindung an den Inhibitor eingeschränkt, aber nicht aufgehoben. Diese Art von Inhibitor folgt nicht der Michaelis-Menten-Gleichung. ⓘ
Irreversibel
Ein irreversibler Hemmstoff inaktiviert das Enzym dauerhaft, indem er in der Regel eine kovalente Bindung an das Protein eingeht. Penicillin und Aspirin sind gängige Medikamente, die auf diese Weise wirken. ⓘ
Funktionen von Inhibitoren
In vielen Organismen können Inhibitoren als Teil eines Rückkopplungsmechanismus wirken. Wenn ein Enzym zu viel von einer Substanz im Organismus produziert, kann diese Substanz als Hemmstoff für das Enzym am Anfang des Produktionsweges wirken, wodurch die Produktion der Substanz verlangsamt oder gestoppt wird, wenn eine ausreichende Menge vorhanden ist. Dies ist eine Form der negativen Rückkopplung. Wichtige Stoffwechselwege wie der Zitronensäurezyklus machen von diesem Mechanismus Gebrauch. ⓘ
Da Inhibitoren die Funktion von Enzymen modulieren, werden sie häufig als Arzneimittel eingesetzt. Bei vielen dieser Medikamente handelt es sich um reversible kompetitive Inhibitoren, die dem nativen Substrat des Enzyms ähneln, wie z. B. Methotrexat (s. o.); andere bekannte Beispiele sind Statine, die zur Behandlung von hohem Cholesterinspiegel eingesetzt werden, und Proteaseinhibitoren, die zur Behandlung retroviraler Infektionen wie HIV verwendet werden. Ein bekanntes Beispiel für einen irreversiblen Inhibitor, der als Medikament eingesetzt wird, ist Aspirin, das die Enzyme COX-1 und COX-2 hemmt, die den Entzündungsbotenstoff Prostaglandin produzieren. Andere Enzyminhibitoren sind Gifte. Das Gift Cyanid beispielsweise ist ein irreversibler Enzyminhibitor, der sich mit dem Kupfer und Eisen im aktiven Zentrum des Enzyms Cytochrom c-Oxidase verbindet und die Zellatmung blockiert. ⓘ
Faktoren, die die Enzymaktivität beeinflussen
Da Enzyme aus Proteinen bestehen, reagieren sie empfindlich auf Veränderungen vieler physikalisch-chemischer Faktoren wie pH-Wert, Temperatur, Substratkonzentration usw. ⓘ
In der folgenden Tabelle sind die optimalen pH-Werte für verschiedene Enzyme aufgeführt. ⓘ
| Enzym | Optimaler pH-Wert | pH-Beschreibung ⓘ |
|---|---|---|
| Pepsin | 1.5–1.6 | Stark sauer |
| Invertase | 4.5 | Säuerlich |
| Lipase (Magen) | 4.0–5.0 | Säuerlich |
| Lipase (Rizinusöl) | 4.7 | Säuerlich |
| Lipase (Bauchspeicheldrüse) | 8.0 | Alkalisch |
| Amylase (Malz) | 4.6–5.2 | Säuerlich |
| Amylase (Bauchspeicheldrüse) | 6.7–7.0 | Saure-neutrale |
| Zellobiase | 5.0 | Säuerlich |
| Maltase | 6.1–6.8 | Säuerlich |
| Sucrase | 6.2 | Säuerlich |
| Katalase | 7.0 | Neutral |
| Urease | 7.0 | Neutral |
| Cholinesterase | 7.0 | Neutral |
| Ribonuklease | 7.0–7.5 | Neutral |
| Fumarase | 7.8 | Alkalisch |
| Trypsin | 7.8–8.7 | Alkalisch |
| Adenosintriphosphat | 9.0 | Alkalisch |
| Arginase | 10.0 | Hochgradig alkalisch |
Biologische Funktion
Enzyme haben eine hohe biologische Bedeutung, sie spielen die zentrale Rolle im Stoffwechsel aller lebenden Organismen. Nahezu jede biochemische Reaktion wird von Enzymen bewerkstelligt und kontrolliert. Bekannte Beispiele sind Glycolyse und Citrat-Zyklus, Atmungskette und Photosynthese, Transkription und Translation sowie die DNA-Replikation. Enzyme wirken nicht nur als Katalysatoren, sie sind auch wichtige Regulations- und Kontrollpunkte im Stoffwechselgeschehen. ⓘ
Die Bedeutung der Enzyme beschränkt sich jedoch nicht auf den Stoffwechsel, auch bei der Reizaufnahme und -weitergabe sind sie wichtig. An der Signaltransduktion, also der Vermittlung einer Information innerhalb einer Zelle, sind häufig Rezeptoren mit enzymatischer Funktion beteiligt. Auch Kinasen, wie die Tyrosinkinasen und Phosphatasen spielen bei der Weitergabe von Signalen eine entscheidende Rolle. Die Aktivierung und Deaktivierung der Träger der Information, also der Hormone, geschehen durch Enzyme. ⓘ
Weiterhin sind Enzyme an der Verteidigung des eigenen Organismus beteiligt, so sind zum Beispiel diverse Enzyme wie die Serinproteasen des Komplementsystems Teil des unspezifischen Immunsystems des Menschen. ⓘ
Fehler in Enzymen können fatale Folgen haben. Durch solche Enzymdefekte ist die Aktivität eines Enzyms vermindert oder gar nicht mehr vorhanden. Manche Enzymdefekte werden genetisch vererbt, d. h., das Gen, das die Aminosäuresequenz des entsprechenden Enzyms codiert, enthält eine oder mehrere Mutationen oder fehlt ganz. Beispiele für vererbbare Enzymdefekte sind die Phenylketonurie und Galaktosämie. ⓘ
Artifizielle Enzyme (beispielsweise in Brotteig, die beim Backvorgang nicht denaturiert werden) bergen das Risiko, Allergien auszulösen ⓘ
Enzyme erfüllen in lebenden Organismen eine Vielzahl von Funktionen. Sie sind unverzichtbar für die Signalübertragung und die Zellregulierung, häufig über Kinasen und Phosphatasen. Sie sorgen auch für Bewegung, wobei Myosin ATP hydrolysiert, um eine Muskelkontraktion zu erzeugen, und transportieren als Teil des Zytoskeletts Ladungen in der Zelle. Andere ATPasen in der Zellmembran sind Ionenpumpen, die am aktiven Transport beteiligt sind. Enzyme sind auch an exotischeren Funktionen beteiligt, wie die Luziferase, die in Glühwürmchen Licht erzeugt. Viren können auch Enzyme für die Infektion von Zellen enthalten, wie die HIV-Integrase und die reverse Transkriptase, oder für die Freisetzung von Viren aus Zellen, wie die Neuraminidase des Influenzavirus. ⓘ
Eine wichtige Funktion von Enzymen ist die des Verdauungssystems von Tieren. Enzyme wie Amylasen und Proteasen spalten große Moleküle (Stärke bzw. Proteine) in kleinere Moleküle auf, damit sie vom Darm aufgenommen werden können. Stärkemoleküle zum Beispiel sind zu groß, um vom Darm absorbiert zu werden, aber Enzyme hydrolysieren die Stärkeketten in kleinere Moleküle wie Maltose und schließlich Glukose, die dann absorbiert werden können. Verschiedene Enzyme verdauen unterschiedliche Nahrungsbestandteile. Bei Wiederkäuern, die sich pflanzenfressend ernähren, produzieren Mikroorganismen im Darm ein weiteres Enzym, die Cellulase, um die Zellulose-Zellwände der Pflanzenfasern aufzuspalten. ⓘ
Stoffwechsel
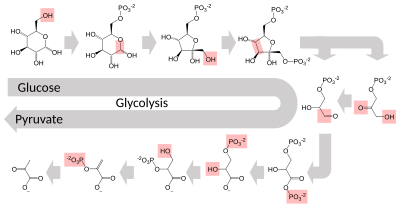
Mehrere Enzyme können in einer bestimmten Reihenfolge zusammenarbeiten und so Stoffwechselwege bilden. In einem Stoffwechselweg nimmt ein Enzym das Produkt eines anderen Enzyms als Substrat auf. Nach der katalytischen Reaktion wird das Produkt dann an ein anderes Enzym weitergegeben. Manchmal können mehrere Enzyme dieselbe Reaktion parallel katalysieren; dies kann eine komplexere Regulierung ermöglichen: zum Beispiel mit einer niedrigen konstanten Aktivität durch ein Enzym, aber einer induzierbaren hohen Aktivität durch ein zweites Enzym. ⓘ
Enzyme bestimmen, welche Schritte in diesen Stoffwechselwegen ablaufen. Ohne Enzyme würde der Stoffwechsel nicht in denselben Schritten ablaufen und könnte nicht entsprechend den Bedürfnissen der Zelle reguliert werden. Die meisten zentralen Stoffwechselwege werden in einigen wenigen Schlüsselschritten reguliert, in der Regel durch Enzyme, deren Aktivität die Hydrolyse von ATP beinhaltet. Da bei dieser Reaktion so viel Energie freigesetzt wird, können andere Reaktionen, die thermodynamisch ungünstig sind, an die ATP-Hydrolyse gekoppelt werden, wodurch die gesamte Reihe der miteinander verbundenen Stoffwechselreaktionen angetrieben wird. ⓘ
Kontrolle der Aktivität
Als langfristige Reaktion auf geänderte Anforderungen an den Stoffwechsel werden Enzyme gezielt abgebaut oder neugebildet. Die Neubildung von Enzymen wird über die Expression ihrer Gene gesteuert. Eine solche Art der genetischen Regulation bei Bakterien beschreibt das Operon-Modell von Jacob und Monod. Der kontrollierte Abbau von Enzymen in eukaryotischen Zellen kann durch Ubiquitinierung realisiert werden. Das Anheften von Polyubiquitin-Ketten an Enzyme, katalysiert durch spezifische Ubiquitin-Ligasen, markiert diese für den Abbau im Proteasom, einem „Müllschlucker“ der Zelle. ⓘ
Die Enzymaktivität wird in der Zelle im Wesentlichen auf fünf Arten gesteuert. ⓘ
Regulierung
Enzyme können entweder durch andere Moleküle aktiviert oder gehemmt werden. So sind beispielsweise die Endprodukte eines Stoffwechselwegs häufig Hemmstoffe für eines der ersten Enzyme des Wegs (in der Regel der erste irreversible Schritt, der so genannte "committed step"), wodurch die Menge des durch den Weg gebildeten Endprodukts reguliert wird. Ein solcher Regulierungsmechanismus wird als negativer Rückkopplungsmechanismus bezeichnet, da die Menge des erzeugten Endprodukts durch seine eigene Konzentration reguliert wird. Der Mechanismus der negativen Rückkopplung kann die Syntheserate von Intermediärmetaboliten effektiv an den Bedarf der Zellen anpassen. Dies hilft bei der effektiven Zuteilung von Materialien und der Energieeinsparung und verhindert die übermäßige Herstellung von Endprodukten. Wie andere homöostatische Mechanismen trägt auch die Kontrolle der Enzymaktivität zur Aufrechterhaltung eines stabilen internen Milieus in lebenden Organismen bei. ⓘ
Posttranslationale Modifikation
Beispiele für posttranslationale Modifikationen sind Phosphorylierung, Myristoylierung und Glykosylierung. Bei der Reaktion auf Insulin beispielsweise trägt die Phosphorylierung mehrerer Enzyme, einschließlich der Glykogensynthase, dazu bei, die Synthese oder den Abbau von Glykogen zu steuern, und ermöglicht es der Zelle, auf Veränderungen des Blutzuckerspiegels zu reagieren. Ein weiteres Beispiel für eine posttranslationale Modifikation ist die Spaltung der Polypeptidkette. Chymotrypsin, eine verdauungsfördernde Protease, wird in der Bauchspeicheldrüse in inaktiver Form als Chymotrypsinogen produziert und in dieser Form in den Magen transportiert, wo es aktiviert wird. Dadurch wird verhindert, dass das Enzym die Bauchspeicheldrüse oder andere Gewebe verdaut, bevor es in den Darm gelangt. Diese Art von inaktivem Vorläufer eines Enzyms wird als Zymogen oder Proenzym bezeichnet. ⓘ
Menge
Die Enzymproduktion (Transkription und Translation von Enzymgenen) kann von einer Zelle als Reaktion auf Veränderungen in der Zellumgebung verstärkt oder vermindert werden. Diese Form der Genregulation wird als Enzyminduktion bezeichnet. So können Bakterien beispielsweise gegen Antibiotika wie Penicillin resistent werden, weil Enzyme, so genannte Beta-Lactamasen, induziert werden, die den entscheidenden Beta-Lactam-Ring im Penicillin-Molekül hydrolysieren. Ein weiteres Beispiel sind Enzyme in der Leber, die so genannten Cytochrom-P450-Oxidasen, die für den Arzneimittelstoffwechsel wichtig sind. Die Induktion oder Hemmung dieser Enzyme kann zu Wechselwirkungen zwischen Arzneimitteln führen. Der Enzymspiegel kann auch durch Änderung der Abbaurate des Enzyms reguliert werden. Das Gegenteil der Enzyminduktion ist die Enzymunterdrückung. ⓘ
Subzelluläre Verteilung
Enzyme können kompartimentiert werden, wobei verschiedene Stoffwechselwege in verschiedenen zellulären Kompartimenten ablaufen. So werden beispielsweise Fettsäuren von einer Reihe von Enzymen im Zytosol, im endoplasmatischen Retikulum und in den Golgi synthetisiert und von einer anderen Reihe von Enzymen im Mitochondrium durch β-Oxidation als Energiequelle genutzt. Darüber hinaus kann der Transport des Enzyms in verschiedene Kompartimente den Grad der Protonierung (z. B. das neutrale Zytoplasma und das saure Lysosom) oder den Oxidationszustand (z. B. oxidierendes Periplasma oder reduzierendes Zytoplasma) verändern, was wiederum die Enzymaktivität beeinflusst. Im Gegensatz zur Aufteilung in membrangebundene Organellen kann die subzelluläre Lokalisierung von Enzymen auch durch Polymerisation von Enzymen in makromolekulare zytoplasmatische Filamente verändert werden. ⓘ
Organische Spezialisierung
In multizellulären Eukaryonten weisen Zellen in verschiedenen Organen und Geweben unterschiedliche Muster der Genexpression auf und verfügen daher über unterschiedliche Enzymsätze (so genannte Isoenzyme), die für Stoffwechselreaktionen zur Verfügung stehen. Dies bietet einen Mechanismus zur Regulierung des gesamten Stoffwechsels des Organismus. So gibt es beispielsweise von Hexokinase, dem ersten Enzym des Glykolyse-Wegs, eine spezialisierte Form namens Glucokinase, die in der Leber und der Bauchspeicheldrüse exprimiert wird und eine geringere Affinität für Glukose hat, aber empfindlicher auf die Glukosekonzentration reagiert. Dieses Enzym ist an der Erkennung des Blutzuckerspiegels und der Regulierung der Insulinproduktion beteiligt. ⓘ
Beteiligung an Krankheiten
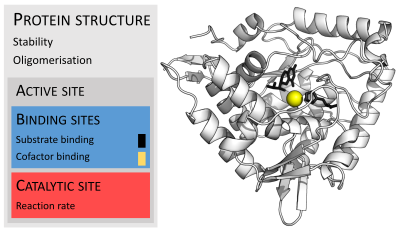

Da die strenge Kontrolle der Enzymaktivität für die Homöostase unerlässlich ist, kann jede Fehlfunktion (Mutation, Überproduktion, Unterproduktion oder Deletion) eines einzigen kritischen Enzyms zu einer genetischen Krankheit führen. Die Fehlfunktion eines einzigen Enzymtyps unter den Tausenden von Enzymtypen, die es im menschlichen Körper gibt, kann tödlich sein. Ein Beispiel für eine tödliche Erbkrankheit aufgrund von Enzymmangel ist die Tay-Sachs-Krankheit, bei der den Patienten das Enzym Hexosaminidase fehlt. ⓘ
Ein Beispiel für einen Enzymmangel ist die häufigste Form der Phenylketonurie. Viele verschiedene Mutationen einzelner Aminosäuren im Enzym Phenylalaninhydroxylase, das den ersten Schritt beim Abbau von Phenylalanin katalysiert, führen zu einer Anhäufung von Phenylalanin und verwandten Produkten. Einige Mutationen befinden sich im aktiven Zentrum und stören direkt die Bindung und Katalyse, aber viele Mutationen sind weit vom aktiven Zentrum entfernt und verringern die Aktivität durch Destabilisierung der Proteinstruktur oder durch Beeinträchtigung der korrekten Oligomerisierung. Dies kann zu geistiger Behinderung führen, wenn die Krankheit unbehandelt bleibt. Ein weiteres Beispiel ist der Pseudocholinesterase-Mangel, bei dem die Fähigkeit des Körpers, Cholinester-Medikamente abzubauen, beeinträchtigt ist. Die orale Verabreichung von Enzymen kann zur Behandlung einiger funktioneller Enzymmängel eingesetzt werden, z. B. bei Pankreasinsuffizienz und Laktoseintoleranz. ⓘ
Eine weitere Möglichkeit, wie Fehlfunktionen von Enzymen Krankheiten verursachen können, sind Keimbahnmutationen in Genen, die für DNA-Reparaturenzyme kodieren. Defekte in diesen Enzymen verursachen Krebs, da die Zellen weniger in der Lage sind, Mutationen in ihrem Genom zu reparieren. Dies führt zu einer langsamen Anhäufung von Mutationen und damit zur Entstehung von Krebs. Ein Beispiel für ein solches erbliches Krebssyndrom ist Xeroderma pigmentosum, bei dem sich schon bei minimaler Exposition gegenüber ultraviolettem Licht Hautkrebs entwickelt. ⓘ
Entwicklung
Wie jedes andere Protein verändern sich auch Enzyme im Laufe der Zeit durch Mutationen und Sequenzdivergenz. Angesichts ihrer zentralen Rolle im Stoffwechsel spielt die Evolution von Enzymen eine entscheidende Rolle bei der Anpassung. Eine Schlüsselfrage ist daher, ob und wie Enzyme ihre enzymatischen Aktivitäten parallel dazu verändern können. Es wird allgemein angenommen, dass sich viele neue Enzymaktivitäten durch Genduplikation und Mutation der Duplikate entwickelt haben, obwohl die Evolution auch ohne Duplikation stattfinden kann. Ein Beispiel für ein Enzym, das seine Aktivität verändert hat, ist der Vorfahre der Methionyl-Aminopeptidase (MAP) und der Kreatin-Amidinohydrolase (Kreatinase), die eindeutig homolog sind, aber sehr unterschiedliche Reaktionen katalysieren (MAP entfernt das aminoterminale Methionin in neuen Proteinen, während Kreatinase Kreatin zu Sarkosin und Harnstoff hydrolysiert). Darüber hinaus ist MAP von Metallionen abhängig, während Creatinase dies nicht ist, so dass auch diese Eigenschaft im Laufe der Zeit verloren ging. Kleine Änderungen der enzymatischen Aktivität sind bei Enzymen sehr häufig. Insbesondere die Substratbindungsspezifität (siehe oben) kann sich leicht und schnell ändern, wenn nur eine einzige Aminosäure in der Substratbindungstasche verändert wird. Dies ist bei den wichtigsten Enzymklassen, wie z. B. Kinasen, häufig der Fall. ⓘ
Die künstliche (in vitro) Evolution wird heute häufig eingesetzt, um die Aktivität oder Spezifität von Enzymen für industrielle Anwendungen zu verändern (siehe unten). ⓘ
Industrielle Anwendungen
Enzyme werden in der chemischen Industrie und anderen industriellen Anwendungen eingesetzt, wenn extrem spezifische Katalysatoren benötigt werden. Enzyme sind im Allgemeinen in der Anzahl der Reaktionen, die sie katalysieren können, und durch ihre mangelnde Stabilität in organischen Lösungsmitteln und bei hohen Temperaturen begrenzt. Infolgedessen ist das Protein-Engineering ein aktiver Forschungsbereich, in dem versucht wird, neue Enzyme mit neuartigen Eigenschaften zu schaffen, entweder durch rationales Design oder durch In-vitro-Evolution. Diese Bemühungen sind inzwischen erfolgreich, und einige Enzyme wurden "von Grund auf" so konzipiert, dass sie Reaktionen katalysieren, die in der Natur nicht vorkommen. ⓘ
| Anwendung | Verwendete Enzyme | Verwendungen ⓘ |
|---|---|---|
| Biokraftstoff-Industrie | Zellulasen | Zerlegen Zellulose in Zucker, der zur Herstellung von Zellulose-Ethanol vergoren werden kann. |
| Ligninasen | Vorbehandlung von Biomasse für die Biokraftstoffproduktion. | |
| Biologisches Detergenz | Proteasen, Amylasen, Lipasen | Entfernen Proteine, Stärke und Fett- oder Ölflecken aus Wäsche und Geschirr. |
| Mannanasen | Entfernen Lebensmittelflecken aus dem üblichen Lebensmittelzusatzstoff Guarkernmehl. | |
| Brauerei-Industrie | Amylase, Glucanasen, Proteasen | Spaltung von Polysacchariden und Proteinen im Malz. |
| Betaglucanasen | Verbesserung der Würze- und Bierfiltrationseigenschaften. | |
| Amyloglucosidase und Pullulanasen | Herstellung von kalorienarmem Bier und Einstellung der Gärfähigkeit. | |
| Acetolactat-Decarboxylase (ALDC) | Erhöht die Effizienz der Gärung durch Verringerung der Diacetylbildung. | |
| Kulinarische Verwendungen | Papain | Zartmachen von Fleisch zum Kochen. |
| Molkereiindustrie | Rennin | Hydrolyse von Proteinen bei der Herstellung von Käse. |
| Lipasen | Herstellung von Camembert-Käse und Blauschimmelkäse wie Roquefort. | |
| Verarbeitung von Lebensmitteln | Amylasen | Erzeugen Zucker aus Stärke, z. B. bei der Herstellung von Maissirup mit hohem Fruktosegehalt. |
| Proteasen | Senken den Proteingehalt von Mehl, z. B. bei der Herstellung von Keksen. | |
| Trypsin | Stellen hypoallergene Babynahrung her. | |
| Cellulasen, Pektinasen | Klären Fruchtsäfte. | |
| Molekularbiologie | Nukleasen, DNA-Ligasen und Polymerasen | Restriktionsverdau und Polymerase-Kettenreaktion zur Herstellung rekombinanter DNS verwenden. |
| Papierindustrie | Xylanasen, Hemicellulasen und Ligninperoxidasen | Entfernen Lignin aus Kraftzellstoff. |
| Körperpflege | Proteasen | Entfernen Proteine auf Kontaktlinsen, um Infektionen zu verhindern. |
| Stärkeindustrie | Amylasen | Umwandlung von Stärke in Glukose und verschiedene Sirupe. |
Die folgende Tabelle gibt einen Überblick über die Einsatzgebiete von Enzymen. Zur Herstellung siehe Protein. ⓘ
| technischer Prozess | Enzyme | Wirkung ⓘ |
|---|---|---|
| Stärkeverarbeitung | α-Amylase, Glucoamylase | Stärkehydrolyse |
| Racematspaltung | L-Acylase | Herstellung von Aminosäuren |
| Waschmittel | Proteasen, Lipasen | Hydrolyse von Eiweißen, Fetten |
| Käseproduktion | Proteasen | Milchgerinnung |
| Brennerei-Produkte | α-Amylase, Glucoamylase | Stärkeverzuckerung |
| Brauereiindustrie | α-Amylase, Glucoamylase, Proteasen | Maischprozess |
| Fruchtsaftverarbeitung | Pektinasen, α-Amylase | Hydrolyse der Pektine bzw. von Stärke |
| Backwarenherstellung | α-Amylase, Proteasen, Pentosanase | teilweise Hydrolyse von Mehl- und Teiginhaltsstoffen |
| Lederverarbeitung | Proteasen | Weichen, Enthaaren von Leder |
| Textilindustrie | α-Amylase | Stärkehydrolyse, Entschlichten |
Enzymkinetik
Die Enzymkinetik beschäftigt sich mit dem zeitlichen Verlauf enzymatischer Reaktionen. Eine zentrale Größe hierbei ist die Reaktionsgeschwindigkeit. Sie ist ein Maß für die Änderung der Substratkonzentration mit der Zeit, also für die Stoffmenge Substrat, die in einem bestimmten Reaktionsvolumen pro Zeiteinheit umgesetzt wird (Einheit: mol/(l·s)). Neben den Reaktionsbedingungen wie Temperatur, Salzkonzentration und pH-Wert der Lösung hängt sie von den Konzentrationen des Enzyms, der Substrate und Produkte sowie von Effektoren (Aktivatoren oder Inhibitoren) ab. ⓘ
Im Zusammenhang mit der Reaktionsgeschwindigkeit steht die Enzymaktivität. Sie gibt an, wie viel aktives Enzym sich in einer Enzym-Präparation befindet. Die Einheiten der Enzymaktivität sind Unit (U) und Katal (kat), wobei 1 U definiert ist als diejenige Menge Enzym, welche unter angegebenen Bedingungen ein Mikromol Substrat pro Minute umsetzt: 1 U = 1 µmol/min. Katal wird selten benutzt, ist jedoch die SI-Einheit der Enzymaktivität: 1 kat = 1 mol/s. Eine weitere wichtige Messgröße bei Enzymen ist die spezifische Aktivität (Aktivität pro Masseneinheit, U/mg). Daran kann man sehen, wie viel von dem gesamten Protein in der Lösung wirklich das gesuchte Enzym ist. ⓘ
Die gemessene Enzymaktivität ist proportional zur Reaktionsgeschwindigkeit und damit stark von den Reaktionsbedingungen abhängig. Sie steigt mit der Temperatur entsprechend der RGT-Regel an: eine Erhöhung der Temperatur um ca. 5–10 °C führt zu einer Verdoppelung der Reaktionsgeschwindigkeit und damit auch der Aktivität. Dies gilt jedoch nur für einen begrenzten Temperaturbereich. Bei Überschreiten einer optimalen Temperatur kommt es zu einem steilen Abfallen der Aktivität durch Denaturierung des Enzyms. Änderungen im pH-Wert der Lösung haben oft dramatische Effekte auf die Enzymaktivität, da dieser die Ladung einzelner für die Katalyse wichtiger Aminosäuren im Enzym beeinflussen kann. Jenseits des pH-Optimums vermindert sich die Enzymaktivität und kommt irgendwann zum Erliegen. Ähnliches gilt für die Salzkonzentration bzw. die Ionenstärke in der Umgebung. ⓘ
Kooperativität und Allosterie
Einige Enzyme zeigen nicht die hyperbolische Sättigungskurve, wie sie die Michaelis-Menten-Theorie vorhersagt, sondern ein sigmoides Sättigungsverhalten. So etwas wurde erstmals bei Bindeproteinen wie dem Hämoglobin beschrieben und wird als positive Kooperativität mehrerer Bindungsstellen gedeutet: die Bindung eines Liganden (Substratmolekül) beeinflusst weitere Bindungsstellen im gleichen Enzym (oft aber in anderen Untereinheiten) in ihrer Affinität. Bei positiver Kooperativität hat ein Bindeprotein mit vielen freien Bindungsstellen eine schwächere Affinität als ein größtenteils besetztes Protein. Bindet derselbe Ligand an alle Bindungszentren, spricht man von einem homotropen Effekt. Die Kooperativität ist bei Enzymen eng mit der Allosterie verknüpft. Unter Allosterie versteht man das Vorhandensein weiterer Bindungsstellen (allosterischen Zentren) in einem Enzym, abgesehen vom aktiven Zentrum. Binden Effektoren (nicht Substratmoleküle) an allosterische Zentren, liegt ein heterotroper Effekt vor. Die Allosterie ist zwar begrifflich von der Kooperativität zu unterscheiden, dennoch treten sie oft gemeinsam auf. ⓘ
Regulation und Kontrolle der Enzymaktivität im Organismus
Enzyme wirken im lebenden Organismus in einem komplexen Geflecht von Stoffwechselwegen zusammen. Um sich schwankenden inneren und äußeren Bedingungen optimal anpassen zu können, ist eine feine Regulation und Kontrolle des Stoffwechsels und der zugrundeliegenden Enzyme nötig. Unter Regulation versteht man Vorgänge, die der Aufrechterhaltung stabiler innerer Bedingungen bei wechselnden Umweltbedingungen (Homöostase) dienen. Als Kontrolle bezeichnet man Veränderungen, die auf Grund von externen Signalen (beispielsweise durch Hormone) stattfinden. Es gibt schnelle/kurzfristige, mittelfristige sowie langsame/langfristige Regulations- und Kontrollvorgänge im Stoffwechsel: ⓘ
Mittelfristige Anpassung
Eine häufige Form der Stoffwechselkontrolle ist die kovalente Modifikation von Enzymen, besonders die Phosphorylierung. Wie durch einen molekularen Schalter kann das Enzym beispielsweise nach einem hormonellen Signal durch phosphat-übertragende Enzyme (Kinasen) ein- oder ausgeschaltet werden. Die Einführung einer negativ geladenen Phosphatgruppe zieht strukturelle Änderungen im Enzym nach sich und kann prinzipiell sowohl aktive als auch inaktive Konformationen begünstigen. Die Abspaltung der Phosphatgruppe durch Phosphatasen kehrt diesen Vorgang um, so dass eine flexible Anpassung des Stoffwechsels an wechselnde physiologische Anforderungen möglich ist. ⓘ
Verwendung und Auftreten im Alltag
Enzyme sind wertvolle Werkzeuge der Biotechnologie. Ihre Einsatzmöglichkeiten reichen von der Käseherstellung (Labferment) über die Enzymatik bis hin zur Gentechnik. Für bestimmte Anwendungen entwickeln Wissenschaftler heute gezielt leistungsfähigere Enzyme durch Protein-Engineering. Zudem konstruierte man eine neuartige Form katalytisch aktiver Proteine, die katalytischen Antikörper, die aufgrund ihrer Ähnlichkeit zu den Enzymen Abzyme genannt wurden. Auch Ribonukleinsäuren (RNA) können katalytisch aktiv sein; diese werden dann als Ribozyme bezeichnet. ⓘ
Enzyme werden unter anderem in der Industrie benötigt. Waschmitteln und Geschirrspülmitteln fügt man Lipasen (Fett spaltende Enzyme), Proteasen (Eiweiß spaltende Enzyme) und Amylasen (Stärke spaltende Enzyme) zur Erhöhung der Reinigungsleistung hinzu, weil diese Enzyme die entsprechenden Flecken in Kleidung oder Speisereste am Geschirr zersetzen. ⓘ
Enzyme werden auch zur Herstellung einiger Medikamente und Insektenschutzmittel verwendet. Bei der Käseherstellung wirkt das Labferment mit, ein Enzym, das aus Kälbermägen gewonnen wurde. ⓘ
Viele Enzyme können heute mit Hilfe von gentechnisch veränderten Mikroorganismen hergestellt werden. ⓘ
Die in rohen Ananas, Kiwifrüchten und Papayas enthaltenen Enzyme verhindern das Erstarren von Tortengelatine, ein unerwünschter Effekt, wenn beispielsweise ein Obstkuchen, der rohe Stücke dieser Früchte enthält, mit einem festen Tortengelatinebelag überzogen werden soll. Das Weichbleiben des Übergusses tritt nicht bei der Verwendung von Früchten aus Konservendosen auf, diese werden pasteurisiert, wobei die eiweißabbauenden Enzyme deaktiviert werden. ⓘ
Beim Schälen von Obst und Gemüse werden pflanzliche Zellen verletzt und in der Folge Enzyme freigesetzt. Dadurch kann das geschälte Gut (bei Äpfeln und Avocados gut ersichtlich) durch enzymatisch unterstützte Reaktion von Flavonoiden oder anderen empfindlichen Inhaltsstoffen mit Luftsauerstoff braun werden. Ein Zusatz von Zitronensaft wirkt dabei als Gegenmittel. Die im Zitronensaft enthaltene Ascorbinsäure verhindert die Oxidation oder reduziert bereits oxidierte Verbindungen (Zusatz von Ascorbinsäure als Lebensmittelzusatzstoff). ⓘ
In der Medizin spielen Enzyme eine wichtige Rolle. Viele Arzneimittel hemmen Enzyme oder verstärken ihre Wirkung, um eine Krankheit zu heilen. Prominentester Vertreter solcher Arzneistoffe ist wohl die Acetylsalicylsäure, die das Enzym Cyclooxygenase hemmt und somit unter anderem schmerzlindernd wirkt. ⓘ
Einsatz von Enzymen für Plastikrecycling
Enzyme kommen auch für das Recycling von Plastik zum Einsatz. Diese müssen ausreichend hitzestabil sein, d. h., sie müssen Temperaturen um die 70 Grad aushalten. Die französische Firma Carbios hat ein Enzym gefunden, das Polyethylenterephthalat (PET) in seine Monomere (Ethylenglycol und Terephthalsäure) zerlegt. Die Flaschen müssen vor dem Erhitzen zuerst verkleinert werden. Am Ende des Prozesses steht ein Plastikgranulat, das für neue PET-Produkte verwendet werden kann. Trotz des relativ hohen Aufwands wird das Verfahren als lohnend bewertet, da die Ausgaben sich nur auf etwa 4 % der Kosten belaufen, die für die Produktion neuer Plastikflaschen aus Rohöl anfallen. ⓘ
Bedeutung von Enzymen in der medizinischen Diagnostik
Die Diagnostik verwendet Enzyme, um Krankheiten zu entdecken. In den Teststreifen für Diabetiker befindet sich zum Beispiel ein Enzymsystem, das unter Einwirkung von Blutzucker einen Stoff produziert, dessen Gehalt gemessen werden kann. So wird indirekt der Blutzuckerspiegel gemessen. Man nennt diese Vorgehensweise eine „enzymatische Messung“. Sie wird auch in medizinischen Laboratorien angewandt, zur Bestimmung von Glucose (Blutzucker) oder Alkohol. Enzymatische Messungen sind relativ einfach und preisgünstig anzuwenden. Man macht sich dabei die Substratspezifität von Enzymen zu Nutze. Es wird also der zu analysierenden Körperflüssigkeit ein Enzym zugesetzt, welches das zu messende Substrat spezifisch umsetzen kann. An der entstandenen Menge von Reaktionsprodukten kann man dann ablesen, wie viel des Substrats in der Körperflüssigkeit vorhanden war. ⓘ
Im menschlichen Blut sind auch eine Reihe von Enzymen anhand ihrer Aktivität direkt messbar. Die im Blut zirkulierenden Enzyme entstammen teilweise spezifischen Organen. Es können daher anhand der Erniedrigung oder Erhöhung von Enzymaktivitäten im Blut Rückschlüsse auf Schädigungen bestimmter Organe gezogen werden. So kann eine Bauchspeicheldrüsenentzündung durch die stark erhöhte Aktivität der Lipase und der Pankreas-Amylase im Blut erkannt werden. ⓘ



![{\displaystyle {\ce {CO2{}+H2O->[{\text{Kohlenstoffanhydrase}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c4a2d171ac7b03d84a5323432d9363b2bdae9c4)
![{\displaystyle {\ce {CO2{}+H2O<-[{\text{Kohlenhydratanhydrase}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45cbd6cae6a49dc72f6d337ad67e4e741ba9f75f)







