Silicium
| Silizium | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache |
| ||||||||||||||||||||||||||||||
| Allotrope | siehe Allotrope des Siliciums | ||||||||||||||||||||||||||||||
| Erscheinungsbild | kristallin, spiegelnd mit bläulich gefärbten Flächen | ||||||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Si) |
| ||||||||||||||||||||||||||||||
| Silicium im Periodensystem | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 14 | ||||||||||||||||||||||||||||||
| Gruppe | Gruppe 14 (Kohlenstoffgruppe) | ||||||||||||||||||||||||||||||
| Periode | Periode 3 | ||||||||||||||||||||||||||||||
| Block | p-Block | ||||||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Neon|Ne]]] 3s2 3p2 | ||||||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 4 | ||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||
| Phase bei STP | fest | ||||||||||||||||||||||||||||||
| Schmelzpunkt | 1687 K (1414 °C, 2577 °F) | ||||||||||||||||||||||||||||||
| Siedepunkt | 3538 K (3265 °C, 5909 °F) | ||||||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 2,3290 g/cm3 | ||||||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 2,57 g/cm3 | ||||||||||||||||||||||||||||||
| Schmelzwärme | 50,21 kJ/mol | ||||||||||||||||||||||||||||||
| Verdampfungswärme | 383 kJ/mol | ||||||||||||||||||||||||||||||
| Molare Wärmekapazität | 19,789 J/(mol-K) | ||||||||||||||||||||||||||||||
Verdampfungsdruck
| |||||||||||||||||||||||||||||||
| Atomare Eigenschaften | |||||||||||||||||||||||||||||||
| Oxidationsstufen | -4, -3, -2, -1, 0, +1, +2, +3, +4 (ein amphoteres Oxid) | ||||||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 1.90 | ||||||||||||||||||||||||||||||
| Ionisierungsenergien |
| ||||||||||||||||||||||||||||||
| Atomradius | empirisch: 111 pm | ||||||||||||||||||||||||||||||
| Kovalenter Radius | 111 pm | ||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 210 pm | ||||||||||||||||||||||||||||||
| Spektrallinien von Silizium | |||||||||||||||||||||||||||||||
| Andere Eigenschaften | |||||||||||||||||||||||||||||||
| Natürliches Vorkommen | primordial | ||||||||||||||||||||||||||||||
| Kristallstruktur | flächenzentriert diamantkubisch | ||||||||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | 8433 m/s (bei 20 °C) | ||||||||||||||||||||||||||||||
| Thermische Ausdehnung | 2,6 µm/(m⋅K) (bei 25 °C) | ||||||||||||||||||||||||||||||
| Thermische Leitfähigkeit | 149 W/(m⋅K) | ||||||||||||||||||||||||||||||
| Elektrischer Widerstand | 2,3×103 Ω⋅m (bei 20 °C) | ||||||||||||||||||||||||||||||
| Bandlücke | 1,12 eV (bei 300 K) | ||||||||||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | ||||||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -3,9×10-6 cm3/mol (298 K) | ||||||||||||||||||||||||||||||
| Elastizitätsmodul | 130-188 GPa | ||||||||||||||||||||||||||||||
| Schermodul | 51-80 GPa | ||||||||||||||||||||||||||||||
| Elastizitätsmodul | 97,6 GPa | ||||||||||||||||||||||||||||||
| Poissonzahl | 0.064–0.28 | ||||||||||||||||||||||||||||||
| Mohs-Härte | 6.5 | ||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-21-3 | ||||||||||||||||||||||||||||||
| Geschichte | |||||||||||||||||||||||||||||||
| Namensgebung | nach dem lateinischen 'silex' oder 'silicis', was Feuerstein bedeutet | ||||||||||||||||||||||||||||||
| Vorhersage | Antoine Lavoisier (1787) | ||||||||||||||||||||||||||||||
| Entdeckung und erste Isolierung | Jöns Jacob Berzelius (1823) | ||||||||||||||||||||||||||||||
| Benannt durch | Thomas Thomson (1817) | ||||||||||||||||||||||||||||||
| Hauptisotope von Silizium | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Silizium ist ein chemisches Element mit dem Symbol Si und der Ordnungszahl 14. Es ist ein harter, spröder, kristalliner Feststoff mit blau-grauem Metallglanz und gehört zu den vierwertigen Metalloiden und Halbleitern. Es gehört zur Gruppe 14 des Periodensystems: Kohlenstoff steht darüber, Germanium, Zinn, Blei und Flerovium stehen darunter. Es ist relativ unreaktiv. Aufgrund seiner hohen chemischen Affinität zu Sauerstoff gelang es Jöns Jakob Berzelius erst 1823, es in reiner Form herzustellen und zu charakterisieren. Seine Oxide bilden eine Familie von Anionen, die als Silikate bezeichnet werden. Sein Schmelz- und Siedepunkt von 1414 °C bzw. 3265 °C ist der zweithöchste aller Metalloide und Nichtmetalle und wird nur noch von Bor übertroffen. Silicium ist das achthäufigste Element im Universum (nach Masse), kommt aber nur sehr selten als reines Element in der Erdkruste vor. Am weitesten verbreitet ist es im Weltraum in kosmischen Stäuben, Planetoiden und Planeten als verschiedene Formen von Siliziumdioxid (Kieselsäure) oder Silikaten. Mehr als 90 % der Erdkruste besteht aus Silikatmineralien, womit Silizium nach Sauerstoff das zweithäufigste Element in der Erdkruste ist (etwa 28 % der Masse). Silizium ist ein natürliches Element und hat, wenn es nicht vorher vorhanden war, eine Verweildauer von etwa 400 Jahren in den Weltmeeren. ⓘ
Das meiste Silizium wird kommerziell genutzt, ohne dass es abgetrennt wird, wobei die natürlichen Mineralien oft nur wenig verarbeitet werden. So wird es unter anderem im industriellen Bau mit Tonen, Quarzsand und Stein verwendet. Silikate werden in Portlandzement für Mörtel und Stuck verwendet und mit Quarzsand und -kies gemischt, um Beton für Gehwege, Fundamente und Straßen herzustellen. Sie werden auch in weißer Keramik wie Porzellan und in traditionellem Kalknatronglas auf Silikatbasis sowie in vielen anderen Spezialgläsern verwendet. Siliciumverbindungen wie Siliciumcarbid werden als Schleifmittel und Bestandteile von hochfesten Keramiken verwendet. Silizium ist die Grundlage für die weit verbreiteten synthetischen Polymere, die Silikone. ⓘ
Das späte 20. bis frühe 21. Jahrhundert wurde als Siliziumzeitalter (auch als Digitalzeitalter oder Informationszeitalter bekannt) bezeichnet, da das elementare Silizium einen großen Einfluss auf die moderne Weltwirtschaft hat. Der geringe Anteil an sehr hoch gereinigtem elementarem Silizium, der in der Halbleiterelektronik verwendet wird (< 10 %), ist für die Transistoren und integrierten Schaltkreise, die in den meisten modernen Technologien wie Smartphones und anderen Computern verwendet werden, unerlässlich. Im Jahr 2019 entfielen 32,4 % des Halbleitermarktsegments auf Netzwerke und Kommunikationsgeräte, und die Halbleiterindustrie wird bis 2027 voraussichtlich 726,73 Milliarden US-Dollar erreichen. ⓘ
Silizium ist ein wesentliches Element in der Biologie. Die meisten Tiere benötigen nur Spuren davon, aber einige Meeresschwämme und Mikroorganismen, wie Kieselalgen und Radiolarien, scheiden Skelettstrukturen aus Kieselsäure aus. Kieselsäure wird in vielen Pflanzengeweben abgelagert. ⓘ
Silicium ist ein klassisches Halbmetall, weist daher sowohl Eigenschaften von Metallen als auch von Nichtmetallen auf und ist ein Elementhalbleiter. Reines, elementares Silicium besitzt eine grau-schwarze Farbe und weist einen typisch metallischen, oftmals bronzenen bis bläulichen Glanz auf. ⓘ
Silicium ist äußerst wichtig für die Elektronik und diente 2018 bis 2019 in isotopenreiner Form auch zur Definition des Kilogramms. Elementares Silicium ist für den menschlichen Körper ungiftig, in gebundener silicatischer Form ist Silicium für den Menschen wichtig. Der menschliche Körper enthält etwa 20 mg/kg Körpermasse Silicium; die Menge nimmt mit zunehmendem Alter ab. ⓘ
Geschichte
Da Silizium in der Erdkruste reichlich vorhanden ist, werden natürliche Materialien auf Siliziumbasis seit Tausenden von Jahren verwendet. Bergkristalle aus Silizium waren verschiedenen antiken Zivilisationen bekannt, z. B. den prädynastischen Ägyptern, die sie für Perlen und kleine Vasen verwendeten, sowie den alten Chinesen. Siliciumdioxidhaltiges Glas wurde von den Ägyptern seit mindestens 1500 v. Chr. hergestellt, ebenso wie von den alten Phöniziern. Natürliche Silikatverbindungen wurden auch in verschiedenen Arten von Mörtel für den Bau der frühen menschlichen Behausungen verwendet. ⓘ
Entdeckung

1787 vermutete Antoine Lavoisier, dass es sich bei Siliziumdioxid um ein Oxid eines grundlegenden chemischen Elements handeln könnte, aber die chemische Affinität von Silizium zu Sauerstoff ist so hoch, dass er keine Möglichkeit hatte, das Oxid zu reduzieren und das Element zu isolieren. Nach einem Versuch, Silizium im Jahr 1808 zu isolieren, schlug Sir Humphry Davy den Namen "Silicium" für Silizium vor, abgeleitet vom lateinischen silex, silicis für Feuerstein, und fügte die Endung "-ium" hinzu, weil er es für ein Metall hielt. Die meisten anderen Sprachen verwenden transkribierte Formen von Davys Namen, manchmal angepasst an die lokale Phonologie (z. B. deutsch Silizium, türkisch silisyum, katalanisch silici). Einige wenige Sprachen verwenden stattdessen eine Umschreibung der lateinischen Wurzel (z. B. Russisch кремний, von кремень "Feuerstein"; Griechisch πυρίτιο von πυρ "Feuer"; Finnisch pii von piikivi "Feuerstein", Tschechisch křemík von křemen "Quarz", "Feuerstein"). ⓘ
Es wird angenommen, dass Gay-Lussac und Thénard 1811 durch Erhitzen von kürzlich isoliertem Kaliummetall mit Siliziumtetrafluorid unreines amorphes Silizium herstellten, aber sie reinigten und charakterisierten das Produkt nicht und identifizierten es auch nicht als neues Element. Seinen heutigen Namen erhielt Silicium 1817 von dem schottischen Chemiker Thomas Thomson. Er behielt einen Teil des Namens von Davy bei, fügte aber ein "-on" hinzu, weil er glaubte, dass Silicium ein Nichtmetall sei, ähnlich wie Bor und Kohlenstoff. 1824 stellte Jöns Jacob Berzelius amorphes Silizium her, indem er ungefähr die gleiche Methode wie Gay-Lussac verwendete (Reduktion von Kaliumfluorsilikat mit geschmolzenem Kaliummetall), aber das Produkt durch wiederholtes Waschen zu einem braunen Pulver reinigte. Daher wird ihm in der Regel die Entdeckung des Elements zugeschrieben. Im selben Jahr stellte Berzelius als Erster Siliciumtetrachlorid her; Siliciumtetrafluorid war bereits 1771 von Carl Wilhelm Scheele durch Auflösen von Kieselsäure in Flusssäure hergestellt worden. ⓘ
Silicium in seiner häufigeren kristallinen Form wurde erst 31 Jahre später von Deville hergestellt. Durch Elektrolyse einer Mischung aus Natriumchlorid und Aluminiumchlorid, die etwa 10 % Silizium enthielt, gelang es ihm 1854, ein leicht unreines Silizium-Allotrop zu erhalten. Später wurden kostengünstigere Methoden entwickelt, um mehrere Allotropformen zu isolieren, zuletzt Silicen im Jahr 2010. Friedrich Wöhler entdeckte die ersten flüchtigen Siliciumhydride, indem er 1857 Trichlorsilan und 1858 Silan selbst synthetisierte. Eine eingehende Untersuchung der Silane wurde jedoch erst zu Beginn des 20. Jahrhunderts von Alfred Stock durchgeführt, obwohl die ersten Spekulationen zu diesem Thema bereits auf die Anfänge der synthetischen organischen Chemie in den 1830er Jahren zurückgehen. In ähnlicher Weise wurde die erste siliciumorganische Verbindung, Tetraethylsilan, 1863 von Charles Friedel und James Crafts synthetisiert, aber eine detaillierte Charakterisierung der siliciumorganischen Chemie erfolgte erst zu Beginn des 20. Jahrhunderts durch Frederic Kipping. ⓘ
Jahrhunderts durch Frederic Kipping. Ab den 1920er Jahren gelang es William Lawrence Bragg mit seiner Arbeit zur Röntgenkristallographie, die bis dahin aus der analytischen Chemie bekannten, aber noch nicht verstandenen Zusammensetzungen der Silikate aufzuklären, zusammen mit Linus Paulings Entwicklung der Kristallchemie und Victor Goldschmidts Entwicklung der Geochemie. Mitte des 20. Jahrhunderts entwickelten sich die Chemie und die industrielle Nutzung von Siloxanen sowie die zunehmende Verwendung von Silikonpolymeren, -elastomeren und -harzen. Im späten 20. Jahrhundert wurde die Komplexität der Kristallchemie von Siliziden und die Festkörperphysik von dotierten Halbleitern kartiert. ⓘ

Der Begriff Silicium leitet sich vom lateinischen Wort silex (Kieselstein, Feuerstein) ab. Er bringt zum Ausdruck, dass Silicium häufiger Bestandteil vieler Minerale ist. ⓘ
Der englische Begriff silicon wurde 1817 von dem schottischen Chemiker Thomas Thomson (1773–1852) vorgeschlagen. Die Endung -on soll dabei auf die chemische Verwandtschaft zu den Nichtmetallen Kohlenstoff (carbon) und Bor (boron) hinweisen. ⓘ
Die erstmalige Herstellung reinen, kristallinen Siliciums gelang im Jahre 1854 dem französischen Chemiker Henri Etienne Sainte-Claire Deville mittels Elektrolyse. ⓘ
Silizium-Halbleiter
Die ersten Halbleiterbauelemente verwendeten kein Silizium, sondern Bleiglanz, darunter der Kristalldetektor des deutschen Physikers Ferdinand Braun im Jahr 1874 und der Radiokristalldetektor des indischen Physikers Jagadish Chandra Bose im Jahr 1901. Das erste Silizium-Halbleitergerät war ein Silizium-Radiokristalldetektor, der 1906 von dem amerikanischen Ingenieur Greenleaf Whittier Pickard entwickelt wurde. ⓘ
Im Jahr 1940 entdeckte Russell Ohl den p-n-Übergang und die photovoltaischen Effekte in Silizium. 1941 wurden Techniken zur Herstellung hochreiner Germanium- und Siliziumkristalle für Radar-Mikrowellendetektorkristalle während des Zweiten Weltkriegs entwickelt. 1947 stellte der Physiker William Shockley die Theorie eines Feldeffekt-Verstärkers aus Germanium und Silizium auf, konnte aber kein funktionierendes Gerät bauen und arbeitete schließlich stattdessen mit Germanium. Der erste funktionierende Transistor war ein Punktkontakttransistor, der im selben Jahr von John Bardeen und Walter Brattain gebaut wurde, die unter Shockley arbeiteten. 1954 stellte der Physikochemiker Morris Tanenbaum in den Bell Labs den ersten Siliziumtransistor her. 1955 entdeckten Carl Frosch und Lincoln Derick in den Bell Labs zufällig, dass Siliziumdioxid (SiO2) auf Silizium gezüchtet werden kann. 1958 schlugen sie vor, dass damit Siliziumoberflächen während Diffusionsprozessen maskiert werden könnten. ⓘ
Das Silizium-Zeitalter
Das "Siliziumzeitalter" bezieht sich auf das späte 20. bis frühe 21. Jahrhundert. Dies ist darauf zurückzuführen, dass Silizium das vorherrschende Material des Siliziumzeitalters (auch bekannt als Digitales Zeitalter oder Informationszeitalter) ist, ähnlich wie die Steinzeit, die Bronzezeit und die Eisenzeit durch die vorherrschenden Materialien während ihrer jeweiligen Zivilisationszeitalter definiert wurden. ⓘ
Da Silizium ein wichtiges Element in hochtechnologischen Halbleitergeräten ist, tragen viele Orte auf der Welt seinen Namen. So erhielt beispielsweise das Santa Clara Valley in Kalifornien den Spitznamen Silicon Valley, da das Element das Grundmaterial für die dortige Halbleiterindustrie ist. Seitdem haben viele andere Orte ähnliche Bezeichnungen erhalten, darunter Silicon Wadi in Israel, Silicon Forest in Oregon, Silicon Hills in Austin, Texas, Silicon Slopes in Salt Lake City, Utah, Silicon Saxony in Deutschland, Silicon Valley in Indien, Silicon Border in Mexicali, Mexiko, Silicon Fen in Cambridge, England, Silicon Roundabout in London, Silicon Glen in Schottland, Silicon Gorge in Bristol, England, Silicon Alley in New York, New York und Silicon Beach in Los Angeles, Kalifornien. ⓘ
Standardsprachlich wird das Element „Silizium“ geschrieben. Die Schreibweise mit „c“ ist vor allem in der chemischen Fachsprache gebräuchlich. Beide Schreibweisen entstammen dem lateinischen Ausdruck silicia „Kieselerde“, verknüpft mit lat. silex „Kieselstein“, „Fels“. ⓘ
Nutzung in vorindustrieller Zeit
Siliciumhaltige Verbindungen, vor allem Gesteine, spielen in der Menschheitsgeschichte als Baumaterial traditionell eine wichtige Rolle. Ein typisches Beispiel für ein frühes Bauwerk aus Stein ist Stonehenge. Ein weiteres wichtiges silicathaltiges Material, das seit langer Zeit als Baumaterial dient, ist Lehm, der als Stampflehm, im Lehmbau mit Astgeflecht oder Stroh verstärkt oder in Lehmziegelbauten verwendet wurde, später auch gebrannt als Backstein. Zement, der ebenfalls silicathaltig ist, wurde erstmals von den Römern entwickelt. ⓘ
Aufgrund ihrer scharfen Schnittkanten fanden siliciumhaltige Gesteine in der Steinzeit auch Einsatz als Werkzeuge. Bereits in vorgeschichtlicher Zeit ist zum Beispiel Obsidian als besonders geeignetes Werkzeugmaterial abgebaut und durch Handel weithin verbreitet worden. Auch Feuerstein wurde in Kreidegebieten, etwa in Belgien und Dänemark, bergmännisch gewonnen. Bei der Metallgewinnung, insbesondere bei der Stahlherstellung, wird Silicat-Schlacke zum Schutz der Herde und Öfen vor Sauerstoffzutritt und als Form aus Ton oder Sand eingesetzt; dabei wurde möglicherweise die Glasherstellung entdeckt. ⓘ
Eigenschaften
Physikalisch und atomar
Ein Siliciumatom hat vierzehn Elektronen. Im Grundzustand sind sie in der Elektronenkonfiguration [Ne]3s23p2 angeordnet. Davon sind vier Valenzelektronen, die das 3s-Orbital und zwei der 3p-Orbitale besetzen. Wie die anderen Mitglieder seiner Gruppe, der leichtere Kohlenstoff und die schwereren Germanium-, Zinn- und Blei-Atome, hat es die gleiche Anzahl an Valenzelektronen wie an Valenzorbitalen: Daher kann es sein Oktett vervollständigen und die stabile Edelgaskonfiguration von Argon erhalten, indem es sp3-Hybridorbitale bildet, die tetraedrische SiX4-Derivate bilden, bei denen das zentrale Siliciumatom ein Elektronenpaar mit jedem der vier Atome teilt, an die es gebunden ist. Die ersten vier Ionisierungsenergien von Silicium betragen 786,3, 1576,5, 3228,3 bzw. 4354,4 kJ/mol; diese Werte sind hoch genug, um eine einfache kationische Chemie für das Element auszuschließen. Entsprechend dem Periodensystem liegt der kovalente Radius des Elements mit 117,6 pm zwischen dem von Kohlenstoff (77,2 pm) und Germanium (122,3 pm). Der hexakoordinierte Ionenradius von Silicium kann mit 40 pm angenommen werden, wobei dies eine rein fiktive Zahl ist, da es in der Realität kein einfaches Si4+-Kation gibt. ⓘ
Elektrisch
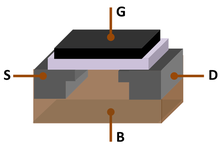
Bei Standardtemperatur und -druck ist Silicium ein glänzender Halbleiter mit bläulich-grauem Metallglanz; wie für Halbleiter typisch, sinkt sein spezifischer Widerstand mit steigender Temperatur. Dies ist darauf zurückzuführen, dass Silizium eine kleine Energielücke (Bandlücke) zwischen den höchsten besetzten Energieniveaus (Valenzband) und den niedrigsten unbesetzten (Leitungsband) aufweist. Das Fermi-Niveau liegt etwa auf halber Strecke zwischen dem Valenz- und dem Leitungsband und ist die Energie, bei der ein Zustand mit gleicher Wahrscheinlichkeit von einem Elektron besetzt ist wie nicht. Daher ist reines Silizium bei Raumtemperatur praktisch ein Isolator. Durch die Dotierung von Silicium mit einem pntogenen Stoff wie Phosphor, Arsen oder Antimon wird jedoch ein zusätzliches Elektron pro Dotierungsstoff eingeführt, das dann entweder thermisch oder photolytisch in das Leitungsband angeregt werden kann, wodurch ein n-Typ-Halbleiter entsteht. In ähnlicher Weise führt die Dotierung von Silicium mit einem Element der Gruppe 13 wie Bor, Aluminium oder Gallium zur Einführung von Akzeptorniveaus, die Elektronen einfangen, die aus dem gefüllten Valenzband angeregt werden können, wodurch ein p-Typ-Halbleiter entsteht. Durch die Verbindung von Silizium vom n-Typ mit Silizium vom p-Typ entsteht ein p-n-Übergang mit einem gemeinsamen Fermi-Niveau; Elektronen fließen von n nach p, während Löcher von p nach n fließen, wodurch ein Spannungsabfall entsteht. Dieser p-n-Übergang wirkt somit wie eine Diode, die Wechselstrom gleichrichten kann, so dass der Strom leichter in die eine als in die andere Richtung fließen kann. Ein Transistor ist ein n-p-n-Übergang mit einer dünnen Schicht aus schwach p-leitendem Silizium zwischen zwei n-leitenden Bereichen. Wenn man den Emitter mit einer kleinen Vorwärtsspannung und den Kollektor mit einer großen Rückwärtsspannung vorspannt, kann der Transistor wie ein Triodenverstärker arbeiten. ⓘ
Kristallstruktur
Silizium kristallisiert unter Standardbedingungen in einer riesigen kovalenten Struktur, nämlich in einem kubischen Diamantgitter (Raumgruppe 227). Es hat daher einen hohen Schmelzpunkt von 1414 °C, da viel Energie erforderlich ist, um die starken kovalenten Bindungen aufzubrechen und den Festkörper zu schmelzen. Beim Schmelzen zieht sich Silicium zusammen, da das weitreichende tetraedrische Bindungsnetz aufbricht und die Hohlräume in diesem Netz aufgefüllt werden, ähnlich wie bei Wassereis, wenn die Wasserstoffbrücken beim Schmelzen aufgebrochen werden. Bei Normaldruck gibt es keine thermodynamisch stabilen Allotrope, doch sind mehrere andere Kristallstrukturen bei höherem Druck bekannt. Die allgemeine Tendenz ist eine mit dem Druck zunehmende Koordinationszahl, die bei etwa 40 Gigapascal in einem hexagonalen, dicht gepackten Allotrop gipfelt, das als Si-VII bekannt ist (die Standardmodifikation ist Si-I). Ein Allotrop namens BC8 (oder bc8), das ein kubisch-raumzentriertes Gitter mit acht Atomen pro Elementarzelle (Raumgruppe 206) aufweist, kann bei hohem Druck entstehen und bleibt bei niedrigem Druck metastabil. Seine Eigenschaften sind eingehend untersucht worden. ⓘ
Silizium siedet bei 3265 °C: Diese Temperatur ist zwar hoch, aber immer noch niedriger als die Temperatur, bei der sein leichterer Verwandter Kohlenstoff sublimiert (3642 °C), und Silizium hat ebenfalls eine niedrigere Verdampfungswärme als Kohlenstoff, was damit zusammenhängt, dass die Si-Si-Bindung schwächer ist als die C-C-Bindung. ⓘ
Es ist auch möglich, Silicen-Schichten analog zu Graphen zu konstruieren. ⓘ
Isotope
Das natürlich vorkommende Silicium besteht aus drei stabilen Isotopen: 28Si (92,23 %), 29Si (4,67 %) und 30Si (3,10 %). Von diesen ist nur 29Si für die NMR- und EPR-Spektroskopie von Nutzen, da es als einziges einen Kernspin (I =1/2) besitzt. Alle drei entstehen in Supernovae des Typs Ia durch den Sauerstoffverbrennungsprozess, wobei 28Si im Rahmen des Alphaprozesses gebildet wird und daher am häufigsten vorkommt. Die Verschmelzung von 28Si mit Alphateilchen durch Photodisintegrationsumlagerung in Sternen wird als Siliziumverbrennungsprozess bezeichnet; es ist das letzte Stadium der stellaren Nukleosynthese vor dem schnellen Kollaps und der gewaltigen Explosion des betreffenden Sterns in einer Supernova vom Typ II. ⓘ
Zwanzig Radioisotope wurden charakterisiert, die beiden stabilsten sind 32Si mit einer Halbwertszeit von etwa 150 Jahren und 31Si mit einer Halbwertszeit von 2,62 Stunden. Alle übrigen radioaktiven Isotope haben eine Halbwertszeit von weniger als sieben Sekunden, und die meisten von ihnen haben eine Halbwertszeit von weniger als einer Zehntelsekunde. Silizium hat ein bekanntes Kernisomer, 34mSi, mit einer Halbwertszeit von weniger als 210 Nanosekunden. 32Si unterliegt einem Betazerfall mit niedriger Energie zu 32P und anschließend zu stabilem 32S. 31Si kann durch Neutronenaktivierung von natürlichem Silicium erzeugt werden und ist daher für quantitative Analysen nützlich; es lässt sich leicht durch seinen charakteristischen Betazerfall zu stabilem 31P nachweisen, bei dem das emittierte Elektron eine Energie von bis zu 1,48 MeV hat. ⓘ
Die bekannten Isotope des Siliciums haben eine Massenzahl zwischen 22 und 44. Der häufigste Zerfallsmodus der Isotope mit niedrigeren Massenzahlen als die drei stabilen Isotope ist der inverse Betazerfall, bei dem hauptsächlich Aluminiumisotope (13 Protonen) als Zerfallsprodukte entstehen. Der häufigste Zerfallsmodus für die schwereren instabilen Isotope ist der Betazerfall, wobei als Zerfallsprodukte hauptsächlich Phosphorisotope (15 Protonen) entstehen. ⓘ
Silizium kann durch Grundwasser und Flüsse in die Ozeane gelangen. Die Isotopenzusammensetzung großer Grundwasserströme unterscheidet sich von der Isotopenzusammensetzung der Siliziumeinträge aus Flüssen. Isotopenschwankungen im Grundwasser und im Flusstransport tragen zu Schwankungen der ozeanischen 30Si-Werte bei. Derzeit gibt es erhebliche Unterschiede in den Isotopenwerten des Tiefenwassers in den Ozeanbecken der Welt. Zwischen dem Atlantik und dem Pazifik besteht ein 30Si-Gefälle im Tiefenwasser von mehr als 0,3 Teilen pro Tausend. 30Si wird am häufigsten mit der Produktivität der Ozeane in Verbindung gebracht. ⓘ
Physikalische Eigenschaften

Silicium ist wie die im Periodensystem benachbarten Germanium, Gallium, Phosphor und Antimon ein Elementhalbleiter. Der gemäß dem Bändermodell geltende energetische Abstand zwischen Valenzband und Leitungsband beträgt 1,107 eV (bei Raumtemperatur). Durch Dotierung mit geeigneten Dotierelementen wie beispielsweise Bor oder Arsen kann die Leitfähigkeit um einen Faktor 106 gesteigert werden. In solchermaßen dotiertem Silicium ist die durch die von Fremdatomen und Gitterdefekten verursachte Störstellenleitung deutlich größer als die der Eigenleitung, weshalb derartige Materialien als Störstellenhalbleiter bezeichnet werden. Der Gitterparameter beträgt 543 pm. ⓘ
Der von der Wellenlänge des Lichts abhängige komplexe Brechungsindex ist im nebenstehenden Bild dargestellt. Auch hier lassen sich Informationen über die Bandstruktur ablesen. So erkennt man anhand des stark steigenden Verlaufs des Extinktionskoeffizienten k einen direkten Bandübergang bei 370 nm (EΓ1 = 3,4 eV). Ein weiterer direkter Bandübergang ist bei ≈ 300 nm (EΓ2 = 4,2 eV) zu beobachten. Der indirekte Bandübergang von Silicium (Eg = 1,1 eV) kann nur erahnt werden. Dass weitere indirekte Bandübergänge vorhanden sind, ist an der weit auslaufenden Kurve von k für Wellenlängen > 400 nm erkennbar. ⓘ
Wie Wasser und einige wenige andere Stoffe weist Silicium eine Dichteanomalie auf: Seine Dichte ist in flüssiger Form (bei Tm = 1685 K) um 10–11 % höher als in fester, kristalliner Form (c-Si) bei 300 K. ⓘ
Mechanische Eigenschaften
Die mechanischen Eigenschaften von Silicium sind anisotrop (richtungsabhängig). Je nach gewählter Kristallorientierung nimmt der Elastizitätsmodul Werte zwischen 130 GPa und 189 GPa an. Eine allgemeine Beschreibung des elastischen Verhaltens erfolgt in Voigt-Notation wie für alle kubischen Kristalle über die drei unabhängigen elastischen Konstanten C11, C12 und C44. Die Elastizitätsmatrix ist für Silicium:
Die elastischen Konstanten haben dabei folgende Werte:
Aus den elastischen Konstanten lassen sich für die einzelnen Hauptkristallrichtungen des Siliciums (100,110 und 111) die jeweiligen Elastizitätsmoduln errechnen:
Polykristallines Silicium besitzt – makroskopisch betrachtet – ein isotropes Elastizitätsverhalten. In der Literatur werden die entsprechenden Werte des Elastizitätsmoduls, Schubmoduls sowie der Poissonzahl mit ⓘ
angegeben. ⓘ
Chemie und Verbindungen
| X = | C | Si | H | F | Cl | Br | I | O- | N< |
|---|---|---|---|---|---|---|---|---|---|
| C-X | 368 | 360 | 435 | 453 | 351 | 293 | 216 | ~360 | ~305 |
| Si-X | 360 | 340 | 393 | 565 | 381 | 310 | 234 | 452 | 322 |
Kristallines Silicium ist in der Masse eher träge, wird aber bei hohen Temperaturen reaktionsfreudiger. Wie sein Nachbar Aluminium bildet auch Silicium eine dünne, durchgehende Oberflächenschicht aus Siliciumdioxid (SiO2), die das Metall vor Oxidation schützt. So reagiert Silicium unterhalb von 900 °C nicht messbar mit der Luft, aber zwischen 950 °C und 1160 °C nimmt die Bildung des glasartigen Dioxids rasch zu, und bei 1400 °C reagiert auch der Luftstickstoff zu den Nitriden SiN und Si3N4. Silicium reagiert mit gasförmigem Schwefel bei 600 °C und mit gasförmigem Phosphor bei 1000 °C. Diese Oxidschicht verhindert jedoch nicht die Reaktion mit den Halogenen; Fluor greift Silicium bei Raumtemperatur heftig an, Chlor bei etwa 300 °C und Brom und Jod bei etwa 500 °C. Silicium reagiert nicht mit den meisten wässrigen Säuren, wird aber durch Flusssäuregemische, die entweder Chlor oder Salpetersäure enthalten, oxidiert und komplexiert, wobei Hexafluorsilicate entstehen. In heißem wässrigem Alkali löst es sich leicht auf und bildet Silikate. Bei hohen Temperaturen reagiert Silicium auch mit Alkylhalogeniden; diese Reaktion kann durch Kupfer katalysiert werden, um Organosiliciumchloride als Vorläufer für Siliconpolymere direkt zu synthetisieren. Beim Schmelzen wird Silicium extrem reaktiv, legiert sich mit den meisten Metallen zu Siliciden und reduziert die meisten Metalloxide, da die Bildungswärme von Siliciumdioxid so groß ist. Tatsächlich reagiert geschmolzenes Silicium praktisch mit allen bekannten Tiegelmaterialien (mit Ausnahme seines eigenen Oxids, SiO2). Dies geschieht aufgrund der hohen Bindungskräfte des Siliciums für die leichten Elemente und seines hohen Lösevermögens für die meisten Elemente. Daher müssen Behälter für flüssiges Silizium aus feuerfesten, nicht reaktiven Materialien wie Zirkoniumdioxid oder Boriden der Gruppen 4, 5 und 6 hergestellt werden. ⓘ
Die tetraedrische Koordination ist in der Siliciumchemie ebenso wie in der Kohlenstoffchemie ein wichtiges Strukturmotiv. Allerdings ist die 3p-Unterschale etwas diffuser als die 2p-Unterschale und hybridisiert nicht so gut mit der 3s-Unterschale. Infolgedessen unterscheidet sich die Chemie des Siliciums und seiner schwereren Verwandten deutlich von der des Kohlenstoffs, und somit ist auch die oktaedrische Koordination von Bedeutung. So ist beispielsweise die Elektronegativität von Silicium (1,90) viel geringer als die von Kohlenstoff (2,55), weil die Valenzelektronen von Silicium weiter vom Kern entfernt sind als die von Kohlenstoff und daher geringere elektrostatische Anziehungskräfte vom Kern erfahren. Die geringe Überlappung der 3p-Orbitale führt auch dazu, dass Silicium viel weniger zur Verkettung (Bildung von Si-Si-Bindungen) neigt als Kohlenstoff, da die Si-Si-Bindung im Vergleich zur C-C-Bindung schwächer ist: Die durchschnittliche Si-Si-Bindungsenergie beträgt etwa 226 kJ/mol, verglichen mit einem Wert von 356 kJ/mol für die C-C-Bindung. Dies führt dazu, dass mehrfach gebundene Siliciumverbindungen im Allgemeinen viel weniger stabil sind als ihre Kohlenstoff-Gegenstücke - ein Beispiel für die Regel der Doppelbindung. Andererseits deutet das Vorhandensein von radialen Knoten in den 3p-Orbitalen von Silicium auf die Möglichkeit einer Hypervalenz hin, wie sie in fünf- und sechskoordinierten Siliciumderivaten wie SiX-
5 und SiF2-
6. Aufgrund der zunehmenden Energielücke zwischen den s- und p-Orbitalen der Valenzgruppe nimmt die Bedeutung des zweiwertigen Zustands von Kohlenstoff bis Blei zu, so dass für Silicium einige instabile zweiwertige Verbindungen bekannt sind; diese Absenkung der Hauptoxidationsstufe führt in Verbindung mit zunehmenden Atomradien zu einer Zunahme des metallischen Charakters in der Gruppe. Silicium zeigt bereits erste metallische Eigenschaften, vor allem in seinen Oxidverbindungen und bei der Reaktion mit Säuren und Basen (was allerdings einige Mühe kostet), und wird daher oft als Metalloid und nicht als Nichtmetall bezeichnet. Allerdings wird die Metallizität in der Gruppe 14 erst bei Germanium deutlich und dominiert bis Zinn, wobei die Bedeutung der niedrigeren Oxidationsstufe +2 zunimmt. ⓘ
Silizium unterscheidet sich deutlich von Kohlenstoff. So gibt es in der organischen Chemie nur sehr wenige Analogien zur Siliziumchemie, während Silikatminerale eine strukturelle Komplexität aufweisen, die bei den Oxokohlenstoffen nicht zu finden ist. Greenwood und Earnshaw, S. 328-329</ref> Silizium neigt dazu, Germanium viel ähnlicher zu sein als Kohlenstoff, und diese Ähnlichkeit wird durch die Kontraktion des d-Blocks noch verstärkt, was dazu führt, dass die Größe des Germaniumatoms viel näher an der des Siliziumatoms liegt, als die periodischen Trends vorhersagen würden. Dennoch gibt es einige Unterschiede, die auf die wachsende Bedeutung des zweiwertigen Zustands von Germanium im Vergleich zu Silizium zurückzuführen sind, was dazu führt, dass Germanium deutlich metallischer ist als Silizium. Außerdem führt die geringere Ge-O-Bindungsstärke im Vergleich zur Si-O-Bindungsstärke dazu, dass es keine "Germanon"-Polymere gibt, die den Siliconpolymeren entsprechen würden. ⓘ
Mit Ausnahme von chlorhaltiger oder salpetersäurehaltiger Flusssäure (in denen sich Hexafluorosilicat bildet) ist Silicium in Säuren unlöslich, da es zur Passivierung durch die Bildung einer festen Siliciumdioxidschicht kommt. Leicht löst es sich hingegen in heißen Alkalilaugen unter Wasserstoffbildung. Trotz seines negativen Normalpotenzials (−0,81 V) ist es in kompakter Form reaktionsträge, da es sich an der Luft mit einer schützenden Oxidhaut überzieht. ⓘ
Silizide

Es sind zahlreiche Metallsilicide bekannt, von denen die meisten Formeln nicht durch einfache Hinweise auf die Wertigkeit erklärt werden können: Ihre Bindungen reichen von metallischen über ionische bis hin zu kovalenten Bindungen. Einige bekannte Stöchiometrien sind M6Si, M5Si, M4Si, M15Si4, M3Si, M5Si2, M2Si, M5Si3, M3Si2, MSi, M2Si3, MSi2, MSi3 und MSi6. Sie sind strukturell den Boriden ähnlicher als den Karbiden, was der diagonalen Beziehung zwischen Bor und Silizium entspricht, obwohl die größere Größe von Silizium im Vergleich zu Bor bedeutet, dass exakte strukturelle Analogien nur selten zu finden sind. Die Bildungswärme der Silizide ist in der Regel ähnlich wie die der Boride und Karbide der gleichen Elemente, aber sie schmelzen normalerweise bei niedrigeren Temperaturen. Silizide sind für alle stabilen Elemente der Gruppen 1-10 bekannt, mit Ausnahme von Beryllium: insbesondere Uran und die Übergangsmetalle der Gruppen 4-10 weisen die größte Bandbreite an Stöchiometrien auf. Mit Ausnahme von Kupfer bilden die Metalle der Gruppen 11-15 keine Silizide. Stattdessen bilden die meisten eutektische Mischungen, obwohl die schwersten Nach-Übergangsmetalle Quecksilber, Thallium, Blei und Wismut mit flüssigem Silicium völlig unmischbar sind. ⓘ
In der Regel werden Silizide durch direkte Reaktion der Elemente hergestellt. So reagieren beispielsweise die Alkali- und Erdalkalimetalle mit Silicium oder Siliciumoxid zu Siliciden. Doch selbst mit diesen hoch elektropositiven Elementen lassen sich keine echten Siliciumanionen herstellen, und die meisten dieser Verbindungen sind Halbleiter. So sind beispielsweise die Alkalimetallsilicide (M+
)
4(Si4-
4) enthalten pyramidales, dreifach koordiniertes Silicium im Si4-
4-Anion, isoelektronisch mit weißem Phosphor, P4. Metallreiche Silizide neigen zu isolierten Siliziumatomen (z. B. Cu5Si); mit steigendem Siliziumgehalt nimmt die Verkettung zu, so dass zunächst isolierte Cluster aus zwei (z. B. U3Si2) oder vier Siliziumatomen (z. B. [K+]4[Si4]4-) entstehen, gefolgt von Ketten (z. B. CaSi), Schichten (z. B. CaSi2) oder dreidimensionalen, den Raum überspannenden Netzwerken aus Siliziumatomen (z. B. α-ThSi2), wenn der Siliziumgehalt noch weiter ansteigt. ⓘ
Die Silizide der Metalle der Gruppe 1 und 2 sind in der Regel reaktiver als die Übergangsmetallsilizide. Letztere reagieren in der Regel nicht mit wässrigen Reagenzien, mit Ausnahme von Flusssäure; sie reagieren jedoch mit wesentlich aggressiveren Reagenzien wie flüssigem Kaliumhydroxid oder gasförmigem Fluor oder Chlor, wenn sie rotglühend sind. Die Metallsilicide vor dem Übergang reagieren dagegen leicht mit Wasser und wässrigen Säuren, wobei normalerweise Wasserstoff oder Silane entstehen:
- Na2Si + 3 H2O → Na2SiO3 + 3 H2
- Mg2Si + 2 H2SO4 → 2 MgSO4 + SiH4
Die Produkte hängen oft von der Stöchiometrie des Silizidreaktanten ab. Ca2Si zum Beispiel ist polar und nicht leitend und hat die Anti-PbCl2-Struktur mit einzelnen isolierten Siliciumatomen; es reagiert mit Wasser zu Calciumhydroxid, hydratisiertem Siliciumdioxid und Wasserstoffgas. CaSi mit seinen Zickzack-Ketten von Siliciumatomen reagiert stattdessen zu Silanen und polymerem SiH2, während CaSi2 mit seinen gekräuselten Schichten von Siliciumatomen nicht mit Wasser reagiert, aber mit verdünnter Salzsäure: Das Produkt ist ein gelber polymerer Feststoff mit der Stöchiometrie Si2H2O. ⓘ
Silane
Spekulationen über die Chemie der Siliciumhydride begannen in den 1830er Jahren, zeitgleich mit der Entwicklung der synthetischen organischen Chemie. Silan selbst sowie Trichlorsilan wurden erstmals 1857 von Friedrich Wöhler und Heinrich Buff durch Reaktion von Aluminium-Silizium-Legierungen mit Salzsäure synthetisiert und 1867 von Charles Friedel und Albert Ladenburg als SiH4 und SiHCl3 charakterisiert. Disilan (Si2H6) wurde 1902 erstmals von Henri Moissan und Samuel Smiles durch Protonolyse von Magnesiumsiliziden hergestellt. Wegen der hohen Reaktivität und der thermischen Instabilität der Silane mussten weitere Untersuchungen bis 1916 warten. Zu diesem Zeitpunkt begann Alfred Stock, die Siliciumhydride mit neuen fettfreien Vakuumtechniken ernsthaft zu untersuchen, da sie als Verunreinigungen in den von ihm untersuchten Borhydriden gefunden wurden. Die Bezeichnungen Silane und Borane gehen auf ihn zurück und basieren auf der Analogie zu den Alkanen. Die Methode von Moissan und Smiles zur Herstellung von Silanen und Silanderivaten durch Protonolyse von Metallsiliciden wird immer noch angewandt, obwohl die Ausbeute durch die gleichzeitig stattfindende Hydrolyse der Produkte verringert wird, so dass der bevorzugte Weg heute darin besteht, substituierte Silane mit Hydridreduktionsmitteln wie Lithiumaluminiumhydrid in ätherischen Lösungen bei niedrigen Temperaturen zu behandeln. Die direkte Reaktion von HX oder RX mit Silicium, eventuell mit einem Katalysator wie Kupfer, ist ebenfalls eine praktikable Methode zur Herstellung substituierter Silane. ⓘ
Die Silane umfassen eine homologe Reihe von Siliciumhydriden mit der allgemeinen Formel SinH2n + 2. Sie alle sind starke Reduktionsmittel. Unverzweigte und verzweigte Ketten sind bis zu n=8 bekannt, und auch die Zyklen Si5H10 und Si6H12 sind bekannt. Die ersten beiden, Silan und Disilan, sind farblose Gase; die schwereren Mitglieder der Reihe sind flüchtige Flüssigkeiten. Alle Silane sind sehr reaktiv und fangen Feuer oder explodieren spontan an der Luft. Ihre thermische Stabilität nimmt mit der Raumtemperatur ab, so dass nur Silan bei Raumtemperatur unbegrenzt stabil ist, während Disilan sich nicht sehr schnell zersetzt (nur 2,5 % einer Probe zersetzen sich nach acht Monaten). Sie zersetzen sich unter Bildung von polymerem Polysiliciumhydrid und Wasserstoffgas. Wie aufgrund des unterschiedlichen Atomgewichts zu erwarten, sind die Silane weniger flüchtig als die entsprechenden Alkane und Borane, aber flüchtiger als die entsprechenden Germane. Sie sind wesentlich reaktionsfreudiger als die entsprechenden Alkane, da der größere Radius von Silicium im Vergleich zu Kohlenstoff einen nukleophilen Angriff am Silicium erleichtert, die Si-H-Bindung im Vergleich zur C-H-Bindung eine größere Polarität aufweist und Silicium die Fähigkeit besitzt, sein Oktett zu erweitern und somit Addukte zu bilden und die Aktivierungsenergie der Reaktion zu senken. ⓘ
Bei der Silanpyrolyse entstehen polymere Spezies und schließlich elementares Silicium und Wasserstoff; in der Tat wird hochreines Silicium kommerziell durch die Pyrolyse von Silan hergestellt. Während die thermische Zersetzung von Alkanen mit dem Bruch einer C-H- oder C-C-Bindung und der Bildung von radikalischen Zwischenprodukten beginnt, zersetzen sich Polysilane durch die Abspaltung von Silylenen :SiH2 oder :SiHR, da die Aktivierungsenergie dieses Prozesses (~210 kJ/mol) viel geringer ist als die Si-Si- und Si-H-Bindungsenergien. Während reine Silane nicht mit reinem Wasser oder verdünnten Säuren reagieren, katalysieren Spuren von Alkali die sofortige Hydrolyse zu hydratisiertem Siliciumdioxid. Wird die Reaktion in Methanol durchgeführt, führt die kontrollierte Solvolyse zu den Produkten SiH2(OMe)2, SiH(OMe)3 und Si(OMe)4. Die Si-H-Bindung addiert auch an Alkene, eine Reaktion, die langsam verläuft und sich mit zunehmender Substitution des beteiligten Silans beschleunigt. Bei 450 °C ist das Silan an einer Additionsreaktion mit Aceton sowie an einer Ringöffnungsreaktion mit Ethylenoxid beteiligt. Die direkte Reaktion der Silane mit Chlor oder Brom führt bei Raumtemperatur zu Explosionen, aber die Reaktion von Silan mit Brom bei -80 °C verläuft kontrolliert und ergibt Bromsilan und Dibromsilan. Die Monohalogensilane können durch Reaktion von Silan mit dem entsprechenden Halogenwasserstoff mit einem Al2X6-Katalysator oder durch Reaktion von Silan mit einem festen Silberhalogenid in einem beheizten Durchflussreaktor gebildet werden:
- SiH4 + 2 AgCl SiH3Cl + HCl + 2 Ag
Unter den Silanderivaten sind Jodsilan (SiH3I) und Kaliumsilanid (KSiH3) sehr nützliche synthetische Zwischenprodukte für die Herstellung komplizierterer siliciumhaltiger Verbindungen: Letzteres ist ein farbloser kristalliner ionischer Feststoff, der K+-Kationen und SiH-
3-Anionen in der NaCl-Struktur und wird durch die Reduktion von Silan mit Kaliummetall hergestellt. Außerdem ist die reaktive hypervalente Spezies SiH-
5 ist ebenfalls bekannt. Mit geeigneten organischen Substituenten lassen sich stabile Polysilane herstellen, die aufgrund der Sigma-Delokalisierung der Elektronen in der Kette überraschend hohe elektrische Leitfähigkeiten aufweisen. ⓘ
Halogenide
Silicium und Siliciumcarbid reagieren leicht mit allen vier stabilen Halogenen und bilden die farblosen, reaktiven und flüchtigen Siliciumtetrahalogenide Siliciumtetrafluorid kann auch durch Fluorierung der anderen Siliciumhalogenide hergestellt werden und wird durch den Angriff von Fluorwasserstoffsäure auf Glas erzeugt. Durch Erhitzen von zwei verschiedenen Tetrahalogeniden entsteht auch ein zufälliges Gemisch von gemischten Halogeniden, die auch durch Halogenaustauschreaktionen hergestellt werden können. Die Schmelz- und Siedepunkte dieser Spezies steigen in der Regel mit zunehmendem Atomgewicht, obwohl es viele Ausnahmen gibt: So sinken beispielsweise die Schmelz- und Siedepunkte beim Übergang von SiFBr3 über SiFClBr2 zu SiFCl2Br. Der Übergang von den hypoelektronischen Elementen der Gruppe 13 und früher zu den Elementen der Gruppe 14 wird durch den Wechsel von einer unendlichen Ionenstruktur in Aluminiumfluorid zu einem Gitter einfacher kovalenter Siliciumtetrafluoridmoleküle veranschaulicht, die durch die geringere Elektronegativität von Aluminium im Vergleich zu Silicium, die Stöchiometrie (die Oxidationsstufe +4 ist zu hoch für echte Ionizität) und die geringere Größe des Siliciumatoms im Vergleich zum Aluminiumatom bedingt ist. ⓘ
Siliciumtetrachlorid wird in großem Maßstab als Vorprodukt für die Herstellung von reinem Silicium, Siliciumdioxid und einigen Siliciumestern hergestellt. Die Siliciumtetrahalogenide lassen sich im Gegensatz zu den Kohlenstofftetrahalogeniden leicht in Wasser hydrolysieren, was wiederum auf die größere Größe des Siliciumatoms zurückzuführen ist, die es offener für nukleophile Angriffe macht, sowie auf die Fähigkeit des Siliciumatoms, sein Oktett zu erweitern, was beim Kohlenstoff nicht möglich ist. Bei der Reaktion von Siliciumfluorid mit überschüssiger Flusssäure entsteht das oktaedrische Hexafluorosilicat-Anion SiF2-
6. ⓘ
Analog zu den Silanen sind auch die Halogenpolysilane SinX2n + 2 bekannt. Während die Verkettung in Kohlenstoffverbindungen eher in den Wasserstoffverbindungen als in den Halogeniden maximiert wird, gilt für Silizium das Gegenteil, so dass die Halogenpolysilane mindestens bis Si14F30, Si6Cl14 und Si4Br10 bekannt sind. Eine vorgeschlagene Erklärung für dieses Phänomen ist die Kompensation des Elektronenverlusts von Silicium an die elektronegativeren Halogenatome durch pi-Backbonding von den gefüllten pπ-Orbitalen an den Halogenatomen zu den leeren dπ-Orbitalen am Silicium: Dies ähnelt der Situation von Kohlenmonoxid in Metallcarbonylkomplexen und erklärt deren Stabilität. Diese Halogenpolysilane können durch Komproportionierung von Siliciumtetrahalogeniden mit elementarem Silicium oder durch Kondensation von leichteren Halogenpolysilanen hergestellt werden (Trimethylammonium ist ein nützlicher Katalysator für diese Reaktion). ⓘ
Kieselsäure
Siliciumdioxid (SiO2), auch bekannt als Kieselsäure, ist nach Wasser eine der am besten untersuchten Verbindungen. Es sind zwölf verschiedene Kristallmodifikationen von Kieselsäure bekannt, von denen die häufigste der α-Quarz ist, der ein Hauptbestandteil vieler Gesteine wie Granit und Sandstein ist. Es kommt auch in reiner Form als Bergkristall vor; unreine Formen sind als Rosenquarz, Rauchquarz, Morion, Amethyst und Citrin bekannt. Es sind auch einige schwach kristalline Formen von Quarz bekannt, wie Chalcedon, Chrysopras, Karneol, Achat, Onyx, Jaspis, Heliotrop und Flint. Andere Modifikationen von Siliziumdioxid sind in einigen anderen Mineralien wie Tridymit und Cristobalit sowie in den weitaus selteneren Coesit und Stishovit bekannt. Biologisch erzeugte Formen sind auch als Kieselgur und Diatomeenerde bekannt. Glasartiges Siliciumdioxid ist als Tektit und Obsidian, seltener als Lechatelierit bekannt. Einige synthetische Formen sind als Keatit bekannt. Opale bestehen aus komplizierten kristallinen Aggregaten aus teilweise hydratisiertem Siliciumdioxid. ⓘ
Coesit ⓘ
Die meisten kristallinen Formen von Siliciumdioxid bestehen aus unendlichen Anordnungen von {SiO4}-Tetraedern (mit Si im Zentrum), die an ihren Ecken miteinander verbunden sind, wobei jedes Sauerstoffatom mit zwei Siliciumatomen verbunden ist. In der thermodynamisch stabilen Form bei Raumtemperatur, dem α-Quarz, sind diese Tetraeder in verschlungenen Helixketten mit zwei unterschiedlichen Si-O-Abständen (159,7 und 161,7 pm) und einem Si-O-Si-Winkel von 144° verbunden. Diese Helices können entweder links- oder rechtshändig sein, so dass einzelne α-Quarzkristalle optisch aktiv sind. Bei 537 °C wandelt sich dieser schnell und reversibel in den ähnlichen β-Quarz um, wobei sich der Si-O-Si-Winkel auf 155° ändert, die Händigkeit aber erhalten bleibt. Weiteres Erhitzen auf 867 °C führt zu einem weiteren reversiblen Phasenübergang zu β-Tridymit, bei dem einige Si-O-Bindungen gebrochen werden, um die Anordnung der {SiO4}-Tetraeder in einer offeneren und weniger dichten hexagonalen Struktur zu ermöglichen. Dieser Übergang ist langsam, so dass Tridymit auch unterhalb dieser Übergangstemperatur als metastabiles Mineral vorkommt; bei Abkühlung auf etwa 120 °C wandelt es sich schnell und reversibel durch leichte Verschiebungen einzelner Silicium- und Sauerstoffatome in α-Tridymit um, ähnlich wie beim Übergang von α-Quarz zu β-Quarz. β-Tridymit wandelt sich bei etwa 1470 °C langsam in kubischen β-Cristobalit um, der wiederum unterhalb dieser Übergangstemperatur metastabil vorliegt und sich bei 200-280 °C durch kleine Atomverschiebungen in α-Cristobalit umwandelt. β-Cristobalit schmilzt bei 1713 °C; das Gefrieren von Siliciumdioxid aus der Schmelze ist recht langsam, und stattdessen kommt es wahrscheinlich zur Verglasung oder zur Bildung eines Glases. In glasartigem Siliciumdioxid bleiben die {SiO4}-Tetraeder eckenverbunden, aber die Symmetrie und Periodizität der kristallinen Formen gehen verloren. Aufgrund der langsamen Umwandlungen zwischen diesen drei Formen ist es möglich, bei schneller Erhitzung β-Quarz (1550 °C) oder β-Tridymit (1703 °C) zu schmelzen. Kieselsäure siedet bei etwa 2800 °C. Es sind auch andere Hochdruckformen von Kieselsäure bekannt, wie z. B. Coesit und Stishovit: Diese sind in der Natur bekannt, die sich unter dem Schockdruck eines Meteoriteneinschlags bilden und dann schnell abgeschreckt werden, um die Kristallstruktur zu erhalten. Ein ähnliches Schmelzen und Abkühlen von Siliziumdioxid findet nach Blitzeinschlägen statt, wobei glasartiger Lechatelierit entsteht. W-Siliciumdioxid ist eine instabile Form mit geringer Dichte, bei der {SiO4}-Tetraeder anstelle von Ecken gegenüberliegende Kanten aufweisen und parallele Ketten bilden, ähnlich wie Siliciumdisulfid (SiS2) und Siliciumdiselenid (SiSe2): Bei Wärme oder Spuren von Wasser bildet sich schnell wieder amorphes Siliciumdioxid ⓘ

Siliciumdioxid ist chemisch gesehen eher inert. Sie wird von keiner anderen Säure als Flusssäure angegriffen. In heißen konzentrierten Alkalien löst sie sich jedoch langsam und in geschmolzenen Metallhydroxiden oder -carbonaten recht schnell auf, wobei Metallsilikate entstehen. Von den Elementen wird sie bei Raumtemperatur nur von Fluor unter Bildung von Siliciumtetrafluorid angegriffen: Wasserstoff und Kohlenstoff reagieren ebenfalls, benötigen dafür aber Temperaturen über 1000 °C. Siliciumdioxid reagiert jedoch mit zahlreichen Metall- und Metalloidoxiden zu einer Vielzahl von Verbindungen, die vor allem in der Glas- und Keramikindustrie von Bedeutung sind, aber auch viele andere Verwendungszwecke haben: So wird Natriumsilicat aufgrund seiner puffernden, verseifenden und emulgierenden Eigenschaften häufig in Waschmitteln verwendet ⓘ
Die gesamte Erde besteht mit einem Massenanteil von etwa 15 % aus Silicium; insbesondere der Erdmantel setzt sich zu einem beträchtlichen Anteil aus silicatischen Gesteinsschmelzen zusammen. Die Erdkruste besteht mit einem Massenanteil von etwa 25,8 % aus Silicium. Damit ist Silicium das zweithäufigste chemische Element nach dem Sauerstoff und kommt hauptsächlich in silicatischen Mineralen oder als reines Siliciumdioxid auf. So besteht Sand vorwiegend aus Siliciumdioxid und Quarz ist reines Siliciumdioxid. ⓘ
Da Silicium in der Natur auch in gediegener, das heißt elementarer Form vorkommt, ist es bei der International Mineralogical Association (IMA) als Mineral anerkannt und wird in der Strunz’schen Mineralsystematik (9. Auflage) unter der System-Nr. 1.CB.15 (8. Auflage: I/B.05-10) in der Abteilung der Halbmetalle und Nichtmetalle geführt. In der vorwiegend im englischen Sprachraum bekannten Systematik der Minerale nach Dana trägt das Element-Mineral die System-Nr. 01.03.07.01. ⓘ
Gediegenes Silicium konnte bisher (Stand: 2011) an 15 Fundorten nachgewiesen werden, davon erstmals in der Lagerstätte Nuevo Potosí auf Kuba. Weitere Fundorte liegen in der Volksrepublik China, Russland, der Türkei und in den Vereinigten Staaten. ⓘ
Kieselsäuren
Silicatische Mineralien werden permanent durch Reaktion mit der Kohlensäure des Wassers zu Metakieselsäure und Carbonaten abgebaut, wie am Beispiel des Calciumsilicats gezeigt werden kann:
Die unlösliche Metakieselsäure reagiert weiter mit Kohlensäure zu löslicher Orthokieselsäure:
Allerdings reagiert Orthokieselsäure mit sich selbst schnell wieder zu (amorphem) Siliciumdioxid und Wasser, sofern der pH-Wert ≥ 3 ist. Die absolute Konzentration der Orthokieselsäure ist gering (z. B. < ca. 7 mmol in Meerwasser). ⓘ
Durch Einbau von Kieselsäure oder wasserlöslichen Silicaten in Meeresorganismen (1.), die nach dem Absterben auf den Meeresboden, durch Vulkanismus oder Austritt von Magma am Meeresboden sedimentieren, werden die silicatischen Mineralien wieder zurückgebildet (2.) und der Kreislauf ist geschlossen:
Der Zeithorizont, in dem dieser Prozess stattfindet, beträgt mehrere Millionen Jahre, ist also beträchtlich länger als im Fall des Kohlenstoffkreislaufs der belebten Natur. ⓘ
Silikat-Mineralien
| CN 4 | LiI (59) |
BeII (27) | AlIII (39) | SiIV (26) | |
|---|---|---|---|---|---|
| CN 6 | NaI (102) | MgII (72) | AlIII (54) | TiIV (61) | FeII (78) |
| CN 8 | KI (151) | CaII (112) | |||
| CN 12 | KI (164) |
Etwa 95 % der Gesteine der Erdkruste bestehen aus Siliciumdioxid oder Silicat- und Alumosilicatmineralien, was sich darin widerspiegelt, dass Sauerstoff, Silicium und Aluminium die drei häufigsten Elemente in der Kruste sind (in dieser Reihenfolge). Gemessen an der Masse macht Silizium 27,7 % der Erdkruste aus. Reine Siliziumkristalle kommen in der Natur nur sehr selten vor. Eine bemerkenswerte Ausnahme sind Kristalle mit einem Durchmesser von bis zu 0,3 mm, die bei der Entnahme von Gasproben aus dem Vulkan Kudriavy auf Iturup, einer der Kurileninseln, gefunden wurden. ⓘ
Silikat- und Alumosilikatminerale weisen viele verschiedene Strukturen und unterschiedliche Stöchiometrien auf, können aber nach einigen allgemeinen Grundsätzen klassifiziert werden. Tetraedrische {SiO4}-Einheiten sind fast allen diesen Verbindungen gemeinsam, entweder als diskrete Strukturen oder durch die gemeinsame Nutzung von Ecksauerstoffatomen zu größeren Einheiten verbunden. Diese können unterteilt werden in neso-Silikate (diskrete {SiO4}-Einheiten) ohne gemeinsame Sauerstoffatome, soro-Silikate (diskrete {Si2O7}-Einheiten) mit einem gemeinsamen Sauerstoffatom, cyclo-Silikate (geschlossene Ringstrukturen) und ino-Silikate (kontinuierliche Ketten- oder Bandstrukturen) mit zwei gemeinsamen Atomen, phyllo-Silikate (kontinuierliche Blätter) mit drei gemeinsamen Atomen und tecto-Silikate (kontinuierliche dreidimensionale Gerüste) mit vier gemeinsamen Atomen. Das sich daraus ergebende Gitter aus Sauerstoffatomen ist in der Regel dicht gepackt oder nahe daran, wobei die Ladung durch andere Kationen an verschiedenen polyedrischen Stellen je nach Größe ausgeglichen wird. ⓘ
Die Orthosilikate MII
2SiO
4 (M = Be, Mg, Mn, Fe, Zn) und ZrSiO4 sind neso-Silikate. Be
2SiO
4 (Phenakit) ist ungewöhnlich, da sowohl BeII als auch SiIV tetraedrische, vierfach koordinierte Plätze besetzen; die anderen zweiwertigen Kationen besetzen stattdessen sechsfach koordinierte oktaedrische Plätze und ersetzen sich oft isomorph, wie in Olivin, (Mg,Fe,Mn)2SiO4. Zirkon, ZrSiO4, erfordert aufgrund der Stöchiometrie und wegen seines größeren Ionenradius (84 pm) eine Acht-Koordination der ZrIV-Kationen. Ebenfalls von Bedeutung sind die Granate, [MII
3MIII
2(SiO
4)
3], in denen die zweiwertigen Kationen (z. B. Ca, Mg, Fe) achtfach koordiniert sind und die dreiwertigen sechsfach koordiniert sind (z. B. Al, Cr, Fe). Eine regelmäßige Koordinierung ist nicht immer gegeben: So ist sie beispielsweise nicht in Ca2SiO4 zu finden, wo sechs- und achtkoordinierte Stellen für CaII gemischt sind. Sorosilikate mit diskreten zwei- oder dreifach tetraedrischen Einheiten sind recht selten: Metasilikate mit zyklischen "[(SiO3)n]2n-"-Einheiten aus aneinanderstoßenden Tetraedern, die einen polygonalen Ring bilden, sind ebenfalls bekannt. ⓘ
Kettenmetasilikate, {SiO2-
3}
∞, bilden sich durch Eckenteilung einer unendlichen Kette von miteinander verbundenen {SiO4}-Tetraedern. Viele Unterschiede ergeben sich aus den unterschiedlichen Wiederholungsabständen der Konformation in der Tetraederreihe. Am häufigsten ist ein Wiederholungsabstand von zwei, wie bei den meisten Pyroxenmineralen, aber auch Wiederholungsabstände von eins, drei, vier, fünf, sechs, sieben, neun und zwölf sind bekannt. Diese Ketten können dann miteinander verbunden werden, um Doppelketten und Bänder zu bilden, wie in den Asbestmineralen, die wiederholte Ketten von zyklischen Tetraederringen enthalten. ⓘ

Schichtsilikate, wie die Tonminerale und Glimmer, sind sehr häufig und werden oft durch horizontale Vernetzung von Metasilikatketten oder durch flächige Kondensation kleinerer Einheiten gebildet. Ein Beispiel ist Kaolinit [Al2(OH)4Si2O5]; in vielen dieser Minerale ist der Austausch von Kationen und Anionen üblich, so dass zum Beispiel tetraedrisches SiIV durch AlIII, oktaedrisches AlIII durch MgII und OH- durch F- ersetzt werden kann. Dreidimensionale Gerüst-Aluminiumsilikate sind strukturell sehr komplex; man kann sich vorstellen, dass sie von der SiO2-Struktur ausgehen, aber nachdem sie bis zur Hälfte der SiIV-Atome durch AlIII ersetzt haben, müssen mehr Kationen in die Struktur aufgenommen werden, um die Ladung auszugleichen. Beispiele hierfür sind Feldspäte (die häufigsten Mineralien auf der Erde), Zeolithe und Ultramarine. Viele Feldspäte können als Teil des ternären Systems NaAlSi3O8-KAlSi3O8-CaAl2Si2O8 betrachtet werden. Diese Reaktion, die Feldspäte zerstört, könnte ein Grund für die Mohorovičić-Diskontinuität sein, was bedeuten würde, dass die Kruste und der Mantel dieselbe chemische Zusammensetzung, aber unterschiedliche Gitter haben, obwohl dies keine allgemein gültige Meinung ist. Zeolithe haben viele polyedrische Hohlräume in ihren Gerüsten (am häufigsten sind abgestumpfte Kuboktaeder, aber auch andere Polyeder sind als Zeolith-Hohlräume bekannt), die es ihnen ermöglichen, lose gebundene Moleküle wie Wasser in ihre Struktur aufzunehmen. Ultramarine enthalten abwechselnd Silicium- und Aluminiumatome und eine Vielzahl anderer Anionen wie Cl-, SO2-
4 und S2-
2, sind aber ansonsten den Feldspäten ähnlich. ⓘ
Andere anorganische Verbindungen
Siliciumdisulfid (SiS2) entsteht durch Verbrennen von Silicium in gasförmigem Schwefel bei 100 °C; die Sublimation der entstehenden Verbindung in Stickstoff führt zu weißen, flexiblen, langen Fasern, die an Asbest erinnern und eine ähnliche Struktur wie W-Siliciumdioxid aufweisen. Dieses schmilzt bei 1090 °C und sublimiert bei 1250 °C; bei hoher Temperatur und hohem Druck wandelt es sich in eine Kristallstruktur um, die der von Cristobalit ähnelt. SiS2 weist jedoch nicht die Strukturvielfalt von SiO2 auf und wird schnell zu Kieselsäure und Schwefelwasserstoff hydrolysiert. Außerdem wird es durch flüssigen Ammoniak schnell und vollständig ammonolysiert, wobei ein Imid entsteht:
- SiS2 + 4 NH3 → Si(NH)2 + 2 NH4SH
Es reagiert mit den Sulfiden von Natrium, Magnesium, Aluminium und Eisen unter Bildung von Metallthiosilikaten: Bei der Reaktion mit Ethanol entstehen Tetraethylsilikat Si(OEt)4 und Schwefelwasserstoff. Ethylsilikat ist nützlich, da durch seine kontrollierte Hydrolyse klebrige oder filmartige Formen von Kieselsäure entstehen. Bei der Reaktion von Schwefelwasserstoff mit Siliciumtetrahalogeniden entstehen Siliciumthiohalogenide wie S(SiCl)3, das zyklische Cl2Si(μ-S)2SiCl2 und das kristalline (SiSCl2)4. Trotz der Regel der Doppelbindung wurden stabile Organosilanethione RR'Si=S dank des stabilisierenden Mechanismus der intermolekularen Koordination über eine Amingruppe hergestellt. ⓘ
Siliciumnitrid, Si3N4, kann durch direkte Reaktion von Silicium mit Stickstoff bei einer Temperatur von über 1300 °C gebildet werden, aber eine wirtschaftlichere Herstellungsmethode ist das Erhitzen von Siliciumdioxid und Koks in einem Strom aus Stickstoff und Wasserstoffgas bei 1500 °C. Siliciumdioxid wäre eine vielversprechende Keramik, wäre da nicht die Schwierigkeit, es zu bearbeiten und zu sintern: Es ist chemisch nahezu inert und behält selbst bei über 1000 °C seine Festigkeit und Form und ist weiterhin verschleiß- und korrosionsbeständig. Es ist sehr hart (9 auf der Mohs-Härteskala), dissoziiert erst bei 1900 °C bei 1 atm und ist aufgrund seiner kompakten Struktur, die der von Phenakit (Be
2SiO
4). Ein ähnliches feuerfestes Material ist Si2N2O, das durch Erhitzen von Silicium und Siliciumdioxid bei 1450 °C in einem Argonstrom mit 5 % Stickstoff gebildet wird, wobei sich 4-koordinatiges Silicium und 3-koordinatiger Stickstoff in gekräuselten hexagonalen Kacheln abwechseln, die durch nichtlineare Si-O-Si-Bindungen miteinander verbunden sind. ⓘ
Bei der Reaktion von Silylhalogeniden mit Ammoniak oder Alkylammoniak-Derivaten in der Gasphase oder in ethanolischer Lösung entstehen verschiedene flüchtige Silylamide, die Silizium-Analoga der Amine sind:
- 3 SiH3Cl + 4 NH3 → N(SiH3)3 + 3 NH4Cl
- SiH3Br + 2 Me2NH → SiH3NMe2 + Me2NH2Br
- 4 SiH3I + 5 N2H4 → (SiH3)2NN(SiH3)2 + 4 N2H5I ⓘ
Es wurden viele solcher Verbindungen hergestellt, wobei die einzige bekannte Einschränkung darin besteht, dass der Stickstoff immer tertiär ist und Arten, die die SiH-NH-Gruppe enthalten, bei Raumtemperatur instabil sind. Die Stöchiometrie um das Stickstoffatom in Verbindungen wie N(SiH3)3 ist planar, was auf eine pπ-dπ-Wechselwirkung zwischen einem einsamen Paar am Stickstoff und einem leeren dπ-Orbital am Silicium zurückgeführt wird. In ähnlicher Weise sind Trisilylamine als Liganden schwächer als ihre Kohlenstoffanaloga, die tertiären Amine, obwohl die Substitution einiger SiH3-Gruppen durch CH3-Gruppen diese Schwäche abschwächt. So bildet beispielsweise N(SiH3)3 überhaupt kein Addukt mit BH3, während MeN(SiH3)2 und Me2NSiH3 bei niedrigen Temperaturen Addukte bilden, die sich bei Erwärmung zersetzen. Es sind einige Siliciumanaloga von Iminen mit einer Si=N-Doppelbindung bekannt: Das erste gefundene But2Si=N-SiBut3 wurde 1986 entdeckt. ⓘ

Siliciumcarbid (SiC) wurde erstmals 1891 von Edward Goodrich Acheson hergestellt, der es Karborundum nannte, um auf seine mittlere Härte und Abriebfestigkeit zwischen Diamant (einem Allotrop des Kohlenstoffs) und Korund (Aluminiumoxid) hinzuweisen. Bald darauf gründete er ein Unternehmen, das es herstellte, und heute werden jährlich etwa eine Million Tonnen produziert. Siliziumkarbid gibt es in etwa 250 kristallinen Formen. Der Polymorphismus von SiC ist durch eine große Familie ähnlicher kristalliner Strukturen gekennzeichnet, die Polytypen genannt werden. Dabei handelt es sich um Varianten derselben chemischen Verbindung, die in zwei Dimensionen identisch sind und sich in der dritten unterscheiden. Man kann sie also als Schichten betrachten, die in einer bestimmten Reihenfolge übereinander liegen. Es wird industriell durch Reduktion von Quarzsand mit überschüssigem Koks oder Anthrazit bei 2000-2500 °C in einem Elektroofen hergestellt:
- SiO2 + 2 C → Si + 2 CO
- Si + C → SiC ⓘ
Es handelt sich um die thermisch stabilste binäre Siliciumverbindung, die sich erst ab etwa 2700 °C unter Verlust von Silicium zersetzt. Es ist gegen die meisten wässrigen Säuren beständig, mit Ausnahme von Phosphorsäure. Es bildet an der Oberfläche eine Schutzschicht aus Siliciumdioxid und oxidiert daher erst oberhalb von 1000 °C nennenswert an der Luft; die Entfernung dieser Schicht durch geschmolzene Hydroxide oder Carbonate führt zu einer schnellen Oxidation. Siliciumcarbid wird schnell von Chlorgas angegriffen, das bei 100 °C SiCl4 und Kohlenstoff bildet und bei 1000 °C SiCl4 und CCl4. Siliciumcarbid wird hauptsächlich als Schleifmittel und feuerfestes Material verwendet, da es chemisch stabil und sehr widerstandsfähig ist und beim Brechen eine sehr scharfe Schneidkante bildet. Es eignet sich auch als intrinsischer Halbleiter und, wenn es dotiert ist, als extrinsischer Halbleiter. Durch sein diamantähnliches Verhalten veranschaulicht es die chemische Ähnlichkeit zwischen Kohlenstoff und Silizium. ⓘ
Siliziumorganische Verbindungen

Da die Si-C-Bindung ähnlich stark ist wie die C-C-Bindung, sind siliciumorganische Verbindungen in der Regel thermisch und chemisch sehr stabil. So kann Tetraphenylsilan (SiPh4) selbst bei seinem Siedepunkt von 428 °C an der Luft destilliert werden, ebenso wie seine substituierten Derivate Ph3SiCl und Ph2SiCl2, die bei 378 °C bzw. 305 °C sieden. Da Kohlenstoff und Silicium chemisch verwandt sind, weist die siliciumorganische Chemie einige signifikante Ähnlichkeiten mit der Kohlenstoffchemie auf, z. B. in der Neigung solcher Verbindungen zur Verkettung und zur Bildung von Mehrfachbindungen. Es gibt jedoch auch bedeutende Unterschiede: Da Silicium elektropositiver ist als Kohlenstoff, sind Bindungen zu elektronegativeren Elementen bei Silicium im Allgemeinen stärker als bei Kohlenstoff und umgekehrt. So ist die Si-F-Bindung wesentlich stärker als die C-F-Bindung und gehört zu den stärksten Einfachbindungen, während die Si-H-Bindung viel schwächer als die C-H-Bindung ist und leicht gebrochen werden kann. Darüber hinaus hat Silicium nicht die gleiche Fähigkeit wie Kohlenstoff, sein Oktett zu erweitern, so dass einige siliciumorganische Reaktionen keine organischen Entsprechungen haben. Ein nukleophiler Angriff auf Silicium läuft beispielsweise nicht nach dem SN2- oder SN1-Verfahren ab, sondern über ein negativ geladenes, echtes pentakoordiniertes Zwischenprodukt und wirkt wie eine Substitution an einem gehinderten tertiären Atom. Dies funktioniert bei Silicium anders als bei Kohlenstoff, weil die langen Si-C-Bindungen die sterische Hinderung verringern und das d-Orbital von Silicium geometrisch nicht für einen nukleophilen Angriff gezwungen ist, anders als beispielsweise ein C-O σ*-Antibindungsorbital. Trotz dieser Unterschiede wird der Mechanismus der Einfachheit halber oft als "SN2 am Silicium" bezeichnet. ⓘ
Eine der nützlichsten siliciumhaltigen Gruppen ist Trimethylsilyl, Me3Si-. Die Si-C-Bindung, die sie mit dem Rest des Moleküls verbindet, ist relativ stark, so dass sie bestehen bleibt, während der Rest des Moleküls Reaktionen durchläuft, aber sie ist nicht so stark, dass sie nicht bei Bedarf gezielt entfernt werden kann, zum Beispiel durch das Fluoridion, das ein sehr schwaches Nukleophil für Kohlenstoffverbindungen, aber ein sehr starkes für Organosiliciumverbindungen ist. Es kann mit sauren Protonen verglichen werden; während Trisilylmethyl durch harte Nukleophile anstelle von Basen entfernt wird, fördern beide Entfernungen normalerweise die Eliminierung. Generell gilt: Während gesättigter Kohlenstoff am besten von Nukleophilen angegriffen wird, die neutrale Verbindungen sind oder auf Nichtmetallen weit unten im Periodensystem basieren (z. B. Schwefel, Selen oder Jod), oder sogar von beiden, wird Silicium am besten von geladenen Nukleophilen angegriffen, insbesondere von solchen, die hoch elektronegative Nichtmetalle wie Sauerstoff, Fluor oder Chlor enthalten. Beispielsweise reagieren Enolate in Halogenalkanen am Kohlenstoff, in Silylchloriden jedoch am Sauerstoff; und wenn Trimethylsilyl aus einem organischen Molekül mit Hilfe von Hydroxid als Nucleophil entfernt wird, ist das Produkt der Reaktion nicht das Silanol, wie man es in Analogie zur Kohlenstoffchemie erwarten würde, denn das Siloxid ist stark nucleophil und greift das ursprüngliche Molekül an, um den Silylether Hexamethyldisiloxan, (Me3Si)2O, zu ergeben. Während die SN2-Reaktion durch das Vorhandensein einer partiellen positiven Ladung (δ+) am Kohlenstoff weitgehend unbeeinflusst bleibt, ist die analoge "SN2"-Reaktion am Silicium davon betroffen. So sind beispielsweise die Silyltriflate so elektrophil, dass sie 108 bis 109 Mal schneller als Silylchloride mit sauerstoffhaltigen Nukleophilen reagieren. Trimethylsilyltriflat ist insbesondere eine sehr gute Lewis-Säure und wird verwendet, um Carbonylverbindungen in Acetale und Silylenolether umzuwandeln, wobei sie analog zur Aldolreaktion miteinander reagieren. ⓘ
Si-C-Bindungen werden in der Regel auf drei Arten gebildet. Im Labor erfolgt die Herstellung häufig in kleinen Mengen durch Reaktion von Tetrachlorsilan (Siliciumtetrachlorid) mit Organolithium-, Grignard- oder Organoaluminium-Reagenzien oder durch katalytische Addition von Si-H über C=C-Doppelbindungen. Der zweite Weg hat den Nachteil, dass er für die wichtigsten Silane, die Methyl- und Phenylsilane, nicht anwendbar ist. Organosilane werden industriell durch direkte Reaktion von Alkyl- oder Arylhalogeniden mit Silicium und 10 Gew.-% metallischem Kupfer als Katalysator hergestellt. Die resultierenden Organosilane sind oft wesentlich reaktiver als ihre Kohlenstoffverwandten und lassen sich leicht hydrolysieren, ammonolysieren, alkoholysieren und kondensieren, um zyklische Oligomere oder lineare Polymere zu bilden. ⓘ
Siliconpolymere
Der Begriff "Silikon" wurde erstmals von Frederic Kipping im Jahr 1901 verwendet. Er erfand den Begriff, um die Ähnlichkeit der chemischen Formeln von Ph2SiO und Benzophenon, Ph2CO, zu verdeutlichen, betonte aber auch die fehlende chemische Ähnlichkeit aufgrund der polymeren Struktur von Ph2SiO, die Ph2CO nicht aufweist. ⓘ
Silikone können als Analogie zu Mineralsilikaten betrachtet werden, bei denen die Methylgruppen der Silikone den isoelektronischen O- der Silikate entsprechen. Sie sind recht stabil gegenüber extremen Temperaturen, Oxidation und Wasser und haben nützliche dielektrische, Antihaft- und Antischaumeigenschaften. Darüber hinaus sind sie über lange Zeiträume hinweg beständig gegen ultraviolette Strahlung und Witterungseinflüsse und physiologisch gesehen inert. Sie sind relativ unreaktiv, reagieren aber mit konzentrierten Lösungen, die Hydroxidionen und Fluorierungsmittel enthalten, und können gelegentlich sogar als milde Reagenzien für selektive Synthesen verwendet werden. So eignet sich (Me3Si)2O beispielsweise für die Herstellung von Molybdän- und Wolframoxidhalogenid-Derivaten, indem es eine Wolframhexachlorid-Suspension in Dichlorethan-Lösung in weniger als einer Stunde bei Raumtemperatur quantitativ in WOCl4 und anschließend bei 100 °C in Petrolether über Nacht mit einer Ausbeute von 95 % in gelbes WO2Cl2 umwandelt. ⓘ
Vorkommen

Silicium ist nach Wasserstoff, Helium, Kohlenstoff, Stickstoff, Sauerstoff, Eisen und Neon das achthäufigste Element im Universum. Diese Häufigkeiten lassen sich auf der Erde nicht gut reproduzieren, da bei der Entstehung des Sonnensystems eine erhebliche Trennung der Elemente stattgefunden hat. Silizium macht 27,2 % des Gewichts der Erdkruste aus und steht damit an zweiter Stelle nach Sauerstoff (45,5 %), mit dem es in der Natur immer vergesellschaftet ist. Eine weitere Fraktionierung fand bei der Entstehung der Erde durch planetarische Differenzierung statt: Der Erdkern, der 31,5 % der Erdmasse ausmacht, hat die ungefähre Zusammensetzung Fe25Ni2Co0,1S3; der Erdmantel macht 68,1 % der Erdmasse aus und besteht zumeist aus dichteren Oxiden und Silikaten, wie z. B. Olivin, (Mg,Fe)2SiO4; die leichteren silikatischen Minerale, wie z. B. Alumosilikate, steigen an die Oberfläche und bilden die Kruste, die 0,4 % der Erdmasse ausmacht. ⓘ
Die Kristallisation von Eruptivgestein aus Magma hängt von einer Reihe von Faktoren ab; dazu gehören die chemische Zusammensetzung des Magmas, die Abkühlungsgeschwindigkeit und einige Eigenschaften der einzelnen zu bildenden Minerale, wie z. B. die Gitterenergie, der Schmelzpunkt und die Komplexität ihrer Kristallstruktur. Bei der Abkühlung des Magmas tritt Olivin zuerst auf, gefolgt von Pyroxen, Amphibol, Biotitglimmer, Orthoklas-Feldspat, Muskovitglimmer, Quarz, Zeolithen und schließlich hydrothermalen Mineralen. Diese Abfolge zeigt einen Trend zu immer komplexeren Silikateinheiten mit der Abkühlung und der Einführung von Hydroxid- und Fluoridanionen zusätzlich zu den Oxiden. Viele Metalle können das Silizium ersetzen. Nachdem diese Eruptivgesteine verwittert, transportiert und abgelagert worden sind, bilden sich Sedimentgesteine wie Ton, Schiefer und Sandstein. Metamorphose kann auch bei hohen Temperaturen und Drücken stattfinden, wodurch eine noch größere Vielfalt an Mineralien entsteht. ⓘ
Es gibt vier Quellen für den Eintrag von Silizium in den Ozean: chemische Verwitterung von kontinentalem Gestein, Transport durch Flüsse, Auflösung kontinentaler terrigener Silikate und durch die Reaktion zwischen submarinen Basalten und hydrothermalen Flüssigkeiten, die gelöstes Silizium freisetzen. Alle vier Ströme sind im biogeochemischen Kreislauf des Ozeans miteinander verbunden, da sie alle ursprünglich durch die Verwitterung der Erdkruste entstanden sind. ⓘ
Jährlich werden etwa 300-900 Megatonnen Äolischer Staub in den Weltmeeren abgelagert. Davon liegen 80-240 Megatonnen in Form von Siliziumpartikeln vor. Die Gesamtmenge an Silizium, die in Form von Partikeln in den Ozean gelangt, ist immer noch geringer als die Menge an Silizium, die über die Flüsse in den Ozean gelangt. Äolische Einträge von partikulärem lithogenem Silizium in den Nordatlantik und den westlichen Nordpazifik sind das Ergebnis von Staub, der sich aus der Sahara bzw. der Wüste Gobi auf den Ozeanen absetzt. Flüsse sind die Hauptquelle für den Siliziumeintrag in den Ozean in den Küstenregionen, während die Siliziumablagerung im offenen Ozean in hohem Maße durch die Ablagerung von äolischem Staub beeinflusst wird. ⓘ
Silicium in der belebten Natur
Neben der bereits erwähnten essentiellen Natur des Siliciums gibt es eine Reihe von Lebewesen, die siliciumdioxidhaltige Strukturen erzeugen. Am bekanntesten sind dabei die Kieselalgen (Diatomeen), Schwämme (Porifera, Spongiaria) und Radiolarien, die sich durch enzymkatalysierte Kondensation von Orthokieselsäure Si(OH)4 ein Exoskelett aus Siliciumdioxid aufbauen. Auch viele Pflanzen enthalten in ihren Stängeln und Blättern Siliciumdioxid. Bekannte Beispiele sind hier der Schachtelhalm und die Bambuspflanze. Durch das aufgebaute Siliciumdioxidgerüst erhalten diese zusätzliche Stabilität. ⓘ
Herstellung
Silicium mit einem Reinheitsgrad von 96-99 % wird durch Reduktion von Quarzit oder Sand mit hochreinem Koks hergestellt. Die Reduktion erfolgt in einem elektrischen Lichtbogenofen, wobei ein Überschuss an SiO2 verwendet wird, um die Anreicherung von Siliciumcarbid (SiC) zu verhindern:
- SiO2 + 2 C → Si + 2 CO
- 2 SiC + SiO2 → 3 Si + 2 CO ⓘ
Diese als carbothermische Reduktion von Siliciumdioxid bezeichnete Reaktion wird in der Regel in Gegenwart von Eisenschrott mit geringen Mengen an Phosphor und Schwefel durchgeführt, wodurch Ferrosilicium entsteht. Ferrosilicium, eine Eisen-Silicium-Legierung, die ein unterschiedliches Verhältnis von elementarem Silicium und Eisen enthält, macht etwa 80 % der weltweiten Produktion von elementarem Silicium aus, wobei China, der führende Lieferant von elementarem Silicium, 4,6 Millionen Tonnen (oder 2/3 der Weltproduktion) Silicium liefert, den größten Teil davon in Form von Ferrosilicium. Es folgen Russland (610.000 t), Norwegen (330.000 t), Brasilien (240.000 t) und die Vereinigten Staaten (170.000 t). Ferrosilicium wird in erster Linie von der Eisen- und Stahlindustrie (siehe unten) verwendet, vor allem als Legierungszusatz in Eisen oder Stahl und zur Desoxidation von Stahl in integrierten Stahlwerken. ⓘ
Eine weitere, manchmal verwendete Reaktion ist die aluminothermische Reduktion von Siliciumdioxid, die wie folgt verläuft:
- 3 SiO2 + 4 Al → 3 Si + 2 Al2O3 ⓘ
Durch Auslaugen von pulverisiertem 96-97 % reinem Silizium mit Wasser erhält man ~98,5 % reines Silizium, das in der chemischen Industrie verwendet wird. Für Halbleiteranwendungen ist jedoch eine noch höhere Reinheit erforderlich, die durch die Reduktion von Tetrachlorsilan (Siliciumtetrachlorid) oder Trichlorsilan erreicht wird. Tetrachlorsilan wird durch Chlorierung von Siliziumabfällen hergestellt, während Trichlorsilan ein Nebenprodukt der Silikonherstellung ist. Diese Verbindungen sind flüchtig und können daher durch wiederholte fraktionierte Destillation und anschließende Reduktion zu elementarem Silicium mit hochreinem Zinkmetall als Reduktionsmittel gereinigt werden. Die so entstandenen schwammigen Siliziumstücke werden geschmolzen und dann zu zylindrischen Einkristallen gezüchtet, bevor sie durch Zonenraffination gereinigt werden. Andere Verfahren nutzen die thermische Zersetzung von Silan oder Tetrajodsilan (SiI
4). Ein weiteres Verfahren ist die Reduktion von Natriumhexafluorsilikat, einem üblichen Abfallprodukt der Phosphatdüngerindustrie, durch metallisches Natrium: Dieses Verfahren ist sehr exotherm und erfordert daher keine externe Brennstoffquelle.
Silizium-Nanostrukturen können direkt aus Siliziumdioxid durch herkömmliche metallothermische Verfahren oder durch Verbrennungssynthese hergestellt werden. Solche nanostrukturierten Siliziummaterialien können in verschiedenen funktionellen Anwendungen eingesetzt werden, z. B. als Anode von Lithium-Ionen-Batterien oder in der Phorokatalyse. ⓘ
Hyperfeines Silizium wird mit einem höheren Reinheitsgrad als fast jedes andere Material hergestellt: Für die Herstellung von Transistoren sind Verunreinigungsgrade in Siliziumkristallen von weniger als 1 Teil pro 1010 erforderlich, und in speziellen Fällen werden Verunreinigungsgrade von weniger als 1 Teil pro 1012 benötigt und erreicht. Silizium-Nanostrukturen können direkt aus Quarzsand mit Hilfe der Verbrennungssynthese hergestellt werden. Solche nanostrukturierten Siliziummaterialien können als Anode von Lithium-Ionen-Batterien (LIBs) verwendet werden. ⓘ

Hochreaktives amorphes Silicium kann durch Reduktion mit Natrium oder Acidolyse von Siliciden erhalten werden:
Anwendungen
Verbindungen
Das meiste Silizium wird industriell verwendet, ohne gereinigt zu werden, und zwar oft mit vergleichsweise geringer Aufbereitung aus seiner natürlichen Form. Mehr als 90 % der Erdkruste besteht aus Silikatmineralien, die Verbindungen aus Silizium und Sauerstoff sind, oft mit metallischen Ionen, wenn negativ geladene Silikatanionen Kationen zum Ausgleich der Ladung benötigen. Viele dieser Mineralien werden direkt kommerziell genutzt, z. B. Ton, Quarzsand und die meisten Arten von Bausteinen. Die überwiegende Mehrheit der Verwendungszwecke von Silicium sind also strukturelle Verbindungen, entweder in Form von Silicatmineralien oder von Siliciumdioxid (Rohsiliciumdioxid). Silikate werden zur Herstellung von Portlandzement (hauptsächlich aus Kalziumsilikaten) verwendet, der in Mörtel und modernem Stuck zum Einsatz kommt, aber vor allem in Verbindung mit Quarzsand und Kies (der in der Regel Silikatmineralien wie Granit enthält) zur Herstellung von Beton, der die Grundlage für die meisten der größten industriellen Bauprojekte der modernen Welt ist. ⓘ
Siliciumdioxid wird zur Herstellung von Schamottesteinen, einer Art von Keramik, verwendet. Silikatmineralien sind auch in Weißzeugkeramik enthalten, einer wichtigen Produktklasse, die in der Regel verschiedene Arten von gebrannten Tonmineralien (natürliche Aluminiumphyllosilikate) enthält. Ein Beispiel dafür ist Porzellan, das auf dem Silikatmineral Kaolinit basiert. Herkömmliches Glas (Natron-Kalk-Glas auf Siliziumdioxid-Basis) hat viele der gleichen Funktionen und wird auch für Fenster und Behälter verwendet. Darüber hinaus werden spezielle Glasfasern auf Siliziumdioxidbasis für optische Fasern sowie zur Herstellung von Glasfasern für strukturelle Zwecke und von Glaswolle für die Wärmedämmung verwendet. ⓘ
Silikone werden häufig in Abdichtungsmitteln, Formmassen, Trennmitteln, mechanischen Dichtungen, Hochtemperaturfetten und -wachsen sowie Dichtungsmassen verwendet. Silikon wird manchmal auch in Brustimplantaten, Kontaktlinsen, Sprengstoffen und Pyrotechnik verwendet. Silly Putty wurde ursprünglich durch Zugabe von Borsäure zu Silikonöl hergestellt. Andere Siliziumverbindungen dienen als hochtechnologische Schleifmittel und neue hochfeste Keramiken auf der Grundlage von Siliziumkarbid. Silicium ist ein Bestandteil einiger Superlegierungen. ⓘ
Legierungen
Elementares Silizium wird geschmolzenem Gusseisen in Form von Ferrosilizium oder Silizium-Calcium-Legierungen zugesetzt, um die Leistung beim Gießen dünner Abschnitte zu verbessern und die Bildung von Zementit zu verhindern, wenn es der Außenluft ausgesetzt ist. Das Vorhandensein von elementarem Silizium im geschmolzenen Eisen wirkt als Sauerstoffsenke, so dass der Kohlenstoffgehalt des Stahls, der für jede Stahlsorte innerhalb enger Grenzen gehalten werden muss, besser kontrolliert werden kann. Die Herstellung und Verwendung von Ferrosilicium wird von der Stahlindustrie überwacht, und obwohl diese Form von elementarem Silicium sehr unrein ist, macht sie 80 % des weltweiten Verbrauchs an freiem Silicium aus. Silizium ist ein wichtiger Bestandteil von Elektrostahl und verändert dessen Widerstand und ferromagnetische Eigenschaften. ⓘ
Die Eigenschaften von Silizium können zur Modifizierung von Legierungen mit anderen Metallen als Eisen genutzt werden. "Metallurgisches Silizium" ist Silizium mit einem Reinheitsgrad von 95-99 %. Etwa 55 % des weltweiten Verbrauchs an metallurgischem Silizium entfallen auf die Herstellung von Aluminium-Silizium-Legierungen (Silumin-Legierungen) für den Aluminiumguss, die hauptsächlich in der Automobilindustrie verwendet werden. Die Bedeutung von Silizium für den Aluminiumguss liegt darin, dass ein hoher Siliziumanteil (12 %) in Aluminium ein eutektisches Gemisch bildet, das mit sehr geringer thermischer Kontraktion erstarrt. Dadurch wird die Bildung von Rissen und Spannungsrissen beim Abkühlen von Gusslegierungen bis zur Erstarrung erheblich reduziert. Silizium verbessert auch die Härte und damit die Verschleißfestigkeit von Aluminium erheblich. ⓘ
Elektronik
Der größte Teil des produzierten elementaren Siliziums verbleibt als Ferrosiliziumlegierung, und nur etwa 20 % werden auf metallurgische Reinheit aufbereitet (insgesamt 1,3-1,5 Millionen Tonnen/Jahr). Schätzungsweise 15 % der weltweiten Produktion von metallurgischem Silizium werden weiter auf Halbleiterreinheit raffiniert. Dabei handelt es sich in der Regel um "nine-9" oder 99,9999999 % reines, nahezu fehlerfreies einkristallines Material. ⓘ
Monokristallines Silizium dieser Reinheit wird in der Regel nach dem Czochralski-Verfahren hergestellt und zur Produktion von Siliziumscheiben verwendet, die in der Halbleiterindustrie, in der Elektronik und in einigen hochpreisigen und hocheffizienten Photovoltaik-Anwendungen zum Einsatz kommen. Reines Silizium ist ein intrinsischer Halbleiter, was bedeutet, dass es im Gegensatz zu Metallen Elektronenlöcher und Elektronen leitet, die durch Wärme aus den Atomen freigesetzt werden; die elektrische Leitfähigkeit von Silizium steigt mit höheren Temperaturen. Reines Silizium hat eine zu geringe Leitfähigkeit (d. h. einen zu hohen spezifischen Widerstand), um als Schaltungselement in der Elektronik verwendet zu werden. In der Praxis wird reines Silizium mit geringen Konzentrationen bestimmter anderer Elemente dotiert, die seine Leitfähigkeit stark erhöhen und sein elektrisches Verhalten durch Steuerung der Anzahl und Ladung (positiv oder negativ) der aktivierten Ladungsträger beeinflussen. Eine solche Steuerung ist für Transistoren, Solarzellen, Halbleiterdetektoren und andere Halbleiterbauelemente erforderlich, die in der Computerindustrie und anderen technischen Anwendungen eingesetzt werden. In der Silizium-Photonik kann Silizium als kontinuierliches Raman-Lasermedium verwendet werden, um kohärentes Licht zu erzeugen. ⓘ
In gewöhnlichen integrierten Schaltkreisen dient ein Wafer aus monokristallinem Silizium als mechanischer Träger für die Schaltkreise, die durch Dotierung hergestellt und durch dünne Schichten aus Siliziumoxid voneinander isoliert werden, einem Isolator, der leicht auf Si-Oberflächen durch Prozesse der thermischen Oxidation oder der lokalen Oxidation (LOCOS) erzeugt werden kann, bei denen das Element unter den richtigen Bedingungen, die durch das Deal-Grove-Modell vorhergesagt werden können, Sauerstoff ausgesetzt wird. Silizium ist zum beliebtesten Material für Hochleistungshalbleiter und integrierte Schaltungen geworden, da es die höchsten Temperaturen und die größte elektrische Aktivität aushalten kann, ohne einen Lawinendurchbruch zu erleiden (eine Elektronenlawine entsteht, wenn Wärme freie Elektronen und Löcher erzeugt, die wiederum mehr Strom durchlassen, was wiederum mehr Wärme erzeugt). Außerdem ist das isolierende Oxid von Silizium nicht wasserlöslich, was ihm bei bestimmten Herstellungstechniken einen Vorteil gegenüber Germanium (einem Element mit ähnlichen Eigenschaften, das ebenfalls in Halbleiterbauelementen verwendet werden kann) verschafft. ⓘ
Die Herstellung von monokristallinem Silizium ist teuer und in der Regel nur bei der Produktion von integrierten Schaltkreisen gerechtfertigt, wo winzige Kristallfehler die winzigen Leiterbahnen stören können. Für andere Zwecke können andere Arten von reinem Silizium verwendet werden. Dazu gehören hydriertes amorphes Silizium und veredeltes metallurgisches Silizium (UMG-Si), das bei der Herstellung von kostengünstiger, großflächiger Elektronik für Anwendungen wie Flüssigkristallanzeigen und großflächigen, kostengünstigen Dünnschicht-Solarzellen verwendet wird. Solche Halbleiterqualitäten von Silizium sind entweder etwas weniger rein oder polykristallin statt monokristallin und werden in vergleichbaren Mengen wie monokristallines Silizium hergestellt: 75.000 bis 150.000 Tonnen pro Jahr. Der Markt für diese geringere Qualität wächst schneller als der für monokristallines Silizium. Bis 2013 wird die Produktion von polykristallinem Silizium, das hauptsächlich für Solarzellen verwendet wird, voraussichtlich 200.000 Tonnen pro Jahr erreichen, während für monokristallines Silizium für Halbleiter weniger als 50.000 Tonnen pro Jahr erwartet werden. ⓘ
Quantenpunkte
Silizium-Quantenpunkte werden durch die thermische Verarbeitung von Wasserstoffsilsesquioxan zu Nanokristallen von wenigen Nanometern bis zu einigen Mikrometern erzeugt, die größenabhängige Lumineszenzeigenschaften aufweisen. Die Nanokristalle weisen eine große Stokes-Verschiebung auf, die Photonen im ultravioletten Bereich in Photonen im sichtbaren oder infraroten Bereich umwandelt, je nach Partikelgröße, was aufgrund ihrer begrenzten Selbstabsorption Anwendungen in Quantenpunkt-Displays und lumineszierenden Solarkonzentratoren ermöglicht. Ein Vorteil der Verwendung von Quantenpunkten auf Siliziumbasis gegenüber Kadmium oder Indium ist die ungiftige, metallfreie Natur des Siliziums. Eine weitere Anwendung von Silizium-Quantenpunkten ist die Erkennung von Gefahrstoffen. Die Sensoren machen sich die lumineszierenden Eigenschaften der Quantenpunkte zunutze, indem sie die Photolumineszenz in Gegenwart der gefährlichen Substanz löschen. Es gibt viele Methoden zur Erkennung gefährlicher Chemikalien, einige davon sind Elektronentransfer, Fluoreszenzresonanzenergietransfer und Fotostromerzeugung. Elektronentransfer-Löschung tritt auf, wenn das niedrigste unbesetzte Molekülorbital (LUMO) eine geringfügig niedrigere Energie hat als das Leitungsband des Quantenpunkts, was den Elektronentransfer zwischen den beiden ermöglicht und die Rekombination von Löchern und Elektronen innerhalb der Nanokristalle verhindert. Der Effekt kann auch umgekehrt erzielt werden, indem ein Donatormolekül, dessen höchstbesetztes Molekülorbital (HOMO) etwas höher liegt als eine Valenzbandkante des Quantenpunkts, den Elektronentransfer zwischen beiden ermöglicht, wodurch die Löcher gefüllt und die Rekombination verhindert wird. Der Fluoreszenzresonanzenergietransfer findet statt, wenn sich ein Komplex zwischen dem Quantenpunkt und einem Quencher-Molekül bildet. Der Komplex absorbiert weiterhin Licht, aber wenn die Energie in den Grundzustand umgewandelt wird, gibt er kein Photon ab und löscht das Material aus. Die dritte Methode verwendet einen anderen Ansatz, indem sie den von den Quantenpunkten emittierten Photostrom misst, anstatt die photolumineszente Anzeige zu überwachen. Erhöht sich die Konzentration der gewünschten Chemikalie, so ändert sich der von den Nanokristallen abgegebene Photostrom entsprechend. ⓘ
Biologische Rolle

Obwohl Silizium in Form von Silikaten leicht verfügbar ist, verwenden es nur sehr wenige Organismen direkt. Kieselalgen, Radiolarien und Kieselschwämme verwenden biogene Kieselsäure als Strukturmaterial für ihr Skelett. In höher entwickelten Pflanzen sind die Siliziumdioxid-Phytolithen (Opal-Phytolithen) starre mikroskopische Körper, die in der Zelle vorkommen; einige Pflanzen, z. B. Reis, benötigen Silizium für ihr Wachstum. Es hat sich gezeigt, dass Silizium bei einigen Pflanzen die Festigkeit der Zellwände und die strukturelle Integrität verbessert. ⓘ
Es ist bekannt, dass mehrere Gartenbaupflanzen sich mit Silizium gegen Pilzkrankheiten schützen, und zwar in einem solchen Maße, dass die Anwendung von Fungiziden fehlschlagen kann, wenn sie nicht von einer ausreichenden Siliziumzufuhr begleitet wird. Siliziumhaltige Pflanzenabwehrmoleküle aktivieren einige Phytoalexine, d. h. einige von ihnen sind Signalstoffe, die eine erworbene Immunität erzeugen. Bei einem Mangel an Silizium produzieren einige Pflanzen als Ersatz andere Abwehrstoffe. ⓘ
Mikrobielle Einflüsse aus dem Meer
Kieselalgen verwenden Silizium in Form von biogenem Siliziumdioxid (BSIO2), das vom Siliziumtransportprotein (SIT) aufgenommen wird, um vorwiegend in der Zellwandstruktur als Frusteln verwendet zu werden. Silizium gelangt in gelöster Form wie Kieselsäure oder Silikat in den Ozean. Da Kieselalgen zu den Hauptnutzern dieser Formen von Silizium gehören, tragen sie in hohem Maße zur Siliziumkonzentration im Ozean bei. Silizium bildet im Ozean ein nährstoffähnliches Profil, was auf die Kieselalgenproduktivität in geringen Tiefen zurückzuführen ist. Daher ist die Siliziumkonzentration im oberen Ozean geringer und im tiefen/unteren Ozean höher. ⓘ
Die Kieselalgenproduktivität im oberen Ozean trägt zur Menge des in den unteren Ozean exportierten Siliziums bei. Wenn Kieselalgenzellen im oberen Ozean lysiert werden, werden ihre Nährstoffe wie Eisen, Zink und Silizium durch einen Prozess namens Meeresschnee in den unteren Ozean gebracht. Bei Meeresschnee werden partikelförmige organische Stoffe durch vertikale Vermischung von gelösten organischen Stoffen nach unten transportiert. Es wurde vermutet, dass Silizium für die Produktivität der Kieselalgen von entscheidender Bedeutung ist. Solange Kieselsäure für die Kieselalgen verfügbar ist, können sie auch zu anderen wichtigen Nährstoffkonzentrationen in der Tiefsee beitragen. ⓘ
In den Küstengebieten sind Kieselalgen die wichtigsten Organismen des Phytoplanktons und tragen in hohem Maße zur biogenen Kieselsäureproduktion bei. Im offenen Ozean hingegen spielen Kieselalgen eine geringere Rolle bei der globalen jährlichen Kieselerdeproduktion. Die Kieselalgen in den subtropischen Wirbeln des Nordatlantiks und des Nordpazifiks tragen nur zu etwa 5-7 % zur globalen jährlichen Siliziumdioxidproduktion im Meer bei. Der Südliche Ozean produziert etwa ein Drittel der globalen marinen biogenen Kieselsäure. Der Südliche Ozean wird als "biogeochemische Kluft" bezeichnet, da nur winzige Mengen an Silizium aus dieser Region transportiert werden. ⓘ
Menschliche Ernährung
Es gibt einige Hinweise darauf, dass Silizium für die menschliche Gesundheit wichtig ist, z. B. für das Nagel-, Haar-, Knochen- und Hautgewebe. So zeigen Studien, dass prämenopausale Frauen mit einer höheren Siliziumzufuhr in der Nahrung eine höhere Knochendichte haben und dass eine Siliziumergänzung das Knochenvolumen und die Knochendichte bei Patienten mit Osteoporose erhöhen kann. Silizium wird für die Synthese von Elastin und Kollagen benötigt, von denen die Aorta die größte Menge im menschlichen Körper enthält, und wurde als essentielles Element angesehen; es ist jedoch schwierig, seine Essenzialität zu beweisen, da Silizium sehr häufig vorkommt und daher Mangelerscheinungen schwer zu reproduzieren sind. ⓘ
Derzeit wird geprüft, ob Silizium von der Association of American Plant Food Control Officials (AAPFCO) in den Status eines "pflanzlichen Nutzstoffs" erhoben werden soll. ⓘ
Sicherheit
Menschen können am Arbeitsplatz mit elementarem Silizium in Berührung kommen, indem sie es einatmen, verschlucken oder mit der Haut oder den Augen in Kontakt kommen. In den beiden letztgenannten Fällen stellt Silizium als Reizstoff eine geringe Gefahr dar. Es ist gefährlich, wenn es eingeatmet wird. Die Occupational Safety and Health Administration (OSHA) hat den gesetzlichen Grenzwert für die Siliziumexposition am Arbeitsplatz auf 15 mg/m3 Gesamtexposition und 5 mg/m3 Atemexposition an einem achtstündigen Arbeitstag festgelegt. Das National Institute for Occupational Safety and Health (NIOSH) hat einen empfohlenen Grenzwert (REL) von 10 mg/m3 Gesamtexposition und 5 mg/m3 Exposition der Atemwege an einem achtstündigen Arbeitstag festgelegt. Das Einatmen von kristallinem Siliziumdioxidstaub kann zu Silikose führen, einer berufsbedingten Lungenerkrankung, die durch Entzündungen und Vernarbungen in Form von knotigen Läsionen in den oberen Lungenflügeln gekennzeichnet ist. ⓘ
Silicium ist als Pulver wie viele Elemente brennbar. Als Pulver und Granulat ist es reizend. Kompaktes Silicium ist ungefährlich. ⓘ
Hydriertes, das heißt oberflächlich mit Wasserstoff bedecktes, poröses Silicium kann unter Lasereinstrahlung und Zunahme von Sauerstoff hochexplosiv sein, wie Forscher der Technischen Universität München zufällig entdeckt haben. Sprengungen im Mikrometerbereich sind möglich. Die Detonationsgeschwindigkeit und Detonationsenergie sind höher als bei TNT und Dynamit. ⓘ
Physiologische Bedeutung für den Menschen
Silicium scheint für Knochenbildung und -reifung benötigt zu werden. Bei Kälbern führte die Gabe von Orthosilicat zur Vermehrung von Kollagen in Haut und Knorpel. Die aus Tierversuchen abgeleitete wünschenswerte Zufuhr liegt bei 30 mg/d. Mangelzustände beim Menschen sind bisher nicht bekannt. ⓘ
Als Kieselerde oder Silicea terra werden Präparate zum Einnehmen angeboten. Sie enthalten im Wesentlichen Kieselsäureanhydride (Siliciumdioxid) und sollen Haut, Nägel, Knochen und Bindegewebe stärken und gesund erhalten. Eine Wirkung ist wissenschaftlich nicht nachgewiesen. ⓘ
Ein Überschuss an Silicium kann zur Hämolyse von Erythrocyten führen und als Folge Zellveränderungen verursachen. Bei stark übersteigerter Einnahme fördert Silicium die Bildung von Harnsteinen. ⓘ
Gewinnung in der Industrie
Elementares Silicium findet in unterschiedlichen Reinheitsgraden Verwendung in der Metallurgie (Ferrosilicium), der Photovoltaik (Solarzellen) und in der Mikroelektronik (Halbleiter, Computerchips). Demgemäß ist es in der Wirtschaft gebräuchlich, elementares Silicium anhand unterschiedlicher Reinheitsgrade zu klassifizieren. Man unterscheidet Simg (metallurgical grade, Rohsilicium, 98–99 % Reinheit), Sisg (solar grade, Solarsilicium, Verunreinigungen kleiner 0,01 %) und Sieg (electronic grade, Halbleitersilicium, Verunreinigungen kleiner 10−9). Für Solarzellen ist die Reinheit des Materials in seiner gesamten Stärke wichtig, um eine möglichst lange Ladungsträger-Lebensdauer zu gewährleisten, für viele Anwendungen in der Mikroelektronik müssen nur die oberen Schichten von etwa 20 bis 30 µm hochrein sein. ⓘ
Traditionell wird das Siemens-Verfahren eingesetzt, bei dem das Silicium zunächst mit gasförmigem Chlorwasserstoff bei 300–350 °C in einem Wirbelschichtreaktor zu Trichlorsilan (Silicochloroform) umgesetzt wird. ⓘ
Nach mehreren Destillationsschritten wird das Trichlorsilan in Anwesenheit von Wasserstoff in einer Umkehrung der obigen Reaktion an beheizten Reinstsiliciumstäben bei 1000–1200 °C wieder thermisch zersetzt. Das elementare Silicium wächst dabei auf die Stäbe auf. Der dabei freiwerdende Chlorwasserstoff wird in den Kreislauf zurückgeführt. Als Nebenprodukt fällt Siliciumtetrachlorid an, das entweder zu Trichlorsilan umgesetzt und in den Prozess zurückgeführt oder in der Sauerstoffflamme zu pyrogener Kieselsäure verbrannt wird. Beim Siemensverfahren entstehen pro kg Reinstsilicium 19 kg Abfall- und Nebenstoffe. ⓘ
Halbleitersilicium

Für Anwendungen in der Mikroelektronik wird hochreines, monokristallines Silicium (Sieg) benötigt. Insbesondere Verunreinigungen mit Elementen, die auch als Dotierelemente geeignet sind, müssen durch Tiegelziehen oder Zonenschmelzen auf Konzentrationen unterhalb bestimmter kritischer Werte gebracht werden. Der Hersteller Shin-Etsu bewarb eine „11N“-Reinheit (= 99,999 999 999 %) seiner Ingots. ⓘ
Beim Tiegelziehen (Czochralski-Verfahren) wird das im Siemensverfahren erhaltene Solarsilicium in Quarztiegeln geschmolzen. Ein Impfkristall aus hochreinem, monokristallinem Silicium wird in diese Schmelze gebracht und langsam unter Drehen aus der Schmelze herausgezogen, wobei hochreines Silicium in monokristalliner Form auf dem Kristall auskristallisiert und dadurch fast alle Verunreinigungen in der Schmelze zurückbleiben. Physikalischer Hintergrund dieses Reinigungsverfahrens ist die Schmelzpunkterniedrigung und Neigung von Stoffen, möglichst rein zu kristallisieren. ⓘ
Alternativ wird beim Zonenschmelzen mit Hilfe einer (ringförmigen) elektrischen Induktionsheizung eine Schmelzzone durch einen Siliciumstab gefahren, wobei sich ein Großteil der Verunreinigungen in der Schmelze löst und mitwandert. ⓘ
Hochreines kristallines Silicium ist derzeit das für die Mikroelektronik am besten geeignete Grundmaterial; weniger hinsichtlich seiner elektrischen Eigenschaften als vielmehr wegen der chemischen, physikalischen und technisch nutzbaren Eigenschaften von Silicium und seiner Verbindungen (Siliciumdioxid, Siliciumnitrid usw.). Alle gängigen Computerchips, Speicher, Transistoren etc. verwenden hochreines Silicium als Ausgangsmaterial. Diese Anwendungen beruhen auf der Tatsache, dass Silicium ein Halbleiter ist. Durch die gezielte Einlagerung von Fremdatomen (Dotierung), wie beispielsweise Indium, Antimon, Arsen, Bor oder Phosphor, können die elektrischen Eigenschaften von Silicium in einem weiten Bereich verändert werden. Vor allem mittels der dadurch erzeugbaren PN-Übergangs-Effekte lassen sich verschiedenste elektronische Schaltungen realisieren. Wegen der zunehmenden Bedeutung der elektronischen Schaltungen spricht man auch vom Silicium-Zeitalter. Auch die Bezeichnung Silicon Valley (dt. „Silicium-Tal“) für die Hightech-Region in Kalifornien weist auf die enorme Bedeutung des Siliciums in der Halbleiter- und Computerindustrie hin. ⓘ
Amorphes Silicium kann mit Hilfe von Excimerlasern in polykristallines Silicium umgewandelt werden. Dies ist für die Herstellung von Dünnfilmtransistoren (engl. thin-film transistor, TFT) für Flachbildschirme von zunehmender Bedeutung. ⓘ
Hersteller
Silicium ist im Handel sowohl als feinkörniges Pulver als auch in größeren Stücken erhältlich. Hochreines Silicium für die Anwendung in Solarmodulen oder in Halbleiterkomponenten wird in der Regel in Form von dünnen Scheiben aus Einkristallen, sogenannten Silicium-Wafern (siehe Abb.), produziert. Aufgrund der hohen Anfangsinvestitionen und langen Bauzeiten für die notwendigen Öfen stellen allerdings weltweit nur wenige Firmen Rohsilicium her. ⓘ
Die größten Produzenten für metallurgisches Silicium sind:
- Elkem (N, USA)
- Invensil (F, USA)
- Globe Metallurgical (USA)
- Rima Metal (Br)
Es gibt noch ca. 15 andere große Produzenten. In der Volksrepublik China gibt es eine Reihe kleinerer Werke, im Ländervergleich ist sie daher der größte Produzent. ⓘ
Der Markt für Polysilicium bzw. Reinstsilicium ist seit Mitte der 2000er Jahre im Umbruch. Aufgrund des hohen Bedarfes der Solarbranche kam es 2006 zu einer Siliciumknappheit. ⓘ
| Hersteller | Produktion im Jahr 2016 | Firmensitz |
|---|---|---|
| GCL-Poly | 69,1 kt | China (Hongkong) |
| Wacker Chemie | 67,5 kt | Deutschland |
| OCI | 49,4 kt | Südkorea |
| Xinte Energy | 22,8 kt | China |
| Daqo New Energy | 13,1 kt | China |
Verbindungen


Silicium tritt in chemischen Verbindungen fast immer vierwertig auf. Demgemäß ist das Siliciumatom in Verbindungen in der Regel vierfach koordiniert. Daneben existieren aber mittlerweile eine Reihe von Verbindungen, in denen Silicium eine fünf- oder sechsfache Koordination aufweist. Neben dem vierwertigen Silicium sind auch synthetisch hergestellte Verbindungen des zweiwertigen Siliciums (Silylene) bekannt, die jedoch meistens sehr instabil sind. Von größerer Bedeutung ist einzig das Siliciummonoxid, das als Material zur Vergütung von optischen Linsen verwendet wird. Darüber hinaus wurde 2012 auch eine dreifach koordinierte Verbindung ähnlich der eindimensionalen Struktur von Graphen experimentell nachgewiesen, dem sogenannten Silicen. ⓘ
Die gesamte Chemie des Siliciums ist im Wesentlichen durch die hohe Affinität des Siliciums zum Sauerstoff geprägt. Silicium stellt in aller Regel den elektropositiven Partner einer chemischen Verbindung dar, obwohl auch Verbindungen mit formal negativiertem Silicium existieren. Dabei handelt es sich meistens um Silicide, bei denen Silicium auch echte Anionen ausbilden kann. ⓘ
Besonders erwähnenswert ist die Inversion der Bindungspolarität von Element-Wasserstoff-Bindungen beim Übergang von Kohlenstoff zum Silicium. Hier ändert sich die Elektronegativitätsdifferenz von +0,45 (Kohlenstoff-Wasserstoff) auf −0,2, weshalb Siliciumwasserstoffverbindungen eine gänzlich andere Reaktivität als Kohlenwasserstoffe aufweisen. ⓘ
Die wichtigsten Verbindungen des Siliciums kann man in folgende Klassen einteilen, von denen jeweils einige Vertreter genannt sind: Binäre Verbindungen
- Siliciumcarbid
- Siliciumdioxid
- Siliciumnitrid
- Silicide ⓘ
Silicate
- Zirkon und alle anderen Silicate und Verbindungen der Kieselsäure ⓘ
Siliciumhalogenide
- Siliciumtetrafluorid
- Siliciumtetrachlorid
- Trichlorsilan (Silicochloroform) ⓘ
Siliciumwasserstoffe
- Monosilan
- Silane ⓘ
Organische Siliciumverbindungen
- Tetramethylsilan (TMS, NMR-Standard)
- Methylchlorsilane wie Dichlormethylsilan (Bausteine für Silikone)
- Phenylchlorsilan
- Carbosilane
- Carbosilazane
- Carbosiloxane ⓘ
Polymere Siliciumverbindungen
- Silikone (Silicone, Polyorganosiloxane) entstehen durch Polymerisation und gehören zu den wichtigsten industriellen Kunststoffen. Polymere Silicium-Sauerstoff-Verbindungen finden Anwendung in vielen Bereichen; so dienen sie als Schmiermittel und Dichtstoffe in der Kosmetik- und Bauindustrie.
- Polysilane, -carbosilane, -carbosilazane, -carbosiloxane ⓘ
Sonstiges
Bis heute kommt es immer wieder vor, dass das englische Wort „silicon“ (für Silicium) in populärwissenschaftlichen Artikeln oder bei Filmsynchronisationen fälschlich als „Silikon“ (engl. „silicone“) übersetzt bzw. ausgesprochen wird. Dies geschah beispielsweise in der Science-Fiction-Serie Star Trek, dem James-Bond-Agententhriller Im Angesicht des Todes oder in der Zeichentrickserie Die Simpsons. Beispiel: „Besteht die Lebensform aus Kohlenstoff oder aus Silikon?“ ⓘ
Sogar in nicht übersetzten Texten wie dem 1980er-Jahre-Hit Monopoli fiel Songschreiber und Interpret Klaus Lage auf die falsche Verwendung herein, denn er textete: „[…] deinen Job macht jetzt ein Stück Silikon […]“. ⓘ