Kupfer
 | ||||||||||||||||||||||||||||
| Kupfer | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Erscheinungsbild | rot-orangefarbener Metallglanz | |||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Cu) |
| |||||||||||||||||||||||||||
| Kupfer im Periodensystem | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 29 | |||||||||||||||||||||||||||
| Gruppe | Gruppe 11 | |||||||||||||||||||||||||||
| Periode | Periode 4 | |||||||||||||||||||||||||||
| Block | d-Block | |||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Argon|Ar]]] 3d10 4s1 | |||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 1 | |||||||||||||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||||||||||||
| Phase bei STP | fest | |||||||||||||||||||||||||||
| Schmelzpunkt | 1357,77 K (1084,62 °C, 1984,32 °F) | |||||||||||||||||||||||||||
| Siedepunkt | 2835 K (2562 °C, 4643 °F) | |||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 8,96 g/cm3 | |||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 8,02 g/cm3 | |||||||||||||||||||||||||||
| Schmelzwärme | 13,26 kJ/mol | |||||||||||||||||||||||||||
| Verdampfungswärme | 300,4 kJ/mol | |||||||||||||||||||||||||||
| Molare Wärmekapazität | 24.440 J/(mol-K) | |||||||||||||||||||||||||||
Verdampfungsdruck
| ||||||||||||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||||||||||||
| Oxidationsstufen | -2, 0, +1, +2, +3, +4 (ein schwach basisches Oxid) | |||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 1.90 | |||||||||||||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||||||||||||
| Atomradius | empirisch: 128 pm | |||||||||||||||||||||||||||
| Kovalenter Radius | 132±4 pm | |||||||||||||||||||||||||||
| Van-der-Waals-Radius | 140 pm | |||||||||||||||||||||||||||
| Spektrallinien von Kupfer | ||||||||||||||||||||||||||||
| Andere Eigenschaften | ||||||||||||||||||||||||||||
| Natürliches Vorkommen | Ursprünglich | |||||||||||||||||||||||||||
| Kristallstruktur | kubisch-flächenzentriert (fcc) | |||||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | (geglüht) 3810 m/s (bei r.t.) | |||||||||||||||||||||||||||
| Thermische Ausdehnung | 16,5 µm/(m⋅K) (bei 25 °C) | |||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 401 W/(m⋅K) | |||||||||||||||||||||||||||
| Elektrischer Widerstand | 16,78 nΩ⋅m (bei 20 °C) | |||||||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | |||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -5,46×10-6 cm3/mol | |||||||||||||||||||||||||||
| Elastizitätsmodul | 110-128 GPa | |||||||||||||||||||||||||||
| Schermodul | 48 GPa | |||||||||||||||||||||||||||
| Elastizitätsmodul | 140 GPa | |||||||||||||||||||||||||||
| Poissonzahl | 0.34 | |||||||||||||||||||||||||||
| Mohs-Härte | 3.0 | |||||||||||||||||||||||||||
| Vickers-Härte | 343-369 MPa | |||||||||||||||||||||||||||
| Brinell-Härte | 235-878 MPa | |||||||||||||||||||||||||||
| CAS-Nummer | 7440-50-8 | |||||||||||||||||||||||||||
| Geschichte | ||||||||||||||||||||||||||||
| Namensgebung | nach Zypern, Hauptabbauort in der römischen Ära (Cyprium) | |||||||||||||||||||||||||||
| Entdeckung | Naher Osten (9000 v. Chr.) | |||||||||||||||||||||||||||
| Symbol | "Cu": von lateinisch cuprum | |||||||||||||||||||||||||||
| Hauptisotope von Kupfer | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Kupfer ist ein chemisches Element mit dem Symbol Cu (von lateinisch: cuprum) und der Ordnungszahl 29. Es ist ein weiches, verformbares und dehnbares Metall mit einer sehr hohen thermischen und elektrischen Leitfähigkeit. Eine frisch freigelegte Oberfläche aus reinem Kupfer hat eine rosa-orange Farbe. Kupfer wird als Wärme- und Elektrizitätsleiter, als Baumaterial und als Bestandteil verschiedener Metalllegierungen verwendet, z. B. als Sterlingsilber für Schmuck, als Kupfernickel für die Herstellung von Schiffsbeschlägen und Münzen sowie als Konstantan für Dehnungsmessstreifen und Thermoelemente zur Temperaturmessung. ⓘ
Kupfer ist eines der wenigen Metalle, die in der Natur in einer direkt verwendbaren metallischen Form vorkommen können (native Metalle). Dies führte dazu, dass es schon sehr früh, etwa ab 8000 v. Chr., in verschiedenen Regionen vom Menschen genutzt wurde. Tausende von Jahren später war es das erste Metall, das aus sulfidischen Erzen geschmolzen wurde (ca. 5000 v. Chr.), das erste Metall, das in eine Form gegossen wurde (ca. 4000 v. Chr.), und das erste Metall, das absichtlich mit einem anderen Metall, nämlich Zinn, legiert wurde, um Bronze herzustellen (ca. 3500 v. Chr.). ⓘ
In der römischen Ära wurde Kupfer vor allem auf Zypern abgebaut, woher auch der Name des Metalls stammt, der sich von aes cyprium (Metall von Zypern) ableitet und später in cuprum (lateinisch) umgewandelt wurde. Coper (Altenglisch) und Kupfer wurden davon abgeleitet, die spätere Schreibweise wurde erstmals um 1530 verwendet. ⓘ
Häufig vorkommende Verbindungen sind Kupfer(II)-Salze, die Mineralien wie Azurit, Malachit und Türkis oft eine blaue oder grüne Farbe verleihen und in der Vergangenheit häufig als Pigmente verwendet wurden. ⓘ
Kupfer, das in Gebäuden, in der Regel für Dächer, verwendet wird, oxidiert und bildet einen grünen Grünspan (oder Patina). Kupfer wird manchmal in der dekorativen Kunst verwendet, sowohl in seiner elementaren Metallform als auch in Verbindungen als Pigmente. Kupferverbindungen werden als bakteriostatische Mittel, Fungizide und Holzschutzmittel verwendet. ⓘ
Kupfer ist als Spurenelement für alle lebenden Organismen essentiell, da es ein wichtiger Bestandteil des Atmungsenzymkomplexes Cytochrom-C-Oxidase ist. Bei Weichtieren und Krebstieren ist Kupfer ein Bestandteil des Blutpigments Hämocyanin, das bei Fischen und anderen Wirbeltieren durch das Eisen-komplexe Hämoglobin ersetzt wird. Beim Menschen ist Kupfer vor allem in der Leber, den Muskeln und den Knochen zu finden. Der Körper eines Erwachsenen enthält zwischen 1,4 und 2,1 mg Kupfer pro Kilogramm Körpergewicht. ⓘ
Kupfer ist als relativ weiches Metall gut formbar und zäh. Als hervorragender Wärme- und Stromleiter findet es vielseitige Verwendung. Darüber hinaus zählt es auch zur Gruppe der Münzmetalle. ⓘ
Als wichtiges Technologie- bzw. Funktionsmetall gehört Kupfer zu den Halbedelmetallen. ⓘ
Geschichte


Kupfer, Gold, Silber und Zinn waren die ersten Metalle, welche die Menschheit in ihrer Entwicklung kennenlernte. Da Kupfer leicht zu verarbeiten ist, wurde es bereits von den ältesten bekannten Kulturen vor etwa 10.000 Jahren verwendet. Die Zeit seines weiträumigen Gebrauchs vom 5. Jahrtausend v. Chr. bis zum 3. Jahrtausend v. Chr. wird je nach Region auch Kupferzeit genannt. In Hujayrat al-Ghuzlan in Jordanien bestand schon um 4.000 v. Chr. eine Massenproduktionsstätte von Kupfer. In der Alchemie wurde Kupfer mit Venus und Weiblichkeit ♀ (Planetenmetalle) assoziiert und als Verbindung von Schwefel und Quecksilber angesehen. Die ersten Spiegel wurden aus diesem Metall hergestellt. Während der späten ostmediterranen Bronzezeit wurde Kupfer vor allem auf Zypern gefördert und von dort in zumeist ca. 30 kg schweren Kupferbarren in Form von Rinderhäuten (sogenannte Ochsenhautbarren) exportiert. Fragmente zyprischer Ochsenhautbarren aus der Zeit zwischen dem 16. und dem 11. Jahrhundert v. Chr. finden sich in weiten Teilen des Mittelmeerraums, bis nach Sardinien, auf dem Balkan und sogar nördlich der Alpen (Depotfund von Oberwilflingen). Größter vorindustrieller Kupferhersteller war das Römische Reich mit einer geschätzten Jahresproduktion von 15.000 t. ⓘ
Später wurde Kupfer mit Zinn und Bleianteilen zu Bronze legiert. Diese härtere und technisch widerstandsfähigere Legierung wurde zum Namensgeber der Bronzezeit. Die Unterscheidung von Blei und Zinn wurde erst mit wachsenden Metallkenntnissen eingeführt, sodass der Begriff Bronze aus heutiger Sicht nur auf die hochkupferhaltigen Zinn-Kupferlegierungen richtig angewendet ist. ⓘ
Die goldgelbe Kupfer-Zink-Legierung „Messing“ war bereits im antiken Griechenland bekannt. Es wurde durch gemeinsames Verarbeiten der jeweiligen Erze erschmolzen, aber erst die Römer haben dieses Verfahren verstärkt verwendet. In Altkolumbien wurde die Gold-Kupfer-Legierung Tumbaga häufig verwendet. ⓘ
Eine Zeitleiste des Kupfers veranschaulicht, wie dieses Metall die menschliche Zivilisation in den letzten 11.000 Jahren vorangebracht hat. ⓘ
Moderne


Der Große Kupferberg war ein Bergwerk in Falun, Schweden, das vom 10. Jahrhundert bis 1992 in Betrieb war. Sie deckte zwei Drittel des europäischen Kupferverbrauchs im 17. Jahrhundert und trug zur Finanzierung vieler schwedischer Kriege während dieser Zeit bei. Sie wurde als Schatzkammer der Nation bezeichnet; Schweden hatte eine kupfergedeckte Währung. ⓘ
Kupfer wird für Dacheindeckungen, Währungen und für die fotografische Technologie, die Daguerreotypie, verwendet. Kupfer wurde in der Bildhauerei der Renaissance verwendet und diente zum Bau der Freiheitsstatue; Kupfer wird auch heute noch in verschiedenen Bauwerken verwendet. Kupferbeschichtungen und Kupferummantelungen wurden in großem Umfang zum Schutz von Schiffsrümpfen verwendet, eine Technik, die von der britischen Admiralität im 18. Die Norddeutsche Affinerie in Hamburg war die erste moderne Galvanisierungsanlage, die 1876 ihre Produktion aufnahm. Der deutsche Wissenschaftler Gottfried Osann erfand 1830 die Pulvermetallurgie, als er die Atommasse des Metalls bestimmte; zu dieser Zeit entdeckte man, dass die Menge und die Art des Legierungselements (z. B. Zinn) zum Kupfer den Glockenton beeinflussen würde. ⓘ
Während des Anstiegs der Nachfrage nach Kupfer für das Zeitalter der Elektrizität, von den 1880er Jahren bis zur Großen Depression der 1930er Jahre, produzierten die Vereinigten Staaten ein Drittel bis die Hälfte des weltweit neu geförderten Kupfers. Zu den wichtigsten Gebieten gehörte der Keweenaw-Distrikt im Norden Michigans, der hauptsächlich aus einheimischen Kupfervorkommen bestand, die in den späten 1880er Jahren von den riesigen Sulfidvorkommen in Butte, Montana, in den Schatten gestellt wurden, die ihrerseits von den Porphyrvorkommen im Südwesten der Vereinigten Staaten, insbesondere in Bingham Canyon, Utah, und Morenci, Arizona, in den Schatten gestellt wurden. Die Einführung des Dampfschaufel-Tagebaus und Innovationen in den Bereichen Verhüttung, Raffination, Flotationskonzentration und anderen Verarbeitungsschritten führten zur Massenproduktion. Zu Beginn des zwanzigsten Jahrhunderts stand Arizona an erster Stelle, gefolgt von Montana, Utah und Michigan. ⓘ
Die Schwebeschmelze wurde von Outokumpu in Finnland entwickelt und erstmals 1949 in Harjavalta angewandt; auf dieses energieeffiziente Verfahren entfallen 50 % der weltweiten Primärkupferproduktion. ⓘ
Der 1967 von Chile, Peru, Zaire und Sambia gegründete Zwischenstaatliche Rat der kupferexportierenden Länder agierte auf dem Kupfermarkt wie die OPEC auf dem Erdölmarkt, obwohl er nie den gleichen Einfluss erlangte, insbesondere weil der zweitgrößte Produzent, die Vereinigten Staaten, nie Mitglied war; er wurde 1988 aufgelöst. ⓘ
Kupfer als Mineral
Natürliche Vorkommen an gediegen Kupfer, das heißt in seiner elementaren Form, waren bereits lange vor der Gründung der International Mineralogical Association (IMA) bekannt. Kupfer ist daher als sogenanntes grandfathered Mineral als eigenständige Mineralart anerkannt. ⓘ
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Kupfer unter der System-Nr. „1.AA.05“ (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe) beziehungsweise in der veralteten 8. Auflage unter I/A.01 (Kupfer-Reihe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.01.03 (Goldgruppe). ⓘ
In der Natur bildet sich Kupfer meist in basaltischen Laven entweder in Form von „kupferroten“, metallisch glänzenden Nuggets (aus der Schmelze erstarrt) oder in verzweigten Strukturen, so genannten Dendriten. Gelegentlich sind auch kristalline Ausbildung anzutreffen. Kupfer tritt in Paragenese mit verschiedenen, meist sekundären Kupfermineralen wie Bornit, Chalkosin, Cornwallit, Cuprit, Azurit und Malachit sowie Tenorit auf, kann aber auch mit vielen anderen Mineralen wie Calcit, Klinoklas, Prehnit, Pumpellyit, Quarz und Silber vergesellschaftet sein. ⓘ
Pseudomorphose von Kupfer nach Aragonit ⓘ
Kupfererze kommen häufig vor. So wird Kupfer aus Chalkopyrit (Kupferkies, CuFeS2), Chalkosin (Kupferglanz, Cu2S), seltener auch aus Bornit (Buntkupferkies, Cu5FeS4), Atacamit (CuCl2·Cu(OH)2), Malachit (Cu2[(OH)2|CO3]) und anderen Erzen gewonnen. Im Jahre 2019 waren 636 Kupferminerale bekannt. Die Minerale mit der höchsten Kupferkonzentration in der Verbindung sind Cuprit (bis 88,8 %) und Algodonit (bis 83,6 %) sowie Paramelaconit, Tenorit und Chalkosin (bis 79,9 %). ⓘ
Vorkommen und Förderung
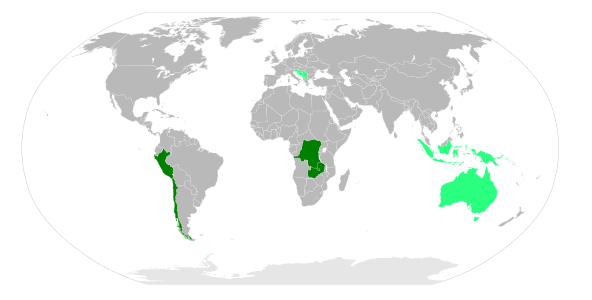
Kupfer kommt in der Erde nach Angaben des Deutschen Kupferinstituts mit einem Gehalt von etwa 0,006 % vor und steht in Bezug auf die Häufigkeit der Elemente in der Erdkruste an der 23. Stelle. Häufig tritt Kupfer gediegen, das heißt in elementarer Form auf. Weltweit sind aktuell (Stand 2017) über 3000 Fundorte für gediegen Kupfer bekannt, so unter anderem in Afghanistan, Argentinien, Australien, Belgien, Bolivien, Brasilien, Bulgarien, Chile, China, der Demokratischen Republik Kongo, Deutschland, Finnland, Frankreich, Griechenland, Indien, im Iran, in Irland, Italien, Japan, Kanada, Kasachstan, Marokko, Mexiko, der Mongolei, Namibia, Neuseeland, Norwegen, Österreich, Peru, den Philippinen, Polen, Portugal, Rumänien, Russland, Sambia, Schweden, der Schweiz, Simbabwe, der Slowakei, Spanien, Südafrika, Tschechien, der Türkei, der Ukraine, Ungarn, den Vereinigten Staaten von Amerika (USA) und dem Vereinigten Königreich (UK). ⓘ
Auch in mehreren Gesteinsproben vom Mittelatlantischen Rücken sowie vom Mond, das die Sonde der Luna 24-Mission vom Mare Crisium mitbrachte, konnte gediegen Kupfer nachgewiesen werden. ⓘ
Förderung und Reserven
Der bedeutendste Kupferproduzent ist Chile, mit großem Abstand gefolgt von Peru und China. In Europa sind Polen, Portugal und Schweden nennenswert. Die wichtigsten Exportländer waren von 1967 bis 1988 in der CIPEC organisiert. Zur CIPEC gehörten unter anderem Chile, Peru und Papua-Neuguinea, auf dessen Insel Bougainville eine der weltgrößten Kupferminen 1988 zu einem Bürgerkrieg führte. ⓘ
Historisch bedeutsam waren die Kupfergruben auf der Keweenaw-Halbinsel im Oberen See (USA). Dort gab es das weltweit größte Vorkommen von gediegen Kupfer. Abbau fand dort schon in vorkolumbischer Zeit statt. In Deutschland wurde bis 1990 im Mansfelder Land Kupferschiefer abgebaut. Weitere historische Abbaustätten waren Kupferberg/Oberfranken (ab dem 13. Jahrhundert) und das niederschlesische Kupferberg/Riesengebirge (seit dem 12. Jahrhundert) In Cornwall (England) hat es vor allem im 18. und 19. Jahrhundert bedeutenden Kupferbergbau gegeben. ⓘ
Laut International Copper Study Group ICSG liegen nach Angaben des United States Geological Survey (USGS) die Kupferreserven derzeit bei rund 870 Millionen Tonnen (Mt). Identifizierte und unentdeckte Kupferressourcen werden auf etwa 2.100 Mt bzw. 3.500 Mt geschätzt (insgesamt 5.600 Mt). Letzteres berücksichtigt nicht die riesigen Kupfermengen, die in Tiefseeknollen und landseitigen und submarinen Massivsulfiden sind. ⓘ
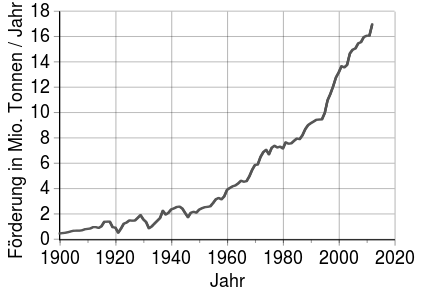
Entwicklung der Kupferförderung (1900–2012) ⓘ
| Land | Abbau 2018 | Abbau 2019 | Abbau 2020 | Reserven | Raffinerieproduktion 2019 | Raffinerieproduktion 2020 |
|---|---|---|---|---|---|---|
| 920 | 934 | 885 | 93.000 | 426 | 427 | |
| 5.800 | 5.790 | 5.730 | 200.000 | 2.270 | 2.330 | |
| 1.590 | 1.680 | 1.720 | 26.000 | 9.780 | 10.000 | |
| 632 | 643 | |||||
| 651 | 505 | 24.000 | 269 | |||
| 1.500 | 1.580 | |||||
| 573 | 585 | 9.800 | 281 | 290 | ||
| 603 | 562 | 552 | 20.000 | 512 | 515 | |
| 1.200 | 1.290 | 1.600 | 31.000 | 1.080 | 1.350 | |
| 760 | 715 | 733 | 53.000 | 477 | 492 | |
| 2.400 | 2.460 | 2.150 | 77.000 | 308 | 324 | |
| 399 | 393 | 31.000 | 566 | 560 | ||
| 710 | 801 | 810 | 62.000 | 1.050 | 1040 | |
| 870 | 797 | 853 | 21.000 | 262 | 378 | |
| 665 | 671 | |||||
| 1.200 | 1.260 | 1.200 | 48.000 | 1.030 | 918 | |
| Andere Länder | 3.540 | 3.100 | 2.840 | 180.000 | 3.640 | 3.450 |
| Welt gesamt (gerundet) | 20.400 | 20.400 | 20.600 | 880.000 | 24.500 | 25.300 |
Gewinnung

Rohkupfer

Die durchschnittliche Kupferkonzentration in Erzen beträgt nur 0,6 %, und bei den meisten kommerziellen Erzen handelt es sich um Sulfide, insbesondere Chalkopyrit (CuFeS2), Bornit (Cu5FeS4) und in geringerem Maße Covellit (CuS) und Chalkosin (Cu2S). Die durchschnittliche Kupferkonzentration in polymetallischen Knollen wird dagegen auf 1,3 % geschätzt. Die Methoden zur Gewinnung von Kupfer und anderen Metallen, die in diesen Knollen vorkommen, umfassen Schwefelauslaugung, Schmelzen und die Anwendung des Cuprion-Verfahrens. Die in den Erzen an Land vorkommenden Mineralien werden aus den zerkleinerten Erzen durch Schaumflotation oder Biolaugung auf einen Kupfergehalt von 10-15 % konzentriert. Durch Erhitzen dieses Materials mit Siliziumdioxid in einer Schwebeschmelze wird ein Großteil des Eisens als Schlacke entfernt. Das Verfahren nutzt die leichtere Umwandlung von Eisensulfiden in Oxide, die wiederum mit der Kieselsäure reagieren und die Silikatschlacke bilden, die auf der erhitzten Masse schwimmt. Die entstehende Kupfermatte, die aus Cu2S besteht, wird geröstet, um die Sulfide in Oxide umzuwandeln:
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
Das Kupferoxid reagiert mit Kupfersulfid und wandelt sich beim Erhitzen in Blisterkupfer um:
- 2 Cu2O + Cu2S → 6 Cu + 2 SO2
Beim Sudbury-Matt-Verfahren wurde nur die Hälfte des Sulfids in Oxid umgewandelt und dieses Oxid dann verwendet, um den restlichen Schwefel als Oxid zu entfernen. Anschließend wurde es elektrolytisch raffiniert und der Anodenschlamm wegen des darin enthaltenen Platins und Goldes ausgebeutet. Bei diesem Schritt wird die relativ einfache Reduktion von Kupferoxiden zu Kupfermetall genutzt. Erdgas wird über die Blase geblasen, um den größten Teil des verbleibenden Sauerstoffs zu entfernen, und das so entstandene Material wird elektroraffiniert, um reines Kupfer zu erhalten:
- Cu2+ + 2 e- → Cu ⓘ
- Blisterkupfer
- Schmelzen
- Flammofen
- Entfernung der Schlacke
- Kupferguss von Anoden
- Gießrad
- Anodenentnahme-Maschine
- Anodenabzug
- Waggons
- Transport zum Kesselhaus

Die wichtigsten Öfen für die Kupfergewinnung sind der Flammofen und seit 1980 der Schwebeschmelzofen. ⓘ
Zur Herstellung von Kupfer wird aus Kupferkies (CuFeS2) zunächst so genannter Kupferstein (Cu2S mit variierenden Gehalten an FeS und einem Cu-Gehalt von ca. 70 %) gewonnen. Dazu wird das Ausgangsmaterial unter Zusatz von Koks geröstet und die enthaltenen Eisenoxide durch kieselsäurehaltige Zuschlagstoffe verschlackt. Diese Eisensilikat-Schlacke schwimmt auf dem Kupferstein und kann so leicht abgegossen werden. ⓘ
- Röstarbeit:
- ⓘ
- Schmelzarbeit:
- ⓘ
Der so erhaltene Kupferstein wird zu Rohkupfer (auch Schwarzkupfer) weiterverarbeitet. Dazu wird er glutflüssig in einen Konverter gegossen und in diese Schmelze Luft eingeblasen. In einer ersten Stufe (Schlackenblasen) wird dabei das darin enthaltene Eisensulfid zu Eisenoxid geröstet und dieses durch zugeschlagenen Quarz zur Schlacke gebunden, die abgegossen werden kann. In einem zweiten Schritt (Garblasen) werden zwei Drittel des verbleibenden Cu2S zu Cu2O oxidiert. Das Oxid setzt sich dann mit dem restlichen Sulfid zum Rohkupfer um. ⓘ
- Schlackenblasen:
- ⓘ
- Garblasen:
- ⓘ
Das Rohkupfer hat einen Kupferanteil von 98 %. In den restlichen 2 % sind neben unedlen Metallen wie Eisen und Zink auch Edelmetalle wie Silber und Gold enthalten. ⓘ
Raffination
Die elektrolytische Raffination von Kupfer wird in einer schwefelsäurehaltigen Kupfer(II)-sulfat-Lösung mit einer Rohkupfer-Anode und einer Reinkupfer-Kathode durchgeführt. Bei der Elektrolyse werden nun alle im Vergleich zu Kupfer unedleren Metalle oxidiert und gehen als Kationen in Lösung, während die edleren Metalle als Anodenschlamm absinken. ⓘ
Reaktionsgleichung der elektrolytischen Raffination:
- Anode
- ⓘ
- Kathode
- ⓘ
Während die Anode sich langsam unter Bildung der Kationen auflöst, scheidet sich an der Kathode durch Reduktion von Kupferionen ausschließlich Kupfer, das Elektrolytkupfer, mit einem Massenanteil von w(Cu) = 99,99 % ab. ⓘ
Der als Nebenprodukt entstehende Anodenschlamm wird später weiter verwertet und dient als Ausgangsmaterial für die Gewinnung der Edelmetalle. ⓘ
Die Gewinnung von Kupfer erfolgt in Affinerien. In Europa ist dafür die Aurubis AG (früher Norddeutsche Affinerie) mit Hauptsitz in Hamburg bekannt, früher war es auch die Duisburger Kupferhütte (heute DK Recycling und Roheisen). ⓘ
Kupfer kann auch als so genannter Zementkupfer durch Fällung aus Kupfersulfat-Lösung mit Eisen gewonnen werden. Der Vorgang der Fällung wird Zementation genannt. Das erhaltene Kupfer ist oft verunreinigt. Die Fällung von Kupfer auf Eisen aus natürlich vorkommenden Metallsalz-Lösungen wurde in China bereits seit 1086 n. Chr. praktiziert. ⓘ
Kupfer kann auch durch eine aluminothermische Reaktion dargestellt werden. Als Thermit dient hierbei ein Gemisch aus Kupfer(II)-oxid und Aluminiumgrieß. Durch den Einsatz eines Fließmittels (z. B. Calciumfluorid) kann die Ausbeute erhöht werden, weil sich die elementaren Metalle im Gegensatz zur entstehenden Schlacke nicht im Fließmittel lösen können. Die aluminothermische Gewinnung ist wegen des dafür nötigen Aluminiums nicht wirtschaftlich. ⓘ
Verwendete Verfahren zur Kupfergewinnung (1930–1995) ⓘ
Eigenschaften


Kupfer reagiert nicht mit Wasser, aber es reagiert langsam mit Luftsauerstoff und bildet eine braun-schwarze Kupferoxidschicht, die - anders als der Rost, der sich an feuchter Luft auf Eisen bildet - das darunter liegende Metall vor weiterer Korrosion schützt (Passivierung). Eine grüne Grünspanschicht (Kupferkarbonat) ist häufig auf alten Kupferkonstruktionen zu sehen, z. B. auf den Dächern vieler älterer Gebäude und der Freiheitsstatue. Kupfer läuft an, wenn es mit bestimmten Schwefelverbindungen in Berührung kommt, mit denen es unter Bildung verschiedener Kupfersulfide reagiert. ⓘ
Die gute elektrische und Wärmeleitfähigkeit sind wichtige Eigenschaften des Werkstoffes Kupfer. Die große Bedeutung dieses Werkstoffes für die Technik ergibt sich aber erst durch die Kombination der verschiedenen guten Eigenschaften, die – auch in Verbindung mit anderen Metallen in Form von Kupferlegierungen – seit Jahren genutzt und weiterentwickelt werden. Außerdem verfügt Kupfer über eine ausgezeichnete Korrosionsbeständigkeit und ist zu 100 Prozent ohne Qualitätsverluste recycelbar. ⓘ
Physikalische Eigenschaften


Aufgrund seiner Dichte von 8920 kg/m³ gehört Kupfer zu den Schwermetallen, das kubisch-flächenzentriert kristallisiert und damit eine kubisch dichteste Kugelpackung mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225) aufweist. Der Gitterparameter beträgt bei reinem Kupfer 0,3615 nm (entspricht 3,615 Å) bei 4 Formeleinheiten pro Elementarzelle. ⓘ
Kupfer ist ein sehr guter Wärmeleiter. Sein Schmelzpunkt liegt bei 1083,4 °C. Ebenso ist Kupfer ein sehr guter elektrischer Leiter mit einer elektrischen Leitfähigkeit von 58 · 106 S/m. Seine Leitfähigkeit ist nur wenig schlechter als Silber und deutlich besser als Gold. Da alle im Kupfer gelösten Beimengungen, besonders Verunreinigungen wie Phosphor und Eisen die Leitfähigkeit stark herabsetzen, werden für Leiterwerkstoffe oft höchste Reinheitsgrade verwendet (Cu-ETP, früher E-Kupfer, 99,9 % Reinheit). ⓘ
Die Mohshärte von Kupfer beträgt 2,5 bis 3, was einer Vickershärte (VHN) von 77–99 bei einer Prüfkraft von 1 N entspricht. Durch Kaltumformung wird die Zugfestigkeit von 150 bis 200 MPa (weich) auf > 350 MPa erhöht. Die Bruchdehnung sinkt dadurch auf unter 5 % mit Härtewerten um 100 HB. Die Leitfähigkeit sinkt. Verformtes und anschließend weichgeglühtes Kupfer hat eine Bruchdehnung > 40 % und Härtewerte um die 50 HB. ⓘ
Die Weichheit von Kupfer erklärt zum Teil die hohe elektrische Leitfähigkeit und die hohe Wärmeleitfähigkeit, die unter den reinen Metallen bei Raumtemperatur die zweithöchste nach Silber ist. Dies liegt daran, dass der spezifische Widerstand für den Elektronentransport in Metallen bei Raumtemperatur in erster Linie auf der Streuung von Elektronen bei thermischen Schwingungen des Gitters beruht, die in einem weichen Metall relativ schwach sind. ⓘ
Schmieden ist bei Temperaturen von 700 bis 800 °C sehr gut möglich. Kaltverformung ist ohne Zwischenglühen durchführbar, es tritt Kaltverfestigung ein. ⓘ
Als blankes Metall hat Kupfer eine hellrote Farbe, die Strichfarbe ist rosarot. Die rote Farbe rührt daher, dass es bei normaler Temperatur das komplementäre grüne und blaue Licht etwas mehr absorbiert. An der Luft läuft es an und wird zunächst rotbraun. Bei weiterer Verwitterung und Korrosion geht sehr langsam (oft über Jahrhunderte) die glatte Oberfläche verloren und die Farbe verändert sich durch die Bildung einer Patina von rotbraun zu blaugrün. Kupfer ist ein beständiger Bauwerkstoff mit einer technischen „Lebenserwartung“ von über 200 Jahren. Diese Beständigkeit beruht auf seiner Fähigkeit, an der Atmosphäre eine witterungsbeständige, festhaftende Schutzschicht auszubilden. Diese Oxidschicht ist in sich stabil und „selbstheilend“. Unabhängig von ihrer Zusammensetzung stellt sie einen Schutz gegen weitere Korrosionsangriffe dar. ⓘ
Kupfer ist eines der wenigen metallischen Elemente mit einer anderen natürlichen Farbe als Grau oder Silber. Reine Kupferoberflächen sind lachsrot und verfärben sich an der Luft rotbraun. Die charakteristische Farbe von Kupfer ergibt sich aus Interband-Übergängen von im d-Atomorbital vorhandenen Elektronen. ⓘ
Wie bei anderen Metallen tritt galvanische Korrosion auf, wenn Kupfer in einem Elektrolyten mit einem anderen Metall in Kontakt gebracht wird. Es bildet Lokalelemente, zum Beispiel als Spurenbestandteil in Zink. Als relativ edles Metall in der elektrochemischen Spannungsreihe ist es jedoch meist nicht selbst von der Korrosion betroffen. ⓘ


Chemische Eigenschaften
| Oxidationszustände von Kupfer ⓘ | |
|---|---|
| +1 | CuCl, Cu2O, CuH, Cu2C2 |
| +2 | CuCl2, CuO, CuSO4, Kupfer(II)-acetat |
| +3 | KCuO2, K3CuF6 |
| +4 | Cs2CuF6 |
Kupfer tritt in den Oxidationsstufen 0, +1, +2, +3 und +4 auf, am häufigsten sind +1 und +2, wobei +2 die stabilste Oxidationsstufe in wässrigen Lösungen ist; Stufe +4 ist extrem selten (beispielsweise in Cs2CuF6). Kupfer(II)-Salze (z. B. Kupfersulfat) sind meist von blauer oder grüner Farbe. Kupfer hat chemisch teils ähnliche Eigenschaften wie die in der gleichen Gruppe stehenden Elemente Silber und Gold. So scheidet sich an einem Eisennagel, der in eine Lösung aus Kupfersulfat getaucht wird, eine Schicht aus metallischem Kupfer ab, wofür Eisen als Eisensulfat in Lösung geht, weil Eisen unedler als Kupfer ist (siehe dazu auch Spannungsreihe). Kupfer wird von Salzsäure normalerweise nicht angegriffen, bei Anwesenheit von Sauerstoff jedoch stark angegriffen, von heißer Schwefelsäure wird es aufgelöst. Es löst sich auch in Salpetersäure und Königswasser auf. Eine Mischung aus Salzsäure oder Schwefelsäure mit Wasserstoffperoxid löst Kupfer sehr schnell auf. Das Metall wird auch von organischen Säuren angegriffen. Gegen Laugen verhält es sich stabil. Bei Rotglut reagiert es mit Sauerstoff und bildet eine dicke Schicht aus Kupferoxid. Kupfer wird von Fluor und seinen Verbindungen passiviert. Abhängig von der Korngröße ist Kupferpulver entzündbar oder brennbar. Das Metall in kompakter Form ist nicht brennbar und wird nach Ausbildung einer dünnen Oxidschicht von Luft und Wasser nicht weiter angegriffen, ist also gegen saubere Luft und Wasser beständig. ⓘ
In flüssigem Kupfer lösen sich Sauerstoff und Wasserstoff, die sich bei der Erstarrung der Schmelze zu Wasserdampf umsetzen können und damit die Ursache für Gasporosität im Gussstück bilden. ⓘ
In sauerstoffhaltigen Kupfersorten können beim Kontakt mit wasserstoffhaltigen Gasen Risse und Hohlräume entstehen, was zu der sogenannten Wasserstoffversprödung bei Kupfer führt. ⓘ
Biologische Eigenschaften
Für den menschlichen Organismus ist Kupfer ein essentielles Spurenelement, d. h. der Mensch benötigt Kupfer, um zu überleben. Gewöhnlich wird der Tagesbedarf eines Erwachsenen von ca. 2 mg durch eine ausgewogene Ernährung mit einem reichlichen Anteil Getreide, Fleisch, Wurzelgemüse, Hülsenfrüchten, Nüssen oder auch Schokolade erreicht. Kupfer ist ein natürlich vorkommendes Element, das man in verschiedenen Formen und Konzentrationen in der Erdkruste, den Ozeanen, Seen und Flüssen finden kann. Flora und Fauna haben sich im Rahmen dieses natürlichen Vorhandenseins von Kupfer entwickelt. Daher verfügen die meisten Organismen über einen immanenten Mechanismus zu seiner Nutzung. ⓘ
Antimikrobielle Eigenschaften
Kupfer ist für viele Mikroorganismen (Viren, Keime) bereits in geringen Konzentrationen toxisch. Aufgrund der antimikrobiellen Eigenschaft von Kupfer wird das Material z. B. in Krankenhäusern in Großversuchen eingesetzt. So belegt eine klinische Studie von 2008/2009, dass in der Asklepios Klinik Wandsbek, Hamburg, nach dem Austausch von 50 Türgriffen/-platten und Lichtschaltern die MRSA-Keime auf 63 % reduziert wurden. Eine Studie aus Chile stellte bei einer Luftfeuchte von 7,2 bis 19,7 % eine Reduktion der Keimzahlen auf Gegenständen aus Kupferlegierungen um bis zu 92 % fest. Eine Multicenter-Studie von 2010/2011 aus den USA belegt, dass die Infektionsrate in „Kupferzimmern“ um annähernd 60 % sinkt, auf den Kupfergegenständen reduzierte sich die Keimzahl um über 80 %. 2013 tauschte die Klinik für Kinder- und Jugendmedizin im Klinikum Niederberg, Nordrhein-Westfalen, ihre Türklinken gegen solche aus Kupferlegierungen um. Legierungen mit über 60 % Kupferanteil seien vonnöten. In den USA laufen weitere Versuche mit verschiedenen Kupferanwendungen. ⓘ
Experimente legen nahe, dass die Kontaktabtötung durch einen Mechanismus abläuft, bei dem der Metall-Bakterien-Kontakt die Zellhülle schädigt, was wiederum die Zellen anfällig für weitere Schäden durch Kupfer macht. Aktuell befinden sich drei Experimente der Arbeitsgruppe auf der Raumstation ISS und es sind weitere geplant. ⓘ
Die keimreduzierende Wirkung entsteht genauer gesagt dadurch, dass Kupferionen sich an Thiolgruppen von Proteinen binden und Lipide der Zellmembran peroxidieren, was zur Bildung von freien Radikalen führt, welche die DNA und Zellmembranen schädigen. Beim Menschen führt das beispielsweise im Fall von Morbus Wilson (Kupferspeicherkrankheit) zu Schädigungen der Organe mit einem hohen Kupferüberschuss. ⓘ
Kupferlegierungen mit einem Kupferanteil von mindestens 60 % zeigen auch eine toxische Wirkung gegenüber Noroviren. ⓘ
Wirkung gegen Schnecken
Durch den Schneckenschleim wird das Kupfer im Kupferdraht oder Kupferfolie oxidiert, die als Barriere zu gefährdeten Pflanzen dient. Dadurch entsteht eine reizende Substanz, die die Schnecke daran hindert, weiter zu kriechen. ⓘ
Biologischer Kupferbedarf
Da Kupfer insbesondere für den Stoffwechsel von großer Wichtigkeit ist, kann ein Kupfermangel zu schweren gesundheitlichen Problemen führen. Die gesundheitlichen Vorteile von Kupfer sind zahlreich, denn Kupfer beeinflusst als Bestandteil lebenswichtiger Enzyme und Proteine viele Körperfunktionen: Kupfer ist essentiell für das Wachstum von Säuglingen, die Knochenstärke, die Reifung von roten und weißen Blutzellen, den Eisentransport, den Cholesterin- und Glukosestoffwechsel, die Herzmuskelkontraktion und die Entwicklung des Gehirns. ⓘ
Der tägliche Bedarf eines erwachsenen Menschen beträgt 1,0–1,5 Milligramm. Im menschlichen Körper wird Kupfer hauptsächlich in der Leber gespeichert. ⓘ
Kupfer ist vor allem in Schokolade, Leber, Getreide, Gemüse und Nüssen enthalten. Kupfermangel tritt beim Menschen selten auf. Hauptsächlich ist ein Mangel möglich bei langanhaltenden Durchfällen, frühreifen Kindern, nach einer langanhaltenden Unterernährung oder einer Malabsorption durch Krankheiten wie z. B. Sprue, Morbus Crohn oder Mukoviszidose. Die Einnahme hoher Dosen von Zink, Eisen oder Molybdat kann ebenfalls zu verringerten Kupfermengen im Körper führen. Das Menkes-Syndrom ist eine seltene angeborene Kupferstoffwechselstörung. ⓘ
Kupferüberschuss und Vergiftung

Überschüssiges Kupfer wird mit der Gallenflüssigkeit zur Ausscheidung in das Verdauungssystem abgegeben. ⓘ
Kupfersulfat (Kupfervitriol) ist ein starkes Brechmittel und wurde deshalb zur Behandlung vieler Vergiftungen eingesetzt, beispielsweise durch weißen Phosphor, was in diesem speziellen Fall auch noch den Vorteil hat, dass gleichzeitig der Phosphor als schwerlösliches Kupferphosphid gebunden wird. ⓘ
Bei der seltenen Erbkrankheit Morbus Wilson ist die Kupferausscheidung beeinträchtigt und es kommt zu vermehrter Kupferanlagerung, zuerst in der Leber, dann, wenn diese das Kupfer in den Blutkreislauf ausscheidet, auch in anderen Organen. Eine weitere seltene Erkrankung des Kupferstoffwechsels ist das Menkes-Syndrom. Dabei kann das Kupfer von den Zellen zwar aufgenommen, dann aber nicht mehr geordnet weitertransportiert werden, so dass einige Organe einen erhöhten, andere wiederum einen erniedrigten Kupfergehalt aufweisen. ⓘ
Kupfer und Morbus Alzheimer
Immer wieder wurde der Zusammenhang zwischen Kupfer und der Entstehung der Alzheimer-Krankheit diskutiert. Bereits 2003 vermuteten Forscher, dass Kupfer die Produktion von Amyloid A bremst und ein Mangel an Kupfer die Alzheimerdemenz fördert. Eine darauf folgende Pilotstudie mit 70 Alzheimer-Patienten konnte jedoch keine protektive Wirkung von einer erhöhten Kupfer-Einnahme zeigen, auch wenn es zu einer Stabilisierung im Abfall von Abeta42 im Liquor kam, einem Krankheitsmarker der Alzheimer-Erkrankung. ⓘ
Andere Studien zeigten, dass Kupfer für das Gehirn schädlich sein könnte. So zeigte eine Studie mit dem Ionophor PBT2 als Wirkstoff gegen Alzheimer gute Ergebnisse in einer Phase-II-Studie. Der Wirkstoff bindet nicht nur Zink, sondern auch Kupfer und verringert somit die Konzentration von Kupfer im Gehirn. ⓘ
Eine neue Studie zeigt, dass Kupfer sich bei langfristiger hoher Zufuhr in den Hirnkapillaren ablagert und dort die Blut-Hirn-Schranke schädigen kann. Dadurch wird der Abtransport von Beta-Amyloid behindert, die Akkumulation des Stoffes verursacht dann den Morbus Alzheimer. ⓘ
Isotope
Es gibt 29 Isotope von Kupfer. 63Cu und 65Cu sind stabil, wobei 63Cu etwa 69 % des natürlich vorkommenden Kupfers ausmacht; beide haben einen Spin von 3⁄2. Die anderen Isotope sind radioaktiv, wobei das stabilste 67Cu mit einer Halbwertszeit von 61,83 Stunden ist. Sieben metastabile Isotope wurden charakterisiert; 68mCu ist das langlebigste mit einer Halbwertszeit von 3,8 Minuten. Isotope mit einer Massenzahl über 64 zerfallen durch β-, während Isotope mit einer Massenzahl unter 64 durch β+ zerfallen. 64Cu, das eine Halbwertszeit von 12,7 Stunden hat, zerfällt in beide Richtungen. ⓘ
62Cu und 64Cu haben bedeutende Anwendungen. 62Cu wird in 62Cu-PTSM als radioaktiver Tracer für die Positronen-Emissions-Tomographie verwendet. ⓘ
Vorkommen

Kupfer wird in massiven Sternen erzeugt und ist in der Erdkruste in einem Anteil von etwa 50 Teilen pro Million (ppm) vorhanden. In der Natur kommt Kupfer in einer Vielzahl von Mineralien vor, darunter natives Kupfer, Kupfersulfide wie Chalkopyrit, Bornit, Digenit, Covellit und Chalkosin, Kupfersulfosalze wie Tetrahedit-Tennantit und Enargit, Kupferkarbonate wie Azurit und Malachit sowie Kupfer(I)- und Kupfer(II)-Oxide wie Cuprit und Tenorit. Die größte entdeckte Masse an elementarem Kupfer wog 420 Tonnen und wurde 1857 auf der Keweenaw-Halbinsel in Michigan, USA, gefunden. Natives Kupfer ist ein Polykristall, wobei der größte jemals beschriebene Einkristall 4,4×3,2×3,2 cm misst. Kupfer ist das 25. häufigste Element in der Erdkruste und macht 50 ppm aus, verglichen mit 75 ppm für Zink und 14 ppm für Blei. ⓘ
Typische Hintergrundkonzentrationen von Kupfer übersteigen nicht 1 ng/m3 in der Atmosphäre, 150 mg/kg im Boden, 30 mg/kg in der Vegetation, 2 μg/L im Süßwasser und 0,5 μg/L im Meerwasser. ⓘ
Verwendung



Kupfer wird rein oder als Legierung insbesondere aufgrund seiner hervorragenden elektrischen Leitfähigkeit und Wärmeleitfähigkeit, aber auch wegen der ausgezeichneten Verarbeitbarkeit und Langlebigkeit in einer Vielzahl von Anwendungen und in vielen verschiedenen Industrien wie im Automobil- oder Maschinenbau eingesetzt. Ein wichtiges Anwendungsfeld sind inzwischen auch erneuerbare Energien (Stichwort: Green Building). Dazu gehören aber auch Bereiche wie Telekommunikation, Architektur, konventionelle Energien, Sanitärinstallation, Heizung, Verkehr, maritime Anwendungen, Elektrotechnik (z. B. Elektroinstallation) , Präzisionsteile, Münzen, Essbesteck, Kunstgegenstände, Musikinstrumente und vieles mehr. ⓘ
Wird Kupfer in Kontakt mit anderen Metallen eingesetzt, führt dies bei diesen bei Feuchtigkeitseinfluss zu Kontaktkorrosion. ⓘ
Nach Silber besitzt Kupfer noch vor Gold die zweithöchste elektrische Leitfähigkeit aller Stoffe und wird daher u. a. eingesetzt für:
- elektrische Leitungen, Schaltdrähte und Stromkabel geringen Querschnitts, Oberleitungen
- Leiterbahnen auf Leiterplatten und teilweise in integrierten Schaltkreisen
- Elektrische Maschinen: Drahtwicklungen in Transformatoren, Drosseln/Spulen und Elektromotoren
- Bauteile: Anodenkörper von Magnetrons, Klemmen, Bauteilanschlussbeine, Kontaktträger, Presshülsen
Aluminium ist zwar billiger und auf die Masse pro Länge bezogen ein besserer elektrischer Leiter als Kupfer. Es ist aber voluminöser. U. a. deshalb und auch weil Kupfer besser kontaktiert werden kann und es eine höhere Biegewechselbeständigkeit hat, wird es als Stromleiter gegenüber Aluminium meist bevorzugt, außer wenn es auf das Gewicht oder den Preis ankommt. ⓘ
Drähte und Litzen aus sogenanntem Oxygen Free Copper (OFC, englisch für Sauerstoff-freies Kupfer mit einer Reinheit von > 99,99 %) haben ein sehr feinkörniges Kristallgefüge und eine besonders hohe Ermüdungsbruchfestigkeit. Sie werden für mechanisch hochbeanspruchte Kabel und Leitungen eingesetzt. ⓘ
Für Oberleitungen werden Legierungen von Kupfer und Magnesium verwendet. Dabei muss ein Kompromiss zwischen steigender Zugfestigkeit und sinkender Leitfähigkeit gefunden werden. ⓘ
Kupfer besitzt ein hohes Reflexionsvermögen im Infrarotbereich und wird daher als Spiegel für Kohlendioxidlaser-Strahlen und zur Glasbeschichtung (Isolierglas) eingesetzt. ⓘ
Wegen seiner hohen Wärmeleitfähigkeit und Korrosionsbeständigkeit eignet es sich gut als Material für Wärmetauscher, Kühlkörper und Montageplatten von Leistungshalbleitern. In der Gastronomie wird es oft als Kochgeschirr eingesetzt. ⓘ
Im Kunsthandwerk wird Kupferblech getrieben, das heißt durch Hämmern verformt, was aufgrund seiner Weichheit leicht möglich ist. In der bildenden Kunst wird Kupfer bis heute zur Fertigung von Druckplatten für Kupferstiche und Radierungen verwendet. ⓘ
Auch Dächer werden mit Kupferblech gedeckt, worauf sich dann eine beständige grünliche Patina bildet, die aus verschiedenen basischen Kupferhydroxiden bzw. Kupfercarbonaten besteht. Diese oft fälschlich auch als „Grünspan“ (siehe Kupferacetat) bezeichnete Patina schützt das darunterliegende Metall gut vor weiterer Korrosion, sodass Kupferdächer eine Lebensdauer von mehreren Jahrhunderten haben können. Kupfernägel finden beim traditionellen Schieferdach Verwendung. Zunehmend wird Kupfer auch aus ästhetischen Gründen für Dächer und Fassaden eingesetzt. ⓘ
Für einen kurzen Zeitraum von Ende der 1960er bis Ende der 1970er Jahre wurden in vielen amerikanischen Wohnungsbauprojekten Kupferleitungen durch Aluminiumleitungen ersetzt. Die neue Verkabelung war in eine Reihe von Hausbränden verwickelt und die Industrie kehrte zu Kupfer zurück. ⓘ
Legierungen
Kupfer ist auch Bestandteil von mehr als 400 Legierungen wie z. B. Messing (mit Zink), Bronze (mit Zinn) und Neusilber (mit Zink und Nickel). Diese Kupferlegierungen werden wegen ihrer guten Eigenschaften, wie Farbe, Korrosionsbeständigkeit und Verarbeitbarkeit gerne vielfältig eingesetzt. Man unterscheidet Knetlegierungen (Messing und Neusilber) und Gusswerkstoffe (Rotguss, Bronzen): Knetlegierungen werden durch plastisches Umformen (Warmumformen: Walzen, Schmieden usw. oder Kaltumformen: Drahtziehen, Hämmern, Kaltwalzen, Tiefziehen usw.) in die gewünschte Form gebracht, während Gusswerkstoffe meist nur schwer oder gar nicht plastisch formbar sind. ⓘ
Je nach Nickelzusatz verschwindet die kupfereigene Farbe und es entstehen gelbliche bis weiße korrosionsfeste Legierungen (Kupfernickel). ⓘ
Viele Münzwerkstoffe sind auf Kupferbasis hergestellt, so ist das „Nordisches Gold“ genannte Metall der goldfarbigen Teile der Euromünzen eine Kupfer-Zink-Aluminium-Zinn-Legierung. Die Münzmetalle der bis 2001 gültigen 1-DM-Geldstücke sowie die hellen Anteile der Euromünzen bestehen aus Kupfernickel-Legierungen. ⓘ
Kupferverbindungen kommen in Farbpigmenten, als Toner, in medizinischen Präparaten und galvanischen Oberflächenbeschichtungen zum Einsatz. ⓘ
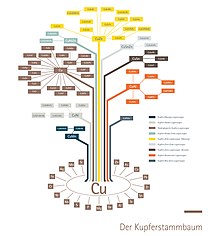
Eine Übersicht über die verschiedenen Legierungsfamilien gibt der Kupferstammbaum des Deutschen Kupferinstituts. ⓘ
Nachweis

Kupfer färbt die Boraxperle in der oxidierenden Flammenzone blau bis blau-grün, in der reduzierenden Flammenzone ist keine Färbung bemerkbar bzw. wird die Perle rot bis rotbraun gefärbt. Im klassischen Kationentrenngang wird Kupfer in der Schwefelwasserstoff-Gruppe gefällt und dort in der Kupfergruppe als blauer Komplex nachgewiesen. Letztere Färbung beruht darauf, dass Lösungen von Kupfer(II)-Ionen mit Ammoniak einen tiefblauen Kupfertetramminkomplex, [Cu(NH3)4]2+, bilden (siehe auch Komplexbildungsreaktion). ⓘ
Eine Kaliumhexacyanoferrat(II)-Lösung fällt Kupfer(II)-Ionen als Kupfer(II)-hexacyanoferrat(II), Cu2[Fe(CN)6]. Diese Nachweisreaktion ist sehr empfindlich, d. h., sie zeigt auch geringe Kupfermengen an. ⓘ
Kupfersalze färben die Flamme (Bunsenbrennerflamme) grün bis blau (Flammenfärbung, Spektralanalyse). ⓘ
Die quantitative Bestimmung kann durch Elektrogravimetrie an einer Platinnetzkathode aus einer schwefelsauren Kupfer(II)-haltigen Lösung erfolgen. Maßanalytisch kann Kupfer durch Iodometrie oder Komplexometrie (Titration mit Titriplex/Komplexon III mit Indikator Murexid) bestimmt werden. Im Spurenbereich steht die Differenzpulspolarographie zur Verfügung (Halbstufenpotential −0,62 V gegen SCE in 1 M Thiocyanat-Lösung). Ultraspuren an Kupfer bestimmt man mittels Inversvoltammetrie, Graphitrohr-AAS oder ICP-MS. ⓘ
Kupfer(II)-Ionen bilden mit Cuprizon (Oxalsäurebiscyclohexylidenhydrazid) in schwach alkalischer Lösung einen blauen Komplex. ⓘ
Verbindungen

Kupfer bildet eine Vielzahl von Verbindungen, in der Regel mit den Oxidationsstufen +1 und +2, die oft als Kupfer(II)- bzw. Kupfer(II)-oxid bezeichnet werden. Kupferverbindungen, ob organische Komplexe oder metallorganische Verbindungen, fördern oder katalysieren zahlreiche chemische und biologische Prozesse. ⓘ
Oxide und Hydroxide

Kupfer(I)-oxid ist rötlich und besitzt eine kubische Kristallstruktur mit der Raumgruppe Pn3m (Raumgruppen-Nr. 224). Es wird als Pigment in Glas, Keramik, Email, Porzellanlasur sowie als optisches Glaspoliermittel, Insektizid, Katalysator für die Ammoniakherstellung, Lösungsmittel für Chromeisenerze, in galvanischen Elektroden, in der Pyrotechnik, Wolkenbildung, Korrosionsinhibitoren, Galvanisierverfahren, Elektronik, Textilien, als Flammschutzmittel, Kraftstoffadditiv, Katalysator zur Schadstoffbekämpfung, zum Drucken und Fotokopieren und als Holzschutzmittel verwendet. ⓘ
Kupfer(II)-oxid ist ein schwarzer, amorpher oder kristalliner Feststoff und bildet eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15). Es wird in der Keramikindustrie verwendet, um Gläser, Glasuren und Emails blau, grün oder rot zu färben. Es wird gelegentlich zur Einarbeitung in Mineralstoffzusätze zur Absicherung gegen Kupfermangel in der Tierernährung eingesetzt. Zu seinen weiteren Anwendungen gehört die Aufbereitung von Lösungen für die Zellstoffindustrie. ⓘ
Kupfer(II)-hydroxid ist blau und wird zur Herstellung von Zellstoff, Batterieelektroden und anderen Kupfersalzen verwendet. Es wird als Beizmittel beim Färben, als Pigment- und Futtermittelzusatz, bei der Behandlung der Lagerfäule bei Preiselbeeren und als Fungizid gegen bakterielle Schwachstellen bei Salat, Pfirsichen, Preiselbeeren und Walnüssen verwendet. ⓘ
Halogenide
Kupfer(II)-chlorid ist ein braunes, stark hygroskopisches Pulver. Es wird als Katalysator für organische und anorganische Reaktionen, Beizmittel zum Färben und Bedrucken von Textilien, Pigment für Glas und Keramik, Holzschutzmittel, Desinfektionsmittel, Insektizid, Fungizid und Herbizid sowie als Katalysator bei der Herstellung von Chlor aus Chlorwasserstoff verwendet. Kupfer(II)-chlorid-Dihydrat (CuCl2 · 2 H2O) ist ein blaugrüner Feststoff. ⓘ
Kupfer(I)-chlorid ist weiß und besitzt eine Kristallstruktur vom Zinkblende-Typ mit der Raumgruppe F43m (Raumgruppen-Nr. 216). Es wird als Katalysator für viele organische Reaktionen verwendet. Ammoniaklösungen von Kupfer(I)-chlorid werden zur Reinigung von Gasen von Kohlenstoffmonoxid eingesetzt. ⓘ
Weitere anorganische Verbindungen
Kupfersulfat kommt in der Natur als Chalkanthit (Kupfersulfat-Pentahydrat, Cu[SO4] · 5H2O) und als Boothit (Kupfersulfat-Heptahydrat, Cu[SO4] · 7H2O) vor. Es dient zum Konservieren von Häuten, zum Gerben von Leder, zur Herstellung von Kupfersalzen, zum Konservieren von Zellstoffholz und gemahlenem Zellstoff, zur Bekämpfung des Algenwachstums in stehenden Gewässern. Außerdem wird es in Galvaniklösungen, Wasch- und Metallmarkierungsfarben, Erdölraffinerien, in der Pyrotechnik und für viele andere industrielle Anwendungen eingesetzt. ⓘ
Organische Verbindungen

Kupfer(II)-acetat (Grünspan) bildet dunkelgrüne Kristalle. Es wird als Fungizid, Katalysator für organische Reaktionen, Pigment für Keramiken, Insektizid, Schimmelschutzmittel, Konservierungsmittel für Cellulosematerialien, Stabilisator für Polyurethane und Nylons, Korrosionsschutzmittel und Kraftstoffadditiv verwendet. ⓘ
Organokupferchemie
Verbindungen, die eine Kohlenstoff-Kupfer-Bindung enthalten, werden als kupferorganische Verbindungen bezeichnet. Sie sind sehr reaktionsfreudig gegenüber Sauerstoff und bilden Kupfer(I)-oxid und finden in der Chemie vielfältige Verwendung. Sie werden durch Behandlung von Kupfer(I)-Verbindungen mit Grignard-Reagenzien, endständigen Alkinen oder Organolithium-Reagenzien synthetisiert; insbesondere die zuletzt beschriebene Reaktion ergibt ein Gilman-Reagenz. Diese können durch Substitution mit Alkylhalogeniden Kupplungsprodukte bilden und sind daher für die organische Synthese von Bedeutung. Kupfer(I)-acetylid ist sehr stoßempfindlich, ist aber ein Zwischenprodukt bei Reaktionen wie der Cadiot-Chodkiewicz-Kupplung und der Sonogashira-Kupplung. Auch die Konjugataddition an Enone und die Carbokupration von Alkinen kann mit kupferorganischen Verbindungen durchgeführt werden. Kupfer(I) bildet eine Vielzahl von schwachen Komplexen mit Alkenen und Kohlenmonoxid, insbesondere in Gegenwart von Aminliganden. ⓘ
Kupfer(III) und Kupfer(IV)
Kupfer(III) ist am häufigsten in Form von Oxiden zu finden. Ein einfaches Beispiel ist Kaliumkupfer, KCuO2, ein blauschwarzer Feststoff. Die am intensivsten untersuchten Kupfer(III)-Verbindungen sind die Kuprat-Supraleiter. Yttriumbariumkupferoxid (YBa2Cu3O7) besteht sowohl aus Cu(II)- als auch aus Cu(III)-Zentren. Wie das Oxid ist auch das Fluorid ein stark basisches Anion und dafür bekannt, Metallionen in hohen Oxidationsstufen zu stabilisieren. Es sind sowohl Kupfer(III)- als auch Kupfer(IV)-Fluoride bekannt, K3CuF6 bzw. Cs2CuF6. ⓘ
Einige Kupferproteine bilden Oxokomplexe, die ebenfalls Kupfer(III) enthalten. Bei Tetrapeptiden werden die violett gefärbten Kupfer(III)-Komplexe durch die deprotonierten Amidliganden stabilisiert. ⓘ
Kupfer(III)-Komplexe finden sich auch als Zwischenprodukte bei Reaktionen von kupferorganischen Verbindungen. Zum Beispiel bei der Kharasch-Sosnovsky-Reaktion. ⓘ
Preisentwicklung
Kupfer ist ein relativ teures Metall. Sein Preis entsteht maßgeblich an den großen Rohstoffbörsen und Warenterminbörsen der Welt. Führend im Kupferhandel ist die London Metal Exchange (LME). ⓘ
Der Weltmarktpreis für Kupfer unterliegt starken Schwankungen: Eine der größten Schwankungen erfuhr er im Jahr 2008, als der Preis für Kupfer am 2. Juli an der LME noch zum zwischenzeitlichen Höchststand von 8.940 USD/t gehandelt wurde und bis zum 23. Dezember 2008 auf seinen 10-Jahres-Tiefststand von 2.825 USD fiel. Danach erholte sich der Kupferpreis in weniger als 4 Monaten bis zum 15. April 2009 wieder bis auf 4.860 USD/t. Seinen 10-Jahres-Höchststand hatte der Kupferpreis am 14. Februar 2011 mit 10.180 USD/t. ⓘ
Von März 2012 bis März 2013 stieg der Kupferpreis in der Spitze am 2. April 2012 bis auf 8.619,75 USD und am 2. August 2012 bis auf 7.288,25 USD. Eine ähnliche Spannweite zeigte sich auch von Oktober 2012 bis März 2013 zwischen 8.350 USD/t und 7.577 USD/t. ⓘ
Im August 2014 lag der Weltmarktpreis für Kupfer bei etwa 7.000 USD/t. Dies waren nach damaligem Wechselkurs 6.833 EUR/t. ⓘ
Der hohe Kupferpreis bedingt auch einen Anstieg der Diebstähle von kupferhaltigen Gegenständen. Besonders betroffen sind hier Erdungskabel von Eisenbahnen. Beispielsweise entstanden der Deutschen Bahn AG im Jahr 2015 rund 14 Mio. Euro Schaden. ⓘ
Einer der größten Finanzskandale der neueren Geschichte ist die Sumitomo-Affäre. Sie beruhte auf dem Handel mit Kupfer. In Folge der Aufdeckung sank 1996 der Kupferpreis innerhalb eines Tages um 27 %. ⓘ
Kupfer wird seit mindestens 10.000 Jahren verwendet, aber mehr als 95 % des jemals geförderten und verhütteten Kupfers wurde seit 1900 abgebaut. Wie bei vielen natürlichen Ressourcen ist die Gesamtmenge des Kupfers auf der Erde riesig: Etwa 1014 Tonnen befinden sich im obersten Kilometer der Erdkruste, was bei der derzeitigen Abbaurate einem Wert von etwa 5 Millionen Jahren entspricht. Allerdings ist nur ein winziger Bruchteil dieser Reserven bei den heutigen Preisen und Technologien wirtschaftlich rentabel. Die Schätzungen der für den Abbau verfügbaren Kupferreserven schwanken zwischen 25 und 60 Jahren, je nach Kernannahmen wie der Wachstumsrate. Recycling ist eine wichtige Quelle für Kupfer in der modernen Welt. Aufgrund dieser und anderer Faktoren ist die Zukunft der Kupferproduktion und -versorgung Gegenstand vieler Debatten, einschließlich des Konzepts des "Peak Copper", das mit dem "Peak Oil" vergleichbar ist. ⓘ
Der Kupferpreis ist seit jeher unbeständig und stieg von einem 60-Jahres-Tiefstand von 0,60 US$/lb (1,32 US$/kg) im Juni 1999 auf 3,75 $ pro Pfund (8,27 $/kg) im Mai 2006. Im Februar 2007 fiel er auf 2,40 $/lb (5,29 $/kg), um dann im April 2007 wieder auf 3,50 $/lb (7,71 $/kg) anzusteigen. Im Februar 2009 ließen die nachlassende weltweite Nachfrage und der steile Rückgang der Rohstoffpreise seit den Höchstständen des Vorjahres die Kupferpreise auf 1,51 $/lb (3,32 $/kg) fallen. Zwischen September 2010 und Februar 2011 stieg der Kupferpreis von 5.000 £ pro Tonne auf 6.250 £ pro Tonne. ⓘ
Herstellung



Das meiste Kupfer wird in Form von Kupfersulfiden aus großen Tagebauen in Porphyr-Kupferlagerstätten mit einem Kupfergehalt von 0,4 bis 1,0 % abgebaut oder gewonnen. Zu den Standorten gehören Chuquicamata in Chile, die Bingham Canyon Mine in Utah, Vereinigte Staaten, und die El Chino Mine in New Mexico, Vereinigte Staaten. Nach Angaben des British Geological Survey war Chile im Jahr 2005 mit mindestens einem Drittel des Weltanteils der größte Kupferproduzent, gefolgt von den Vereinigten Staaten, Indonesien und Peru. Kupfer kann auch durch das In-situ-Laugungsverfahren gewonnen werden. Mehrere Standorte im Bundesstaat Arizona gelten als erstklassige Kandidaten für diese Methode. Die Menge des verwendeten Kupfers nimmt zu, und die verfügbare Menge reicht kaum aus, damit alle Länder das Verbrauchsniveau der entwickelten Welt erreichen können. Eine alternative Kupferquelle, die derzeit erforscht wird, sind polymetallische Knollen, die sich in den Tiefen des Pazifischen Ozeans in einer Tiefe von etwa 3000 bis 6500 Metern unter dem Meeresspiegel befinden. Diese Knollen enthalten auch andere wertvolle Metalle wie Kobalt und Nickel. ⓘ
Wiederverwertung
Wie Aluminium kann auch Kupfer ohne Qualitätsverlust recycelt werden, und zwar sowohl aus dem Rohzustand als auch aus den hergestellten Produkten. Gemessen am Volumen ist Kupfer nach Eisen und Aluminium das am dritthäufigsten recycelte Metall. Schätzungsweise 80 % des jemals geförderten Kupfers wird heute noch verwendet. Laut dem Bericht "Metal Stocks in Society" des International Resource Panel beträgt der weltweite Pro-Kopf-Bestand an Kupfer, der in der Gesellschaft verwendet wird, 35-55 kg. Ein Großteil davon befindet sich in höher entwickelten Ländern (140-300 kg pro Kopf) und nicht in weniger entwickelten Ländern (30-40 kg pro Kopf). ⓘ
Der Prozess des Recyclings von Kupfer ist in etwa derselbe wie bei der Gewinnung von Kupfer, erfordert jedoch weniger Schritte. Hochreines Altkupfer wird in einem Ofen geschmolzen und dann reduziert und in Barren gegossen; weniger reines Altkupfer wird durch Galvanisieren in einem Schwefelsäurebad raffiniert. ⓘ
Anwendungen

Die wichtigsten Verwendungszwecke von Kupfer sind elektrische Drähte (60 %), Dachdecker- und Klempnerarbeiten (20 %) und Industriemaschinen (15 %). Kupfer wird meist als reines Metall verwendet, aber wenn eine größere Härte erforderlich ist, wird es in Legierungen wie Messing und Bronze verarbeitet (5 % der Gesamtverwendung). Seit mehr als zwei Jahrhunderten wird Kupferfarbe auf Bootsrümpfen verwendet, um das Wachstum von Pflanzen und Schalentieren zu kontrollieren. Ein kleiner Teil des Kupferangebots wird für Nahrungsergänzungsmittel und Fungizide in der Landwirtschaft verwendet. Kupfer kann maschinell bearbeitet werden, wobei Legierungen für eine gute Bearbeitbarkeit bei der Herstellung komplizierter Teile bevorzugt werden. ⓘ
Elektromotoren
Die hervorragende Leitfähigkeit von Kupfer erhöht die Effizienz von Elektromotoren. Dies ist wichtig, da Motoren und motorgetriebene Systeme 43 % bis 46 % des gesamten weltweiten Stromverbrauchs und 69 % des gesamten Stromverbrauchs in der Industrie ausmachen. Eine Erhöhung der Masse und des Querschnitts von Kupfer in einer Spule steigert den Wirkungsgrad des Motors. Kupfermotorrotoren, eine neue Technologie, die für Motoranwendungen entwickelt wurde, bei denen Energieeinsparungen zu den wichtigsten Konstruktionszielen gehören, ermöglichen es Induktionsmotoren für allgemeine Zwecke, die Premium-Effizienzstandards der National Electrical Manufacturers Association (NEMA) zu erfüllen und zu übertreffen. ⓘ
Architektur



Kupfer wird seit der Antike als haltbares, korrosionsbeständiges und wetterfestes Baumaterial verwendet. Dächer, Abdeckungen, Regenrinnen, Fallrohre, Kuppeln, Türme, Gewölbe und Türen werden seit Hunderten oder Tausenden von Jahren aus Kupfer hergestellt. Die architektonische Verwendung von Kupfer wurde in der heutigen Zeit auf Innen- und Außenwandverkleidungen, Dehnungsfugen, Hochfrequenzabschirmung sowie antimikrobielle und dekorative Produkte für den Innenbereich wie attraktive Handläufe, Badezimmerarmaturen und Arbeitsplatten ausgeweitet. Zu den weiteren wichtigen Vorteilen von Kupfer als architektonisches Material gehören die geringe Wärmebewegung, das geringe Gewicht, der Blitzschutz und die Wiederverwertbarkeit. ⓘ
Die unverwechselbare natürliche grüne Patina des Metalls ist bei Architekten und Designern seit langem begehrt. Die endgültige Patina ist eine besonders haltbare Schicht, die sehr widerstandsfähig gegen atmosphärische Korrosion ist und so das darunter liegende Metall vor weiterer Verwitterung schützt. Sie kann eine Mischung aus Karbonat- und Sulfatverbindungen in unterschiedlichen Mengen sein, je nach Umweltbedingungen wie schwefelhaltigem saurem Regen. Architekturkupfer und seine Legierungen können auch "veredelt" werden, um ein bestimmtes Aussehen, eine bestimmte Haptik oder Farbe zu erhalten. Zu den Veredelungen gehören mechanische Oberflächenbehandlungen, chemische Färbungen und Beschichtungen. ⓘ
Kupfer lässt sich hervorragend löten und schweißen; die besten Ergebnisse werden mit dem Metall-Gasschweißen erzielt. ⓘ
Antifouling
Kupfer ist biostatisch, d. h. Bakterien und viele andere Lebensformen können darauf nicht wachsen. Aus diesem Grund wird es seit langem für die Auskleidung von Schiffsteilen zum Schutz vor Seepocken und Muscheln verwendet. Ursprünglich wurde es in reiner Form verwendet, ist aber inzwischen durch Muntz-Metall und Farben auf Kupferbasis ersetzt worden. Wie in Kupferlegierungen in der Aquakultur erläutert, haben sich Kupferlegierungen zu wichtigen Netzmaterialien in der Aquakulturindustrie entwickelt, da sie antimikrobiell sind und selbst unter extremen Bedingungen Biofouling verhindern und über starke strukturelle und korrosionsbeständige Eigenschaften in Meeresumgebungen verfügen. ⓘ
Antimikrobiell
Berührungsflächen aus Kupferlegierungen haben natürliche Eigenschaften, die eine Vielzahl von Mikroorganismen zerstören (z. B. E. coli O157:H7, Methicillin-resistenter Staphylococcus aureus (MRSA), Staphylococcus, Clostridium difficile, Influenza-A-Virus, Adenovirus, SARS-Cov-2 und Pilze). Die Inder verwenden Kupfergefäße schon seit der Antike zur Aufbewahrung von Wasser, noch bevor die moderne Wissenschaft die antimikrobiellen Eigenschaften des Kupfers erkannte. Es wurde nachgewiesen, dass einige Kupferlegierungen bei regelmäßiger Reinigung mehr als 99,9 % der krankheitsverursachenden Bakterien innerhalb von nur zwei Stunden abtöten. Die US-Umweltschutzbehörde (EPA) hat die Registrierung dieser Kupferlegierungen als "antimikrobielle Materialien mit Nutzen für die öffentliche Gesundheit" genehmigt; diese Genehmigung erlaubt es den Herstellern, den Nutzen für die öffentliche Gesundheit von Produkten, die aus den registrierten Legierungen hergestellt werden, rechtlich geltend zu machen. Darüber hinaus hat die EPA eine lange Liste von antimikrobiellen Kupferprodukten aus diesen Legierungen zugelassen, wie z. B. Bettgitter, Handläufe, Tische über Betten, Waschbecken, Wasserhähne, Türknöpfe, Toilettenartikel, Computertastaturen, Geräte für Fitnessstudios und Griffe für Einkaufswagen (eine umfassende Liste finden Sie unter: Antimikrobielle Berührungsflächen aus Kupferlegierungen#Zugelassene Produkte). Krankenhäuser verwenden Kupfertürklinken, um die Übertragung von Krankheiten zu verringern, und die Legionärskrankheit wird durch Kupferrohre in Sanitäranlagen unterdrückt. Antimikrobielle Produkte aus Kupferlegierungen werden jetzt in Gesundheitseinrichtungen in Großbritannien, Irland, Japan, Korea, Frankreich, Dänemark und Brasilien installiert und in den USA sowie in der U-Bahn in Santiago, Chile, gefordert, wo zwischen 2011 und 2014 in etwa 30 Stationen Handläufe aus Kupfer-Zink-Legierungen installiert wurden. Textilfasern können mit Kupfer gemischt werden, um antimikrobielle Schutzstoffe herzustellen. ⓘ
Spekulative Anlagen
Kupfer kann als spekulative Anlage genutzt werden, da ein Anstieg des Verbrauchs aufgrund des weltweiten Infrastrukturwachstums prognostiziert wird und Kupfer eine wichtige Rolle bei der Herstellung von Windturbinen, Solarpanelen und anderen erneuerbaren Energiequellen spielt. Ein weiterer Grund für den prognostizierten Anstieg der Nachfrage ist die Tatsache, dass Elektroautos im Durchschnitt 3,6 Mal so viel Kupfer enthalten wie herkömmliche Autos, obwohl die Auswirkungen von Elektroautos auf die Kupfernachfrage umstritten sind. Einige Menschen investieren in Kupfer über Kupferminenaktien, börsengehandelte Fonds und Futures. Andere lagern physisches Kupfer in Form von Kupferbarren oder -rondellen, obwohl diese im Vergleich zu Edelmetallen in der Regel mit einem höheren Aufschlag verbunden sind. Diejenigen, die die Aufschläge für Kupferbarren vermeiden wollen, lagern alternativ alten Kupferdraht, Kupferrohre oder amerikanische Pennys, die vor 1982 hergestellt wurden. ⓘ
Volksmedizin
Kupfer wird häufig in Schmuckstücken verwendet, und einigen Volksüberlieferungen zufolge lindern Kupferarmbänder die Symptome von Arthritis. In einer Studie zur Behandlung von Osteoarthritis und einer Studie zur Behandlung von rheumatoider Arthritis wurden keine Unterschiede zwischen Kupferarmbändern und Kontrollarmbändern (ohne Kupfer) festgestellt. Es gibt keine Belege dafür, dass Kupfer über die Haut aufgenommen werden kann. Sollte dies der Fall sein, könnte dies zu einer Kupfervergiftung führen. ⓘ
Kompressionskleidung
In jüngster Zeit wurde einige Kompressionskleidung mit eingewebtem Kupfer mit ähnlichen gesundheitsbezogenen Angaben wie in der Volksmedizin auf den Markt gebracht. Da Kompressionskleidung eine wirksame Behandlung für einige Beschwerden ist, kann die Kleidung diesen Nutzen haben, aber das zugesetzte Kupfer hat möglicherweise keinen über einen Placebo-Effekt hinausgehenden Nutzen. ⓘ
Zersetzung
Chromobacterium violaceum und Pseudomonas fluorescens können beide festes Kupfer als Cyanidverbindung mobilisieren. Die erikoidalen Mykorrhizapilze, die mit Calluna, Erica und Vaccinium vergesellschaftet sind, können in metallhaltigen Böden wachsen, die Kupfer enthalten. Der Ektomykorrhizapilz Suillus luteus schützt junge Kiefern vor Kupfertoxizität. Eine Probe des Pilzes Aspergillus niger wuchs in einer Goldminenlösung und enthielt Cyanokomplexe von Metallen wie Gold, Silber, Kupfer, Eisen und Zink. Der Pilz spielt auch eine Rolle bei der Solubilisierung von Schwermetallsulfiden. ⓘ
Biologische Rolle

Biochemie
Kupferproteine spielen verschiedene Rollen im biologischen Elektronentransport und Sauerstofftransport, Prozesse, die die einfache Umwandlung von Cu(I) und Cu(II) ausnutzen. Kupfer ist für die aerobe Atmung aller Eukaryonten unerlässlich. In den Mitochondrien ist es in der Cytochrom-c-Oxidase enthalten, die das letzte Protein der oxidativen Phosphorylierung ist. Die Cytochrom-c-Oxidase ist das Protein, das das O2 zwischen Kupfer und Eisen bindet; das Protein überträgt 8 Elektronen auf das O2-Molekül, um es zu zwei Wassermolekülen zu reduzieren. Kupfer ist auch in vielen Superoxid-Dismutasen enthalten, Proteinen, die den Abbau von Superoxiden katalysieren, indem sie es (durch Disproportionierung) in Sauerstoff und Wasserstoffperoxid umwandeln:
- Cu2+-SOD + O2- → Cu+-SOD + O2 (Reduktion von Kupfer; Oxidation von Superoxid)
- Cu+-SOD + O2- + 2H+ → Cu2+-SOD + H2O2 (Oxidation von Kupfer; Reduktion von Superoxid) ⓘ
Das Protein Hämocyanin ist der Sauerstoffträger in den meisten Weichtieren und einigen Gliederfüßern wie dem Hufeisenkrebs (Limulus polyphemus). Da Hämocyanin blau ist, haben diese Organismen blaues Blut und nicht das rote Blut des eisenhaltigen Hämoglobins. Strukturell verwandt mit Hämocyanin sind die Laccasen und Tyrosinasen. Anstatt Sauerstoff reversibel zu binden, hydroxylieren diese Proteine Substrate, wie ihre Rolle bei der Bildung von Lacken zeigt. Die biologische Rolle von Kupfer begann mit dem Auftreten von Sauerstoff in der Erdatmosphäre. Mehrere Kupferproteine, wie die "blauen Kupferproteine", interagieren nicht direkt mit Substraten und sind daher keine Enzyme. Diese Proteine übertragen Elektronen durch den Prozess des Elektronentransfers. ⓘ
Ein einzigartiges tetranukleares Kupferzentrum wurde in der Nitrousoxid-Reduktase gefunden. ⓘ
Chemische Verbindungen, die für die Behandlung der Wilson-Krankheit entwickelt wurden, werden für die Krebstherapie untersucht. ⓘ
Absorption
Kupfer wird im Darm absorbiert und dann an Albumin gebunden zur Leber transportiert. Nach der Verarbeitung in der Leber wird das Kupfer in einer zweiten Phase unter Beteiligung des Proteins Ceruloplasmin, das den größten Teil des Kupfers im Blut trägt, auf andere Gewebe verteilt. Ceruloplasmin transportiert auch das Kupfer, das mit der Milch ausgeschieden wird, und ist als Kupferquelle besonders gut resorbierbar. Das Kupfer im Körper wird normalerweise über den enterohepatischen Kreislauf aufgenommen (ca. 5 mg pro Tag gegenüber ca. 1 mg pro Tag, die mit der Nahrung aufgenommen und ausgeschieden werden), und der Körper ist in der Lage, einen Teil des überschüssigen Kupfers bei Bedarf über die Galle auszuscheiden, die einen Teil des Kupfers aus der Leber transportiert, der dann nicht vom Darm resorbiert wird. ⓘ
Empfehlungen für die Ernährung
Das U.S. Institute of Medicine (IOM) aktualisierte 2001 den geschätzten durchschnittlichen Bedarf (EAR) und die empfohlenen Tagesdosen (RDA) für Kupfer. Wenn keine ausreichenden Informationen für die Festlegung von EARs und RDAs vorliegen, wird stattdessen eine Schätzung verwendet, die als Adequate Intake (AI) bezeichnet wird. Die AI für Kupfer sind: 200 μg Kupfer für 0-6 Monate alte männliche und weibliche Kinder und 220 μg Kupfer für 7-12 Monate alte männliche und weibliche Kinder. Die RDA-Werte für Kupfer betragen für beide Geschlechter: 340 μg Kupfer für 1-3-Jährige, 440 μg Kupfer für 4-8-Jährige, 700 μg Kupfer für 9-13-Jährige, 890 μg Kupfer für 14-18-Jährige und 900 μg Kupfer für 19-Jährige und Ältere. Für die Schwangerschaft: 1.000 μg. Für die Stillzeit 1.300 μg. Was die Sicherheit betrifft, so legt die IOM auch für Vitamine und Mineralien tolerierbare Höchstmengen (UL) fest, wenn die Beweise ausreichend sind. Im Falle von Kupfer wird der UL auf 10 mg/Tag festgelegt. Die EARs, RDAs, AIs und ULs werden zusammen als Dietary Reference Intakes bezeichnet. ⓘ
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) bezeichnet die Gesamtheit der Informationen als Referenzwerte für die Ernährung, wobei die Bevölkerungsreferenzzufuhr (PRI) anstelle der RDA und der durchschnittliche Bedarf anstelle der EAR steht. AI und UL sind genauso definiert wie in den Vereinigten Staaten. Für Frauen und Männer ab 18 Jahren wurden die AI auf 1,3 bzw. 1,6 mg/Tag festgelegt. Der AI-Wert für Schwangerschaft und Stillzeit beträgt 1,5 mg/Tag. Für Kinder im Alter von 1-17 Jahren steigt der AI mit zunehmendem Alter von 0,7 auf 1,3 mg/Tag. Diese AIs sind höher als die RDAs in den USA. Die Europäische Behörde für Lebensmittelsicherheit hat dieselbe Sicherheitsfrage geprüft und ihren UL auf 5 mg/Tag festgelegt, was der Hälfte des US-Wertes entspricht. ⓘ
Bei der Kennzeichnung von Lebensmitteln und Nahrungsergänzungsmitteln in den USA wird die Menge in einer Portion als Prozentsatz des Tageswertes (%DV) angegeben. Bei der Kennzeichnung von Kupfer betrug 100 % des Tageswerts 2,0 mg, aber am 27. Mai 2016 wurde er auf 0,9 mg geändert, um ihn mit der RDA in Einklang zu bringen. Eine Tabelle mit den alten und neuen Tageswerten für Erwachsene finden Sie unter Reference Daily Intake. ⓘ
Mangel
Aufgrund seiner Rolle bei der Erleichterung der Eisenaufnahme kann Kupfermangel zu anämieähnlichen Symptomen, Neutropenie, Knochenanomalien, Hypopigmentierung, Wachstumsstörungen, vermehrtem Auftreten von Infektionen, Osteoporose, Hyperthyreose und Anomalien im Glukose- und Cholesterinstoffwechsel führen. Umgekehrt kommt es bei der Wilson-Krankheit zu einer Anhäufung von Kupfer in den Körpergeweben. ⓘ
Ein schwerer Mangel kann durch Testen auf niedrige Plasma- oder Serumkupferwerte, niedrige Ceruloplasmin- und niedrige Superoxiddismutase-Werte in den roten Blutkörperchen festgestellt werden; diese sind nicht empfindlich für einen marginalen Kupferstatus. Die "Cytochrom-c-Oxidase-Aktivität von Leukozyten und Thrombozyten" wurde als weiterer Faktor für einen Mangel angegeben, aber die Ergebnisse wurden nicht durch Replikation bestätigt. ⓘ
Toxizität
Gramm-Mengen verschiedener Kupfersalze wurden bei Selbstmordversuchen eingenommen und führten beim Menschen zu akuter Kupfertoxizität, möglicherweise aufgrund von Redox-Zyklen und der Bildung reaktiver Sauerstoffspezies, die die DNA schädigen. Entsprechende Mengen an Kupfersalzen (30 mg/kg) sind bei Tieren toxisch. Als Mindestwert für ein gesundes Wachstum bei Kaninchen wurde ein Anteil von mindestens 3 ppm in der Nahrung angegeben. Höhere Kupferkonzentrationen (100 ppm, 200 ppm oder 500 ppm) in der Kaninchennahrung können jedoch die Futterverwertung, die Wachstumsraten und den Prozentsatz der Schlachtkörperverwertung positiv beeinflussen. ⓘ
Eine chronische Kupfertoxizität tritt beim Menschen normalerweise nicht auf, da die Transportsysteme die Aufnahme und Ausscheidung regeln. Autosomal rezessiv vererbte Mutationen in Kupfertransportproteinen können diese Systeme ausschalten, was bei Personen, die zwei defekte Gene geerbt haben, zur Wilson-Krankheit mit Kupferanreicherung und Leberzirrhose führt. ⓘ
Erhöhte Kupferspiegel wurden auch mit einer Verschlimmerung der Symptome der Alzheimer-Krankheit in Verbindung gebracht. ⓘ
Exposition des Menschen
In den USA hat die Occupational Safety and Health Administration (OSHA) einen zulässigen Expositionsgrenzwert (PEL) für Kupferstaub und -dämpfe am Arbeitsplatz als zeitlich gewichteten Durchschnitt (TWA) von 1 mg/m3 festgelegt. Das National Institute for Occupational Safety and Health (NIOSH) hat einen empfohlenen Expositionsgrenzwert (REL) von 1 mg/m3, zeitlich gewichtetes Mittel, festgelegt. Der IDLH-Wert (unmittelbar lebens- und gesundheitsgefährdend) liegt bei 100 mg/m3. ⓘ
Kupfer ist ein Bestandteil des Tabakrauchs. Die Tabakpflanze nimmt Schwermetalle wie Kupfer aus dem umgebenden Boden leicht auf und reichert sie in ihren Blättern an. Diese werden nach dem Einatmen des Rauches leicht in den Körper des Benutzers aufgenommen. Die gesundheitlichen Folgen sind nicht klar. ⓘ