Tantal
 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Tantal | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /ˈtæntələm/ (TAN-təl-əm) | |||||||||||||||||||||||||||||||||||||||||||||||
| Erscheinungsbild | graublau | |||||||||||||||||||||||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Ta) |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Tantal im Periodensystem | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 73 | |||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | Gruppe 5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Periode | Periode 6 | |||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-Block | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Xenon|Xe]]] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 32, 11, 2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||
| Phase bei STP | fest | |||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3290 K (3017 °C, 5463 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5731 K (5458 °C, 9856 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 16,69 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 15 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 36,57 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 753 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Molare Wärmekapazität | 25,36 J/(mol-K) | |||||||||||||||||||||||||||||||||||||||||||||||
Verdampfungsdruck
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationsstufen | -3, -1, 0, +1, +2, +3, +4, +5 (ein leicht saures Oxid) | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Atomarer Radius | empirisch: 146 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 170±8 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Spektrallinien von Tantal | ||||||||||||||||||||||||||||||||||||||||||||||||
| Sonstige Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||
| Natürliches Vorkommen | primordial | |||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch-raumzentriert (bcc) α-Ta | |||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | tetragonal β-Ta | |||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | 3400 m/s (bei 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Thermische Ausdehnung | 6,3 µm/(m⋅K) (bei 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Thermische Leitfähigkeit | 57,5 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektrischer Widerstand | 131 nΩ⋅m (bei 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Magnetische Ordnung | paramagnetisch | |||||||||||||||||||||||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | +154,0×10-6 cm3/mol (293 K) | |||||||||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 186 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Schermodul | 69 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Elastizitätsmodul | 200 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0.34 | |||||||||||||||||||||||||||||||||||||||||||||||
| Mohs-Härte | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Vickers-Härte | 870-1200 MPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Brinell-Härte | 440-3430 MPa | |||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||
| Geschichte | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entdeckung | Anders Gustaf Ekeberg (1802) | |||||||||||||||||||||||||||||||||||||||||||||||
| Anerkannt als eigenständiges Element durch | Heinrich Rose (1844) | |||||||||||||||||||||||||||||||||||||||||||||||
| Hauptisotope von Tantal | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Tantal ist ein chemisches Element mit dem Symbol Ta und der Ordnungszahl 73. Es war früher unter dem Namen Tantalium bekannt und ist nach Tantalus, einem Bösewicht der griechischen Mythologie, benannt. Tantal ist ein seltenes, hartes, blaugraues, glänzendes Übergangsmetall, das sehr korrosionsbeständig ist. Es gehört zur Gruppe der Refraktärmetalle, die häufig als Nebenbestandteile in Legierungen verwendet werden. ⓘ
Die chemische Inertheit von Tantal macht es zu einem wertvollen Stoff für Laborgeräte und als Ersatz für Platin. Heute wird es hauptsächlich in Tantalkondensatoren in elektronischen Geräten wie Mobiltelefonen, DVD-Playern, Videospielsystemen und Computern verwendet. Tantal kommt, immer zusammen mit dem chemisch ähnlichen Niob, in den Mineralgruppen Tantalit, Kolumbit und Coltan vor (letzteres ist eine Mischung aus Kolumbit und Tantalit, wird aber nicht als eigene Mineralart anerkannt). Tantal wird von der Europäischen Kommission als ein technologiekritisches Element eingestuft. ⓘ
Geschichte
Tantal wurde 1802 in Schweden von Anders Ekeberg entdeckt, und zwar in zwei Mineralproben - eine aus Schweden und eine aus Finnland. Ein Jahr zuvor hatte Charles Hatchett das Kolumbium (heute Niob) entdeckt, und 1809 verglich der englische Chemiker William Hyde Wollaston dessen Oxid, Kolumbit, mit einer Dichte von 5,918 g/cm3 mit dem von Tantal, Tantalit, mit einer Dichte von 7,935 g/cm3. Er kam zu dem Schluss, dass die beiden Oxide trotz des Unterschieds in der gemessenen Dichte identisch sind, und behielt den Namen Tantal bei. Nachdem Friedrich Wöhler diese Ergebnisse bestätigt hatte, ging man davon aus, dass es sich bei Columbium und Tantal um dasselbe Element handelte. Diese Schlussfolgerung wurde 1846 von dem deutschen Chemiker Heinrich Rose bestritten, der behauptete, dass die Tantalitprobe zwei weitere Elemente enthielt, die er nach den Kindern des Tantalus benannte: Niobium (nach Niobe, der Göttin der Tränen) und Pelopium (nach Pelops). Das vermeintliche Element "Pelopium" wurde später als eine Mischung aus Tantal und Niob identifiziert, und es stellte sich heraus, dass das Niob mit dem bereits 1801 von Hatchett entdeckten Columbium identisch war. ⓘ
Die Unterschiede zwischen Tantal und Niob wurden 1864 von Christian Wilhelm Blomstrand und Henri Etienne Sainte-Claire Deville sowie von Louis J. Troost, der 1865 die empirischen Formeln einiger ihrer Verbindungen bestimmte, eindeutig nachgewiesen. Eine weitere Bestätigung kam 1866 von dem Schweizer Chemiker Jean Charles Galissard de Marignac, der nachwies, dass es nur zwei Elemente gab. Diese Entdeckungen hielten die Wissenschaftler nicht davon ab, bis 1871 Artikel über das so genannte Ilmenium zu veröffentlichen. De Marignac war der erste, der 1864 die metallische Form von Tantal herstellte, als er Tantalchlorid durch Erhitzen in einer Wasserstoffatmosphäre reduzierte. Frühe Forscher waren nur in der Lage, unreines Tantal herzustellen, und das erste relativ reine duktile Metall wurde 1903 von Werner von Bolton in Charlottenburg produziert. Drähte aus metallischem Tantal wurden für Glühbirnen verwendet, bis Wolfram das Metall in der breiten Öffentlichkeit ablöste. ⓘ
Der Name Tantal wurde vom Namen des mythologischen Tantalus abgeleitet, dem Vater von Niobe in der griechischen Mythologie. In der Geschichte wurde er nach dem Tod dazu verurteilt, knietief im Wasser zu stehen, während über seinem Kopf perfekte Früchte wuchsen, die ihn auf ewig verlockten. (Wenn er sich bückte, um das Wasser zu trinken, versickerte es unterhalb des von ihm erreichbaren Niveaus, und wenn er nach den Früchten griff, entzogen sich die Zweige seinem Zugriff). Anders Ekeberg schrieb: "Dieses Metall nenne ich Tantal ... zum Teil in Anspielung auf seine Unfähigkeit, wenn es in Säure getaucht wird, diese zu absorbieren und gesättigt zu werden." ⓘ
Jahrzehntelang bestand die kommerzielle Technologie zur Trennung von Tantal und Niob in der fraktionierten Kristallisation von Kaliumheptafluortantalat aus Kaliumoxypentafluoroniobat-Monohydrat, ein Verfahren, das 1866 von Jean Charles Galissard de Marignac entdeckt wurde. Diese Methode wurde durch die Lösungsmittelextraktion aus fluoridhaltigen Tantallösungen abgelöst. ⓘ

Das Element wurde 1802 von Anders Gustav Ekeberg sowohl in einem Tantalit-Erz aus Kimito in Finnland als auch in Yttererde aus Ytterby in Schweden gefunden. Er trennte ein sehr beständiges Oxid (Tantal(V)-oxid) ab, das sich in keiner Säure löste. Diese Unfähigkeit Säure aufzunehmen, auch wenn sie in großer Menge vorhanden ist, veranlasste Ekeberg in Anspielung auf die mythologische Figur des Tantalos, der mitten in einem Teich stehend nicht trinken konnte, das Metall Tantal zu nennen. ⓘ
Nach der Entdeckung des neuen Elements wurde von verschiedenen Chemikern versucht, Tantal auch elementar darzustellen. Der erste, der elementares Tantal durch Reduktion von Kaliumheptafluorotantalat mit Kalium darstellte, war 1824 Jöns Jakob Berzelius. Allerdings bestand sein Metall wie das von Rose dargestellte Tantal nur zu 50 % aus Tantal. Henri Moissan versuchte 1902, Tantal im elektrischen Ofen herzustellen, sein Produkt war jedoch durch den enthaltenen Kohlenstoff sehr hart und spröde. ⓘ
Der erste, der reines, duktiles Tantal herstellen konnte, war Werner von Bolton 1903. Er erreichte dies durch Reduktion der glühenden Oxide im Vakuum sowie durch Schmelzen von unreinem Tantalmetall im Vakuum und elektrischem Flammenbogen. ⓘ
Die erste Anwendung des neuen Elementes war diejenige als Glühfaden in Glühlampen. Der Grund für den Wechsel vom vorher verwendeten Osmium zu Tantal lag darin, dass es leichter zu verarbeiten ist und eine höhere mögliche Nutztemperatur bis zu 2300 °C besitzt. Später wurde es durch Wolfram ersetzt, das einen noch höheren Schmelzpunkt besitzt und damit ein dem Sonnenlicht näheres Lichtspektrum und eine höhere Lichtausbeute ermöglicht. ⓘ
Im Jahr 1922 wurde mit der Verwendung in Gleichrichtern und ein Jahr später in Radioröhren ein neuer Einsatzzweck für Tantal gefunden. ⓘ
Vorkommen

Der Gewichtsanteil von Tantal in der Erdkruste wird auf etwa 1 bis 2 ppm geschätzt. Es gibt viele Arten von Tantalmineralen, von denen bisher nur einige von der Industrie als Rohstoffe verwendet werden: Tantalit (eine Reihe bestehend aus Tantalit-(Fe), Tantalit-(Mn) und Tantalit-(Mg)), Mikrolith (jetzt ein Gruppenname), Wodginit, Euxenit (eigentlich Euxenit-(Y)) und Polykras (eigentlich Polykras-(Y)). Tantalit (Fe, Mn)Ta2O6 ist das wichtigste Mineral für die Tantalgewinnung. Tantalit hat die gleiche Mineralstruktur wie Kolumbit (Fe, Mn) (Ta, Nb)2O6; wenn mehr Tantal als Niob vorhanden ist, spricht man von Tantalit und wenn mehr Niob als Tantal vorhanden ist, von Kolumbit (oder Niobit). Aufgrund der hohen Dichte von Tantalit und anderen tantalhaltigen Mineralien ist die Trennung durch Schwerkraft die beste Methode. Zu den anderen Mineralien gehören Samarskit und Fergusonit. ⓘ
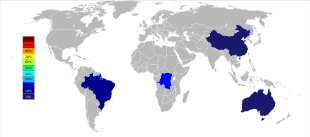
Vor den 2010er Jahren war Australien der Hauptproduzent von Tantal, wobei Global Advanced Metals (früher bekannt als Talison Minerals) das größte Tantalbergbauunternehmen des Landes ist. Das Unternehmen betreibt zwei Minen in Westaustralien, Greenbushes im Südwesten und Wodgina in der Pilbara-Region. Die Wodgina-Mine wurde im Januar 2011 wiedereröffnet, nachdem der Bergbau an diesem Standort Ende 2008 aufgrund der weltweiten Finanzkrise eingestellt worden war. Weniger als ein Jahr nach der Wiedereröffnung gab Global Advanced Metals bekannt, dass der Tantalabbau Ende Februar 2012 unter anderem wegen der nachlassenden Nachfrage nach Tantal eingestellt werden sollte. Wodgina produziert ein primäres Tantalkonzentrat, das im Greenbushes-Betrieb weiter veredelt wird, bevor es an Kunden verkauft wird. Die großen Niobproduzenten befinden sich in Brasilien und Kanada, wobei das dortige Erz auch einen geringen Anteil an Tantal enthält. Einige andere Länder wie China, Äthiopien und Mosambik bauen Erze mit einem höheren Tantalanteil ab und produzieren einen beträchtlichen Anteil der Weltproduktion. Tantal wird auch in Thailand und Malaysia als Nebenprodukt des dortigen Zinnabbaus gewonnen. Bei der Schwerkrafttrennung der Erze aus den Seifenlagerstätten wird nicht nur Kassiterit (SnO2), sondern auch ein geringer Prozentsatz an Tantalit gefunden. Die Schlacke aus den Zinnhütten enthält dann wirtschaftlich nutzbare Mengen an Tantal, das aus der Schlacke ausgelaugt wird. ⓘ

Die weltweite Tantalminenproduktion hat sich seit Beginn des 21. Jahrhunderts, als die Produktion hauptsächlich aus Australien und Brasilien stammte, geografisch stark verlagert. Ab 2007 und bis 2014 verlagerten sich die Hauptquellen der Tantalproduktion aus Minen drastisch in die Demokratische Republik Kongo, Ruanda und einige andere afrikanische Länder. Künftige Tantalvorkommen - in der Reihenfolge ihres geschätzten Umfangs - werden in Saudi-Arabien, Ägypten, Grönland, China, Mosambik, Kanada, Australien, den Vereinigten Staaten, Finnland und Brasilien erschlossen. ⓘ
Schätzungen zufolge werden die Tantalvorkommen um das Jahr 2060 erschöpft sein, wenn man von der derzeitigen Abbaurate ausgeht, was die Notwendigkeit eines verstärkten Recyclings verdeutlicht. ⓘ
Tantal ist mit einem Gehalt von 2 ppm in der kontinentalen Erdkruste bzw. 8 ppm in der Erdhülle ein seltenes Element auf der Erde. Die Häufigkeit ist vergleichbar mit der von Arsen und Germanium. Innerhalb der Gruppe nimmt die Häufigkeit jeweils um eine Zehnerpotenz ab. Im Sonnensystem ist 180mTa sogar das seltenste stabile Isotop unter den seltenen Elementen. ⓘ

Einige Tantalerze wie z. B. die tantalreichen Vertreter der Columbit-Tantalit-Mischkistallreihe wurden 2012 von der US-amerikanischen Börsenaufsicht SEC als so genanntes Konfliktmineral eingestuft, dessen Verwendung für Unternehmen gegenüber der SEC berichtspflichtig ist. Als Grund hierfür werden ebendiese Produktionsorte im Osten des Kongo angeführt, die von Rebellen kontrolliert werden und so im Verdacht stehen, bewaffnete Konflikte mitzufinanzieren. ⓘ
Tantal wird als Konfliktressource betrachtet. Coltan, die industrielle Bezeichnung für ein Kolumbit-Tantalit-Mineral, aus dem Niob und Tantal gewonnen werden, kommt auch in Zentralafrika vor, weshalb Tantal mit der Kriegsführung in der Demokratischen Republik Kongo (früher Zaire) in Verbindung gebracht wird. Einem Bericht der Vereinten Nationen vom 23. Oktober 2003 zufolge haben der Schmuggel und der Export von Coltan dazu beigetragen, den Krieg im Kongo anzuheizen, eine Krise, die seit 1998 etwa 5,4 Millionen Tote gefordert hat und damit der weltweit tödlichste dokumentierte Konflikt seit dem Zweiten Weltkrieg ist. Die Ausbeutung von Rohstoffen wie Coltan in den bewaffneten Konfliktregionen des Kongobeckens wirft ethische Fragen in Bezug auf verantwortungsbewusstes unternehmerisches Handeln, Menschenrechte und die Gefährdung der Tierwelt auf. Der United States Geological Survey berichtet in seinem Jahrbuch, dass diese Region zwischen 2002 und 2006 etwas weniger als 1 % der weltweiten Tantalproduktion produzierte und in den Jahren 2000 und 2008 einen Spitzenwert von 10 % erreichte. Aus den im Januar 2021 veröffentlichten Daten des USGS geht hervor, dass fast 40 % der weltweiten Tantalminenproduktion aus der Demokratischen Republik Kongo stammen, weitere 18 % aus den Nachbarländern Ruanda und Burundi. ⓘ
Das erklärte Ziel des Tantalprojekts Solutions for Hope ist es, "konfliktfreies Tantal aus der Demokratischen Republik Kongo zu beziehen". ⓘ
Gewinnung und Darstellung
Die Raffination von Tantal aus seinen Erzen ist einer der anspruchsvollsten Trennungsprozesse in der industriellen Metallurgie. Das Hauptproblem besteht darin, dass Tantalerze beträchtliche Mengen an Niob enthalten, dessen chemische Eigenschaften fast identisch mit denen von Ta sind. Um diese Herausforderung zu meistern, wurde eine Vielzahl von Verfahren entwickelt. ⓘ
In der heutigen Zeit wird die Trennung durch Hydrometallurgie erreicht. Die Extraktion beginnt mit der Auslaugung des Erzes mit Flusssäure in Verbindung mit Schwefelsäure oder Salzsäure. Dieser Schritt ermöglicht es, Tantal und Niob von den verschiedenen nichtmetallischen Verunreinigungen im Gestein zu trennen. Obwohl Ta in verschiedenen Mineralien vorkommt, wird es praktischerweise als Pentoxid dargestellt, da sich die meisten Oxide von Tantal(V) unter diesen Bedingungen ähnlich verhalten. Eine vereinfachte Gleichung für die Extraktion lautet wie folgt:
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O ⓘ
Völlig analoge Reaktionen laufen für die Niobkomponente ab, aber das Hexafluorid ist unter den Bedingungen der Extraktion typischerweise vorherrschend.
- Nb2O5 + 12 HF → 2 H[NbF6] + 5 H2O
Diese Gleichungen sind vereinfacht: Es wird vermutet, dass Bisulfat (HSO4-) und Chlorid als Liganden für die Nb(V)- und Ta(V)-Ionen konkurrieren, wenn Schwefelsäure bzw. Salzsäure verwendet wird. Die Tantal- und Niobfluoridkomplexe werden dann aus der wässrigen Lösung durch Flüssig-Flüssig-Extraktion in organische Lösungsmittel wie Cyclohexanon, Octanol und Methylisobutylketon entfernt. Mit diesem einfachen Verfahren lassen sich die meisten metallhaltigen Verunreinigungen (z. B. Eisen, Mangan, Titan, Zirkonium) entfernen, die in Form ihrer Fluoride und anderer Komplexe in der wässrigen Phase verbleiben. ⓘ
Die Abtrennung von Tantal und Niob erfolgt dann durch Herabsetzung der Ionenstärke des Säuregemischs, wodurch sich das Niob in der wässrigen Phase auflöst. Es wird angenommen, dass sich unter diesen Bedingungen das Oxyfluorid H2[NbOF5] bildet. Nach der Entfernung des Niobs wird die Lösung des gereinigten H2[TaF7] mit wässrigem Ammoniak neutralisiert, um hydratisiertes Tantaloxid als Feststoff auszufällen, der zu Tantalpentoxid (Ta2O5) kalziniert werden kann. ⓘ
Anstelle der Hydrolyse kann H2[TaF7] mit Kaliumfluorid behandelt werden, um Kaliumheptafluortantalat herzustellen:
- H2[TaF7] + 2 KF → K2[TaF7] + 2 HF
Im Gegensatz zu H2[TaF7] lässt sich das Kaliumsalz leicht kristallisieren und als Feststoff handhaben. ⓘ
K2[TaF7] kann durch Reduktion mit Natrium bei ca. 800 °C in der Salzschmelze in metallisches Tantal umgewandelt werden. ⓘ
- K2[TaF7] + 5 Na → Ta + 5 NaF + 2 KF ⓘ
Bei einer älteren Methode, dem so genannten Marignac-Verfahren, wurde das Gemisch aus H2[TaF7] und H2[NbOF5] in ein Gemisch aus K2[TaF7] und K2[NbOF5] umgewandelt, das dann durch fraktionierte Kristallisation unter Ausnutzung ihrer unterschiedlichen Wasserlöslichkeit getrennt wurde. ⓘ
Da in den zur Tantalgewinnung verwendeten Erzen Tantal und Niob immer zusammen vorliegen, müssen sie für eine Gewinnung der Reinmetalle getrennt werden. Dies wird durch die große Ähnlichkeit der beiden Elemente erschwert. ⓘ
Das erste Verfahren zur Trennung wurde 1866 von Jean Charles Galissard de Marignac entwickelt. Er nutzte dabei die unterschiedliche Löslichkeit der beiden Elemente in verdünnter Flusssäure. Tantal bildet das gering lösliche K2TaF7, Niob das gut lösliche K3NbOF5 ·2 H2O. ⓘ
Eine mögliche Alternative zur Extraktion besteht in der fraktionierten Destillation. Dazu werden die unterschiedlichen Siedepunkte der beiden Chloride Niob(V)-chlorid und Tantal(V)-chlorid genutzt. Diese können bei hohen Temperaturen aus den Erzen mit Chlor und Koks gewonnen werden. Nach der Trennung wird das Tantalchlorid ebenfalls mit Natrium zum Metall reduziert. ⓘ
Neben den Columbit-Tantalit-Erzen sind Schlacken aus der Zinnverhüttung eine wichtige Quelle für die Tantalgewinnung (enthalten wenige Prozent Tantal). ⓘ
Recycling
Tantal aus Kondensatoren in elektronischen Baugruppen wird fast gar nicht recycelt. Die bei der Pulverherstellung und der Herstellung von Kondensatoren entstehenden internen Abfälle dagegen kommen für das Recycling in Frage. Bei der Herstellung von Tantal-Walzerzeugnissen (20 % des Verbrauchs) fallen Späne und Fehlchargen an, die durch Umschmelzen effektiv zu recyceln sind. Außerdem sind Tantalcarbid-Legierungzusätze aus Hartmetallen und die Reste von Sputtertargets recycelbar. ⓘ
Tantal(V)-oxid aus Gläsern und solches in Form von Lithiumtantalat-Einkristallen in Elektronikbauteilen erfordert einen aufwendigen chemischen Recyclingprozess. Dieser umfasst Rösten, Auflösen in Flusssäure oder Schwefelsäure, Solventextraktion mit Ketonen sowie die Fällung von Tantal(V)-oxid oder die Kristallisation von Kaliumfluorotantalat. Diese werden anschließend im Elektronenstrahlofen aufgeschmolzen. ⓘ
Aus End-of-Life-Schrotten werden weltweit ca. 10 % des enthaltenen Tantals zurückgewonnen, die fast ausschließlich aus gewerblichen Anwendungen stammen. Die Rückführung von Tantal aus Superlegierungen und Sputtertargets funktioniert besser als die Rückführung aus Kondensatoren, Chemikalien und Hartmetallen. In Konsumgütern wie z. B. Smartphones und anderen mobilen elektronischen Geräten ist zwar Tantal enthalten, jedoch ist dessen Konzentration für das Recycling zu gering. Zusammen mit Neuschrotten, die bei der Produktion und Weiterverarbeitung anfallen, ergibt sich eine Schrotteinsatzquote von ca. 25 % in der Tantalproduktion. ⓘ
Eigenschaften
Physikalische Eigenschaften
Tantal ist dunkel (blaugrau), dicht, dehnbar, sehr hart, leicht zu bearbeiten und hat eine hohe Wärme- und Stromleitfähigkeit. Das Metall ist für seine Korrosionsbeständigkeit gegenüber Säuren bekannt; bei Temperaturen unter 150 °C ist Tantal sogar fast völlig immun gegen den Angriff des normalerweise aggressiven Königswassers. Es lässt sich mit Flusssäure oder sauren Lösungen, die Fluoridionen und Schwefeltrioxid enthalten, sowie mit Kaliumhydroxid auflösen. Der hohe Schmelzpunkt von Tantal von 3017 °C (Siedepunkt 5458 °C) wird unter den Elementen nur von Wolfram, Rhenium und Osmium für Metalle und Kohlenstoff übertroffen. ⓘ
Tantal kommt in zwei kristallinen Phasen vor, der Alpha- und der Beta-Phase. Die Alpha-Phase ist relativ duktil und weich; sie hat eine kubisch-raumzentrierte Struktur (Raumgruppe Im3m, Gitterkonstante a = 0,33058 nm), eine Knoop-Härte von 200-400 HN und einen spezifischen elektrischen Widerstand von 15-60 µΩ⋅cm. Die Beta-Phase ist hart und spröde; ihre Kristallsymmetrie ist tetragonal (Raumgruppe P42/mnm, a = 1,0194 nm, c = 0,5313 nm), die Knoop-Härte beträgt 1000-1300 HN und der spezifische elektrische Widerstand ist mit 170-210 µΩ⋅cm relativ hoch. Die Beta-Phase ist metastabil und wandelt sich beim Erhitzen auf 750-775 °C in die Alpha-Phase um. Tantal besteht fast ausschließlich aus der Alpha-Phase, und die Beta-Phase liegt gewöhnlich in Form von dünnen Schichten vor, die durch Magnetron Sputtern, chemisches Aufdampfen oder elektrochemisches Abscheiden aus einer eutektischen Salzschmelze. ⓘ

Tantal ist ein deutlich lilagraues, stahlhartes (Vickershärte: 60–120 HV), hochschmelzendes Schwermetall, das in den meisten seiner Eigenschaften dem Niob ähnelt. Es kristallisiert in einer kubisch-raumzentrierten Kristallstruktur. Neben der kubischen α-Struktur ist auch β-Tantal bekannt, das in einer tetragonalen, dem β-Uran entsprechenden, Kristallstruktur mit den Gitterparametern a = 1021 pm und c = 531 pm kristallisiert. Diese Modifikation ist metastabil und lässt sich durch Elektrolyse einer Tantalfluoridschmelze gewinnen. ⓘ
Unterhalb einer Sprungtemperatur von 4,3 Kelvin wird Tantal zum Supraleiter. ⓘ
Während reines Tantal duktil ist und sich stark dehnen lässt (Zugfestigkeit: 240 MPa), verändern schon kleine Mengen Beimengungen an Kohlenstoff oder Wasserstoff die mechanische Festigkeit deutlich. Das Material wird spröde und schwer zu verarbeiten. Man nutzt diesen Sachverhalt zur Herstellung von Tantalpulver. Es wird in der Technik mit Wasserstoff beladen und somit versprödet, dann entsprechend zerkleinert und bei höherer Temperatur durch Ausheizen wieder vom Wasserstoff befreit. ⓘ
Chemische Eigenschaften
Tantal ist ein unedles Metall und reagiert bei hohen Temperaturen mit den meisten Nichtmetallen, wie Sauerstoff, den Halogenen oder Kohlenstoff. Bei Raumtemperatur ist das Metall allerdings durch eine dünne Schicht aus Tantal(V)-oxid geschützt und damit passiviert. Eine Reaktion findet erst ab einer Temperatur von etwa 300 °C statt. Als Pulver ist es ein entzündbarer Feststoff, der durch kurzzeitige Einwirkung einer Zündquelle leicht entzündet werden kann und dann nach deren Entfernung weiterbrennt. Die Entzündungsgefahr ist umso größer, je feiner der Stoff verteilt ist. Das Metall in kompakter Form ist nicht brennbar. ⓘ
In den meisten Säuren ist Tantal wegen der Passivierung nicht löslich, sogar Königswasser vermag das Metall nicht zu lösen. Angegriffen wird Tantal nur von Flusssäure, Oleum (einer Mischung von Schwefelsäure und Schwefeltrioxid) und Salzschmelzen. ⓘ
Isotope
Natürliches Tantal besteht aus zwei Isotopen: 180mTa (0,012 %) und 181Ta (99,988 %). 181Ta ist ein stabiles Isotop. Der Zerfall von 180mTa (m bezeichnet einen metastabilen Zustand) wird auf drei Arten vorhergesagt: isomerer Übergang zum Grundzustand von 180Ta, Betazerfall zu 180W oder Elektroneneinfang zu 180Hf. Die Radioaktivität dieses Kernisomers wurde jedoch nie beobachtet, und es wurde lediglich eine untere Grenze für seine Halbwertszeit von 2,0 × 1016 Jahren festgelegt. Der Grundzustand von 180Ta hat eine Halbwertszeit von nur 8 Stunden. 180mTa ist das einzige natürlich vorkommende nukleare Isomer (ohne radiogene und kosmogene kurzlebige Nuklide). Unter Berücksichtigung der Elementhäufigkeit von Tantal und der Isotopenhäufigkeit von 180mTa in der natürlichen Isotopenmischung (wiederum unter Ausschluss radiogener und kosmogener kurzlebiger Nuklide) ist es auch das seltenste primordiale Isotop im Universum. ⓘ
Tantal wurde theoretisch als "Salz"-Material für Kernwaffen untersucht (Kobalt ist das bekanntere hypothetische Salz-Material). Eine äußere Hülle aus 181Ta würde durch den intensiven hochenergetischen Neutronenfluss einer hypothetischen explodierenden Kernwaffe bestrahlt werden. Dadurch würde das Tantal in das radioaktive Isotop 182Ta umgewandelt, das eine Halbwertszeit von 114,4 Tagen hat und Gammastrahlen mit einer Energie von etwa 1,12 Millionen Elektronenvolt (MeV) pro Stück erzeugt, was die Radioaktivität des nuklearen Fallouts der Explosion für mehrere Monate erheblich erhöhen würde. Soweit öffentlich bekannt ist, wurden solche "gesalzenen" Waffen noch nie gebaut oder getestet und schon gar nicht als Waffen eingesetzt. ⓘ
Tantal kann als Zielmaterial für beschleunigte Protonenstrahlen zur Erzeugung verschiedener kurzlebiger Isotope wie 8Li, 80Rb und 160Yb verwendet werden. ⓘ
Verwendung

Der größte Teil des Tantals (weltweite Jahresproduktionsmenge 1.400 t) wird für sehr kleine Kondensatoren mit hoher Kapazität verwendet. 2007 wurden 60 % des Tantals für die Herstellung von Kondensatoren gebraucht. Diese Tantal-Elektrolytkondensatoren werden überall in der modernen Mikroelektronik, beispielsweise für Mobiltelefone und im Automobilbau, eingesetzt. Die Wirkung beruht auf der selbst in sehr dünner Ausführung noch stabilen und sicher isolierenden Tantaloxidschicht auf der Oberfläche der aufgewickelten Tantalfolie. Je dünner die Schicht zwischen den Elektroden ist, desto höher wird die Kapazität bei gleichbleibender Folienfläche; zudem hat Tantaloxid eine extrem hohe Permittivität, die ebenfalls die Kapazität erhöht. ⓘ
Da Tantal nicht giftig ist und nicht mit Körpergewebe oder -flüssigkeiten reagiert, wird elementares Tantal für medizinische Implantate und Instrumente eingesetzt. Es werden beispielsweise Knochennägel, Prothesen, Klammern und Kieferschrauben aus Tantal gefertigt. Als Beschichtung auf einem porösen Karbon-Gitter erzielt es eine besonders gute Osseointegration, weshalb Tantal-beschichtete Implantate vor allem in der Rekonstruktionschirurgie bei größeren tumor- oder infektbedingten Knochensubstanzverlusten eingesetzt wird, ohne dass es allerdings antimikrobiell wirkt. Daneben ist es ein aufgrund der hohen Kosten wenig eingesetztes Röntgenkontrastmittel. ⓘ
In der chemischen Industrie wird Tantal wegen seiner Beständigkeit eingesetzt. Es dient als Auskleidungsmaterial für Reaktionskessel und wird für Wärmeaustauscher und Pumpen verwendet. Für diese Zwecke wird meist kein reines Tantal, sondern Legierungen, die 2,5–10 % Wolfram enthalten, verwendet. Diese sind stabiler und widerstandsfähiger als reines Tantal. Gleichzeitig bleibt die erwünschte Duktilität erhalten. Weitere Verwendungszwecke sind Laborgeräte, Spinndüsen und die Kathoden von Elektronenröhren. Hier kommt Tantal zugute, dass es in der Lage ist, bei 800 °C bis zu 740 Volumenteile Gase aufzunehmen (Getterwirkung), was ein hohes Vakuum in den Röhren gewährleistet. ⓘ
Superlegierungen, die im Bau von Turbinen und Flugzeugtriebwerken eingesetzt werden, enthalten bis zu 9 % Tantal. So erhöht der Zusatz von 3–4 % Tantal zu einer Nickel-Superlegierung die Festigkeit des Materials bei hohen Temperaturen. ⓘ
Sicherheitshinweise
Unter Laborbedingungen verursacht der Umgang mit Tantal und seinen Verbindungen normalerweise keine Probleme. Elementares Tantal wie auch Tantalverbindungen sind nicht toxisch. Es gibt aber vage Hinweise auf krebsauslösendes Verhalten einiger Tantalverbindungen. Von Tantalpulver und -staub geht – wie auch von anderen fein verteilten Metallen – eine hohe Feuer- und Explosionsgefahr aus. ⓘ
Verbindungen
Tantal(V)-oxid Ta2O5 ist ein weißes Pulver, das zur Herstellung hochlichtbrechender Gläser und spezieller Kristallmaterialien verwendet wird. ⓘ
Tantalcarbid TaC dient mit seiner Schmelztemperatur von 3880 °C und einer Härte, die ähnlich der von Quarz ist, als Schutzschicht auf hochwarmfesten Legierungen in Triebwerken und Schneidwerkzeugen. ⓘ
Chemische Verbindungen
Oxide, Nitride, Karbide, Sulfide
Tantalpentoxid (Ta2O5) ist aus Sicht der Anwendungen die wichtigste Verbindung. Die Oxide von Tantal in niedrigeren Oxidationsstufen sind zahlreich, einschließlich vieler Defektstrukturen, und sind nur wenig untersucht oder schlecht charakterisiert. ⓘ
Tantalate, Verbindungen, die [TaO4]3- oder [TaO3]- enthalten, sind sehr zahlreich. Lithiumtantalat (LiTaO3) weist eine Perowskitstruktur auf. Lanthantantalat (LaTaO4) enthält isolierte TaO3-
4-Tetraeder. ⓘ
Wie bei den anderen hochschmelzenden Metallen sind die härtesten bekannten Tantalverbindungen Nitride und Carbide. Tantalkarbid (TaC) ist wie das häufiger verwendete Wolframkarbid eine harte Keramik, die in Schneidwerkzeugen verwendet wird. Tantal(III)-nitrid wird als Dünnschicht-Isolator in einigen mikroelektronischen Herstellungsverfahren verwendet. ⓘ
Das am besten untersuchte Chalkogenid ist TaS2, ein geschichteter Halbleiter, wie er auch für andere Übergangsmetall-Dichalkogenide verwendet wird. Eine Tantal-Tellur-Legierung bildet Quasikristalle. ⓘ
Halogenide
Tantalhalogenide umfassen die Oxidationsstufen +5, +4 und +3. Tantalpentafluorid (TaF5) ist ein weißer Feststoff mit einem Schmelzpunkt von 97,0 °C. Das Anion [TaF7]2- wird für die Abtrennung von Niob verwendet. Das Chlorid TaCl
5, das als Dimer vorliegt, ist das wichtigste Reagenz bei der Synthese neuer Ta-Verbindungen. Es lässt sich leicht zu einem Oxychlorid hydrolysieren. Die niederen Halogenide TaX
4 und TaX
3, weisen Ta-Ta-Bindungen auf. ⓘ
Organotantal-Verbindungen
Zu den Organotantalverbindungen gehören Pentamethyltantal, gemischte Alkyltantalchloride, Alkyltantalhydride, Alkylidenkomplexe sowie Cyclopentadienylderivate derselben. Diverse Salze und substituierte Derivate sind für das Hexacarbonyl [Ta(CO)6]- und verwandte Isocyanide bekannt. ⓘ

Produktion und Fabrikation

Bei der Gewinnung von Tantal aus Tantalit sind mehrere Schritte erforderlich. Zunächst wird das Mineral zerkleinert und durch Schwerkraftabscheidung konzentriert. Dies geschieht in der Regel in der Nähe des Minenstandortes. ⓘ
Elektrolyse
Tantal kann auch durch Elektrolyse gereinigt werden, wobei eine modifizierte Version des Hall-Héroult-Verfahrens verwendet wird. Anstatt dass das Eingangsoxid und das Ausgangsmetall in flüssiger Form vorliegen müssen, arbeitet die Tantal-Elektrolyse mit nicht flüssigen, pulverförmigen Oxiden. Die erste Entdeckung erfolgte 1997, als Forscher der Universität Cambridge kleine Proben bestimmter Oxide in Bäder mit geschmolzenem Salz tauchten und das Oxid mit elektrischem Strom reduzierten. Für die Kathode wird pulverförmiges Metalloxid verwendet. Die Anode besteht aus Kohlenstoff. Das geschmolzene Salz mit einer Temperatur von 1.000 °C (1.830 °F) ist der Elektrolyt. Die Kapazität der ersten Raffinerie reicht aus, um 3-4 % des weltweiten Jahresbedarfs zu decken. ⓘ
Herstellung und Metallbearbeitung
Alle Schweißarbeiten an Tantal müssen in einer inerten Atmosphäre aus Argon oder Helium durchgeführt werden, um es vor Verunreinigungen durch atmosphärische Gase zu schützen. Tantal ist nicht lötbar. Das Schleifen von Tantal ist schwierig, insbesondere bei geglühtem Tantal. Im geglühten Zustand ist Tantal äußerst dehnbar und lässt sich leicht zu Blechen formen. ⓘ
Umweltaspekte
Tantal findet im Umweltbereich weit weniger Beachtung als in anderen Geowissenschaften. Die Konzentration in der oberen Kruste (Upper Crust Concentration, UCC) und das Nb/Ta-Verhältnis in der oberen Kruste und in Mineralien sind verfügbar, da diese Messungen als geochemisches Instrument nützlich sind. Der jüngste Wert für die Konzentration in der oberen Kruste beträgt 0,92 ppm, und das Nb/Ta(w/w)-Verhältnis liegt bei 12,7. ⓘ
Es liegen nur wenige Daten über die Tantalkonzentrationen in den verschiedenen Umweltkompartimenten vor, insbesondere in natürlichen Gewässern, für die noch nicht einmal zuverlässige Schätzungen der "gelösten" Tantalkonzentrationen in Meer- und Süßwasser vorliegen. Es wurden zwar einige Werte zu den gelösten Konzentrationen in den Ozeanen veröffentlicht, diese sind jedoch widersprüchlich. Die Werte in Süßgewässern sind etwas besser, liegen aber in allen Fällen wahrscheinlich unter 1 ng L-1, da die "gelösten" Konzentrationen in natürlichen Gewässern weit unter den meisten derzeitigen analytischen Möglichkeiten liegen. Die Analyse erfordert Vorkonzentrationsverfahren, die derzeit keine konsistenten Ergebnisse liefern. In jedem Fall scheint Tantal in natürlichen Gewässern eher in Form von Partikeln als in gelöster Form vorzuliegen. ⓘ
Werte für Konzentrationen in Böden, Sedimenten und atmosphärischen Aerosolen sind leichter zu finden. Die Werte in Böden liegen nahe bei 1 ppm und damit bei den UCC-Werten. Dies deutet auf einen detritischen Ursprung hin. Für atmosphärische Aerosole sind die verfügbaren Werte verstreut und begrenzt. Wenn eine Anreicherung von Tantal beobachtet wird, ist dies wahrscheinlich auf den Verlust von mehr wasserlöslichen Elementen in Aerosolen in den Wolken zurückzuführen. ⓘ
Eine Verschmutzung durch die menschliche Nutzung des Elements wurde nicht festgestellt. Tantal scheint in biogeochemischer Hinsicht ein sehr konservatives Element zu sein, aber sein Kreislauf und seine Reaktivität sind noch nicht vollständig geklärt. ⓘ
Vorsichtsmaßnahmen
Tantalhaltige Verbindungen sind im Labor selten anzutreffen. Das Metall ist in hohem Maße biokompatibel und wird für Körperimplantate und Beschichtungen verwendet, so dass die Aufmerksamkeit auf andere Elemente oder die physikalische Beschaffenheit der chemischen Verbindung gerichtet werden kann. ⓘ
Menschen können Tantal am Arbeitsplatz ausgesetzt sein, indem sie es einatmen, mit der Haut oder den Augen in Berührung kommen. Die Occupational Safety and Health Administration (OSHA) hat den gesetzlichen Grenzwert (zulässiger Expositionsgrenzwert) für die Exposition gegenüber Tantal am Arbeitsplatz auf 5 mg/m3 an einem 8-Stunden-Arbeitstag festgelegt. Das National Institute for Occupational Safety and Health (NIOSH) hat einen empfohlenen Expositionsgrenzwert (REL) von 5 mg/m3 über einen 8-Stunden-Arbeitstag und einen Kurzzeitgrenzwert von 10 mg/m3 festgelegt. Bei einer Konzentration von 2500 mg/m3 ist Tantal unmittelbar lebens- und gesundheitsgefährlich. ⓘ

