Blei
 | ||||||||||||||||||||||||||
| Blei | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /ˈlɛd/ (led) | |||||||||||||||||||||||||
| Erscheinungsbild | metallisch grau | |||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Pb) |
| |||||||||||||||||||||||||
| Blei im Periodensystem | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Ordnungszahl (Z) | 82 | |||||||||||||||||||||||||
| Gruppe | Gruppe 14 (Kohlenstoffgruppe) | |||||||||||||||||||||||||
| Periode | Periode 6 | |||||||||||||||||||||||||
| Block | p-Block | |||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Xenon|Xe]]] 4f14 5d10 6s2 6p2 | |||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 32, 18, 4 | |||||||||||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||||||||||
| Phase bei STP | fest | |||||||||||||||||||||||||
| Schmelzpunkt | 600,61 K (327,46 °C, 621,43 °F) | |||||||||||||||||||||||||
| Siedepunkt | 2022 K (1749 °C, 3180 °F) | |||||||||||||||||||||||||
| Dichte (nahe r.t.) | 11,34 g/cm3 | |||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 10,66 g/cm3 | |||||||||||||||||||||||||
| Schmelzwärme | 4,77 kJ/mol | |||||||||||||||||||||||||
| Verdampfungswärme | 179,5 kJ/mol | |||||||||||||||||||||||||
| Molare Wärmekapazität | 26.650 J/(mol-K) | |||||||||||||||||||||||||
Verdampfungsdruck
| ||||||||||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||||||||||
| Oxidationsstufen | -4, -2, -1, +1, +2, +3, +4 (ein amphoteres Oxid) | |||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 2,33 (bei +4), 1,87 (bei +2) | |||||||||||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||||||||||
| Atomradius | empirisch: 175 pm | |||||||||||||||||||||||||
| Kovalenter Radius | 146±5 pm | |||||||||||||||||||||||||
| Van-der-Waals-Radius | 202 pm | |||||||||||||||||||||||||
| Spektrallinien von Blei | ||||||||||||||||||||||||||
| Andere Eigenschaften | ||||||||||||||||||||||||||
| Natürliches Vorkommen | primordial | |||||||||||||||||||||||||
| Kristallstruktur | kubisch-flächenzentriert (fcc) a=495,08 pm | |||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | 1190 m/s (bei r.t.) (geglüht) | |||||||||||||||||||||||||
| Thermische Ausdehnung | 28,9 µm/(m⋅K) (bei 25 °C) | |||||||||||||||||||||||||
| Wärmeleitfähigkeit | 35,3 W/(m⋅K) | |||||||||||||||||||||||||
| Elektrischer Widerstand | 208 nΩ⋅m (bei 20 °C) | |||||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | |||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -23,0×10-6 cm3/mol (bei 298 K) | |||||||||||||||||||||||||
| Elastizitätsmodul | 16 GPa | |||||||||||||||||||||||||
| Schermodul | 5,6 GPa | |||||||||||||||||||||||||
| Elastizitätsmodul | 46 GPa | |||||||||||||||||||||||||
| Poissonzahl | 0.44 | |||||||||||||||||||||||||
| Mohs-Härte | 1.5 | |||||||||||||||||||||||||
| Brinell-Härte | 38-50 MPa | |||||||||||||||||||||||||
| CAS-Nummer | 7439-92-1 | |||||||||||||||||||||||||
| Geschichte | ||||||||||||||||||||||||||
| Entdeckung | Naher Osten (7000 v. Chr.) | |||||||||||||||||||||||||
| Symbol | "Pb": aus dem Lateinischen plumbum | |||||||||||||||||||||||||
| Hauptisotope von Blei | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Isotopenhäufigkeiten variieren stark je nach Probe | ||||||||||||||||||||||||||
Blei ist ein chemisches Element mit dem Symbol Pb (aus dem Lateinischen plumbum) und der Ordnungszahl 82. Es ist ein Schwermetall, das dichter ist als die meisten herkömmlichen Materialien. Blei ist weich und verformbar und hat einen relativ niedrigen Schmelzpunkt. Im frischen Zustand ist Blei silbrig mit einem Hauch von Blau; an der Luft läuft es mattgrau an. Blei hat die höchste Ordnungszahl aller stabilen Elemente, und drei seiner Isotope sind Endpunkte großer Kernzerfallsketten schwererer Elemente. ⓘ
Blei ist ein relativ unreaktives Post-Übergangsmetall. Sein schwacher metallischer Charakter zeigt sich in seiner amphoteren Natur; Blei und Bleioxide reagieren mit Säuren und Basen, und es neigt zur Bildung kovalenter Bindungen. Bleiverbindungen liegen in der Regel in der Oxidationsstufe +2 vor und nicht in der Oxidationsstufe +4, wie sie bei leichteren Mitgliedern der Kohlenstoffgruppe üblich ist. Ausnahmen sind meist auf bleiorganische Verbindungen beschränkt. Wie die leichteren Mitglieder der Gruppe neigt auch Blei dazu, sich mit sich selbst zu verbinden; es kann Ketten und polyedrische Strukturen bilden. ⓘ
Da Blei leicht aus seinen Erzen gewonnen werden kann, war es schon den prähistorischen Menschen im Nahen Osten bekannt. Bleiglanz ist ein Haupterz des Bleis, das oft Silber enthält. Das Interesse an Silber trug dazu bei, dass die Gewinnung und Verwendung von Blei im alten Rom weit verbreitet war. Nach dem Fall Roms ging die Bleiproduktion zurück und erreichte erst mit der industriellen Revolution ein vergleichbares Niveau. Blei spielte eine entscheidende Rolle bei der Entwicklung des Buchdrucks, da bewegliche Lettern relativ leicht aus Bleilegierungen gegossen werden konnten. Im Jahr 2014 betrug die weltweite Jahresproduktion von Blei etwa zehn Millionen Tonnen, wovon mehr als die Hälfte aus dem Recycling stammte. Die hohe Dichte, der niedrige Schmelzpunkt, die Duktilität und die relative Oxidationsbeständigkeit von Blei machen es so nützlich. Diese Eigenschaften in Verbindung mit seinem relativen Vorkommen und den niedrigen Kosten führten zu seiner umfangreichen Verwendung im Bauwesen, in der Sanitärtechnik, in Batterien, Kugeln und Schrot, Gewichten, Lötmitteln, Zinn, Schmelzlegierungen, weißen Farben, verbleitem Benzin und als Strahlenschutz. ⓘ
Die Giftigkeit von Blei wurde erst im späten 19. Jahrhundert allgemein anerkannt, obwohl bereits einige gebildete griechische und römische Schriftsteller diese Tatsache kannten und sogar einige der Symptome einer Bleivergiftung kannten. Blei ist ein Nervengift, das sich in Weichteilen und Knochen anreichert; es schädigt das Nervensystem und stört die Funktion biologischer Enzyme, was zu neurologischen Störungen führt, die von Verhaltensproblemen bis zu Hirnschäden reichen, und auch die allgemeine Gesundheit, das Herz-Kreislauf-System und die Nieren beeinträchtigt. ⓘ
Die Isotope 206Pb, 207Pb und 208Pb sind die schwersten stabilen Atome, Blei ist damit das Element mit der höchsten Massen- und Ordnungszahl, das noch stabil ist. Alle Bleiisotope haben die magische Protonenzahl 82, die diese Stabilität bewirkt. Bei 208Pb liegt sogar ein so genannter doppelt magischer Kern vor, weil er zusätzlich die magische Neutronenzahl 126 aufweist. ⓘ
Physikalische Eigenschaften
Atomare
Ein Bleiatom hat 82 Elektronen, die in der Elektronenkonfiguration [[[Xenon|Xe]]]4f145d106s26p2 angeordnet sind. Die Summe der ersten und zweiten Ionisierungsenergie von Blei - die Gesamtenergie, die zur Entfernung der beiden 6p-Elektronen erforderlich ist - liegt nahe bei der von Zinn, dem oberen Nachbarn von Blei in der Kohlenstoffgruppe. Dies ist ungewöhnlich, da die Ionisierungsenergien in der Regel in der Gruppe abnehmen, wenn die Außenelektronen eines Elements weiter vom Kern entfernt sind und durch kleinere Orbitale abgeschirmt werden. ⓘ
Die Ähnlichkeit der Ionisierungsenergien ist auf die Lanthanidenkontraktion zurückzuführen, d. h. die Abnahme der Elementradien von Lanthan (Ordnungszahl 57) bis Lutetium (71) und die relativ kleinen Radien der Elemente ab Hafnium (72). Dies ist auf die schlechte Abschirmung des Kerns durch die 4f-Elektronen der Lanthanide zurückzuführen. Die Summe der ersten vier Ionisierungsenergien von Blei übersteigt die von Zinn, entgegen den Vorhersagen des Periodensystems. Relativistische Effekte, die bei schwereren Atomen bedeutsam werden, tragen zu diesem Verhalten bei. Einer dieser Effekte ist der Trägheitspaareffekt: Die 6s-Elektronen des Bleis beteiligen sich nur ungern an Bindungen, wodurch der Abstand zwischen den nächstgelegenen Atomen im kristallinen Blei ungewöhnlich groß wird. ⓘ
Die leichteren Kohlenstoffkongenere des Bleis bilden stabile oder metastabile Allotrope mit der tetraedrisch koordinierten und kovalent gebundenen kubischen Diamantstruktur. Die Energieniveaus ihrer äußeren s- und p-Orbitale liegen nahe genug beieinander, um eine Vermischung zu vier sp3-Hybridorbitalen zu ermöglichen. Bei Blei vergrößert der Inertpaareffekt den Abstand zwischen seinen s- und p-Orbitalen, und die Lücke kann nicht durch die Energie überwunden werden, die durch zusätzliche Bindungen nach der Hybridisierung freigesetzt würde. Statt einer kubisch-diamantischen Struktur bildet Blei metallische Bindungen, bei denen nur die p-Elektronen delokalisiert sind und zwischen den Pb2+-Ionen geteilt werden. Blei hat folglich eine kubisch-flächenzentrierte Struktur wie die ähnlich großen zweiwertigen Metalle Calcium und Strontium. ⓘ
Masse
Reines Blei hat ein helles, silbriges Aussehen mit einem Hauch von Blau. Bei Kontakt mit feuchter Luft läuft es an und nimmt ein mattes Aussehen an, wobei der Farbton von den vorherrschenden Bedingungen abhängt. Zu den charakteristischen Eigenschaften von Blei gehören eine hohe Dichte, Verformbarkeit, Duktilität und eine hohe Korrosionsbeständigkeit durch Passivierung. ⓘ

Die dicht gepackte, kubisch-flächenzentrierte Struktur und das hohe Atomgewicht von Blei führen zu einer Dichte von 11,34 g/cm3, die höher ist als die von herkömmlichen Metallen wie Eisen (7,87 g/cm3), Kupfer (8,93 g/cm3) und Zink (7,14 g/cm3). Diese Dichte ist der Grund für die Redewendung, die wie ein Bleiballon über die Bühne geht. Einige seltenere Metalle sind dichter: Wolfram und Gold haben beide eine Dichte von 19,3 g/cm3, und Osmium - das dichteste bekannte Metall - hat eine Dichte von 22,59 g/cm3, fast doppelt so hoch wie die von Blei. ⓘ
Blei ist ein sehr weiches Metall mit einer Mohshärte von 1,5; es kann mit dem Fingernagel zerkratzt werden. Es ist ziemlich formbar und etwas dehnbar. Das Volumenmodul von Blei - ein Maß für die leichte Kompressibilität - beträgt 45,8 GPa. Im Vergleich dazu beträgt der Modul von Aluminium 75,2 GPa, von Kupfer 137,8 GPa und von Baustahl 160-169 GPa. Die Zugfestigkeit von Blei ist mit 12-17 MPa gering (die von Aluminium ist 6-mal höher, die von Kupfer 10-mal höher und die von Baustahl 15-mal höher); sie kann durch Zugabe geringer Mengen von Kupfer oder Antimon erhöht werden. ⓘ
Der Schmelzpunkt von Blei ist mit 327,5 °C (621,5 °F) im Vergleich zu den meisten Metallen sehr niedrig. Sein Siedepunkt von 1749 °C (3180 °F) ist der niedrigste unter den Elementen der Kohlenstoffgruppe. Der elektrische Widerstand von Blei liegt bei 20 °C bei 192 Nanoohm-Metern und damit fast eine Größenordnung über dem anderer Industriemetalle (Kupfer mit 15,43 nΩ-m, Gold mit 20,51 nΩ-m und Aluminium mit 24,15 nΩ-m). Blei ist ein Supraleiter bei Temperaturen unter 7,19 K; dies ist die höchste kritische Temperatur aller Typ-I-Supraleiter und die dritthöchste aller elementaren Supraleiter. ⓘ
Isotopenhäufigkeiten variieren stark je nach Probe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Pb) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Darauf gründet die ausgeprägte Duktilität des Metalls und die geringe Mohshärte von 1,5. Es lässt sich daher leicht zu Blechen walzen oder zu Drähten formen, die jedoch wegen ihrer geringen Härte nur wenig beständig sind. Eine diamantartige Modifikation, wie sie von den leichteren Homologen der Gruppe 14 bekannt ist, tritt beim Blei nicht auf. Das liegt an der relativistisch bedingten Instabilität der Pb-Pb-Bindung und an der geringen Tendenz, vierwertig aufzutreten. ⓘ
Frische Bleiproben sind von grauweißer bis metallisch weißer Farbe und zeigen einen typisch metallischen Glanz, der aber durch oberflächliche Oxidation sehr schnell abnimmt. Die Farbe wechselt dabei ins Dunkelgraue und wird matt. Auf Papier hinterlässt das weiche Metall einen (blei)grauen Strich. Aus diesem Grund wurde früher mit Blei geschrieben und gemalt. Der Name „Bleistift“ blieb bis heute erhalten, obwohl man seit langem dafür Graphit benutzt. ⓘ
Isotope
Natürliches Blei besteht aus vier stabilen Isotopen mit den Massenzahlen 204, 206, 207 und 208 sowie aus Spuren von fünf kurzlebigen Radioisotopen. Die hohe Anzahl der Isotope steht im Einklang mit der geraden Ordnungszahl des Bleis. Blei hat eine magische Anzahl von Protonen (82), für die das Kernschalenmodell einen besonders stabilen Kern vorhersagt. Blei-208 hat 126 Neutronen, eine weitere magische Zahl, die erklären könnte, warum Blei-208 außerordentlich stabil ist. ⓘ
Mit seiner hohen Ordnungszahl ist Blei das schwerste Element, dessen natürliche Isotope als stabil gelten; Blei-208 ist der schwerste stabile Atomkern. (Diese Auszeichnung wurde früher dem Bismut mit einer Ordnungszahl von 83 zuteil, bis man 2003 feststellte, dass sein einziges ursprüngliches Isotop, Bismut-209, sehr langsam zerfällt). Die vier stabilen Isotope des Bleis könnten theoretisch unter Freisetzung von Energie in Isotope des Quecksilbers zerfallen, was jedoch bei keinem von ihnen beobachtet wurde; ihre vorhergesagten Halbwertszeiten liegen zwischen 1035 und 10189 Jahren (mindestens das 1025-fache des derzeitigen Alters des Universums). ⓘ
Drei der stabilen Isotope sind in drei der vier großen Zerfallsketten zu finden: Blei-206, Blei-207 und Blei-208 sind die Endprodukte des Zerfalls von Uran-238, Uran-235 bzw. Thorium-232. Diese Zerfallsketten werden als Urankette, Actiniumkette und Thoriumkette bezeichnet. Ihre Isotopenkonzentration in einer natürlichen Gesteinsprobe hängt stark vom Vorhandensein dieser drei Uran- und Thoriumisotope ab. So kann die relative Häufigkeit von Blei-208 zwischen 52 % in normalen Proben und 90 % in Thoriumerzen liegen; aus diesem Grund wird das Standard-Atomgewicht von Blei mit nur einer Dezimalstelle angegeben. Im Laufe der Zeit nimmt das Verhältnis von Blei-206 und Blei-207 zu Blei-204 zu, da die beiden erstgenannten Elemente durch den radioaktiven Zerfall schwererer Elemente ergänzt werden, die letzteren jedoch nicht; dies ermöglicht die Datierung von Blei-Blei. Wenn Uran in Blei zerfällt, ändern sich die relativen Mengen; dies ist die Grundlage für die Uran-Blei-Datierung. Blei-207 weist eine kernmagnetische Resonanz auf, eine Eigenschaft, die zur Untersuchung seiner Verbindungen in Lösung und im festen Zustand, auch im menschlichen Körper, genutzt wurde. ⓘ

Abgesehen von den stabilen Isotopen, die fast das gesamte natürlich vorkommende Blei ausmachen, gibt es Spurenmengen einiger radioaktiver Isotope. Eines davon ist Blei-210, das zwar nur eine Halbwertszeit von 22,2 Jahren hat, aber in der Natur in geringen Mengen vorkommt, weil Blei-210 durch eine lange Zerfallsreihe entsteht, die mit Uran-238 beginnt (das seit Milliarden von Jahren auf der Erde vorhanden ist). Blei-211, -212 und -214 sind in den Zerfallsketten von Uran-235, Thorium-232 bzw. Uran-238 enthalten, so dass Spuren aller drei Blei-Isotope in der Natur vorkommen. Geringe Spuren von Blei-209 stammen aus dem sehr seltenen Cluster-Zerfall von Radium-223, einem der Tochterprodukte von natürlichem Uran-235, und aus der Zerfallskette von Neptunium-237, das in Spuren durch Neutroneneinfang in Uranerzen entsteht. Blei-210 ist besonders nützlich, um das Alter von Proben zu bestimmen, indem sein Verhältnis zu Blei-206 gemessen wird (beide Isotope sind in einer einzigen Zerfallskette vorhanden). ⓘ
Insgesamt sind 43 Blei-Isotope mit den Massenzahlen 178-220 synthetisiert worden. Blei-205 ist das stabilste Radioisotop mit einer Halbwertszeit von etwa 1,73×107 Jahren. Das zweitstabilste ist Blei-202 mit einer Halbwertszeit von etwa 52 500 Jahren, länger als alle anderen natürlichen Spurenradioisotope. ⓘ
Chemie

An feuchter Luft bildet Blei eine Schutzschicht mit unterschiedlicher Zusammensetzung. Blei(II)-Karbonat ist ein häufiger Bestandteil; in städtischen oder maritimen Umgebungen kann auch Sulfat oder Chlorid vorhanden sein. Durch diese Schicht ist Blei in der Luft praktisch chemisch inert. Fein pulverisiertes Blei ist, wie viele andere Metalle, pyrophor und brennt mit einer bläulich-weißen Flamme. ⓘ
Fluor reagiert mit Blei bei Raumtemperatur unter Bildung von Blei(II)-fluorid. Die Reaktion mit Chlor ist ähnlich, erfordert jedoch ein Erhitzen, da die entstehende Chloridschicht die Reaktivität der Elemente vermindert. Geschmolzenes Blei reagiert mit den Chalkogenen zu Blei(II)-chalcogeniden. ⓘ
Bleimetall widersteht Schwefel- und Phosphorsäure, nicht aber Salz- oder Salpetersäure; das Ergebnis hängt von der Unlöslichkeit und der anschließenden Passivierung des Produktsalzes ab. Organische Säuren, wie z. B. Essigsäure, lösen Blei in Gegenwart von Sauerstoff auf. Konzentrierte Alkalien lösen Blei auf und bilden Bleiglätte. ⓘ
Anorganische Verbindungen
Blei weist zwei Hauptoxidationsstufen auf: +4 und +2. Der vierwertige Zustand ist für die Kohlenstoffgruppe üblich. Der zweiwertige Zustand ist bei Kohlenstoff und Silizium selten, bei Germanium unbedeutend, bei Zinn wichtig (aber nicht vorherrschend) und bei Blei der wichtigere der beiden Oxidationszustände. Dies ist auf relativistische Effekte zurückzuführen, insbesondere auf den Inertpaareffekt, der sich bei einem großen Unterschied in der Elektronegativität zwischen Blei und Oxid-, Halogenid- oder Nitridanionen manifestiert und zu einer signifikanten partiellen positiven Ladung des Bleis führt. Das Ergebnis ist eine stärkere Kontraktion des 6s-Orbitals von Blei als bei dem 6p-Orbital, wodurch es in ionischen Verbindungen eher inert wird. Der Inertpaareffekt gilt weniger für Verbindungen, in denen Blei kovalente Bindungen mit Elementen ähnlicher Elektronegativität eingeht, wie z. B. Kohlenstoff in Organobleiverbindungen. In diesen bleiben die 6s und 6p Orbitale ähnlich groß und die sp3 Hybridisierung ist immer noch energetisch günstig. Wie Kohlenstoff ist auch Blei in solchen Verbindungen überwiegend vierwertig. ⓘ
Es besteht ein relativ großer Unterschied in der Elektronegativität von Blei(II) mit 1,87 und Blei(IV) mit 2,33. Dieser Unterschied markiert die Umkehrung des Trends der zunehmenden Stabilität der Oxidationsstufe +4 in der Kohlenstoffgruppe; im Vergleich dazu hat Zinn Werte von 1,80 in der Oxidationsstufe +2 und 1,96 in der Oxidationsstufe +4. ⓘ
Blei(II)
Blei(II)-Verbindungen sind charakteristisch für die anorganische Chemie des Bleis. Selbst starke Oxidationsmittel wie Fluor und Chlor reagieren mit Blei und ergeben nur PbF2 und PbCl2. Blei(II)-Ionen sind in der Regel farblos in Lösung und hydrolysieren teilweise zu Pb(OH)+ und schließlich zu [Pb4(OH)4]4+ (wobei die Hydroxyl-Ionen als Brückenliganden fungieren), sind aber keine Reduktionsmittel wie Zinn(II)-Ionen. Verfahren zum Nachweis von Pb2+-Ionen in Wasser beruhen im Allgemeinen auf der Ausfällung von Blei(II)-chlorid mit verdünnter Salzsäure. Da das Chloridsalz in Wasser nur schwer löslich ist, wird in sehr verdünnten Lösungen die Ausfällung von Blei(II)-sulfid stattdessen durch Durchspülen der Lösung mit Schwefelwasserstoff erreicht. ⓘ
Bleimonoxid kommt in zwei Polymorphen vor, dem litharoten α-PbO (rot) und dem massigen β-PbO (gelb), wobei letzteres nur oberhalb von etwa 488 °C stabil ist. Litharge ist die am häufigsten verwendete anorganische Verbindung von Blei. Es gibt kein Blei(II)-hydroxid; eine Erhöhung des pH-Werts von Lösungen von Blei(II)-Salzen führt zu Hydrolyse und Kondensation. Blei reagiert in der Regel mit schwereren Chalkogenen. Bleisulfid ist ein Halbleiter, ein Photoleiter und ein extrem empfindlicher Infrarotdetektor. Die beiden anderen Chalkogenide, Bleiselenid und Bleitellurid, sind ebenfalls photoleitend. Sie sind insofern ungewöhnlich, als ihre Farbe in der Gruppe nach unten hin heller wird. ⓘ

Bleidihalogenide sind gut charakterisiert; dazu gehören Diastatide und Mischhalogenide wie PbFCl. Die relative Unlöslichkeit des letzteren bildet eine nützliche Grundlage für die gravimetrische Bestimmung von Fluor. Das Difluorid war die erste feste ionisch leitende Verbindung, die entdeckt wurde (1834 von Michael Faraday). Die anderen Dihalogenide, insbesondere das Dijodid, zersetzen sich bei Einwirkung von ultraviolettem oder sichtbarem Licht. Es sind viele Blei(II)-Pseudohalogenide bekannt, wie z. B. Cyanid, Cyanat und Thiocyanat. Blei(II) bildet eine Vielzahl von Halogenid-Koordinationskomplexen, wie z. B. [PbCl4]2-, [PbCl6]4- und das [Pb2Cl9]n5n-Kettenanion. ⓘ
Blei(II)-sulfat ist, wie die Sulfate anderer schwerer zweiwertiger Kationen, unlöslich in Wasser. Blei(II)-nitrat und Blei(II)-acetat sind sehr gut löslich, was bei der Synthese anderer Bleiverbindungen ausgenutzt wird. ⓘ
Blei(IV)
Es sind nur wenige anorganische Blei(IV)-Verbindungen bekannt. Sie werden nur in stark oxidierenden Lösungen gebildet und kommen normalerweise unter Standardbedingungen nicht vor. Blei(II)-oxid ergibt bei weiterer Oxidation ein Mischoxid, Pb3O4. Es wird als Blei(II,IV)-oxid oder strukturell als 2PbO-PbO2 bezeichnet und ist die bekannteste Bleiverbindung mit gemischter Wertigkeit. Bleidioxid ist ein starkes Oxidationsmittel, das in der Lage ist, Salzsäure zu Chlorgas zu oxidieren. Dies liegt daran, dass das erwartete PbCl4 instabil ist und sich spontan in PbCl2 und Cl2 zersetzt. Ähnlich wie Bleimonoxid ist auch Bleidioxid in der Lage, Blei-Anionen zu bilden. Bleidisulfid und Bleidiselenid sind nur bei hohem Druck stabil. Bleitetrafluorid, ein gelbes kristallines Pulver, ist stabil, aber weniger stabil als das Difluorid. Bleitetrachlorid (ein gelbes Öl) zersetzt sich bei Raumtemperatur, Bleitetrabromid ist noch weniger stabil, und die Existenz von Bleitrajodid ist fraglich. ⓘ
Andere Oxidationsstufen

Einige Bleiverbindungen existieren in anderen formalen Oxidationsstufen als +4 oder +2. Blei(III) kann als Zwischenstufe zwischen Blei(II) und Blei(IV) in größeren Organobleikomplexen erhalten werden; diese Oxidationsstufe ist nicht stabil, da sowohl das Blei(III)-Ion als auch die größeren Komplexe, die es enthalten, Radikale sind. Das Gleiche gilt für Blei(I), das in solchen radikalischen Spezies vorkommen kann. ⓘ
Es sind zahlreiche gemischte Blei(II,IV)-Oxide bekannt. Wenn PbO2 an der Luft erhitzt wird, entsteht bei 293 °C Pb12O19, bei 351 °C Pb12O17, bei 374 °C Pb3O4 und schließlich bei 605 °C PbO. Ein weiteres Sesquioxyd, Pb2O3, kann bei hohem Druck zusammen mit mehreren nicht-stöchiometrischen Phasen erhalten werden. Viele von ihnen weisen defekte Fluoritstrukturen auf, in denen einige Sauerstoffatome durch Leerstellen ersetzt sind: PbO kann als eine solche Struktur angesehen werden, bei der alle alternierenden Schichten von Sauerstoffatomen fehlen. ⓘ
Negative Oxidationsstufen können als Zintl-Phasen auftreten, entweder als freie Bleianionen, wie in Ba2Pb, wobei das Blei formal Blei(-IV) ist, oder in sauerstoffempfindlichen ringförmigen oder polyedrischen Cluster-Ionen wie dem trigonalen bipyramidalen Pb52- Ion, bei dem zwei Bleiatome Blei(-I) und drei Blei(0) sind. In solchen Anionen befindet sich jedes Atom an einem polyedrischen Scheitelpunkt und trägt zwei Elektronen zu jeder kovalenten Bindung entlang einer Kante aus ihren sp3-Hybridorbitalen bei, wobei die anderen beiden ein externes einsames Paar darstellen. Sie können in flüssigem Ammoniak durch die Reduktion von Blei mit Natrium hergestellt werden. ⓘ
Organolead
Blei kann mehrfach gebundene Ketten bilden, eine Eigenschaft, die es mit seinen leichteren Homologen in der Kohlenstoffgruppe teilt. Seine Fähigkeit dazu ist jedoch viel geringer, da die Energie der Pb-Pb-Bindung mehr als dreieinhalb Mal niedriger ist als die der C-C-Bindung. Mit sich selbst kann Blei Metall-Metall-Bindungen bis zu einer Größenordnung von drei bilden. Mit Kohlenstoff bildet Blei organische Bleiverbindungen, die den typischen organischen Verbindungen ähneln, aber im Allgemeinen weniger stabil sind als diese (da die Pb-C-Bindung eher schwach ist). Dadurch ist die metallorganische Chemie des Bleis weit weniger umfangreich als die des Zinns. Blei bildet überwiegend Organolead(IV)-Verbindungen, auch wenn es von anorganischen Blei(II)-Reaktanten ausgeht; es sind nur sehr wenige Organolead(II)-Verbindungen bekannt. Die am besten charakterisierten Ausnahmen sind Pb[CH(SiMe3)2]2 und Pb(η5-C5H5)2. ⓘ
Das Bleianalogon der einfachsten organischen Verbindung, Methan, ist Plumban. Plumban kann durch eine Reaktion zwischen metallischem Blei und atomarem Wasserstoff gewonnen werden. Zwei einfache Derivate, Tetramethylblei und Tetraethylblei, sind die bekanntesten bleiorganischen Verbindungen. Diese Verbindungen sind relativ stabil: Tetraethylblei beginnt sich nur zu zersetzen, wenn es erhitzt oder dem Sonnenlicht oder ultraviolettem Licht ausgesetzt wird. Mit Natriummetall bildet Blei leicht eine äquimolare Legierung, die mit Alkylhalogeniden unter Bildung von metallorganischen Verbindungen wie Tetraethylblei reagiert. Die oxidierende Eigenschaft vieler bleiorganischer Verbindungen wird sinnvoll ausgenutzt: Bleitetetraacetat ist ein wichtiges Laborreagenz für die Oxidation in der organischen Synthese. Tetraethylblei, das einst dem Benzin zugesetzt wurde, wurde in größeren Mengen hergestellt als jede andere metallorganische Verbindung. Andere bleiorganische Verbindungen sind chemisch weniger stabil. Für viele organische Verbindungen gibt es kein Bleianalogon. ⓘ
Organische Bleiverbindungen liegen fast immer in der Oxidationsstufe +4 vor. Deren bekannteste ist Tetraethylblei Pb(C2H5)4 (TEL), eine giftige Flüssigkeit, die als Antiklopfmittel Benzin zugesetzt wurde. Heute wird Tetraethylblei nur noch in Flugbenzin verwendet. ⓘ
Ursprung und Vorkommen
| Atomare Nummer |
Element | Relativ Menge ⓘ |
|---|---|---|
| 42 | Molybdän | 0.798 |
| 46 | Palladium | 0.440 |
| 50 | Zinn | 1.146 |
| 78 | Platin | 0.417 |
| 80 | Quecksilber | 0.127 |
| 82 | Blei | 1 |
| 90 | Thorium | 0.011 |
| 92 | Uran | 0.003 |
Im Weltraum
Die Pro-Teilchen-Häufigkeit von Blei im Sonnensystem beträgt 0,121 ppb (parts per billion). Diese Zahl ist zweieinhalb Mal höher als die von Platin, acht Mal höher als die von Quecksilber und siebzehn Mal höher als die von Gold. Die Menge an Blei im Universum nimmt langsam zu, da die meisten schwereren Atome (die alle instabil sind) allmählich zu Blei zerfallen. Die Bleihäufigkeit im Sonnensystem hat seit seiner Entstehung vor 4,5 Milliarden Jahren um etwa 0,75 % zugenommen. Die Tabelle der Häufigkeiten im Sonnensystem zeigt, dass Blei trotz seiner relativ hohen Ordnungszahl häufiger vorkommt als die meisten anderen Elemente mit Ordnungszahlen über 40. ⓘ
Primordiales Blei - bestehend aus den Isotopen Blei-204, Blei-206, Blei-207 und Blei-208 - entstand hauptsächlich durch wiederholte Neutroneneinfangprozesse in Sternen. Die beiden Hauptarten des Einfangs sind der s- und der r-Prozess. ⓘ
Beim s-Prozess (s steht für "langsam") liegen zwischen den Einfangvorgängen Jahre oder Jahrzehnte, so dass weniger stabile Kerne einen Betazerfall durchlaufen können. Ein stabiler Thallium-203-Kern kann ein Neutron einfangen und sich in Thallium-204 verwandeln, das durch Betazerfall zu stabilem Blei-204 zerfällt; beim Einfangen eines weiteren Neutrons wird es zu Blei-205, das eine Halbwertszeit von etwa 15 Millionen Jahren hat. Weitere Einfänge führen zu Blei-206, Blei-207 und Blei-208. Beim Einfang eines weiteren Neutrons wird Blei-208 zu Blei-209, das schnell in Wismut-209 zerfällt. Beim Einfangen eines weiteren Neutrons wird Wismut-209 zu Wismut-210, das als Beta-Zerfall in Polonium-210 übergeht, das als Alpha-Zerfall in Blei-206 übergeht. Der Zyklus endet also mit Blei-206, Blei-207, Blei-208 und Bismut-209. ⓘ
Beim r-Prozess (r steht für "rapid") erfolgt der Einfang schneller, als die Kerne zerfallen können. Dies geschieht in Umgebungen mit einer hohen Neutronendichte, wie z. B. bei einer Supernova oder der Verschmelzung zweier Neutronensterne. Der dabei auftretende Neutronenfluss kann in der Größenordnung von 1022 Neutronen pro Quadratzentimeter und Sekunde liegen. Beim r-Prozess wird nicht so viel Blei gebildet wie beim s-Prozess. Er hört tendenziell auf, wenn die neutronenreichen Kerne 126 Neutronen erreichen. Zu diesem Zeitpunkt sind die Neutronen in vollständigen Schalen im Atomkern angeordnet, und es wird schwieriger, weitere Neutronen energetisch unterzubringen. Wenn der Neutronenfluss nachlässt, zerfallen diese Kerne durch Beta-Zerfall in stabile Isotope von Osmium, Iridium und Platin. ⓘ
Auf der Erde
Blei kommt in der Erdkruste mit einem Gehalt von etwa 0,0018 % vor und tritt eher selten gediegen, das heißt in elementarer Form auf. Dennoch sind weltweit inzwischen rund 200 Fundorte für gediegen Blei bekannt (Stand: 2017), so unter anderem in Argentinien, Äthiopien, Australien, Belgien, Brasilien, Volksrepublik China, Deutschland, Finnland, Frankreich, Georgien, Griechenland, Grönland, Italien, Kanada, Kasachstan, Kirgisistan, Mexiko, der Mongolei, Namibia, Norwegen, Österreich, Polen, Russland, Schweden, Slowenien, Tschechien, der Ukraine, den US-amerikanischen Jungferninseln, im Vereinigten Königreich und den Vereinigten Staaten von Amerika (USA). ⓘ
Auch in Gesteinsproben des mittelatlantischen Rückens, genauer am nordöstlichen Rand der „Markov-Tiefe“ innerhalb der „Sierra-Leone-Bruchzone“ (Sierra-Leone-Schwelle), sowie außerhalb der Erde auf dem Mond im Mare Fecunditatis konnte Blei gefunden werden. ⓘ
An jedem Fundort weicht die Isotopenzusammensetzung geringfügig von den oben angegebenen Mittelwerten ab, so dass man mit einer genauen Analyse der Isotopenzusammensetzung den Fundort bestimmen und bei archäologischen Fundstücken auf alte Handelswege schließen kann. Zudem kann Blei ebenfalls fundortabhängig verschiedene Fremdbeimengungen wie Silber, Kupfer, Zink, Eisen, Zinn und/oder Antimon enthalten. ⓘ
In Bleierzen ist Blei zumeist als Galenit (Bleisulfid PbS, Bleiglanz) zugegen. Dieses Mineral ist auch die bedeutendste kommerzielle Quelle für die Gewinnung neuen Bleis. Weitere Bleimineralien sind Cerussit (Blei(II)-carbonat, PbCO3, auch Weißbleierz), Krokoit (Blei(II)-chromat, PbCrO4, auch Rotbleierz) und Anglesit (Blei(II)-sulfat, PbSO4, auch Bleivitriol). Die Bleiminerale mit der höchsten Bleikonzentration in der Verbindung sind Lithargit und Massicotit (bis 92,8 %) sowie Minium (bis 90,67 %). Insgesamt sind bisher 514 Bleiminerale bekannt (Stand: 2017). ⓘ
Die wirtschaftlich abbaubaren Vorräte werden weltweit auf 67 Millionen Tonnen geschätzt (Stand 2004). Die größten Vorkommen findet man in der Volksrepublik China, den USA, Australien, Russland und Kanada. In Europa sind Schweden und Polen die Länder mit den größten Vorkommen. ⓘ
Auch in Deutschland wurde in der nördlichen Eifel (Rescheid / Gruben Wohlfahrt und Schwalenbach; Mechernich / Grube Günnersdorf und auch Tagebau /Virginia; Bleialf), im Schwarzwald, im Harz (Goslar/Rammelsberg), in Sachsen (Freiberg/Muldenhütten), an der unteren Lahn (Bad Ems, Holzappel), sowie in Westfalen (Ramsbeck/Sauerland) in der Vergangenheit Bleierz abgebaut, verhüttet und veredelt. ⓘ
Die bedeutendste Quelle für Blei ist heute das Recycling alter Bleiprodukte. Daher bestehen in Deutschland nur noch zwei Primärhütten, die Blei aus Erz herstellen, die Bleihütte Binsfeldhammer in Stolberg (Rhld.) und Metaleurop in Nordenham bei Bremerhaven. Sämtliche andere Hütten erzeugen so genanntes Sekundärblei, indem sie altes Blei (insbesondere aus gebrauchten Autobatterien) aufarbeiten. ⓘ
Blei wird nach der Goldschmidt-Klassifikation als chalcophil eingestuft, was bedeutet, dass es im Allgemeinen in Verbindung mit Schwefel vorkommt. Es kommt selten in seiner ursprünglichen, metallischen Form vor. Viele Bleimineralien sind relativ leicht und sind im Laufe der Erdgeschichte in der Kruste geblieben, anstatt tiefer ins Erdinnere zu sinken. Dies erklärt die relativ hohe Häufigkeit von Blei in der Kruste von 14 ppm; es ist das 38. häufigste Element in der Kruste. ⓘ
Das wichtigste bleihaltige Mineral ist Bleiglanz (PbS), der meist mit Zinkerzen vorkommt. Die meisten anderen Bleimineralien sind in irgendeiner Weise mit Bleiglanz verwandt; Boulangerit, Pb5Sb4S11, ist ein Mischsulfid, das sich von Bleiglanz ableitet; Anglesit, PbSO4, ist ein Oxidationsprodukt von Bleiglanz; und Cerussit oder Weißbleierz, PbCO3, ist ein Zersetzungsprodukt von Bleiglanz. Arsen, Zinn, Antimon, Silber, Gold, Kupfer und Wismut sind häufige Verunreinigungen in Bleimineralien. ⓘ

Typische Hintergrundkonzentrationen von Blei überschreiten nicht 0,1 μg/m3 in der Atmosphäre, 100 mg/kg im Boden, 4 mg/kg in der Vegetation und 5 μg/L im Süß- und Meerwasser. ⓘ
Etymologie
Das moderne englische Wort Blei ist germanischen Ursprungs; es stammt aus dem mittelenglischen leed und dem altenglischen lēad (wobei der Makron über dem "e" bedeutet, dass der Vokal dieses Buchstabens lang ist). Das altenglische Wort leitet sich von dem hypothetischen rekonstruierten proto-germanischen *lauda- ('Blei') ab. Nach der linguistischen Theorie hat dieses Wort in mehreren germanischen Sprachen Nachkommen mit genau der gleichen Bedeutung. ⓘ
Es besteht kein Konsens über den Ursprung des proto-germanischen *lauda-. Eine Hypothese besagt, dass es sich vom proto-indoeuropäischen *lAudh- ("Blei"; die Großschreibung des Vokals entspricht dem Makron) ableitet. Eine andere Hypothese besagt, dass es aus dem Proto-Keltischen *ɸloud-io- ("Blei") entlehnt ist. Dieses Wort ist mit dem lateinischen plumbum verwandt, das dem Element sein chemisches Symbol Pb gab. Man nimmt an, dass das Wort *ɸloud-io- der Ursprung des proto-germanischen *bliwa- (was ebenfalls "Blei" bedeutet) ist, von dem sich das deutsche Blei ableitet. ⓘ
Der Name des chemischen Elements steht in keinem Zusammenhang mit dem Verb derselben Schreibweise, das sich vom proto-germanischen *laidijan- ("führen") ableitet. ⓘ
Geschichte
Vorgeschichte und Frühgeschichte
In Kleinasien wurden metallische Bleikugeln gefunden, die auf 7000-6500 v. Chr. zurückgehen und möglicherweise das erste Beispiel für Metallverhüttung darstellen. Zu dieser Zeit hatte Blei aufgrund seiner Weichheit und seines stumpfen Aussehens nur wenige (wenn überhaupt) Anwendungen. Der Hauptgrund für die Verbreitung der Bleiproduktion war die Verbindung mit Silber, das durch Verbrennen von Bleiglanz (einem häufigen Bleimineral) gewonnen werden kann. Die alten Ägypter waren die ersten, die Bleimineralien in Kosmetika verwendeten, eine Anwendung, die sich im antiken Griechenland und darüber hinaus verbreitete; die Ägypter verwendeten Blei möglicherweise als Senkblei für Fischernetze, Glasuren, Gläser, Emaille und für Ornamente. Verschiedene Zivilisationen des Fruchtbaren Halbmonds verwendeten Blei als Schreibmaterial, für Münzen und als Baumaterial. Am altchinesischen Königshof wurde Blei als Stimulans, als Zahlungsmittel und als Verhütungsmittel verwendet; die Zivilisation des Indus-Tals und die Mesoamerikaner nutzten es zur Herstellung von Amuletten, und die Völker des östlichen und südlichen Afrikas verwendeten Blei zum Drahtziehen. ⓘ
Klassisches Zeitalter
Da Silber in großem Umfang als Dekorationsmaterial und Tauschmittel verwendet wurde, begann man ab 3000 v. Chr. in Kleinasien Bleivorkommen abzubauen; später wurden Bleivorkommen in der Ägäis und in Laurion erschlossen. Diese drei Regionen zusammen beherrschten die Produktion von Bleiminen bis etwa 1200 v. Chr. Ab ca. 2000 v. Chr. bauten die Phönizier auf der Iberischen Halbinsel Blei ab; um 1600 v. Chr. gab es Bleibergbau in Zypern, Griechenland und Sardinien. ⓘ

Die territoriale Ausdehnung Roms in Europa und im Mittelmeerraum sowie die Entwicklung des Bergbaus führten dazu, dass Rom während der klassischen Epoche der größte Bleiproduzent wurde, mit einer geschätzten Jahresproduktion von bis zu 80.000 Tonnen. Wie ihre Vorgänger gewannen die Römer Blei hauptsächlich als Nebenprodukt der Silberverhüttung. Blei wurde in Mitteleuropa, Britannien, auf dem Balkan, in Griechenland, Anatolien und Hispanien abgebaut, wobei auf letzteres 40 % der Weltproduktion entfielen. ⓘ
Bleitafeln wurden häufig als Material für Briefe verwendet. Im alten Judäa wurden Bleisärge verwendet, die in flache Sandformen gegossen wurden und deren Motive je nach dem Glauben des Verstorbenen austauschbar waren. Blei wurde ab dem 5. Jahrhundert v. Chr. zur Herstellung von Schleudergeschossen verwendet. In römischer Zeit wurden Schleudergeschosse aus Blei reichlich verwendet, die auf eine Entfernung von 100 bis 150 Metern wirksam waren. Die balearischen Schleuderer, die als Söldner in karthagischen und römischen Armeen eingesetzt wurden, waren berühmt für ihre Schussweite und Treffsicherheit. ⓘ

Blei wurde im Römischen Reich zur Herstellung von Wasserrohren verwendet; das lateinische Wort für das Metall, plumbum, ist der Ursprung des englischen Wortes "plumbing". Seine leichte Bearbeitbarkeit, sein niedriger Schmelzpunkt, der die Herstellung völlig wasserdichter Schweißverbindungen ermöglichte, und seine Korrosionsbeständigkeit sorgten dafür, dass es auch in anderen Bereichen wie der Pharmazie, der Bedachung, der Währung und der Kriegsführung weit verbreitet war. Schriftsteller der damaligen Zeit wie Cato der Ältere, Columella und Plinius der Ältere empfahlen Bleigefäße (oder mit Blei beschichtete Gefäße) für die Zubereitung von Süß- und Konservierungsmitteln für Wein und Speisen. Das Blei verlieh einen angenehmen Geschmack durch die Bildung von "Bleizucker" (Blei-II-Acetat), während Kupfer- oder Bronzegefäße durch Grünspanbildung einen bitteren Geschmack vermitteln konnten. ⓘ
Dieses Metall war in der Antike das bei weitem am häufigsten verwendete Material, und es ist angebracht, von der (römischen) Bleizeit zu sprechen. Blei war für die Römer das, was für uns der Kunststoff ist.
Heinz Eschnauer und Markus Stoeppler
"Wein - Eine enologische Musterbank", 1992 ⓘ
Der römische Schriftsteller Vitruv berichtete über die gesundheitlichen Gefahren von Blei, und moderne Autoren haben behauptet, dass Bleivergiftungen eine wichtige Rolle beim Niedergang des Römischen Reiches spielten. Andere Forscher haben solche Behauptungen kritisiert und beispielsweise darauf hingewiesen, dass nicht alle Bauchschmerzen durch Bleivergiftung verursacht werden. Archäologischen Forschungen zufolge erhöhten römische Bleirohre den Bleigehalt im Leitungswasser, aber es ist unwahrscheinlich, dass eine solche Wirkung wirklich schädlich war". Wenn es doch zu einer Bleivergiftung kam, wurden die Opfer "saturnin" genannt, düster und zynisch, nach dem schaurigen Göttervater Saturn. Blei galt als der Vater aller Metalle. Sein Stellenwert in der römischen Gesellschaft war gering, da es leicht verfügbar und billig war. ⓘ
Verwechslung mit Zinn und Antimon
Seit der Bronzezeit haben Metallurgen und Ingenieure den Unterschied zwischen dem seltenen und wertvollen Zinn, das für die Legierung mit Kupfer zur Herstellung von zäher und korrosionsbeständiger Bronze unerlässlich ist, und dem "billigen und fröhlichen" Blei verstanden. Allerdings ist die Nomenklatur in einigen Sprachen ähnlich. Die Römer nannten Blei plumbum nigrum ("schwarzes Blei") und Zinn plumbum candidum ("helles Blei"). Die Assoziation von Blei und Zinn ist auch in anderen Sprachen zu beobachten: Das Wort olovo bedeutet im Tschechischen "Blei", aber im Russischen bedeutet das verwandte Wort олово (olovo) "Zinn". Um die Verwirrung noch zu vergrößern, war Blei eng mit Antimon verwandt: beide Elemente kommen häufig als Sulfide (Bleiglanz und Stibnit) vor, oft zusammen. Plinius schrieb fälschlicherweise, dass Stibnit beim Erhitzen Blei anstelle von Antimon ergibt. In Ländern wie der Türkei und Indien wurde der ursprünglich persische Name surma entweder für Antimonsulfid oder für Bleisulfid verwendet, und in einigen Sprachen, wie z. B. dem Russischen, wurde der Name auf Antimon (сурьма) übertragen. ⓘ
Mittelalter und Renaissance

Nach dem Untergang des Weströmischen Reiches ging der Bleierzbergbau in Westeuropa zurück, nur in Arabien und Iberien wurde noch in nennenswertem Umfang Blei gefördert. Die größte Bleiproduktion fand in Süd- und Ostasien statt, insbesondere in China und Indien, wo die Bleiförderung rasch zunahm. ⓘ
In Europa nahm die Bleiproduktion im 11. und 12. Jahrhundert zu, als Blei wieder für Dächer und Rohrleitungen verwendet wurde. Ab dem 13. Jahrhundert wurde Blei für die Herstellung von Glasmalereien verwendet. In der europäischen und arabischen Tradition der Alchemie galt Blei (Symbol ![]() in der europäischen Tradition) als unedles Metall, das durch Trennung, Reinigung und Ausgleich seiner Bestandteile in reines und unbestechliches Gold verwandelt werden konnte. In dieser Zeit wurde Blei zunehmend zur Verfälschung von Wein verwendet. Die Verwendung von solchem Wein wurde 1498 durch eine päpstliche Bulle für den Gebrauch in christlichen Riten verboten, aber er wurde weiterhin getrunken und führte bis zum Ende des 18. Blei war ein wichtiges Material in Teilen der Druckerpresse, und der von den Druckern häufig eingeatmete Bleistaub führte zu Bleivergiftungen. Blei wurde auch zum Hauptmaterial für die Herstellung von Geschossen für Feuerwaffen: Es war billig, beschädigte eiserne Gewehrläufe weniger, hatte eine höhere Dichte (was eine bessere Beibehaltung der Geschwindigkeit ermöglichte), und sein niedrigerer Schmelzpunkt erleichterte die Herstellung von Geschossen, da sie mit Hilfe eines Holzfeuers hergestellt werden konnten. Blei in Form von venezianischer Ceruse wurde von der westeuropäischen Aristokratie in großem Umfang in Kosmetika verwendet, da ein weißes Gesicht als Zeichen der Bescheidenheit angesehen wurde. Diese Praxis weitete sich später auf weiße Perücken und Lidstriche aus und verschwand erst mit der Französischen Revolution im späten 18. Eine ähnliche Mode entstand in Japan im 18. Jahrhundert mit dem Aufkommen der Geishas, eine Praxis, die bis weit ins 20. Jahrhundert anhielt. Die weißen Gesichter der Frauen "repräsentierten ihre weiblichen Tugenden als japanische Frauen", wobei Blei als Bleichmittel üblich war. ⓘ
in der europäischen Tradition) als unedles Metall, das durch Trennung, Reinigung und Ausgleich seiner Bestandteile in reines und unbestechliches Gold verwandelt werden konnte. In dieser Zeit wurde Blei zunehmend zur Verfälschung von Wein verwendet. Die Verwendung von solchem Wein wurde 1498 durch eine päpstliche Bulle für den Gebrauch in christlichen Riten verboten, aber er wurde weiterhin getrunken und führte bis zum Ende des 18. Blei war ein wichtiges Material in Teilen der Druckerpresse, und der von den Druckern häufig eingeatmete Bleistaub führte zu Bleivergiftungen. Blei wurde auch zum Hauptmaterial für die Herstellung von Geschossen für Feuerwaffen: Es war billig, beschädigte eiserne Gewehrläufe weniger, hatte eine höhere Dichte (was eine bessere Beibehaltung der Geschwindigkeit ermöglichte), und sein niedrigerer Schmelzpunkt erleichterte die Herstellung von Geschossen, da sie mit Hilfe eines Holzfeuers hergestellt werden konnten. Blei in Form von venezianischer Ceruse wurde von der westeuropäischen Aristokratie in großem Umfang in Kosmetika verwendet, da ein weißes Gesicht als Zeichen der Bescheidenheit angesehen wurde. Diese Praxis weitete sich später auf weiße Perücken und Lidstriche aus und verschwand erst mit der Französischen Revolution im späten 18. Eine ähnliche Mode entstand in Japan im 18. Jahrhundert mit dem Aufkommen der Geishas, eine Praxis, die bis weit ins 20. Jahrhundert anhielt. Die weißen Gesichter der Frauen "repräsentierten ihre weiblichen Tugenden als japanische Frauen", wobei Blei als Bleichmittel üblich war. ⓘ
Außerhalb Europas und Asiens
In der Neuen Welt wurde die Bleiproduktion schon bald nach der Ankunft der europäischen Siedler aufgenommen. Der früheste Nachweis stammt aus dem Jahr 1621 in der englischen Kolonie Virginia, vierzehn Jahre nach ihrer Gründung. In Australien war die erste Mine, die von Kolonisten auf dem Kontinent eröffnet wurde, eine Bleimine im Jahr 1841. In Afrika war der Abbau und die Verhüttung von Blei im Benue-Trog und im unteren Kongobecken bekannt, wo Blei für den Handel mit den Europäern und im 17. ⓘ
Industrielle Revolution

In der zweiten Hälfte des 18. Jahrhunderts erlebten Großbritannien und später auch Kontinentaleuropa und die Vereinigten Staaten die Industrielle Revolution. In dieser Zeit übertraf die Bleiproduktion zum ersten Mal die von Rom. Großbritannien war der führende Produzent, verlor diesen Status jedoch Mitte des 19. Jahrhunderts mit der Erschöpfung seiner Minen und der Entwicklung der Bleiförderung in Deutschland, Spanien und den Vereinigten Staaten. Um 1900 waren die Vereinigten Staaten weltweit führend in der Bleiproduktion, und auch andere außereuropäische Länder - Kanada, Mexiko und Australien - hatten mit einer bedeutenden Produktion begonnen; die außereuropäische Produktion übertraf die innere. Ein großer Teil der Bleinachfrage kam aus dem Sanitär- und Malerhandwerk - Bleifarben wurden regelmäßig verwendet. Zu dieser Zeit kamen mehr Menschen (aus der Arbeiterklasse) mit dem Metall in Berührung, und die Fälle von Bleivergiftungen nahmen zu. Dies führte zu Untersuchungen über die Auswirkungen der Bleiaufnahme. Es wurde nachgewiesen, dass Blei in Form von Dämpfen gefährlicher ist als in fester Form. Bleivergiftung und Gicht wurden miteinander in Verbindung gebracht; der britische Arzt Alfred Baring Garrod stellte fest, dass ein Drittel seiner Gichtpatienten Klempner und Maler waren. Im 19. Jahrhundert wurden auch die Auswirkungen einer chronischen Bleieinnahme, einschließlich psychischer Störungen, untersucht. Die ersten Gesetze zur Verringerung der Bleivergiftung in Fabriken wurden in den 1870er und 1880er Jahren im Vereinigten Königreich erlassen. ⓘ
Moderne Ära
Im späten 19. und frühen 20. Jahrhundert wurden weitere Beweise für die Gefährdung des Menschen durch Blei entdeckt. Die Mechanismen der Schädigung wurden besser verstanden, Bleierblindheit wurde dokumentiert, und das Element wurde in den Vereinigten Staaten und Europa schrittweise aus dem öffentlichen Gebrauch genommen. Das Vereinigte Königreich führte 1878 obligatorische Fabrikinspektionen ein und ernannte 1898 den ersten Medical Inspector of Factories; in der Folge ging die Zahl der Bleivergiftungen zwischen 1900 und 1944 um das 25-fache zurück. In den meisten europäischen Ländern wurde die Verwendung von Bleifarben - die wegen ihrer Undurchsichtigkeit und Wasserbeständigkeit häufig für Innenräume verwendet wurden - um 1930 verboten. ⓘ
Die letzte größere Exposition des Menschen gegenüber Blei war der Zusatz von Tetraethylblei zu Benzin als Antiklopfmittel, eine Praxis, die 1921 in den Vereinigten Staaten eingeführt wurde. Diese Praxis wurde in den Vereinigten Staaten und der Europäischen Union bis zum Jahr 2000 schrittweise eingestellt. ⓘ
In den 1970er Jahren führten die Vereinigten Staaten und die westeuropäischen Länder Rechtsvorschriften zur Verringerung der Luftverschmutzung durch Blei ein. Die Auswirkungen waren beträchtlich: Während eine von den Centers for Disease Control and Prevention in den Vereinigten Staaten 1976-1980 durchgeführte Studie ergab, dass 77,8 % der Bevölkerung erhöhte Bleiwerte im Blut aufwiesen, sank der Anteil der Menschen mit derart hohen Werten in den Jahren 1991-1994 laut einer Studie desselben Instituts auf 2,2 %. Das wichtigste Produkt, das bis zum Ende des 20. Jahrhunderts aus Blei hergestellt wurde, war die Blei-Säure-Batterie. ⓘ
Von 1960 bis 1990 stieg die Bleiproduktion im Westblock um etwa 31 %. Der Anteil des Ostblocks an der weltweiten Bleiproduktion stieg zwischen 1950 und 1990 von 10 % auf 30 %, wobei die Sowjetunion Mitte der 1970er und in den 1980er Jahren der weltweit größte Produzent war und China Ende des 20. Im Gegensatz zu den kommunistischen Ländern Europas war China bis Mitte des 20. Jahrhunderts weitgehend unindustrialisiert; 2004 überholte China Australien als größter Bleiproduzent. Wie zur Zeit der europäischen Industrialisierung hat sich Blei auch in China negativ auf die Gesundheit ausgewirkt. ⓘ
Produktion
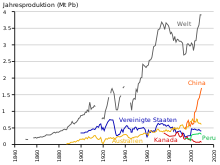
Seit 2014 nimmt die Bleiproduktion aufgrund der Verwendung in Blei-Säure-Batterien weltweit zu. Es gibt zwei Hauptkategorien der Produktion: die Primärproduktion aus abgebauten Erzen und die Sekundärproduktion aus Schrott. Im Jahr 2014 stammten 4,58 Millionen Tonnen aus der Primärproduktion und 5,64 Millionen Tonnen aus der Sekundärproduktion. Die drei größten Produzenten von Bleikonzentrat waren in diesem Jahr China, Australien und die Vereinigten Staaten. Die drei größten Produzenten von raffiniertem Blei waren China, die Vereinigten Staaten und Indien. Laut dem Bericht "Metal Stocks in Society" des International Resource Panel aus dem Jahr 2010 beläuft sich die Gesamtmenge des verwendeten, gelagerten, weggeworfenen oder in die Umwelt freigesetzten Bleis weltweit auf 8 kg pro Kopf der Bevölkerung. Ein Großteil davon befindet sich in höher entwickelten Ländern (20-150 kg pro Kopf) und nicht in weniger entwickelten Ländern (1-4 kg pro Kopf). ⓘ
Die Prozesse der primären und sekundären Bleiproduktion sind ähnlich. Einige Betriebe, die Blei für die Primärproduktion herstellen, ergänzen ihren Betrieb mit Bleischrott, und dieser Trend wird sich in Zukunft wahrscheinlich noch verstärken. Mit geeigneten Techniken ist das aus Sekundärprozessen gewonnene Blei nicht von dem aus Primärprozessen gewonnenen Blei zu unterscheiden. Bleischrott aus dem Baugewerbe ist in der Regel recht sauber und wird ohne Schmelzen wieder eingeschmolzen, auch wenn manchmal eine Raffination erforderlich ist. Die sekundäre Bleiproduktion ist daher im Hinblick auf den Energiebedarf billiger als die primäre Produktion, oft um 50 % oder mehr. ⓘ
Primäres Blei
Die meisten Bleierze enthalten einen geringen Prozentsatz an Blei (reiche Erze haben typischerweise einen Gehalt von 3-8 %), der für die Gewinnung konzentriert werden muss. Bei der Erstaufbereitung werden die Erze in der Regel zerkleinert, getrennt, gemahlen, schaumgeschwemmt und getrocknet. Das resultierende Konzentrat mit einem Bleigehalt von 30-80 Massenprozent (in der Regel 50-60 %) wird dann zu (unreinem) Bleimetall verarbeitet. ⓘ
Hierfür gibt es zwei Hauptverfahren: ein zweistufiges Verfahren mit Röstung und anschließender Hochofenextraktion, die in getrennten Behältern durchgeführt werden, oder ein direktes Verfahren, bei dem die Extraktion des Konzentrats in einem einzigen Behälter erfolgt. Letzteres ist inzwischen die gängigste Methode, auch wenn das erste Verfahren immer noch von Bedeutung ist.
| Land | Produktion (Tausend Tonnen) ⓘ |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Andere Länder | 170 |
Zweistufiges Verfahren

Das entstehende Werkblei enthält 2–5 % andere Metalle, darunter Kupfer, Silber, Gold, Zinn, Antimon, Arsen, Bismut in wechselnden Anteilen. Das Aufreinigen und Vermarkten einiger dieser Beiprodukte, insbesondere des bis zu 1 % im Werkblei enthaltenen Silbers, trägt wesentlich zur Wirtschaftlichkeit der Bleigewinnung bei. ⓘ
Die pyrometallische Raffination des Bleis ist ein mehrstufiger Prozess. Durch Schmelzen in Gegenwart von Natriumnitrat/Natriumcarbonat bzw. von Luft werden Antimon, Zinn und Arsen oxidiert und können als Bleiantimonate, -stannate und -arsenate von der Oberfläche der Metallschmelze abgezogen werden („Antimonabstrich“). Kupfer wie auch eventuell enthaltenes Zink, Nickel und Kobalt werden durch Seigern des Werkbleis aus dem Rohmetall entfernt. Dabei sinkt auch der Schwefelgehalt beträchtlich. Silber wird nach dem Parkes-Verfahren ggf. durch die Zugabe von Zink und das Ausseigern der sich bildenden Zn-Ag-Mischkristalle aus dem Blei abgeschieden („Parkesierung“), während die Bedeutung des älteren Pattinson-Verfahrens stark zurückgegangen ist (siehe auch Herstellung von Silber, Blicksilber). Bismut kann nach dem Kroll-Betterton-Verfahren durch Legieren mit Calcium und Magnesium als Bismutschaum von der Oberfläche der Bleischmelze abgezogen werden. ⓘ
Eine weitere Reinigung kann durch elektrolytische Raffination erfolgen, jedoch ist dieses Verfahren bedingt durch den hohen Energiebedarf kostenintensiver. Blei ist zwar ein unedles Element, welches in der elektrochemischen Spannungsreihe ein negativeres Standardpotential als Wasserstoff aufweist. Dieser hat jedoch an Bleielektroden eine hohe Überspannung, so dass eine elektrolytische Abscheidung metallischen Bleis aus wässrigen Lösungen möglich wird, siehe elektrolytische Bleiraffination. ⓘ
Raffiniertes Blei kommt als Weichblei bzw. genormtes Hüttenblei mit 99,9- bis 99,97%iger Reinheit (z. B. Eschweiler Raffiné) oder als Feinblei mit 99,985 bis 99,99 % Blei (DIN 1719, veraltet) in den Handel. Entsprechend dem Verwendungszweck sind auch Bezeichnungen wie Kabelblei für die Legierung mit ca. 0,04 % Kupfer verbreitet. Aktuelle Normen wie DIN EN 12659 kennen diese noch gebräuchlichen Bezeichnungen nicht mehr. ⓘ
Zunächst wird das Sulfidkonzentrat an der Luft geröstet, um das Bleisulfid zu oxidieren:
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑ ⓘ
Da das ursprüngliche Konzentrat kein reines Bleisulfid war, erhält man beim Rösten nicht nur das gewünschte Blei(II)-oxid, sondern ein Gemisch aus Oxiden, Sulfaten und Silikaten des Bleis und der anderen im Erz enthaltenen Metalle. Dieses unreine Bleioxid wird in einem koksbefeuerten Hochofen zu dem (ebenfalls unreinen) Metall reduziert:
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑. ⓘ
Direktes Verfahren
Bei diesem Verfahren werden Bleibarren und Schlacken direkt aus Bleikonzentraten gewonnen. Das Bleisulfidkonzentrat wird in einem Ofen geschmolzen und oxidiert, wobei sich Bleimonoxid bildet. Der geschmolzenen Charge werden Kohlenstoff (als Koks oder Kohlegas) und Flussmittel zugesetzt. Das Bleimonoxid wird dabei zu metallischem Blei reduziert, wobei eine bleimonoxidreiche Schlacke entsteht. ⓘ
Bei bleihaltigem Einsatzmaterial können bis zu 80 % des ursprünglichen Bleis als Barren gewonnen werden; die restlichen 20 % bilden eine bleimonoxidreiche Schlacke. Bei einem minderwertigen Einsatzmaterial kann das gesamte Blei zu einer bleihaltigen Schlacke oxidiert werden. Aus den bleihaltigen Schlacken (25-40 %) wird durch Verbrennung oder Einblasen von Unterwasserbrennstoff, durch Reduktion mit Hilfe eines Elektroofens oder durch eine Kombination aus beidem metallisches Blei gewonnen. ⓘ
Alternativen
Die Forschung nach einem saubereren, weniger energieintensiven Verfahren zur Bleigewinnung wird fortgesetzt; ein großer Nachteil ist, dass entweder zu viel Blei als Abfall verloren geht oder die Alternativen zu einem hohen Schwefelgehalt im entstehenden Bleimetall führen. Die hydrometallurgische Gewinnung, bei der Anoden mit unreinem Blei in einen Elektrolyten getaucht werden und reines Blei auf einer Kathode abgeschieden wird, ist eine Technik, die möglicherweise Potenzial hat, aber derzeit nicht wirtschaftlich ist, außer in Fällen, in denen Strom sehr billig ist. ⓘ
Sekundäres
Das Schmelzen, das ein wesentlicher Bestandteil der Primärproduktion ist, wird bei der Sekundärproduktion oft übersprungen. Sie wird nur dann durchgeführt, wenn das metallische Blei eine erhebliche Oxidation erfahren hat. Der Prozess ähnelt dem der Primärproduktion in einem Hoch- oder Drehrohrofen, wobei der wesentliche Unterschied in der größeren Variabilität der Ausbeute besteht: In Hochöfen wird hartes Blei (10 % Antimon) erzeugt, während in den Öfen des Drehrohrofens halbweiches Blei (3-4 % Antimon) entsteht. ⓘ
Das ISASMELT-Verfahren ist eine neuere Verhüttungsmethode, die als Erweiterung der Primärproduktion dienen kann; dabei wird die Batteriepaste aus verbrauchten Blei-Säure-Batterien (die Bleisulfat und Bleioxide enthält) durch eine Alkalibehandlung vom Sulfat befreit und anschließend in einem mit Kohle befeuerten Ofen in Gegenwart von Sauerstoff behandelt, wodurch unreines Blei entsteht, wobei Antimon die häufigste Verunreinigung ist. Die Raffination von sekundärem Blei ähnelt der von primärem Blei; einige Raffinationsprozesse können je nach dem recycelten Material und seiner möglichen Verunreinigung übersprungen werden. ⓘ
Von den Bleiquellen für das Recycling sind Blei-Säure-Batterien die wichtigsten; Bleirohre, Bleche und Kabelummantelungen sind ebenfalls von Bedeutung. ⓘ
Anwendungen

Entgegen der landläufigen Meinung wurden Bleistiftminen in Holzbleistiften nie aus Blei hergestellt. Als der Bleistift als ummanteltes Graphitschreibgerät entstand, wurde die verwendete Graphitsorte Plumbago (wörtlich: Akt für Blei oder Bleimodell) genannt. ⓘ
Elementare Form
Bleimetall hat mehrere nützliche mechanische Eigenschaften, darunter eine hohe Dichte, einen niedrigen Schmelzpunkt, Duktilität und relative Inertheit. Viele andere Metalle sind dem Blei in einigen dieser Aspekte überlegen, sind aber im Allgemeinen weniger verbreitet und schwieriger aus den Erzen zu gewinnen. Die Toxizität von Blei hat dazu geführt, dass es in einigen Bereichen nicht mehr verwendet wird. ⓘ
Blei wird seit seiner Erfindung im Mittelalter für Geschosse verwendet. Es ist preiswert, sein niedriger Schmelzpunkt ermöglicht das Gießen von Kleinwaffenmunition und Schrotkugeln mit minimaler technischer Ausrüstung, und es ist dichter als andere gängige Metalle, was eine bessere Beibehaltung der Geschwindigkeit ermöglicht. Blei ist nach wie vor das Hauptmaterial für Geschosse, die mit anderen Metallen als Härter legiert werden. Es wurden Bedenken geäußert, dass die für die Jagd verwendeten Bleigeschosse die Umwelt schädigen könnten. ⓘ
Die hohe Dichte und Korrosionsbeständigkeit von Blei wurde in einer Reihe von verwandten Anwendungen genutzt. Es wird als Ballast in Segelbootkielen verwendet; aufgrund seiner Dichte nimmt es nur ein geringes Volumen ein und minimiert den Wasserwiderstand, wodurch die Krängung des Segels durch den Wind ausgeglichen wird. Es wird in Gewichtsgürteln für Taucher verwendet, um den Auftrieb des Tauchers auszugleichen. 1993 wurde der Sockel des schiefen Turms von Pisa mit 600 Tonnen Blei stabilisiert. Wegen seiner Korrosionsbeständigkeit wird Blei als Schutzmantel für Unterwasserkabel verwendet. ⓘ

Blei wird in der Bauindustrie vielfältig eingesetzt: Bleibleche werden als architektonische Metalle für Dacheindeckungen, Verkleidungen, Abdeckungen, Dachrinnen und Dachrinnenanschlüsse sowie für Dachbrüstungen verwendet. Blei wird immer noch für Statuen und Skulpturen verwendet, auch für Armaturen. In der Vergangenheit wurde es häufig zum Auswuchten der Räder von Autos verwendet; aus Umweltschutzgründen wird diese Verwendung jedoch zugunsten anderer Materialien eingestellt. ⓘ
Blei wird Kupferlegierungen wie Messing und Bronze zugesetzt, um die Bearbeitbarkeit zu verbessern und um die Schmiereigenschaften zu verbessern. Da das Blei in Kupfer praktisch unlöslich ist, bildet es feste Kügelchen in Unebenheiten der Legierung, z. B. an Korngrenzen. In geringen Konzentrationen wirken die Kügelchen nicht nur als Schmiermittel, sondern verhindern auch die Bildung von Spänen bei der Bearbeitung der Legierung und verbessern so die Bearbeitbarkeit. Kupferlegierungen mit höheren Bleikonzentrationen werden in Lagern verwendet. Das Blei sorgt für die Schmierung, während das Kupfer die tragende Rolle spielt. ⓘ
Die hohe Dichte, Ordnungszahl und Formbarkeit von Blei bilden die Grundlage für die Verwendung von Blei als Barriere, die Schall, Vibrationen und Strahlung absorbiert. Blei hat keine natürlichen Resonanzfrequenzen, weshalb Bleibleche als schalldämpfende Schicht in den Wänden, Böden und Decken von Tonstudios verwendet werden. Orgelpfeifen werden häufig aus einer Bleilegierung hergestellt, die mit verschiedenen Mengen Zinn gemischt wird, um den Klang der einzelnen Pfeifen zu steuern. Blei ist aufgrund seiner Dichte und seines hohen Abschwächungskoeffizienten ein bewährtes Material zur Abschirmung von Strahlung in der Kernforschung und in Röntgenräumen. Geschmolzenes Blei wurde als Kühlmittel für bleigekühlte Schnellreaktoren verwendet. ⓘ
Zu Beginn des 21. Jahrhunderts wird Blei vor allem in Blei-Säure-Batterien verwendet. Das Blei in den Batterien kommt nicht direkt mit dem Menschen in Berührung, so dass es weniger Bedenken hinsichtlich der Toxizität gibt. Menschen, die in Produktionsanlagen für Bleibatterien arbeiten, können Bleistaub ausgesetzt sein und ihn einatmen.} Die Reaktionen in der Batterie zwischen Blei, Bleidioxid und Schwefelsäure sorgen für eine zuverlässige Spannungsquelle. Superkondensatoren, die Blei-Säure-Batterien enthalten, wurden in Australien, Japan und den Vereinigten Staaten im Kilowatt- und Megawattbereich zur Frequenzregulierung, zur Glättung und Verschiebung von Solarzellen, zur Glättung von Windkraftanlagen und für andere Anwendungen eingesetzt. Diese Batterien haben eine geringere Energiedichte und Lade-Entlade-Effizienz als Lithium-Ionen-Batterien, sind aber deutlich billiger. ⓘ
Blei wird in Hochspannungskabeln als Ummantelungsmaterial verwendet, um das Eindringen von Wasser in die Isolierung zu verhindern; diese Verwendung geht zurück, da Blei allmählich aus dem Verkehr gezogen wird. Auch die Verwendung von Blei in Lötmitteln für elektronische Geräte wird in einigen Ländern schrittweise eingestellt, um die Menge an umweltschädlichem Abfall zu verringern. Blei ist eines der drei Metalle, die im Oddy-Test für Museumsmaterialien verwendet werden, um organische Säuren, Aldehyde und saure Gase nachzuweisen. ⓘ
Ein wichtiger Abnehmer für Bleimetall war und ist das Militär. Blei dient als Grundstoff für Geschosse, sowohl für Schleudern als auch für Feuerwaffen. In sogenannten Kartätschen wurde gehacktes Blei verschossen. Der Grund für die Verwendung von Blei waren und sind einerseits die hohe Dichte und damit hohe Durchschlagskraft und andererseits die leichte Herstellung durch Gießen. Heutzutage wird das Blei meist von einem Mantel (daher „Mantelgeschoss“) aus einer Kupferlegierung (Tombak) umschlossen. Vorteile sind vor allem eine höhere erreichbare Geschossgeschwindigkeit, bei der ein nicht ummanteltes Bleigeschoss aufgrund seiner Weichheit nicht mehr verwendet werden kann, und die Verhinderung von Bleiablagerungen im Inneren des Laufes einer Feuerwaffe. Bleifreie Munition ist jedoch auch verfügbar. ⓘ
Verbindungen


Bleibatterien sind nicht nur die Hauptanwendung für Bleimetall, sondern auch der Hauptverbraucher von Bleiverbindungen. Die in diesen Geräten verwendete Reaktion zur Energiespeicherung/-freisetzung umfasst Bleisulfat und Bleidioxid:
- Pb(s) + PbO
2(s) + 2H
2SO
4(aq) → 2PbSO
4(s) + 2H
2O(l) ⓘ
Andere Anwendungen von Bleiverbindungen sind sehr speziell und oft verblasst. Farbstoffe auf Bleibasis werden in Keramikglasuren und Glas verwendet, insbesondere für rote und gelbe Farbtöne. Während Bleifarben in Europa und Nordamerika aus dem Verkehr gezogen wurden, werden sie in weniger entwickelten Ländern wie China, Indien oder Indonesien weiterhin verwendet. Bleitetraacetat und Bleidioxid werden als Oxidationsmittel in der organischen Chemie verwendet. Blei wird häufig in der Polyvinylchloridbeschichtung von Elektrokabeln verwendet. Es kann zur Behandlung von Kerzendochten verwendet werden, um ein längeres und gleichmäßigeres Brennen zu gewährleisten. Wegen seiner Giftigkeit verwenden europäische und nordamerikanische Hersteller Alternativen wie Zink. Bleiglas besteht zu 12 bis 28 % aus Bleioxid, was seine optischen Eigenschaften verändert und die Durchlässigkeit für ionisierende Strahlung verringert, eine Eigenschaft, die in alten Fernsehern und Computermonitoren mit Kathodenstrahlröhren genutzt wird. Halbleiter auf Bleibasis wie Bleitellurid und Bleiselenid werden in Fotovoltaikzellen und Infrarotdetektoren verwendet. ⓘ
Biologische Wirkungen
| Gefahren | |
|---|---|
| GHS-Kennzeichnung: | |
Piktogramme
|
  
|
Signalwort
|
Gefahr |
Gefahrenhinweise
|
H302, H332, H351, H360Df, H373, H410 |
Sicherheitshinweise
|
P201, P261, P273, P304, P308, P312, P313, P340, P391 |
| NFPA 704 (Feuerdiamant) | |
Für Blei gibt es keine bestätigte biologische Funktion, und es gibt keine bestätigte sichere Bleiexposition. Eine kanadisch-amerikanische Studie aus dem Jahr 2009 kam zu dem Schluss, dass Blei selbst bei Konzentrationen, die als wenig bis gar nicht gefährlich gelten, "negative Auswirkungen auf die psychische Gesundheit" haben kann. Sein Vorkommen im menschlichen Körper - bei einem Erwachsenen durchschnittlich 120 mg - wird jedoch unter den Schwermetallen nur von Zink (2500 mg) und Eisen (4000 mg) übertroffen. Bleisalze werden vom Körper sehr gut aufgenommen. Ein kleiner Teil des Bleis (1 %) wird in den Knochen gespeichert; der Rest wird innerhalb weniger Wochen nach der Exposition mit dem Urin und den Fäkalien ausgeschieden. Nur etwa ein Drittel des Bleis wird von einem Kind ausgeschieden. Eine kontinuierliche Exposition kann zu einer Bioakkumulation von Blei führen. ⓘ
Toxizität
Blei ist ein hochgiftiges Metall (sowohl beim Einatmen als auch beim Verschlucken), das fast alle Organe und Systeme des menschlichen Körpers angreift. Bei einer Konzentration von 100 mg/m3 in der Luft ist es unmittelbar lebens- und gesundheitsgefährlich. Das meiste verschluckte Blei wird in den Blutkreislauf aufgenommen. Die Hauptursache für seine Toxizität ist seine Neigung, das ordnungsgemäße Funktionieren von Enzymen zu beeinträchtigen. Dies geschieht, indem es sich an die Sulfhydrylgruppen vieler Enzyme bindet oder andere Metalle nachahmt und verdrängt, die als Kofaktoren in vielen enzymatischen Reaktionen wirken. Zu den wesentlichen Metallen, mit denen Blei interagiert, gehören Kalzium, Eisen und Zink. Hohe Kalzium- und Eisenkonzentrationen bieten in der Regel einen gewissen Schutz vor Bleivergiftungen, während niedrige Konzentrationen die Anfälligkeit erhöhen. ⓘ
Auswirkungen
Blei kann zu schweren Schäden an Gehirn und Nieren und schließlich zum Tod führen. Da es Kalzium imitiert, kann Blei die Blut-Hirn-Schranke überwinden. Es baut die Myelinscheiden der Neuronen ab, verringert deren Anzahl, stört die Neurotransmissionswege und verringert das Wachstum der Neuronen. Im menschlichen Körper hemmt Blei die Porphobilinogensynthase und die Ferrochelatase und verhindert so sowohl die Porphobilinogenbildung als auch den Einbau von Eisen in Protoporphyrin IX, den letzten Schritt der Häm-Synthese. Dies führt zu einer ineffektiven Häm-Synthese und mikrozytärer Anämie. ⓘ

Zu den Symptomen einer Bleivergiftung gehören Nephropathie, kolikartige Bauchschmerzen und möglicherweise Schwäche in den Fingern, Handgelenken oder Knöcheln. Vor allem bei Menschen mittleren und höheren Alters kann ein leichter Blutdruckanstieg festgestellt werden, der eine Anämie verursachen kann. In mehreren Studien, meist Querschnittsstudien, wurde ein Zusammenhang zwischen erhöhter Bleiexposition und verminderter Herzfrequenzvariabilität festgestellt. Bei schwangeren Frauen kann eine hohe Bleiexposition zu Fehlgeburten führen. Chronische, hohe Bleibelastung verringert nachweislich die Fruchtbarkeit bei Männern. ⓘ
Im sich entwickelnden Gehirn eines Kindes beeinträchtigt Blei die Synapsenbildung in der Großhirnrinde, die neurochemische Entwicklung (einschließlich der Entwicklung von Neurotransmittern) und die Organisation von Ionenkanälen. Eine frühkindliche Bleiexposition wird mit einem erhöhten Risiko von Schlafstörungen und übermäßiger Tagesmüdigkeit in der späteren Kindheit in Verbindung gebracht. Hohe Blutwerte werden mit einer verzögerten Pubertät bei Mädchen in Verbindung gebracht. Der Anstieg und Rückgang der Bleiexposition in der Luft durch die Verbrennung von Tetraethylblei in Benzin während des 20. Jahrhunderts wurde mit dem historischen Anstieg und Rückgang der Kriminalität in Verbindung gebracht. ⓘ
Expositionsquellen
Die Bleiexposition ist ein globales Problem, da der Abbau und die Verhüttung von Blei sowie die Herstellung/Entsorgung/Wiederverwertung von Batterien in vielen Ländern üblich sind. Blei gelangt durch Einatmen, Verschlucken oder Hautresorption in den Körper. Fast das gesamte eingeatmete Blei wird vom Körper aufgenommen; bei der Einnahme liegt die Rate bei 20-70 %, wobei Kinder einen höheren Prozentsatz aufnehmen als Erwachsene. ⓘ
Vergiftungen entstehen in der Regel durch die Aufnahme von mit Blei kontaminierten Lebensmitteln oder Wasser, seltener durch die versehentliche Aufnahme von kontaminierter Erde, Staub oder bleihaltiger Farbe. Meerwasserprodukte können Blei enthalten, wenn sie durch nahe gelegene Industriegewässer verunreinigt sind. Obst und Gemüse können durch hohe Bleikonzentrationen in den Böden, in denen sie angebaut wurden, kontaminiert werden. Der Boden kann durch die Ansammlung von Partikeln aus Blei in Rohren, Bleifarben und Restemissionen aus verbleitem Benzin kontaminiert werden. ⓘ
Die Verwendung von Blei für Wasserleitungen ist in Gebieten mit weichem oder saurem Wasser ein Problem. Hartes Wasser bildet unlösliche Schutzschichten auf der Innenfläche der Rohre, während weiches und saures Wasser die Bleirohre auflöst. Gelöstes Kohlendioxid im mitgeführten Wasser kann zur Bildung von löslichem Bleibicarbonat führen; sauerstoffhaltiges Wasser kann Blei in ähnlicher Weise als Blei(II)-hydroxid auflösen. Das Trinken von solchem Wasser kann im Laufe der Zeit aufgrund der Toxizität des gelösten Bleis zu gesundheitlichen Problemen führen. Je härter das Wasser ist, desto mehr Kalziumbikarbonat und Sulfat enthält es, und desto mehr wird die Innenseite der Rohre mit einer Schutzschicht aus Bleikarbonat oder Bleisulfat überzogen. ⓘ

Das Verschlucken von aufgetragener Bleifarbe ist die Hauptquelle der Exposition von Kindern: Eine direkte Quelle ist das Kauen auf alten gestrichenen Fensterbänken. Alternativ dazu blättert die Farbe ab, wenn sie sich zersetzt, wird zu Staub zermahlen und gelangt dann durch Hand-zu-Mund-Kontakt oder kontaminierte Lebensmittel, Wasser oder Alkohol in den Körper. Die Einnahme bestimmter Hausmittel kann zu einer Exposition gegenüber Blei oder seinen Verbindungen führen. ⓘ
Die Inhalation ist der zweite wichtige Expositionspfad, der Raucher und insbesondere Arbeitnehmer in bleibezogenen Berufen betrifft. Zigarettenrauch enthält neben anderen toxischen Substanzen auch radioaktives Blei-210. ⓘ
Die Exposition der Haut kann für Personen, die mit organischen Bleiverbindungen arbeiten, erheblich sein. Bei anorganischem Blei ist die Absorptionsrate der Haut geringer. ⓘ
Blei in Plastikspielzeug
Nach Angaben des United States Center for Disease Control ist die Verwendung von Blei in Kunststoffen nicht verboten worden. Blei macht den Kunststoff weicher und flexibler, so dass er wieder in seine ursprüngliche Form zurückkehren kann. Es kann auch in Kunststoffspielzeug verwendet werden, um die Moleküle vor Hitze zu stabilisieren. Bleistaub kann sich bilden, wenn Kunststoff dem Sonnenlicht, der Luft und Reinigungsmitteln ausgesetzt wird, die die chemische Bindung zwischen Blei und Kunststoff aufbrechen. ⓘ
Behandlung
Die Behandlung von Bleivergiftungen umfasst normalerweise die Verabreichung von Dimercaprol und Succimer. In akuten Fällen kann der Einsatz von Dinatriumcalciumedetat, dem Calciumchelat, und dem Dinatriumsalz der Ethylendiamintetraessigsäure (EDTA) erforderlich sein. EDTA hat eine größere Affinität zu Blei als zu Kalzium, so dass durch Austausch ein Bleichelat gebildet wird, das mit dem Urin ausgeschieden wird und unschädliches Kalzium zurücklässt. ⓘ
Auswirkungen auf die Umwelt
Die Gewinnung, Herstellung, Verwendung und Entsorgung von Blei und seinen Produkten hat zu einer erheblichen Verunreinigung der Böden und Gewässer der Erde geführt. Die Emissionen von Blei in die Atmosphäre erreichten ihren Höhepunkt während der industriellen Revolution und der Zeit des verbleiten Benzins in der zweiten Hälfte des zwanzigsten Jahrhunderts. ⓘ
Die Bleifreisetzungen stammen aus natürlichen Quellen (d. h. Konzentration des natürlich vorkommenden Bleis), aus der industriellen Produktion, der Verbrennung und dem Recycling sowie der Mobilisierung von zuvor vergrabenem Blei. Da Blei aus anderen Verwendungszwecken ausgemustert wurde, sind insbesondere im globalen Süden Bleirecyclingverfahren zur Gewinnung von billigem Blei für die globale Produktion zu einer gut dokumentierten Expositionsquelle geworden. In Böden und Sedimenten in postindustriellen und städtischen Gebieten sind nach wie vor hohe Bleikonzentrationen festzustellen; industrielle Emissionen, einschließlich derer aus der Kohleverbrennung, sind in vielen Teilen der Welt, insbesondere in den Entwicklungsländern, weiterhin vorhanden. ⓘ
Blei kann sich in Böden ansammeln, insbesondere in solchen mit hohem organischem Anteil, wo es Hunderte bis Tausende von Jahren verbleibt. Blei in der Umwelt kann mit anderen Metallen konkurrieren, die sich in und auf Pflanzenoberflächen befinden, und möglicherweise die Photosynthese hemmen und bei ausreichend hohen Konzentrationen das Wachstum und Überleben der Pflanzen beeinträchtigen. Die Kontamination von Böden und Pflanzen kann dazu führen, dass Blei in der Nahrungskette aufsteigt und Mikroorganismen und Tiere beeinträchtigt. Bei Tieren wirkt Blei in vielen Organen toxisch und schädigt nach Verschlucken, Einatmen oder Hautresorption das Nerven-, Nieren-, Fortpflanzungs-, Blutbildungs- und Herz-Kreislauf-System. Fische nehmen Blei sowohl aus dem Wasser als auch aus dem Sediment auf; die Bioakkumulation in der Nahrungskette stellt eine Gefahr für Fische, Vögel und Meeressäuger dar. ⓘ
Anthropogenes Blei umfasst Blei aus Schrot und Senkblei. Diese gehören neben den Standorten der Bleiproduktion zu den stärksten Quellen der Bleiverunreinigung. Blei wurde 2017 in den Vereinigten Staaten für Schrot und Senkblei verboten, obwohl dieses Verbot nur einen Monat lang galt, und ein ähnliches Verbot wird in der Europäischen Union erwogen. ⓘ
Zu den Analysemethoden für die Bestimmung von Blei in der Umwelt gehören Spektrophotometrie, Röntgenfluoreszenz, Atomspektroskopie und elektrochemische Methoden. Es wurde eine spezifische ionenselektive Elektrode auf der Grundlage des Ionophors S,S'-Methylenbis (N,N-Diisobutyldithiocarbamat) entwickelt. Ein wichtiger Biomarker für Bleivergiftungen ist der δ-Aminolävulinsäuregehalt in Plasma, Serum und Urin. ⓘ
Einschränkung und Sanierung

Bis Mitte der 1980er Jahre ging die Verwendung von Blei in der Industrie deutlich zurück. In den Vereinigten Staaten wurde die Verwendung von Blei in Produkten, die nicht aus Batterien bestehen, wie z. B. Benzin, Farben, Lötmitteln und Wassersystemen, durch Umweltvorschriften reduziert oder ganz eingestellt. In Kohlekraftwerken wurden Vorrichtungen zur Partikelkontrolle installiert, um Bleiemissionen zu erfassen. 1992 forderte der US-Kongress die Umweltschutzbehörde auf, die Bleikonzentration im Blut der Kinder des Landes zu senken. Die Verwendung von Blei wurde durch die Richtlinie der Europäischen Union zur Beschränkung gefährlicher Stoffe aus dem Jahr 2003 weiter eingeschränkt. In den Niederlanden kam es nach dem nationalen Verbot der Verwendung von Bleischrot für die Jagd und den Schießsport im Jahr 1993 zu einem starken Rückgang der Bleibelastung: von 230 Tonnen im Jahr 1990 auf 47,5 Tonnen im Jahr 1995. ⓘ
In den Vereinigten Staaten wurde der zulässige Grenzwert für die Bleiexposition am Arbeitsplatz, der metallisches Blei, anorganische Bleiverbindungen und Bleiseifen umfasst, auf 50 μg/m3 an einem 8-Stunden-Arbeitstag und der Grenzwert für den Bleigehalt im Blut auf 5 μg pro 100 g Blut im Jahr 2012 festgelegt. Blei kann immer noch in schädlichen Mengen in Steingut, Vinyl (z. B. für Schläuche und die Isolierung von Elektrokabeln) und chinesischem Messing enthalten sein. Alte Häuser können noch Bleifarbe enthalten. Weiße Bleifarbe wird in den Industrieländern nicht mehr verkauft, aber andere Pigmente wie gelbes Bleichromat werden noch immer speziell verwendet. Beim Abschleifen von alter Farbe entsteht Staub, der eingeatmet werden kann. Einige Behörden haben Programme zur Bleisanierung von Häusern vorgeschrieben, in denen kleine Kinder leben. ⓘ
Je nach Gerichtsbarkeit und Art des Abfalls können bleihaltige Abfälle als Hausmüll (zur Erleichterung von Bleisanierungsmaßnahmen) oder als potenziell gefährliche Abfälle behandelt werden, die eine spezielle Behandlung oder Lagerung erfordern. Blei wird an Schießplätzen in die Umwelt freigesetzt, und es wurde eine Reihe von Bleimanagementverfahren entwickelt, um der Bleikontamination entgegenzuwirken. Um dem entgegenzuwirken, wird empfohlen, die Böden mit Kalk zu behandeln, um sie zu neutralisieren und die Auswaschung von Blei zu verhindern. ⓘ
Es wurde erforscht, wie Blei mit biologischen Mitteln aus Biosystemen entfernt werden kann: Fischgräten werden auf ihre Fähigkeit hin untersucht, Blei in kontaminierten Böden biologisch zu sanieren. Der Pilz Aspergillus versicolor ist in der Lage, Blei-Ionen aus Industrieabfällen zu absorbieren, bevor sie in Gewässer gelangen. Mehrere Bakterien wurden auf ihre Fähigkeit untersucht, Blei aus der Umwelt zu entfernen, darunter die sulfatreduzierenden Bakterien Desulfovibrio und Desulfotomaculum, die beide in wässrigen Lösungen sehr wirksam sind. ⓘ
Blei als Mineral

Natürliche Vorkommen an Blei in seiner elementaren Form waren bereits vor der Gründung der International Mineralogical Association (IMA) bekannt. Als vermutliche Typlokalität wird die manganreichen Eisenerz-Lagerstätte Långban in Schweden angegeben, wo derbe Massen von bis zu 50 kg oder 60 kg gefunden worden sein sollen. Blei ist daher als sogenanntes grandfathered Mineral als eigenständige Mineralart anerkannt. ⓘ
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Blei unter der System-Nummer 1.AA.05 (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe) beziehungsweise in der veralteten 8. Auflage unter I/A.03 (Zinn-Blei-Gruppe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.01.04 (Goldgruppe). ⓘ
In der Natur tritt gediegen Blei meist in Form von zentimetergroßen Blechen und Platten sowie in körnigen, dendritischen, haar- oder drahtförmigen Aggregaten auf. Sehr selten finden sich auch oktaedrische, würfelige und dodekaedrische Bleikristalle, die meist winzig sind, aber gelegentlich eine Größe zwischen 4 cm und 6 cm erreichen können. ⓘ
Gewinnung und Darstellung
Das mit Abstand bedeutendste Bleimineral ist das Galenit. Dieses tritt häufig vergesellschaftet mit den Sulfiden anderer Metalle (Kupfer, Bismut, Zink, Arsen, Antimon u. a.) auf, die naturgemäß als Verunreinigung des Rohbleis bis zu einem Anteil von 5 % enthalten sind. ⓘ
Das durch Zerkleinerung, Klassierung und Flotation auf bis zu 60 % Mineralgehalt aufbereitete Erz wird in drei verschiedenen industriellen Prozessen in metallisches Blei überführt. Dabei treten die Verfahren der Röstreduktion und der Röstreaktion zunehmend in den Hintergrund und werden durch Direktschmelzverfahren ersetzt, die sich einerseits wirtschaftlicher gestalten lassen und die andererseits umweltverträglicher sind. ⓘ
Röstreduktionsarbeit
Dieses Verfahren verläuft in zwei Stufen, dem Rösten und der Reduktion. Beim Rösten wird das fein zerkleinerte Bleisulfid auf einen Wanderrost gelegt und 1000 °C heiße Luft hindurchgedrückt. Dabei reagiert es mit dem Sauerstoff der Luft in einer exothermen Reaktion zu Blei(II)-oxid (PbO) und Schwefeldioxid. Dieses wird über die Röstgase ausgetrieben und kann für die Schwefelsäureproduktion verwendet werden. Das Bleioxid ist unter diesen Bedingungen flüssig und fließt nach unten. Dort kann es gesintert werden. ⓘ
- (Röstarbeit) ⓘ
Anschließend erfolgt die Reduktion des Bleioxids mit Hilfe von Koks zu metallischem Blei. Dies geschieht in einem Schachtofen, ähnlich dem beim Hochofenprozess verwendeten. Dabei werden schlackebildende Zuschlagsstoffe wie Kalk beigefügt. ⓘ
- (Reduktionsarbeit) ⓘ
Röstreaktionsarbeit
Dieses Verfahren kommt vor allem bei hochgradig mit PbS angereicherten Bleierzen zum Einsatz und ermöglicht die Bleierzeugung in einem Schritt. Dabei wird das sulfidische Erz nur unvollständig geröstet. Anschließend wird das Bleisulfid/Bleioxid-Gemisch weiter unter Luftabschluss erhitzt. Dabei setzt das Bleioxid sich mit dem verbliebenen PbS ohne Zugabe eines weiteren Reduktionsmittels zu Blei und Schwefeldioxid um:
- (Röstarbeit), ⓘ
- (Reaktionsarbeit). ⓘ
Direktschmelzverfahren
Moderne Herstellungsverfahren für Blei basieren auf Direktschmelzverfahren, die auf Umweltverträglichkeit und Wirtschaftlichkeit hin optimiert wurden (z. B. das QSL-Verfahren). Vorteilhaft ist die kontinuierliche Prozessführung mit Beschränkung auf einen Reaktionsraum, der als einziger Emittent für Schadstoffe auftritt – im Vergleich dazu weisen die klassischen Produktionsverfahren das Sintern als zusätzlichen emittierenden Schritt auf. Das Rösten und die Reduktion finden parallel in einem Reaktor statt. Das Bleisulfid wird ähnlich wie beim Röstreaktionsverfahren nicht vollständig geröstet. Ein Teil des Bleis entsteht somit durch Reaktion des Bleisulfids mit Bleioxid. Da der Reaktor leicht geneigt ist, fließen Blei und bleioxidhaltige Schlacke ab. Diese passiert die Reduktionszone, in die Kohlenstaub eingeblasen und das Bleioxid so zu Blei reduziert wird. Beim Rösten wird statt Luft reiner Sauerstoff verwendet. Dadurch verringert sich das Volumen an Abgasen erheblich, die andererseits eine im Vergleich zu konventionellen Verfahren höhere Konzentration an Schwefeldioxid aufweisen. Deren Verwendung für die Schwefelsäureherstellung gestaltet sich somit einfacher und wirtschaftlicher. ⓘ
Verwendung
Die größten Bleiverbraucher sind die USA, Japan, Deutschland und die Volksrepublik China. Der Verbrauch ist stark von der Konjunktur in der Automobilindustrie abhängig, in deren Akkumulatoren etwa 60 % des Weltbedarfs an Blei verwendet werden. Weitere 20 % werden in der chemischen Industrie verarbeitet. ⓘ
Strahlenabschirmung

Wegen seiner hohen Atommasse eignet sich Blei in ausreichend dicken Schichten oder Blöcken zur Abschirmung gegen Gamma- und Röntgenstrahlung; es absorbiert Röntgen- und Gammastrahlung sehr wirksam. Blei ist hierfür billiger und leichter zu verarbeiten, etwa als weiches Blech, als noch „atom-schwerere“, dichtere Metalle. Deshalb wird es ganz allgemein im Strahlenschutz (z. B. Nuklearmedizin, Radiologie, Strahlentherapie) zur Abschirmung benutzt. Ein Beispiel ist die Bleischürze, welche Ärzte und Patienten bei Röntgenaufnahmen tragen. Bleiglas wird ebenfalls zum Strahlenschutz verwendet. ⓘ
Im Krankenhausbereich ist als technische Angabe bei baulichen Einrichtungen mit Abschirmfunktion wie Wänden, Türen, Fenster der Bleidickegleichwert üblich und oft angeschrieben, um die Wirksamkeit von Strahlenschutz und Strahlenbelastung berechnen zu können. ⓘ
Blei wird deshalb z. B. auch für Streustrahlenraster eingesetzt. ⓘ
Einen besonderen Anwendungsfall stellt die Abschirmung von Gamma-Spektrometern für die Präzisionsdosimetrie dar. Hierfür wird Blei mit möglichst geringer Eigen-Radioaktivität benötigt. Der natürliche Gehalt an radioaktivem 210Pb wirkt sich störend aus. Er fällt umso niedriger aus, je länger der Verhüttungszeitpunkt zurückliegt, denn mit der Verhüttung werden die Mutter-Nuklide aus der Uran-Radium-Reihe (Begleiter im Erz) vom Blei abgetrennt. Das 210Pb zerfällt daher vom Zeitpunkt der Verhüttung an mit seiner Halbwertszeit von 22,3 Jahren, ohne dass neues nachgebildet wird. Deshalb sind historische Bleigegenstände wie etwa Trimmgewichte aus gesunkenen Schiffen oder historische Kanonenkugeln zur Gewinnung von strahlungsarmem Blei für die Herstellung solcher Abschirmungen begehrt. Auch gibt es noch andere Forschungseinrichtungen, die aus ähnlichen Gründen dieses alte Blei benötigen. ⓘ
Metall
Maschinenbau
Da Blei eine hohe Dichte besitzt, wird es als Gewicht benutzt. Umgangssprachlich gibt es deshalb die Bezeichnung „bleischwer“ für sehr schwere Dinge. Bleigewichte wurden unter anderem als Ausgleichsgewichte zum Auswuchten von Autorädern benutzt. Dies ist aber seit dem 1. Juli 2003 bei PKW-Neuwagen und seit dem 1. Juli 2005 bei allen PKW (bis 3,5 t) verboten; die Bleigewichte sind durch Zink- oder Kupfergewichte ersetzt worden. Weitere Anwendungen unter Ausnutzung der hohen Dichte sind: Bleiketten zur Straffung von Gardinen und Tauchgewichte, um beim Tauchen den Auftrieb von Taucher und Ausrüstung auszugleichen. Außerdem wird Blei als Schwingungsdämpfer in vibrationsempfindlichen (Auto-)Teilen, zur Stabilisierung von Schiffen und für Sonderanwendungen des Schallschutzes verwendet. ⓘ
Apparatebau
Blei ist durch Passivierung chemisch sehr beständig und widersteht u. a. Schwefelsäure und Brom. Daher wird es als Korrosionsschutz im Apparate- und Behälterbau eingesetzt. Eine früher wichtige Anwendung war das Bleikammerverfahren zur Schwefelsäureherstellung, da damals Blei das einzige bekannte Metall war, das den Schwefelsäuredämpfen widerstand. Auch frühere Anlagen und Räume zur Herstellung von Nitroglyzerin wurden an Boden und Wand mit Blei ausgekleidet. Blei wurde auch häufig zur Ummantelung von Kabeln zum Schutz vor Umwelteinflüssen benutzt, beispielsweise bei Telefonkabeln. Heute ist Blei dabei meist durch Kunststoffe, z. B. PVC, abgelöst worden, wird aber bis heute bei Kabeln in Raffinerien eingesetzt, da es auch gegen Kohlenwasserstoffe unempfindlich ist. ⓘ
Bauwesen

Da Blei leicht zu bearbeiten und zu gießen ist, wurde Blei in der Vergangenheit häufig für metallische Gegenstände verwendet. Zu den wichtigsten Bleiprodukten zählten u. a. Rohre. Aufgrund der Toxizität der aus dem Blei evtl. entstehenden chemischen Verbindungen (Bleivergiftung) kommen Bleirohre aber seit den 1970er Jahren nicht mehr zum Einsatz. Trotz einer gebildeten Karbonatschicht in den Rohren löst sich das Blei weiterhin im Trinkwasser. Erfahrungsgemäß wird bereits nach wenigen Metern der Grenzwert der geltenden Trinkwasserverordnung nicht mehr eingehalten. ⓘ

Weitere Verwendung im Hochbau fand Blei zur Verbindung von Steinen durch eingegossene Metallklammern oder Metalldübel, etwa um Scharniere an einen steinernen Türstock zu befestigen oder ein Eisengeländer an einer Steintreppe. Diese Verbleiungstechnik ist in der Restaurierung noch weit verbreitet. So an der Turmspitze im Wiener Stephansdom oder der Brücke in Mostar. Auch für Fensterfassungen, z. B. an mittelalterlichen Kirchenfenstern, wurden oft Bleiruten verwendet. Blei (Walzblei) findet auch Verwendung als Dachdeckung (z. B. die Hauptkuppeln der Hagia Sophia) oder für Dachabschlüsse (z. B. bei den berühmten „Bleikammern“, dem ehemaligen Gefängnis von Venedig und im Kölner Dom) sowie zur Einfassung von Dachöffnungen. Auch wurde früher Farben und Korrosionsschutzanstrichen Blei beigemischt, insbesondere bei Anstrichen für Metalloberflächen. Noch heute stellt Blei bei Gebäuden im Bestand einen zu berücksichtigenden Gebäudeschadstoff dar, da es in vielen älteren Bau- und Anlageteilen weiterhin zu finden ist. ⓘ
Pneumatiksteuerungen
Ein spezieller Anwendungsbereich von Bleirohren waren ab dem späten 19. Jahrhundert pneumatische Steuerungen für Orgeln (pneumatische Traktur), pneumatische Kunstspielklaviere und, als ein spezieller und sehr erfolgreicher Einsatzfall, die Steuerung der Link-Trainer, des ersten weitverbreiteten Flugsimulators. Die Vorteile von Bleirohren (billig, stabil, flexibel, kleiner Platzbedarf für die nötigen umfangreichen Rohrbündel, lötbar, mechanisch leicht zu verarbeiten, langlebig) waren dafür ausschlaggebend. ⓘ
Karosseriereparatur
Vor dem Aufkommen moderner 2-Komponenten-Spachtelmasse wurden Blei oder Blei-Zinn-Legierungen aufgrund ihres geringen Schmelzpunktes zum Ausfüllen von Schad- und Reparaturstellen an Fahrzeugkarosserien genutzt. Dazu wurde das Material mit Lötbrenner und Flussmittel auf die Schadstelle aufgelötet. Anschließend wurde die Stelle wie beim Spachteln verschliffen. Dies hat den Vorteil, dass das Blei im Gegensatz zu Spachtelmasse eine feste Bindung mit dem Blech eingeht und bei Temperaturschwankungen auch dessen Längenausdehnung mitmacht. Da die entstehenden Dämpfe und Stäube giftig sind, wird dieses Verfahren heute außer bei der Restaurierung historischer Fahrzeuge kaum noch verwendet. ⓘ
Brauchtum
Ein alter Orakel-Brauch, den bereits die Römer pflegten, ist das Bleigießen, bei dem flüssiges Blei (heutzutage auch in Legierung mit Zinn) in kaltem Wasser zum Erstarren gebracht wird. Anhand der zufällig entstehenden Formen sollen Weissagungen über die Zukunft getroffen werden. Heute wird der Brauch noch gerne zu Neujahr geübt, um einen (nicht unbedingt ernst genommenen) Ausblick auf das kommende Jahr zu bekommen. ⓘ
Wassersport

Beim Tauchen werden Bleigewichte zum Tarieren verwendet; der hohe Dichteüberschuss (gut 10 g/cm³) gegenüber Wasser liefert kompakt den Abtrieb, so dass ein Taucher auch in geringer Wassertiefe schweben kann. Für die Verwendung von Blei als Gewicht ist ferner der vergleichsweise niedrige Preis begünstigend: Ausgehend von den Weltmarktpreisen für Metalle vom Juli 2013 hat Blei ein hervorragendes Preis-Gewichts-Verhältnis. Die Verwendung erfolgt in Form von Platten an den Schuhsohlen eines Panzertauchanzugs, als abgerundete Blöcke aufgefädelt auf einem breiten Hüftgurt oder – modern – als Schrotkugeln in Netzen in den Taschen einer Tarierweste. Öffnen der Gurtschnalle oder der Taschen (unten) erlaubt es, den Ballast notfalls rasch abzuwerfen. ⓘ
Der Kielballast von Segelyachten besteht bevorzugt aus Blei. Eisenschrott ist zwar billiger, aber auch weniger dicht, was bei den heute üblichen schlanken Kielen nicht optimal ist. Neben der Dichte ist ein weiter Vorteil, dass Blei nicht rostet und daher auch bei einem Schaden in der Kielverkleidung nicht degeneriert. ⓘ
Bleifrei
Bleihaltige Produkte und Anwendungen werden entweder vollständig ersetzt (wie Tetraethylblei im Benzin) oder der Bleigehalt durch Grenzwerte auf einen der technischen Verunreinigung entsprechenden Wert beschränkt (z. B. Zinn und Lot). Diese Produkte werden gern „bleifrei“ genannt. Grenzwerte gibt es u. a. in der Gesetzgebung um die so genannte RoHS (Richtlinie 2011/65/EU), die 1000 ppm (0,1 %) vorsieht. Strenger ist der Grenzwert für Verpackungen mit 100 ppm (Richtlinie 94/62/EG). ⓘ
Der politische Wille zum Ersetzen des Bleis gilt auch dort, wo die Verwendung aufgrund der Eigenschaften technisch oder wirtschaftlich interessant wäre, die Gesundheitsgefahr gering und ein Recycling mit sinnvollem Aufwand möglich wäre (z. B. Blei als Dacheindeckung). ⓘ
Bleiglas
Wegen der abschirmenden Wirkung des Bleis besteht der Konus von Kathodenstrahlröhren (d. h. der „hintere“ Teil der Röhre) für Fernseher, Computerbildschirme etc. aus Bleiglas. Das Blei absorbiert die in Kathodenstrahlröhren zwangsläufig entstehenden weichen Röntgenstrahlen. Für diesen Verwendungszweck ist Blei noch nicht sicher zu ersetzen, daher wird die RoHS-Richtlinie hier nicht angewendet. Glas mit sehr hohem Bleigehalt wird wegen dieser Abschirmwirkung auch in der Radiologie sowie im Strahlenschutz (zum Beispiel in Fensterscheiben) verwendet. Ferner wird Bleiglas wegen seines hohen Brechungsindexes für hochwertige Glaswaren als sogenanntes Bleikristall verwendet. ⓘ
Bleibelastung der Umwelt
Luft
Die Bleibelastung der Luft wird hauptsächlich durch bleihaltige Stäube verursacht: Hauptquellen sind die Blei-erzeugende Industrie, die Verbrennung von Kohle und bis vor einigen Jahren vor allem der Autoverkehr durch die Verbrennung bleihaltiger Kraftstoffe in Automotoren – durch Reaktion mit dem Benzin zugesetzten halogenierten Kohlenwasserstoffen entstand aus dem zugesetzten Bleitetraethyl neben geringeren Mengen an Blei(II)-chlorid und Blei(II)-bromid vor allem Blei und Blei(II)-oxid. Infolge des Verbotes bleihaltiger Kraftstoffe ist die entsprechende Luftbelastung in den letzten Jahren deutlich zurückgegangen. ⓘ
Am höchsten ist die Bleibelastung durch Bleistäube derzeit bei der Arbeit in Blei-produzierenden und -verarbeitenden Betrieben. Auch beim Reinigen und Entfernen alter Mennige-Anstriche durch Sandstrahlen entsteht Bleistaub. Die bei der Bleiraffination und der Verbrennung von Kohle entstehenden Bleioxidstäube konnten durch geeignete Filter verringert werden. Eine weitere Quelle, die mengenmäßig aber kaum ins Gewicht fällt, ist die Verbrennung von Hausmüll in Müllverbrennungsanlagen. ⓘ
Sport- und andere Schützen sind erheblichen Belastungen durch im Mündungs- bzw. Zündfeuer enthaltene (Schwer)metalle ausgesetzt, darunter neben Antimon, Kupfer und Quecksilber eben auch Blei; Vorsorge kann durch den Betrieb entsprechender Absauganlagen auf Schießständen sowie durch den Gebrauch bleifreier Munition getroffen werden. ⓘ
Boden
Auch Böden können mit Blei belastet sein. Der mittlere Bleigehalt der kontinentalen Erdkruste liegt bei 15 mg/kg. Böden enthalten von Natur aus zwischen 2 und 60 mg/kg Blei; wenn sie aus bleierzhaltigen Gesteinen entstanden sind, kann der Gehalt deutlich höher sein. Der Großteil der Bleibelastung von Böden ist anthropogen, die Quellen dafür sind vielfältig. Der Großteil des Eintrags erfolgt über Bleistäube aus der Luft, welche mit dem Regen oder durch trockene Deposition in die Böden gelangen. Für Deutschland und das Jahr 2000 wurde der atmosphärische Eintrag in Böden auf 571 t Blei/Jahr geschätzt. Eine weitere Quelle ist belasteter Dünger, sowohl Mineraldünger (136 t Pb/a), insbesondere Ammonsalpeter, als auch Wirtschaftsdünger (182 t Pb/a). Klärschlämme (90 t Pb/a) und Kompost (77 t Pb/a) tragen ebenfalls zur Bleibelastung der Böden bei. Ein erheblicher Eintrag erfolgt auch durch Bleischrot-Munition. Bei Altlasten, wie z. B. an ehemaligen Standorten von bleiproduzierenden Industriebetrieben oder in der Umgebung von alten bleiummantelten Kabeln, kann der Boden ebenfalls eine hohe Bleibelastung aufweisen. Eine besonders große Bleiverseuchung hat beispielsweise im Ort Santo Amaro da Purificação (Brasilien) zu hohen Belastungen bei Kindern geführt. ⓘ
Wasser
Die Bleibelastung der Gewässer resultiert hauptsächlich aus dem Ausschwemmen von Blei aus belasteten Böden. Dazu tragen auch geringe Mengen bei, die der Regen aus Bleiwerkstoffen wie Dachplatten löst. Die direkte Verschmutzung von Gewässern durch die Bleiindustrie und den Bleibergbau spielt (zumindest in Deutschland) auf Grund des Baus von Kläranlagen fast keine Rolle mehr. Der Jahreseintrag von Blei in Gewässer ist in Deutschland von ca. 900 t im Jahr 1985 auf ungefähr 300 t im Jahr 2000 zurückgegangen. ⓘ
In Deutschland beträgt der Grenzwert im Trinkwasser seit dem 1. Dezember 2013 10 µg/l (früher 25 µg/l); die Grundlage der Messung ist eine für die durchschnittliche wöchentliche Wasseraufnahme durch Verbraucher repräsentative Probe (siehe Trinkwasserverordnung). ⓘ
Analytik
Klassische qualitative Bestimmung von Blei
Nachweis durch Kristallisation
Bleiionen können in einer mikroskopischen Nachweisreaktion als Blei(II)-iodid dargestellt werden. Dabei wird die Probe in verdünnter Salzsäure gelöst und vorsichtig bis zur Kristallisation eingedampft. Der Rückstand wird mit einem Tropfen Wasser aufgenommen und anschließend mit einem Kristall eines wasserlöslichen Iodids, z. B. Kaliumiodid (KI), versetzt. Es entstehen nach kurzer Zeit mikroskopisch kleine, gelbe, hexagonale Blättchen des Blei(II)-iodids. ⓘ
Qualitativer Nachweis im Trennungsgang
Da Blei nach Zugabe von HCl nicht quantitativ als PbCl2 ausfällt, kann es sowohl in der HCl-Gruppe als auch in der H2S-Gruppe nachgewiesen werden. Das PbCl2 kann sowohl durch Zugabe von Kaliumiodid gemäß obiger Reaktion als gelbes PbI2 gefällt werden, als auch mit K2Cr2O7 als gelbes Bleichromat, PbCrO4. ⓘ
Nach Einleiten von H2S in die salzsaure Probe fällt zweiwertiges Blei in Form von schwarzem PbS aus. Dieses wird nach Digerieren mit (NH4)SX und Zugabe von 4 M HNO3 als PbI2 oder PbCrO4 nachgewiesen. ⓘ
Instrumentelle quantitative Analytik des Bleis
Für die Spurenanalytik von Blei und seinen Organoderivaten steht eine Reihe von Methoden zur Verfügung. Allerdings werden in der Literatur laufend neue bzw. verbesserte Verfahren vorgestellt, auch im Hinblick auf die oft erforderliche Vorkonzentrierung. Ein nicht zu unterschätzendes Problem besteht in der Probenaufarbeitung. ⓘ
Atomabsorptionsspektrometrie (AAS)
Unter den verschiedenen Techniken der AAS liefert die Quarzrohr- und die Graphitrohrtechnik die besten Ergebnisse für die Spurenanalytik von Bleiverbindungen. Häufig wird Blei mit Hilfe von NaBH4 in das leicht flüchtige Bleihydrid, PbH2, überführt. Dieses wird in eine Quarzküvette geleitet und anschließend elektrisch auf über 900 °C erhitzt. Dabei wird die Probe atomisiert und es wird unter Verwendung einer Hohlkathodenlampe die Absorbanz bei 283,3 nm gemessen. Es wurde eine Nachweisgrenze von 4,5 ng/ml erzielt. Gerne wird in der AAS auch eine Luft-Acetylenfackel (F-AAS) oder mikrowelleninduziertes Plasma (MIP-AAS) zur Atomisierung eingesetzt. ⓘ
Atomemissionsspektrometrie (AES)
In der AES haben sich das mikrowelleninduzierte Plasma (MIP-AES) und das induktiv gekoppelte Argon-Plasma (ICP-AES) zur Atomisierung bewährt. Die Detektion findet bei den charakteristischen Wellenlängen 283,32 nm und 405,78 nm statt. Mit Hilfe der MIP-AES wurde für Trimethylblei, (CH3)3Pb+, eine Nachweisgrenze von 0,19 pg/g ermittelt. Die ICP-AES ermöglicht eine Nachweisgrenze für Blei in Trinkwasser von 15,3 ng/ml. ⓘ
Photometrie
Die am weitesten verbreitete Methode zur photometrischen Erfassung von Blei ist die sog. Dithizon-Methode. Dithizon ist ein zweizähniger, aromatischer Ligand und bildet bei pH 9–11,5 mit Pb2+-Ionen einen roten Komplex dessen Absorbanz bei 520 nm (ε = 6,9·104 l/mol·cm) gemessen wird. Bismut und Thallium stören die Bestimmung und sollten vorher quantitativ gefällt oder extrahiert werden. ⓘ
Voltammetrie
Für die elektrochemische Bestimmung von Spuren von Blei eignet sich hervorragend die subtraktive anodische Stripping-Voltammetrie (SASV). Dabei geht der eigentlichen voltammetrischen Bestimmung eine reduktive Anreicherungsperiode auf einer rotierenden Ag-Disk-Elektrode voraus. Es folgt die eigentliche Bestimmung durch Messung des Oxidationsstroms beim Scannen eines Potentialfensters von −800 mV bis −300 mV. Anschließend wird die Messung ohne vorangehende Anreicherung wiederholt und die so erhaltene Kurve von der ersten Messung subtrahiert. Die Höhe des verbleibenden Oxidationspeaks bei −480 mV korreliert mit der Menge an vorhandenem Blei. Es wurde eine Nachweisgrenze von 50 pM Blei in Wasser ermittelt. ⓘ
Bleiverbindungen
Oxide
- Blei(II)-oxid PbO tritt in zwei Modifikationen, als rote Bleiglätte und als gelbes Massicolit, auf. Beide Modifikationen wurden früher als Pigmente verwendet. Es dient als Ausgangsstoff für andere Bleiverbindungen.
- Blei(II,IV)-oxid Pb3O4, auch Mennige genannt, ist ein leuchtend rotes Pulver, das früher verbreitet als Pigment und Rostschutzfarbe verwendet wurde. Es ist in Deutschland, seit 2005 auch in der Schweiz, als Rostschutz verboten. Pb3O4 wird in der Glasherstellung für die Bereitung von Bleikristall verwendet.
- Blei(IV)-oxid PbO2 ist ein schwarz-braunes Pulver, das als Elektrodenmaterial in Bleiakkumulatoren und als Oxidationsmittel in der chemischen Industrie (z. B. Farbstoffherstellung) verwendet wird. ⓘ















