Sepsis
| Sepsis ⓘ | |
|---|---|
| Andere Bezeichnungen | Sepsis, Septikämie, Blutinfektion, Blutvergiftung |
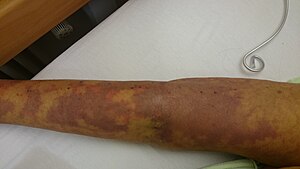 | |
| Fleckenbildung und Entzündung der Haut durch Sepsis | |
| Aussprache |
|
| Fachgebiet | Infektionskrankheit |
| Symptome |
|
| Komplikationen |
|
| Übliches Auftreten | Kann schnell (weniger als drei Stunden) oder langwierig (mehrere Tage) sein |
| Ursachen | Durch eine Infektion ausgelöste Immunreaktion |
| Risikofaktoren |
|
| Diagnostische Methode | Systemisches Entzündungsreaktionssyndrom (SIRS), qSOFA |
| Vorbeugung | Grippeimpfung, Impfstoffe, Impfung gegen Lungenentzündung |
| Behandlung | Intravenöse Flüssigkeiten, antimikrobielle Mittel, Vasopressoren |
| Prognose | 10 bis 80 % Todesrisiko; es ist wichtig zu beachten, dass diese Sterblichkeitsraten (sie gelten für eine Reihe von Erkrankungen entlang eines Spektrums: Sepsis, schwere Sepsis und septischer Schock) bei aggressiver und frühzeitiger Behandlung niedriger sein können, je nach Organismus und Krankheit, dem vorherigen Gesundheitszustand des Patienten und den Fähigkeiten des Behandlungsortes und seines Personals |
| Häufigkeit | 0,2-3 pro 1000 pro Jahr (entwickelte Welt) |
Die Sepsis, früher auch als Septikämie (engl. septicaemia) oder Blutvergiftung bezeichnet, ist ein lebensbedrohlicher Zustand, der entsteht, wenn die Reaktion des Körpers auf eine Infektion eine Schädigung der eigenen Gewebe und Organe verursacht. Auf diese erste Phase folgt eine Unterdrückung des Immunsystems. Zu den üblichen Anzeichen und Symptomen gehören Fieber, erhöhte Herzfrequenz, erhöhte Atemfrequenz und Verwirrung. Es können auch Symptome auftreten, die mit einer bestimmten Infektion zusammenhängen, wie Husten bei einer Lungenentzündung oder schmerzhaftes Wasserlassen bei einer Niereninfektion. Sehr junge und alte Menschen sowie Menschen mit einem geschwächten Immunsystem haben möglicherweise keine Symptome einer bestimmten Infektion, und die Körpertemperatur kann niedrig oder normal sein, anstatt Fieber zu haben. Eine schwere Sepsis verursacht eine schlechte Organfunktion oder Durchblutung. Niedriger Blutdruck, hohes Blutlaktat oder geringe Urinausscheidung können auf eine schlechte Durchblutung hindeuten. Ein septischer Schock ist ein sepsisbedingter niedriger Blutdruck, der sich nach einer Flüssigkeitszufuhr nicht bessert. ⓘ
Eine Sepsis wird durch viele Organismen verursacht, darunter Bakterien, Viren und Pilze. Häufige Orte für die Primärinfektion sind die Lunge, das Gehirn, die Harnwege, die Haut und die Unterleibsorgane. Zu den Risikofaktoren gehören sehr junges oder altes Alter, ein geschwächtes Immunsystem aufgrund von Krankheiten wie Krebs oder Diabetes, schwere Traumata und Verbrennungen. Früher mussten für eine Sepsis-Diagnose mindestens zwei Kriterien des systemischen Entzündungssyndroms (SIRS) im Zusammenhang mit einer vermuteten Infektion erfüllt sein. Im Jahr 2016 wurde das SIRS-Diagnosesystem durch einen verkürzten Score zur Bewertung des sequenziellen Organversagens (SOFA-Score) ersetzt, der als Quick-SOFA-Score (qSOFA) bekannt ist. qSOFA-Kriterien für Sepsis umfassen mindestens zwei der folgenden drei Kriterien: erhöhte Atemfrequenz, veränderter Bewusstseinszustand und niedriger Blutdruck. In den Sepsis-Leitlinien wird empfohlen, vor der Verabreichung von Antibiotika Blutkulturen anzulegen; für die Diagnose ist es jedoch nicht erforderlich, dass das Blut infiziert ist. Die medizinische Bildgebung ist hilfreich, wenn es darum geht, den möglichen Ort der Infektion zu bestimmen. Andere mögliche Ursachen für ähnliche Anzeichen und Symptome sind Anaphylaxie, Nebenniereninsuffizienz, niedriges Blutvolumen, Herzversagen und Lungenembolie. ⓘ
Eine Sepsis erfordert eine sofortige Behandlung mit intravenöser Flüssigkeit und antimikrobiellen Mitteln. Die weitere Betreuung erfolgt häufig auf einer Intensivstation. Wenn ein angemessener Flüssigkeitsersatz nicht ausreicht, um den Blutdruck aufrechtzuerhalten, ist der Einsatz von blutdrucksteigernden Medikamenten erforderlich. Mechanische Beatmung und Dialyse können erforderlich sein, um die Funktion der Lunge bzw. der Nieren zu unterstützen. Ein zentraler Venenkatheter und ein arterieller Katheter können für den Zugang zum Blutkreislauf und zur Steuerung der Behandlung gelegt werden. Weitere hilfreiche Messungen sind das Herzzeitvolumen und die Sauerstoffsättigung der Vena cava superior. Menschen mit Sepsis benötigen vorbeugende Maßnahmen gegen tiefe Venenthrombosen, Stressgeschwüre und Druckgeschwüre, es sei denn, andere Erkrankungen verhindern solche Eingriffe. Einige Menschen könnten von einer strengen Kontrolle des Blutzuckerspiegels mit Insulin profitieren. Der Einsatz von Kortikosteroiden ist umstritten, wobei einige Studien einen Nutzen feststellen, andere wiederum nicht. ⓘ
Der Schweregrad der Erkrankung bestimmt zum Teil das Ergebnis. Das Risiko, an einer Sepsis zu sterben, liegt bei bis zu 30 %, bei einer schweren Sepsis sogar bei 50 % und bei einem septischen Schock bei 80 %. Im Jahr 2017 waren etwa 49 Millionen Menschen von Sepsis betroffen, mit 11 Millionen Todesfällen (1 von 5 Todesfällen weltweit). In den Industrieländern sind jährlich etwa 0,2 bis 3 von 1000 Menschen von einer Sepsis betroffen, in den Vereinigten Staaten sind es etwa eine Million Fälle pro Jahr. Die Erkrankungsraten haben zugenommen. Einige Daten deuten darauf hin, dass die Sepsis bei Männern häufiger auftritt als bei Frauen, andere Daten zeigen jedoch, dass die Krankheit bei Frauen häufiger auftritt. Beschreibungen der Sepsis reichen bis in die Zeit von Hippokrates zurück. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| A40.- | Streptokokken-Sepsis |
| A41.- | Sonstige Sepsis |
| R65.1 | Systemisches inflammatorisches Response-Syndrom [SIRS] infektiöser Genese mit Organdysfunktion |
| R57.2 | Septischer Schock |
| B37.7 | Candida-Sepsis |
| P36 | Bakterielle Sepsis beim Neugeborenen |
| A02.1 | Salmonellensepsis |
| A20.7 | Pestsepsis |
| A22.7 | Milzbrandsepsis |
| A26.7 | Erysipelothrix-Sepsis |
| A32.7 | Listeriensepsis |
| A39.2 | Akute Meningokokkensepsis |
| A39.3 | Chronische Meningokokkensepsis |
| A39.4 | Meningokokkensepsis, nicht näher bezeichnet |
| A42.7 | Aktinomykotische Sepsis |
| ICD-10 online (WHO-Version 2019) | |
Die Intensivmedizin kann durch vorübergehenden Ersatz oder Unterstützung der Organfunktionen (Beatmung, Nierenersatztherapie, Kreislauftherapie, Gerinnungstherapie) kritische Phasen überbrücken. Trotzdem versterben ca. 25 % der Patienten mit Sepsis und 45 % der Patienten mit schwerer Sepsis unter maximaler Therapie. Der frühestmögliche Therapiebeginn ist entscheidend für das Überleben. ⓘ
Sepsis ist eine der häufigsten und kostenintensivsten Erkrankungen im stationären Sektor. Die Weltgesundheitsorganisation (WHO) erklärte die Erkrankung daher 2017 zu einer der führenden Prioritäten in den Gesundheitssystemen der Mitgliedsstaaten, um Prävention, Diagnostik, Therapie, Erfassung und Nachsorge von Sepsispatienten zu verbessern. ⓘ
Anzeichen und Symptome
Zusätzlich zu den Symptomen, die mit der eigentlichen Ursache zusammenhängen, können Menschen mit Sepsis Fieber, niedrige Körpertemperatur, schnelle Atmung, einen schnellen Herzschlag, Verwirrung und Ödeme haben. Zu den frühen Anzeichen gehören eine schnelle Herzfrequenz, vermindertes Wasserlassen und hoher Blutzucker. Zu den Anzeichen einer etablierten Sepsis gehören Verwirrtheit, metabolische Azidose (die mit einer schnelleren Atemfrequenz einhergehen kann, die zu einer respiratorischen Alkalose führt), niedriger Blutdruck aufgrund eines verringerten systemischen Gefäßwiderstands, ein höheres Herzzeitvolumen und Störungen der Blutgerinnung, die zu Organversagen führen können. Fieber ist das häufigste Symptom bei einer Sepsis, aber bei manchen Menschen, wie z. B. älteren Menschen oder Menschen mit geschwächtem Immunsystem, kann Fieber fehlen. ⓘ
Der bei der Sepsis auftretende Blutdruckabfall kann zu Benommenheit führen und ist Teil der Kriterien für einen septischen Schock. ⓘ
Bei einem septischen Schock wird oxidativer Stress beobachtet, wobei die zirkulierenden Kupfer- und Vitamin-C-Spiegel verringert sind. ⓘ
Ursache
Infektionen, die zu einer Sepsis führen, sind in der Regel bakteriell, können aber auch durch Pilze, Parasiten oder Viren verursacht werden. Vor der Einführung von Antibiotika in den 1950er Jahren waren gram-positive Bakterien die Hauptursache für Sepsis. Nach der Einführung von Antibiotika waren von den 1960er bis zu den 1980er Jahren gramnegative Bakterien die vorherrschende Ursache für Sepsis. Seit den 1980er Jahren werden mehr als 50 % der Sepsisfälle durch grampositive Bakterien, vor allem Staphylokokken, verursacht. Weitere häufig vorkommende Bakterien sind Streptococcus pyogenes, Escherichia coli, Pseudomonas aeruginosa und Klebsiella-Arten. Eine Pilzsepsis macht etwa 5 % der Fälle von schwerer Sepsis und septischem Schock aus; die häufigste Ursache für eine Pilzsepsis ist eine Infektion mit Hefepilzen der Gattung Candida, eine häufige Infektion, die im Krankenhaus erworben wird. Die häufigsten Ursachen für eine parasitäre Sepsis sind Plasmodium (das zu Malaria führt), Schistosoma und Echinococcus. ⓘ
Die häufigsten Infektionsorte, die zu einer schweren Sepsis führen, sind die Lunge, der Bauchraum und die Harnwege. In der Regel beginnen 50 % aller Sepsisfälle mit einer Infektion in der Lunge. In einem Drittel bis der Hälfte der Fälle ist die Infektionsquelle unklar. ⓘ
Pathophysiologie
Die Sepsis wird durch eine Kombination von Faktoren verursacht, die mit dem/den jeweiligen eindringenden Erreger(n) und dem Zustand des Immunsystems des Wirts zusammenhängen. Auf die frühe Phase der Sepsis, die durch eine übermäßige Entzündung gekennzeichnet ist (die manchmal zu einem Zytokinsturm führt), kann ein längerer Zeitraum mit verminderter Funktion des Immunsystems folgen. Jede dieser Phasen kann tödlich enden. Das systemische Entzündungsreaktionssyndrom (SIRS) hingegen tritt bei Menschen auf, bei denen keine Infektion vorliegt, z. B. bei Verbrennungen, Polytrauma oder dem Anfangszustand bei Pankreatitis und chemischer Pneumonitis. Aber auch die Sepsis verursacht ähnliche Reaktionen wie das SIRS. ⓘ
Mikrobielle Faktoren
Bakterielle Virulenzfaktoren wie die Glykokalyx und verschiedene Adhäsine ermöglichen die Kolonisierung, die Umgehung des Immunsystems und die Etablierung der Krankheit im Wirt. Man geht davon aus, dass die durch gramnegative Bakterien verursachte Sepsis weitgehend auf eine Reaktion des Wirts auf die Lipid-A-Komponente des Lipopolysaccharids, auch Endotoxin genannt, zurückzuführen ist. Eine durch grampositive Bakterien verursachte Sepsis kann auf eine immunologische Reaktion auf die Lipoteichonsäure der Zellwand zurückzuführen sein. Bakterielle Exotoxine, die als Superantigene wirken, können ebenfalls eine Sepsis verursachen. Superantigene binden gleichzeitig an Haupthistokompatibilitätskomplex- und T-Zell-Rezeptoren, ohne dass eine Antigenpräsentation stattfindet. Diese erzwungene Rezeptorinteraktion induziert die Produktion von entzündungsfördernden chemischen Signalen (Zytokinen) durch T-Zellen. ⓘ
Es gibt eine Reihe von mikrobiellen Faktoren, die die typische septische Entzündungskaskade auslösen können. Ein eingedrungener Krankheitserreger wird durch seine pathogen-assoziierten molekularen Muster (PAMPs) erkannt. Beispiele für PAMPs sind Lipopolysaccharide und Flagellin in gram-negativen Bakterien, Muramyl-Dipeptid im Peptidoglykan der gram-positiven Bakterienzellwand und bakterielle CpG-DNA. Diese PAMPs werden von den Mustererkennungsrezeptoren (PRRs) des angeborenen Immunsystems erkannt, die membrangebunden oder zytosolisch sein können. Es gibt vier Familien von PRRs: die Toll-like-Rezeptoren, die C-Typ-Lektin-Rezeptoren, die NOD-like-Rezeptoren und die RIG-I-like-Rezeptoren. Die Assoziation zwischen einem PAMP und einem PRR führt unweigerlich zu einer Reihe von intrazellulären Signalkaskaden. Infolgedessen werden Transkriptionsfaktoren wie Nuclear Factor Kappa B und Activator Protein-1 die Expression von entzündungsfördernden und entzündungshemmenden Zytokinen hochregulieren. ⓘ
Wirtsfaktoren
Beim Nachweis mikrobieller Antigene wird das systemische Immunsystem des Wirts aktiviert. Immunzellen erkennen nicht nur pathogen-assoziierte molekulare Muster, sondern auch schadensassoziierte molekulare Muster aus geschädigtem Gewebe. Daraufhin wird eine unkontrollierte Immunreaktion ausgelöst, da die Leukozyten nicht an den spezifischen Infektionsort, sondern überall im Körper rekrutiert werden. Dann kommt es zu einer Immunsuppression, wenn die proinflammatorischen T-Helferzellen 1 (TH1) durch Interleukin 10 in TH2 umgewandelt werden, was als "kompensatorisches Entzündungshemmungssyndrom" bezeichnet wird. Die Apoptose (Zelltod) von Lymphozyten verschlimmert die Immunsuppression weiter. Neutrophile, Monozyten, Makrophagen, dendritische Zellen, CD4+ T-Zellen und B-Zellen unterliegen alle der Apoptose, während regulatorische T-Zellen eher apoptoseresistent sind. In der Folge kommt es zu einem multiplen Organversagen, da die Gewebe aufgrund der Hemmung der Cytochrom-c-Oxidase den Sauerstoff nicht effizient nutzen können. ⓘ
Entzündungsreaktionen verursachen das Syndrom der multiplen Organdysfunktion durch verschiedene Mechanismen, die im Folgenden beschrieben werden. Eine erhöhte Durchlässigkeit der Lungengefäße führt zum Austritt von Flüssigkeit in die Alveolen, was zu einem Lungenödem und einem akuten Atemnotsyndrom (ARDS) führt. Eine gestörte Sauerstoffverwertung in der Leber beeinträchtigt den Gallensalztransport und verursacht Gelbsucht (gelbliche Verfärbung der Haut). In den Nieren führt eine unzureichende Sauerstoffversorgung zu einer Schädigung der Tubulusepithelzellen (der Zellen, die die Nierentubuli auskleiden) und damit zu einer akuten Nierenschädigung (AKI). Im Herzen können ein gestörter Kalziumtransport und eine geringe Produktion von Adenosintriphosphat (ATP) zu einer Depression des Herzmuskels führen, die die Kontraktionsfähigkeit des Herzens verringert und Herzversagen verursacht. Im Magen-Darm-Trakt wird durch die erhöhte Durchlässigkeit der Schleimhaut die Mikroflora verändert, was zu Schleimhautblutungen und paralytischem Ileus führt. Im zentralen Nervensystem führen direkte Schädigungen der Gehirnzellen und Störungen der Neurotransmissionen zu einem veränderten mentalen Status. Zytokine wie Tumornekrosefaktor, Interleukin 1 und Interleukin 6 können in den Zellen, die die Blutgefäße auskleiden, Prokoagulationsfaktoren aktivieren, was zu einer Schädigung der Endothelien führt. Die geschädigte Endotheloberfläche hemmt die gerinnungshemmenden Eigenschaften und erhöht die Antifibrinolyse, was zu intravaskulärer Gerinnung, zur Bildung von Blutgerinnseln in kleinen Blutgefäßen und zum Versagen mehrerer Organe führen kann. ⓘ
Der niedrige Blutdruck, der bei Menschen mit Sepsis auftritt, ist das Ergebnis verschiedener Prozesse, einschließlich einer übermäßigen Produktion von Chemikalien, die die Blutgefäße erweitern, wie Stickstoffmonoxid, eines Mangels an Chemikalien, die die Blutgefäße verengen, wie Vasopressin, und der Aktivierung von ATP-empfindlichen Kaliumkanälen. Bei schwerer Sepsis und septischem Schock führt diese Abfolge von Ereignissen zu einer Art von Kreislaufschock, der als distributiver Schock bezeichnet wird. ⓘ
Diagnose
Eine frühzeitige Diagnose ist notwendig, um die Sepsis richtig zu behandeln, da die rasche Einleitung einer Therapie der Schlüssel zur Verringerung der Todesfälle durch schwere Sepsis ist. Einige Krankenhäuser verwenden von elektronischen Krankenakten generierte Warnmeldungen, um so früh wie möglich auf potenzielle Fälle aufmerksam zu machen. ⓘ

Innerhalb der ersten drei Stunden nach dem Verdacht auf eine Sepsis sollten diagnostische Untersuchungen durchgeführt werden, darunter die Bestimmung der weißen Blutkörperchen, die Messung des Serumlaktats und die Entnahme geeigneter Kulturen, bevor mit der Verabreichung von Antibiotika begonnen wird, sofern dies den Einsatz von Antibiotika nicht um mehr als 45 Minuten verzögert. Zur Identifizierung des/der verursachenden Organismus(s) sind mindestens zwei Sätze von Blutkulturen unter Verwendung von Flaschen mit Medien für aerobe und anaerobe Organismen erforderlich. Mindestens eine sollte durch die Haut und eine durch jeden Gefäßzugang (z. B. einen IV-Katheter), der länger als 48 Stunden liegt, gezogen werden. Bakterien sind nur in etwa 30 % der Fälle im Blut vorhanden. Eine weitere mögliche Nachweismethode ist die Polymerase-Kettenreaktion. Besteht der Verdacht auf andere Infektionsquellen, sollten auch von diesen Quellen, wie Urin, Liquor, Wunden oder Atemwegssekreten, Kulturen angelegt werden, sofern dies den Einsatz von Antibiotika nicht verzögert. ⓘ
Bleibt der Blutdruck innerhalb von sechs Stunden trotz einer anfänglichen Flüssigkeitszufuhr von 30 ml/kg niedrig oder ist das anfängliche Laktat ≥ vier mmol/l (36 mg/dl), sollten der zentralvenöse Druck und die zentralvenöse Sauerstoffsättigung gemessen werden. Das Laktat sollte erneut gemessen werden, wenn das Ausgangslaktat erhöht war. Die Evidenz für die Laktatmessung am Behandlungsort gegenüber den üblichen Messmethoden ist jedoch gering. ⓘ
Innerhalb von zwölf Stunden muss unbedingt jede Infektionsquelle diagnostiziert oder ausgeschlossen werden, die eine sofortige Kontrolle der Infektionsquelle erfordert, wie z. B. eine nekrotisierende Weichteilinfektion, eine Infektion, die eine Entzündung der Bauchhöhlenauskleidung verursacht, eine Infektion des Gallengangs oder ein Darminfarkt. Ein durchstochenes inneres Organ (freie Luft auf einem Bauchröntgenbild oder CT-Scan), ein abnormales Röntgenbild des Brustkorbs, das auf eine Lungenentzündung (mit fokaler Trübung) hindeutet, oder Petechien, Purpura oder Purpura fulminans können auf eine Infektion hindeuten. ⓘ
Definitionen
| Befund | Wert |
|---|---|
| Temperatur | <36 °C (96,8 °F) oder >38 °C (100,4 °F) |
| Herzfrequenz | >90/min |
| Atmungsfrequenz | >20/min oder PaCO2<32 mmHg (4,3 kPa) |
| LEUKOZYTEN | <4x109/L (<4000/mm3), >12x109/L (>12.000/mm3), oder ≥10% Bänder |

Bisher wurden die SIRS-Kriterien zur Definition der Sepsis verwendet. Wenn die SIRS-Kriterien negativ sind, ist es sehr unwahrscheinlich, dass die Person eine Sepsis hat; wenn sie positiv sind, besteht nur eine mäßige Wahrscheinlichkeit, dass die Person eine Sepsis hat. Nach SIRS gibt es verschiedene Stufen der Sepsis: Sepsis, schwere Sepsis und septischer Schock. Die Definition von SIRS ist unten aufgeführt:
- SIRS ist das Vorhandensein von zwei oder mehr der folgenden Punkte: abnorme Körpertemperatur, Herzfrequenz, Atemfrequenz oder Blutgaswerte und Anzahl der weißen Blutkörperchen.
- Sepsis ist definiert als SIRS als Reaktion auf einen infektiösen Prozess.
- Schwere Sepsis ist definiert als Sepsis mit sepsisbedingter Organdysfunktion oder Gewebehypoperfusion (die sich in Hypotonie, erhöhtem Laktat oder verminderter Urinausscheidung äußert). Schwere Sepsis ist ein infektiöser Krankheitszustand, der mit einem Syndrom der multiplen Organdysfunktion (MODS) einhergeht.
- Septischer Schock ist eine schwere Sepsis mit anhaltend niedrigem Blutdruck trotz intravenöser Flüssigkeitszufuhr. ⓘ
Im Jahr 2016 wurde ein neuer Konsens erzielt, das Screening anhand des systemischen Entzündungsreaktionssyndroms (SIRS) durch die sequentielle Bewertung des Organversagens (SOFA-Score) und die abgekürzte Version (qSOFA) zu ersetzen. Zu den drei Kriterien für den qSOFA-Score gehören eine Atemfrequenz von 22 Atemzügen pro Minute oder mehr, ein systolischer Blutdruck von 100 mmHg oder weniger und ein veränderter mentaler Status. Ein Verdacht auf Sepsis besteht, wenn 2 der qSOFA-Kriterien erfüllt sind. Der SOFA-Score sollte auf der Intensivstation (ICU) verwendet werden, wo er bei der Aufnahme in die ICU durchgeführt und dann alle 48 Stunden wiederholt wird, während der qSOFA-Score auch außerhalb der ICU verwendet werden kann. Einige Vorteile des qSOFA-Scores sind, dass er schnell durchgeführt werden kann und keine Laborwerte erfordert. Das American College of Chest Physicians (CHEST) hat jedoch Bedenken geäußert, dass die qSOFA- und SOFA-Kriterien zu einer verzögerten Diagnose einer schweren Infektion und damit zu einer verzögerten Behandlung führen könnten. Obwohl die SIRS-Kriterien zu empfindlich und nicht spezifisch genug sein können, um eine Sepsis zu erkennen, hat auch SOFA seine Grenzen und ist nicht als Ersatz für die SIRS-Definition gedacht. qSOFA hat sich ebenfalls als wenig empfindlich erwiesen, obwohl es für das Sterberisiko recht spezifisch ist, während SIRS für das Screening möglicherweise besser geeignet ist. HINWEIS - Die Leitlinien der Surviving Sepsis Campaign 2021 empfehlen, qSOFA im Vergleich zu SIRS, NEWS oder MEWS nicht als einziges Screening-Instrument für Sepsis oder septischen Schock zu verwenden". ⓘ
Nach der 2016 aktualisierten Definition gilt:
“Sepsis is defined as life-threatening organ dysfunction caused by a dysregulated host response to infection.”
„Sepsis ist definiert als lebensbedrohliche Organdysfunktion verursacht durch eine fehlregulierte Wirtsantwort auf eine Infektion.“
Bis 1992 galt in Deutschland die Sepsisdefinition nach Hugo Schottmüller aus dem Jahr 1914, für die der Nachweis eines Infektionserregers in der Blutkultur Voraussetzung für die Diagnose Sepsis war:
„Eine Sepsis liegt dann vor, wenn sich innerhalb des Körpers ein Herd gebildet hat, von dem kontinuierlich oder periodisch pathogene Bakterien in den Kreislauf gelangen und zwar derart, dass durch diese Invasion subjektive und objektive Krankheitserscheinungen ausgelöst werden.“
Dysfunktion der Endorgane
Beispiele für Funktionsstörungen der Endorgane sind folgende:
- Lunge: akutes Atemnotsyndrom (ARDS) (PaO2/FiO2-Verhältnis < 300), abweichendes Verhältnis beim pädiatrischen akuten Atemnotsyndrom
- Gehirn: Enzephalopathie-Symptome einschließlich Unruhe, Verwirrung, Koma; Ursachen können Ischämie, Blutungen, Bildung von Blutgerinnseln in kleinen Blutgefäßen, Mikroabszesse, multifokale nekrotisierende Leukoenzephalopathie sein
- Leber: Die Störung der Proteinsynthesefunktion äußert sich akut in einer fortschreitenden Störung der Blutgerinnung aufgrund der Unfähigkeit, Gerinnungsfaktoren zu synthetisieren, und die Störung der Stoffwechselfunktionen führt zu einer Beeinträchtigung des Bilirubinstoffwechsels, was zu erhöhten unkonjugierten Serumbilirubinwerten führt
- Niere: geringe oder keine Urinausscheidung, Elektrolytanomalien oder Volumenüberladung
- Herz: systolische und diastolische Herzinsuffizienz, wahrscheinlich aufgrund von chemischen Signalen, die die Myozytenfunktion beeinträchtigen, Zellschäden, die sich als Troponin-Leck manifestieren (obwohl sie nicht unbedingt ischämischer Natur sind) ⓘ
Für SIRS in der Pädiatrie gibt es spezifischere Definitionen von Endorgan-Dysfunktion.
- Kardiovaskuläre Dysfunktion (nach Flüssigkeitsreanimation mit mindestens 40 ml/kg Kristalloid)
- Hypotonie mit Blutdruck < 5. Perzentil für das Alter oder systolischer Blutdruck < 2 Standardabweichungen unter dem Normalwert für das Alter, oder
- Bedarf an Vasopressoren, oder
- zwei der folgenden Kriterien:
- ungeklärte metabolische Azidose mit Basendefizit > 5 mEq/l
- Laktatazidose: Serumlaktat um das Zweifache über dem oberen Grenzwert der Norm
- Oligurie (Urinausscheidung < 0,5 ml/kg/h)
- verlängerte Kapillarwiederauffüllung > 5 Sekunden
- Differenz zwischen Kern- und peripherer Temperatur > 3 °C
- Atmungsstörungen (bei Fehlen eines zyanotischen Herzfehlers oder einer bekannten chronischen Atemwegserkrankung)
- Verhältnis des arteriellen Sauerstoffpartialdrucks zum Sauerstoffanteil der eingeatmeten Gase (PaO2/FiO2) < 300 (Definition der akuten Lungenschädigung) oder
- arterieller Partialdruck des Kohlendioxids (PaCO2) > 65 Torr (20 mmHg) über dem Ausgangs-PaCO2 (Anzeichen für hyperkapnisches Lungenversagen), oder
- Zusätzlicher Sauerstoffbedarf von mehr als FiO2 0,5 zur Aufrechterhaltung einer Sauerstoffsättigung von ≥ 92%
- Neurologische Funktionsstörung
- Glasgow Coma Score (GCS) ≤ 11, oder
- veränderter mentaler Status mit einem Abfall des GCS um 3 oder mehr Punkte bei einer Person mit Entwicklungsverzögerung/intellektueller Behinderung
- Hämatologische Funktionsstörung
- Thrombozytenzahl < 80.000/mm3 oder Rückgang um 50 % gegenüber dem Maximalwert bei chronischer Thrombozytopenie, oder
- international normalisierter Quotient (INR) > 2
- Disseminierte intravaskuläre Gerinnung
- Nierenfunktionsstörung
- Serumkreatinin ≥ 2 mal die obere Grenze des Normalwerts für das Alter oder 2-facher Anstieg des Ausgangskreatinins bei Menschen mit chronischer Nierenerkrankung
- Leberfunktionsstörung (gilt nur für Säuglinge > 1 Monat)
Die Konsensdefinitionen entwickeln sich jedoch ständig weiter, wobei die neueste die Liste der Anzeichen und Symptome der Sepsis erweitert, um die klinische Erfahrung am Krankenbett zu berücksichtigen. ⓘ
Biomarker
Biomarker können die Diagnose unterstützen, da sie auf das Vorhandensein oder den Schweregrad einer Sepsis hinweisen können, obwohl ihre genaue Rolle bei der Behandlung der Sepsis noch nicht definiert ist. Eine Übersichtsarbeit aus dem Jahr 2013 kam zu dem Schluss, dass es mäßige Belege für die Verwendung des Procalcitoninspiegels als Methode zur Unterscheidung zwischen Sepsis und nicht-infektiösen Ursachen des SIRS gibt. In derselben Übersichtsarbeit wurde festgestellt, dass die Sensitivität des Tests bei 77 % und die Spezifität bei 79 % liegt. Die Autoren schlugen vor, dass Procalcitonin als hilfreicher diagnostischer Marker für Sepsis dienen kann, warnten jedoch davor, dass sein Spiegel allein die Diagnose nicht definitiv stellt. In einer systematischen Übersichtsarbeit aus dem Jahr 2012 wurde festgestellt, dass der lösliche Plasminogenaktivator-Rezeptor vom Urokinase-Typ (SuPAR) ein unspezifischer Entzündungsmarker ist und die Sepsis nicht genau diagnostiziert. Dieselbe Übersichtsarbeit kam jedoch zu dem Schluss, dass SuPAR einen prognostischen Wert hat, da höhere SuPAR-Werte mit einer erhöhten Sterblichkeitsrate bei Patienten mit Sepsis verbunden sind. Die serielle Messung des Laktatspiegels (etwa alle 4 bis 6 Stunden) kann als Richtschnur für die Behandlung dienen und ist mit einer geringeren Sterblichkeitsrate bei Sepsis verbunden. ⓘ
Differentialdiagnose
Die Differentialdiagnose der Sepsis ist breit gefächert und muss die nicht-infektiösen Erkrankungen untersuchen (um sie auszuschließen), die die systemischen Zeichen des SIRS verursachen können: Alkoholentzug, akute Pankreatitis, Verbrennungen, Lungenembolie, Thyreotoxikose, Anaphylaxie, Nebenniereninsuffizienz und neurogener Schock. Hyperinflammatorische Syndrome wie die hämophagozytische Lymphohistiozytose (HLH) können ähnliche Symptome aufweisen und gehören zur Differentialdiagnose. ⓘ
Neonatale Sepsis
Im allgemeinen klinischen Sprachgebrauch bezieht sich die neonatale Sepsis auf eine bakterielle Blutstrominfektion im ersten Lebensmonat, wie z. B. Meningitis, Pneumonie, Pyelonephritis oder Gastroenteritis, aber die neonatale Sepsis kann auch durch eine Infektion mit Pilzen, Viren oder Parasiten verursacht werden. Kriterien für eine Beeinträchtigung der Hämodynamik oder ein Versagen der Atmung sind nicht sinnvoll, da sie zu spät für eine Intervention auftreten. ⓘ
Behandlung
Eine frühzeitige Erkennung und gezielte Behandlung kann die Ergebnisse bei Sepsis verbessern. Die aktuellen Empfehlungen der Fachleute umfassen eine Reihe von Maßnahmen ("Bündel"), die so schnell wie möglich nach der Diagnose zu ergreifen sind. Innerhalb der ersten drei Stunden sollte eine Person mit Sepsis Antibiotika und intravenöse Flüssigkeit erhalten, wenn es Anzeichen für einen niedrigen Blutdruck oder andere Anzeichen für eine unzureichende Blutversorgung der Organe gibt (wie z. B. ein erhöhter Laktatspiegel); innerhalb dieses Zeitraums sollten auch Blutkulturen angelegt werden. Nach sechs Stunden sollte der Blutdruck angemessen sein, eine engmaschige Überwachung des Blutdrucks und der Blutzufuhr zu den Organen erfolgen und das Laktat erneut gemessen werden, wenn es anfänglich erhöht war. Ein ähnliches Paket, die "Sepsis Six", ist im Vereinigten Königreich weit verbreitet; es erfordert die Verabreichung von Antibiotika innerhalb einer Stunde nach Erkennung, Blutkulturen, Laktat- und Hämoglobinbestimmung, Überwachung der Urinausscheidung, Sauerstoff mit hohem Durchfluss und intravenöse Flüssigkeiten. ⓘ
Neben der rechtzeitigen Verabreichung von Flüssigkeit und Antibiotika umfasst die Behandlung der Sepsis auch die chirurgische Drainage infizierter Flüssigkeitsansammlungen und eine angemessene Unterstützung bei Organfunktionsstörungen. Dazu können die Hämodialyse bei Nierenversagen, die mechanische Beatmung bei Lungenfunktionsstörungen, die Transfusion von Blutprodukten sowie die medikamentöse und flüssigkeitsbezogene Therapie bei Kreislaufversagen gehören. Die Sicherstellung einer angemessenen Ernährung - vorzugsweise durch enterale Ernährung, aber erforderlichenfalls auch durch parenterale Ernährung - ist bei längerer Krankheit wichtig. Medikamente zur Vorbeugung von tiefen Venenthrombosen und Magengeschwüren können ebenfalls eingesetzt werden. ⓘ
Antibiotika
Es werden zwei Sätze von Blutkulturen (aerob und anaerob) empfohlen, ohne die Einleitung von Antibiotika zu verzögern. Bei Verdacht auf Infektionen an anderen Stellen wie Atemwegssekreten, Urin, Wunden, Liquor und Kathetereinführungsstellen (mehr als 48 Stunden in-situ) werden Kulturen empfohlen. Bei schwerer Sepsis und septischem Schock werden Breitspektrum-Antibiotika (in der Regel zwei, ein β-Laktam-Antibiotikum mit breiter Abdeckung oder ein Breitspektrum-Carbapenem in Kombination mit Fluorchinolonen, Makroliden oder Aminoglykosiden) empfohlen. Die Wahl der Antibiotika ist wichtig für das Überleben der Person. Einige empfehlen eine Verabreichung innerhalb einer Stunde nach Diagnosestellung, da jede Stunde Verzögerung bei der Verabreichung von Antibiotika mit einem Anstieg der Sterblichkeit um 6 % verbunden ist. Andere haben keinen Nutzen einer frühen Verabreichung festgestellt. ⓘ
Für die Wahl des am besten geeigneten Antibiotikaregimes sind mehrere Faktoren ausschlaggebend. Dazu gehören lokale Muster der bakteriellen Empfindlichkeit gegenüber Antibiotika, die Frage, ob es sich um eine im Krankenhaus oder in der Gemeinschaft erworbene Infektion handelt und welche Organsysteme vermutlich infiziert sind. Das Antibiotikaregime sollte täglich neu bewertet und gegebenenfalls angepasst werden. Die Behandlungsdauer beträgt in der Regel 7-10 Tage, wobei sich die Art des verwendeten Antibiotikums nach den Ergebnissen der Kulturen richtet. Ist das Ergebnis der Kultur negativ, sollten die Antibiotika entsprechend der klinischen Reaktion der Person deeskaliert oder ganz abgesetzt werden, wenn keine Infektion vorliegt, um das Risiko zu verringern, dass die Person mit Organismen infiziert ist, die gegen mehrere Medikamente resistent sind. Bei Personen, bei denen ein hohes Risiko besteht, mit mehrfach resistenten Organismen wie Pseudomonas aeruginosa oder Acinetobacter baumannii infiziert zu sein, wird die Zugabe eines für den gramnegativen Organismus spezifischen Antibiotikums empfohlen. Bei Methicillin-resistentem Staphylococcus aureus (MRSA) wird Vancomycin oder Teicoplanin empfohlen. Bei einer Legionelleninfektion wird der Zusatz eines Makrolids oder Fluorchinolons gewählt. Besteht der Verdacht auf eine Pilzinfektion, wird bei schwerer Sepsis ein Echinocandin wie Caspofungin oder Micafungin und bei weniger kranken Personen ein Triazol (Fluconazol und Itraconazol) eingesetzt. Eine längere Antibiotikaprophylaxe wird bei Personen mit SIRS ohne infektiösen Ursprung wie akuter Pankreatitis und Verbrennungen nicht empfohlen, es sei denn, es besteht der Verdacht auf Sepsis. ⓘ
Die einmal tägliche Verabreichung von Aminoglykosid reicht aus, um die maximale Plasmakonzentration für eine klinische Reaktion ohne Nierentoxizität zu erreichen. Bei Antibiotika mit geringer Volumenverteilung (Vancomycin, Teicoplanin, Colistin) ist hingegen eine Ladedosis erforderlich, um einen angemessenen therapeutischen Spiegel zur Bekämpfung von Infektionen zu erreichen. Häufige Infusionen von Beta-Lactam-Antibiotika ohne Überschreitung der Tagesgesamtdosis würden dazu beitragen, den Antibiotikaspiegel über der minimalen Hemmkonzentration (MHK) zu halten und damit eine bessere klinische Reaktion zu erzielen. Die kontinuierliche Verabreichung von Beta-Laktam-Antibiotika kann besser sein als eine intermittierende Verabreichung. Der Zugang zur therapeutischen Überwachung ist wichtig, um einen angemessenen therapeutischen Wirkstoffspiegel zu gewährleisten und gleichzeitig zu verhindern, dass das Medikament toxische Werte erreicht. ⓘ
Intravenöse Flüssigkeiten
Die Surviving Sepsis Campaign empfiehlt für Erwachsene eine Flüssigkeitsgabe von 30 ml/kg in den ersten drei Stunden, gefolgt von einer Titration der Flüssigkeit in Abhängigkeit von Blutdruck, Urinausscheidung, Atemfrequenz und Sauerstoffsättigung mit einem mittleren arteriellen Druck (MAP) von 65 mmHg als Zielwert. Bei Kindern ist eine Anfangsmenge von 20 ml/kg bei Schock angemessen. Bei schwerer Sepsis und septischem Schock, bei denen ein zentraler Venenkatheter zur dynamischen Messung des Blutdrucks verwendet wird, sollten Flüssigkeiten verabreicht werden, bis der zentrale Venendruck 8-12 mmHg erreicht. Sobald diese Ziele erreicht sind, wird die zentralvenöse Sauerstoffsättigung (ScvO2), d. h. die an der Hohlvene gemessene Sauerstoffsättigung des zum Herzen zurückfließenden venösen Blutes, optimiert. Liegt die ScvO2 unter 70 %, kann Blut gegeben werden, um einen Hämoglobinwert von 10 g/dL zu erreichen, und dann werden Inotropika zugeführt, bis die ScvO2 optimiert ist. Bei Patienten mit akutem Atemnotsyndrom (ARDS) und ausreichender Gewebeflüssigkeit sollte vorsichtig mehr Flüssigkeit gegeben werden. ⓘ
Als Flüssigkeit der Wahl für die Wiederbelebung wird kristalloide Lösung empfohlen. Albumin kann verwendet werden, wenn eine große Menge an kristalloider Lösung zur Wiederbelebung erforderlich ist. Kristalloide Lösungen unterscheiden sich in Bezug auf das Sterberisiko kaum von Hydroxyethylstärke. Stärke birgt auch ein erhöhtes Risiko einer akuten Nierenschädigung und der Notwendigkeit einer Bluttransfusion. Verschiedene kolloidale Lösungen (z. B. modifizierte Gelatine) bieten keinen Vorteil gegenüber kristalloiden Lösungen. Auch Albumin scheint keinen Vorteil gegenüber Kristalloiden zu bieten. ⓘ
Blutprodukte
Die Surviving Sepsis Campaign empfiehlt die Transfusion gepackter roter Blutkörperchen bei Hämoglobinwerten unter 70 g/L, wenn keine myokardiale Ischämie, Hypoxämie oder akute Blutung vorliegt. In einer Studie aus dem Jahr 2014 machten Bluttransfusionen, um den Zielhämoglobinwert über 70 oder 90 g/L zu halten, keinen Unterschied bei den Überlebensraten; die Patienten mit einer niedrigeren Transfusionsschwelle erhielten jedoch insgesamt weniger Transfusionen. Erythropoietin wird bei der Behandlung von Anämie im septischen Schock nicht empfohlen, da es die Blutgerinnung beschleunigen kann. Die Transfusion von gefrorenem Frischplasma führt in der Regel nicht zur Behebung der zugrunde liegenden Gerinnungsstörungen vor einem geplanten chirurgischen Eingriff. Eine Thrombozytentransfusion wird jedoch bei Thrombozytenzahlen unter (10 × 109/L) ohne Blutungsrisiko oder (20 × 109/L) mit hohem Blutungsrisiko oder (50 × 109/L) mit aktiven Blutungen vor einer geplanten Operation oder einem invasiven Eingriff empfohlen. Die intravenöse Gabe von Immunglobulinen wird nicht empfohlen, da ihre positive Wirkung ungewiss ist. Monoklonale und polyklonale Zubereitungen von intravenösem Immunglobulin (IVIG) senken die Sterblichkeitsrate bei Neugeborenen und Erwachsenen mit Sepsis nicht. Die Belege für die Verwendung von IgM-angereicherten polyklonalen IVIG-Präparaten sind widersprüchlich. Andererseits ist die Verwendung von Antithrombin zur Behandlung der disseminierten intravasalen Gerinnung ebenfalls nicht sinnvoll. Die Blutreinigungstechniken (wie Hämoperfusion, Plasmafiltration und gekoppelte Plasmafiltrationsadsorption) zur Entfernung von Entzündungsmediatoren und bakteriellen Toxinen aus dem Blut zeigen ebenfalls keinen Überlebensvorteil bei septischem Schock. ⓘ
Vasopressoren
Wenn die Person ausreichend mit Flüssigkeit reanimiert wurde, der mittlere arterielle Druck jedoch nicht über 65 mmHg liegt, werden Vasopressoren empfohlen. Norepinephrin (Noradrenalin) wird als erste Wahl empfohlen. Ein verzögerter Beginn der vasopressorischen Therapie bei septischem Schock ist mit einer erhöhten Sterblichkeit verbunden. ⓘ
Norepinephrin wird häufig als Erstlinientherapie bei hypotonem septischem Schock eingesetzt, da es nachweislich zu einem relativen Vasopressinmangel kommt, wenn der Schock 24 bis 48 Stunden lang anhält. Noradrenalin erhöht den Blutdruck durch eine gefäßverengende Wirkung und hat nur geringe Auswirkungen auf das Schlagvolumen und die Herzfrequenz. Bei manchen Menschen kann die erforderliche Dosis des Vasopressors zur Erhöhung des mittleren arteriellen Drucks so hoch werden, dass sie toxisch wirkt. Um die erforderliche Dosis des Vasopressors zu verringern, kann Epinephrin hinzugefügt werden. Epinephrin wird nicht häufig als Erstbehandlung bei hypotonem Schock eingesetzt, da es die Durchblutung der Bauchorgane verringert und den Laktatspiegel erhöht. Vasopressin kann bei septischem Schock eingesetzt werden, da Studien gezeigt haben, dass ein relativer Mangel an Vasopressin besteht, wenn der Schock 24 bis 48 Stunden anhält. Vasopressin reduziert jedoch den Blutfluss zum Herzen, zu den Fingern/Zehen und zu den Bauchorganen, was zu einer mangelnden Sauerstoffversorgung dieser Gewebe führt. Dopamin wird in der Regel nicht empfohlen. Dopamin ist zwar nützlich, um das Schlagvolumen des Herzens zu erhöhen, verursacht aber mehr Herzrhythmusstörungen als Noradrenalin und hat außerdem eine immunsuppressive Wirkung. Es ist nicht erwiesen, dass Dopamin eine schützende Wirkung auf die Nieren hat. Dobutamin kann auch bei hypotonem septischem Schock eingesetzt werden, um die Herzleistung zu erhöhen und die Durchblutung des Gewebes zu verbessern. Dobutamin wird aufgrund seiner Nebenwirkungen, zu denen auch die Verringerung des Blutflusses zum Darm gehört, nicht so häufig eingesetzt wie Epinephrin. Außerdem erhöht Dobutamin das Herzzeitvolumen, indem es die Herzfrequenz abnormal erhöht. ⓘ
Steroide
Der Einsatz von Steroiden bei Sepsis ist umstritten. Studien vermitteln kein klares Bild darüber, ob und wann Glukokortikoide eingesetzt werden sollten. Die Surviving Sepsis Campaign 2016 empfiehlt niedrig dosiertes Hydrocortison nur dann, wenn sowohl intravenöse Flüssigkeiten als auch Vasopressoren nicht in der Lage sind, einen septischen Schock adäquat zu behandeln. Die Surviving Sepsis Campaign 2021 empfiehlt intravenöse Kortikosteroide für Erwachsene mit septischem Schock, die eine kontinuierliche Vasopressor-Therapie benötigen. Ein Cochrane-Review aus dem Jahr 2019 und zwei weitere Reviews aus dem Jahr 2019 fanden nur minderwertige Belege für einen Nutzen. ⓘ
Während einer kritischen Erkrankung kann ein Zustand der Nebenniereninsuffizienz und der Geweberesistenz gegenüber Kortikosteroiden auftreten. Dies wird als kritische krankheitsbedingte Kortikosteroid-Insuffizienz bezeichnet. Die Behandlung mit Kortikosteroiden könnte bei septischem Schock und frühem schwerem ARDS am vorteilhaftesten sein, während ihre Rolle bei anderen Patienten, z. B. mit Pankreatitis oder schwerer Lungenentzündung, unklar ist. Die genaue Art und Weise, wie eine Kortikosteroidinsuffizienz festgestellt wird, bleibt jedoch problematisch. Sie sollte bei Patienten vermutet werden, die auf die Wiederbelebung mit Flüssigkeit und Vasopressoren schlecht ansprechen. Zur Bestätigung der Diagnose werden weder ACTH-Stimulationstests noch stichprobenartige Kortisolspiegel empfohlen. Die Methode zum Absetzen von Glukokortikoid-Medikamenten ist unterschiedlich, und es ist unklar, ob sie langsam reduziert oder einfach abrupt abgesetzt werden sollten. Die Surviving Sepsis Campaign 2016 empfiehlt jedoch, die Steroide abzusetzen, wenn die Vasopressoren nicht mehr benötigt werden. ⓘ
Anästhesie
Ein Zieltidalvolumen von 6 ml/kg des prädizierten Körpergewichts (PBW) und ein Plateaudruck von weniger als 30 cm H2O wird für Patienten empfohlen, die aufgrund eines durch Sepsis verursachten schweren ARDS beatmet werden müssen. Ein hoher positiver endexspiratorischer Druck (PEEP) wird für mittelschweres bis schweres ARDS bei Sepsis empfohlen, da dadurch mehr Lungeneinheiten für den Sauerstoffaustausch geöffnet werden. Das voraussichtliche Körpergewicht wird auf der Grundlage des Geschlechts und der Körpergröße berechnet, und es stehen entsprechende Instrumente zur Verfügung. Bei schwerem ARDS kann ein Rekrutierungsmanöver erforderlich sein, bei dem der transpulmonale Druck kurzzeitig erhöht wird. Es wird empfohlen, das Kopfende des Bettes wenn möglich anzuheben, um die Ventilation zu verbessern. β2-Adrenorezeptor-Agonisten werden jedoch nicht zur Behandlung des ARDS empfohlen, da sie die Überlebensrate verringern und Herzrhythmusstörungen hervorrufen können. Ein Spontanatmungsversuch mit kontinuierlichem positivem Atemwegsdruck (CPAP), einem T-Stück oder einer Inspirationsdruckerhöhung kann hilfreich sein, um die Beatmungsdauer zu verkürzen. Eine Minimierung der intermittierenden oder kontinuierlichen Sedierung ist hilfreich, um die Dauer der mechanischen Beatmung zu verkürzen. ⓘ
Eine Vollnarkose wird für Menschen mit Sepsis empfohlen, bei denen chirurgische Eingriffe zur Entfernung der Infektionsquelle erforderlich sind. In der Regel werden Inhalationsanästhetika und intravenöse Anästhetika verwendet. Der Bedarf an Anästhetika kann bei Sepsis reduziert sein. Inhalationsanästhetika können den Spiegel proinflammatorischer Zytokine senken, die Adhäsion und Proliferation von Leukozyten verändern und die Apoptose (Zelltod) von Lymphozyten auslösen, möglicherweise mit einer toxischen Wirkung auf die Mitochondrienfunktion. Obwohl Etomidat nur minimale Auswirkungen auf das Herz-Kreislauf-System hat, wird es häufig nicht als Medikament zur Unterstützung der Intubation in dieser Situation empfohlen, da man befürchtet, dass es zu einer schlechten Nebennierenfunktion und einem erhöhten Sterberisiko führen könnte. Die wenigen Belege, die es gibt, haben jedoch keine Veränderung des Todesrisikos durch Etomidat ergeben. ⓘ
Der Einsatz von Lähmungsmitteln bei Sepsis ohne ARDS wird nicht empfohlen, da es immer mehr Belege für eine kürzere Dauer der mechanischen Beatmung, der Intensivstation und des Krankenhausaufenthalts gibt. Der Einsatz von Lähmungsmitteln bei ARDS bleibt jedoch umstritten. Bei angemessenem Einsatz können Paralytika eine erfolgreiche mechanische Beatmung unterstützen, allerdings gibt es auch Hinweise darauf, dass die mechanische Beatmung bei schwerer Sepsis den Sauerstoffverbrauch und die Sauerstoffzufuhr nicht verbessert. ⓘ
Quellenkontrolle
Die Kontrolle der Infektionsquelle bezieht sich auf physische Eingriffe zur Kontrolle eines Infektionsherdes und zur Verringerung der Bedingungen, die das Wachstum von Mikroorganismen oder die Beeinträchtigung der Wirtsabwehr begünstigen, wie z. B. die Drainage von Eiter aus einem Abszess. Sie ist eines der ältesten Verfahren zur Bekämpfung von Infektionen, was zu der lateinischen Redewendung Ubi pus, ibi evacua führte, und bleibt trotz des Aufkommens modernerer Behandlungsmethoden wichtig. ⓘ
Frühe zielgerichtete Therapie
Die frühe zielgerichtete Therapie (Early Goal Directed Therapy, EGDT) ist ein Ansatz für die Behandlung einer schweren Sepsis in den ersten 6 Stunden nach der Diagnose. Es handelt sich um ein schrittweises Vorgehen mit dem physiologischen Ziel, die Vorlast, Nachlast und Kontraktilität des Herzens zu optimieren. Dazu gehört die frühzeitige Gabe von Antibiotika. Die EGDT umfasst auch die Überwachung der hämodynamischen Parameter und spezifische Maßnahmen zur Erreichung der wichtigsten Reanimationsziele, darunter die Aufrechterhaltung eines zentralvenösen Drucks zwischen 8 und 12 mmHg, eines mittleren arteriellen Drucks zwischen 65 und 90 mmHg, einer zentralvenösen Sauerstoffsättigung (ScvO2) von über 70 % und einer Urinausscheidung von über 0,5 ml/kg/Stunde. Ziel ist es, die Sauerstoffzufuhr zu den Geweben zu optimieren und ein Gleichgewicht zwischen systemischer Sauerstoffzufuhr und -bedarf herzustellen. Eine angemessene Senkung des Serumlaktats ist möglicherweise gleichwertig mit dem ScvO2 und leichter zu erreichen. ⓘ
In der ursprünglichen Studie wurde festgestellt, dass eine frühzeitige zielgerichtete Therapie die Sterblichkeit von 46,5 % auf 30,5 % bei Sepsispatienten senkt, und die Surviving Sepsis Campaign empfiehlt ihre Anwendung. Drei neuere große randomisierte Kontrollstudien (ProCESS, ARISE und ProMISe) konnten jedoch keinen Vorteil der frühen zielgerichteten Therapie im Vergleich zur Standardtherapie bei schwerer Sepsis in Bezug auf die 90-Tage-Sterblichkeit nachweisen. Es ist wahrscheinlich, dass einige Teile der EGDT wichtiger sind als andere. Nach diesen Studien wird der Einsatz der EGDT weiterhin als sinnvoll erachtet. ⓘ
Neugeborene
Eine neonatale Sepsis kann schwer zu diagnostizieren sein, da Neugeborene oft keine Symptome zeigen. Zeigt ein Neugeborenes Anzeichen und Symptome, die auf eine Sepsis hindeuten, wird sofort mit der Gabe von Antibiotika begonnen, die entweder auf einen bestimmten, durch diagnostische Tests identifizierten Organismus ausgerichtet sind oder nach Ausschluss einer infektiösen Ursache für die Symptome abgesetzt werden. Trotz frühzeitigen Eingreifens sterben 13 % der Kinder, die einen septischen Schock entwickeln, wobei das Risiko zum Teil von anderen Gesundheitsproblemen abhängt. Bei Kindern, bei denen nicht mehrere Organsysteme versagen oder die nur ein inotropes Mittel benötigen, ist die Sterblichkeit gering. ⓘ
Andere
Die Behandlung von Fieber bei Sepsis, einschließlich Menschen mit septischem Schock, wurde nicht mit einer Verbesserung der Sterblichkeit über einen Zeitraum von 28 Tagen in Verbindung gebracht. Die Behandlung von Fieber erfolgt nach wie vor aus anderen Gründen. ⓘ
Ein Cochrane-Review aus dem Jahr 2012 kam zu dem Schluss, dass N-Acetylcystein die Sterblichkeit bei Patienten mit SIRS oder Sepsis nicht senkt und sogar schädlich sein kann. ⓘ
Rekombinantes aktiviertes Protein C (Drotrecogin alpha) wurde ursprünglich für schwere Sepsis (erkennbar an einem hohen APACHE-II-Score) eingeführt, wo man glaubte, dass es einen Überlebensvorteil bringt. Spätere Studien zeigten jedoch, dass es die unerwünschten Ereignisse - insbesondere das Blutungsrisiko - erhöhte und die Sterblichkeit nicht verringerte. Es wurde 2011 aus dem Verkauf genommen. Ein anderes Medikament, Eritoran, hat ebenfalls keinen Nutzen gezeigt. ⓘ
Bei hohen Blutzuckerwerten wird Insulin empfohlen, um den Blutzuckerspiegel auf 7,8-10 mmol/L (140-180 mg/dL) zu senken, da sich bei niedrigeren Werten die Ergebnisse möglicherweise verschlechtern. Aus Kapillarblut gewonnene Glukosewerte sollten mit Vorsicht interpretiert werden, da solche Messungen möglicherweise nicht genau sind. Wenn eine Person einen arteriellen Katheter hat, wird für die Blutzuckermessung arterielles Blut empfohlen. ⓘ
Falls angezeigt, kann eine intermittierende oder kontinuierliche Nierenersatztherapie durchgeführt werden. Natriumbicarbonat wird jedoch bei einer Person mit Laktatazidose infolge von Hypoperfusion nicht empfohlen. Niedermolekulares Heparin (LMWH), unfraktioniertes Heparin (UFH) und eine mechanische Prophylaxe mit intermittierender pneumatischer Kompression werden für alle Personen mit Sepsis empfohlen, die ein mittleres bis hohes Risiko für venöse Thromboembolien aufweisen. Eine Ulkusprophylaxe mit Protonenpumpeninhibitoren (PPI) und H2-Antagonisten ist bei Personen mit Risikofaktoren für obere gastrointestinale Blutungen (UGIB) sinnvoll, z. B. bei mechanischer Beatmung für mehr als 48 Stunden, Gerinnungsstörungen, Lebererkrankungen und Nierenersatztherapie. Die teilweise oder vollständige enterale Ernährung (Verabreichung von Nährstoffen über eine Ernährungssonde) ist im Vergleich zur intravenösen Ernährung die beste Methode zur Versorgung von Personen, bei denen eine orale Aufnahme kontraindiziert ist oder die eine orale Ernährung in den ersten sieben Tagen der Sepsis nicht vertragen. Omega-3-Fettsäuren werden jedoch nicht als Immunergänzung für Personen mit Sepsis oder septischem Schock empfohlen. Die Verwendung von prokinetischen Mitteln wie Metoclopramid, Domperidon und Erythromycin wird für Personen empfohlen, die septisch sind und keine enterale Ernährung vertragen. Diese Mittel können jedoch zu einer Verlängerung des QT-Intervalls führen und somit eine ventrikuläre Arrhythmie wie Torsades de pointes auslösen. Die Verwendung von Prokinetika sollte täglich neu bewertet und abgesetzt werden, wenn sie nicht mehr angezeigt ist. ⓘ
Adjunktive Therapien
Bei schwerem septischen Schock wird auf Basis aktueller Studien und Metaanalysen auch eine begleitende Therapie mit Hydrocortison empfohlen, da diese den Bedarf an kreislaufstabilisierenden Katecholaminen reduzieren und dazu beitragen können, die Beatmungs- und Aufenthaltsdauer auf der Intensivstation zu reduzieren. Für die Effektivität einer Vielzahl anderer sogenannter adjunktiver, immunmodulatorischer Therapieverfahren gibt es keinen wissenschaftlich belastbaren Nachweis. Dies gilt auch für Verfahren zur Elimination von Endotoxin oder Zytokinen durch Endotoxinfilter, Hemoadsorptionsverfahren mit Zytokinadsorptionsfiltern und frühe Hämodialyse. Ältere Verfahren wie Early Goal-Directed Therapy sind obsolet. ⓘ
Prognose
Eine Sepsis endet in etwa 24,4 % der Fälle tödlich, ein septischer Schock in 34,7 % der Fälle innerhalb von 30 Tagen (32,2 % und 38,5 % nach 90 Tagen). Der Laktatwert ist eine nützliche Methode zur Bestimmung der Prognose: Bei einem Wert von mehr als 4 mmol/L liegt die Sterblichkeit bei 40 %, bei einem Wert von weniger als 2 mmol/L bei weniger als 15 %. ⓘ
Es gibt eine Reihe von prognostischen Stratifizierungssystemen, wie APACHE II und Mortalität bei Sepsis in der Notaufnahme. APACHE II berücksichtigt das Alter der Person, die Grunderkrankung und verschiedene physiologische Variablen, um das Risiko, an einer schweren Sepsis zu sterben, zu schätzen. Von den einzelnen Kovariaten beeinflusst der Schweregrad der Grunderkrankung das Sterberisiko am stärksten. Der septische Schock ist ebenfalls ein starker Prädiktor für die kurz- und langfristige Sterblichkeit. Die Sterblichkeitsraten sind bei kulturpositiver und kulturnegativer schwerer Sepsis ähnlich. Der MEDS-Score (Mortality in Emergency Department Sepsis) ist einfacher und in der Notaufnahme nützlich. ⓘ
Bei einigen Menschen kann es nach einer schweren Sepsis langfristig zu einer schweren kognitiven Beeinträchtigung kommen, doch da bei den meisten Menschen mit Sepsis keine neuropsychologischen Ausgangsdaten vorliegen, ist die Häufigkeit dieser Beeinträchtigung schwer zu quantifizieren oder zu untersuchen. ⓘ
Epidemiologie
Sepsis verursacht jedes Jahr weltweit Millionen von Todesfällen und ist die häufigste Todesursache bei Menschen, die ins Krankenhaus eingeliefert wurden. Die Zahl der neuen Sepsisfälle weltweit wird auf 18 Millionen Fälle pro Jahr geschätzt. In den Vereinigten Staaten sind etwa 3 von 1.000 Menschen von Sepsis betroffen, und eine schwere Sepsis ist für mehr als 200.000 Todesfälle pro Jahr verantwortlich. ⓘ
Sepsis tritt bei 1-2 % aller Krankenhausaufenthalte auf und ist für bis zu 25 % der Bettenbelegung auf Intensivstationen verantwortlich. Da die Sepsis nur selten als Hauptdiagnose angegeben wird (oft ist sie eine Komplikation von Krebs oder anderen Krankheiten), werden die Inzidenz-, Mortalitäts- und Morbiditätsraten der Sepsis wahrscheinlich unterschätzt. Eine Studie der US-Bundesstaaten ergab, dass im Jahr 2010 auf 100 000 Einwohner etwa 651 Krankenhausaufenthalte mit einer Sepsisdiagnose entfielen. Die Sepsis ist die zweithäufigste Todesursache auf nicht koronaren Intensivstationen (ICU) und die zehnthäufigste Todesursache insgesamt (an erster Stelle stehen Herzerkrankungen). Kinder unter 12 Monaten und ältere Menschen sind am häufigsten von einer schweren Sepsis betroffen. Von den US-Bürgern, die im Jahr 2010 mehrfach wegen einer Sepsis ins Krankenhaus eingewiesen wurden, wurden diejenigen, die nach dem ersten Krankenhausaufenthalt in eine qualifizierte Pflegeeinrichtung oder Langzeitpflege entlassen wurden, mit größerer Wahrscheinlichkeit wieder aufgenommen als diejenigen, die in eine andere Pflegeeinrichtung entlassen wurden. Eine Studie in 18 US-Bundesstaaten ergab, dass bei Medicare-Versicherten im Jahr 2011 Sepsis der zweithäufigste Hauptgrund für eine Rückübernahme innerhalb von 30 Tagen war. ⓘ
Mehrere medizinische Bedingungen erhöhen die Anfälligkeit einer Person für Infektionen und die Entwicklung einer Sepsis. Zu den häufigen Risikofaktoren für eine Sepsis gehören das Alter (insbesondere bei sehr jungen und alten Menschen), Erkrankungen, die das Immunsystem schwächen, wie Krebs, Diabetes oder das Fehlen einer Milz, sowie schwere Traumata und Verbrennungen. ⓘ
Daten aus der National Hospital Discharge Survey der Vereinigten Staaten zeigen, dass sich die Inzidenz von Sepsis zwischen 1979 und 2000 auf 240 Fälle pro 100 000 Einwohner vervierfacht hat, wobei die Inzidenz bei Männern höher ist als bei Frauen. Die globale Prävalenz der Sepsis wird jedoch bei Frauen als höher eingeschätzt. Im gleichen Zeitraum konnte die Sterblichkeitsrate im Krankenhaus von 28 % auf 18 % gesenkt werden. Laut einer landesweiten Stichprobe von stationären Patienten in den Vereinigten Staaten stieg die Inzidenz schwerer Sepsis jedoch von 200 pro 10.000 Einwohner im Jahr 2003 auf 300 Fälle im Jahr 2007 für die Bevölkerung im Alter von mehr als 18 Jahren. Besonders hoch ist die Inzidenzrate bei Säuglingen mit einer Inzidenz von 500 Fällen pro 100.000 Einwohner. Die sepsisbedingte Sterblichkeit nimmt mit dem Alter zu, von weniger als 10 % in der Altersgruppe von 3 bis 5 Jahren auf 60 % im sechsten Lebensjahrzehnt. Der Anstieg des Durchschnittsalters der Bevölkerung, die Zunahme von Menschen mit chronischen Krankheiten oder von Menschen, die immunsuppressive Medikamente einnehmen, sowie die steigende Zahl invasiver Eingriffe haben zu einer erhöhten Sepsisrate geführt. ⓘ
2015 wurden in Deutschland 75.000 Sepsis-Todesfälle dokumentiert. Das sind mehr Todesfälle als die aufgrund von Lungen-, Darm-, Brust- und Prostatakrebs zusammen. Bei ca. 15 % der 2015 in Deutschland im Krankenhaus verstorbenen Patienten lag eine Sepsis vor. Diese Schätzungen sind jedoch eher noch zu niedrig angesetzt: Jüngste Studien zeigen, dass weniger als 50 % der anhand von Patientenakten identifizierten Patienten mit einer Sepsis in den offiziellen, von der Weltgesundheitsorganisation (WHO) vorgegebenen Registern (International Classification of Diseases, ICD-10) zur Erfassung der Krankheitslast dokumentiert werden. ⓘ
Geschichte

Der Begriff "σήψις" (Sepsis) wurde von Hippokrates im vierten Jahrhundert v. Chr. eingeführt und bezeichnete den Prozess des Zerfalls oder der Zersetzung organischer Stoffe. Im elften Jahrhundert verwendete Avicenna den Begriff "Blutfäule" für Krankheiten, die mit schweren eitrigen Prozessen verbunden waren. Obwohl eine schwere systemische Toxizität bereits beobachtet worden war, wurde der spezifische Begriff Sepsis erst im 19. ⓘ
Die Begriffe "Septikämie", auch "Sepsis", und "Blutvergiftung" bezogen sich auf Mikroorganismen oder deren Toxine im Blut. Die Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme (ICD) Version 9, die in den USA bis 2013 verwendet wurde, verwendete den Begriff Septikämie mit zahlreichen Modifikatoren für verschiedene Diagnosen, wie z. B. "Streptokokken-Septikämie". Alle diese Diagnosen wurden in der ICD-10 in Sepsis umgewandelt, wiederum mit Modifikatoren, wie z. B. "Sepsis durch Streptokokken". ⓘ
Die heutigen Bezeichnungen hängen von dem vorhandenen Mikroorganismus ab: Bakteriämie, wenn Bakterien in abnormaler Menge im Blut vorhanden und die Ursache sind, Virämie für Viren und Fungämie für einen Pilz. ⓘ
Ende des 19. Jahrhunderts war man davon überzeugt, dass Mikroben Substanzen produzieren, die den Säugetierwirt schädigen können, und dass lösliche Toxine, die während der Infektion freigesetzt werden, das Fieber und den Schock verursachen, die bei schweren Infektionen an der Tagesordnung sind. Pfeiffer prägte zu Beginn des 20. Jahrhunderts den Begriff Endotoxin, um das mit Vibrio cholerae assoziierte pyrogene Prinzip zu bezeichnen. Bald erkannte man, dass Endotoxine von den meisten, vielleicht sogar allen gramnegativen Bakterien gebildet werden. Der Lipopolysaccharid-Charakter der enterischen Endotoxine wurde 1944 von Shear aufgeklärt. Der molekulare Charakter dieses Materials wurde 1973 von Luderitz et al. bestimmt. ⓘ
1965 wurde entdeckt, dass ein C3H/HeJ-Mausstamm gegen den Endotoxin-induzierten Schock immun ist. Der genetische Locus für diesen Effekt wurde als Lps bezeichnet. Diese Mäuse erwiesen sich auch als überempfindlich gegenüber Infektionen mit gramnegativen Bakterien. Diese Beobachtungen wurden schließlich 1998 durch die Entdeckung des Toll-like-Rezeptor-Gens 4 (TLR 4) miteinander verbunden. Genetische Kartierungsarbeiten, die über einen Zeitraum von fünf Jahren durchgeführt wurden, zeigten, dass TLR4 der einzige Kandidaten-Locus innerhalb der kritischen Lps-Region war; dies deutete stark darauf hin, dass eine Mutation innerhalb von TLR4 für den Lipopolysaccharid-Resistenz-Phänotyp verantwortlich sein muss. Es wurde festgestellt, dass der Defekt im TLR4-Gen, der zu dem endotoxinresistenten Phänotyp führte, auf eine Mutation im Zytoplasma zurückzuführen ist. ⓘ
Im Jahr 2013 kam es in der wissenschaftlichen Gemeinschaft zu einer Kontroverse über die Verwendung von Mausmodellen in der Sepsisforschung, als Wissenschaftler eine Übersicht über das Immunsystem der Maus im Vergleich zum menschlichen Immunsystem veröffentlichten und aufzeigten, dass beide auf Systemebene sehr unterschiedlich funktionieren; die Autoren wiesen darauf hin, dass zum Zeitpunkt ihres Artikels über 150 klinische Versuche zur Sepsis beim Menschen durchgeführt worden waren, von denen fast alle durch vielversprechende Daten bei Mäusen unterstützt wurden, und dass sie alle gescheitert waren. Die Autoren riefen dazu auf, die Verwendung von Mausmodellen in der Sepsisforschung aufzugeben; andere lehnten dies ab, forderten aber mehr Vorsicht bei der Interpretation der Ergebnisse von Mausstudien und eine sorgfältigere Gestaltung der präklinischen Studien. Ein Ansatz besteht darin, sich mehr auf die Untersuchung von Biopsien und klinischen Daten von Menschen zu stützen, die an Sepsis erkrankt sind, um Biomarker und Angriffspunkte für Medikamente zu ermitteln. ⓘ
Gesellschaft und Kultur
Wirtschaft
Im Jahr 2013 war die Sepsis mit Gesamtkosten von 23,6 Milliarden US-Dollar für fast 1,3 Millionen Krankenhausaufenthalte die teuerste Erkrankung, die in den Vereinigten Staaten behandelt wurde. Die Kosten für Sepsis-Krankenhausaufenthalte haben sich seit 1997 mit einem jährlichen Anstieg von 11,5 Prozent mehr als vervierfacht. Aufgeschlüsselt nach Kostenträgern war die Sepsis die teuerste Erkrankung, die Medicare und den Nichtversicherten in Rechnung gestellt wurde, die zweitteuerste, die Medicaid in Rechnung stellte, und die viertteuerste, die Privatversicherungen in Rechnung stellten. ⓘ
Bildung
In Deutschland haben sich 2005 weltweit erstmals Menschen, die von Sepsis betroffen sind oder waren, zusammengeschlossen, woraus sich die Deutsche Sepsis-Hilfe e. V. gebildet hat. 2012 wurde die Sepsis-Stiftung als gemeinnützige Organisation in Jena gegründet, die sich zum Ziel gesetzt hat, „Todesfälle durch Sepsis nachhaltig zu reduzieren“. Dafür engagiert sie sich für Forschung und Wissenschaft sowie für Aufklärung und Prävention. Die Gründungsmitglieder der Sepsis-Stiftung waren die Deutsche Sepsis-Gesellschaft und das Universitätsklinikum Jena. Unter dem Dach der Sepsis-Stiftung arbeitet das ehemalige Kompetenznetzwerk für klinische Sepsisforschung „SepNet“ als unabhängige Studiengruppe. Die Sepsis-Hilfe e. V. ist im Kuratorium der Sepsis-Stiftung vertreten. Die Deutsche Sepsis-Gesellschaft (DSG) ist eine medizinische Fachgesellschaft, die sich zum Ziel gesetzt hat, „das Verständnis für das Krankheitsbild Sepsis sowohl in der Öffentlichkeit als auch in der medizinischen Fachwelt (zu) bilden und schärfen“. Die DSG wurde 2001 gegründet und hält alle 2 Jahre den Weimarer Sepsis-Update Kongress. Die Sepsis Hilfe e. V., die Sepsis-Stiftung und die Deutsche Sepsis-Gesellschaft sind Mitgliedsorganisationen der Global Sepsis Alliance. ⓘ
Obwohl die Sepsis für viele Facharztgruppen ein relevantes Problem ist, wird Sepsis von keiner Medizindisziplin als Schwerpunktaufgabe begriffen. ⓘ
Im Jahr 2002 wurde eine große internationale Zusammenarbeit mit dem Namen Surviving Sepsis Campaign" ins Leben gerufen, um die Menschen über Sepsis aufzuklären und die Ergebnisse bei Sepsis zu verbessern. Die Kampagne hat eine evidenzbasierte Übersicht über die Behandlungsstrategien für schwere Sepsis veröffentlicht, mit dem Ziel, in den folgenden Jahren einen vollständigen Satz von Leitlinien zu veröffentlichen. Die Leitlinien wurden 2016 und erneut 2021 aktualisiert. ⓘ
Forschung

Einige Autoren vermuten, dass die Auslösung einer Sepsis durch die normalerweise mutualistischen (oder neutralen) Mitglieder des Mikrobioms nicht immer eine zufällige Nebenwirkung des sich verschlechternden Wirtsimmunsystems ist. Vielmehr handelt es sich häufig um eine adaptive mikrobielle Reaktion auf eine plötzliche Verschlechterung der Überlebenschancen des Wirts. In diesem Szenario profitieren die Mikrobenarten, die die Sepsis auslösen, davon, dass sie den zukünftigen Kadaver in Beschlag nehmen, seine Biomasse als Zersetzer nutzen und dann über den Boden oder das Wasser übertragen werden, um wechselseitige Beziehungen zu neuen Individuen aufzubauen. Die Bakterien Streptococcus pneumoniae, Escherichia coli, Proteus spp., Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella spp., Clostridium spp., Lactobacillus spp., Bacteroides spp. und die Pilze Candida spp. sind alle zu einem solchen hohen Maß an phänotypischer Plastizität fähig. Offensichtlich entstehen nicht alle Fälle von Sepsis durch solche adaptiven mikrobiellen Strategiewechsel. ⓘ
Paul E. Mariks "Marik-Protokoll", auch bekannt als "HAT"-Protokoll, schlug eine Kombination aus Hydrocortison, Vitamin C und Thiamin als Behandlung zur Vorbeugung von Sepsis bei Menschen auf der Intensivstation vor. Mariks eigene erste Forschungsergebnisse, die 2017 veröffentlicht wurden, zeigten einen dramatischen Nutzen, was dazu führte, dass das Protokoll unter Intensivmedizinern populär wurde, insbesondere nachdem das Protokoll in den sozialen Medien und im National Public Radio Aufmerksamkeit erlangte, was zu Kritik an der Wissenschaft durch Pressekonferenzen der breiteren medizinischen Gemeinschaft führte. Nachfolgende unabhängige Untersuchungen konnten die positiven Ergebnisse von Marik nicht wiederholen, was darauf hindeutet, dass sie möglicherweise durch Voreingenommenheit beeinträchtigt wurden. Eine systematische Überprüfung von Studien im Jahr 2021 ergab, dass die behaupteten Vorteile des Protokolls nicht bestätigt werden konnten. Eine weitere neuere Überprüfung ergab, dass "die HAT-Therapie die Dauer des Vasopressor-Einsatzes signifikant verkürzt und den SOFA-Score verbessert, aber offenbar keine signifikanten Vorteile bei anderen Ergebnissen für Patienten mit Sepsis hat". ⓘ
Insgesamt bleibt die Evidenz für eine Rolle von Vitamin C bei der Behandlung von Sepsis bis 2021 unklar. ⓘ
Zum Begriff
Das Wort „Sepsis“ stammt aus dem Altgriechischen σῆψις sēpsis („Fäulnis“ oder „Gärung“). Der früher synonym verwendete Begriff der Septikämie wird aufgrund der unscharfen Definition seit 1991 nicht mehr verwendet. Auch der bisweilen synonym verwendete Begriff der Bakteriämie ist veraltet und entspricht nicht der medizinischen Realität, da nur etwa 30–40 % der Sepsen mit einer Bakteriämie einhergehen. Der Begriff „Blutvergiftung“ ist nicht definiert und wird fachsprachlich nicht verwendet. ⓘ
Gemäß einer älteren Definition (von Hugo Schottmüller und Konrad Bingold, 1925) liegt eine Sepsis vor, „wenn sich innerhalb des Körpers ein Herd gebildet hat, von dem aus konstant oder periodisch pathogene Keime in den Blutkreislauf gelangen und zwar derart, daß durch diese Invasion subjektive und objektive Krankheitserscheinungen ausgelöst werden“. ⓘ
Diagnosesicherung
Die Verdachtsdiagnose einer Sepsis muss durch die ärztliche, klinische Untersuchung des Patienten gesichert und durch Unterstützung von bildgebenden Verfahren wie Ultraschall, Röntgen, Computertomografie (CT) oder Magnetresonanztomographie (MRT) versucht werden, den auslösenden Infektionsherd zu identifizieren. Zusätzlich ist es von großer Bedeutung, durch mikrobiologische Verfahren den auslösenden Infektionserreger zu finden. Weitere wichtige Maßnahmen zur Abklärung des Vorliegens einer Infektion sind labordiagnostische Blutuntersuchungen zur Bestimmung von Entzündungsparametern und Laborparametern, die auf Organfunktionsstörungen hinweisen. Von den mehr als hundert vorgeschlagenen Biomarkern einer Sepsis sind nur wenige ausreichend untersucht und haben bisher den Weg in den klinischen Alltag gefunden. Dazu gehören C-reaktives Protein, Procalcitonin und die Zytokine IL-6 und IL-8. ⓘ
Trotz Fortschritten von molekulardiagnostischen Techniken ist nach wie vor die klassische Bebrütung von Blutkultur und Materialien aus anderen Körperkompartimenten der Goldstandard für die Erregeridentifizierung bei Sepsis und Infektionen. Der Nachteil dieses Verfahrens besteht vor allem in seiner Langsamkeit; meist dauert die Erregeridentifizierung deutlich länger als 24 Stunden. Jedoch sind eine ganze Reihe von Verfahren in der Entwicklung und klinischen Evaluierung, die versprechen die Erregerdiagnostik, die eine wichtige Voraussetzung für eine effektive Sepsistherapie ist, schneller und sensitiver zu machen und darüber hinaus auch die Testung der Empfindlichkeit der Erreger gegenüber mikrobiellen Substanzen zu beschleunigen. ⓘ
Von den in der Klinik derzeit eingesetzten Sepsismarkern ist Procalcitonin am umfassendsten evaluiert. Dabei hat sich gezeigt, dass es den Einsatz von Antibiotika zu reduzieren hilft und dies mit einer Verbesserung der Überlebenschancen einhergehen kann. ⓘ
Folgeerkrankungen und Langzeitfolgen
Nach der Entlassung aus dem Krankenhaus erleidet etwa die Hälfte der Patienten mit Sepsis keine gravierenden Folgen. Die durchschnittliche 30-Tage-Sepsis-Mortalität liegt bei 24,4 %, die Sterblichkeit nach einem septischen Schock nach 30 Tagen beträgt 34,7 %. Etwa 40 % der Patienten werden innerhalb von 90 Tagen nach der Entlassung erneut stationär aufgenommen. Zudem ist bei Sepsisüberlebenden das Risiko für eine erneute Infektion, akutes Nierenversagen und kardiovaskuläre Ereignisse erhöht. ⓘ
Folgeerkrankungen nach Sepsis stellen nationale Gesundheitssysteme vor eine erhebliche Herausforderung. Zudem können die Alltagsfähigkeiten und die Lebensqualität von Betroffenen durch Sepsisfolgen deutlich eingeschränkt sein. Durch das mangelnde Wissen über Sepsisfolgen fehlen zudem konkrete, sepsisspezifische Rehabilitationsangebote. Sofern Sepsisüberlebende in Reha-Einrichtungen behandelt werden, geschieht dies meist in Einrichtungen, die sich auf die Behandlung spezieller Organsysteme und Krankheitsfolgen von z. B. Herzinfarkt, Schlaganfall oder schweren Traumata spezialisiert haben. ⓘ
Kosten
Sepsis ist eine der häufigsten und kostenintensivsten Erkrankungen im stationären Sektor. Kostenfaktoren sind die häufigen Wiedereinweisungen und die langanhaltenden Krankheitsfolgen wie Langzeitbeatmung und Dialysepflichtigkeit, aber auch langfristige Arbeitsunfähigkeit und Frühberentung. Mit jährlichen Kosten in Höhe von 24 Milliarden Dollar steht Sepsis in den USA an Nummer eins bei den Krankenhausbehandlungskosten. In Deutschland wurden die direkten Behandlungskosten für Sepsis im ambulanten und stationären Bereich im Jahr 2013 auf 7,5 Milliarden Euro geschätzt. Die Kosten der langfristigen Folgen einer Sepsis sind wahrscheinlich deutlich höher. Derzeit liegen dazu aber keine Berechnungen für Deutschland vor. ⓘ
Bedeutung der Vorbeugung und Risikofaktoren
Die WHO geht in der Sepsisresolution davon aus, dass die Mehrzahl der sepsisbedingten Todesfälle vermeidbar ist. Die wesentlichen Elemente hierzu sind die Vermeidung von Infektionen durch Impfung und strikte Beachtung der Hygieneregeln im Krankenhaus sowie allen Behandlungs- und Pflegeeinrichtungen im Gesundheitswesen und bei der häuslichen Pflege. In stärker ressourcenlimitierten Ländern erfordert dies den Zugang zu sauberem Wasser und das Vorhandensein von sanitären Mindeststandards. Für alle Regionen der Welt gilt, dass durch Sepsisfrüherkennung und -behandlung sowie Zugang zu geeigneten Behandlungseinrichtungen die Sepsissterblichkeit erheblich reduziert werden kann. ⓘ
In Deutschland ist das Wissen zu Vorbeugung und Früherkennung von Sepsis gering. Eine repräsentative Befragung bei über 60-Jährigen im Jahr 2017 ergab, dass zwar 88 % den Begriff Sepsis kannten, doch Ursachen und Symptome der Erkrankung sind weitgehend unbekannt. Nur 17 % der Bundesbürger wissen, dass Sepsis durch Infektionen ausgelöst wird, gegen die man sich beispielsweise durch Impfungen gegen Pneumokokken und Influenza schützen kann. Dies erklärt teilweise die in Deutschland mit 31,4 % deutlich niedrigere Impfquote gegen Pneumokokken im Vergleich zu den USA (63,6 %), England (69,8 %) und Australien (56,0 %). Auch die Impfquote gegen Influenza ist in Deutschland mit 31,4 % niedriger als in den USA (69,1 %), England (71,1 %) und Australien (74,6 %). Insbesondere für Risikogruppen von Sepsis, denen etwa 34,5 Millionen Bundesbürger zuzurechnen sind, gibt es spezifische Impfempfehlungen der Ständigen Impfkommission (STIKO) am RKI. ⓘ
Als Risikofaktoren für Sepsis gelten höheres Lebensalter, chronische Erkrankungen der Lunge, des Herzens, der Leber und der Nieren, Diabetes mellitus, Alkoholismus, die Behandlung mit immunsuppressiven Medikamenten und Milzlosigkeit. Krebs- und HIV-Patienten haben ebenfalls ein deutlich erhöhtes Infektions- und Sepsisrisiko. ⓘ
Auftreten und Krankheitsverlauf werden durch die Abwehrkräfte des Patienten und die Aggressivität (Virulenz) des verursachenden Krankheitserregers bestimmt. Chronische Krankheiten – wie chronisch obstruktive Lungenerkrankung, Krebs, Leberzirrhose, AIDS und andere Erkrankungen des Immunsystems – bringen ein erhöhtes Sepsisrisiko mit sich. Auch demografische und soziale Faktoren – wie (männliches) Geschlecht, Ernährung, Lebensstil (zum Beispiel Tabak- und Alkoholkonsum) und Armut – erhöhen die Anfälligkeit für Infektionen und Sepsis. ⓘ
Internationale Strategien
Die WHO-Sepsis-Resolution
Im Jahr 2017 hat die Weltgesundheitsorganisation (WHO) die Resolution „Verbesserung der Prävention, Diagnose und des klinischen Managements von Sepsis“ verabschiedet. Gründe dafür waren die enorme sepsis-bedingte Krankheitslast und die Erkenntnis, dass die Mehrzahl der Todesfälle vermeidbar ist. Auf globaler Ebene hat die WHO dieser Resolution eine hohe Priorität eingeräumt. Sie fordert ihre 194 Mitgliedsstaaten darin dringend auf, diese Forderungen in ihre nationalen Gesundheitsstrategien zu integrieren. ⓘ
Forderungen der WHO Sepsis-Resolution:
- Verbesserung der Früherkennung durch die Nutzung des Wortes Sepsis, Steigerung der Aufmerksamkeit und Aufklärung über die Frühsymptome von Sepsis in allen medizinischen und gesellschaftlichen Bereichen
- Steigerung der Impfquoten bei Risikogruppen gegen die saisonale Grippe (Influenza), Pneumokokken und andere Infektionen, die zur Sepsis führen können
- Vermeidung von nosokomialen Infektionen im Krankenhaus, in Pflegeeinrichtungen und im ambulanten Bereich durch eine Verbesserung der Vorbeugungsmaßnahmen
- Optimierung der Therapie mit Antibiotika durch gezielten, zeitgerechten Einsatz
- Reduzierung von Antibiotikaresistenzen durch Vermeidung missbräuchlicher Verordnung
- Entwicklung effektiver Strategien zum Umgang mit Patienten, die mit multiresistenten Keimen infiziert sind, und effektives Management von Erregerausbrüchen multiresistenter Keime
- Weiterentwicklung effektiver Vorbeugungs- und Eindämmungsstrategien für Pandemien und Epidemien
- Nutzung und Verbesserung des ICD-Klassifizierungssystems, um die Entwicklung der Sepsishäufigkeit und -sterblichkeit sowie der Antibiotikaresistenz zu verfolgen
- Förderung der Sepsisforschung und Entwicklung von innovativen, effektiven Diagnostika und Therapeutika
- Schaffung von geeigneten Versorgungsstrukturen für Sepsisüberlebende ⓘ
World Sepsis Day / Welt-Sepsis-Tag
Seit 2012 findet jährlich am 13. September der Welt-Sepsis-Tag statt, um auf die Erkrankung und deren schwerwiegende Folgen aufmerksam zu machen. Hierzu finden zahlreiche internationale Aktionen sowie alle zwei Jahre ein web-basierter World Sepsis Congress zum Thema Sepsis statt. Der Welt-Sepsis-Tag wird von der Global Sepsis Alliance koordiniert. ⓘ
Global Sepsis Alliance
Die Global Sepsis Alliance (GSA) vereint die Mitglieder der globalen Sepsis-Gemeinschaft, in der sich über 100 Betroffenenorganisationen und medizinische Fachgesellschaften zahlreicher Fachgebiete im Kampf gegen die Sepsis zusammengeschlossen haben. Sie war die treibende Kraft für das Zustandekommen der WHO-Sepsis-Resolution. ⓘ
Unter dem Dach der GSA wurden zudem die African Sepsis Alliance (ASA) und die European Sepsis Alliance (ESA) gegründet, die sich jeweils aus den Mitgliedern der Region/des Kontinents zusammensetzen. ⓘ
Nationale Strategien
Da in Deutschland jährlich 15.000–20.000 Patienten als vermeidbar gelten, fordert ein breites Bündnis von über 30 medizinischen Fachgesellschaften, Berufsverbänden, Fachexperten und Patientenorganisationen einen Nationalen Sepsisplan unter der Regie der Sepsis-Stiftung und unter der Schirmherrschaft des Aktionsbündnisses Patientensicherheit (APS) einen Nationalen Sepsisplan. Im Juni 2018 hat die Gemeinsame Konferenz der Gesundheitsminister (GMK) das Bundesministerium für Gesundheit (BMG) aufgefordert am Robert Koch-Institut eine Expertenkommission einzurichten, um über die Umsetzung der Forderungen aus der WHO-Resolution zu beraten. Konkrete Schritte hierfür sind jedoch bisher nicht erfolgt. ⓘ
Da in Deutschland die Sepsissterblichkeit im Verhältnis zu anderen einkommensstarken Ländern hoch ist und der wissenschaftliche Beleg für die Effektivität von Qualitätsverbesserungsmaßnahmen auf Länder- und Krankenhausebene besteht, haben 2017 die Patientenvertreter im Gemeinsamen Bundesausschuss (G-BA) mit Unterstützung der Sepsis-Stiftung einen Antrag für eine bessere Qualitätssicherung beim G-BA eingebracht. Inzwischen wurde das Institut für Qualitätssicherung und Transparenz im Gesundheitswesen (IQTIG) vom G-BA beauftragt, Maßnahmen zur Entwicklung eines Qualitätssicherungsverfahrens bei der Behandlung der Sepsis zu entwickeln. Ob in Deutschland die Sepsissterblichkeit im Verhältnis zu anderen einkommensstarken Ländern wirklich höher ist, ist jedoch nach neueren Erkenntnissen umstritten. ⓘ
Weitere Organisationen und Verbünde auf internationaler Ebene
- National Health Service, der in enger Kooperation mit Betroffenenorganisationen auch Laien und Schulkinder über die Vorbeugungsmöglichkeiten und Frühsymptome einer Sepsis aufklärt
- Centers for Disease Control and Prevention (CDC)
- UK Sepsis Trust
- Sepsis Alliance
- Rory Staunton Foundation ⓘ
Meldepflicht
In Österreich sind „invasive bakterielle Erkrankungen (Meningitiden und Sepsis)“ (z. B. durch Meningokokken, Pneumokokken, Haemophilus influenzae) gemäß § 1 Abs. 1 Nummer 2 Epidemiegesetz 1950 bei Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz). ⓘ