Chlor
 | |||||||||||||||||||||||
| Chlor | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /ˈklɔːriːn, -aɪn/ (KLOR-een, -eyen) | ||||||||||||||||||||||
| Erscheinungsbild | blass gelb-grünes Gas | ||||||||||||||||||||||
| Standard-Atomgewicht Ar°(Cl) |
| ||||||||||||||||||||||
| Chlor im Periodensystem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ordnungszahl (Z) | 17 | ||||||||||||||||||||||
| Gruppe | Gruppe 17 (Halogene) | ||||||||||||||||||||||
| Periode | Periode 3 | ||||||||||||||||||||||
| Block | p-Block | ||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Neon|Ne]]] 3s2 3p5 | ||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 7 | ||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||
| Phase bei STP | Gas | ||||||||||||||||||||||
| Schmelzpunkt | (Cl2) 171,6 K (-101,5 °C, -150,7 °F) | ||||||||||||||||||||||
| Siedepunkt | (Cl2) 239,11 K (-34,04 °C, -29,27 °F) | ||||||||||||||||||||||
| Dichte (bei STP) | 3,2 g/L | ||||||||||||||||||||||
| in flüssigem Zustand (bei B.P.) | 1,5625 g/cm3 | ||||||||||||||||||||||
| Kritischer Punkt | 416,9 K, 7,991 MPa | ||||||||||||||||||||||
| Schmelzwärme | (Cl2) 6.406 kJ/mol | ||||||||||||||||||||||
| Verdampfungswärme | (Cl2) 20,41 kJ/mol | ||||||||||||||||||||||
| Molare Wärmekapazität | (Cl2) 33,949 J/(mol-K) | ||||||||||||||||||||||
Verdampfungsdruck
| |||||||||||||||||||||||
| Atomare Eigenschaften | |||||||||||||||||||||||
| Oxidationsstufen | -1, +1, +2, +3, +4, +5, +6, +7 (ein stark saures Oxid) | ||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 3.16 | ||||||||||||||||||||||
| Ionisierungsenergien |
| ||||||||||||||||||||||
| Kovalenter Radius | 102±4 pm | ||||||||||||||||||||||
| Van-der-Waals-Radius | 175 pm | ||||||||||||||||||||||
| Spektrallinien des Chlors | |||||||||||||||||||||||
| Andere Eigenschaften | |||||||||||||||||||||||
| Natürliches Vorkommen | primordial | ||||||||||||||||||||||
| Kristallstruktur | orthorhombisch | ||||||||||||||||||||||
| Schallgeschwindigkeit | 206 m/s (Gas, bei 0 °C) | ||||||||||||||||||||||
| Wärmeleitfähigkeit | 8,9×10-3 W/(m⋅K) | ||||||||||||||||||||||
| Spezifischer elektrischer Widerstand | >10 Ω⋅m (bei 20 °C) | ||||||||||||||||||||||
| Magnetische Ordnung | diamagnetisch | ||||||||||||||||||||||
| Molare magnetische Suszeptibilität | -40,5×10-6 cm3/mol | ||||||||||||||||||||||
| CAS-Nummer | Cl2: 7782-50-5 | ||||||||||||||||||||||
| Geschichte | |||||||||||||||||||||||
| Entdeckung und erste Isolierung | Carl Wilhelm Scheele (1774) | ||||||||||||||||||||||
| Erkannt als ein Element durch | Humphry Davy (1808) | ||||||||||||||||||||||
| Hauptisotope des Chlors | |||||||||||||||||||||||
| |||||||||||||||||||||||
Chlor ist ein chemisches Element mit dem Symbol Cl und der Ordnungszahl 17. Es ist das zweitleichteste der Halogene und steht im Periodensystem zwischen Fluor und Brom, wobei seine Eigenschaften meist zwischen diesen beiden liegen. Chlor ist bei Raumtemperatur ein gelb-grünes Gas. Es ist ein äußerst reaktives Element und ein starkes Oxidationsmittel: Von allen Elementen hat es die höchste Elektronenaffinität und die dritthöchste Elektronegativität auf der revidierten Pauling-Skala, nach Sauerstoff und Fluor. Auf mehreren anderen Skalen als der revidierten Pauling-Skala ist die Elektronegativität von Stickstoff ebenfalls größer als die von Chlor, z. B. auf der Allen-, Allred-Rochow-, Martynov-Batsanov-, Mulliken-Jaffe-, Nagle- und Noorizadeh-Shakerzadeh-Elektronegativitätsskala. ⓘ
Chlor spielte eine wichtige Rolle bei den Experimenten der mittelalterlichen Alchemisten, die in der Regel Chloridsalze wie Ammoniumchlorid (Sal ammoniac) und Natriumchlorid (Kochsalz) erhitzten und dabei verschiedene chlorhaltige chemische Substanzen wie Chlorwasserstoff, Quecksilber(II)-chlorid (ätzendes Sublimat) und Salzsäure (in Form von Königswasser) erzeugten. Die Natur des freien Chlorgases als eigenständige Substanz wurde jedoch erst um 1630 von Jan Baptist van Helmont erkannt. Carl Wilhelm Scheele beschrieb das Chlorgas 1774 und nahm an, dass es sich um ein Oxid eines neuen Elements handelt. Im Jahr 1809 vermuteten Chemiker, dass es sich bei dem Gas um ein reines Element handeln könnte, was 1810 von Sir Humphry Davy bestätigt wurde, der es aufgrund seiner Farbe nach dem altgriechischen χλωρός (khlōrós, "blassgrün") benannte. ⓘ
Aufgrund seiner hohen Reaktivität liegt das gesamte Chlor in der Erdkruste in Form von ionischen Chloridverbindungen vor, zu denen auch Kochsalz gehört. Es ist das zweithäufigste Halogen (nach Fluor) und das einundzwanzigsthäufigste chemische Element in der Erdkruste. Diese Vorkommen in der Erdkruste werden jedoch von den riesigen Chloridreserven im Meerwasser in den Schatten gestellt. ⓘ
Elementares Chlor wird kommerziell aus Sole durch Elektrolyse hergestellt, vor allem im Chloralkaliverfahren. Das hohe Oxidationspotenzial des elementaren Chlors führte zur Entwicklung kommerzieller Bleichmittel und Desinfektionsmittel sowie zu einem Reagenz für zahlreiche Prozesse in der chemischen Industrie. Chlor wird bei der Herstellung einer Vielzahl von Konsumgütern verwendet, etwa zwei Drittel davon sind organische Chemikalien wie Polyvinylchlorid (PVC), viele Zwischenprodukte für die Herstellung von Kunststoffen und andere Endprodukte, die das Element nicht enthalten. Als gängiges Desinfektionsmittel werden elementares Chlor und chlorerzeugende Verbindungen direkt in Schwimmbädern verwendet, um diese hygienisch zu halten. Elementares Chlor ist in hohen Konzentrationen extrem gefährlich und für die meisten Lebewesen giftig. Als chemischer Kampfstoff wurde Chlor erstmals im Ersten Weltkrieg als Giftgaswaffe eingesetzt. ⓘ
In Form von Chloridionen ist Chlor für alle bekannten Lebensformen notwendig. Andere Arten von Chlorverbindungen sind in lebenden Organismen selten, und künstlich hergestellte chlorierte organische Verbindungen reichen von inert bis giftig. In der oberen Atmosphäre werden chlorhaltige organische Moleküle wie Fluorchlorkohlenwasserstoffe mit dem Abbau der Ozonschicht in Verbindung gebracht. Geringe Mengen elementaren Chlors entstehen durch die Oxidation von Chloridionen in den Neutrophilen als Teil einer Reaktion des Immunsystems gegen Bakterien. ⓘ
In der Natur kommt Chlor nicht elementar, sondern nur gebunden in verschiedenen Verbindungen vor. Die wichtigsten Verbindungen sind die Chloride, in denen Chlor in Form des Anions Cl− auftritt. Das bekannteste Chlorid ist Natriumchlorid, häufig auch als Kochsalz oder kurz Salz bezeichnet. Chlorid ist ein häufiger Bestandteil des Meerwassers und besitzt wichtige biologische Funktionen, vor allem bei der Steuerung des Wasserhaushaltes im Körper. ⓘ
Das fast ausschließlich durch Elektrolyse gewonnene Chlor wird großteils für die Synthese chlorhaltiger Verbindungen wie des Vinylchlorids, eines Ausgangsprodukts für die Produktion des Kunststoffes PVC, eingesetzt. ⓘ
Geschichte
Die gebräuchlichste Chlorverbindung, Natriumchlorid, ist seit dem Altertum bekannt; Archäologen haben Beweise dafür gefunden, dass Steinsalz bereits 3000 v. Chr. und Sole bereits 6000 v. Chr. verwendet wurde. ⓘ
Frühe Entdeckungen
Um 900 experimentierten die Autoren der arabischen Schriften, die Dschabir ibn Hayyan (lateinisch: Geber) und dem persischen Arzt und Alchemisten Abu Bakr al-Razi (ca. 865-925, lateinisch: Rhazes) zugeschrieben werden, mit Sal Ammoniak (Ammoniumchlorid), das bei der Destillation zusammen mit Vitriol (hydratisierte Sulfate verschiedener Metalle) Chlorwasserstoff ergab. Es scheint jedoch, dass bei diesen frühen Experimenten mit Chlorsalzen die gasförmigen Produkte verworfen wurden, und Chlorwasserstoff wurde möglicherweise viele Male hergestellt, bevor man entdeckte, dass er chemisch verwendet werden kann. Eine der ersten derartigen Verwendungen war die Synthese von Quecksilber(II)-chlorid (ätzender Sublimat), dessen Herstellung durch Erhitzen von Quecksilber entweder mit Alaun und Ammoniumchlorid oder mit Vitriol und Natriumchlorid erstmals in De aluminibus et salibus ("Über Alaun und Salze") beschrieben wurde, einem arabischen Text aus dem elften oder zwölften Jahrhundert, der fälschlicherweise Abu Bakr al-Razi zugeschrieben und in der zweiten Hälfte des zwölften Jahrhunderts von Gerard von Cremona (1144-1187) ins Lateinische übersetzt wurde). Eine weitere wichtige Entwicklung war die Entdeckung von Pseudo-Geber (in De inventione veritatis, "Über die Entdeckung der Wahrheit", nach ca. 1300), dass durch Zugabe von Ammoniumchlorid zu Salpetersäure ein starkes Lösungsmittel hergestellt werden kann, das in der Lage ist, Gold aufzulösen (d. h. Königswasser). Obwohl Königswasser ein instabiles Gemisch ist, das ständig Dämpfe abgibt, die freies Chlorgas enthalten, scheint dieses Chlorgas bis etwa 1630 ignoriert worden zu sein, als seine Natur als separate gasförmige Substanz von dem flämischen Chemiker und Arzt Jan Baptist van Helmont erkannt wurde. ⓘ

Isolierung
Das Element wurde erstmals 1774 von dem schwedischen Chemiker Carl Wilhelm Scheele eingehend untersucht, und ihm wird die Entdeckung zugeschrieben. Scheele stellte Chlor durch Reaktion von MnO2 (in Form des Minerals Pyrolusit) mit HCl her:
- 4 HCl + MnO2 → MnCl2 + 2 H2O + Cl2 ⓘ
Scheele beobachtete mehrere Eigenschaften des Chlors: die bleichende Wirkung auf Lackmus, die tödliche Wirkung auf Insekten, die gelb-grüne Farbe und den dem Königswasser ähnlichen Geruch. Er nannte es "dephlogifizierte muriatische Säureluft", da es ein Gas ist (damals "Luft" genannt) und aus Salzsäure (damals "muriatische Säure" genannt) stammt. Es gelang ihm nicht, Chlor als Element nachzuweisen. ⓘ
Die damals gängige chemische Theorie besagte, dass eine Säure eine Verbindung ist, die Sauerstoff enthält (Reste davon sind in den deutschen und niederländischen Bezeichnungen für Sauerstoff erhalten geblieben: sauerstoff oder zuurstof, die beide ins Englische als acid substance übersetzt werden). Daher schlugen einige Chemiker, darunter Claude Berthollet, vor, dass Scheele's dephloginierte Mäusesäure-Luft eine Kombination aus Sauerstoff und dem noch unentdeckten Element Muriaticum sein müsse. ⓘ
Im Jahr 1809 versuchten Joseph Louis Gay-Lussac und Louis-Jacques Thénard, die dephloginierte Mursäure-Luft zu zersetzen, indem sie sie mit Holzkohle reagierten, um das freie Element Muriaticum (und Kohlendioxid) freizusetzen. Sie hatten keinen Erfolg und veröffentlichten einen Bericht, in dem sie die Möglichkeit in Betracht zogen, dass es sich bei dephloginierter muriatisierter Luft um ein Element handelt, aber nicht überzeugt waren. ⓘ
1810 versuchte Sir Humphry Davy dasselbe Experiment erneut und kam zu dem Schluss, dass es sich bei der Substanz um ein Element und nicht um eine Verbindung handelte. Am 15. November desselben Jahres gab er seine Ergebnisse der Royal Society bekannt. Damals nannte er dieses neue Element "Chlor", abgeleitet vom griechischen Wort χλωρος (chlōros, "grün-gelb"), in Anlehnung an seine Farbe. Der Name "Halogen", der so viel wie "Salzbildner" bedeutet, wurde ursprünglich 1811 von Johann Salomo Christoph Schweigger für Chlor verwendet. Später wurde dieser Begriff als Oberbegriff für alle Elemente der Chlor-Familie (Fluor, Brom, Jod) verwendet, nachdem Jöns Jakob Berzelius 1826 einen Vorschlag gemacht hatte. Im Jahr 1823 verflüssigte Michael Faraday zum ersten Mal Chlor und wies nach, dass das damals als festes Chlor" bezeichnete Element die Struktur von Chlorhydrat (Cl2-H2O) aufweist. ⓘ
Zunächst wurde Chlor überwiegend nach einem von Walter Weldon entwickelten Verfahren aus Salzsäure und Mangandioxid gewonnen. Da dies nicht sehr effektiv war, wurde es 1866 durch das von Henry Deacon entwickelte Deacon-Verfahren ersetzt. Dabei diente billiger Luftsauerstoff als Oxidationsmittel und Kupfer(II)-chlorid als Katalysator. Chlor wurde zwar schon 1800 erstmals elektrolytisch hergestellt, jedoch spielte dies bis zur Entwicklung der nötigen Generatoren durch Werner von Siemens Ende des 19. Jahrhunderts keine große Rolle. Seitdem sind elektrochemische Herstellungsverfahren die weitaus wichtigsten Produktionsverfahren von Chlor. ⓘ
Spätere Verwendungen
Chlorgas wurde erstmals 1785 von dem französischen Chemiker Claude Berthollet zum Bleichen von Textilien verwendet. Moderne Bleichmittel sind das Ergebnis weiterer Arbeiten von Berthollet, der 1789 in seinem Labor in der Stadt Javel (heute Teil von Paris, Frankreich) erstmals Natriumhypochlorit herstellte, indem er Chlorgas durch eine Natriumcarbonatlösung leitete. Die daraus resultierende Flüssigkeit, bekannt als "Eau de Javel" ("Javelwasser"), war eine schwache Lösung von Natriumhypochlorit. Dieses Verfahren war nicht sehr effizient, und es wurde nach alternativen Herstellungsmethoden gesucht. Der schottische Chemiker und Industrielle Charles Tennant stellte zunächst eine Lösung aus Kalziumhypochlorit ("Chlorkalk") und dann festes Kalziumhypochlorit (Bleichpulver) her. Diese Verbindungen produzierten geringe Mengen an elementarem Chlor und konnten effizienter transportiert werden als Natriumhypochlorit, das in verdünnten Lösungen verblieb, da es, wenn es gereinigt wurde, um Wasser zu entfernen, zu einem gefährlich starken und instabilen Oxidationsmittel wurde. Jahrhunderts ließ E. S. Smith ein Verfahren zur Herstellung von Natriumhypochlorit patentieren, bei dem durch Elektrolyse von Salzlauge Natriumhydroxid und Chlorgas erzeugt wurden, die sich dann zu Natriumhypochlorit vermischten. Dieses als Chloralkaliverfahren bekannte Verfahren wurde erstmals 1892 in industriellem Maßstab eingeführt und ist heute die Quelle für den größten Teil des elementaren Chlors und des Natriumhydroxids. 1884 entwickelte die Chemische Fabrik Griesheim in Deutschland ein weiteres Chloralkaliverfahren, das 1888 in die kommerzielle Produktion ging. ⓘ
In chemisch basischem Wasser gelöste elementare Chlorlösungen (Natrium- und Kalziumhypochlorit) wurden erstmals in den 1820er Jahren in Frankreich als Fäulnisbekämpfungs- und Desinfektionsmittel eingesetzt, lange bevor die Keimtheorie für Krankheiten aufgestellt wurde. Antoine-Germain Labarraque leistete hier Pionierarbeit, indem er Berthollets Bleichmittel "Javelwasser" und andere Chlorpräparate adaptierte (für eine ausführlichere Geschichte siehe unten). Seitdem hat elementares Chlor eine kontinuierliche Funktion in der örtlichen Antisepsis (Wundspüllösungen und ähnliches) und in der öffentlichen Hygiene, insbesondere im Schwimm- und Trinkwasserbereich. ⓘ
Chlorgas wurde erstmals am 22. April 1915 bei Ypern von der deutschen Armee als Waffe eingesetzt. Die Wirkung auf die Alliierten war verheerend, da die vorhandenen Gasmasken nur schwer einsetzbar waren und nicht flächendeckend verteilt wurden. ⓘ
Eigenschaften


Chlor ist das zweite Halogen und gehört als Nichtmetall zur Gruppe 17 des Periodensystems. Seine Eigenschaften sind daher ähnlich wie die von Fluor, Brom und Jod und liegen weitgehend zwischen denen der ersten beiden. Chlor hat die Elektronenkonfiguration [Ne]3s23p5, wobei die sieben Elektronen in der dritten und äußersten Schale als Valenzelektronen fungieren. Wie alle Halogene hat es also ein Elektron weniger als ein volles Oktett und ist daher ein starkes Oxidationsmittel, das mit vielen Elementen reagiert, um seine äußere Schale zu vervollständigen. Entsprechend den Tendenzen im Periodensystem liegt es in der Elektronegativität zwischen Fluor und Brom (F: 3,98, Cl: 3,16, Br: 2,96, I: 2,66) und ist weniger reaktiv als Fluor und reaktiver als Brom. Außerdem ist es ein schwächeres Oxidationsmittel als Fluor, aber ein stärkeres als Brom. Umgekehrt ist das Chloridion ein schwächeres Reduktionsmittel als Bromid, aber ein stärkeres als Fluorid. Sein Atomradius liegt zwischen dem von Fluor und Brom, was dazu führt, dass viele seiner atomaren Eigenschaften in ähnlicher Weise dem Trend von Jod zu Brom nach oben folgen, z. B. die erste Ionisierungsenergie, die Elektronenaffinität, die Dissoziationsenthalpie des X2-Moleküls (X = Cl, Br, I), der Ionenradius und die X-X-Bindungslänge. (Fluor ist aufgrund seiner geringen Größe anomal.) ⓘ
Alle vier stabilen Halogene unterliegen zwischenmolekularen van-der-Waals-Anziehungskräften, deren Stärke mit der Anzahl der Elektronen in allen homonuklearen zweiatomigen Halogenmolekülen zunimmt. Daher liegen die Schmelz- und Siedepunkte von Chlor zwischen denen von Fluor und Brom: Chlor schmilzt bei -101,0 °C und siedet bei -34,0 °C. Da das Molekulargewicht der Halogene in der Gruppe nach unten hin zunimmt, liegen die Dichte, die Schmelz- und die Verdampfungswärme von Chlor ebenfalls zwischen denen von Brom und Fluor, obwohl alle ihre Verdampfungswärmen aufgrund ihrer zweiatomigen Molekülstruktur recht niedrig sind (was zu einer hohen Flüchtigkeit führt). Die Farbe der Halogene wird mit absteigender Gruppe dunkler: während Fluor ein blassgelbes Gas ist, ist Chlor deutlich gelbgrün. Diese Tendenz ist darauf zurückzuführen, dass die Wellenlängen des sichtbaren Lichts, das von den Halogenen absorbiert wird, in der Gruppe nach unten hin zunehmen. Konkret ergibt sich die Farbe eines Halogens wie Chlor aus dem Elektronenübergang zwischen dem höchsten besetzten antibindenden πg-Molekülorbital und dem niedrigsten unbesetzten antibindenden σu-Molekülorbital. Die Farbe verblasst bei niedrigen Temperaturen, so dass festes Chlor bei -195 °C fast farblos ist. ⓘ
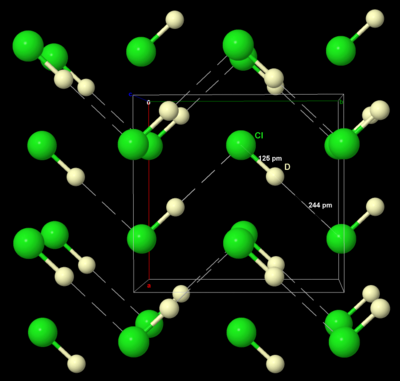
Wie festes Brom und Jod kristallisiert auch festes Chlor im orthorhombischen Kristallsystem, in einem Schichtgitter aus Cl2-Molekülen. Der Cl-Cl-Abstand beträgt 198 pm (nahe dem gasförmigen Cl-Cl-Abstand von 199 pm) und der Cl---Cl-Abstand zwischen den Molekülen beträgt 332 pm innerhalb einer Schicht und 382 pm zwischen den Schichten (zum Vergleich: der van der Waals-Radius von Chlor beträgt 180 pm). Diese Struktur bedeutet, dass Chlor ein sehr schlechter elektrischer Leiter ist, und seine Leitfähigkeit ist so gering, dass sie praktisch nicht messbar ist. ⓘ


Die Löslichkeit ist in verschiedenen Lösungsmitteln unterschiedlich ausgeprägt. In Wasser ist es unter teilweiser Dissoziation mäßig löslich, in einem Liter Wasser lassen sich etwa 2,3 Liter Chlor lösen. Die entstandene Lösung wird als Chlorwasser bezeichnet. Dagegen löst es sich gut in flüssigen chlorhaltigen Verbindungen, etwa Dischwefeldichlorid, Siliciumtetrachlorid und organischen Chlorverbindungen wie Chloroform. Auch in einigen organischen Lösungsmitteln wie Benzol, Essigsäure und Dimethylformamid lösen sich größere Mengen Chlor. ⓘ
Isotope
Chlor hat zwei stabile Isotope, 35Cl und 37Cl. Dies sind die einzigen beiden natürlichen Isotope, die in großen Mengen vorkommen. 35Cl macht 76 % des natürlichen Chlors aus, 37Cl die restlichen 24 %. Beide werden in Sternen durch Sauerstoff- und Siliziumverbrennungsprozesse synthetisiert. Beide haben einen Kernspin von 3/2+ und können daher für die kernmagnetische Resonanz verwendet werden, obwohl der Spin von mehr als 1/2 zu einer nicht kugelförmigen Kernladungsverteilung und damit zu einer Verbreiterung der Resonanz führt, da das Quadrupolmoment des Kerns nicht Null ist und eine quadrupolare Relaxation eintritt. Die anderen Chlorisotope sind alle radioaktiv und haben zu kurze Halbwertszeiten, um in der Natur primordial vorzukommen. Die im Labor am häufigsten verwendeten Isotope sind 36Cl (t1/2 = 3,0×105 y) und 38Cl (t1/2 = 37,2 min), die durch Neutronenaktivierung von natürlichem Chlor erzeugt werden können. ⓘ
Das stabilste Radioisotop des Chlors ist 36Cl. Der primäre Zerfallsmodus von Isotopen, die leichter als 35Cl sind, ist der Elektroneneinfang zu Schwefelisotopen; derjenige von Isotopen, die schwerer als 37Cl sind, ist der Betazerfall zu Argonisotopen; und 36Cl kann auf beiden Wegen zu stabilem 36S oder 36Ar zerfallen. 36Cl kommt in der Natur in Spuren als kosmogenes Nuklid in einem Verhältnis von etwa (7-10) × 10-13 zu 1 mit stabilen Chlorisotopen vor: Es entsteht in der Atmosphäre durch Spallation von 36Ar durch Wechselwirkung mit Protonen der kosmischen Strahlung. In den oberen Metern der Lithosphäre wird 36Cl hauptsächlich durch thermische Neutronenaktivierung von 35Cl und Spallation von 39K und 40Ca erzeugt. In der unterirdischen Umgebung gewinnt der Myoneneinfang durch 40Ca als Weg zur Erzeugung von 36Cl an Bedeutung. ⓘ
38Cl ist ein kurzlebiges Isotop mit einer Halbwertszeit von 37 Minuten und kann zum Beispiel durch Neutronenadsorption aus in Meerwasser enthaltenem 37Cl entstehen. In Flüssigsalzreaktoren welche mit Chloriden operieren (üblich sind allerdings Fluoride) kann die Reaktion von 37Cl zum radioaktive 38Cl problematisch sein, sodass für eine entsprechende Verwendung oft Isotopentrennung vorgeschlagen wird, um 35Cl anzureichern. ⓘ
Chemie und Verbindungen
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
Chlor liegt in seiner Reaktivität zwischen Fluor und Brom und ist eines der reaktivsten Elemente. Chlor ist ein schwächeres Oxidationsmittel als Fluor, aber ein stärkeres als Brom oder Jod. Dies geht aus den Standardelektrodenpotentialen der X2/X- Paare hervor (F, +2,866 V; Cl, +1,395 V; Br, +1,087 V; I, +0,615 V; At, etwa +0,3 V). Dieser Trend zeigt sich jedoch nicht in den Bindungsenergien, da Fluor aufgrund seiner geringen Größe, seiner geringen Polarisierbarkeit und seiner Unfähigkeit, Hypervalenz zu zeigen, eine Sonderstellung einnimmt. Ein weiterer Unterschied besteht darin, dass Chlor eine signifikante Chemie in positiven Oxidationsstufen aufweist, während Fluor dies nicht tut. Die Chlorierung führt oft zu höheren Oxidationsstufen als die Bromierung oder Jodierung, aber zu niedrigeren Oxidationsstufen als die Fluorierung. Chlor neigt dazu, mit Verbindungen, die M-M-, M-H- oder M-C-Bindungen enthalten, zu M-Cl-Bindungen zu reagieren. ⓘ
In Anbetracht der Tatsache, dass E°(1/2O2/H2O) = +1,229 V, also weniger als +1,395 V, beträgt, würde man erwarten, dass Chlor in der Lage sein sollte, Wasser zu Sauerstoff und Salzsäure zu oxidieren. Die Kinetik dieser Reaktion ist jedoch ungünstig, und es ist auch ein Blasenüberspannungseffekt zu berücksichtigen, so dass bei der Elektrolyse wässriger Chloridlösungen Chlorgas und nicht Sauerstoffgas entsteht, was für die industrielle Produktion von Chlor sehr nützlich ist. ⓘ
Chlorwasserstoff
Die einfachste Chlorverbindung ist Chlorwasserstoff (HCl), eine wichtige Chemikalie sowohl in der Industrie als auch im Labor, sowohl als Gas als auch in Wasser gelöst als Salzsäure. Sie wird häufig durch Verbrennung von Wasserstoffgas in Chlorgas oder als Nebenprodukt bei der Chlorierung von Kohlenwasserstoffen hergestellt. Ein anderer Ansatz ist die Behandlung von Natriumchlorid mit konzentrierter Schwefelsäure zur Herstellung von Salzsäure, auch bekannt als "Salzkuchen"-Verfahren:
- NaCl + H2SO4 NaHSO4 + HCl
- NaCl + NaHSO4 Na2SO4 + HCl
Im Labor kann Chlorwasserstoffgas durch Trocknen der Säure mit konzentrierter Schwefelsäure hergestellt werden. Deuteriumchlorid, DCl, kann durch Reaktion von Benzoylchlorid mit schwerem Wasser (D2O) hergestellt werden. ⓘ
Bei Raumtemperatur ist Chlorwasserstoff ein farbloses Gas, wie alle Halogenwasserstoffe mit Ausnahme von Fluorwasserstoff, da Wasserstoff keine starken Wasserstoffbrückenbindungen mit dem größeren elektronegativen Chloratom eingehen kann; in festem kristallinem Chlorwasserstoff sind jedoch bei niedrigen Temperaturen schwache Wasserstoffbrückenbindungen vorhanden, ähnlich wie in der Fluorwasserstoffstruktur, bevor mit steigender Temperatur Unordnung herrscht. Salzsäure ist eine starke Säure (pKa = -7), da die Wasserstoffbrücken zum Chlor zu schwach sind, um die Dissoziation zu verhindern. Das System HCl/H2O hat viele Hydrate HCl-nH2O für n = 1, 2, 3, 4 und 6. Jenseits einer 1:1-Mischung von HCl und H2O trennt sich das System vollständig in zwei getrennte flüssige Phasen. Salzsäure bildet ein Azeotrop mit einem Siedepunkt von 108,58 °C bei 20,22 g HCl pro 100 g Lösung; daher kann Salzsäure nicht über diesen Punkt hinaus durch Destillation konzentriert werden. ⓘ
Im Gegensatz zu Fluorwasserstoff ist wasserfreier, flüssiger Chlorwasserstoff als Lösungsmittel schwierig zu handhaben, da sein Siedepunkt niedrig ist, er einen kleinen Flüssigkeitsbereich hat, seine Dielektrizitätskonstante niedrig ist und er nicht nennenswert in H2Cl+ und HCl-
2-Ionen dissoziiert - letztere sind aufgrund des sehr schwachen Wasserstoffs ohnehin viel weniger stabil als die Bifluorid-Ionen (HF-
2), da die Wasserstoffbrückenbindung zwischen Wasserstoff und Chlor sehr schwach ist. Seine Salze mit sehr großen und schwach polarisierenden Kationen wie Cs+ und NR+
4 (R = Me, Et, Bun) noch isoliert werden können. Wasserfreier Chlorwasserstoff ist ein schlechtes Lösungsmittel, das nur in der Lage ist, kleinmolekulare Verbindungen wie Nitrosylchlorid und Phenol oder Salze mit sehr niedrigen Gitterenergien wie Tetraalkylammoniumhalogenide zu lösen. Es protoniert leicht Elektrophile mit Einzelpaaren oder π-Bindungen. Solvolysen, Ligandenersatzreaktionen und Oxidationen sind in Chlorwasserstofflösung gut charakterisiert:
- Ph3SnCl + HCl ⟶ Ph2SnCl2 + PhH (Solvolyse)
- Ph3COH + 3 HCl ⟶ Ph
3C+
HCl-
2 + H3O+Cl- (Solvolyse) - Me
4N+
HCl-
2 + BCl3 ⟶ Me
4N+
BCl-
4 + HCl (Ligandenersatz) - PCl3 + Cl2 + HCl ⟶ PCl+
4HCl-
2 (Oxidation) ⓘ
Andere binäre Chloride

Nahezu alle Elemente im Periodensystem bilden binäre Chloride. Die Ausnahmen sind deutlich in der Minderheit und haben jeweils eine von drei Ursachen: extreme Trägheit und mangelnde Bereitschaft, an chemischen Reaktionen teilzunehmen (die Edelgase, mit Ausnahme von Xenon in den sehr instabilen XeCl2 und XeCl4); extreme nukleare Instabilität, die chemische Untersuchungen vor dem Zerfall und der Transmutation erschwert (viele der schwersten Elemente jenseits von Wismut); und eine Elektronegativität, die höher ist als die des Chlors (Sauerstoff und Fluor), so dass die entstehenden binären Verbindungen formal keine Chloride, sondern Chloroxide oder -fluoride sind. Obwohl der Stickstoff in NCl3 eine negative Ladung trägt, wird die Verbindung gewöhnlich als Stickstofftrichlorid bezeichnet. ⓘ
Die Chlorierung von Metallen mit Cl2 führt in der Regel zu einer höheren Oxidationsstufe als die Bromierung mit Br2, wenn mehrere Oxidationsstufen vorhanden sind, wie z. B. bei MoCl5 und MoBr3. Chloride können durch Reaktion eines Elements oder seines Oxids, Hydroxids oder Karbonats mit Salzsäure hergestellt werden, die dann bei mäßig hohen Temperaturen und entweder unter niedrigem Druck oder mit wasserfreiem Chlorwasserstoffgas dehydriert wird. Diese Methoden funktionieren am besten, wenn das Chloridprodukt hydrolysestabil ist; andernfalls kommen die oxidative Hochtemperaturchlorierung des Elements mit Chlor oder Chlorwasserstoff, die Hochtemperaturchlorierung eines Metalloxids oder eines anderen Halogenids durch Chlor, ein flüchtiges Metallchlorid, Tetrachlorkohlenstoff oder ein organisches Chlorid in Frage. So reagiert beispielsweise Zirkoniumdioxid mit Chlor unter Standardbedingungen zu Zirkoniumtetrachlorid, und Urantrioxid reagiert mit Hexachlorpropen unter Rückfluss zu Urantetrachlorid. Das zweite Beispiel beinhaltet ebenfalls eine Verringerung der Oxidationsstufe, die ebenfalls durch Reduktion eines höheren Chlorids mit Wasserstoff oder einem Metall als Reduktionsmittel erreicht werden kann. Dies kann auch durch thermische Zersetzung oder Disproportionierung wie folgt erreicht werden:
- EuCl3 + 1/2 H2 ⟶ EuCl2 + HCl
- ReCl5 ReCl3 + Cl2
- AuCl3 AuCl + Cl2 ⓘ
Die meisten Chloride der Metalle der Gruppen 1, 2 und 3 sowie der Lanthaniden und Actiniden in den Oxidationsstufen +2 und +3 sind meist ionisch, während die Nichtmetalle eher kovalente Molekülchloride bilden, ebenso wie die Metalle in den hohen Oxidationsstufen ab +3 und darüber. Silberchlorid ist in Wasser sehr unlöslich und wird daher häufig als qualitativer Test für Chlor verwendet. ⓘ
Elementares Chlor wirkt oxidierend und kann mit pflanzlichem und tierischem Gewebe reagieren. Es ist dementsprechend toxisch und hat keine biologische Bedeutung. Ebenfalls stark oxidierend wirkend und damit ohne biologische Funktionen sind Chlorverbindungen in hohen Oxidationsstufen wie etwa Chloroxide und Chlorsauerstoffsäuren. ⓘ
Von biologischer Bedeutung ist das Element in Form des Chlorid-Anions. Chlorid ist essentiell und eines der häufigeren Bestandteile des Körpers. So enthält ein durchschnittlicher menschlicher Körper von etwa 70 kg 95 g Chlorid. Der größte Teil des Chlorids befindet sich als Gegenion zu Natrium gelöst im Extrazellularraum, so besitzt Blutplasma eine Chloridkonzentration von 100–107 mmol/l. Chlorid beeinflusst maßgeblich den osmotischen Druck und damit den Wasserhaushalt des Körpers. Weiterhin dient Chlorid zum Ladungsausgleich bei Austausch von Ionen in Zellen hinein und aus diesen heraus. Dies spielt beispielsweise beim Transport von Kohlenstoffdioxid als Hydrogencarbonat eine Rolle. Für diesen Ausgleich und die Wiederherstellung des Ruhemembranpotentials dienen Chloridkanäle, durch die Chlorid-Ionen die Zellmembranen passieren können. ⓘ
Eine besonders hohe Chloridkonzentration enthält der Magensaft, da dort neben den Chloridionen überwiegend Oxonium-Ionen vorliegen, ist die Magensäure eine Salzsäure mit einer Konzentration von etwa 0,1 mol/l. ⓘ
Aufgenommen wird das Chlorid überwiegend als Natriumchlorid im Speisesalz. Die empfohlene tägliche Menge für die Aufnahme von Chlorid liegt bei 3,2 g für Erwachsene und 0,5 g für Säuglinge. ⓘ

Anorganische Verbindungen, in denen das Chlor in der Oxidationsstufe −1 und damit als Anion vorliegt, werden Chloride genannt. Diese leiten sich von der gasförmigen Wasserstoffverbindung Chlorwasserstoff (HCl) ab. Diese ist eine starke Säure und gibt in wässrigen Lösungen leicht das Proton ab. Diese wässrige Lösung wird als Salzsäure bezeichnet. Salzsäure ist eine der technisch wichtigsten Säuren und wird in großen Mengen verwendet. Chloride sind in der Regel gut wasserlöslich, Ausnahmen sind Silberchlorid, Quecksilber(I)-chlorid und Blei(II)-chlorid. ⓘ
Polychlorige Verbindungen
Obwohl Dichlor ein starkes Oxidationsmittel mit einer hohen ersten Ionisierungsenergie ist, kann es unter extremen Bedingungen oxidiert werden und das Cl+
2-Kation oxidiert werden. Dieses ist sehr instabil und wurde bisher nur durch sein elektronisches Bandspektrum charakterisiert, wenn es in einer Niederdruckentladungsröhre erzeugt wurde. Das gelbe Cl+
3-Kation ist stabiler und kann wie folgt hergestellt werden:
- Cl2 + ClF + AsF5 Cl+
3AsF-
6
Diese Reaktion wird in dem oxidierenden Lösungsmittel Arsenpentafluorid durchgeführt. Das Trichloridanion, Cl-
3, wurde ebenfalls charakterisiert; es ist analog zum Triiodid. ⓘ
Chlorfluoride
Die drei Fluoride des Chlors bilden eine Untergruppe der Interhalogenverbindungen, die alle diamagnetisch sind. Es sind einige kationische und anionische Derivate bekannt, wie z. B. ClF-
2, ClF-
4, ClF+
2 und Cl2F+. Auch einige Pseudohalogenide des Chlors sind bekannt, z. B. Chlorcyan (ClCN, linear), Chlorcyanat (ClNCO), Chlorthiocyanat (ClSCN, im Gegensatz zu seinem Sauerstoffgegenstück) und Chlorazid (ClN3). ⓘ
Chlormonofluorid (ClF) ist thermisch äußerst stabil und wird im Handel in 500-Gramm-Stahlflaschen angeboten. Es ist ein farbloses Gas, das bei -155,6 °C schmilzt und bei -100,1 °C siedet. Es kann durch die Richtung seiner Elemente bei 225 °C hergestellt werden, muss dann aber von Chlortrifluorid und seinen Reaktionspartnern getrennt und gereinigt werden. Seine Eigenschaften liegen meist zwischen denen von Chlor und Fluor. Es reagiert mit vielen Metallen und Nichtmetallen ab Raumtemperatur und darüber, wobei es diese fluoriert und Chlor freisetzt. Es wirkt auch als Chlorfluorierungsmittel, indem es Chlor und Fluor über eine Mehrfachbindung oder durch Oxidation hinzufügt: So greift es beispielsweise Kohlenmonoxid an und bildet Carbonylchlorfluorid, COFCl. Es reagiert analog mit Hexafluoraceton, (CF3)2CO, mit einem Kaliumfluorid-Katalysator zur Bildung von Heptafluorisopropylhypochlorit, (CF3)2CFOCl; mit Nitrilen RCN zur Bildung von RCF2NCl2; und mit den Schwefeloxiden SO2 und SO3 zur Bildung von ClSO2F bzw. ClOSO2F. Es reagiert auch exotherm mit Verbindungen, die -OH- und -NH-Gruppen enthalten, wie z. B. Wasser:
- H2O + 2 ClF ⟶ 2 HF + Cl2O ⓘ
Chlortrifluorid (ClF3) ist eine flüchtige farblose molekulare Flüssigkeit, die bei -76,3 °C schmilzt und bei 11,8 °C siedet. Es kann durch direkte Fluorierung von gasförmigem Chlor oder Chlormonofluorid bei 200-300 °C gebildet werden. Die Liste der Elemente, die es in Brand setzt, ist vielfältig und enthält Wasserstoff, Kalium, Phosphor, Arsen, Antimon, Schwefel, Selen, Tellur, Brom, Jod sowie pulverförmiges Molybdän, Wolfram, Rhodium, Iridium und Eisen. Es entzündet auch Wasser und viele Stoffe, die unter normalen Umständen als chemisch inert gelten würden, wie Asbest, Beton, Glas und Sand. Beim Erhitzen korrodiert es sogar Edelmetalle wie Palladium, Platin und Gold, und selbst die Edelgase Xenon und Radon entkommen der Fluorierung nicht. Natrium, Magnesium, Aluminium, Zink, Zinn und Silber bilden eine undurchlässige Fluoridschicht, die durch Erhitzen entfernt werden kann. In der Regel werden Nickel-, Kupfer- und Stahlbehälter verwendet, da sie sehr widerstandsfähig gegenüber Chlortrifluorid sind, was auf die Bildung einer nicht reaktiven Metallfluoridschicht zurückzuführen ist. Die Reaktion von Chlortrifluorid mit Hydrazin zur Bildung von Fluorwasserstoff, Stickstoff und Chlorgas wurde in experimentellen Raketentriebwerken verwendet, hat jedoch Probleme, die hauptsächlich auf seine extreme Hypergolizität zurückzuführen sind, die zu einer Zündung ohne messbare Verzögerung führt. Heute wird es vor allem in der Kernbrennstoffaufbereitung verwendet, um Uran zu Uranhexafluorid zu oxidieren und es von Plutonium zu trennen, sowie in der Halbleiterindustrie, wo es zur Reinigung von Kammern für die chemische Gasphasenabscheidung eingesetzt wird. Es kann als Fluoridionendonator oder -akzeptor (Lewis-Base oder Säure) wirken, obwohl es nicht nennenswert in ClF+
2 und ClF-
4-Ionen. ⓘ
Chlorpentafluorid (ClF5) wird in großem Maßstab durch direkte Fluorierung von Chlor mit überschüssigem Fluorgas bei 350 °C und 250 atm und in kleinem Maßstab durch Reaktion von Metallchloriden mit Fluorgas bei 100-300 °C hergestellt. Es schmilzt bei -103 °C und siedet bei -13,1 °C. Es ist ein sehr starkes Fluorierungsmittel, wenngleich es nicht so wirksam ist wie Chlortrifluorid. Es wurden nur wenige spezifische stöchiometrische Reaktionen charakterisiert. Arsenpentafluorid und Antimonpentafluorid bilden ionische Addukte der Form [ClF4]+[MF6]- (M = As, Sb) und Wasser reagiert heftig wie folgt:
- 2 H2O + ClF5 ⟶ 4 HF + FClO2 ⓘ
Das Produkt, Chlorylfluorid, ist eines der fünf bekannten Chloroxidfluoride. Diese reichen vom thermisch instabilen FClO bis zum chemisch unreaktiven Perchlorylfluorid (FClO3), die anderen drei sind FClO2, F3ClO und F3ClO2. Alle fünf verhalten sich strukturell und chemisch ähnlich wie die Chlorfluoride und können als Lewis-Säuren oder -Basen durch Aufnahme bzw. Abgabe von Fluoridionen oder als sehr starke Oxidations- und Fluorierungsmittel wirken. ⓘ
Chloroxide


Die Chloroxide sind trotz ihrer Instabilität (alle sind endotherme Verbindungen) gut erforscht. Sie sind wichtig, weil sie bei der Photolyse von Fluorchlorkohlenwasserstoffen in der oberen Atmosphäre entstehen und die Zerstörung der Ozonschicht verursachen. Keine dieser Verbindungen kann durch direkte Reaktion der Elemente hergestellt werden. ⓘ
Dichlormonoxid (Cl2O) ist ein bräunlich-gelbes Gas (in festem oder flüssigem Zustand rot-braun), das durch Reaktion von Chlorgas mit gelbem Quecksilber(II)-oxid gewonnen werden kann. Es ist sehr gut wasserlöslich und befindet sich im Gleichgewicht mit unterchloriger Säure (HOCl), deren Anhydrid es ist. Es ist daher ein wirksames Bleichmittel und wird meist zur Herstellung von Hypochloriten verwendet. Es explodiert bei Erhitzung, Funkenbildung oder in Gegenwart von Ammoniakgas. ⓘ
Chlordioxid (ClO2) war das erste Chloroxid, das 1811 von Humphry Davy entdeckt wurde. Es ist ein gelbes, paramagnetisches Gas (tiefrot als Feststoff oder Flüssigkeit), wie es aufgrund der ungeraden Elektronenzahl zu erwarten ist: Es ist aufgrund der Delokalisierung des ungepaarten Elektrons stabil gegenüber Dimerisierung. Es explodiert oberhalb von -40 °C als Flüssigkeit und unter Druck als Gas und muss daher in niedrigen Konzentrationen für die Holzbleiche und Wasseraufbereitung hergestellt werden. Normalerweise wird es durch Reduktion eines Chlorats wie folgt hergestellt:
- ClO-
3 + Cl- + 2 H+ ⟶ ClO2 + 1/2 Cl2 + H2O
Seine Bildung ist also eng mit den Redoxreaktionen der Chloroxosäuren verbunden. Es ist ein starkes Oxidationsmittel und reagiert mit Schwefel, Phosphor, Phosphorhalogeniden und Kaliumborhydrid. Es löst sich exotherm in Wasser und bildet dunkelgrüne Lösungen, die sich in der Dunkelheit sehr langsam zersetzen. Die kristallinen Clathrathydrate ClO2-nH2O (n ≈ 6-10) spalten sich bei niedrigen Temperaturen ab. In Gegenwart von Licht zersetzen sich diese Lösungen jedoch rasch unter Bildung eines Gemischs aus Chlor- und Salzsäure. Bei der Photolyse einzelner ClO2-Moleküle entstehen die Radikale ClO und ClOO, während bei Raumtemperatur hauptsächlich Chlor, Sauerstoff und etwas ClO3 und Cl2O6 gebildet werden. Cl2O3 entsteht auch, wenn der Feststoff bei -78 °C photolysiert wird: Es handelt sich um einen dunkelbraunen Feststoff, der unter 0 °C explodiert. Das ClO-Radikal führt zum Abbau des atmosphärischen Ozons und ist daher für die Umwelt wie folgt wichtig:
- Cl- + O3 ⟶ ClO- + O2
- ClO- + O- ⟶ Cl- + O2 ⓘ
Chlorperchlorat (ClOClO3) ist eine blassgelbe Flüssigkeit, die weniger stabil ist als ClO2 und sich bei Raumtemperatur unter Bildung von Chlor, Sauerstoff und Dichlorhexoxid (Cl2O6) zersetzt. Chlorperchlorat kann auch als Chlorderivat der Perchlorsäure (HOClO3) betrachtet werden, ähnlich wie die thermisch instabilen Chlorderivate anderer Oxosäuren: Beispiele sind Chlornitrat (ClONO2, heftig reaktiv und explosiv) und Chlorfluorsulfat (ClOSO2F, stabiler, aber immer noch feuchtigkeitsempfindlich und hochreaktiv). Dichlorhexoxid ist eine dunkelrote Flüssigkeit, die bei -180 °C zu einem gelben Feststoff gefriert: Es wird normalerweise durch Reaktion von Chlordioxid mit Sauerstoff hergestellt. Trotz der Versuche, es als Dimer von ClO3 zu bezeichnen, reagiert es eher wie Chlorylperchlorat, [ClO2]+[ClO4]-, was sich als die korrekte Struktur des Feststoffs bestätigt hat. Es hydrolysiert in Wasser zu einem Gemisch aus Chlor- und Perchlorsäure; die analoge Reaktion mit wasserfreiem Fluorwasserstoff verläuft nicht vollständig. ⓘ
Dichlorheptoxid (Cl2O7) ist das Anhydrid der Perchlorsäure (HClO4) und kann leicht durch Dehydratisierung mit Phosphorsäure bei -10 °C und anschließender Destillation des Produkts bei -35 °C und 1 mmHg gewonnen werden. Es handelt sich um eine stoßempfindliche, farblose, ölige Flüssigkeit. Es ist das am wenigsten reaktive der Chloroxide, da es als einziges bei Zimmertemperatur organische Materialien nicht in Brand setzt. Es kann in Wasser zur Regeneration von Perchlorsäure oder in wässrigen Alkalien zur Regeneration von Perchloraten gelöst werden. Es zersetzt sich jedoch thermisch explosionsartig durch Aufbrechen einer der zentralen Cl-O-Bindungen, wobei die Radikale ClO3 und ClO4 entstehen, die sich über Zwischenoxide sofort in die Elemente zersetzen. ⓘ
Chloroxosäuren und Oxyanionen
| E°(Paar) | a(H+) = 1 (Säure) |
E°(Paar) | a(OH-) = 1 (Base) ⓘ |
|---|---|---|---|
| Cl2/Cl- | +1.358 | Cl2/Cl- | +1.358 |
| HOCl/Cl- | +1.484 | ClO-/Cl- | +0.890 |
| ClO- 3/Cl- |
+1.459 | ||
| HOCl/Cl2 | +1.630 | ClO-/Cl2 | +0.421 |
| HClO2/Cl2 | +1.659 | ||
| ClO- 3/Cl2 |
+1.468 | ||
| ClO- 4/Cl2 |
+1.277 | ||
| HClO2/HOCl | +1.701 | ClO- 2/ClO- |
+0.681 |
| ClO- 3/ClO- |
+0.488 | ||
| ClO- 3/HClO2 |
+1.181 | ClO- 3/ClO- 2 |
+0.295 |
| ClO- 4/ClO- 3 |
+1.201 | ClO- 4/ClO- 3 |
+0.374 |
Chlor bildet vier Oxosäuren: hypochlorige Säure (HOCl), chlorige Säure (HOClO), Chlorsäure (HOClO2) und Perchlorsäure (HOClO3). Wie aus den Redoxpotentialen in der nebenstehenden Tabelle ersichtlich ist, ist Chlor in sauren Lösungen wesentlich stabiler gegenüber Disproportionierung als in alkalischen Lösungen:
ⓘCl2 + H2O ⇌ HOCl + H+ + Cl- Kac = 4,2 × 10-4 mol2 l-2 Cl2 + 2 OH- ⇌ OCl- + H2O + Cl- Kalk = 7,5 × 1015 mol-1 l
Die Hypochlorit-Ionen disproportionieren auch weiter, um Chlorid und Chlorat zu erzeugen (3 ClO- ⇌ 2 Cl- + ClO-
3), aber diese Reaktion ist bei Temperaturen unter 70 °C recht langsam, trotz der sehr günstigen Gleichgewichtskonstante von 1027. Die Chlorat-Ionen können sich selbst disproportionieren und Chlorid und Perchlorat bilden (4 ClO-
3 ⇌ Cl- + 3 ClO-
4), was jedoch trotz der sehr günstigen Gleichgewichtskonstante von 1020 selbst bei 100 °C sehr langsam verläuft. Die Reaktionsgeschwindigkeiten für die Chloroxyanionen steigen mit abnehmender Oxidationsstufe des Chlors. Die Stärken der Chloroxosäuren nehmen mit zunehmender Oxidationsstufe des Chlors sehr schnell zu, da sich die Ladung auf immer mehr Sauerstoffatome in ihren konjugierten Basen verlagert. ⓘ
Die meisten Chloroxosäuren lassen sich durch Ausnutzung dieser Disproportionierungsreaktionen herstellen. Hypochlorige Säure (HOCl) ist hochreaktiv und recht instabil; ihre Salze werden hauptsächlich wegen ihrer bleichenden und sterilisierenden Eigenschaften verwendet. Sie ist ein sehr starkes Oxidationsmittel, das auf die meisten anorganischen Stoffe ein Sauerstoffatom überträgt. Chlorsäure (HOClO) ist noch instabiler und kann nicht isoliert oder konzentriert werden, ohne sich zu zersetzen: Sie ist aus der Zersetzung von wässrigem Chlordioxid bekannt. Natriumchlorit ist jedoch ein stabiles Salz und wird zum Bleichen und Abbeizen von Textilien, als Oxidationsmittel und als Chlordioxidquelle verwendet. Chlorsäure (HOClO2) ist eine starke Säure, die in kaltem Wasser bis zu einer Konzentration von 30 % recht stabil ist, bei Erwärmung jedoch Chlor und Chlordioxid bildet. Durch Verdampfen unter vermindertem Druck kann sie weiter auf etwa 40 % konzentriert werden, zerfällt dann aber in Perchlorsäure, Chlor, Sauerstoff, Wasser und Chlordioxid. Sein wichtigstes Salz ist Natriumchlorat, das meist zur Herstellung von Chlordioxid zum Bleichen von Zellstoff verwendet wird. Die Zersetzung von Chlorat zu Chlorid und Sauerstoff ist eine gängige Methode, um im Labor in kleinem Maßstab Sauerstoff zu erzeugen. Chlorid und Chlorat können sich zu Chlor wie folgt proportional verhalten:
- ClO-
3 + 5 Cl- + 6 H+ ⟶ 3 Cl2 + 3 H2O ⓘ
Perchlorate und Perchlorsäure (HOClO3) sind die stabilsten Oxoverbindungen des Chlors, was der Tatsache entspricht, dass Chlorverbindungen am stabilsten sind, wenn das Chloratom in der niedrigsten (-1) oder höchsten (+7) Oxidationsstufe vorliegt. Perchlorsäure und wässrige Perchlorate sind beim Erhitzen starke und manchmal heftige Oxidationsmittel, was in krassem Gegensatz zu ihrer meist inaktiven Natur bei Raumtemperatur steht, da die Aktivierungsenergie für diese Reaktionen aus kinetischen Gründen hoch ist. Perchlorate werden durch elektrolytische Oxidation von Natriumchlorat hergestellt, und Perchlorsäure wird durch Reaktion von wasserfreiem Natriumperchlorat oder Bariumperchlorat mit konzentrierter Salzsäure hergestellt, wobei das ausgefallene Chlorid abfiltriert und das Filtrat destilliert wird, um es zu konzentrieren. Wasserfreie Perchlorsäure ist eine farblose, bewegliche, schockempfindliche Flüssigkeit, die bei Kontakt mit den meisten organischen Verbindungen explodiert, Jodwasserstoff und Thionylchlorid in Brand setzt und sogar Silber und Gold oxidiert. Obwohl sie ein schwacher Ligand ist, schwächer als Wasser, sind einige Verbindungen mit koordiniertem ClO-
4 sind bekannt. ⓘ
| Oxidationsstufe des Chlors | −1 | +1 | +3 | +5 | +7 ⓘ |
|---|---|---|---|---|---|
| Bezeichnung | Chlorid | Hypochlorit | Chlorit | Chlorat | Perchlorat |
| Formel | Cl- | ClO- | ClO- 2 |
ClO- 3 |
ClO- 4 |
| Struktur | 
|

|

|
Chlororganische Verbindungen

Wie die anderen Kohlenstoff-Halogen-Bindungen ist auch die C-Cl-Bindung eine häufige funktionelle Gruppe, die zum Kernbereich der organischen Chemie gehört. Formal können Verbindungen mit dieser funktionellen Gruppe als organische Derivate des Chloridanions betrachtet werden. Aufgrund der unterschiedlichen Elektronegativität von Chlor (3,16) und Kohlenstoff (2,55) ist der Kohlenstoff in einer C-Cl-Bindung elektronenarm und somit elektrophil. Die Chlorierung verändert die physikalischen Eigenschaften von Kohlenwasserstoffen auf verschiedene Weise: Chlorkohlenwasserstoffe sind in der Regel dichter als Wasser, da Chlor ein höheres Atomgewicht hat als Wasserstoff, und aliphatische Organochloride sind Alkylierungsmittel, da Chlorid eine Abgangsgruppe ist. ⓘ
Alkane und Arylalkane können unter freiradikalischen Bedingungen mit UV-Licht chloriert werden. Das Ausmaß der Chlorierung ist jedoch schwer zu kontrollieren: Die Reaktion ist nicht regioselektiv und führt häufig zu einem Gemisch verschiedener Isomere mit unterschiedlichem Chlorierungsgrad, was jedoch zulässig ist, wenn sich die Produkte leicht trennen lassen. Arylchloride können durch die Friedel-Crafts-Halogenierung unter Verwendung von Chlor und einem Lewis-Säure-Katalysator hergestellt werden. Die Haloform-Reaktion, bei der Chlor und Natriumhydroxid verwendet werden, kann auch Alkylhalogenide aus Methylketonen und verwandten Verbindungen erzeugen. Chlor fügt sich auch an die Mehrfachbindungen von Alkenen und Alkinen an, wodurch Di- oder Tetra-Chlorverbindungen entstehen. Aufgrund der hohen Kosten und der Reaktivität von Chlor werden chlororganische Verbindungen jedoch eher mit Chlorwasserstoff oder mit Chlorierungsmitteln wie Phosphorpentachlorid (PCl5) oder Thionylchlorid (SOCl2) hergestellt. Letzteres ist im Labor sehr praktisch, da alle Nebenprodukte gasförmig sind und nicht abdestilliert werden müssen. ⓘ
Viele chlororganische Verbindungen wurden aus natürlichen Quellen isoliert, die von Bakterien bis zum Menschen reichen. Chlorierte organische Verbindungen finden sich in fast jeder Klasse von Biomolekülen, darunter Alkaloide, Terpene, Aminosäuren, Flavonoide, Steroide und Fettsäuren. Organochloride, darunter auch Dioxine, entstehen in der Hochtemperaturumgebung von Waldbränden, und Dioxine wurden in der konservierten Asche von durch Blitzschlag ausgelösten Bränden gefunden, die vor den synthetischen Dioxinen entstanden sind. Darüber hinaus wurde eine Vielzahl einfacher Chlorkohlenwasserstoffe, darunter Dichlormethan, Chloroform und Tetrachlorkohlenstoff, aus Meeresalgen isoliert. Ein Großteil des Chlormethans in der Umwelt wird auf natürliche Weise durch biologische Zersetzung, Waldbrände und Vulkane erzeugt. ⓘ
Einige Arten von Organochloriden, wenn auch nicht alle, haben eine erhebliche Toxizität für Pflanzen oder Tiere, einschließlich des Menschen. Dioxine, die bei der Verbrennung von organischem Material in Gegenwart von Chlor entstehen, und einige Insektizide wie DDT sind persistente organische Schadstoffe, die eine Gefahr darstellen, wenn sie in die Umwelt freigesetzt werden. So reichert sich DDT, das Mitte des 20. Jahrhunderts in großem Umfang zur Insektenbekämpfung eingesetzt wurde, auch in der Nahrungskette an und verursacht bei bestimmten Vogelarten Fortpflanzungsprobleme (z. B. Ausdünnung der Eierschalen). Aufgrund der leichten homolytischen Spaltung der C-Cl-Bindung zur Bildung von Chlorradikalen in der oberen Atmosphäre wurden Fluorchlorkohlenwasserstoffe wegen der Schädigung der Ozonschicht schrittweise aus dem Verkehr gezogen. ⓘ
Vorkommen und Herstellung
Chlor ist eine der wichtigsten Grundchemikalien und zählt mit einer Menge von 58,9 Millionen Tonnen im Jahr 2006 zu den meistproduzierten Chemikalien. Technisch wird Chlor fast ausschließlich durch verschiedene elektrochemische Verfahren hergestellt, in kleinerem Maßstab kann es auch auf chemischem Weg gewonnen werden. Als Nebenprodukt fällt es bei der elektrochemischen Produktion von Natrium und Magnesium aus den entsprechenden Chloriden an. ⓘ
Ausgangsstoff für die Chloralkalielektrolyse ist eine wässrige Natriumchloridlösung. Aus dieser werden in verschiedenen Verfahren, die sich im Aufbau der Elektrolysezelle unterscheiden, Natronlauge und als Zwangsnebenprodukte Chlor sowie Wasserstoff erzeugt.
- Reaktionsgleichung für die Chloralkalielektrolyse ⓘ
Wichtig bei allen Verfahren zur Chlorproduktion ist, dass die Anode, an der das Chlor entsteht, von der Kathode, an der Wasserstoff und Hydroxidionen gebildet werden, getrennt ist. Wären diese in einem Gefäß vereinigt, würde sich das explosive Chlor-Wasserstoff-Gemisch Chlorknallgas bilden, sowie eine Reaktion von Chlor mit den Hydroxidionen zu Hypochlorit stattfinden.
Das in der Vergangenheit am häufigsten verwendete Verfahren ist das Diaphragmaverfahren (2001: 49 % Marktanteil; 2019 in Europa: 11,6 % Marktanteil). Die Trennung der Elektrodenräume erfolgt dabei durch ein Diaphragma aus Asbest, durch das zwar Natriumionen, nicht jedoch Chlorid- und Hydroxidionen diffundieren können. Allerdings lässt sich mit diesem Verfahren nur eine niedrig konzentrierte und nicht reine Natronlauge, sowie mit Sauerstoff verunreinigtes Chlor erzeugen. Auch ist die Verwendung des krebserregenden Asbestes problematisch. Deswegen wird es für neue Produktionsanlagen vom Membranverfahren abgelöst (2001: 28 % Marktanteil; 2019 in Europa: 83,3 % Marktanteil). Dieses ist wegen der Verwendung einer Kunststoffmembran aus Nafion anstatt des Asbest-Diaphragmas vom Gesundheitsschutz her günstiger und bietet einige technische Vorteile. So ist durch die Membran eine bessere Trennung von Anoden- und Kathodenraum gegeben und ermöglicht damit die Produktion einer reineren und höher konzentrierten Natronlauge. Allerdings ist das Chlor wie beim Diaphragma-Verfahren durch Sauerstoff verunreinigt, der in einer Nebenreaktion an der Anode entsteht. Nachteile des Verfahrens sind die hohen Kosten für die Membranen und die nötigen hohen Reinheiten für die Ausgangssubstanzen. ⓘ
Ein nur noch in geringem Maß eingesetztes Verfahren ist das Amalgamverfahren (2001: 18 % Marktanteil; 2019 in Europa: 5,1 % Marktanteil). Bei diesem werden Anoden- und Kathodenraum vollkommen getrennt. Dazu wird eine Quecksilber-Kathode eingesetzt, die auf Grund der hohen Überspannung ermöglicht, dass anstatt Wasserstoff zunächst Natrium gebildet wird, das als Natriumamalgam vorliegt. Das Amalgam wird in einer zweiten Zelle an Graphitkontakten mit Wasser umgesetzt. Dabei bilden sich Quecksilber, Natronlauge und Wasserstoff. Diese räumliche Trennung ermöglicht sehr reine Produkte. Der größte Nachteil ist die Verwendung des stark toxischen und umweltgefährlichen Quecksilbers, durch das aufwändige und teure Schutzmaßnahmen nötig werden. ⓘ
Es sind verschiedene Verfahren bekannt, mit denen durch chemische Oxidation aus Chlorwasserstoff Chlor hergestellt werden kann (Weldon-Verfahren und Deacon-Verfahren). Diese spielen für die Chlorproduktion nur eine geringe Rolle. Ein weiteres Beispiel ist das KEL-Chlor-Verfahren, bei dem der Chlorwasserstoff mit Schwefelsäure und Nitrosylschwefelsäure umgesetzt wird und das 1975 von DuPont entwickelt wurde. Der entscheidende Reaktionsschritt hierbei ist die Oxidation von Chlorwasserstoff mit Stickstoffdioxid, das in mehreren Teilreaktionen aus der Nitrosylschwefelsäure freigesetzt wird. Nach Erprobung in einer Versuchsanlage wurde das Verfahren jedoch wegen geringer Wirtschaftlichkeit und Materialproblemen wieder eingestellt. Weitere Prozesse beruhen auf Kupfer(II)-chlorid- oder Chrom(III)-oxid-Katalysatoren. ⓘ
Im Labormaßstab kann elementares Chlor unter anderem durch Ansäuern von Chlorkalk dargestellt werden, beispielsweise mit Schwefelsäure.

Chlor ist zu reaktiv, um als freies Element in der Natur vorzukommen, kommt aber in Form seiner Chloridsalze sehr häufig vor. Es ist das einundzwanzigsthäufigste Element in der Erdkruste und macht 126 Teile pro Million aus, und zwar durch die großen Ablagerungen von Chloridmineralen, insbesondere Natriumchlorid, die aus Gewässern verdampft wurden. All dies verblasst im Vergleich zu den Vorräten an Chloridionen im Meerwasser: Kleinere Mengen in höherer Konzentration kommen in einigen Binnenmeeren und unterirdischen Solequellen vor, wie dem Großen Salzsee in Utah und dem Toten Meer in Israel. ⓘ
Kleine Mengen Chlorgas werden im Labor durch die Kombination von Salzsäure und Mangandioxid hergestellt, aber aufgrund der leichten Verfügbarkeit ist dies nur selten erforderlich. In der Industrie wird elementares Chlor in der Regel durch die Elektrolyse von in Wasser gelöstem Natriumchlorid hergestellt. Diese Methode, das 1892 industrialisierte Chloralkaliverfahren, liefert heute den Großteil des industriellen Chlorgases. Neben Chlor erhält man bei diesem Verfahren Wasserstoffgas und Natriumhydroxid, das wertvollste Produkt. Der Prozess läuft nach der folgenden chemischen Gleichung ab:
- 2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH ⓘ
Die Elektrolyse von Chloridlösungen läuft nach folgenden Gleichungen ab:
- Kathode: 2 H2O + 2 e- → H2 + 2 OH-
- Anode: 2 Cl- → Cl2 + 2 e- ⓘ
Bei der Membranzellenelektrolyse wird eine durchlässige Membran als Ionenaustauscher verwendet. Gesättigte Natrium- (oder Kalium-) Chloridlösung wird durch den Anodenraum geleitet und verlässt diesen mit einer niedrigeren Konzentration. Bei diesem Verfahren wird ebenfalls sehr reines Natrium- (oder Kalium-) hydroxid erzeugt, es hat jedoch den Nachteil, dass bei hohen Konzentrationen sehr reine Sole benötigt wird. ⓘ

Für die Reaktion ist ein Katalysator erforderlich. Wie von Deacon eingeführt, basierten die ersten Katalysatoren auf Kupfer. Kommerzielle Verfahren, wie das Mitsui MT-Chlorine Process, sind auf Katalysatoren auf Chrom- und Rutheniumbasis umgestiegen. Das erzeugte Chlor ist in Flaschen mit einer Größe von 450 g bis 70 kg sowie in Fässern (865 kg), Kesselwagen (15 t auf der Straße; 27-90 t auf der Schiene) und Lastkähnen (600-1200 t) erhältlich. ⓘ
Anwendungen
Natriumchlorid ist die gebräuchlichste Chlorverbindung und die wichtigste Chlorquelle für den Bedarf der chemischen Industrie. Etwa 15.000 chlorhaltige Verbindungen werden kommerziell gehandelt, darunter so unterschiedliche Verbindungen wie chloriertes Methan, Ethane, Vinylchlorid, Polyvinylchlorid (PVC), Aluminiumtrichlorid für die Katalyse, Magnesium-, Titan-, Zirkonium- und Hafniumchloride, die die Vorstufen für die Herstellung der reinen Form dieser Elemente sind. ⓘ
Quantitativ gesehen werden etwa 63 % des gesamten produzierten elementaren Chlors für die Herstellung organischer Verbindungen und 18 % für die Herstellung anorganischer Chlorverbindungen verwendet. Etwa 15.000 Chlorverbindungen werden kommerziell genutzt. Die restlichen 19 % des produzierten Chlors werden für Bleichmittel und Desinfektionsprodukte verwendet. Die gemessen am Produktionsvolumen bedeutendsten organischen Verbindungen sind 1,2-Dichlorethan und Vinylchlorid, Zwischenprodukte bei der Herstellung von PVC. Andere besonders wichtige Organochlorine sind Methylchlorid, Methylenchlorid, Chloroform, Vinylidenchlorid, Trichlorethylen, Perchlorethylen, Allylchlorid, Epichlorhydrin, Chlorbenzol, Dichlorbenzole und Trichlorbenzole. Zu den wichtigsten anorganischen Verbindungen gehören HCl, Cl2O, HOCl, NaClO3, chlorierte Isocyanurate, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3 und ZnCl2. ⓘ
Hygiene, Desinfektion und Antisepsis
Bekämpfung der Fäulnis
In Frankreich (wie auch anderswo) wurden Tierdärme zur Herstellung von Musikinstrumentensaiten, Goldschlägerhaut und anderen Produkten verarbeitet. Dies geschah in "Darmfabriken" (Boyauderies) und war ein geruchsintensiver und ungesunder Prozess. Um 1820 lobte die Société d'encouragement pour l'industrie nationale einen Preis für die Entdeckung einer chemischen oder mechanischen Methode zur Abtrennung der Bauchfellmembran von Tierdärmen ohne Fäulnis aus. Den Preis erhielt Antoine-Germain Labarraque, ein 44-jähriger französischer Chemiker und Pharmazeut, der entdeckt hatte, dass Berthollets chlorierte Bleichlösungen ("Eau de Javel") nicht nur den Fäulnisgeruch der Zersetzung von tierischem Gewebe beseitigten, sondern die Zersetzung sogar verzögerten. ⓘ
Die Forschungen von Labarraque führten zur Verwendung von Chloriden und Hypochloriten aus Kalk (Calciumhypochlorit) und Natrium (Natriumhypochlorit) in den Boyauderien. Die gleichen Chemikalien erwiesen sich als nützlich für die routinemäßige Desinfektion und Desodorierung von Latrinen, Abwasserkanälen, Märkten, Schlachthöfen, anatomischen Theatern und Leichenhallen. Sie waren erfolgreich in Krankenhäusern, Lazaretten, Gefängnissen, Krankenstationen (sowohl an Land als auch auf See), Magnaneries, Ställen, Viehställen usw.; und sie waren nützlich bei Exhumierungen, Einbalsamierungen, Ausbrüchen von epidemischen Krankheiten, Fieber und Schwarzbeinigkeit bei Rindern. ⓘ
Desinfektion
Die Chlorkalk- und Sodalösungen von Labarraque werden seit 1828 zur Vorbeugung von Infektionen (so genannte "ansteckende Infektionen", die vermutlich durch "Miasmen" übertragen werden) und zur Behandlung der Fäulnis bestehender Wunden, einschließlich septischer Wunden, empfohlen. In seinem Werk von 1828 empfahl Labarraque den Ärzten, Chlor einzuatmen, ihre Hände in Chlorkalk zu waschen und bei "ansteckenden Infektionen" sogar Chlorkalk über die Betten der Patienten zu streuen. Im Jahr 1828 war die Ansteckung mit Infektionen bereits bekannt, auch wenn die Wirkung der Mikrobe erst mehr als ein halbes Jahrhundert später entdeckt wurde. ⓘ
Während der Pariser Choleraepidemie von 1832 wurden große Mengen des so genannten Chlorkalkes zur Desinfektion der Hauptstadt eingesetzt. Dabei handelte es sich nicht einfach um modernes Kalziumchlorid, sondern um Chlorgas, das in Kalkwasser (verdünntem Kalziumhydroxid) zu Kalziumhypochlorit (Chlorkalk) gelöst war. Labarraques Entdeckung trug dazu bei, den schrecklichen Gestank der Verwesung in Krankenhäusern und Seziersälen zu beseitigen und damit das Quartier Latin in Paris zu desodorieren. Diese "fauligen Miasmen" wurden von vielen als Ursache für die Ausbreitung von "Ansteckung" und "Infektion" angesehen - beides Begriffe, die vor der Keimtheorie der Infektion verwendet wurden. Chlorkalk wurde zur Vernichtung von Gerüchen und "fauligen Substanzen" verwendet. In einer Quelle wird behauptet, dass Dr. John Snow Chlorkalk verwendet hat, um das Wasser aus dem mit Cholera verseuchten Brunnen zu desinfizieren, der 1854 die Pumpe in der Broad Street in London speiste, obwohl drei andere seriöse Quellen, die diese berühmte Choleraepidemie beschreiben, diesen Vorfall nicht erwähnen. Aus einer Quelle geht hervor, dass Chlorkalk verwendet wurde, um die Abfälle und den Schmutz in den Straßen rund um die Pumpe in der Broad Street zu desinfizieren - eine gängige Praxis im England der Mitte des neunzehnten Jahrhunderts. ⓘ
Semmelweis und Experimente mit Antisepsis

Die vielleicht berühmteste Anwendung von Labarraques Chlor- und Basenlösungen fand 1847 statt, als Ignaz Semmelweis Chlorwasser (in reinem Wasser gelöstes Chlor, das billiger war als Chlorkalklösungen) zur Desinfektion der Hände österreichischer Ärzte verwendete, die, wie Semmelweis feststellte, immer noch den Gestank der Verwesung aus den Sektionsräumen in die Untersuchungsräume der Patienten trugen. Lange vor der Keimtheorie stellte Semmelweis die Theorie auf, dass "Kadaverpartikel" den Verwesungsgeruch von frischen medizinischen Kadavern auf lebende Patienten übertrugen, und er verwendete die bekannten "Labarraque'schen Lösungen" als einzige bekannte Methode zur Beseitigung des Verwesungsgeruchs und der Gewebezersetzung (die seiner Meinung nach mit Seife nicht erreicht werden konnte). Die Lösungen erwiesen sich als weitaus wirksamere Antiseptika als Seife (Semmelweis war sich ihrer größeren Wirksamkeit ebenfalls bewusst, aber nicht des Grundes), und dies führte zu Semmelweis' berühmtem Erfolg bei der Unterbindung der Übertragung von Kindbettfieber ("Puerperalfieber") in den Entbindungsstationen des Wiener Allgemeinen Krankenhauses in Österreich im Jahr 1847. ⓘ
Viel später, während des Ersten Weltkriegs im Jahr 1916, wurde eine standardisierte und verdünnte Abwandlung von Labarraques Lösung, die Hypochlorit (0,5 %) und Borsäure als Säurestabilisator enthielt, von Henry Drysdale Dakin entwickelt (der Labarraques frühere Arbeiten auf diesem Gebiet in vollem Umfang würdigte). Die als Dakin-Lösung bezeichnete Methode der Wundspülung mit chlorierten Lösungen ermöglichte die antiseptische Behandlung einer Vielzahl offener Wunden, lange vor der modernen Ära der Antibiotika. Eine abgewandelte Version dieser Lösung wird auch heute noch zur Wundspülung eingesetzt und ist nach wie vor wirksam gegen Bakterien, die gegen mehrere Antibiotika resistent sind (siehe Century Pharmaceuticals). ⓘ
Öffentliche Abwasserentsorgung

Die erste kontinuierliche Anwendung der Chlorierung von Trinkwasser in den USA wurde 1908 in Jersey City, New Jersey, installiert. Bis 1918 forderte das US-Finanzministerium, dass das gesamte Trinkwasser mit Chlor desinfiziert werden sollte. Chlor ist heute eine wichtige Chemikalie für die Wasseraufbereitung (z. B. in Wasseraufbereitungsanlagen), in Desinfektionsmitteln und in Bleichmitteln. Selbst kleine Wasserversorgungen werden heute routinemäßig gechlort. ⓘ
Chlor wird in der Regel (in Form von unterchloriger Säure) verwendet, um Bakterien und andere Mikroben in der Trinkwasserversorgung und in öffentlichen Schwimmbädern abzutöten. In den meisten privaten Schwimmbädern wird nicht Chlor selbst verwendet, sondern Natriumhypochlorit, das aus Chlor und Natriumhydroxid hergestellt wird, oder feste Tabletten mit chlorierten Isocyanuraten. Der Nachteil der Verwendung von Chlor in Schwimmbädern besteht darin, dass das Chlor mit den Aminosäuren der Proteine in Haaren und Haut des Menschen reagiert. Entgegen der landläufigen Meinung ist der charakteristische "Chlorgeruch" in Schwimmbädern nicht das Ergebnis von elementarem Chlor selbst, sondern von Chloramin, einer chemischen Verbindung, die durch die Reaktion von freiem, gelöstem Chlor mit Aminen in organischen Stoffen, einschließlich derer in Urin und Schweiß, entsteht. Als Desinfektionsmittel im Wasser ist Chlor mehr als dreimal so wirksam gegen Escherichia coli wie Brom und mehr als sechsmal so wirksam wie Jod. In zunehmendem Maße wird Monochloramin selbst direkt dem Trinkwasser zur Desinfektion zugesetzt, ein Verfahren, das als Chloraminierung bezeichnet wird. ⓘ
Da es oft unpraktisch ist, giftiges Chlorgas zu lagern und für die Wasseraufbereitung zu verwenden, werden alternative Methoden der Chlorzugabe eingesetzt. Dazu gehören Hypochloritlösungen, die allmählich Chlor an das Wasser abgeben, und Verbindungen wie Natriumdichlor-s-triazintrion (Dihydrat oder wasserfrei), manchmal als "Dichlor" bezeichnet, und Trichlor-s-triazintrion, manchmal als "Trichlor" bezeichnet. Diese Verbindungen sind in festem Zustand stabil und können in Pulver-, Granulat- oder Tablettenform verwendet werden. Wenn sie in kleinen Mengen dem Schwimmbadwasser oder industriellen Wassersystemen zugesetzt werden, hydrolysieren die Chloratome vom Rest des Moleküls und bilden hypochlorige Säure (HOCl), die als allgemeines Biozid wirkt und Keime, Mikroorganismen, Algen usw. abtötet. ⓘ
Verwendung als Waffe
Erster Weltkrieg
Chlorgas, auch Bertholith genannt, wurde erstmals im Ersten Weltkrieg von Deutschland am 22. April 1915 in der Zweiten Schlacht von Ypern als Waffe eingesetzt. Nach den Beschreibungen der Soldaten roch es unverwechselbar nach einer Mischung aus Pfeffer und Ananas. Außerdem schmeckte es metallisch und brannte im Rachen und in der Brust. Chlor reagiert mit Wasser in den Lungenschleimhäuten und bildet Salzsäure, die lebendes Gewebe zerstört und tödlich sein kann. Die menschlichen Atemwege können durch Gasmasken mit Aktivkohle oder anderen Filtern vor Chlorgas geschützt werden, so dass Chlorgas weit weniger tödlich ist als andere chemische Waffen. Der deutsche Wissenschaftler und spätere Nobelpreisträger Fritz Haber vom Kaiser-Wilhelm-Institut in Berlin entwickelte in Zusammenarbeit mit dem deutschen Chemiekonzern IG Farben Methoden zur Einleitung von Chlorgas gegen einen verschanzten Feind. Nach seinem ersten Einsatz setzten beide Seiten des Konflikts Chlor als chemische Waffe ein, doch wurde es bald durch die tödlicheren Phosgen- und Senfgase ersetzt. ⓘ
Mittlerer Osten
Chlorgas wurde auch während des Irak-Kriegs in der Provinz Anbar im Jahr 2007 eingesetzt, als Aufständische LKW-Bomben mit Mörsergranaten und Chlorbehältern bestückten. Bei den Angriffen starben zwei Menschen durch den Sprengstoff und mehr als 350 erkrankten. Die meisten Todesfälle waren auf die Wucht der Explosionen und nicht auf die Wirkung des Chlors zurückzuführen, da sich das giftige Gas durch die Explosion leicht in der Atmosphäre verteilt und verdünnt. Bei einigen Bombenanschlägen wurden über hundert Zivilisten aufgrund von Atembeschwerden ins Krankenhaus eingeliefert. Die irakischen Behörden verschärften die Sicherheitsvorkehrungen für elementares Chlor, das für die Versorgung der Bevölkerung mit sicherem Trinkwasser unerlässlich ist. ⓘ
Am 23. Oktober 2014 wurde berichtet, dass der Islamische Staat im Irak und in der Levante in der irakischen Stadt Duluiyah Chlorgas eingesetzt hat. Laboranalysen von Kleidungs- und Bodenproben bestätigten den Einsatz von Chlorgas gegen kurdische Peshmerga-Kräfte bei einem Angriff mit improvisierten Sprengsätzen am 23. Januar 2015 an der Highway 47 Kiske-Kreuzung in der Nähe von Mosul. ⓘ
Ein weiteres Land im Nahen Osten, Syrien, hat Chlor als chemische Waffe eingesetzt, die von Fassbomben und Raketen aus eingesetzt wurde. Im Jahr 2016 kam der Gemeinsame Untersuchungsmechanismus der OPCW und der Vereinten Nationen zu dem Schluss, dass die syrische Regierung bei drei separaten Angriffen Chlor als chemische Waffe eingesetzt hat. Spätere Untersuchungen des Ermittlungs- und Identifizierungsteams der OPCW kamen zu dem Schluss, dass die syrische Luftwaffe für die Chlorangriffe in den Jahren 2017 und 2018 verantwortlich war. ⓘ
Biologische Rolle
Das Chloridanion ist ein essenzieller Nährstoff für den Stoffwechsel. Chlor wird für die Produktion von Salzsäure im Magen und für zelluläre Pumpfunktionen benötigt. Die Hauptnahrungsquelle ist Kochsalz oder Natriumchlorid. Eine zu niedrige oder zu hohe Chloridkonzentration im Blut ist ein Beispiel für eine Elektrolytstörung. Hypochlorämie (zu wenig Chlorid) tritt selten auf, wenn keine anderen Anomalien vorliegen. Sie ist manchmal mit Hypoventilation verbunden. Sie kann mit einer chronischen respiratorischen Azidose verbunden sein. Eine Hyperchlorämie (zu viel Chlorid) verursacht normalerweise keine Symptome. Wenn doch Symptome auftreten, ähneln sie eher denen einer Hypernatriämie (zu viel Natrium). Die Verringerung des Chloridgehalts im Blut führt zu einer Dehydratisierung des Gehirns; die Symptome werden meist durch eine schnelle Rehydratation verursacht, die zu einem Hirnödem führt. Eine Hyperchlorämie kann den Sauerstofftransport beeinträchtigen. ⓘ
Gefahren
| Gefahren | |
|---|---|
| GHS-Kennzeichnung: | |
Piktogramme
|
  
|
Signalwort
|
Gefahr |
Gefahrenhinweise
|
H270, H315, H319, H331, H335, H400 |
Sicherheitshinweise
|
P220, P233, P244, P261, P304, P312, P340, P403, P410 |
| NFPA 704 (Feuerdiamant) | |
Chlor ist ein giftiges Gas, das die Atmungsorgane, Augen und Haut angreift. Da es dichter als Luft ist, neigt es dazu, sich in schlecht belüfteten Räumen am Boden anzusammeln. Chlorgas ist ein starkes Oxidationsmittel, das mit brennbaren Materialien reagieren kann. ⓘ
Chlor ist mit Messgeräten in Konzentrationen von nur 0,2 Teilen pro Million (ppm) und durch Geruch bei 3 ppm nachweisbar. Husten und Erbrechen können bei 30 ppm auftreten, Lungenschäden bei 60 ppm. Etwa 1000 ppm können nach einigen tiefen Atemzügen des Gases tödlich sein. Die IDLH-Konzentration (unmittelbare Gefahr für Leben und Gesundheit) liegt bei 10 ppm. Das Einatmen niedrigerer Konzentrationen kann die Atemwege verschlimmern, und die Exposition gegenüber dem Gas kann die Augen reizen. Wenn Chlor in Konzentrationen von mehr als 30 ppm eingeatmet wird, reagiert es in der Lunge mit Wasser und erzeugt Salzsäure (HCl) und unterchlorige Säure (HClO). ⓘ
Wenn Chlor in den angegebenen Konzentrationen zur Wasserdesinfektion verwendet wird, ist die Reaktion von Chlor mit Wasser für die menschliche Gesundheit nicht besonders bedenklich. Andere im Wasser vorhandene Stoffe können Desinfektionsnebenprodukte erzeugen, die negative Auswirkungen auf die menschliche Gesundheit haben. ⓘ
In den Vereinigten Staaten hat die Occupational Safety and Health Administration (OSHA) den zulässigen Grenzwert für elementares Chlor auf 1 ppm bzw. 3 mg/m3 festgelegt. Das National Institute for Occupational Safety and Health hat einen empfohlenen Grenzwert von 0,5 ppm über 15 Minuten festgelegt. ⓘ
Im Haushalt kommt es zu Unfällen, wenn Hypochlorit-Bleichlösungen mit bestimmten säurehaltigen Abflussreinigern in Kontakt kommen und Chlorgas erzeugen. Hypochloritbleiche (ein beliebter Waschmittelzusatz) in Verbindung mit Ammoniak (ein weiterer beliebter Waschmittelzusatz) erzeugt Chloramine, eine weitere giftige Gruppe von Chemikalien. ⓘ
Chlor ist nicht brennbar (Chlordioxid entsteht auf anderem Weg), kann jedoch mit vielen Stoffen stark reagieren. So besteht beim Kontakt von Chlor mit Wasserstoff, Kohlenwasserstoffen, Ammoniak, Aminen, Diethylether und einigen anderen Stoffen Explosionsgefahr. ⓘ
Eine spanische Studie kam zu dem Ergebnis, dass die durch die Chlorung des Wassers und die Reaktion mit organischen Verunreinigungen (Urin, Schweiß, Hautschuppen) entstehenden Desinfektionsnebenprodukte das Risiko für Blasenkrebs erhöhen. Dieses Risiko lässt sich durch angemessene hygienische Verhaltensweisen der Badegäste (vor dem Betreten des Beckens duschen, nicht ins Becken urinieren) deutlich verringern. ⓘ
Chlorinduzierte Rissbildung in Baumaterialien
Chlor wird häufig zur Reinigung von Wasser verwendet, insbesondere von Trinkwasser und Schwimmbadwasser. Mehrere katastrophale Einstürze von Schwimmbaddecken sind auf chlorinduzierte Spannungsrisskorrosion an Aufhängungsstäben aus Edelstahl zurückzuführen. Einige Polymere sind ebenfalls empfindlich gegen Angriffe, darunter Acetalharz und Polybuten. Beide Werkstoffe wurden in Warm- und Kaltwasserinstallationen verwendet, und Spannungsrisskorrosion führte in den 1980er und 1990er Jahren in den USA zu weit verbreiteten Ausfällen. ⓘ

Chlor-Eisen-Brand
Das Element Eisen kann sich bei hohen Temperaturen in einer starken exothermen Reaktion mit Chlor verbinden, wodurch ein Chlor-Eisen-Brand entsteht. Chloreisenbrände sind eine Gefahr in chemischen Prozessanlagen, wo ein Großteil der Rohrleitungen, die Chlorgas transportieren, aus Stahl besteht. ⓘ
Siehe auch
- Chlorkreislauf
- Chlorgasvergiftung
- Industrielles Gas
- Abbau von Polymeren
- Reduktive Dechlorierung ⓘ
Allgemeine Bibliographie
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie der Elemente (2. Aufl.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. ⓘ
Bleichmittel
Die historisch wichtigste Verwendung von Chlor liegt in der Anwendung als Bleichmittel. Dazu konnte es entweder elementar eingesetzt werden oder durch Reaktion mit Calciumhydroxid zu Chlorkalk weiterverarbeitet werden. ⓘ
Vorkommen

Chlor kommt auf der Erde auf Grund seiner hohen Reaktivität nur in extrem geringen Mengen elementar vor, z. B. in Vulkangasen oder in der Ozonschicht. Hier wird es aus Fluorchlorkohlenwasserstoffen abgespalten und trägt hauptsächlich zur Bildung des Ozonlochs bei. Sein Anion, das Chlorid, liegt insbesondere in salzartigen Verbindungen auf der Erde relativ häufig vor. In der kontinentalen Erdkruste ist es mit einem Gehalt von 145 ppm in der Häufigkeit hinter Elementen wie Zirconium, Kohlenstoff oder Schwefel an 19. Stelle. ⓘ
Viele Chloride sind in Wasser gut löslich. Daher ist im Meerwasser der Ozeane eine hohe Konzentration an Chloridionen enthalten. Mit einem Gehalt von 19,4 g Cl−/l sind diese nach Sauerstoff und Wasserstoff in Wassermolekülen am häufigsten im Meerwasser (zum Vergleich: 1,4 mg F−, 68 mg Br−, 0,06 mg I−). Außerdem bildet Natriumchlorid mit 18,1 g Cl−/l die Hälfte aller darin gelösten Salze. Hohe Gehalte an Chlorid haben viele abflusslose Seen, wie beispielsweise das Tote Meer, da bei diesen das von den Flüssen zugeführte Wasser verdunstet und das mitgeführte Salz zurückbleibt. ⓘ
Die wichtigsten chlorhaltigen Minerale sind Halit (Hauptbestandteil: Natriumchlorid), häufig als Steinsalz bezeichnet, Sylvin (Kaliumchlorid), Carnallit (KMgCl3·6 H2O), Bischofit (MgCl2·6 H2O) und Kainit (KMgCl(SO4)·3 H2O). Es gibt große Lagerstätten, die beim Austrocknen von Meeresteilen entstanden sind. Da die geringer löslichen Natriumsalze zuerst ausfallen und sich bei fortschreitender Austrocknung die Kaliumsalze darüber ablagern, sind die Lager oft geschichtet. Größere Vorkommen an Halit befinden sich in Deutschland beispielsweise in Bad Friedrichshall und Bad Reichenhall, ein Vorkommen in Österreich liegt bei Hallein. Eine Übersicht über Chlorminerale liefert die :Kategorie:Chlormineral. ⓘ
Es ist eine Vielzahl natürlicher chlororganischer Verbindungen bekannt, im Februar 2002 zählte man 2200. Der größte Teil wird von Meereslebewesen, wie Seetang, Schwämmen, Manteltieren oder Korallen synthetisiert. Auf dem Land lebende Tiere und Pflanzen bilden in deutlich geringerem Umfang chlororganische Verbindungen. Auch bei Vulkanausbrüchen und der Verbrennung von Biomasse entstehen chlororganische Verbindungen. ⓘ
Chlorradikale entstehen durch Zersetzung organischer Chlorverbindungen in der Stratosphäre. Viele dieser chlororganischen Verbindungen, vor allen die Fluorchlorkohlenwasserstoffe (FCKW), sind nicht oder nur in geringem Umfang natürlichen Ursprungs, sondern wurden vom Menschen freigesetzt. Chlorradikale können den Abbau von Ozon katalysieren und sind für das sogenannte Ozonloch, das vor allem im Bereich der Pole auftritt, verantwortlich. ⓘ
Nachweis

Chlor besitzt eine typische grün-gelbe Farbe und ebenso einen charakteristischen Geruch, diese lassen jedoch keine genauere Bestimmung zu. Für den Nachweis von Chlor wird meist die oxidierende Wirkung ausgenutzt. So kann Chlor Iodide und Bromide zu den Elementen oxidieren, wodurch sich eine bromidhaltige Lösung braun beziehungsweise eine iodidhaltige Lösung violett färbt. Damit diese Farbe besser zu sehen ist, wird das Brom oder Iod mit Hexan extrahiert. Auch Reaktionen mit anderen Stoffen, etwa die Entfärbung von Methylorange kann als Nachweis für Chlor genutzt werden. Diese sind jedoch nicht spezifisch, da auch andere Oxidationsmittel in der Lage sind, in gleicher Weise zu reagieren. ⓘ
Einen für Chlor spezifischen Nachweis, der etwa in Prüfröhrchen für Gase angewendet wird, liefert die Reaktion mit Tolidin. Dabei bildet sich ein gelber Farbstoff, der durch kolorimetrische Verfahren nachweisbar ist. ⓘ
Chloride können in wässrigen Lösungen über die Reaktion mit Silberionen und die Bildung des schwerlöslichen Silberchlorids nachgewiesen werden. Dieses liegt als weißer Niederschlag vor und unterscheidet sich damit von den ebenfalls schwerlöslichen Silberbromid und Silberiodid, die eine gelbe Farbe besitzen. Über die Argentometrie lassen sich dadurch auch quantitative Messungen von Chloridgehalten durchführen. ⓘ
Verbindungen
Chlor bildet Verbindungen in verschiedenen Oxidationsstufen von −1 bis +7. Die stabilste und häufigste Oxidationsstufe ist dabei −1, die höheren werden nur in Verbindungen mit den elektronegativeren Elementen Sauerstoff und Fluor gebildet. Dabei sind die ungeraden Oxidationsstufen +1, +3, +5 und +7 stabiler als die geraden. Einen Überblick über die Chlorverbindungen bietet die :Kategorie:Chlorverbindung ⓘ
Chloroxide
Es ist eine größere Anzahl Verbindungen von Chlor und Sauerstoff bekannt. Diese sind nach den allgemeinen Formeln ClOx (x = 1–4) und Cl2Ox (x = 1–7) aufgebaut. Chloroxide sind sehr reaktiv und zerfallen explosionsartig in die Elemente. Von technischer Bedeutung sind nur zwei der Chloroxide, Dichloroxid (Cl2O) und Chlordioxid (ClO2). Letztes ist unter Normalbedingungen gasförmig und eine der wenigen radikalisch aufgebauten Verbindungen. Beim Verfestigen dimerisiert es und ändert dabei die Magnetisierung von Para- zu Diamagnetismus. ⓘ
Chlorsauerstoffsäuren
Neben den Chloroxiden bilden Chlor und Sauerstoff – analog zu den Halogenen Brom und Iod – auch mehrere Säuren, bei denen ein Chloratom von einem bis vier Sauerstoffatomen umgeben sind. Diese zu den Halogensauerstoffsäuren zählenden Verbindungen sind die Hypochlorige Säure, die Chlorige Säure, die Chlorsäure und die Perchlorsäure. Die einzige dieser Säuren, die als Reinstoff stabil ist, ist die Perchlorsäure, die anderen sind nur in wässriger Lösung oder in Form ihrer Salze bekannt. Der pKs-Wert dieser Säuren sinkt mit der zunehmenden Anzahl an Sauerstoffatomen im Molekül. Während die Hypochlorige Säure eine nur schwache Säure ist, zählt Perchlorsäure zu den Supersäuren, den stärksten bekannten Säuren. ⓘ
Organische Chlorverbindungen

Eine Vielzahl von organischen Chlorverbindungen (auch Organochlorverbindungen) wird synthetisch hergestellt. Wichtig sind in der Gruppe der Halogenkohlenwasserstoffe die Chloralkane, die Chloralkene sowie die Chloraromaten. Eingesetzt werden sie unter anderem als Lösungsmittel, Kältemittel, Hydrauliköle, Pflanzenschutzmittel oder Arzneistoffe. ⓘ
Zu den Organochlorverbindungen gehören auch einige stark giftige, persistente und bioakkumulative Substanzen, wie etwa die polychlorierten Dibenzodioxine und Dibenzofurane. Die ersten zwölf in das der Schadstoffkontrolle dienenden Stockholmer Übereinkommen aufgenommenen Verbindungen beziehungsweise Stoffgruppen, das sogenannte Dreckige Dutzend, sind ausnahmslos organische Chlorverbindungen. ⓘ
Außerdem gibt es in der Biosphäre eine Vielzahl von natürlichen organischen Chlorverbindungen, die von Organismen, wie z. B. Bodenbakterien, Schimmelpilze, Seetang und Flechten, synthetisiert werden können. Zu den Verbindungen gehören biogene Halogenkohlenwasserstoffe, wie Methylchlorid, das zu 70 % aus marinen Organismen stammt, und chlorierte Aromate, aber auch chlorhaltige Aminosäuren, wie L-2-Amino-4-chlor-4-pentensäure, die in bestimmten Blätterpilzen vorkommt. Auffällig hoch ist auch der Anteil von chlorierten Huminstoffen in bestimmten Mooren. ⓘ
Die Synthese dieser Verbindungen erfolgt über Haloperoxidasen in Gegenwart von Wasserstoffperoxid, über Direktchlorierung mit enzymatisch freigesetztem Chlor oder Hypochlorit, über Chlorradikale oder durch nucleophile Ringöffnung von Epoxiden mit Chloridionen. Da Chloridionen in der Natur häufig vorkommen, sind diese ausschließlich der Chlorlieferant für die biogenen organischen Chlorverbindungen. Der Anteil dieser Verbindungen in der Umwelt im Vergleich zu dem industriell verursachten Anteil von organischen Chlorverbindungen ist nicht unerheblich. ⓘ
Chlorhydrate
Wie von Faraday 1811 erstmals näher untersucht, bildet Chlorgas bei Abkühlung in Gegenwart von Wasser auskristallisierende „Chlorhydrate“, über deren Aufbau und Zusammensetzung lange Zeit Unklarheit herrschte. Nach einstweilen letztem Stand der Untersuchungen handelt es sich dabei um eine Verbindung der Summenformel Cl2·7H2O. ⓘ





