Glutaminsäure
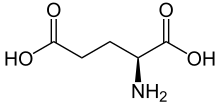 Skelettformel der L-Glutaminsäure
| |||
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Glutaminsäure
| |||
| Systematischer IUPAC-Name
2-Aminopentandisäure | |||
| Andere Namen
2-Aminoglutarsäure
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
| ||
| 3DMet |
| ||
Beilstein-Referenz
|
1723801 (L) 1723799 (rac) 1723800 (D) | ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider |
| ||
| Arzneimittelbank | |||
| EG-Nummer |
| ||
Gmelin-Referenz
|
3502 (L) 101971 (rac) 201189 (D) | ||
| KEGG | |||
PubChem CID
|
|||
| UNII |
| ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C5H9NO4 | ||
| Molekulare Masse | 147.130 g-mol-1 | ||
| Erscheinungsbild | weißes kristallines Pulver | ||
| Dichte | 1.4601 (20 °C) | ||
| Schmelzpunkt | 199 °C (390 °F; 472 K) zersetzt sich | ||
Löslichkeit in Wasser
|
7,5 g/L (20 °C) | ||
| Löslichkeit | 0,00035 g/100 g Ethanol (25 °C) | ||
| Azidität (pKa) | 2.10, 4.07, 9.47 | ||
Magnetische Suszeptibilität (χ)
|
-78,5-10-6 cm3/mol | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|

| ||
Signalwort
|
Warnhinweis | ||
Gefahrenhinweise
|
H315, H319, H335 | ||
Sicherheitshinweise
|
P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
Sofern nicht anders angegeben, gelten die Daten für Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Glutaminsäure (Symbol Glu oder E; die ionische Form wird als Glutamat bezeichnet) ist eine α-Aminosäure, die von fast allen Lebewesen für die Biosynthese von Proteinen verwendet wird. Beim Menschen ist sie nicht essentiell, das heißt, der Körper kann sie selbst synthetisieren. Sie ist auch ein erregender Neurotransmitter, und zwar der am häufigsten vorkommende im Nervensystem der Wirbeltiere. Es dient als Vorläufer für die Synthese der hemmenden Gamma-Aminobuttersäure (GABA) in den GABA-ergenen Neuronen. ⓘ
Seine Molekülformel lautet C
5H
9NO
4. Glutaminsäure kommt in drei optisch isomeren Formen vor; die rechtsdrehende L-Form wird in der Regel durch Hydrolyse von Gluten oder aus den Abwässern der Rübenzuckerherstellung oder durch Fermentation gewonnen. Seine Molekülstruktur könnte idealisiert werden als HOOC-CH(NH
2)-(CH
2)2-COOH, mit zwei Carboxylgruppen -COOH und einer Aminogruppe -NH
2. Im festen Zustand und in leicht sauren wässrigen Lösungen nimmt das Molekül jedoch eine elektrisch neutrale Zwitterionstruktur -OOC-CH(NH+
3)-(CH
2)2-COOH. Sie wird durch die Codons GAA oder GAG kodiert. ⓘ
Die Säure kann ein Proton von ihrer zweiten Carboxylgruppe verlieren, um die konjugierte Base zu bilden, das einfach negative Anion Glutamat -OOC-CH(NH+
3)-(CH
2)2-COO-. Diese Form der Verbindung ist in neutralen Lösungen vorherrschend. Der Neurotransmitter Glutamat spielt die Hauptrolle bei der neuronalen Aktivierung. Dieses Anion sorgt für den würzigen Umami-Geschmack von Lebensmitteln und ist in Glutamat-Aromastoffen wie MSG enthalten. In Europa ist es als Lebensmittelzusatzstoff E620 eingestuft. In stark alkalischen Lösungen ist das doppelt negative Anion -OOC-CH(NH
2)-(CH
2)2-COO- vorherrschend. Das dem Glutamat entsprechende Radikal wird als Glutamyl bezeichnet. ⓘ
| Strukturformel ⓘ | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Struktur der natürlich vorkommenden L-Glutaminsäure | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Glutaminsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C5H9NO4 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 147,13 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,54 g·cm−3 (20 °C) | ||||||||||||
| Schmelzpunkt |
160 °C | ||||||||||||
| Siedepunkt |
Zersetzung bei 205 °C | ||||||||||||
| pKS-Wert |
| ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten |
12961 mg·kg−1 (LD50, Maus, oral) | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Glutaminsäure (auch α-Aminoglutarsäure, 2-Aminoglutarsäure) ist eine α-Aminosäure, die in zwei Spiegelbildisomeren (Enantiomere) vorkommt, deren eine proteinogene Form der menschliche Organismus selber herstellen kann (nicht essentielle Aminosäure). Im Dreibuchstabencode wird sie als Glu und im Einbuchstabencode als E bezeichnet. Ihre Salze und Ester werden Glutamate genannt. In Biologie und Medizin wird die Glutaminsäure meist Glutamat genannt, da die Verbindung im Körper dissoziiert vorliegt. Glutaminsäure ist ein wichtiger Baustein von Proteinen; daneben ist Glutamat einer der wichtigsten erregenden Neurotransmitter im zentralen Nervensystem (ZNS) auch des menschlichen Organismus. Als Lebensmittelzusatzstoff werden L-Glutaminsäure (E 620) sowie einige ihrer Salze (siehe Glutamate) als Geschmacksverstärker eingesetzt, besonders in der asiatischen Küche und bei Convenience-Produkten. ⓘ
Chemie
Ionisierung

Wenn Glutaminsäure in Wasser gelöst wird, kann die Aminogruppe (-NH
2) ein Proton gewinnen (H+
), und/oder die Carboxylgruppen können Protonen verlieren, je nach dem Säuregrad des Mediums. ⓘ
In ausreichend saurem Milieu gewinnt die Aminogruppe ein Proton und das Molekül wird zu einem Kation mit einer einzigen positiven Ladung, HOOC-CH(NH+
3)-(CH
2)2-COOH. ⓘ
Bei pH-Werten zwischen etwa 2,5 und 4,1 verliert die dem Amin näher gelegene Carbonsäure im Allgemeinen ein Proton, und die Säure wird zum neutralen Zwitterion -OOC-CH(NH+
3)-(CH
2)2-COOH. Dies ist auch die Form der Verbindung im kristallinen Festkörper. Der Wechsel des Protonierungszustands erfolgt allmählich; die beiden Formen liegen bei pH 2,10 in gleicher Konzentration vor. ⓘ
Bei einem noch höheren pH-Wert verliert die andere Carbonsäuregruppe ihr Proton und die Säure liegt fast vollständig als Glutamatanion -OOC-CH(NH+
3)-(CH
2)2-COO-, mit einer einzigen negativen Gesamtladung. Der Wechsel des Protonierungszustands erfolgt bei pH 4,07. Diese Form mit beiden Carboxylaten ohne Protonen ist im physiologischen pH-Bereich (7,35-7,45) vorherrschend. ⓘ
Bei einem noch höheren pH-Wert verliert die Aminogruppe das zusätzliche Proton, und die vorherrschende Spezies ist das doppelt negative Anion -OOC-CH(NH
2)-(CH
2)2-COO-. Der Wechsel des Protonierungszustands erfolgt bei pH 9,47. ⓘ
Der isoelektrische Punkt der Glutaminsäure liegt bei pH 3,24. Die Dicarbonsäure löst sich nur wenig in Wasser (≈11 g·l−1 bei 25 °C) und Ethanol; die Lösung reagiert stark sauer (pKCOOH 2,16, pKγ-COOH 4,32). ⓘ
Optische Isomerie
Das der Aminogruppe benachbarte Kohlenstoffatom ist chiral (mit vier verschiedenen Gruppen verbunden). Glutaminsäure kann in drei optischen Isomeren vorliegen, darunter die rechtsdrehende L-Form, d(-) und l(+). Die l-Form ist die in der Natur am häufigsten vorkommende Form, während die d-Form in einigen speziellen Zusammenhängen vorkommt, z. B. in den Zellwänden von Bakterien (die sie mit Hilfe des Enzyms Glutamat-Racemase aus der l-Form herstellen können) und in der Leber von Säugetieren. ⓘ
Geschichte
Obwohl sie natürlicherweise in vielen Lebensmitteln vorkommen, wurden die geschmacklichen Beiträge der Glutaminsäure und anderer Aminosäuren erst Anfang des 20. Entdeckt und identifiziert wurde die Substanz im Jahr 1866 von dem deutschen Chemiker Karl Heinrich Ritthausen, der Weizengluten (nach dem sie benannt wurde) mit Schwefelsäure behandelte. Im Jahr 1908 identifizierte der japanische Forscher Kikunae Ikeda von der Kaiserlichen Universität Tokio braune Kristalle, die nach dem Verdampfen einer großen Menge Kombu-Brühe zurückblieben, als Glutaminsäure. Wenn diese Kristalle gekostet wurden, reproduzierten sie den unbeschreiblichen, aber nicht zu leugnenden Geschmack, den er in vielen Lebensmitteln, vor allem in Seetang, entdeckte. Professor Ikeda bezeichnete diesen Geschmack als umami. Er patentierte daraufhin ein Verfahren zur Massenproduktion eines kristallinen Glutaminsäuresalzes, Mononatriumglutamat. ⓘ
Durch den schwefelsauren Aufschluss von Gluten gelang dem deutschen Chemiker Heinrich Ritthausen 1866 an der Landwirtschaftlichen Akademie Waldau bei Königsberg erstmals die Isolierung von Glutaminsäure. An den ihm von Ritthausen übergebenen Kristallen konnte Gustav Werther, zu der Zeit Professor für Chemie in Königsberg, die Zusammensetzung der Glutaminsäure richtig bestimmen. Nach dem Wechsel Ritthausens an die Landwirtschaftliche Akademie in Bonn-Poppelsdorf veranlasste er dort den Chemiker Wilhelm Dittmar mit der Strukturaufklärung, die Dittmar 1872 gelang. Die Ergebnisse wurden 1890 durch Ludwig Wolff bestätigt. ⓘ
Synthese
Biosynthese
| Reaktanten | Produkte | Enzyme ⓘ |
|---|---|---|
| Glutamin + H2O | → Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → Glu + Acetat | N-Acetyl-Glutamat-Synthase |
| α-Ketoglutarat + NADPH + NH4+ | → Glu + NADP+ + H2O | GLUD1, GLUD2 |
| α-Ketoglutarat + α-Aminosäure | → Glu + α-Ketosäure | Transaminase |
| 1-Pyrrolin-5-Carboxylat + NAD+ + H2O | → Glu + NADH | ALDH4A1 |
| N-Formimino-L-Glutamat + FH4 | → Glu + 5-Formimino-FH4 | FTCD |
| NAAG | → Glu + NAA | GCPII |
Industrielle Synthese
Glutaminsäure wird im größten Umfang aller Aminosäuren hergestellt, mit einer geschätzten Jahresproduktion von etwa 1,5 Millionen Tonnen im Jahr 2006. Die chemische Synthese wurde in den 1950er Jahren durch die aerobe Fermentation von Zuckern und Ammoniak ersetzt, wobei der Organismus Corynebacterium glutamicum (auch bekannt als Brevibacterium flavum) am häufigsten für die Produktion verwendet wird. Es kann durch Konzentration und Kristallisation isoliert und gereinigt werden und ist auch als Hydrochloridsalz weithin erhältlich. ⓘ
Funktion und Verwendung
Stoffwechsel
Glutamat ist eine Schlüsselverbindung im zellulären Stoffwechsel. Beim Menschen werden Nahrungsproteine durch Verdauung in Aminosäuren aufgespalten, die als metabolischer Brennstoff für andere Funktionen im Körper dienen. Ein Schlüsselprozess beim Abbau von Aminosäuren ist die Transaminierung, bei der die Aminogruppe einer Aminosäure auf eine α-Ketosäure übertragen wird, in der Regel katalysiert durch eine Transaminase. Die Reaktion kann wie folgt verallgemeinert werden:
- R1-Aminosäure + R2-α-Ketosäure ⇌ R1-α-Ketosäure + R2-Aminosäure ⓘ
Eine sehr häufige α-Ketosäure ist α-Ketoglutarat, ein Zwischenprodukt im Zitronensäurezyklus. Durch Transaminierung von α-Ketoglutarat entsteht Glutamat. Das entstehende α-Ketosäureprodukt ist oft auch ein nützliches Produkt, das als Brennstoff oder als Substrat für weitere Stoffwechselprozesse dienen kann. Beispiele sind folgende:
- Aspartat + α-Ketoglutarat ⇌ Oxalacetat + Glutamat ⓘ
Sowohl Pyruvat als auch Oxalacetat sind Schlüsselkomponenten des zellulären Stoffwechsels und tragen als Substrate oder Zwischenprodukte zu grundlegenden Prozessen wie der Glykolyse, der Gluconeogenese und dem Zitronensäurezyklus bei. ⓘ
Glutamat spielt auch eine wichtige Rolle bei der Entsorgung von überschüssigem Stickstoff durch den Körper. Glutamat wird einer Desaminierung unterzogen, einer oxidativen Reaktion, die von der Glutamat-Dehydrogenase katalysiert wird, und zwar wie folgt
- Glutamat + H2O + NADP+ → α-Ketoglutarat + NADPH + NH3 + H+ ⓘ
Ammoniak (als Ammonium) wird dann überwiegend als Harnstoff, der in der Leber synthetisiert wird, ausgeschieden. Die Transaminierung kann also mit der Desaminierung verbunden werden, so dass der Stickstoff aus den Amingruppen der Aminosäuren über Glutamat als Zwischenprodukt entfernt und schließlich in Form von Harnstoff aus dem Körper ausgeschieden wird. ⓘ
Glutamat ist auch ein Neurotransmitter (siehe unten), was es zu einem der am häufigsten vorkommenden Moleküle im Gehirn macht. Bösartige Hirntumore, die als Gliome oder Glioblastome bezeichnet werden, nutzen dieses Phänomen, indem sie Glutamat als Energiequelle nutzen, insbesondere wenn diese Tumore aufgrund von Mutationen im Gen IDH1 stärker von Glutamat abhängig werden. ⓘ
L-Glutamat entsteht im Citratzyklus aus α-Ketoglutarat (αKG) und einem Ammoniumion durch die Reaktion des Enzyms Glutamatdehydrogenase (GDH) (1). Ein weiteres Ammoniumion kann über die Reaktion der Glutamin-Synthetase (GlnS) abgefangen werden, wobei Glutamin entsteht (3). Beide Reaktionen dienen der spontanen Entgiftung aller Gewebe und sind im Hirn von besonderer Bedeutung. ⓘ
Für die endgültige Entgiftung müssen Ammoniumionen dem Harnstoffzyklus zugeführt werden. Dies erfolgt sowohl durch Übertragung (Transaminierung) auf Oxalacetat (OA) (2), als auch über die Glutamat-Dehydrogenase-Reaktion (1). Glutamin kann mit α-Ketoglutarat in Pflanzen zu zwei Molekülen L-Glutaminsäure umgesetzt (3) und damit der GDH-Reaktion zugeführt werden. Diese Reaktion wird durch Glutamat-Synthase (GluS) katalysiert. ⓘ
Bei der Aminosäuresynthese ist L-Glutaminsäure der NH2-Donor in einer Transaminierungsreaktion. Diese überführt α-Ketosäuren in die homologen α-Aminosäuren. Beispiele sind Glutamat-Oxalacetat-Transaminase (GOT) (2) und Glutamat-Pyruvat-Transaminase (GPT). Coenzym ist Pyridoxalphosphat. Für nahezu alle anderen Aminogruppen, die im Stoffwechsel benötigt werden, ist Glutamin der Donor. ⓘ
Neurotransmitter
Glutamat ist der am häufigsten vorkommende exzitatorische Neurotransmitter im Nervensystem der Wirbeltiere. An chemischen Synapsen wird Glutamat in Bläschen gespeichert. Nervenimpulse lösen die Freisetzung von Glutamat aus der präsynaptischen Zelle aus. Glutamat wirkt auf ionotrope und metabotrope (G-Protein-gekoppelte) Rezeptoren. In der gegenüberliegenden postsynaptischen Zelle binden Glutamatrezeptoren, wie der NMDA-Rezeptor oder der AMPA-Rezeptor, Glutamat und werden aktiviert. Aufgrund seiner Rolle bei der synaptischen Plastizität ist Glutamat an kognitiven Funktionen wie Lernen und Gedächtnis im Gehirn beteiligt. Die Form der Plastizität, die als Langzeitpotenzierung bekannt ist, findet an glutamatergen Synapsen im Hippocampus, Neokortex und anderen Teilen des Gehirns statt. Glutamat wirkt nicht nur als Punkt-zu-Punkt-Transmitter, sondern auch durch synaptisches Übersprechen zwischen Synapsen, bei dem die Summierung von Glutamat, das von einer benachbarten Synapse freigesetzt wird, eine extrasynaptische Signal-/Volumenübertragung bewirkt. Darüber hinaus spielt Glutamat eine wichtige Rolle bei der Regulierung von Wachstumskegeln und der Synaptogenese während der Gehirnentwicklung, wie ursprünglich von Mark Mattson beschrieben. ⓘ
Nicht-synaptische glutamaterge Signalkreisläufe im Gehirn
Es wurde festgestellt, dass extrazelluläres Glutamat in Drosophila-Gehirnen über einen Prozess der Rezeptordesensibilisierung die postsynaptische Glutamatrezeptor-Gruppierung reguliert. Ein Gen, das in Gliazellen exprimiert wird, transportiert aktiv Glutamat in den extrazellulären Raum, während dieses Gen im Nucleus accumbens, der metabotrope Glutamatrezeptoren der Gruppe II stimuliert, die extrazellulären Glutamatspiegel reduziert. Daraus ergibt sich die Möglichkeit, dass dieses extrazelluläre Glutamat eine "endokrinähnliche" Rolle als Teil eines größeren homöostatischen Systems spielt. ⓘ
GABA-Vorläufer
Glutamat dient auch als Vorläufer für die Synthese der hemmenden Gamma-Aminobuttersäure (GABA) in GABA-ergen Neuronen. Diese Reaktion wird von der Glutamat-Decarboxylase (GAD) katalysiert, die vor allem im Kleinhirn und in der Bauchspeicheldrüse vorkommt. ⓘ
Das Stiff-Person-Syndrom ist eine neurologische Störung, die durch Anti-GAD-Antikörper verursacht wird und zu einer verminderten GABA-Synthese und damit zu einer Beeinträchtigung der motorischen Funktion wie Muskelsteifheit und Spasmen führt. Da die Bauchspeicheldrüse reichlich GAD enthält, kommt es zu einer direkten immunologischen Zerstörung der Bauchspeicheldrüse und die Patienten leiden an Diabetes mellitus. ⓘ
Geschmacksverstärker
Da Glutaminsäure ein Bestandteil von Eiweiß ist, ist sie in eiweißhaltigen Lebensmitteln vorhanden, kann aber nur in ungebundener Form geschmeckt werden. Erhebliche Mengen freier Glutaminsäure sind in einer Vielzahl von Lebensmitteln enthalten, darunter auch in Käse und Sojasoße, und Glutaminsäure ist für den Umami-Geschmack verantwortlich, einen der fünf Grundgeschmacksrichtungen des menschlichen Geschmackssinns. Glutaminsäure wird häufig als Lebensmittelzusatzstoff und Geschmacksverstärker in Form ihres Natriumsalzes, bekannt als Mononatriumglutamat (MSG), verwendet. ⓘ
Nährstoff
Alle Fleischsorten, Geflügel, Fisch, Eier, Milchprodukte und Kombu sind ausgezeichnete Glutaminsäurequellen. Einige proteinreiche pflanzliche Lebensmittel dienen ebenfalls als Quelle. 30 bis 35 % des Glutens (ein Großteil des Proteins in Weizen) besteht aus Glutaminsäure. Fünfundneunzig Prozent des mit der Nahrung aufgenommenen Glutamats werden in einem ersten Durchgang von den Darmzellen verstoffwechselt. ⓘ
Pflanzenwachstum
Auxigro ist ein Pflanzenwachstumspräparat, das 30 % Glutaminsäure enthält. ⓘ
NMR-Spektroskopie
In den letzten Jahren wurde viel über den Einsatz der residualen dipolaren Kopplung (RDC) in der Kernspinresonanzspektroskopie (NMR) geforscht. Ein Glutaminsäurederivat, Poly-γ-benzyl-L-glutamat (PBLG), wird häufig als Ausrichtungsmedium verwendet, um das Ausmaß der beobachteten dipolaren Wechselwirkungen zu kontrollieren. ⓘ
Pharmakologie
Die Droge Phencyclidin (besser bekannt als PCP oder "Angel Dust") antagonisiert Glutaminsäure nicht-kompetitiv am NMDA-Rezeptor. Aus den gleichen Gründen haben auch Dextromethorphan und Ketamin starke dissoziative und halluzinogene Wirkungen. Die akute Infusion des Medikaments LY354740 (auch bekannt als Eglumegad, ein Agonist der metabotropen Glutamatrezeptoren 2 und 3) führte zu einer deutlichen Verringerung der Yohimbin-induzierten Stressreaktion bei Haubenmakaken (Macaca radiata); die chronische orale Verabreichung von LY354740 führte bei diesen Tieren im Vergleich zu unbehandelten Kontrollpersonen zu deutlich verringerten Cortisol-Grundwerten (etwa 50 Prozent). LY354740 wirkt außerdem nachweislich auf den metabotropen Glutamatrezeptor 3 (GRM3) menschlicher Nebennierenrindenzellen, wodurch die Aldosteronsynthase, CYP11B1 und die Produktion von Nebennierensteroiden (d. h. Aldosteron und Cortisol) herunterreguliert werden. Glutamat passiert die Blut-Hirn-Schranke nicht ohne weiteres, sondern wird stattdessen durch ein hochaffines Transportsystem transportiert. Es kann auch in Glutamin umgewandelt werden. ⓘ
Stereochemie
Aminosäuren sind chirale Moleküle. In der Natur liegt im Wesentlichen nur die L-(+)-Glutaminsäure [Synonym: (S)-Glutaminsäure] vor. Wenn in diesem Text oder in der wissenschaftlichen Literatur „Glutaminsäure“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Glutaminsäure gemeint. ⓘ
Die D-(−)-Glutaminsäure [Synonym: (R)-Glutaminsäure] kann auf chemischem Wege erzeugt werden. Auf sie und das Racemat aus beiden Enantiomeren wird in diesem Artikel nicht näher eingegangen. ⓘ
| Isomere von Glutaminsäure ⓘ | ||
| Name | L-Glutaminsäure | D-Glutaminsäure |
| Andere Namen | (S)-Glutaminsäure (+)-Glutaminsäure |
(R)-Glutaminsäure (−)-Glutaminsäure |
| Strukturformel | 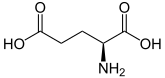 |

|
| CAS-Nummer | 56-86-0 | 6893-26-1 |
| 617-65-2 (DL) | ||
| EG-Nummer | 200-293-7 | 230-000-8 |
| 210-522-2 (DL) | ||
| ECHA-Infocard | 100.000.267 | 100.027.273 |
| 100.009.567 (DL) | ||
| PubChem | 33032 | 23327 |
| 611 (DL) | ||
| DrugBank | DB00142 | |
| – (DL) | ||
| Wikidata | Q26995161 | Q27077040 |
| Q181136 (DL) | ||
Vorkommen
L-Glutaminsäure kommt in den meisten Proteinen in unterschiedlichen Anteilen vor und ist in jedem eiweißhaltigen Nahrungsmittel vorhanden. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Glutaminsäure am Gesamtprotein angegeben. Besonders reich an freiem L-Glutamat sind Käse und Fleischprodukte. ⓘ
| Lebensmittel | Protein | Glutaminsäure | Anteil ⓘ |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 3191 mg | 15,0 % |
| Hähnchenbrustfilet, roh | 23,09 g | 3458 mg | 15,0 % |
| Lachs, roh | 20,42 g | 2830 mg | 13,9 % |
| Hühnerei | 12,58 g | 1676 mg | 13,3 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 687 mg | 20,9 % |
| Walnüsse | 15,23 g | 2816 mg | 18,5 % |
| Weizen-Vollkornmehl | 13,21 g | 4328 mg | 32,8 % |
| Mais-Vollkornmehl | 6,93 g | 1300 mg | 18,8 % |
| Reis, ungeschält | 7,94 g | 1618 mg | 20,4 % |
| Erbsen, getrocknet | 24,55 g | 4196 mg | 17,1 % |
| Tomatenpüree | 1,65 g | 658 mg | 39,9 % |
Herstellung
L-Glutaminsäure wird kommerziell ausschließlich nach der Fermentationsmethode (Sojasauce, Flüssigwürze) hergestellt. Es begann damit, dass systematisch nach Wildtyp-Organismen geforscht wurde, bei denen sich L-Glutaminsäure unter Verwendung günstiger Nährmedien (Edukte) und Kulturbedingungen (Temperatur, Konzentration von Spurenelementen etc.) anreichern ließen. Durch Verwendung von Mutanten wurde die Fermentationsmethode optimiert. ⓘ
Derivate
Beim Erhitzen einer Mischung aus gleichen Gewichtsteilen Glutaminsäure und Wasser in einem Autoklaven erhält man unter Wasserabspaltung bei Reaktionstemperaturen von 135–143 °C Pyroglutaminsäure, ein cyclisches Amid (Lactam). ⓘ
Physiologische Bedeutung
Glutaminsäure (Glutamat) im Blutbefund (Aminosäurenkonzentrationen)
Die Referenzbereiche (Normalwerte) für Glutaminsäure im Blutbefund sind in µmol/ml bei Säuglingen 20–107, bei Kindern 18–65 und bei Erwachsenen 28–92. Als Therapie bei sehr hohen Glutaminsäurewerten (Glutamat) im Blutbefund, wie sie z. B. beim Chinarestaurant-Syndrom oder bei Ekzemen und/oder Histamin-Intoleranz vorkommen können, empfiehlt Reinhart Jarisch eine Vitamin-B6-Gabe in der Größenordnung von 0,5 mg/kg Körpergewicht je Tag. Dies fördert auch die körpereigene Synthese von Diaminooxidase (DAO) und bekämpft so ursächlich die Auswirkungen der Histamin-Intoleranz. ⓘ
Salze
Die verschiedenen Salze der Glutaminsäure sind als Lebensmittelzusatzstoffe bekannt. Es kommen verschiedene Salze der Glutaminsäure mit der Bezeichnung Geschmacksverstärker E 621 bis E 625 zum Einsatz. ⓘ