Oganesson
| Oganesson | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache |
| ||||||||||||
| Erscheinungsbild | metallisch (vorhergesagt) | ||||||||||||
| Massenzahl | [294] | ||||||||||||
| Oganesson im Periodensystem | |||||||||||||
| |||||||||||||
| Ordnungszahl (Z) | 118 | ||||||||||||
| Gruppe | Gruppe 18 (Edelgase) | ||||||||||||
| Periode | Periode 7 | ||||||||||||
| Block | p-Block | ||||||||||||
| Elektronen-Konfiguration | [[[Radon|Rn]]] 5f14 6d10 7s2 7p6 (vorhergesagt) | ||||||||||||
| Elektronen pro Schale | 2, 8, 18, 32, 32, 18, 8 (vorhergesagt) | ||||||||||||
| Physikalische Eigenschaften | |||||||||||||
| Phase bei STP | fest (vorhergesagt) | ||||||||||||
| Schmelzpunkt | 325 ± 15 K (52 ± 15 °C, 125 ± 27 °F) (vorhergesagt) | ||||||||||||
| Siedepunkt | 450 ± 10 K (177 ± 10 °C, 350 ± 18 °F) (vorhergesagt) | ||||||||||||
| Dichte (nahe r.t.) | 6,6-7,4 g/cm3 (vorhergesagt) | ||||||||||||
| Kritischer Punkt | 439 K, 6,8 MPa (extrapoliert) | ||||||||||||
| Schmelzwärme | 23,5 kJ/mol (extrapoliert) | ||||||||||||
| Verdampfungswärme | 19,4 kJ/mol (extrapoliert) | ||||||||||||
| Atomare Eigenschaften | |||||||||||||
| Oxidationsstufen | (-1), (0), (+1), (+2), (+4), (+6) (vorhergesagt) | ||||||||||||
| Ionisierungsenergien |
| ||||||||||||
| Atomradius | empirisch: 152 pm (vorhergesagt) | ||||||||||||
| Kovalenter Radius | 157 pm (vorhergesagt) | ||||||||||||
| Andere Eigenschaften | |||||||||||||
| Natürliches Vorkommen | synthetisch | ||||||||||||
| Kristallstruktur | kubisch-flächenzentriert (fcc) (extrapoliert) | ||||||||||||
| CAS-Nummer | 54144-19-3 | ||||||||||||
| Geschichte | |||||||||||||
| Benennung | nach Juri Oganessian | ||||||||||||
| Vorhersage | Hans Peter Jørgen Julius Thomsen (1895) | ||||||||||||
| Entdeckung | Gemeinsames Institut für Kernforschung und Lawrence Livermore National Laboratory (2002) | ||||||||||||
| Hauptisotope von Oganesson | |||||||||||||
| |||||||||||||
Oganesson ist ein synthetisches chemisches Element mit dem Symbol Og und der Ordnungszahl 118. Es wurde erstmals 2002 am Joint Institute for Nuclear Research (JINR) in Dubna, in der Nähe von Moskau, Russland, von einem gemeinsamen Team aus russischen und amerikanischen Wissenschaftlern synthetisiert. Im Dezember 2015 wurde es von der gemeinsamen Arbeitsgruppe der internationalen wissenschaftlichen Gremien IUPAC und IUPAP als eines von vier neuen Elementen anerkannt. Am 28. November 2016 wurde es formell benannt. Der Name ehrt den Kernphysiker Juri Oganessian, der eine führende Rolle bei der Entdeckung der schwersten Elemente im Periodensystem spielte. Es ist eines von nur zwei Elementen, die nach einer Person benannt wurden, die zum Zeitpunkt der Benennung noch lebte, das andere ist Seaborgium, und das einzige Element, dessen Namensgeber heute noch lebt. ⓘ
Oganesson hat die höchste Ordnungszahl und die höchste Atommasse aller bekannten Elemente. Das radioaktive Oganesson-Atom ist sehr instabil, und seit 2005 sind nur fünf (möglicherweise sechs) Atome des Isotops Oganesson-294 nachgewiesen worden. Obwohl dies nur eine sehr geringe experimentelle Charakterisierung seiner Eigenschaften und möglichen Verbindungen ermöglichte, haben theoretische Berechnungen zu vielen Vorhersagen geführt, darunter auch einige überraschende. So ist Oganesson zwar Mitglied der Gruppe 18 (Edelgase) - das erste synthetische Element, das dies ist -, aber im Gegensatz zu allen anderen Elementen dieser Gruppe möglicherweise sehr reaktiv. Früher wurde es unter normalen Bedingungen für ein Gas gehalten, doch aufgrund relativistischer Effekte wird es jetzt als Feststoff vorhergesagt. Im Periodensystem der Elemente ist es ein Element des p-Blocks und das letzte Element der Periode 7. ⓘ
Im Periodensystem steht es zwischen dem 117Tenness (2010 erstmals synthetisiert) und dem hypothetischen 119Ununennium. ⓘ
Einführung
- Einführung in die schwersten Elemente ⓘ
Geschichte
Frühe Spekulationen
Die Möglichkeit eines siebten Edelgases nach Helium, Neon, Argon, Krypton, Xenon und Radon wurde fast unmittelbar nach der Entdeckung der Edelgasgruppe erwogen. Der dänische Chemiker Hans Peter Jørgen Julius Thomsen sagte im April 1895, ein Jahr nach der Entdeckung des Argons, voraus, dass es eine ganze Reihe chemisch inerter Gase gibt, die dem Argon ähnlich sind und die Gruppen der Halogene und Alkalimetalle überbrücken würden: Er ging davon aus, dass das siebte dieser Reihe eine Periode von 32 Elementen abschließen würde, die Thorium und Uran enthielten und ein Atomgewicht von 292 hätten, was nahe bei den 294 liegt, die heute für das erste und einzige bestätigte Isotop von Oganesson bekannt sind. Der dänische Physiker Niels Bohr stellte 1922 fest, dass dieses siebte Edelgas die Ordnungszahl 118 haben sollte, und sagte seine elektronische Struktur als 2, 8, 18, 32, 32, 18, 8 voraus, was den modernen Vorhersagen entspricht. Daraufhin schrieb der deutsche Chemiker Aristid von Grosse 1965 einen Artikel, in dem er die wahrscheinlichen Eigenschaften des Elements 118 vorhersagte. Es dauerte 107 Jahre nach Thomsens Vorhersage, bis Oganesson erfolgreich synthetisiert wurde, obwohl seine chemischen Eigenschaften nicht untersucht wurden, um festzustellen, ob es sich wie das schwerere Kongener von Radon verhält. In einem Artikel von 1975 schlug der amerikanische Chemiker Kenneth Pitzer vor, dass Element 118 aufgrund relativistischer Effekte ein Gas oder eine flüchtige Flüssigkeit sein sollte. ⓘ
Unbestätigte Entdeckungsansprüche
Ende 1998 veröffentlichte der polnische Physiker Robert Smolańczuk Berechnungen über die Verschmelzung von Atomkernen zur Synthese von superschweren Atomen, darunter Oganesson. Seine Berechnungen deuteten darauf hin, dass es möglich sein könnte, das Element 118 durch Verschmelzung von Blei mit Krypton unter sorgfältig kontrollierten Bedingungen herzustellen, und dass die Fusionswahrscheinlichkeit (Wirkungsquerschnitt) dieser Reaktion nahe an der Blei-Chrom-Reaktion liegen würde, die das Element 106, Seaborgium, hervorgebracht hatte. Dies widersprach den Vorhersagen, wonach die Wirkungsquerschnitte für Reaktionen mit Blei- oder Wismut-Targets exponentiell abnehmen würden, je höher die Ordnungszahl der entstehenden Elemente ist. ⓘ
1999 machten sich Forscher des Lawrence Berkeley National Laboratory diese Vorhersagen zunutze und gaben die Entdeckung der Elemente 118 und 116 in einer in Physical Review Letters veröffentlichten Arbeit bekannt, und kurz darauf wurden die Ergebnisse in Science veröffentlicht. Die Forscher berichteten, dass sie die folgende Reaktion durchgeführt hatten ⓘ
- 208
82Pb
+ 86
36Kr
→ 293
118Og
+
n
. ⓘ
Im Jahr 2001 veröffentlichten sie einen Widerruf, nachdem Forscher in anderen Laboratorien nicht in der Lage waren, die Ergebnisse zu duplizieren, und auch das Berkeley-Labor sie nicht wiederholen konnte. Im Juni 2002 gab der Direktor des Labors bekannt, dass die ursprüngliche Behauptung der Entdeckung dieser beiden Elemente auf Daten beruhte, die vom Hauptautor Victor Ninov gefälscht worden waren. Neuere experimentelle Ergebnisse und theoretische Vorhersagen haben die exponentielle Abnahme der Wirkungsquerschnitte bei Blei- und Wismut-Targets mit zunehmender Ordnungszahl des resultierenden Nuklids bestätigt. ⓘ
Berichte über Entdeckungen
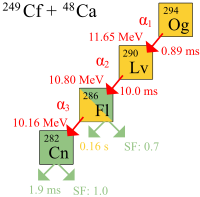
Der erste echte Zerfall von Oganesson-Atomen wurde 2002 am Joint Institute for Nuclear Research (JINR) in Dubna, Russland, von einem gemeinsamen Team russischer und amerikanischer Wissenschaftler beobachtet. Unter der Leitung von Juri Oganessian, einem russischen Kernphysiker armenischer Abstammung, gehörten dem Team auch amerikanische Wissenschaftler des Lawrence Livermore National Laboratory in Kalifornien an. Die Entdeckung wurde nicht sofort bekannt gegeben, da die Zerfallsenergie von 294Og mit der von 212mPo übereinstimmte, einer häufigen Verunreinigung, die bei Fusionsreaktionen zur Erzeugung überschwerer Elemente entsteht, und so wurde die Bekanntgabe bis nach einem Bestätigungsexperiment im Jahr 2005 verschoben, bei dem weitere Oganesson-Atome erzeugt werden sollten. Bei dem Experiment von 2005 wurden eine andere Strahlenergie (251 MeV anstelle von 245 MeV) und eine andere Targetdicke (0,34 mg/cm2 anstelle von 0,23 mg/cm2) verwendet. Am 9. Oktober 2006 gaben die Forscher bekannt, dass sie indirekt insgesamt drei (möglicherweise vier) Oganesson-294-Kerne nachgewiesen haben (einen oder zwei im Jahr 2002 und zwei weitere im Jahr 2005), die durch Kollisionen von Kalifornium-249-Atomen und Kalzium-48-Ionen entstanden sind. ⓘ
- 249
98Cf
+ 48
20Ca
→ 294
118Og
+ 3
n
. ⓘ
Im Jahr 2011 bewertete die IUPAC die Ergebnisse der Dubna-Livermore-Kollaboration aus dem Jahr 2006 und kam zu dem Schluss: "Die drei für das Isotop Z = 118 berichteten Ereignisse weisen eine sehr gute interne Redundanz auf, erfüllen aber nicht die Kriterien für eine Entdeckung". ⓘ
Wegen der sehr geringen Wahrscheinlichkeit einer Fusionsreaktion (der Fusionsquerschnitt beträgt ~0,3-0,6 pb oder (3-6)×10-41 m2) dauerte das Experiment vier Monate und erforderte eine Strahldosis von 2,5×1019 Kalziumionen, die auf das Kalifornium-Target geschossen werden mussten, um das erste aufgezeichnete Ereignis zu erzeugen, bei dem es sich vermutlich um die Synthese von Oganesson handelt. Dennoch waren die Forscher sehr zuversichtlich, dass es sich bei den Ergebnissen nicht um ein falsches positives Ergebnis handelte, da die Wahrscheinlichkeit, dass es sich bei den Entdeckungen um zufällige Ereignisse handelte, auf weniger als einen Teil in 100000 geschätzt wurde. ⓘ
Bei den Experimenten wurde der Alpha-Zerfall von drei Oganesson-Atomen beobachtet. Ein vierter Zerfall durch direkte Spontanspaltung wurde ebenfalls vorgeschlagen. Es wurde eine Halbwertszeit von 0,89 ms berechnet: 294
Og zerfällt in 290
Lv durch Alphazerfall. Da es nur drei Kerne gab, ist die aus den beobachteten Lebensdauern abgeleitete Halbwertszeit mit einer großen Unsicherheit behaftet: 0,89+1,07
-0,31 ms. ⓘ
- 294
118Og
→ 290
116Lv
+ 4
2He ⓘ
Die Identifizierung der 294
Og-Kerns wurde verifiziert, indem der mutmaßliche Tochterkern 290
Lv direkt durch einen Beschuss von 245
Cm mit 48
Ca-Ionen, ⓘ
- 245
96Cm
+ 48
20Ca
→ 290
116Lv
+ 3
n
, ⓘ
erzeugt und überprüft, ob der 290
Lv-Zerfall mit der Zerfallskette der 294
Og-Kerns übereinstimmt. Der Tochterkern 290
Lv ist sehr instabil und zerfällt mit einer Lebensdauer von 14 Millisekunden in 286
Fl, der entweder eine spontane Spaltung oder einen Alphazerfall in 282
Cn, der spontan gespalten werden kann. ⓘ
Bestätigung
Im Dezember 2015 erkannte die gemeinsame Arbeitsgruppe der internationalen wissenschaftlichen Gremien International Union of Pure and Applied Chemistry (IUPAC) und International Union of Pure and Applied Physics (IUPAP) die Entdeckung des Elements an und wies der Dubna-Livermore-Kollaboration die Priorität der Entdeckung zu. Grund dafür waren zwei Bestätigungen der Eigenschaften der Enkelin von 294Og, 286Fl, am Lawrence Berkeley National Laboratory in den Jahren 2009 und 2010 sowie die Beobachtung einer weiteren konsistenten Zerfallskette von 294Og durch die Dubna-Gruppe im Jahr 2012. Das Ziel dieses Experiments war die Synthese von 294Ts über die Reaktion 249Bk(48Ca,3n), aber die kurze Halbwertszeit von 249Bk führte dazu, dass eine beträchtliche Menge des Targets zu 249Cf zerfiel, was zur Synthese von Oganesson anstelle von Tennessin führte. ⓘ
Vom 1. Oktober 2015 bis zum 6. April 2016 führte das Dubna-Team ein ähnliches Experiment mit 48Ca-Projektilen durch, die auf ein Kalifornium-Target mit gemischten Isotopen (249Cf, 250Cf und 251Cf) gerichtet waren, um die schwereren Oganesson-Isotope 295Og und 296Og herzustellen. Es wurden zwei Strahlenergien von 252 MeV und 258 MeV verwendet. Bei der niedrigeren Strahlenergie wurde nur ein Atom beobachtet, dessen Zerfallskette zu der bereits bekannten von 294Og passte (und mit der spontanen Spaltung von 286Fl endete), und bei der höheren Strahlenergie wurde keines beobachtet. Das Experiment wurde daraufhin abgebrochen, da der Kleber der Sektorrahmen das Target bedeckte und verhinderte, dass Verdampfungsrückstände zu den Detektoren gelangten. Die Produktion von 293Og und seiner Tochter 289Lv sowie des noch schwereren Isotops 297Og ist mit dieser Reaktion ebenfalls möglich. Die Isotope 295Og und 296Og können auch bei der Verschmelzung von 248Cm mit 50Ti-Projektilen erzeugt werden. Eine im Sommer 2016 am RIKEN begonnene Suche nach 295Og im 3n-Kanal dieser Reaktion war erfolglos, obwohl eine Wiederaufnahme der Studie geplant ist; eine detaillierte Analyse und ein Grenzquerschnitt wurden nicht vorgelegt. Diese schwereren und wahrscheinlich stabileren Isotope könnten für die Erforschung der Chemie des Oganessons nützlich sein. ⓘ
Benennung

Unter Verwendung von Mendelejews Nomenklatur für unbenannte und unentdeckte Elemente wird Oganesson manchmal als Eka-Radon bezeichnet (bis in die 1960er Jahre als Eka-Emanation, wobei Emanation der alte Name für Radon war). 1979 wies die IUPAC dem unentdeckten Element den systematischen Platzhalter-Namen Ununoctium zu, mit dem entsprechenden Symbol Uuo, und empfahl, diesen bis zur bestätigten Entdeckung des Elements zu verwenden. Obwohl die Empfehlungen in der chemischen Gemeinschaft auf allen Ebenen, vom Chemieunterricht bis zu den Lehrbüchern für Fortgeschrittene, weit verbreitet waren, wurden sie von den Wissenschaftlern auf diesem Gebiet größtenteils ignoriert, die das Element als "Element 118" bezeichneten, mit dem Symbol E118, (118) oder auch einfach 118. ⓘ
Vor dem Rückzug im Jahr 2001 hatten die Forscher aus Berkeley beabsichtigt, das Element Ghiorsium (Gh) zu nennen, nach Albert Ghiorso (einem führenden Mitglied des Forschungsteams). ⓘ
Die russischen Entdecker meldeten ihre Synthese im Jahr 2006. Nach den Empfehlungen der IUPAC haben die Entdecker eines neuen Elements das Recht, einen Namen vorzuschlagen. Im Jahr 2007 erklärte der Leiter des russischen Instituts, dass das Team zwei Namen für das neue Element in Erwägung ziehe: flyorium, zu Ehren von Georgy Flyorov, dem Gründer des Forschungslabors in Dubna, und moskovium, in Anerkennung der Moskauer Oblast, in der Dubna liegt. Er erklärte auch, dass das Element zwar in Zusammenarbeit mit den Amerikanern entdeckt wurde, die das Kalifornium-Target zur Verfügung stellten, dass das Element aber zu Recht zu Ehren Russlands benannt werden sollte, da das Flyorov-Labor für Kernreaktionen am JINR die einzige Einrichtung der Welt war, die dieses Ergebnis erzielen konnte. Diese Namen wurden später für Element 114 (Flerovium) und Element 116 (Moscovium) vorgeschlagen. Flerovium wurde der Name von Element 114; der endgültige Name für Element 116 war Livermorium, während Moscovium später für Element 115 vorgeschlagen und akzeptiert wurde. ⓘ
Traditionell enden die Namen aller Edelgase auf "-on", mit Ausnahme von Helium, das bei seiner Entdeckung noch nicht als Edelgas bekannt war. Die zum Zeitpunkt der Entdeckungsgenehmigung geltenden IUPAC-Richtlinien verlangten jedoch, dass alle neuen Elemente mit der Endung "-ium" benannt werden, auch wenn sie sich als Halogene (traditionell mit der Endung "-ine") oder Edelgase (traditionell mit der Endung "-on") herausstellten. Während der vorläufige Name Ununoctium dieser Konvention folgte, wird in einer 2016 veröffentlichten neuen IUPAC-Empfehlung empfohlen, die Endung "-on" für neue Elemente der Gruppe 18 zu verwenden, unabhängig davon, ob sie die chemischen Eigenschaften eines Edelgases aufweisen. ⓘ
Die Wissenschaftler, die an der Entdeckung von Element 118 sowie von 117 und 115 beteiligt waren, hielten am 23. März 2016 eine Telefonkonferenz ab. Über das Element 118 wurde als letztes entschieden; nachdem Oganessian gebeten worden war, die Telefonkonferenz zu verlassen, beschlossen die verbleibenden Wissenschaftler einstimmig, das Element "Oganesson" nach ihm zu benennen. Oganessian war sechzig Jahre lang ein Pionier in der Erforschung superschwerer Elemente, die bis zu den Anfängen des Fachgebiets zurückreicht: Sein Team und die von ihm vorgeschlagenen Techniken hatten direkt zur Synthese der Elemente 107 bis 118 geführt. Mark Stoyer, ein Nuklearchemiker am LLNL, erinnerte sich später: "Wir hatten vor, diesen Namen von Livermore aus vorzuschlagen, und die Dinge wurden irgendwie gleichzeitig von mehreren Stellen vorgeschlagen. Ich weiß nicht, ob wir behaupten können, dass wir den Namen tatsächlich vorgeschlagen haben, aber wir hatten es vor." ⓘ
In internen Diskussionen fragte die IUPAC das JINR, ob das Element "oganeson" geschrieben werden solle, um der russischen Schreibweise besser zu entsprechen. Oganessian und das JINR lehnten dieses Angebot ab und beriefen sich dabei auf die zu Sowjetzeiten übliche Transliteration von Namen in das lateinische Alphabet nach den Regeln der französischen Sprache ("Oganessian" ist eine solche Transliteration) und argumentierten, dass "Oganesson" leichter mit der Person in Verbindung gebracht werden könne. Im Juni 2016 gab die IUPAC bekannt, dass die Entdecker beabsichtigten, dem Element den Namen Oganesson (Symbol: Og) zu geben. Der Name wurde am 28. November 2016 offiziell. Im Jahr 2017 kommentierte Oganessian die Namensgebung:
,,Für mich ist es eine Ehre. Die Entdeckung des Elements 118 wurde von Wissenschaftlern des Gemeinsamen Instituts für Kernforschung in Russland und des Lawrence Livermore National Laboratory in den USA gemacht, und es waren meine Kollegen, die den Namen Oganesson vorgeschlagen haben. Meine Kinder und Enkelkinder leben seit Jahrzehnten in den USA, aber meine Tochter schrieb mir, dass sie in der Nacht, in der sie es hörte, nicht schlafen konnte, weil sie weinte.
- Juri Oganessian ⓘ
Die Namensgebungszeremonie für Moscovium, Tennessine und Oganesson fand am 2. März 2017 in der Russischen Akademie der Wissenschaften in Moskau statt. ⓘ
In einem Interview aus dem Jahr 2019 antwortete Oganessian auf die Frage, wie es war, seinen Namen im Periodensystem neben Einstein, Mendelejew, den Curies und Rutherford zu sehen:
Nicht so sehr! Sehen Sie, nicht so sehr. In der Wissenschaft ist es üblich, etwas Neues nach seinem Entdecker zu benennen. Es ist nur so, dass es nur wenige Elemente gibt, und das passiert selten. Aber sehen Sie sich an, wie viele Gleichungen und Theoreme in der Mathematik nach jemandem benannt sind. Und in der Medizin? Alzheimer, Parkinson. Da ist nichts Besonderes dabei. ⓘ
Zunächst trug das Element den systematischen Namen Ununoctium (chemisches Symbol Uuo). Nach Meldungen planten die Entdecker, den Namen Moskowium für das neue Element vorzuschlagen, der dann von der IUPAC hätte bestätigt werden müssen. In den Medien wurde diese Bezeichnung bereits teilweise verwendet. Die amerikanische Gruppe um Ninov hatte zunächst zur Ehrung ihres Kollegen Albert Ghiorso, der entscheidend an der Entdeckung der Elemente 95 bis 106 beteiligt war, den Namen Ghiorsium vorgesehen. Der Vorschlag wurde nach Ablehnung der Forschungsergebnisse jedoch obsolet. ⓘ
Eigenschaften
294Og ist radioaktiv und mit einer Halbwertszeit von 0,89 ms sehr kurzlebig. Durch Alphazerfall zerfällt Oganesson in das Element Livermorium, das in Millisekunden weiter zerfällt. Es zählt zu den Transactinoiden und gehört chemisch zur Gruppe der Edelgase. Der Aggregatzustand von Oganesson ist unbekannt. Oganesson liegt im Periodensystem auf der diagonalen Grenze zu den Halbmetallen. Das Halogen Astat, das ebenfalls auf dieser Diagonalen liegt, hat den festen Aggregatzustand und ist vom Aussehen her eher metallisch. Das schwerere Isotop 294Og hat wie 294Ts die höchste experimentell nachgewiesene Massenzahl. ⓘ
Über die chemischen Eigenschaften von Oganesson gibt es bisher keine experimentellen Befunde, da das Element lediglich indirekt anhand seiner typischen Zerfallsprodukte nachgewiesen wurde. ⓘ
Abgesehen von den nuklearen Eigenschaften wurden bisher keine Eigenschaften von Oganesson oder seinen Verbindungen gemessen, da es nur in sehr begrenztem Umfang und sehr teuer hergestellt wird und sehr schnell zerfällt. Daher sind nur Vorhersagen möglich. ⓘ
Kernstabilität und Isotope

Die Stabilität der Kerne nimmt mit zunehmender Ordnungszahl nach Curium (Element 96), dessen Halbwertszeit um vier Größenordnungen länger ist als die aller nachfolgenden Elemente, rasch ab. Alle Nuklide mit einer Ordnungszahl über 101 unterliegen einem radioaktiven Zerfall mit Halbwertszeiten von weniger als 30 Stunden. Kein Element mit einer Ordnungszahl über 82 (nach Blei) hat stabile Isotope. Der Grund dafür ist die immer stärker werdende Coulomb-Abstoßung der Protonen, so dass die starke Kernkraft den Kern nicht lange gegen spontane Spaltung zusammenhalten kann. Berechnungen legen nahe, dass Elemente mit mehr als 104 Protonen nicht existieren dürften, wenn es keine anderen stabilisierenden Faktoren gibt. In den 1960er Jahren vermuteten Forscher jedoch, dass die geschlossenen Kernschalen um 114 Protonen und 184 Neutronen dieser Instabilität entgegenwirken und eine Insel der Stabilität schaffen sollten, in der Nuklide Halbwertszeiten von Tausenden oder Millionen von Jahren haben könnten. Die Wissenschaftler haben diese Insel zwar noch nicht erreicht, aber die bloße Existenz der superschweren Elemente (einschließlich Oganesson) bestätigt, dass dieser stabilisierende Effekt tatsächlich existiert, und im Allgemeinen werden die bekannten superschweren Nuklide exponentiell langlebiger, wenn sie sich dem vorhergesagten Ort der Insel nähern. Oganesson ist radioaktiv und hat eine Halbwertszeit, die weniger als eine Millisekunde zu betragen scheint. Diese Halbwertszeit ist jedoch immer noch länger als einige vorhergesagte Werte, was die Idee der Stabilitätsinsel weiter untermauert. ⓘ
Berechnungen auf der Grundlage eines Quanten-Tunnelmodells sagen die Existenz mehrerer schwerer Oganesson-Isotope mit Halbwertszeiten des Alphazerfalls von nahezu 1 ms voraus. ⓘ
Theoretische Berechnungen der Synthesewege und der Halbwertszeiten anderer Isotope haben gezeigt, dass einige von ihnen etwas stabiler sein könnten als das synthetisierte Isotop 294Og, am wahrscheinlichsten 293Og, 295Og, 296Og, 297Og, 298Og, 300Og und 302Og (das letzte erreicht den N = 184-Schalenschluss). Von diesen Isotopen könnte 297Og die besten Chancen bieten, langlebigere Kerne zu erhalten, und könnte daher im Mittelpunkt künftiger Arbeiten mit diesem Element stehen. Einige Isotope mit sehr viel mehr Neutronen, wie z. B. die Isotope um 313Og, könnten ebenfalls langlebige Kerne liefern. ⓘ
In einem Quanten-Tunnel-Modell wurde die Halbwertszeit des Alphazerfalls von 294
Og auf 0,66+0,23
-0,18 ms vorhergesagt, wobei der experimentelle Q-Wert im Jahr 2004 veröffentlicht wurde. Berechnungen mit theoretischen Q-Werten aus dem makroskopisch-mikroskopischen Modell von Muntian-Hofman-Patyk-Sobiczewski ergeben etwas niedrigere, aber vergleichbare Ergebnisse. ⓘ
Berechnete atomare und physikalische Eigenschaften
Oganesson ist ein Mitglied der Gruppe 18, der Elemente mit Nullvalenz. Die Mitglieder dieser Gruppe sind in der Regel inert gegenüber den meisten üblichen chemischen Reaktionen (z. B. Verbrennung), da die äußere Valenzschale vollständig mit acht Elektronen gefüllt ist. Dadurch entsteht eine stabile Konfiguration mit minimaler Energie, in der die Außenelektronen fest gebunden sind. Es wird vermutet, dass Oganesson ebenfalls eine geschlossene äußere Valenzschale hat, in der die Valenzelektronen in einer 7s27p6-Konfiguration angeordnet sind. ⓘ
Infolgedessen gehen einige davon aus, dass Oganesson ähnliche physikalische und chemische Eigenschaften wie die anderen Mitglieder seiner Gruppe hat, wobei es dem Edelgas Radon, das im Periodensystem über ihm steht, am ähnlichsten ist. Entsprechend dem Periodensystem dürfte Oganesson etwas reaktiver sein als Radon. Theoretische Berechnungen haben jedoch gezeigt, dass es wesentlich reaktiver sein könnte. Oganesson ist nicht nur weitaus reaktiver als Radon, sondern könnte sogar reaktiver sein als die Elemente Flerovium und Copernicium, die schwerere Homologe der chemisch aktiveren Elemente Blei bzw. Quecksilber sind. Der Grund für die mögliche Verstärkung der chemischen Aktivität von Oganesson im Vergleich zu Radon ist eine energetische Destabilisierung und eine radiale Ausdehnung der letzten besetzten 7p-Unterschale. Genauer gesagt führen beträchtliche Spin-Bahn-Wechselwirkungen zwischen den 7p-Elektronen und den inerten 7s-Elektronen effektiv zu einer zweiten Valenzschale, die sich bei Flerovium schließt, und zu einer signifikanten Abnahme der Stabilisierung der geschlossenen Schale von Oganesson. Es wurde auch berechnet, dass Oganesson im Gegensatz zu den anderen Edelgasen ein Elektron unter Abgabe von Energie bindet, oder anders ausgedrückt, dass es aufgrund des relativistisch stabilisierten 8s-Energieniveaus und des destabilisierten 7p3/2-Niveaus eine positive Elektronenaffinität aufweist, während für Kopernizium und Flerovium keine Elektronenaffinität vorhergesagt wird. Es hat sich jedoch gezeigt, dass quantenelektrodynamische Korrekturen diese Affinität erheblich verringern, indem sie die Bindung im Anion Og- um 9 % senken, was die Bedeutung dieser Korrekturen bei überschweren Elementen bestätigt. ⓘ
Es wird erwartet, dass Oganesson eine extrem breite Polarisierbarkeit aufweist, die fast doppelt so groß ist wie die von Radon. Mit Hilfe von Monte-Carlo-Simulationen und Molekulardynamik-Methoden, die mit hochgenauen relativistischen Coupled-Cluster-Berechnungen verglichen wurden, konnte gezeigt werden, dass Oganesson einen Schmelzpunkt von 325±15 K und einen Siedepunkt von 450±10 K hat. Der Grund für dieses Verhalten ist in relativistischen Spin-Bahn-Effekten zu suchen (nicht-relativistisches Oganesson würde bei 220 K schmelzen). Dieser genau ermittelte Schmelzpunkt für Oganesson unterscheidet sich stark von den zuvor geschätzten Werten von 263 K oder 247 K für den Siedepunkt. Somit wäre Oganesson unter Standardbedingungen wahrscheinlich eher ein Feststoff als ein Gas. ⓘ
Aufgrund seiner enormen Polarisierbarkeit wird erwartet, dass Oganesson eine anomal niedrige erste Ionisierungsenergie von 860,1 kJ/mol hat, ähnlich der von Cadmium und geringer als die von Iridium, Platin und Gold. Dieser Wert ist deutlich kleiner als die für Darmstadtium, Röntgenium und Kopernikium vorhergesagten Werte, obwohl er größer ist als der für Flerovium vorhergesagte. Sogar die Schalenstruktur im Kern und in der Elektronenwolke von Oganesson wird stark von relativistischen Effekten beeinflusst: Es wird erwartet, dass die Valenz- und Kernelektronen-Unterschalen in Oganesson in einem homogenen Fermi-Gas von Elektronen "verschmiert" sind, im Gegensatz zu denen von "weniger relativistischem" Radon und Xenon (obwohl es eine beginnende Delokalisierung in Radon gibt), aufgrund der sehr starken Spin-Bahn-Aufspaltung des 7p-Orbitals in Oganesson. Ein ähnlicher Effekt für Nukleonen, insbesondere Neutronen, ist im Kern 302Og mit geschlossener Neutronenschale im Entstehen begriffen und ist bei dem hypothetischen superschweren Kern 472164 mit geschlossener Schale, der 164 Protonen und 308 Neutronen enthält, stark ausgeprägt. Darüber hinaus können Spin-Bahn-Effekte dazu führen, dass Oganesson in der Masse ein Halbleiter ist, für den eine Bandlücke von 1,5±0,6 eV vorhergesagt wird. Alle leichteren Edelgase sind dagegen Isolatoren: Die Bandlücke von Radon in der Masse dürfte beispielsweise 7,1±0,5 eV betragen.) ⓘ
Og besitzt als einziges Gruppe-18-Element eine positive Elektronenaffinität und wäre damit chemisch reaktiv. Weiterhin tritt im Oganesson-Atom eine außerordentlich starke Spin-Bahn-Kopplung auf (beim 7p-Valenzorbital mehr als 10 eV), die zu einem Verlust der äußeren Elektronenschalenstruktur führt. Dies wiederum bewirkt, dass die äußeren Elektronen von Og eher an ein uniformes Elektronengas (Fermi-Gas) erinnern; dies lässt eine extrem hohe Polarisierbarkeit und einen hohen Schmelzpunkt erwarten. Weiterhin wurde kürzlich berechnet, dass kristallines Og eine sehr kleine Bandlücke von lediglich 1,0–1,5 eV aufweist, und damit im Gegensatz zu allen anderen Edelgaskristallen ein Halbleiter ist. ⓘ
Vorausgesagte Verbindungen
Das einzige bestätigte Isotop von Oganesson, 294Og, hat eine viel zu kurze Halbwertszeit, um chemisch experimentell untersucht zu werden. Daher wurden bisher keine Oganesson-Verbindungen synthetisiert. Dennoch wurden seit 1964 Berechnungen zu theoretischen Verbindungen durchgeführt. Man geht davon aus, dass ein Element, dessen Ionisierungsenergie hoch genug ist, nur schwer zu oxidieren ist und daher die häufigste Oxidationsstufe 0 ist (wie bei den Edelgasen); dies scheint jedoch nicht der Fall zu sein. ⓘ
Berechnungen für das zweiatomige Molekül Og
2 ergaben eine Bindungswechselwirkung, die in etwa derjenigen entspricht, die für Hg
2 berechnete Bindungswechselwirkung und eine Dissoziationsenergie von 6 kJ/mol, was etwa dem Vierfachen der Energie von Rn
2. Am auffälligsten ist, dass die berechnete Bindungslänge um 0,16 Å kürzer ist als bei Rn
2 um 0,16 Å kürzer ist, was auf eine bedeutende Bindungswechselwirkung hindeutet. Andererseits weist die Verbindung OgH+ eine Dissoziationsenergie (d. h. Protonenaffinität von Oganesson) auf, die kleiner ist als die von RnH+. ⓘ
Die Bindung zwischen Oganesson und Wasserstoff in OgH wird als sehr schwach vorhergesagt und kann eher als reine van-der-Waals-Wechselwirkung denn als echte chemische Bindung angesehen werden. Andererseits scheint Oganesson mit hoch elektronegativen Elementen stabilere Verbindungen zu bilden als zum Beispiel Copernicium oder Flerovium. Die stabilen Oxidationsstufen +2 und +4 wurden für die Fluoride OgF
2 und OgF
4. Der Zustand +6 wäre aufgrund der starken Bindung der Unterschale 7p1/2 weniger stabil. Dies ist auf die gleichen Spin-Bahn-Wechselwirkungen zurückzuführen, die Oganesson ungewöhnlich reaktiv machen. So wurde beispielsweise gezeigt, dass die Reaktion von Oganesson mit F
2 zur Bildung der Verbindung OgF
2 eine Energie von 106 kcal/mol freisetzen würde, von denen etwa 46 kcal/mol auf diese Wechselwirkungen zurückzuführen sind. Zum Vergleich: Die Spin-Orbit-Wechselwirkung für das ähnliche Molekül RnF
2 etwa 10 kcal/mol von einer Bildungsenergie von 49 kcal/mol. Die gleiche Wechselwirkung stabilisiert die tetraedrische Td-Konfiguration von OgF
4, im Gegensatz zu der quadratischen D4h-Konfiguration von XeF
4, die auch für RnF
4 haben sollte; dies liegt daran, dass OgF4 zwei träge Elektronenpaare (7s und 7p1/2) haben sollte. Es wird erwartet, dass OgF6 als solches ungebunden ist, was den erwarteten Trend zur Destabilisierung der Oxidationsstufe +6 fortsetzt (RnF6 wird voraussichtlich ebenfalls viel weniger stabil sein als XeF6). Die Og-F-Bindung wird höchstwahrscheinlich eher ionisch als kovalent sein, was die Oganesson-Fluoride nicht flüchtig macht. OgF2 wird aufgrund der hohen Elektropositivität von Oganesson voraussichtlich teilweise ionisch sein. Im Gegensatz zu den anderen Edelgasen (mit Ausnahme von Xenon und Radon) ist Oganesson voraussichtlich ausreichend elektropositiv, um eine Og-Cl-Bindung mit Chlor zu bilden. ⓘ
Eine Verbindung aus Oganesson und Tennessin, OgTs4, wurde als potenziell stabil vorhergesagt. ⓘ
Geschichte und Synthese
Erzeugung in Dubna
Im Jahr 2006 wurde erneut die Erzeugung des Elements 118 bekanntgegeben. Einige Atome des Elements waren in Dubna im Rahmen einer Zusammenarbeit des Vereinigten Instituts für Kernforschung und des Lawrence Livermore National Laboratory durch Beschuss von Californium mit Calcium-Ionen hergestellt worden. Identifizieren konnte man sie über ihre Alphazerfalls-Produkte. ⓘ
Die Synthese erfolgte per: