Phosphate

| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Systematischer IUPAC-Name
Phosphat | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
Beilstein-Referenz
|
3903772 | ||
| ChEBI | |||
| ChemSpider | |||
Gmelin-Referenz
|
1997 | ||
| MeSH | Phosphate | ||
PubChem CID
|
|||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
PO3- 4 | ||
| Molekulare Masse | 94,9714 g mol-1 | ||
| Konjugierte Säure | Monohydrogenphosphat | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
In der Chemie ist ein Phosphat ein Anion, Salz, eine funktionelle Gruppe oder ein Ester, das sich von einer Phosphorsäure ableitet. Am häufigsten ist damit Orthophosphat gemeint, ein Derivat der Orthophosphorsäure H
3PO
4. ⓘ
Das Phosphat- oder Orthophosphat-Ion [PO
4]3−
wird aus Phosphorsäure durch die Entfernung von drei Protonen H+ abgeleitet
. Durch Abspaltung von einem oder zwei Protonen entsteht das Dihydrogenphosphat-Ion [H
2PO
4]−
und das Hydrogenphosphat-Ion [HPO
4]2−
Ion. Diese Bezeichnungen werden auch für Salze dieser Anionen verwendet, wie z. B. Ammoniumdihydrogenphosphat und Trinatriumphosphat. ⓘ
Phosphat ⓘ
In der organischen Chemie ist Phosphat oder Orthophosphat ein Organophosphat, ein Ester der Orthophosphorsäure in der Form PO
4RR′R″, bei dem ein oder mehrere Wasserstoffatome durch organische Gruppen ersetzt sind. Ein Beispiel ist Trimethylphosphat, (CH
3)
3PO
4. Der Begriff bezieht sich auch auf die dreiwertige funktionelle Gruppe OP(O-)
3 in solchen Estern. ⓘ
Orthophosphate sind unter den verschiedenen Phosphaten besonders wichtig, da sie eine Schlüsselrolle in der Biochemie, Biogeochemie und Ökologie spielen und für die Landwirtschaft und Industrie von wirtschaftlicher Bedeutung sind. Das Hinzufügen und Entfernen von Phosphatgruppen (Phosphorylierung und Dephosphorylierung) sind Schlüsselschritte im Zellstoffwechsel. ⓘ
Orthophosphate können kondensieren und Pyrophosphate bilden. ⓘ
| Phosphate ⓘ |
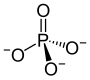 Das Anion PO43− |
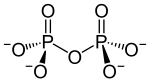 Ein Kondensat: Diphosphat |
 Ein Ester: Phosphorsäureester |
Chemische Eigenschaften
Das Phosphat-Ion hat eine molare Masse von 94,97 g/mol und besteht aus einem zentralen Phosphoratom, das von vier Sauerstoffatomen in einer tetraedrischen Anordnung umgeben ist. Es ist die konjugierte Base des Hydrogenphosphat-Ions H(PO
4)2−
, das wiederum die konjugierte Base des Dihydrogenphosphat-Ions H
2(PO
4)−
ist, das wiederum die konjugierte Base der Orthophosphorsäure, H
3PO
4. ⓘ
Viele Phosphate sind bei Standardtemperatur und -druck in Wasser löslich. Natrium-, Kalium-, Rubidium-, Cäsium- und Ammoniumphosphate sind alle wasserlöslich. Die meisten anderen Phosphate sind nur schwer oder gar nicht in Wasser löslich. In der Regel sind die Wasserstoff- und Dihydrogenphosphate etwas besser löslich als die entsprechenden Phosphate. ⓘ
Gleichgewichte in Lösung

In wässriger Lösung koexistieren die Orthophosphorsäure und ihre drei abgeleiteten Anionen gemäß den folgenden Dissoziations- und Rekombinationsgleichgewichten ⓘ
| Gleichgewicht | Dissoziationskonstante Ka | pKa ⓘ |
|---|---|---|
| H3PO4 ⇌ H 2PO- 4 + H+ |
Ka1 = [ H+ ] [ H 2PO- 4 ] / [ H 3PO 4 ] ≈ 7.5 × 10−3 |
pKa1 = 2,14 |
| H 2PO- 4 ⇌ HPO2- 4 + H+ |
Ka2 = [ H+ ] [ HPO2- 4 ] / [ H 2PO- 4 ] ≈ 6.2 × 10−8 |
pKa2 = 7,20 |
| HPO2- 4 ⇌ PO3- 4 + H+ |
Ka3 = [ H+ ] [ PO3- 4 ] / [ HPO2- 4 ] ≈ 2.14 × 10−13 |
pKa3 = 12,37 |
Die Werte gelten bei 25 °C und 0 Ionenstärke. ⓘ
Die pKa-Werte sind die pH-Werte, bei denen die Konzentration der einzelnen Spezies gleich der ihrer konjugierten Basen ist. Bei pH 1 oder darunter ist die Phosphorsäure praktisch undissoziiert. Bei einem pH-Wert von 4,7 (in der Mitte zwischen den ersten beiden pKa-Werten) ist das Dihydrogenphosphat-Ion, [H
2PO
4]−
praktisch die einzige vorhandene Spezies. Bei einem pH-Wert von 9,8 (in der Mitte zwischen dem zweiten und dem dritten pKa-Wert) ist das Monohydrogenphosphat-Ion [HPO
4]2−
die einzige vorhandene Spezies. Bei einem pH-Wert von 13 oder höher ist die Säure vollständig dissoziiert und das Phosphat-Ion, (PO
4)3−
. ⓘ
Dies bedeutet, dass die Salze der Mono- und Di-Phosphat-Ionen selektiv aus wässriger Lösung kristallisiert werden können, indem der pH-Wert entweder auf 4,7 oder 9,8 eingestellt wird. ⓘ
In der Tat werden H
3PO
4, H
2(PO
4)−
und H(PO
4)2−
verhalten sich wie getrennte schwache Säuren, da sich die aufeinander folgenden pKa um mehr als 4 unterscheiden. ⓘ
Phosphat kann viele polymere Ionen bilden, wie z. B. Pyrophosphat, (P
2O
7)4−
, und Triphosphat, (P
3O
10)5−
. Die verschiedenen Metaphosphat-Ionen (die in der Regel lange lineare Polymere sind) haben die empirische Formel (PO
3)−
und sind in vielen Verbindungen zu finden. ⓘ
Die Salze der dreibasigen ortho-Phosphorsäure (H3PO4) lassen sich in primäre, sekundäre und tertiäre Phosphate einteilen. Bei einwertigen Kationen M′ gelten die Summenformeln entsprechend M′H2PO4, M′2H1PO4 und M′3PO4. Durch die teilweise Neutralisation der Phosphorsäure erhält man Hydrogen- oder Dihydrogenphosphate. Diese können sowohl mit Säuren als auch mit Basen reagieren. Wegen dieser Eigenschaft enthalten viele Pufferlösungen Hydrogenphosphate. ⓘ
Biochemie der Phosphate
In biologischen Systemen kann Phosphor als freies Phosphatanion in Lösung (anorganisches Phosphat) oder an organische Moleküle gebunden als verschiedene Organophosphate vorkommen. ⓘ
Anorganisches Phosphat wird im Allgemeinen als Pi bezeichnet und besteht bei physiologischem (homöostatischem) pH-Wert hauptsächlich aus einer Mischung von [HPO
4]2−
und [H
2PO
4]−
Ionen. Bei einem neutralen pH-Wert, wie im Zytosol (pH = 7,0), haben die Konzentrationen der Orthophosphorsäure und ihrer drei Anionen die folgenden Verhältnisse
- [ H
2PO-
4 ] / [ H
3PO
4 ] ≈ 7.5 × 104 - [ HPO2-
4 ] / [ H
2PO-
4 ] ≈ 0.62 - [ PO3-
4 ] / [ HPO2-
4 ] ≈ 2.14 × 10-6
Somit kann nur [H
2PO
4]−
und [HPO
4]2−
Ionen in nennenswerten Mengen im Cytosol vorhanden (62 % [H
2PO
4]−
, 38% [HPO
4]2−
). In der extrazellulären Flüssigkeit (pH = 7,4) kehrt sich dieses Verhältnis um (61 % [HPO
4]2−
, 39% [H
2PO
4]−
). ⓘ
Anorganisches Phosphat kann auch in Form von Pyrophosphat-Anionen vorhanden sein [P
2O
7]4−
vorliegen, aus denen durch Hydrolyse Orthophosphat entstehen kann:
- [P
2O
7]4−
+ H2O ⇌ 2 [HPO
4]2− ⓘ
Organische Phosphate finden sich häufig in Form von Estern als Nukleotide (z. B. AMP, ADP und ATP) sowie in DNA und RNA. Freie Orthophosphat-Anionen können durch die Hydrolyse der Phosphoanhydridbindungen in ATP oder ADP freigesetzt werden. Diese Phosphorylierungs- und Dephosphorylierungsreaktionen sind die unmittelbare Speicherung und Energiequelle für viele Stoffwechselprozesse. ATP und ADP werden häufig als energiereiche Phosphate bezeichnet, ebenso wie die Phosphagene im Muskelgewebe. Ähnliche Reaktionen laufen auch bei den anderen Nukleosiddiphosphaten und -triphosphaten ab. ⓘ
Knochen und Zähne
Ein wichtiges Vorkommen von Phosphaten in biologischen Systemen ist die Verwendung als Strukturmaterial von Knochen und Zähnen. Diese Strukturen sind aus kristallinem Kalziumphosphat in Form von Hydroxylapatit aufgebaut. Der harte, dichte Zahnschmelz von Säugetierzähnen kann Fluorapatit enthalten, ein Hydroxycalciumphosphat, bei dem einige der Hydroxylgruppen durch Fluoridionen ersetzt wurden. ⓘ
Verwendung in der medizinischen und biologischen Forschung
Der medizinische Typ (Salz) von Phosphor ist das Phosphat. Einige Phosphate, die zur Heilung vieler Harnwegsinfektionen beitragen, werden verwendet, um den Urin saurer zu machen. Um die Bildung von Kalziumsteinen in den Harnwegen zu verhindern, werden einige Phosphate verwendet. Für Patienten, die mit ihrer täglichen Ernährung nicht genügend Phosphor aufnehmen können, werden Phosphate als Nahrungsergänzungsmittel verwendet, meist aufgrund bestimmter Störungen oder Krankheiten. Injizierbare Phosphate können nur von einem Arzt verabreicht werden. ⓘ
Pflanzlicher Stoffwechsel
Pflanzen nehmen Phosphor über verschiedene Wege auf: den arbuskulären Mykorrhizapfad und den direkten Aufnahmeweg. ⓘ
Nachteilige Auswirkungen auf die Gesundheit
Hyperphosphatämie, d. h. ein hoher Phosphatspiegel im Blut, wird in der Allgemeinbevölkerung mit einer erhöhten Sterblichkeit in Verbindung gebracht. Hyperphosphatämie wird in der Regel durch phosphathaltige Lebensmittelzusatzstoffe verursacht, da Phosphate, die von Natur aus in der Nahrung vorhanden sind, nicht vollständig vom Magen-Darm-Trakt aufgenommen werden. Phosphate führen zu Gefäßverkalkung, und es wurde festgestellt, dass eine hohe Phosphatkonzentration im Blut ein Prädiktor für kardiovaskuläre Ereignisse ist. ⓘ
Phosphate werden häufig als Zusatzstoffe in industriell verarbeiteten Lebensmitteln und Fast Food verwendet. Fast Food und verzehrfertige verarbeitete Lebensmittel tragen am meisten zum steigenden Phosphatkonsum der Bevölkerung bei. Phosphatzusätze sind auch in aromatisierten Erfrischungsgetränken und bestimmten Milcherzeugnissen weit verbreitet. ⓘ
Herstellung
Geologisches Vorkommen


Phosphate sind die natürlich vorkommende Form des Elements Phosphor, das in vielen Phosphatmineralien vorkommt. In der Mineralogie und Geologie bezeichnet Phosphat ein Gestein oder Erz, das Phosphat-Ionen enthält. Anorganische Phosphate werden abgebaut, um Phosphor für die Verwendung in Landwirtschaft und Industrie zu gewinnen. ⓘ
Der weltweit größte Produzent und Exporteur von Phosphaten ist Marokko. In Nordamerika liegen die größten Vorkommen in der Region Bone Valley in Zentralflorida, in der Region Soda Springs im Südosten von Idaho und an der Küste von North Carolina. Kleinere Vorkommen befinden sich in Montana, Tennessee, Georgia und South Carolina. Der kleine Inselstaat Nauru und seine Nachbarinsel Banaba Island, die früher über große Phosphatvorkommen bester Qualität verfügten, wurden übermäßig abgebaut. Rohphosphat ist auch in Ägypten, Israel, Palästina, der Westsahara, der Insel Navassa, Tunesien, Togo und Jordanien zu finden, also in Ländern, die über eine große Phosphatabbauindustrie verfügen. ⓘ
Phosphoritminen gibt es vor allem in:
- Nordamerika: Vereinigte Staaten, insbesondere Florida, mit geringeren Vorkommen in North Carolina, Idaho und Tennessee
- Afrika: Marokko, Algerien, Ägypten, Niger, Senegal, Togo, Tunesien.
- Naher Osten: Israel, Saudi-Arabien, Jordanien, Syrien, Iran und Irak, in der Stadt Akashat, nahe der jordanischen Grenze.
- Zentralasien: Kasachstan
- Ozeanien: Australien, Makatea, Nauru und Banaba Island ⓘ
Im Jahr 2007 ging man davon aus, dass die Phosphorvorräte bei der derzeitigen Verbrauchsrate in 345 Jahren erschöpft sein würden. Einige Wissenschaftler gingen jedoch davon aus, dass ein "Phosphor-Peak" in 30 Jahren eintreten würde, und Dana Cordell vom Institute for Sustainable Futures erklärte, dass "bei den derzeitigen Raten die Reserven in den nächsten 50 bis 100 Jahren erschöpft sein werden". Die Reserven beziehen sich auf die Menge, die zu aktuellen Marktpreisen als förderbar gilt. Im Jahr 2012 schätzte der USGS die weltweiten Reserven auf 71 Milliarden Tonnen, während 2011 weltweit 0,19 Milliarden Tonnen abgebaut wurden. Phosphor macht 0,1 % der Masse des durchschnittlichen Gesteins aus (während seine typische Konzentration in der Vegetation 0,03 % bis 0,2 % beträgt), und folglich gibt es in der 3×1019 Tonnen schweren Erdkruste Quadrillionen Tonnen Phosphor, wenn auch in einer überwiegend geringeren Konzentration als die als Reserven gezählten Vorkommen, die inventarisiert und billiger zu fördern sind. Wenn man davon ausgeht, dass es sich bei den Phosphatmineralien im Phosphatgestein hauptsächlich um Hydroxylapatit und Fluorapatit handelt, enthalten die Phosphatmineralien etwa 18,5 % Phosphor nach Gewicht. Wenn Phosphatgestein etwa 20 % dieser Mineralien enthält, hat das durchschnittliche Phosphatgestein einen Phosphorgehalt von etwa 3,7 Gewichtsprozent. ⓘ
Einige Phosphatvorkommen, wie Mulberry in Florida, zeichnen sich dadurch aus, dass sie erhebliche Mengen radioaktiver Uranisotope enthalten. Dies ist besorgniserregend, da bei der Ausbringung des entstehenden Phosphatdüngers Radioaktivität in Oberflächengewässer freigesetzt werden kann. ⓘ
Im Dezember 2012 meldete Cominco Resources eine aktualisierte JORC-konforme Ressource für sein Hinda-Projekt in Kongo-Brazzaville in Höhe von 531 Millionen Tonnen, womit es sich um die größte gemessene und angezeigte Phosphatlagerstätte der Welt handelt. ⓘ
Die Ressourcen von Phosphaten sind begrenzt. Die meisten sind belastet mit Cadmium und/oder radioaktiven Schwermetallen. Manche Phosphatlagerstätten dienten bislang als Quelle für Uran. Man geht davon aus, dass die zur Düngerproduktion nutzbaren Phosphatlagerstätten früher erschöpft sein werden als die weltweiten Erdölvorkommen. Der Cadmiumgehalt der Phosphatlagerstätten ist sehr unterschiedlich. Viele Industrieländer haben bereits einen Grenzwert für Cadmium in Düngemitteln eingeführt. So ist weltweit nur noch eine Lagerstätte bekannt, die den Grenzwert der EU unterschreitet (Kola). In Entwicklungsländern dagegen wird Düngung mit billigeren cadmiumverunreinigten Phosphatdüngern durchgeführt. ⓘ
Die früher in den Industrieländern praktizierte Nutzung von Thomasmehl (einem Nebenprodukt der Eisenerz-Verhüttung) ist auf Grund der hohen Chrombelastung aus Gesundheitsgründen ausgeschlossen. Eine weitere Möglichkeit ist, die im Klärschlamm vorhandenen gefällten oder biologisch angereicherten Phosphate zu nutzen oder zurückzugewinnen. In Deutschland und anderen Ländern wird Klärschlamm bisher meist verbrannt, da er häufig zahlreiche Schwermetalle und endokrine Disruptoren enthält. ⓘ
Da 85 % des in Deutschland verwendeten importierten Phosphats in die Landwirtschaft gehen, könnte ein Teil durch Klärschlamm ersetzt werden. Im Wirtschaftsjahr 2003/2004 lag der Düngemittelabsatz laut den Erhebungen des Statistischen Bundesamtes bei 112.000 Tonnen Phosphor. Dem sollte mit der Novellierung der Klärschlammverordnung 2017 Rechnung getragen werden, wonach „eine Rückgewinnung von Phosphor und eine Rückführung des gewonnenen Phosphors oder der phosphorhaltigen Klärschlammverbrennungsasche in den Wirtschaftskreislauf anzustreben“ ist. Auch in der Schweiz wurden entsprechende Überlegungen angestellt. Die Schweizer Dünger-Verordnung wurde 2001 entsprechend angepasst und es wurde ein Netzwerk für das Phosphorrecycling aufgebaut, an dem andere europäische Länder ebenfalls beteiligt sind. Inzwischen gibt es sieben entsprechende Pilotanlagen. ⓘ
Bergbau
Auf die drei wichtigsten Phosphaterzeugerländer (China, Marokko und die Vereinigten Staaten) entfallen rund 70 % der Weltproduktion. ⓘ
| Land | Herstellung (Millionen kg) |
Anteil an weltweiten Produktion (%) |
Reserven (Millionen kg) ⓘ |
|---|---|---|---|
| Algerien | 1,300 | 0.54 | 2,200,000 |
| Australien | 2,700 | 1.17 | 1,100,000 |
| Brasilien | 4,700 | 3.00 | 1,600,000 |
| China | 95,000 | 44.83 | 3,200,000 |
| Ägypten | 5,000 | 2.47 | 2,800,000 |
| Finnland | 995 | - | 1,000,000 |
| Indien | 1,480 | 0.49 | 46,000 |
| Irak | 200 | 0.09 | 430,000 |
| Israel | 2,810 | 1.48 | 57,000 |
| Jordanien | 9,220 | 3.36 | 800,000 |
| Kasachstan | 1,500 | 0.72 | 260,000 |
| Mexiko | 558 | 0.76 | 30,000 |
| Marokko und Westsahara | 35,500 | 13.45 | 50,000,000 |
| Peru | 4,000 | 1.79 | 210,000 |
| Russland | 13,100 | 5.60 | 600,000 |
| Saudi-Arabien | 6,500 | 1.48 | 1,400,000 |
| Senegal | 3,420 | 0.45 | 50,000 |
| Südafrika | 2,100 | 0.99 | 1,400,000 |
| Syrien | 2,000 | 0.34 | 1,800,000 |
| Togo | 800 | 0.45 | 30,000 |
| Tunesien | 4,110 | 1.79 | 100,000 |
| Usbekistan | 900 | - | 100,000 |
| Vereinigte Staaten | 23,300 | 12.37 | 1,000,000 |
| Vietnam | 4,650 | 1.21 | 30,000 |
| Andere Länder | 1,140 | 1.17 | 840,000 |
| Insgesamt | 227,000 | 100 | 71,000,000 |
Ökologie


In ökologischer Hinsicht ist Phosphat aufgrund seiner wichtigen Rolle in biologischen Systemen eine sehr begehrte Ressource. Sobald es verbraucht ist, ist es oft ein limitierender Nährstoff in der Umwelt, und seine Verfügbarkeit kann die Wachstumsrate von Organismen bestimmen. Dies gilt im Allgemeinen für Süßwasserumgebungen, während Stickstoff häufiger der begrenzende Nährstoff in Meeresumgebungen (Meerwasser) ist. Die Zufuhr hoher Phosphatmengen in Umgebungen und in Mikroumgebungen, in denen Phosphat normalerweise selten vorkommt, kann erhebliche ökologische Folgen haben. So kann es beispielsweise zu einer Vermehrung der Populationen einiger Organismen auf Kosten anderer und zum Zusammenbruch von Populationen kommen, denen Ressourcen wie Sauerstoff entzogen werden (siehe Eutrophierung). Im Zusammenhang mit der Verschmutzung sind Phosphate eine Komponente der gesamten gelösten Feststoffe, ein wichtiger Indikator für die Wasserqualität, aber nicht der gesamte Phosphor liegt in einer molekularen Form vor, die von Algen abgebaut und verbraucht werden kann. ⓘ
Kalziumhydroxylapatit- und Kalzitausfällungen finden sich in der Umgebung von Bakterien im alluvialen Oberboden. Da Tonmineralien die Biomineralisierung fördern, führte die Anwesenheit von Bakterien und Tonmineralien zu Kalziumhydroxylapatit- und Kalzitausfällungen. ⓘ
Phosphatlagerstätten können erhebliche Mengen an natürlich vorkommenden Schwermetallen enthalten. Bei der Verarbeitung von Phosphatgestein im Bergbau können Abraumhalden entstehen, die erhöhte Werte von Cadmium, Blei, Nickel, Kupfer, Chrom und Uran enthalten. Wenn sie nicht sorgfältig bewirtschaftet werden, können diese Abfallprodukte Schwermetalle ins Grundwasser oder in nahe gelegene Flussmündungen auslaugen. Die Aufnahme dieser Stoffe durch Pflanzen und Meereslebewesen kann zu einer Anreicherung von giftigen Schwermetallen in Nahrungsmitteln führen. ⓘ
Mit Ausnahme der Alkali- und Ammonium-Verbindungen sind die meisten Phosphate schlecht wasserlöslich. ⓘ
Phosphate können Verbindungen mit Schwermetallen eingehen. Diese Eigenschaft macht die Verwendung von Phosphaten problematisch, da die Phosphate aus dem Klärschlamm Schwermetalle mobilisieren können. ⓘ
Varianten
Kondensate
Phosphorsäure kann in einer Kondensationsreaktion (Wasserabspaltung) Diphosphorsäure (H4P2O7) bilden. Analog gibt es entsprechende Salze, die Diphosphate (Pyrophosphate) M'4P2O7. Bei einer fortgesetzten Reaktion bilden sich auch poly- oder cyclo-Phosphate. cyclo-Phosphate werden oft Metaphosphate genannt. Polyphosphate und Metaphosphate sind also Polymere der Salze der Phosphorsäure. ⓘ
| di-, poly- und cyclo-Phosphate ⓘ | ||
|---|---|---|
| Name | Reaktion | Struktur des Anions |
| di-Phosphat (auch: Pyrophosphat) |

| |
| tri-Phosphat (allg.: poly-Phosphat) |

| |
| meta-Phosphat (allg.: cyclo-Phosphat) |

| |
Pentanatriumtriphosphat (Na5P3O10) und Metaphosphate wurden zur Wasserenthärtung in Waschmitteln verwendet. Als Lebensmittelzusatzstoffe finden z. B. Pentanatriumtriphosphat und Diphosphate Anwendung. ⓘ
Eigenschaften
Anionen und pH-Werte
In wässriger Lösung existieren Phosphat-Anionen in drei Formen. Unter stark basischen Bedingungen liegt das Phosphat-Anion hauptsächlich als (PO43−) vor, während unter schwach basischen Bedingungen das Hydrogenphosphat-Anion (HPO42−) dominiert. Unter schwach sauren Bedingungen liegt hauptsächlich das Dihydrogenphosphat-Anion (H2PO4−) vor. In stark saurer wässriger Lösung ist Phosphorsäure (H3PO4) die Hauptform. ⓘ
Es liegen also drei pH-abhängige Gleichgewichtsreaktionen vor:
| Gleichgewichtsreaktionen | Gleichgewichtskonstante bei 25 °C ⓘ | |
|---|---|---|
| (1) | ||
| (2) | ||
| (3) | ||
Unter stark alkalischen Bedingungen, wie z. B. bei pH = 13 liegt im Wesentlichen PO43− und HPO42− vor. Ist die Lösung neutral (pH = 7.0) liegen H2PO4− (62 %) und HPO42− (38 %) vor. Bei pH = 7.4 dreht sich das Verhältnis der beiden Komponenten etwa um: 39 % H2PO4− und 61 % HPO42−. Unter stark sauren Bedingungen (pH=1) ist H3PO4 dominierend im Vergleich zu H2PO4−. HPO42− und PO43− sind praktisch abwesend. ⓘ
Bedeutung für die Ernährung
In der menschlichen Ernährung spielt Phosphat eine wesentliche Rolle im Energiestoffwechsel und im Knochenumbau. Es verbindet sich mit Calcium zum festen Calciumapatit. Der Phosphatspiegel steht im engen Zusammenhang mit dem Calciumspiegel. Die Bedeutung von Phosphat für das Auftreten von Hyperaktivität bei Kindern gilt als widerlegt. ⓘ
Verwendung
Dünger
Die Hauptmenge der Phosphate kommt als Dünger zum Einsatz (siehe Phosphatdünger, Superphosphat, Doppelsuperphosphat). Die Eignung von Phosphaten für die Düngung wurde durch Zufall entdeckt: bei der Eisen- und Stahlerzeugung nach dem Thomas-Verfahren fiel als Nebenprodukt das phosphatreiche Thomasmehl an, das sich als hervorragender Dünger erwies. ⓘ
Durch Erosion von landwirtschaftlichen Flächen gelangen Phosphate an Tonminerale gebunden in Flüsse und Seen und von dort weiter in die Meere. In limnischen als auch marinen Ökosystemen tragen sie erheblich zur Eutrophierung bei. Phosphate sind unter anderem ein Auslöser von Blaualgenblüten (Cyanobakterien) in der Ostsee. ⓘ
Waschmittelzusatz
Zur Enthärtung von Wasser kann Pentanatriumtriphosphat verwendet werden. Auf den Einsatz von Phosphaten in Waschmitteln wird in Teilen Europas inzwischen verzichtet, da sie zu einer Überdüngung und schließlich zum Umkippen von Gewässern geführt haben. Als Ersatz wird hierzu Zeolith A eingesetzt. In Maschinengeschirrspülmitteln werden allerdings immer noch Tripolyphosphate als Enthärter verwendet. Tests der Stiftung Warentest im Jahr 2015 und 2016 haben gezeigt, dass einige phosphatfreie Spülmaschinentabs bereits eine vergleichbar gute Reinigungswirkung erzielen wie phosphathaltige Mittel. Die Detergenzienverordnung (EG) Nr. 648/2004 schreibt durch die Änderungsverordnung (EU) Nr. 259/2012 im Anhang VIa vor, dass ab dem 1. Januar 2017 nur noch Maschinengeschirrspülmittel für Privatverbraucher in den Verkehr gebracht werden dürfen, die weniger als 0,3 Gramm Phosphor pro Standarddosierung enthalten. ⓘ
Lebensmittelzusatzstoff
Natriumphosphat (E 339), Kaliumphosphat (E 340), Calciumphosphat (E 341), Magnesiumphosphate (E 343) und die Salze der ortho-Phosphorsäure Diphosphat (E 450), Triphosphat (E 451) und Polyphosphat (E 452) sind als Lebensmittelzusatzstoffe zugelassen und werden als Konservierungsmittel, Säuerungsmittel, Säureregulator, als Trennmittel und Emulgator eingesetzt. Phosphat wird für nichtalkoholische, aromatisierte Getränke (Colagetränke; in diesen auch als Phosphorsäure (E 338)), sterilisierte und ultrahocherhitzte Milch, eingedickte Milch, Milch- und Magermilchpulver und als technischer Hilfsstoff (verhindert das Zusammenklumpen von rieselfähigen Lebensmitteln) verwendet. Phosphate spielen auch bei der Lebensmittelherstellung (vor allem in der Fleischindustrie) eine sehr große Rolle und sind Komponenten des Schmelzsalzes für Schmelzkäse. ⓘ
Eine erhöhte Phosphatzufuhr über die Nahrung steigert den Blutdruck und die Pulsrate auch bei gesunden jungen Erwachsenen. ⓘ
Sonstige Verwendungen
Futtermittel, Korrosionsschutzmittel (siehe Phosphatierung); Flammschutzmittel; Puffersubstanz für neutralen pH-Bereich (s. o.), Akkumulatoren (Lithium-Eisenphosphat-Akkumulator). ⓘ
32P, ein radioaktives Isotop des Phosphors, wird in Form von Dihydrogenphosphat (oder Natriumphosphat) vielseitig in der Forschung und in der nuklearmedizinischen Therapie speziell bei Polycythaemia vera eingesetzt (Radiophosphortherapie). ⓘ
Nachweis
Nachweisreaktionen von Phosphaten werden unter Phosphor beschrieben. ⓘ









![{\displaystyle K_{a1}=\mathrm {\frac {[H_{2}PO_{4}^{\,-}][H_{3}O^{+}]}{[H_{3}PO_{4}]}} \simeq 7{,}5\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/369a6c440b5efdda5a6819860cb4314e098e75a9)

![{\displaystyle K_{a2}=\mathrm {\frac {[HPO_{4}^{2-}][H_{3}O^{+}]}{[H_{2}PO_{4}^{\,-}]}} \simeq 6{,}2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f27bd3b099cf3f4c337951c1f6ba691be8c0748)

![{\displaystyle K_{a3}=\mathrm {\frac {[PO_{4}^{3-}][H_{3}O^{+}]}{[HPO_{4}^{2-}]}} \simeq 2{,}14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/787b16a7960ba1083bae5e371cf83e4ed451a828)
