Radon
| Radon | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /ˈreɪdɒn/ (RAY-don) | |||||||||||||||||||||||||||
| Erscheinungsbild | farbloses Gas | |||||||||||||||||||||||||||
| Massenzahl | [222] | |||||||||||||||||||||||||||
| Radon im Periodensystem | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 86 | |||||||||||||||||||||||||||
| Gruppe | Gruppe 18 (Edelgase) | |||||||||||||||||||||||||||
| Periode | Periode 6 | |||||||||||||||||||||||||||
| Block | p-Block | |||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Xenon|Xe]]] 4f14 5d10 6s2 6p6 | |||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 18, 32, 18, 8 | |||||||||||||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||||||||||||
| Phase bei STP | Gas | |||||||||||||||||||||||||||
| Schmelzpunkt | 202 K (-71 °C, -96 °F) | |||||||||||||||||||||||||||
| Siedepunkt | 211,5 K (-61,7 °C, -79,1 °F) | |||||||||||||||||||||||||||
| Dichte (bei STP) | 9,73 g/L | |||||||||||||||||||||||||||
| in flüssigem Zustand (bei BSP) | 4,4 g/cm3 | |||||||||||||||||||||||||||
| Kritischer Punkt | 377 K, 6,28 MPa | |||||||||||||||||||||||||||
| Schmelzwärme | 3.247 kJ/mol | |||||||||||||||||||||||||||
| Verdampfungswärme | 18,10 kJ/mol | |||||||||||||||||||||||||||
| Molare Wärmekapazität | 5R/2 = 20,786 J/(mol-K) | |||||||||||||||||||||||||||
Verdampfungsdruck
| ||||||||||||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||||||||||||
| Oxidationsstufen | 0, +2, +6 | |||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 2,2 | |||||||||||||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||||||||||||
| Kovalenter Radius | 150 pm | |||||||||||||||||||||||||||
| Van-der-Waals-Radius | 220 pm | |||||||||||||||||||||||||||
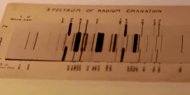
| Spektrallinien von Radon | ||||||||||||||||||||||||||||
| Andere Eigenschaften | ||||||||||||||||||||||||||||
| Natürliches Vorkommen | durch Zerfall | |||||||||||||||||||||||||||
| Kristallstruktur | kubisch-flächenzentriert (fcc) | |||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 3,61×10-3 W/(m⋅K) | |||||||||||||||||||||||||||
| Magnetische Ordnung | nicht-magnetisch | |||||||||||||||||||||||||||
| CAS-Nummer | 10043-92-2 | |||||||||||||||||||||||||||
| Geschichte | ||||||||||||||||||||||||||||
| Entdeckung | Ernest Rutherford und Robert B. Owens (1899) | |||||||||||||||||||||||||||
| Erste Isolierung | William Ramsay und Robert Whytlaw-Gray (1910) | |||||||||||||||||||||||||||
| Die wichtigsten Isotope des Radons | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Radon ist ein chemisches Element mit dem Symbol Rn und der Ordnungszahl 86. Es ist ein radioaktives, farbloses, geruchloses und geschmackloses Edelgas. Es kommt in der Natur in winzigen Mengen als Zwischenschritt in den normalen radioaktiven Zerfallsketten vor, durch die Thorium und Uran langsam in Blei und verschiedene andere kurzlebige radioaktive Elemente zerfallen. Radon selbst ist das unmittelbare Zerfallsprodukt von Radium. Sein stabilstes Isotop, 222Rn, hat eine Halbwertszeit von nur 3,8 Tagen und ist damit eines der seltensten Elemente. Da Thorium und Uran zwei der am häufigsten vorkommenden radioaktiven Elemente auf der Erde sind und zudem drei Isotope mit Halbwertszeiten in der Größenordnung von mehreren Milliarden Jahren haben, wird Radon trotz seiner kurzen Halbwertszeit noch lange auf der Erde vorhanden sein. Beim Zerfall von Radon entstehen viele andere kurzlebige Nuklide, die als "Radontöchter" bezeichnet werden und bei den stabilen Isotopen von Blei enden. ⓘ
Im Gegensatz zu allen anderen Zwischenelementen in den oben genannten Zerfallsketten ist Radon unter Standardbedingungen gasförmig und kann leicht eingeatmet werden, was eine Gefahr für die Gesundheit darstellt. Es trägt häufig am stärksten zur Hintergrundstrahlung einer Person bei, aber aufgrund lokaler Unterschiede in der Geologie ist die Belastung durch Radongas von Ort zu Ort unterschiedlich hoch. Eine häufige Quelle sind uranhaltige Mineralien im Boden, weshalb es sich in unterirdischen Bereichen wie Kellern ansammelt. Radon kann auch in bestimmten Grundwässern wie Quellwasser und heißen Quellen vorkommen. Der Klimawandel kann dazu führen, dass Radon, das zuvor im Untergrund eingeschlossen war, freigesetzt wird, wenn der Permafrost auftaut, insbesondere in Gebieten wie der Arktis, Alaska, Kanada, Grönland und Russland. Es ist möglich, auf Radon zu testen und Techniken wie die Druckentlastung unter der Decke zur Schadensbegrenzung einzusetzen. ⓘ
Epidemiologische Studien haben einen klaren Zusammenhang zwischen dem Einatmen hoher Radonkonzentrationen und dem Auftreten von Lungenkrebs gezeigt. Radon ist ein Schadstoff, der die Qualität der Innenraumluft weltweit beeinträchtigt. Nach Angaben der US-Umweltschutzbehörde (EPA) ist Radon nach dem Zigarettenrauchen die zweithäufigste Ursache für Lungenkrebs und verursacht in den Vereinigten Staaten jährlich 21.000 Todesfälle durch Lungenkrebs. Etwa 2 900 dieser Todesfälle treten bei Menschen auf, die nie geraucht haben. Während Radon die zweithäufigste Ursache für Lungenkrebs ist, ist es nach Schätzungen der EPA, die sich an der Politik orientieren, bei Nichtrauchern die häufigste Ursache. Erhebliche Unsicherheiten bestehen hinsichtlich der gesundheitlichen Auswirkungen einer niedrigen Dosis. Im Gegensatz zum gasförmigen Radon selbst sind Radontöchter fest und haften an Oberflächen, z. B. in Form von Staubpartikeln in der Luft, die beim Einatmen Lungenkrebs verursachen können. ⓘ
Radon [ˈʁaːdɔn], auch: [ʁaˈdoːn] (wie Radium wegen seiner Radioaktivität von lateinisch radius „Strahl“) ist ein radioaktives chemisches Element mit dem Elementsymbol Rn und der Ordnungszahl 86. Im Periodensystem steht es in der 8. Hauptgruppe, bzw. der 18. IUPAC-Gruppe und zählt damit zu den Edelgasen (daher die Endung -on als Analogiebildung). ⓘ
Da sich Radon in Häusern (im Gegensatz zur natürlichen Umgebung) in schlecht belüfteten Räumen ansammeln kann, stellt es eine Gefahr für die Gesundheit und eine erhebliche Radonbelastung dar. Die hauptsächliche Gefahrenquelle sind letztlich nicht das Radon selbst, sondern seine Zerfallsprodukte, wobei Polonium-Isotope am meisten zur Belastung durch Alphastrahlung beitragen. Radon hat am gesamten Strahlungsaufkommen auf der Erdoberfläche den bei weitem größten Anteil (durchschnittliche effektive Dosis pro Person in Deutschland: etwa 1,1 mSv/Jahr), gefolgt von der direkten terrestrischen Strahlung mit ca. 0,4 mSv/Jahr, der direkten kosmischen Strahlung und den natürlicherweise in der Nahrung vorkommenden radioaktiven Stoffen mit je etwa 0,3 mSv/Jahr. ⓘ
Merkmale
Physikalische Eigenschaften
Radon ist ein farb-, geruch- und geschmackloses Gas und kann daher mit den menschlichen Sinnen allein nicht wahrgenommen werden. Bei Standardtemperatur und -druck bildet es ein einatomiges Gas mit einer Dichte von 9,73 kg/m3, was etwa dem Achtfachen der Dichte der Erdatmosphäre auf Meereshöhe (1,217 kg/m3) entspricht. Es ist eines der dichtesten Gase bei Raumtemperatur und das dichteste der Edelgase. Obwohl es bei Standardtemperatur und -druck farblos ist, strahlt es bei Abkühlung unter seinen Gefrierpunkt von 202 K (-71 °C; -96 °F) eine brillante Radiolumineszenz aus, die bei sinkender Temperatur von gelb zu orangerot wechselt. Wenn es kondensiert, leuchtet es aufgrund der intensiven Strahlung, die es erzeugt. Es ist wenig wasserlöslich, aber besser löslich als die leichteren Edelgase. In organischen Flüssigkeiten ist es deutlich besser löslich als in Wasser. Seine Löslichkeitsgleichung lautet wie folgt, ⓘ
- , ⓘ
wobei die molare Fraktion von Radon ist, die absolute Temperatur ist und und Lösungsmittelkonstanten sind. ⓘ
Chemische Eigenschaften
Radon gehört zu den nullwertigen Elementen, die als Edelgase bezeichnet werden, und ist chemisch nicht sehr reaktiv. Die Halbwertszeit von Radon-222 von 3,8 Tagen macht es in den Naturwissenschaften zu einem nützlichen Tracer. Da Radon im Gegensatz zu seinen Zerfallsketten-Eltern unter Standardbedingungen ein Gas ist, kann es für Forschungszwecke leicht aus ihnen extrahiert werden. ⓘ
Es ist inert gegenüber den meisten üblichen chemischen Reaktionen, wie z. B. der Verbrennung, da die äußere Valenzschale acht Elektronen enthält. Dadurch entsteht eine stabile Konfiguration mit minimaler Energie, in der die Außenelektronen fest gebunden sind. Seine erste Ionisierungsenergie - die Mindestenergie, die erforderlich ist, um ihm ein Elektron zu entziehen - beträgt 1037 kJ/mol. Im Einklang mit dem Periodensystem hat Radon eine geringere Elektronegativität als das Element eine Periode vor ihm, Xenon, und ist daher reaktiver. Frühe Studien kamen zu dem Schluss, dass die Stabilität von Radonhydrat in der gleichen Größenordnung liegen sollte wie die von Chlor- (Cl
2) oder Schwefeldioxid (SO
2) und deutlich höher als die Stabilität von Schwefelwasserstoffhydraten (H
2S). ⓘ
Aufgrund der Kosten und der Radioaktivität des Radons werden nur selten experimentelle chemische Forschungen mit Radon durchgeführt, so dass nur wenige Radonverbindungen bekannt sind, die alle entweder Fluoride oder Oxide sind. Radon kann durch starke Oxidationsmittel wie Fluor oxidiert werden und bildet dann Radondifluorid (RnF
2). Bei einer Temperatur von über 523 K (250 °C; 482 °F) zerfällt es wieder in seine Elemente und wird durch Wasser zu Radongas und Fluorwasserstoff reduziert: Es kann auch durch Wasserstoffgas in seine Elemente zurückverwandelt werden. Es hat eine geringe Flüchtigkeit und wurde für RnF
2. Aufgrund der kurzen Halbwertszeit von Radon und der Radioaktivität seiner Verbindungen war es nicht möglich, diese Verbindung im Detail zu untersuchen. Theoretische Studien über dieses Molekül sagen voraus, dass es einen Rn-F-Bindungsabstand von 2,08 ångström (Å) haben sollte und dass die Verbindung thermodynamisch stabiler und weniger flüchtig ist als sein leichteres Gegenstück Xenondifluorid (XeF
2). Das oktaedrische Molekül RnF
6 wurde eine noch niedrigere Bildungsenthalpie vorhergesagt als das Difluorid. Es wird angenommen, dass sich das [RnF]+-Ion durch die folgende Reaktion bildet:
- Rn (g) + 2 [O
2]+
[SbF
6]−
(s) → [RnF]+
[Sb
2F
11]−
(s) + 2 O
2 (g) ⓘ
Aus diesem Grund wird Antimonpentafluorid zusammen mit Chlortrifluorid und N
2F
2Sb
2F
11 wurden wegen der Bildung von Radon-Fluor-Verbindungen für die Radongasbeseitigung in Uranminen in Betracht gezogen. Radonverbindungen können durch den Zerfall von Radium in Radiumhalogeniden gebildet werden, eine Reaktion, die zur Verringerung der Radonmenge genutzt wurde, die während der Bestrahlung aus den Zielen entweicht. Außerdem können Salze des [RnF]+-Kations mit den Anionen SbF-
6, TaF-
6 und BiF-
6 bekannt. Radon wird auch durch Dioxyddifluorid zu RnF
2 bei 173 K (-100 °C; -148 °F) oxidiert. ⓘ
Radonoxide gehören zu den wenigen anderen gemeldeten Verbindungen von Radon; nur das Trioxid (RnO
3) ist bestätigt worden. Die höheren Fluoride RnF
4 und RnF
6 wurden behauptet und gelten als stabil, aber es ist fraglich, ob sie bisher synthetisiert wurden. Sie könnten in Experimenten beobachtet worden sein, bei denen unbekannte radonhaltige Produkte zusammen mit Xenonhexafluorid destilliert wurden: Es könnte sich um RnF
4, RnF
6 oder beides sein. Bei der Erhitzung von Radon mit Xenon, Fluor, Brompentafluorid und entweder Natriumfluorid oder Nickelfluorid wurde angeblich auch ein höheres Fluorid erzeugt, das zu RnO
3. Es wurde zwar behauptet, dass diese Behauptungen in Wirklichkeit auf die Ausfällung von Radon in Form des festen Komplexes [RnF]+
2[NiF6]2- ausfällt, wurde die Tatsache, dass Radon aus wässriger Lösung zusammen mit CsXeO
3F aus wässriger Lösung kopräzipitiert, wurde als Bestätigung dafür angesehen, dass RnO
3 gebildet wurde, was durch weitere Untersuchungen der hydrolysierten Lösung bestätigt wurde. Dass sich [RnO3F]- in anderen Experimenten nicht bildete, könnte auf die hohe Konzentration des verwendeten Fluorids zurückzuführen sein. Elektromigrationsstudien deuten auch auf das Vorhandensein von kationischen [HRnO3]+ und anionischen [HRnO4]- Formen von Radon in schwach saurer wässriger Lösung (pH > 5) hin, wobei das Verfahren zuvor durch die Untersuchung des homologen Xenontrioxids validiert worden war. ⓘ
Die Schwierigkeit, höhere Fluoride des Radons zu identifizieren, ist wahrscheinlich darauf zurückzuführen, dass Radon aufgrund der starken Ionizität von Radondifluorid (RnF
2) und der hohen positiven Ladung des Radons in RnF+ daran gehindert wird, über den zweiwertigen Zustand hinaus oxidiert zu werden; eine räumliche Trennung der RnF
2-Moleküle kann notwendig sein, um höhere Fluoride des Radons eindeutig zu identifizieren, von denen RnF
4 stabiler sein dürfte als RnF
6 aufgrund der Spin-Bahn-Aufspaltung der 6p-Schale von Radon stabiler sein dürfte (RnIV hätte eine geschlossene Schale 6s2
6p2
1/2-Konfiguration). Während also RnF
4 eine ähnliche Stabilität haben sollte wie Xenontetrafluorid (XeF
4) haben sollte, wäre RnF
6 wahrscheinlich viel weniger stabil sein als Xenonhexafluorid (XeF
6): Radonhexafluorid wäre wahrscheinlich auch ein regelmäßiges oktaedrisches Molekül, im Gegensatz zu der verzerrten oktaedrischen Struktur von XeF
6 wegen des Trägheitspaareffekts. Eine Extrapolation der Edelgasgruppe nach unten würde auch die mögliche Existenz von RnO, RnO2 und RnOF4 sowie der ersten chemisch stabilen Edelgaschloride RnCl2 und RnCl4 nahelegen, von denen jedoch noch keines gefunden wurde. ⓘ
Radoncarbonyl (RnCO) wurde als stabil und mit einer linearen Molekülgeometrie vorhergesagt. Die Moleküle Rn
2 und RnXe wurden durch Spin-Orbit-Kopplung erheblich stabilisiert. Radon, das in ein Fulleren eingeschlossen ist, wurde als Medikament gegen Tumore vorgeschlagen. Trotz der Existenz von Xe(VIII) wurde behauptet, dass es keine Rn(VIII)-Verbindungen gibt; RnF
8 sollte chemisch höchst instabil sein (XeF8 ist thermodynamisch instabil). Die stabilste Rn(VIII)-Verbindung dürfte Bariumperradonat (Ba2RnO6) sein, analog zu Bariumperxenat. Die Instabilität von Rn(VIII) ist auf die relativistische Stabilisierung der 6s-Schale zurückzuführen, die auch als Inertpaareffekt bekannt ist. ⓘ
Radon reagiert mit den flüssigen Halogenfluoriden ClF, ClF
3, ClF
5, BrF
3, BrF
5 und IF
7 unter Bildung von RnF
2. In Halogenfluoridlösung ist Radon nicht flüchtig und liegt in Form der Kationen RnF+ und Rn2+ vor; die Zugabe von Fluoridanionen führt zur Bildung der Komplexe RnF-
3 und RnF2-
4, die der Chemie von Beryllium(II) und Aluminium(III) entsprechen. Das Standardelektrodenpotential des Rn2+/Rn-Paares wurde auf +2,0 V geschätzt, obwohl es keine Hinweise auf die Bildung stabiler Radon-Ionen oder -Verbindungen in wässriger Lösung gibt. ⓘ
Isotope
Es sind 34 Isotope und 4 Kernisomere des Radons bekannt, die alle radioaktiv sind. Das bisher schwerste Isotop 229Rn wurde 2008 im CERN-Isotopenlabor ISOLDE durch den Beschuss von Urankernen mit hochenergetischen Protonen erhalten. Seine Halbwertszeit beträgt 12 Sekunden. ⓘ
In den drei natürlichen Zerfallsketten kommen nur die vier Isotope 222Rn, 220Rn, 219Rn und 218Rn vor, welche alle Alphastrahler sind. Daneben entsteht in der heute künstlichen Neptunium-Reihe der Alphastrahler 217Rn. ⓘ
- Radon 222Rn ist das Zerfallsprodukt des Radiumisotops 226Ra in der Uran-Radium-Reihe. Es ist das stabilste Radonisotop und zerfällt unter Aussendung von Alphateilchen mit einer Halbwertszeit von 3,823 Tagen zu Polonium 218Po. Wenn Strahlenschützer von Radon ohne weitere Bezeichnung sprechen, meinen sie 222Rn. Allgemein angewendet (z. B. Radon-Messung), schließt der Begriff auch die kurzlebigen Zerfallsprodukte ein. ⓘ
- Radon 220Rn ist ein Zerfallsprodukt des Radium 224Ra in der Thorium-Reihe. Strahlenschützer bezeichnen es oft als Thoron. Seine Halbwertszeit beträgt 55,6 Sekunden; es zerfällt ebenfalls unter Aussendung von Alphateilchen zu Polonium 216Po. Es kann von ungebranntem Lehm in Gebäuden emittiert werden. Es kann im Hinblick auf die Strahlenbelastung sehr bedeutend sein, da bei gleicher Aktivitätskonzentration wie 222Rn aus den 220Rn-Folgeprodukten (vor allem Polonium-212) eine 14-fach höhere Strahlenbelastung zu beachten ist. In einer Studie, in der Thoron und seine Folgeprodukte in mehreren traditionellen und modernen Wohnhäusern in Deutschland gemessen wurden, verursachten sie einen jährlichen Beitrag zur Strahlendosis der Bewohner von bis zu mehreren Millisievert. ⓘ
- Radon 219Rn ist ein Zerfallsprodukt des Radium 223Ra in der Uran-Actinium-Reihe und trägt auch die Bezeichnung Actinon. Seine Halbwertszeit beträgt 3,96 Sekunden; es zerfällt ebenfalls unter Aussendung von Alphateilchen zu Polonium 215Po. Radiologisch ist es praktisch bedeutungslos. ⓘ
- Radon 218Rn entsteht in einer Seitenkette der Uran-Radium-Reihe beim Zerfall des Astat 218At mit einer Wahrscheinlichkeit von 0,1 %, das Astat selbst entsteht nur mit einer Wahrscheinlichkeit von 0,02 % aus Polonium 218Po. Radon 218Rn zerfällt mit einer Halbwertszeit von nur 35 Millisekunden unter Aussendung von Alphateilchen in Polonium 214Po. Durch seine extrem kurze Halbwertszeit hat es praktisch keine Zeit, um in die Erdatmosphäre zu kommen. Radiologisch ist es deshalb bedeutungslos. ⓘ
- Radon 217Rn entsteht in einer Seitenkette der Neptunium-Reihe beim Zerfall des Radium 221Ra, das Radium selbst entsteht nur mit einer Wahrscheinlichkeit von 0,1 % aus Francium 221Fr. Die restlichen 99,9 % des 221Fr zerfällt zu Astat 217At, das mit 0,01 % Wahrscheinlichkeit ebenfalls zu Radon 217Rn zerfällt. Das Radonisotop entsteht daher auf zwei Wegen in geringer Menge in der Neptunium-Reihe. Radon 217Rn zerfällt mit einer Halbwertszeit von nur 54 Millisekunden unter Aussendung von Alphateilchen in Polonium 213Po. Es kommt natürlich wegen der extrem kurzen Halbwertszeit praktisch nicht vor und ist somit völlig bedeutungslos. ⓘ

Töchter
222Rn gehört zur Zerfallskette von Radium und Uran-238 und hat eine Halbwertszeit von 3,8235 Tagen. Seine vier ersten Produkte (mit Ausnahme der marginalen Zerfallsschemata) sind sehr kurzlebig, was bedeutet, dass die entsprechenden Zerfälle für die ursprüngliche Radonverteilung kennzeichnend sind. Sein Zerfall verläuft in der folgenden Reihenfolge:
- 222Rn, 3,82 Tage, Alphazerfall zu...
- 218Po, 3,10 Minuten, Alphazerfall zu...
- 214Pb, 26,8 Minuten, Beta-Zerfall zu...
- 214Bi, 19,9 Minuten, Beta-Zerfall zu...
- 214Po, 0,1643 ms, Alpha-Zerfall zu...
- 210Pb, das eine viel längere Halbwertszeit von 22,3 Jahren hat, Beta-Zerfall zu...
- 210Bi, 5,013 Tage, Betazerfall zu...
- 210Po, 138.376 Tage, Alpha-Zerfall zu...
- 206Pb, stabil. ⓘ
Der Radon-Gleichgewichtsfaktor ist das Verhältnis zwischen der Aktivität aller kurzlebigen Radon-Folgeprodukte (die für die meisten biologischen Wirkungen von Radon verantwortlich sind) und der Aktivität, die im Gleichgewicht mit dem Radon-Elternteil stehen würde. ⓘ
Wenn ein geschlossenes Volumen ständig mit Radon versorgt wird, steigt die Konzentration der kurzlebigen Isotope an, bis ein Gleichgewicht erreicht ist, bei dem die Zerfallsrate jedes Zerfallsprodukts der des Radons selbst entspricht. Der Gleichgewichtsfaktor ist 1, wenn beide Aktivitäten gleich sind, was bedeutet, dass die Zerfallsprodukte lange genug in der Nähe des Radon-Elternteils geblieben sind, um das Gleichgewicht zu erreichen, und zwar innerhalb von ein paar Stunden. Unter diesen Bedingungen erhöht jedes zusätzliche pCi/L Radon die Exposition um 0,01 Arbeitspegel (WL, ein im Bergbau gebräuchliches Maß für Radioaktivität). Diese Bedingungen sind nicht immer erfüllt; in vielen Haushalten beträgt der Gleichgewichtsfaktor in der Regel 40 %, d. h. für jedes pCi/L Radon in der Luft gibt es 0,004 WL an Töchtern. 210Pb braucht viel länger (Jahrzehnte), um mit Radon ins Gleichgewicht zu kommen, aber wenn die Umgebung eine Ansammlung von Staub über längere Zeiträume zulässt, können 210Pb und seine Zerfallsprodukte ebenfalls zur Gesamtstrahlung beitragen. ⓘ
Aufgrund ihrer elektrostatischen Ladung haften Radonfolgeprodukte an Oberflächen oder Staubpartikeln, während dies bei gasförmigem Radon nicht der Fall ist. Durch Anhaftung werden sie aus der Luft entfernt, was in der Regel dazu führt, dass der Gleichgewichtsfaktor in der Atmosphäre weniger als 1 beträgt. Der Gleichgewichtsfaktor wird auch durch Luftzirkulation oder Luftfilteranlagen gesenkt und durch Staubpartikel in der Luft, einschließlich Zigarettenrauch, erhöht. Der in epidemiologischen Studien ermittelte Gleichgewichtsfaktor liegt bei 0,4. ⓘ
Geschichte und Etymologie
Radon war nach Uran, Thorium, Radium und Polonium das fünfte radioaktive Element, das 1899 von Ernest Rutherford und Robert B. Owens an der McGill-Universität in Montreal entdeckt wurde. Im Jahr 1899 beobachteten Pierre und Marie Curie, dass das von Radium ausgestoßene Gas einen Monat lang radioaktiv blieb. Im selben Jahr stellten Rutherford und Owens bei der Messung der von Thoriumoxid ausgehenden Strahlung Schwankungen fest. Rutherford stellte fest, dass Thoriumverbindungen kontinuierlich ein radioaktives Gas abgeben, das mehrere Minuten lang radioaktiv bleibt, und nannte dieses Gas "Emanation" (von lateinisch emanare, ausströmen, und emanatio, ausatmen), später "Thorium-Emanation" ("Th Em"). Im Jahr 1900 berichtete Friedrich Ernst Dorn über einige Experimente, bei denen er feststellte, dass Radiumverbindungen ein radioaktives Gas ausströmen, das er "Radium-Emanation" ("Ra Em") nannte. Im Jahr 1901 wiesen Rutherford und Harriet Brooks nach, dass die Ausdünstungen radioaktiv sind, schrieben aber den Curies die Entdeckung des Elements zu. Im Jahr 1903 wurden von André-Louis Debierne ähnliche Ausstrahlungen von Actinium beobachtet und als "Actinium-Emanation" ("Ac Em") bezeichnet. ⓘ
Für die drei Emanationen wurden bald mehrere verkürzte Namen vorgeschlagen: exradio, exthorio und exactinio im Jahr 1904; radon (Ro), thoron (To) und akton oder acton (Ao) im Jahr 1918; radeon, thoreon und actineon im Jahr 1919, und schließlich radon, thoron und actinon im Jahr 1920. (Der Name Radon steht in keinem Zusammenhang mit dem des österreichischen Mathematikers Johann Radon). Die Ähnlichkeit der Spektren dieser drei Gase mit denen von Argon, Krypton und Xenon und ihre beobachtete chemische Trägheit veranlassten Sir William Ramsay 1904 zu der Vermutung, dass die "Emanationen" ein neues Element aus der Familie der Edelgase enthalten könnten. ⓘ
Anfang des 20. Jahrhunderts gelangte in den USA mit der Radontochter 210Pb kontaminiertes Gold in die Schmuckindustrie. Es stammte aus Goldsamen, die 222Rn enthalten hatten und nach dem Zerfall des Radons eingeschmolzen worden waren. ⓘ
Im Jahr 1909 isolierten Ramsay und Robert Whytlaw-Gray Radon und bestimmten seine Schmelztemperatur und ungefähre Dichte. Im Jahr 1910 stellten sie fest, dass es das schwerste bekannte Gas ist. Sie schrieben: "L'expression l'émanation du radium est fort incommode" ("der Ausdruck 'Radium-Emanation' ist sehr ungeschickt") und schlugen den neuen Namen Niton (Nt) (von lateinisch: nitens, leuchtend) vor, um die Eigenschaft der Radiolumineszenz zu betonen. 1912 wurde es von der Internationalen Kommission für Atomgewichte akzeptiert. Im Jahr 1923 wählten das Internationale Komitee für chemische Elemente und die Internationale Union für reine und angewandte Chemie (IUPAC) die Bezeichnungen Radon (Rn), Thoron (Tn) und Actinon (An). Später, als die Isotope nummeriert statt benannt wurden, nahm das Element den Namen des stabilsten Isotops, Radon, an, während Tn in 220Rn und An in 219Rn umbenannt wurde. Dies führte in der Literatur zu einiger Verwirrung bezüglich der Entdeckung des Elements, da Dorn zwar das Isotop Radon entdeckt hatte, aber nicht als erster das Element Radon. ⓘ
Noch in den 1960er Jahren wurde das Element auch einfach als Emanation bezeichnet. Die erste synthetische Verbindung von Radon, Radonfluorid, wurde 1962 hergestellt. Auch heute noch kann sich das Wort Radon entweder auf das Element oder sein Isotop 222Rn beziehen, wobei Thoron als Kurzbezeichnung für 220Rn in Gebrauch bleibt, um diese Zweideutigkeit zu vermeiden. Die Bezeichnung Actinon für 219Rn ist heute nur noch selten anzutreffen, was wahrscheinlich auf die kurze Halbwertszeit dieses Isotops zurückzuführen ist. ⓘ
Die Gefahr einer hohen Radonexposition in Bergwerken, die bis zu 1.000.000 Bq/m3 betragen kann, ist seit langem bekannt. Im Jahr 1530 beschrieb Paracelsus eine schwindende Krankheit der Bergleute, die mala metallorum, und Georg Agricola empfahl die Belüftung von Bergwerken, um diese Bergkrankheit zu vermeiden. Im Jahr 1879 wurde diese Krankheit von Harting und Hesse bei ihrer Untersuchung von Bergleuten aus Schneeberg (Deutschland) als Lungenkrebs identifiziert. Die ersten größeren Studien zum Thema Radon und Gesundheit fanden im Zusammenhang mit dem Uranbergbau in der Region Joachimsthal in Böhmen statt. In den USA folgten Studien und Maßnahmen zur Schadensbegrenzung erst nach Jahrzehnten der gesundheitlichen Auswirkungen auf Uranbergleute im Südwesten der USA, die während des frühen Kalten Krieges beschäftigt waren; Normen wurden erst 1971 eingeführt. ⓘ
Das Vorhandensein von Radon in der Innenraumluft wurde bereits 1950 dokumentiert. Ab den 1970er Jahren wurden Forschungsarbeiten zu den Quellen von Radon in der Innenraumluft, zu den Determinanten der Konzentration, zu den gesundheitlichen Auswirkungen und zu Lösungsansätzen eingeleitet. In den USA erlangte das Problem des Radons in Innenräumen nach einem weithin bekannten Vorfall im Jahr 1984 große Aufmerksamkeit und wurde intensiver untersucht. Bei Routinekontrollen in einem Kernkraftwerk in Pennsylvania wurde bei einem Arbeiter eine radioaktive Kontamination festgestellt. Eine hohe Radonkonzentration in seiner Wohnung wurde daraufhin als Ursache ermittelt. ⓘ
Vorkommen
Konzentrationseinheiten

Alle Diskussionen über Radonkonzentrationen in der Umwelt beziehen sich auf 222Rn. Während die durchschnittliche Produktionsrate von 220Rn (aus der Thorium-Zerfallsreihe) etwa gleich hoch ist wie die von 222Rn, ist die Menge von 220Rn in der Umwelt wegen der kurzen Halbwertszeit von 220Rn (55 Sekunden gegenüber 3,8 Tagen) viel geringer als die von 222Rn. ⓘ
Die Radonkonzentration in der Atmosphäre wird in der Regel in Becquerel pro Kubikmeter (Bq/m3), der abgeleiteten SI-Einheit, gemessen. Eine andere in den USA gebräuchliche Maßeinheit ist Pikocurie pro Liter (pCi/L); 1 pCi/L = 37 Bq/m3. Die typische häusliche Exposition beträgt in Innenräumen durchschnittlich 48 Bq/m3, wobei dieser Wert stark schwankt, und im Freien 15 Bq/m3. ⓘ
Im Bergbau wird die Exposition traditionell in Arbeitsstufen (WL) und die kumulative Exposition in Arbeitsstufenmonaten (WLM) gemessen; 1 WL entspricht einer beliebigen Kombination von kurzlebigen 222Rn-Töchtern (218Po, 214Pb, 214Bi und 214Po) in 1 Liter Luft, die 1,3 × 105 MeV potenzieller Alpha-Energie freisetzt; 1 WL entspricht 2,08 × 10-5 Joule pro Kubikmeter Luft (J/m3). Die SI-Einheit der kumulativen Exposition wird in Joule-Stunden pro Kubikmeter (J-h/m3) ausgedrückt. Eine WLM entspricht 3,6 × 10-3 J-h/m3. Eine Exposition gegenüber 1 WL während eines Arbeitsmonats (170 Stunden) entspricht einer kumulativen Exposition von 1 WLM. Eine kumulative Exposition von 1 WLM entspricht in etwa dem Leben eines Jahres in einer Atmosphäre mit einer Radonkonzentration von 230 Bq/m3. ⓘ
222Rn zerfällt zu 210Pb und anderen Radioisotopen. Die Konzentration von 210Pb kann gemessen werden. Die Ablagerungsrate dieses Radioisotops ist wetterabhängig. ⓘ
Die Radonkonzentrationen in der natürlichen Umgebung sind viel zu niedrig, um mit chemischen Mitteln nachgewiesen werden zu können. Eine (relativ hohe) Konzentration von 1.000 Bq/m3 entspricht 0,17 Pikogramm pro Kubikmeter (pg/m3). Die durchschnittliche Radonkonzentration in der Atmosphäre beträgt etwa 6×10-18 Molprozent, d. h. etwa 150 Atome in jedem Milliliter Luft. Die Radonaktivität der gesamten Erdatmosphäre stammt von nur wenigen Dutzend Gramm Radon, das immer wieder durch den Zerfall größerer Mengen von Radium, Thorium und Uran ersetzt wird. ⓘ
Natürlich

Radon entsteht durch den radioaktiven Zerfall von Radium-226, das in Uranerzen, Phosphatgestein, Schiefer, magmatischem und metamorphem Gestein wie Granit, Gneis und Schiefer und in geringerem Maße auch in gewöhnlichem Gestein wie Kalkstein vorkommt. Jeder Quadratkilometer Bodenoberfläche bis zu einer Tiefe von 15 cm (2,6 km2) enthält etwa 1 Gramm Radium, das in geringen Mengen an die Atmosphäre abgegeben wird. Weltweit wird geschätzt, dass jährlich 2,4 Milliarden Curies (90 EBq) Radon aus dem Boden freigesetzt werden. ⓘ
Die Radonkonzentration kann von Ort zu Ort sehr unterschiedlich sein. In der freien Luft liegt sie zwischen 1 und 100 Bq/m3, über dem Meer sogar noch darunter (0,1 Bq/m3). In Höhlen, belüfteten Bergwerken oder schlecht belüfteten Häusern steigt die Konzentration auf 20-2.000 Bq/m3. ⓘ
Im Bergbau kann die Radonkonzentration wesentlich höher sein. Die Belüftungsvorschriften schreiben vor, die Radonkonzentration in Uranbergwerken unter dem "Arbeitswert" zu halten, wobei der 95. Perzentilwert bis zu fast 3 WL (546 pCi 222Rn pro Liter Luft; 20,2 kBq/m3, gemessen von 1976 bis 1985) reicht. Die Konzentration in der Luft im (unbelüfteten) Gasteiner Heilstollen beträgt durchschnittlich 43 kBq/m3 (1,2 nCi/L) mit einem Höchstwert von 160 kBq/m3 (4,3 nCi/L). ⓘ
Radon tritt vor allem in der Zerfallskette der Radium- und Uranreihe (222Rn) und geringfügig in der Thoriumreihe (220Rn) auf. Das Element tritt auf natürliche Weise im Boden und in einigen Baumaterialien in der ganzen Welt auf, überall dort, wo Spuren von Uran oder Thorium zu finden sind, und insbesondere in Regionen mit granit- oder schieferhaltigen Böden, die eine höhere Konzentration von Uran aufweisen. Nicht alle granithaltigen Regionen sind anfällig für hohe Radonemissionen. Da es sich um ein seltenes Gas handelt, wandert es in der Regel ungehindert durch Verwerfungen und fragmentierte Böden und kann sich in Höhlen oder Gewässern ansammeln. Aufgrund seiner sehr kurzen Halbwertszeit (vier Tage für 222Rn) nimmt die Radonkonzentration sehr schnell ab, wenn die Entfernung zum Produktionsgebiet zunimmt. Die Radonkonzentration schwankt stark je nach Jahreszeit und atmosphärischen Bedingungen. Es hat sich beispielsweise gezeigt, dass sich Radon in der Luft anreichert, wenn es eine meteorologische Inversion und wenig Wind gibt. ⓘ
Hohe Radonkonzentrationen können in einigen Quellwässern und heißen Quellen gefunden werden. In den Städten Boulder (Montana), Misasa, Bad Kreuznach (Deutschland) und Japan gibt es radonhaltige Quellen, die Radon freisetzen. Um als Radonmineralwasser eingestuft zu werden, muss die Radonkonzentration über 2 nCi/L (74 kBq/m3) liegen. Die Aktivität von Radon-Mineralwasser erreicht 2.000 kBq/m3 in Meran und 4.000 kBq/m3 in Lurisia (Italien). ⓘ
Die natürliche Radonkonzentration in der Erdatmosphäre ist so gering, dass radonreiches Wasser, das mit der Atmosphäre in Berührung kommt, ständig Radon durch Verflüchtigung verliert. Daher weist das Grundwasser eine höhere 222Rn-Konzentration auf als das Oberflächenwasser, da Radon kontinuierlich durch den radioaktiven Zerfall von 226Ra in den Gesteinen entsteht. Ebenso weist die gesättigte Zone eines Bodens aufgrund von Diffusionsverlusten in die Atmosphäre häufig einen höheren Radongehalt auf als die ungesättigte Zone. ⓘ
Im Jahr 1971 flog Apollo 15 110 km über dem Aristarchus-Plateau auf dem Mond vorbei und entdeckte einen signifikanten Anstieg von Alphateilchen, die vermutlich durch den Zerfall von 222Rn verursacht wurden. Das Vorhandensein von 222Rn wurde später aus Daten des Alpha-Partikel-Spektrometers Lunar Prospector abgeleitet. ⓘ
Radon ist in einigen Erdölsorten enthalten. Da Radon eine ähnliche Druck- und Temperaturkurve wie Propan aufweist und Erdölraffinerien Petrochemikalien auf der Grundlage ihrer Siedepunkte trennen, können die Rohrleitungen, die frisch getrenntes Propan in Erdölraffinerien transportieren, durch zerfallendes Radon und seine Produkte radioaktiv werden. ⓘ
Rückstände aus der Erdöl- und Erdgasindustrie enthalten oft Radium und seine Töchter. Der Sulfatkesselstein aus einer Ölquelle kann radiumhaltig sein, während das Wasser, Öl und Gas aus einem Bohrloch oft Radon enthält. Radon zerfällt zu festen Radioisotopen, die sich auf der Innenseite von Rohrleitungen ablagern. ⓘ
Akkumulation in Gebäuden

Hohe Radonkonzentrationen in Wohnungen wurden 1985 zufällig entdeckt, nachdem die strengen Strahlungstests im neuen Kernkraftwerk Limerick Generating Station ergeben hatten, dass Stanley Watras, ein Bauingenieur der Anlage, mit radioaktiven Stoffen kontaminiert war, obwohl der Reaktor nie in Betrieb war. Die typische häusliche Strahlenbelastung liegt bei etwa 100 Bq/m3 (2,7 pCi/L) in Innenräumen. Ein gewisses Maß an Radon ist in allen Gebäuden zu finden. Radon dringt meist direkt aus dem Boden in ein Gebäude ein, und zwar über die unterste Ebene des Gebäudes, die mit dem Boden in Kontakt ist. Hohe Radonwerte in der Wasserversorgung können ebenfalls die Radonwerte in der Raumluft erhöhen. Typische Eintrittsstellen für Radon in Gebäude sind Risse in massiven Fundamenten und Wänden, Baufugen, Spalten in Zwischenböden und um Versorgungsleitungen, Hohlräume in Wänden und die Wasserversorgung. Die Radonkonzentration an ein und demselben Ort kann innerhalb einer Stunde um das Doppelte/Halbfache schwanken. Auch kann sich die Konzentration in einem Raum eines Gebäudes erheblich von der Konzentration in einem angrenzenden Raum unterscheiden. Die Bodenbeschaffenheit der Wohnungen ist die wichtigste Radonquelle für das Erdgeschoss, und in den unteren Stockwerken werden höhere Radonkonzentrationen in Innenräumen beobachtet. Die meisten hohen Radonkonzentrationen wurden aus Orten in der Nähe von Verwerfungszonen gemeldet; daher ist ein Zusammenhang zwischen der Exhalationsrate von Verwerfungen und den Radonkonzentrationen in Innenräumen offensichtlich. ⓘ
Die Verteilung der Radonkonzentrationen ist im Allgemeinen von Raum zu Raum unterschiedlich, und die Messwerte werden gemäß den behördlichen Protokollen gemittelt. Bei der Radonkonzentration in Innenräumen wird in der Regel davon ausgegangen, dass sie in einem bestimmten Gebiet einer Log-Normal-Verteilung folgt. Daher wird für die Schätzung der "durchschnittlichen" Radonkonzentration in einem Gebiet im Allgemeinen das geometrische Mittel verwendet. ⓘ
Die mittlere Konzentration reicht von weniger als 10 Bq/m3 bis zu über 100 Bq/m3 in einigen europäischen Ländern. Typische geometrische Standardabweichungen, die in Studien gefunden wurden, liegen zwischen 2 und 3, was bedeutet (angesichts der 68-95-99,7-Regel), dass die Radonkonzentration in 2 bis 3 % der Fälle mehr als das Hundertfache der mittleren Konzentration betragen dürfte. ⓘ
Einige der höchsten Radonrisiken in den USA finden sich in Iowa und in den Appalachen im Südosten Pennsylvanias. Iowa weist die höchsten durchschnittlichen Radonkonzentrationen in den USA auf, was auf die starke Vergletscherung zurückzuführen ist, bei der das Granitgestein des Kanadischen Schildes zermahlen und als Boden abgelagert wurde, der das reiche Ackerland in Iowa bildet. Viele Städte in diesem Bundesstaat, wie z. B. Iowa City, haben Vorschriften für radonsichere Konstruktionen in neuen Häusern erlassen. Die zweithöchsten Messwerte in Irland wurden in Bürogebäuden in der irischen Stadt Mallow in der Grafschaft Cork festgestellt, was zu Befürchtungen hinsichtlich Lungenkrebs führte. ⓘ
An einigen Orten wurden Uranabfälle als Deponien genutzt und anschließend bebaut, was zu einer erhöhten Radonbelastung führen kann. ⓘ
Da Radon ein farb- und geruchloses Gas ist, kann man nur durch Tests feststellen, wie viel davon in der Luft oder im Wasser vorhanden ist. In den USA sind Radon-Testkits für den Hausgebrauch in Einzelhandelsgeschäften (z. B. Baumärkten) erhältlich, und die Tests werden von zugelassenen Fachleuten durchgeführt, bei denen es sich häufig um Hausinspektoren handelt. Maßnahmen zur Verringerung der Radonkonzentration in Innenräumen werden als Radonsanierung bezeichnet. In den USA empfiehlt die EPA, alle Häuser auf Radon zu testen. Im Vereinigten Königreich sind Immobilieneigentümer im Rahmen des Housing Health & Safety Rating System (HHSRS) verpflichtet, potenzielle Risiken und Gefahren für die Gesundheit und Sicherheit in einer Wohnimmobilie zu bewerten. ⓘ
Industrielle Produktion
Radon wird als Nebenprodukt bei der Verarbeitung uranhaltiger Erze gewonnen, nachdem es in 1 %ige Lösungen von Salz- oder Bromwasserstoffsäuren überführt wurde. Das aus den Lösungen extrahierte Gasgemisch enthält H
2, O
2, He, Rn, CO
2, H
2O und Kohlenwasserstoffe. Das Gemisch wird gereinigt, indem es bei 993 K (720 °C; 1.328 °F) über Kupfer geleitet wird, um das H
2 und das O
2 zu entfernen, und anschließend KOH und P
2O
5 verwendet, um die Säuren und die Feuchtigkeit durch Sorption zu entfernen. Das Radon wird mit flüssigem Stickstoff kondensiert und durch Sublimation von den Restgasen gereinigt. ⓘ
Die Vermarktung von Radon ist reglementiert, aber es ist in kleinen Mengen für die Kalibrierung von 222Rn-Messsystemen erhältlich, und zwar zu einem Preis von fast 6.000 US-Dollar (entspricht 7.551 US-Dollar im Jahr 2021) pro Milliliter Radiumlösung (die nur etwa 15 Pikogramm tatsächliches Radon zu einem bestimmten Zeitpunkt enthält). Radon entsteht aus einer Lösung von Radium-226 (Halbwertszeit von 1.600 Jahren). Radium-226 zerfällt durch die Emission von Alphateilchen, wobei Radon entsteht, das sich mit einer Geschwindigkeit von etwa 1 mm3/Tag pro Gramm Radium über den Radium-226-Proben ansammelt; das Gleichgewicht wird schnell erreicht und Radon entsteht in einem stetigen Fluss mit einer Aktivität, die der des Radiums (50 Bq) entspricht. Gasförmiges 222Rn (Halbwertszeit von etwa vier Tagen) entweicht durch Diffusion aus der Kapsel. ⓘ
Konzentrationsmaßstab
| Bq/m3 | pCi/L | Beispiel für Vorkommen ⓘ |
|---|---|---|
| 1 | ~0.027 | Die Radonkonzentration an den Ufern der großen Ozeane beträgt typischerweise 1 Bq/m3.
Die Radonspurenkonzentration über Ozeanen oder in der Antarktis kann weniger als 0,1 Bq/m3 betragen. |
| 10 | 0.27 | Mittlere kontinentale Konzentration in der freien Luft: 10 bis 30 Bq/m3.
Auf der Grundlage einer Reihe von Erhebungen wird die mittlere Radonkonzentration in Innenräumen weltweit auf 39 Bq/m3 geschätzt. |
| 100 | 2.7 | Typische häusliche Exposition in Innenräumen. Die meisten Länder haben eine Radonkonzentration von 200-400 Bq/m3 für die Innenraumluft als Aktions- oder Referenzwert festgelegt. Wenn bei Tests Werte von weniger als 4 Pikocurie Radon pro Liter Luft (150 Bq/m3) festgestellt werden, sind keine Maßnahmen erforderlich. Eine kumulierte Exposition von 230 Bq/m3 Radongaskonzentration über einen Zeitraum von 1 Jahr entspricht 1 WLM. |
| 1,000 | 27 | Sehr hohe Radonkonzentrationen (>1000 Bq/m3) wurden in Häusern festgestellt, die auf Böden mit hohem Urangehalt und/oder hoher Durchlässigkeit des Bodens gebaut wurden. Liegen die Werte bei 20 Pikocurie Radon pro Liter Luft (800 Bq/m3) oder höher, sollte der Hauseigentümer ein Verfahren zur Senkung der Radonkonzentration in Innenräumen in Erwägung ziehen. Die zulässigen Konzentrationen in Uranminen betragen etwa 1.220 Bq/m3 (33 pCi/L). |
| 10,000 | 270 | Die Konzentration in der Luft des (unbelüfteten) Gasteiner Heilstollens beträgt durchschnittlich 43 kBq/m3 (etwa 1,2 nCi/L) mit einem Höchstwert von 160 kBq/m3 (etwa 4,3 nCi/L). |
| 100,000 | ~2700 | Im Keller von Stanley Watras wurden etwa 100.000 Bq/m3 (2,7 nCi/L) gemessen. |
| 1,000,000 | 27000 | In unbelüfteten Uranminen können Konzentrationen von bis zu 1.000.000 Bq/m3 gefunden werden. |
| ~5.54 × 1019 | ~1.5 × 1018 | Theoretische Obergrenze: Radongas (222Rn) bei 100 % Konzentration (1 Atmosphäre, 0 °C); 1,538×105 Curies/Gramm; 5,54×1019 Bq/m3. |
Anwendungen
Medizinisch
Eine Form der Quacksalberei aus dem frühen 20. Jahrhundert war die Behandlung von Krankheiten in einem Radiotorium. Dabei handelte es sich um einen kleinen, versiegelten Raum, in dem Patienten wegen der "medizinischen Wirkung" von Radon bestrahlt wurden. Dass Radon aufgrund seiner ionisierenden Strahlung krebserregend ist, wurde erst später deutlich. Die molekülschädigende Radioaktivität des Radons wurde zur Abtötung von Krebszellen eingesetzt, erhöht aber nicht die Gesundheit der gesunden Zellen. Die ionisierende Strahlung verursacht die Bildung freier Radikale, die zu Zellschäden führen, die wiederum eine erhöhte Krankheitsrate, einschließlich Krebs, zur Folge haben. ⓘ
Es wird vermutet, dass die Radonexposition Autoimmunkrankheiten wie Arthritis in einem als Strahlungshormese bekannten Prozess abschwächt. Daher wurden im späten 20. und frühen 21. Jahrhundert in Basin, Montana, "Gesundheitsminen" eingerichtet, die Menschen anzogen, die durch eine begrenzte Exposition gegenüber radioaktivem Grubenwasser und Radon gesundheitliche Probleme wie Arthritis lindern wollten. Aufgrund der gut dokumentierten schädlichen Auswirkungen hoher Strahlungsdosen auf den Körper wird von dieser Praxis abgeraten. ⓘ
Radioaktive Wasserbäder werden seit 1906 in Jáchymov, Tschechische Republik, angewandt, aber schon vor der Entdeckung des Radons wurden sie in Bad Gastein, Österreich, genutzt. Radiumhaltige Quellen werden auch in traditionellen japanischen Onsen in Misasa, Präfektur Tottori, verwendet. In Bad Brambach, Deutschland, wird eine Trinkkur durchgeführt, und zu Beginn des 20. Jahrhunderts wurde radonhaltiges Quellwasser in Flaschen abgefüllt und verkauft (aufgrund der kurzen Halbwertszeit von Radon enthielt dieses Wasser wenig bis gar kein Radon mehr, als es an die Verbraucher gelangte). Die Inhalationstherapie wird in Gasteiner-Heilstollen, Österreich, in Świeradów-Zdrój, Czerniawa-Zdrój, Kowary, Lądek Zdrój, Polen, in Harghita Băi, Rumänien, und in Boulder, Montana, durchgeführt. In den USA und in Europa gibt es mehrere "Radon-Spas", in denen sich Menschen minuten- oder stundenlang in einer hochradonhaltigen Atmosphäre aufhalten. ⓘ
Radon wurde für den Einsatz in der Strahlentherapie kommerziell hergestellt, wurde aber größtenteils durch Radionuklide ersetzt, die in Teilchenbeschleunigern und Kernreaktoren hergestellt werden. Radon wurde in implantierbaren Seeds aus Gold oder Glas verwendet, die in erster Linie zur Behandlung von Krebserkrankungen eingesetzt wurden, der so genannten Brachytherapie. Die Goldseeds wurden hergestellt, indem man ein langes Rohr mit Radon füllte, das aus einer Radiumquelle gepumpt wurde, und das Rohr dann durch Quetschen und Schneiden in kurze Abschnitte teilte. Die Goldschicht hält das Radon im Inneren und filtert die Alpha- und Betastrahlung heraus, während die Gammastrahlen entweichen können (die das kranke Gewebe abtöten). Die Aktivitäten können zwischen 0,05 und 5 Millicurie pro Samen (2 bis 200 MBq) liegen. Die Gammastrahlen werden von Radon und den ersten kurzlebigen Elementen seiner Zerfallskette (218Po, 214Pb, 214Bi, 214Po) erzeugt. ⓘ
Da Radon und seine ersten Zerfallsprodukte sehr kurzlebig sind, wird der Keim an Ort und Stelle belassen. Nach 11 Halbwertszeiten (42 Tagen) beträgt die Radioaktivität des Radons 1/2.000 des ursprünglichen Wertes. In diesem Stadium stammt die vorherrschende Restaktivität von dem Radon-Zerfallsprodukt 210Pb, dessen Halbwertszeit (22,3 Jahre) 2.000 Mal so lang ist wie die von Radon und seinen Nachkommen 210Bi und 210Po. ⓘ
Wissenschaftlich
Die Radonemission aus dem Boden hängt von der Bodenart und dem Urangehalt an der Oberfläche ab, so dass die Radonkonzentration im Freien in begrenztem Maße zur Bestimmung von Luftmassen herangezogen werden kann. Diese Tatsache wurde von einigen Atmosphärenforschern genutzt (Radonsturm). Wegen des schnellen Verlusts von Radon an die Luft und des vergleichsweise schnellen Zerfalls wird Radon in der hydrologischen Forschung verwendet, die die Wechselwirkung zwischen Grundwasser und Flüssen untersucht. Jede signifikante Radonkonzentration in einem Fluss ist ein guter Indikator für einen lokalen Grundwassereintrag. ⓘ
Die Radonkonzentration im Boden wurde versuchsweise zur Kartierung von vergrabenen, oberflächennahen geologischen Verwerfungen verwendet, da die Konzentrationen im Allgemeinen über den Verwerfungen höher sind. Auch bei der Erkundung von geothermischen Gradienten hat sie in begrenztem Umfang Verwendung gefunden. ⓘ
Einige Forscher haben Veränderungen der Radonkonzentration im Grundwasser im Hinblick auf die Vorhersage von Erdbeben untersucht. Vor den Erdbeben von Taschkent 1966 und Mindoro 1994 wurde ein Anstieg der Radonkonzentration festgestellt. Radon hat eine Halbwertszeit von etwa 3,8 Tagen, was bedeutet, dass es nur kurz nach seiner Entstehung in der radioaktiven Zerfallskette gefunden werden kann. Aus diesem Grund wurde die Hypothese aufgestellt, dass der Anstieg der Radonkonzentration auf die Entstehung neuer Risse im Untergrund zurückzuführen ist, die eine verstärkte Grundwasserzirkulation ermöglichen und das Radon ausspülen. Es ist nicht unvernünftig anzunehmen, dass die Entstehung neuer Risse größeren Erdbeben vorausgeht. In den 1970er und 1980er Jahren wurde bei wissenschaftlichen Messungen von Radonemissionen in der Nähe von Verwerfungen festgestellt, dass Erdbeben häufig ohne Radonsignal auftraten und Radon häufig ohne Erdbeben nachgewiesen wurde. Daraufhin wurde es von vielen als unzuverlässiger Indikator abgetan. Seit 2009 wird es von der NASA als möglicher Vorläufer untersucht. ⓘ
Radon ist ein bekannter Schadstoff, der von geothermischen Kraftwerken ausgeht, da es in dem aus der Tiefe gepumpten Material enthalten ist. Es verteilt sich schnell, und in verschiedenen Untersuchungen wurde keine radiologische Gefahr nachgewiesen. Außerdem wird das Material in den meisten Fällen nicht an der Oberfläche freigesetzt, sondern in die Tiefe gepumpt, so dass die Umweltauswirkungen minimal sind. ⓘ
In den 1940er und 50er Jahren wurde Radon für die industrielle Radiographie verwendet. Andere Röntgenquellen, die nach dem Zweiten Weltkrieg verfügbar wurden, haben Radon für diese Anwendung schnell ersetzt, da sie kostengünstiger sind und weniger Gefahr durch Alphastrahlung besteht. ⓘ
Gesundheitliche Risiken
Im Bergbau
Radon-222-Zerfallsprodukte wurden von der Internationalen Agentur für Krebsforschung als krebserregend für den Menschen eingestuft. Da es sich um ein Gas handelt, das eingeatmet werden kann, ist Lungenkrebs ein besonderes Problem für Menschen, die über einen längeren Zeitraum erhöhten Radonwerten ausgesetzt sind. In den 1940er und 1950er Jahren, als Sicherheitsnormen, die eine aufwendige Belüftung in Bergwerken vorschreiben, noch nicht weit verbreitet waren, wurde die Radonexposition mit Lungenkrebs bei nicht rauchenden Bergleuten in Verbindung gebracht, die Uran und andere Hartgesteine im Gebiet der heutigen Tschechischen Republik abbauten, sowie später bei Bergleuten im Südwesten der USA und in Südaustralien. Obwohl diese Gefahren bereits in den frühen 1950er Jahren bekannt waren, wurde dieses Berufsrisiko in vielen Bergwerken bis in die 1970er Jahre hinein nur unzureichend behandelt. In dieser Zeit öffneten mehrere Unternehmer ehemalige Uranminen in den USA für die breite Öffentlichkeit und warben mit angeblichen gesundheitlichen Vorteilen durch das Einatmen von Radongas unter Tage. Zu den behaupteten gesundheitlichen Vorteilen gehörten die Linderung von Schmerzen, Nasennebenhöhlen, Asthma und Arthritis. Diese Behauptungen erwiesen sich jedoch als falsch, und die Regierung verbot 1975 diese Werbung. ⓘ
Seitdem wurden in den meisten betroffenen Bergwerken, die weiterhin in Betrieb sind, Belüftungs- und andere Maßnahmen ergriffen, um die Radonwerte zu senken. In den letzten Jahren ist die durchschnittliche jährliche Exposition der Uranbergleute auf Werte gesunken, die mit den Konzentrationen vergleichbar sind, die in manchen Haushalten eingeatmet werden. Dadurch hat sich das Risiko berufsbedingter Krebserkrankungen durch Radon verringert, wenngleich für diejenigen, die derzeit in den betroffenen Bergwerken beschäftigt sind oder in der Vergangenheit dort gearbeitet haben, weiterhin gesundheitliche Probleme bestehen können. In dem Maße, wie das relative Risiko für Bergleute gesunken ist, hat sich auch die Fähigkeit verbessert, übermäßige Risiken in dieser Bevölkerungsgruppe zu erkennen. ⓘ
Rückstände aus der Verarbeitung von Uranerz können ebenfalls eine Radonquelle darstellen. Radon, das durch den hohen Radiumgehalt in nicht abgedeckten Halden und Absetzteichen entsteht, kann leicht in die Atmosphäre freigesetzt werden und die in der Nähe lebenden Menschen beeinträchtigen. ⓘ
Neben Lungenkrebs haben Forscher auch ein möglicherweise erhöhtes Leukämierisiko durch Radonexposition vermutet. Die empirische Unterstützung durch Studien an der Allgemeinbevölkerung ist widersprüchlich, und in einer Studie an Uranbergleuten wurde ein Zusammenhang zwischen Radonexposition und chronischer lymphatischer Leukämie festgestellt. ⓘ
Bergleute (sowie Arbeiter in der Mühle und im Erztransport), die in den USA zwischen den 1940er Jahren und 1971 in der Uranindustrie tätig waren, können nach dem Radiation Exposure Compensation Act (RECA) entschädigt werden. Hinterbliebene können auch dann einen Antrag stellen, wenn die ehemals beschäftigte Person verstorben ist. ⓘ
Nicht nur Uranminen sind von erhöhten Radonwerten betroffen. Insbesondere Kohlebergwerke sind ebenfalls betroffen, da Kohle mehr Uran und Thorium enthalten kann als kommerziell betriebene Uranbergwerke. ⓘ
Exposition im häuslichen Bereich
Eine längere Exposition gegenüber höheren Radonkonzentrationen führt zu einem Anstieg von Lungenkrebs. Seit 1999 gibt es weltweit Untersuchungen darüber, wie Radonkonzentrationen geschätzt werden. Allein in den Vereinigten Staaten wurden Durchschnittswerte von mindestens 40 Bq/m3 ermittelt. Steck et al. führten eine Studie über die Unterschiede zwischen Innen- und Außenradon in Iowa und Minnesota durch. In einer besiedelten Region wurde eine höhere Strahlung festgestellt als in unbesiedelten Regionen in ganz Mittelamerika. In einigen Bezirken im Nordwesten von Iowa und im Südwesten von Minnesota übersteigen die Radonkonzentrationen im Freien den nationalen Durchschnitt der Radonkonzentrationen in Innenräumen. Trotz des überdurchschnittlichen Wertes lagen die Werte sowohl in Minnesota als auch in Iowa unabhängig von der Entfernung außergewöhnlich nahe beieinander. Genaue Radondosierungen sind dringend erforderlich, um die Probleme, die Radon insgesamt für eine Gemeinde mit sich bringen kann, besser zu verstehen. Es ist bekannt, dass eine Radonvergiftung zu Gesundheitsschäden und Lungenkrebs führt, aber mit weiteren Forschungsarbeiten könnten Kontrollen die Ergebnisse der Radonemissionen sowohl innerhalb als auch außerhalb von Wohneinheiten verändern. ⓘ
In zahlreichen Fall-Kontroll-Studien, die in den USA, Europa und China durchgeführt wurden, wurde ein Zusammenhang zwischen Radonexposition (hauptsächlich Radontöchter) und Lungenkrebs festgestellt. In den USA sterben jährlich etwa 21 000 Menschen an Lungenkrebs, der durch Radon verursacht wird. In Slowenien, einem Land mit einer hohen Radonkonzentration, sterben jährlich etwa 120 Menschen an den Folgen von Radon. Eine der umfassendsten Radonstudien, die in den USA von Dr. R. William Field und Kollegen durchgeführt wurde, ergab ein um 50 % erhöhtes Lungenkrebsrisiko, selbst bei lang anhaltender Exposition gegenüber dem EPA-Auslösewert von 4 pCi/L. Nordamerikanische und europäische zusammengefasste Analysen stützen diese Ergebnisse ebenfalls. Die Diskussion über die gegenteiligen Ergebnisse dauert jedoch noch an, insbesondere eine retrospektive Fall-Kontroll-Studie zum Lungenkrebsrisiko aus dem Jahr 2008, die eine erhebliche Verringerung der Krebsrate bei Radonkonzentrationen zwischen 50 und 123 Bq/m3 ergab. ⓘ
Die meisten Modelle für die Radonexposition von Haushalten basieren auf Studien mit Bergleuten, und direkte Schätzungen der Risiken für Hausbesitzer wären wünschenswerter. Da es schwierig ist, das Risiko von Radon im Vergleich zum Rauchen zu messen, wurden häufig Modelle für die Wirkung von Radon herangezogen. ⓘ
Radon wurde von der EPA als zweitwichtigste Ursache für Lungenkrebs und als wichtigste umweltbedingte Ursache für Krebssterblichkeit eingestuft, wobei Rauchen die erste Ursache ist. Andere haben ähnliche Schlussfolgerungen für das Vereinigte Königreich und Frankreich gezogen. Die Radonexposition in Wohnungen und Büros kann durch bestimmte unterirdische Gesteinsformationen und auch durch bestimmte Baumaterialien (z. B. einige Granite) verursacht werden. Das größte Risiko einer Radonexposition besteht in Gebäuden, die luftdicht sind, unzureichend belüftet werden und undichte Fundamente haben, durch die Luft aus dem Boden in Keller und Wohnräume eindringen kann. ⓘ
Thoron wurde in vergleichsweise hohen Konzentrationen in Gebäuden mit Lehmbauweise gemessen, wie z. B. in traditionellen Fachwerkhäusern und modernen Häusern mit Lehmverkleidungen. Wegen seiner kurzen Halbwertszeit kommt Thoron nur in der Nähe der Lehmoberflächen als Quellen vor, während seine Folgeprodukte in der gesamten Innenraumluft solcher Gebäude zu finden sind. Daher kann die Strahlenbelastung an jedem Ort in solchen Häusern auftreten. In verschiedenen Wohngebäuden mit Lehmbauweise in Deutschland wurden in einer Studie jährliche innere Strahlendosen durch das Einatmen von Thoron und seinen Folgeprodukten von bis zu mehreren Millisievert festgestellt. ⓘ
Maßnahmen und Referenzwerte
Die WHO hat 2009 einen empfohlenen Referenzwert (den nationalen Referenzwert) von 100 Bq/m3 für Radon in Wohnräumen vorgelegt. Die Empfehlung besagt auch, dass in Fällen, in denen dies nicht möglich ist, 300 Bq/m3 als höchster Wert gewählt werden sollte. Ein nationaler Referenzwert sollte kein Grenzwert sein, sondern die höchstzulässige durchschnittliche jährliche Radonkonzentration in einer Wohnung darstellen. ⓘ
Die Radonkonzentration in einer Wohnung, bei der Maßnahmen ergriffen werden sollten, hängt von der Organisation ab, die die Empfehlung ausspricht. So empfiehlt die EPA, bereits bei einer Konzentration von 74 Bq/m3 (2 pCi/L) Maßnahmen zu ergreifen, und die Europäische Union empfiehlt, bei einer Konzentration von 400 Bq/m3 (11 pCi/L) in alten Häusern und 200 Bq/m3 (5 pCi/L) in neuen Häusern tätig zu werden. Am 8. Juli 2010 gab die britische Health Protection Agency neue Empfehlungen heraus, in denen ein Zielwert" von 100 Bq/m3 und ein Aktionswert" von 200 Bq/m3 festgelegt wurden. Ähnliche Werte (wie im Vereinigten Königreich) wurden von der norwegischen Behörde für Strahlenschutz und nukleare Sicherheit (DSA) veröffentlicht, wobei der Höchstwert für Schulen, Kindergärten und neue Wohnungen auf 200 Bq/m3 festgelegt wurde, während 100 Bq/m3 als Auslösewert gilt. In allen neuen Wohnungen sollten vorbeugende Maßnahmen gegen eine Radonanreicherung getroffen werden. ⓘ
Inhalation und Rauchen
Die Ergebnisse epidemiologischer Studien deuten darauf hin, dass das Lungenkrebsrisiko mit der Exposition gegenüber Radon in Wohnräumen zunimmt. Ein bekanntes Beispiel für eine Fehlerquelle ist das Rauchen, der Hauptrisikofaktor für Lungenkrebs. In den USA werden schätzungsweise 80 bis 90 % aller Lungenkrebsfälle durch Zigarettenrauch verursacht. ⓘ
Nach Angaben der EPA ist das Lungenkrebsrisiko für Raucher aufgrund der Synergieeffekte von Radon und Rauchen erheblich. In dieser Bevölkerungsgruppe sterben etwa 62 von 1.000 Personen an Lungenkrebs, verglichen mit 7 von 1.000 Personen, die nie geraucht haben. Es ist nicht auszuschließen, dass das Risiko von Nichtrauchern in erster Linie durch eine Wirkung von Radon erklärt werden kann. ⓘ
Radon ist, wie andere bekannte oder vermutete externe Risikofaktoren für Lungenkrebs, eine Gefahr für Raucher und ehemalige Raucher. Dies wurde in der europäischen Pooling-Studie nachgewiesen. In einem Kommentar zur Pooling-Studie heißt es: "Es ist nicht angemessen, einfach von einem Risiko durch Radon in Wohnungen zu sprechen. Das Risiko geht vom Rauchen aus, das bei Rauchern durch einen synergistischen Effekt des Radons verstärkt wird. Ohne das Rauchen scheint der Effekt so gering zu sein, dass er unbedeutend ist". ⓘ
Laut der europäischen Pooling-Studie gibt es einen Unterschied im Risiko für die histologischen Subtypen von Lungenkrebs und Radonexposition. Das kleinzellige Lungenkarzinom, das stark mit dem Rauchen korreliert, hat ein höheres Risiko nach Radonexposition. Bei anderen histologischen Subtypen wie dem Adenokarzinom, von dem hauptsächlich Nichtraucher betroffen sind, scheint das Risiko durch Radon geringer zu sein. ⓘ
Eine Studie über die Strahlung nach einer Mastektomie zeigt, dass die einfachen Modelle, die bisher zur Bewertung der kombinierten und getrennten Risiken von Strahlung und Rauchen verwendet wurden, weiterentwickelt werden müssen. Dies wird auch durch eine neue Diskussion über die Berechnungsmethode, das lineare Modell ohne Schwellenwert, unterstützt, das routinemäßig verwendet wurde. ⓘ
Eine Studie aus dem Jahr 2001, an der 436 Nichtraucher und eine Kontrollgruppe von 1649 Nichtrauchern teilnahmen, zeigte, dass die Exposition gegenüber Radon das Lungenkrebsrisiko bei Nichtrauchern erhöht. Die Gruppe, die in der Wohnung Tabakrauch ausgesetzt war, schien ein wesentlich höheres Risiko zu haben, während diejenigen, die nicht dem Passivrauchen ausgesetzt waren, kein erhöhtes Risiko mit zunehmender Radonexposition aufwiesen. ⓘ
Verschlucken
Die Auswirkungen von Radon bei der Einnahme sind nicht bekannt, obwohl Studien ergeben haben, dass die biologische Halbwertszeit von Radon zwischen 30 und 70 Minuten liegt, wobei 90 % nach 100 Minuten abgebaut sind. Im Jahr 1999 untersuchte der Nationale Forschungsrat der USA das Thema Radon im Trinkwasser. Das mit der Einnahme verbundene Risiko wurde als nahezu vernachlässigbar eingestuft. Wasser aus unterirdischen Quellen kann je nach den umgebenden Gesteins- und Bodenverhältnissen erhebliche Mengen an Radon enthalten, während dies bei oberirdischen Quellen im Allgemeinen nicht der Fall ist. ⓘ
Auswirkungen von Radon auf den Ozean
Die Meeresoberfläche trägt nur etwa 10^-4 226 Ra, wobei die Messungen der 222 Ra-Konzentration auf verschiedenen Kontinenten 1 % betragen haben. Um den Fluss von 222 Ra aus dem Ozean zu verstehen, muss man wissen, dass die Zunahme des Radons auch in der Atmosphäre zirkuliert und zunimmt. Die Konzentrationen an der Meeresoberfläche stehen im Austausch mit der Atmosphäre, wodurch 222 Radon über die Luft-Meer-Grenzfläche ansteigt. Obwohl die untersuchten Gebiete sehr flach waren, sollten zusätzliche Messungen in einer Vielzahl von Küstenregimen dazu beitragen, die Art des beobachteten 222 Radon zu definieren. Radon wird nicht nur über das Trinkwasser aufgenommen, sondern auch aus dem Wasser freigesetzt, wenn die Temperatur steigt, der Druck sinkt und das Wasser belüftet wird. Optimale Bedingungen für die Radonfreisetzung und -exposition herrschen beim Duschen. Wasser mit einer Radonkonzentration von 104 pCi/L kann unter normalen Bedingungen die Radonkonzentration in der Raumluft um 1 pCi/L erhöhen. ⓘ
Tests und Schadensbegrenzung


Es gibt relativ einfache Tests für Radongas. In einigen Ländern werden diese Tests systematisch in Gebieten mit bekannter systematischer Gefährdung durchgeführt. Radon-Detektionsgeräte sind im Handel erhältlich. Digitale Radon-Detektoren ermöglichen kontinuierliche Messungen, die sowohl tägliche, wöchentliche, kurzfristige als auch langfristige Durchschnittswerte auf einem digitalen Display anzeigen. Kurzzeit-Radontestgeräte, die für ein erstes Screening verwendet werden, sind kostengünstig, in einigen Fällen sogar kostenlos. Für die Durchführung von Radon-Kurzzeittests gibt es wichtige Protokolle, die unbedingt befolgt werden müssen. Das Set enthält einen Kollektor, den der Benutzer zwei bis sieben Tage lang in der untersten bewohnbaren Etage des Hauses aufhängt. Anschließend schickt der Benutzer den Kollektor zur Analyse an ein Labor. Es sind auch Langzeitkits erhältlich, die Sammlungen bis zu einem Jahr oder länger erfassen. Mit einem Testkit für offenes Gelände können Radonemissionen aus dem Gelände vor Baubeginn getestet werden. Die Radonkonzentrationen können täglich schwanken, und für genaue Schätzungen der Radonexposition sind langfristige durchschnittliche Radonmessungen in den Räumen erforderlich, in denen sich eine Person längere Zeit aufhält. ⓘ
Die Radonwerte schwanken aufgrund von Faktoren wie vorübergehenden Witterungsbedingungen auf natürliche Weise, so dass ein erster Test möglicherweise keine genaue Einschätzung des durchschnittlichen Radonwerts eines Hauses ergibt. Die Radonwerte sind während der kühlsten Tageszeit am höchsten, wenn die Druckunterschiede am größten sind. Daher rechtfertigt ein hoher Wert (über 4 pCi/L) eine Wiederholung des Tests, bevor kostspieligere Sanierungsmaßnahmen ergriffen werden. Bei Messwerten zwischen 4 und 10 pCi/L ist ein Langzeit-Radontest gerechtfertigt. Bei Messwerten über 10 pCi/L ist nur ein weiterer Kurzzeittest gerechtfertigt, damit die Sanierungsmaßnahmen nicht übermäßig verzögert werden. Käufern von Immobilien wird geraten, den Kauf zu verschieben oder abzulehnen, wenn der Verkäufer die Radonkonzentration nicht erfolgreich auf 4 pCi/L oder weniger gesenkt hat. ⓘ
Da die Halbwertszeit von Radon nur 3,8 Tage beträgt, wird die Gefahr durch die Beseitigung oder Isolierung der Quelle innerhalb weniger Wochen erheblich verringert. Eine weitere Methode zur Verringerung der Radonkonzentration ist die Änderung der Belüftung des Gebäudes. Im Allgemeinen steigt die Radonkonzentration in Innenräumen mit abnehmender Belüftungsrate. In einem gut belüfteten Gebäude entspricht die Radonkonzentration in der Regel den Werten im Freien (typischerweise 10 Bq/m3, zwischen 1 und 100 Bq/m3). ⓘ
Die vier wichtigsten Methoden zur Verringerung der sich in einem Haus ansammelnden Radonmenge sind:
- Druckentlastung unter der Decke (Bodensog) durch verstärkte Belüftung des Fußbodens;
- Verbesserung der Belüftung des Hauses und Vermeidung des Transports von Radon aus dem Keller in die Wohnräume;
- Installation eines Radon-Sumpfsystems im Keller;
- Installation eines Überdruck- oder Überdruckbelüftungssystems. ⓘ
Nach Angaben der EPA wird zur Radonreduzierung "...in erster Linie ein Entlüftungsrohrsystem und ein Ventilator verwendet, der das Radon aus dem Keller absaugt und nach außen leitet", was auch als Unterdruckentlastung, aktive Bodenentlastung oder Bodenabsaugung bezeichnet wird. Im Allgemeinen kann Radon in Innenräumen durch eine Druckentlastung unter der Decke und die Ableitung der radonhaltigen Luft ins Freie, weg von Fenstern und anderen Gebäudeöffnungen, verringert werden. "Die EPA empfiehlt generell Methoden, die das Eindringen von Radon verhindern. Die Bodenabsaugung zum Beispiel verhindert das Eindringen von Radon in Ihr Haus, indem sie das Radon von unten ansaugt und durch ein oder mehrere Rohre in die Luft über dem Haus ableitet, wo es schnell verdünnt wird", und die EPA empfiehlt nicht die Verwendung von Abdichtungen allein zur Verringerung von Radon, da die Abdichtungen allein nicht nachweislich die Radonwerte signifikant oder beständig senken. ⓘ
Überdrucklüftungssysteme können mit einem Wärmetauscher kombiniert werden, um beim Luftaustausch mit der Außenluft Energie zurückzugewinnen. Eine einfache Ableitung der Kellerluft nach außen ist nicht unbedingt eine praktikable Lösung, da dadurch Radongas in die Wohnung gezogen werden kann. Bei Häusern, die auf einem Kriechkeller gebaut sind, kann ein Radonsammler von Vorteil sein, der unter einer "Radonsperre" (einer Plastikfolie, die den Kriechkeller abdeckt) installiert wird. Für Kriechräume stellt die EPA fest: "Eine wirksame Methode zur Verringerung der Radonwerte in Häusern mit Kriechräumen besteht darin, den Erdboden mit einer hochdichten Kunststofffolie abzudecken. Mit einem Entlüftungsrohr und einem Ventilator wird das Radon unter der Folie abgesaugt und ins Freie abgeleitet. Diese Form der Bodenabsaugung wird als Submembranabsaugung bezeichnet und ist bei ordnungsgemäßer Anwendung die wirksamste Methode zur Senkung der Radonwerte in Häusern mit Kriechkeller." ⓘ
Eigenschaften
Wie alle Edelgase ist Radon chemisch fast nicht reaktiv; mit Fluor reagiert es zu Radondifluorid, ob Verbindungen mit Sauerstoff beobachtet wurden, ist umstritten. Unter Normalbedingungen ist Radongas farblos, geruchlos, geschmacklos; beim Abkühlen unter seinen Schmelzpunkt wird es leuchtend gelb bis orange. Als Füllung in Gasentladungsröhren erzeugt Radon rotes Licht. Außerdem ist es mit 9,73 kg·m−3 das mit Abstand dichteste elementare Gas, wenn man vom exotisch raren Astat und heißem zweiatomigen Iod-Dampf absieht. ⓘ
Wie sein leichteres gruppenhomologes Xenon ist Radon in der Lage, echte Verbindungen zu bilden. Es kann erwartet werden, dass diese stabiler und vielfältiger sind als beim Xenon. Das Studium der Radonchemie wird durch die hohe spezifische Aktivität des Radons sehr behindert, weil die energiereiche Strahlung zur Selbstzersetzung (Autoradiolyse) der Verbindungen führt. Eine Chemie mit wägbaren Mengen dieser Stoffe ist daher nicht möglich. Ab-initio- und Dirac-Hartree-Fock-Berechnungen beschreiben einige Eigenschaften des noch nicht synthetisierten Radonhexafluorids (RnF6). ⓘ
Als radioaktives Gas mit sehr hoher Dichte kann sich Radon in Gebäuden, besonders in Kellern und den unteren Stockwerken, in physiologisch bedeutsamen Mengen ansammeln. Bei neueren Messungen kamen in Gebäuden, wenn dort Baumaterialien wie ungebrannter Lehm verwendet wurden, zudem größere Radonmengen in den oberen Stockwerken vor. ⓘ
Die Löslichkeit des Isotops Rn-222 in Wasser beträgt bei 20 °C und 101,325 kPa 259 ml/l. ⓘ
Gewinnung
Wenn die oben genannten radioaktiven Substanzen zu Radon zerfallen, kann dieses ausgasen. In einem Labor kann man das aus einer Probe entweichende Radon auffangen und durch Verflüssigen von der Restluft trennen. Beim Zerfall eines Gramms 226Ra entstehen 0,64 cm3 222Rn pro Monat. ⓘ
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen, die bei Edelgasen nicht auftritt. Wichtig sind die auf der Radioaktivität beruhenden Gefahren. ⓘ
Nach Studien der Weltgesundheitsorganisation nimmt das Auftreten von Lungenkrebs bei Radon in Raumluft linear zu, der von der WHO empfohlene Langzeitgrenzwert liegt bei 100 Bq pro Kubikmeter Raumluft. Die Wahrscheinlichkeit für Lungenkrebs steigt in Näherung mit der Zunahme um 100 Bq/m³ in der Raumluft um 10 %. ⓘ
2018 wurden im Bundesland Salzburg in Österreich in 3.400 Wohnobjekten Radon-Messungen durchgeführt und ermittelt, dass in 10 % der Wohnungen ein Grenzwert von 300 Bq pro Kubikmeter Luft überschritten wird. ⓘ