Fluor
 Flüssiges Fluor (bei extrem niedrigen Temperaturen) | ||||||||||||||||||
| Fluor | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache |
| |||||||||||||||||
| Allotrope | alpha, beta (siehe Allotrope des Fluors) | |||||||||||||||||
| Erscheinungsbild | Gas: sehr blassgelb flüssig: hellgelb fest: alpha ist undurchsichtig, beta ist durchsichtig | |||||||||||||||||
| Standard-Atomgewicht Ar°(F) |
| |||||||||||||||||
| Fluor im Periodensystem | ||||||||||||||||||
| ||||||||||||||||||
| Ordnungszahl (Z) | 9 | |||||||||||||||||
| Gruppe | Gruppe 17 (Halogene) | |||||||||||||||||
| Periode | Periode 2 | |||||||||||||||||
| Block | p-Block | |||||||||||||||||
| Elektronenkonfiguration | [[[Helium|He]]] 2s2 2p5 | |||||||||||||||||
| Elektronen pro Schale | 2, 7 | |||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||
| Phase bei STP | Gas | |||||||||||||||||
| Schmelzpunkt | (F2) 53,48 K (-219,67 °C, -363,41 °F) | |||||||||||||||||
| Siedepunkt | (F2) 85,03 K (-188,11 °C, -306,60 °F) | |||||||||||||||||
| Dichte (bei STP) | 1,696 g/L | |||||||||||||||||
| in flüssigem Zustand (bei B.P.) | 1,505 g/cm3 | |||||||||||||||||
| Tripelpunkt | 53,48 K, 90 kPa | |||||||||||||||||
| Kritischer Punkt | 144,41 K, 5,1724 MPa | |||||||||||||||||
| Verdampfungswärme | 6,51 kJ/Mol | |||||||||||||||||
| Molare Wärmekapazität | Cp: 31 J/(mol-K) (bei 21,1 °C) Cv: 23 J/(mol-K) (bei 21,1 °C) | |||||||||||||||||
Dampfdruck
| ||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||
| Oxidationsstufen | -1, 0 (oxidiert Sauerstoff) | |||||||||||||||||
| Elektronegativität | Pauling-Skala: 3.98 | |||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||
| Kovalenter Radius | 64 pm | |||||||||||||||||
| Van-der-Waals-Radius | 135 pm | |||||||||||||||||
| Spektrallinien von Fluor | ||||||||||||||||||
| Andere Eigenschaften | ||||||||||||||||||
| Natürliches Vorkommen | primordial | |||||||||||||||||
| Kristallstruktur | kubisch | |||||||||||||||||
| Wärmeleitfähigkeit | 0,02591 W/(m⋅K) | |||||||||||||||||
| Magnetische Ordnung | diamagnetisch (-1,2×10-4) | |||||||||||||||||
| CAS-Nummer | 7782-41-4 | |||||||||||||||||
| Geschichte | ||||||||||||||||||
| Namensgebung | nach dem Mineral Fluorit, das seinerseits nach dem lateinischen Wort fluo (fließen, in der Verhüttung) benannt ist | |||||||||||||||||
| Entdeckung | André-Marie Ampère (1810) | |||||||||||||||||
| Erste Isolierung | Henri Moissan (26. Juni 1886) | |||||||||||||||||
| Benannt durch |
| |||||||||||||||||
| Hauptisotope des Fluors | ||||||||||||||||||
| ||||||||||||||||||
Fluor ist ein chemisches Element mit dem Symbol F und der Ordnungszahl 9. Es ist das leichteste Halogen und liegt unter Standardbedingungen als hochgiftiges, blassgelbes zweiatomiges Gas vor. Als elektronegativstes Element ist es extrem reaktiv, da es mit allen anderen Elementen außer Argon, Neon und Helium reagiert. ⓘ
Unter den Elementen rangiert Fluor an 24. Stelle in der universellen Häufigkeit und an 13. in der terrestrischen Häufigkeit. Fluorit, die primäre mineralische Fluorquelle, die dem Element seinen Namen gab, wurde erstmals 1529 beschrieben; da es Metallerzen zugesetzt wurde, um deren Schmelzpunkt für die Verhüttung zu senken, gab das lateinische Verb fluo, das "fließen" bedeutet, dem Mineral seinen Namen. 1810 wurde Fluor als Element vorgeschlagen, doch erwies es sich als schwierig und gefährlich, es von seinen Verbindungen zu trennen, und mehrere frühe Experimentatoren starben oder verletzten sich bei ihren Versuchen. Erst 1886 gelang es dem französischen Chemiker Henri Moissan, elementares Fluor durch Niedertemperatur-Elektrolyse zu isolieren, ein Verfahren, das auch heute noch in der Produktion eingesetzt wird. Die industrielle Produktion von Fluorgas für die Urananreicherung, seine wichtigste Anwendung, begann während des Manhattan-Projekts im Zweiten Weltkrieg. ⓘ
Aufgrund der hohen Kosten für die Raffination von reinem Fluor werden für die meisten kommerziellen Anwendungen Fluorverbindungen verwendet, wobei etwa die Hälfte des abgebauten Fluorits in der Stahlherstellung eingesetzt wird. Der Rest des Fluorits wird auf dem Weg zu verschiedenen organischen Fluoriden in korrosiven Fluorwasserstoff oder in Kryolith umgewandelt, das eine Schlüsselrolle bei der Aluminiumraffination spielt. Moleküle, die eine Kohlenstoff-Fluor-Bindung enthalten, weisen oft eine sehr hohe chemische und thermische Stabilität auf; sie werden hauptsächlich als Kühlmittel, zur elektrischen Isolierung und für Kochgeschirr sowie als PTFE (Teflon) verwendet. Pharmazeutika wie Atorvastatin und Fluoxetin enthalten C-F-Bindungen. Das Fluoridion aus gelösten Fluoridsalzen hemmt Zahnkaries und wird daher in Zahnpasta und bei der Wasserfluoridierung verwendet. Der weltweite Umsatz mit Fluorchemikalien beläuft sich auf mehr als 69 Milliarden US-Dollar pro Jahr. ⓘ
Fluorkohlenstoffhaltige Gase sind in der Regel Treibhausgase mit einem Erderwärmungspotenzial, das 100 bis 23.500 Mal höher ist als das von Kohlendioxid, und SF6 hat das höchste Erderwärmungspotenzial aller bekannten Stoffe. Fluororganische Verbindungen bleiben aufgrund der Stärke der Kohlenstoff-Fluor-Bindung häufig in der Umwelt erhalten. Fluor spielt im Stoffwechsel von Säugetieren keine Rolle; einige wenige Pflanzen und Meeresschwämme synthetisieren fluororganische Gifte (meist Monofluoracetate), die zur Abschreckung von Raubtieren dienen. ⓘ
| Eigenschaften ⓘ | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[[[Helium|He]]] 2s2 2p5
9F
Periodensystem | |||||||||||||||||||||||||||||||||||||
| Allgemein | |||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Fluor, F, 9 | ||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halogene | ||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 17, 2, p | ||||||||||||||||||||||||||||||||||||
| Aussehen | blasses, gelbliches Gas | ||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-954-8 | ||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.029.049 | ||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,028 % | ||||||||||||||||||||||||||||||||||||
| Atomar | |||||||||||||||||||||||||||||||||||||
| Atommasse | 18,998403163(6) u | ||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 50 (42) pm | ||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 71 pm | ||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 147 pm | ||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [[[Helium|He]]] 2s2 2p5 | ||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 17.42282(5) eV ≈ 1681.05 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 34.97081(12) eV ≈ 3374.17 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 62.70798(25) eV ≈ 6050.4 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 87.175(17) eV ≈ 8411.11 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 114.249(6) eV ≈ 11023.3 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 157.16311(25) eV ≈ 15163.9 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 7. Ionisierungsenergie | 185.1868(6) eV ≈ 17867.8 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Physikalisch | |||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig (F2) | ||||||||||||||||||||||||||||||||||||
| Dichte | 1,6965 kg/m3 bei 273 K | ||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch | ||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 53,53 K (−219,62 °C) | ||||||||||||||||||||||||||||||||||||
| Siedepunkt | 85,15 K (−188 °C) | ||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 11,20 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 6,32 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 0,2552 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,0279 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Chemisch | |||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −1 | ||||||||||||||||||||||||||||||||||||
| Normalpotential | 2,87 V (F + e− → F−) | ||||||||||||||||||||||||||||||||||||
| Elektronegativität | 3,98 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,15 mg·m−3 | ||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||
Der Name des Elementes ist von lateinisch fluores für Flussspat abgeleitet, dem natürlich vorkommenden Mineral Fluorit, das in der Metallurgie als Flussmittel zur Herabsetzung des Schmelzpunktes von Erzen verwendet wird. ⓘ
Elementares Fluor ist stark ätzend und sehr giftig; sein durchdringender Geruch kann schon in geringeren Konzentrationen bemerkt werden. Dessen Salze – Fluoride und diverse Fluorokomplexsalze wie Natriummonofluorophosphat – sind in höherer Konzentration ebenfalls giftig. Schon in Spuren beeinflussen Fluor und Fluoride die Bildung von Knochen und Zähnen, insbesondere des Zahnschmelzes. Sie werden daher zur Prophylaxe von Zahnkaries in Zahnpasten eingesetzt sowie als Fluoridierung dem Trinkwasser oder dem Speisesalz zugesetzt. ⓘ
Eigenschaften
Elektronenkonfiguration
Fluoratome haben neun Elektronen, eines weniger als Neon, und die Elektronenkonfiguration 1s22s22p5: zwei Elektronen in einer gefüllten inneren Schale und sieben in einer äußeren Schale, die ein weiteres Elektron benötigt, um gefüllt zu werden. Die Außenelektronen sind bei der Kernabschirmung ineffektiv und erfahren eine hohe effektive Kernladung von 9 - 2 = 7; dies wirkt sich auf die physikalischen Eigenschaften des Atoms aus. ⓘ
Die erste Ionisierungsenergie von Fluor ist nach Helium und Neon die dritthöchste aller Elemente, was die Entfernung von Elektronen aus neutralen Fluoratomen erschwert. Es hat auch eine hohe Elektronenaffinität, die nur von Chlor übertroffen wird, und neigt dazu, ein Elektron einzufangen, um mit dem Edelgas Neon isoelektronisch zu werden; es hat die höchste Elektronegativität aller Elemente. Fluoratome haben einen kleinen kovalenten Radius von etwa 60 Pikometern, ähnlich wie die Atome der benachbarten Elemente Sauerstoff und Neon. ⓘ
Reaktivität
| Externes Video ⓘ | |
|---|---|

Die Bindungsenergie von Difluor ist viel niedriger als die von Cl
2 oder Br
2 und ähnelt der leicht zu spaltenden Peroxidbindung. Zusammen mit der hohen Elektronegativität ist dies der Grund für die leichte Dissoziation von Fluor, seine hohe Reaktivität und die starken Bindungen zu Nicht-Fluoratomen. Umgekehrt sind die Bindungen zu anderen Atomen wegen der hohen Elektronegativität des Fluors sehr stark. Nicht reaktive Stoffe wie Stahlpulver, Glasscherben und Asbestfasern reagieren schnell mit kaltem Fluorgas; Holz und Wasser verbrennen spontan unter einem Fluorstrahl. ⓘ
Die Reaktionen von elementarem Fluor mit Metallen erfordern unterschiedliche Bedingungen. Alkalimetalle führen zu Explosionen, und Erdalkalimetalle zeigen in der Masse eine starke Aktivität; um eine Passivierung durch die Bildung von Metallfluoridschichten zu verhindern, müssen die meisten anderen Metalle wie Aluminium und Eisen pulverisiert werden, und Edelmetalle benötigen reines Fluorgas bei 300-450 °C (575-850 °F). Einige feste Nichtmetalle (Schwefel, Phosphor) reagieren heftig mit flüssigem Fluor. Schwefelwasserstoff und Schwefeldioxid verbinden sich leicht mit Fluor, letzteres manchmal explosiv; Schwefelsäure ist weit weniger aktiv und erfordert höhere Temperaturen. ⓘ
Wasserstoff, wie auch einige Alkalimetalle, reagieren explosionsartig mit Fluor. Kohlenstoff, wie Lampenruß, reagiert bei Raumtemperatur zu Fluormethan. Graphit verbindet sich oberhalb von 400 °C (750 °F) mit Fluor zu nicht-stöchiometrischem Kohlenstoffmonofluorid; bei höheren Temperaturen entstehen gasförmige Fluorkohlenstoffe, manchmal mit Explosionen. Kohlendioxid und Kohlenmonoxid reagieren bei oder knapp über Raumtemperatur, während Paraffine und andere organische Chemikalien starke Reaktionen auslösen: Selbst vollständig substituierte Halogenalkane wie Tetrachlorkohlenstoff, die normalerweise nicht brennbar sind, können explodieren. Obwohl Stickstofftrifluorid stabil ist, benötigt Stickstoff aufgrund der sehr starken Dreifachbindung in elementarem Stickstoff eine elektrische Entladung bei erhöhten Temperaturen, um mit Fluor zu reagieren; Ammoniak kann explosiv reagieren. Sauerstoff verbindet sich unter Umgebungsbedingungen nicht mit Fluor, kann aber durch elektrische Entladung bei niedrigen Temperaturen und Drücken zur Reaktion gebracht werden; die Produkte zerfallen beim Erhitzen in ihre Bestandteile. Schwere Halogene reagieren leicht mit Fluor, ebenso das Edelgas Radon; von den anderen Edelgasen reagieren nur Xenon und Krypton, und das auch nur unter besonderen Bedingungen. ⓘ
Phasen

2-Moleküle, die jeden beliebigen Winkel einnehmen können. Andere Moleküle sind an Ebenen gebunden. ⓘ

Bei Raumtemperatur ist Fluor ein Gas aus zweiatomigen Molekülen, das in reinem Zustand blassgelb ist (manchmal auch als gelb-grün bezeichnet). Es hat einen charakteristischen halogenähnlichen, stechenden und beißenden Geruch, der bei 20 ppb nachweisbar ist. Fluor kondensiert bei -188 °C (-306 °F) zu einer leuchtend gelben Flüssigkeit, einer Übergangstemperatur ähnlich der von Sauerstoff und Stickstoff. ⓘ
Fluor hat zwei feste Formen, α- und β-Fluor. Letzteres kristallisiert bei -220 °C (-364 °F) und ist transparent und weich, mit der gleichen ungeordneten kubischen Struktur wie frisch kristallisierter fester Sauerstoff, im Gegensatz zu den orthorhombischen Systemen der anderen festen Halogene. Eine weitere Abkühlung auf -228 °C (-378 °F) führt zu einem Phasenübergang in undurchsichtiges und hartes α-Fluor, das eine monokline Struktur mit dichten, gewinkelten Molekülschichten aufweist. Der Übergang von β- zu α-Fluor ist exothermer als die Kondensation von Fluor und kann heftig sein. ⓘ
Isotope
Nur ein Isotop des Fluors kommt in der Natur in großer Menge vor, das stabile Isotop 19
F. Es hat ein hohes magnetogyrisches Verhältnis und eine außergewöhnliche Empfindlichkeit gegenüber Magnetfeldern; da es auch das einzige stabile Isotop ist, wird es in der Magnetresonanztomographie verwendet. Es wurden achtzehn Radioisotope mit Massenzahlen von 13 bis 31 synthetisiert, von denen 18
F mit einer Halbwertszeit von 109,77 Minuten das stabilste ist. Andere Radioisotope haben Halbwertszeiten von weniger als 70 Sekunden; die meisten zerfallen in weniger als einer halben Sekunde. Die Isotope 17
F und 18
F zerfallen durch β+-Zerfall und Elektroneneinfang, die leichteren Isotope zerfallen durch Protonenemission, und die schwereren als 19
F unterliegen dem β-Zerfall (die schwersten Isotope mit verzögerter Neutronenemission). Es sind zwei metastabile Isomere des Fluors bekannt, 18m
F, mit einer Halbwertszeit von 162(7) Nanosekunden, und 26m
F, mit einer Halbwertszeit von 2,2(1) Millisekunden. ⓘ
18F wird in der Krebsdiagnostik in Form von Fluordesoxyglucose, Fluorethylcholin, Fluorethyltyrosin bzw. 18F-Fluorid als Radionuklid in der Positronen-Emissions-Tomographie (PET) eingesetzt. ⓘ
Siehe auch: Liste der Fluor-Isotope ⓘ
Moleküleigenschaften

Fluor liegt im elementaren Zustand wie die anderen Halogene in Form zweiatomiger Moleküle vor. Die Bindungslänge im Fluormolekül ist mit 144 pm kürzer als die Einfachbindungen in anderen Elementen (beispielsweise Kohlenstoff-Kohlenstoff-Bindung: 154 pm). Trotz dieser kurzen Bindung ist die Dissoziationsenergie der Fluor-Fluor-Bindung im Vergleich zu anderen Bindungen mit 158 kJ/mol gering und entspricht etwa der des Iodmoleküls mit einer Bindungslänge von 266 pm. Die Gründe für die geringe Dissoziationsenergie liegen vor allem darin, dass sich die freien Elektronenpaare der Fluoratome stark nähern und es zu Abstoßungen kommt. Diese schwache Bindung bewirkt die hohe Reaktivität des Fluors. ⓘ
Durch die Molekülorbitaltheorie lässt sich die Bindung im Fluormolekül ebenfalls erklären. Dabei werden die s- und p-Atomorbitale der einzelnen Atome zu bindenden und antibindenden Molekülorbitalen zusammengesetzt. Die 1s- und 2s-Orbitale der Fluoratome werden jeweils zu σs und σs*- bindenden und antibindenden Molekülorbitalen. Da diese Orbitale vollständig mit Elektronen gefüllt sind, tragen sie nichts zur Bindung bei. Aus den 2p-Orbitalen werden insgesamt sechs Molekülorbitale mit unterschiedlicher Energie. Dies sind die bindenden σp-, πy- und πz- sowie die entsprechenden antibindenden σp*-, πy*- und πz*-Molekülorbitale. Die π-Orbitale besitzen dabei gleiche Energie. Werden Elektronen in die Molekülorbitale verteilt, kommt es dazu, dass sowohl sämtliche bindenden als auch die antibindenden π*-Orbitale vollständig besetzt sind. Dadurch ergibt sich eine Bindungsordnung von (6–4)/2 = 1 und ein diamagnetisches Verhalten, das auch beobachtet wird. ⓘ
Vorkommen
Universum
| Atomare Nummer |
Element | Relativ Menge ⓘ |
|---|---|---|
| 6 | Kohlenstoff | 4,800 |
| 7 | Stickstoff | 1,500 |
| 8 | Sauerstoff | 8,800 |
| 9 | Fluor | 1 |
| 10 | Neon | 1,400 |
| 11 | Natrium | 24 |
| 12 | Magnesium | 430 |
Unter den leichteren Elementen ist die Häufigkeit von Fluor mit 400 ppb (Teile pro Milliarde) - dem 24. Platz unter den Elementen im Universum - außergewöhnlich niedrig: andere Elemente von Kohlenstoff bis Magnesium sind zwanzigmal oder mehr so häufig. Das liegt daran, dass die Nukleosyntheseprozesse in den Sternen das Fluor umgehen, und dass die ansonsten entstehenden Fluoratome einen hohen Kernquerschnitt haben, so dass bei Kollisionen mit Wasserstoff oder Helium Sauerstoff bzw. Neon entstehen. ⓘ
Abgesehen von dieser vorübergehenden Existenz wurden drei Erklärungen für das Vorhandensein von Fluor vorgeschlagen:
- Bei Supernovae vom Typ II könnte der Beschuss von Neonatomen durch Neutrinos diese in Fluor umwandeln;
- der Sonnenwind von Wolf-Rayet-Sternen könnte Fluor von allen Wasserstoff- und Heliumatomen wegblasen; oder
- Fluor wird von Konvektionsströmen getragen, die bei der Fusion in asymptotischen Riesenaststernen entstehen. ⓘ
Erde

In der Erdkruste ist Fluor mit 525 ppm ein relativ häufiges Element. Es kommt aufgrund seiner Reaktivität in der Natur nur äußerst selten elementar, sondern fast ausschließlich gebunden als Fluorid in Form einiger Minerale vor. Eine Ausnahme bildet Stinkspat (eine uranhaltige Fluorit-Varietät) u. a. aus Wölsendorf, sowie Villiaumit, in denen geringe Mengen elementares Fluor durch Radiolyse entstanden sind, was bei mechanischen Bearbeitungen einen starken Geruch durch freigesetztes Fluor verursacht. Meerwasser enthält wenig gelöste Fluoride, da bei Anwesenheit von Calcium die Löslichkeit durch Bildung von schwerlöslichem Calciumfluorid eingeschränkt wird. Die häufigsten Fluorminerale sind der Fluorit CaF2 und der Fluorapatit Ca5(PO4)3F. Der größte Teil des Fluorits ist in Fluorapatit gebunden, jedoch enthält dieser nur einen geringen Massenanteil Fluor von ca. 3,8 %. Daher wird Fluorapatit nicht wegen seines Fluorgehaltes, sondern vor allem als Phosphatquelle abgebaut. Die Hauptquelle für die Gewinnung von Fluor und Fluorverbindungen ist der Fluorit. Größere Fluoritvorkommen existieren in Mexiko, China, Südafrika, Spanien und Russland. Auch in Deutschland findet sich Fluorit, beispielsweise im eingangs erwähnten Wölsendorf. ⓘ
Ein weiteres natürlich vorkommendes Fluormineral ist Kryolith Na3AlF6. Die ursprünglich bedeutenden Kryolithvorkommen bei Ivigtut auf Grönland sind ausgebeutet. Das in der Aluminiumproduktion benötigte Kryolith wird heute chemisch hergestellt. ⓘ
Fluorid-Ionen kommen daneben auch in einigen seltenen Mineralen vor, in denen sie die Hydroxidgruppen ersetzen. Beispiele sind Asbest sowie der Schmuckstein Topas Al2SiO4(OH, F)2, Sellait MgF2 und Bastnäsit (La,Ce)(CO3)F. Eine Übersicht gibt die :Kategorie:Fluormineral. ⓘ
Einige wenige Organismen können Fluoride in fluororganische Verbindungen einbauen. Der südafrikanische Busch Gifblaar und weitere Pflanzenarten der Gattung Dichapetalum können Fluoressigsäure synthetisieren und in ihren Blättern speichern. Dies dient zur Abwehr von Fressfeinden, für die Fluoressigsäure tödlich wirkt. Die Giftwirkung wird durch Unterbrechung des Citratzyklus ausgelöst. ⓘ
Kryolith: Ein parallelogrammförmiger Umriss mit zweiatomigen Molekülen, die in zwei Schichten angeordnet sind ⓘ
Auch andere Mineralien wie Topas enthalten Fluor. Fluoride sind im Gegensatz zu anderen Halogeniden unlöslich und kommen in salzhaltigen Gewässern nicht in kommerziell günstigen Konzentrationen vor. In Vulkanausbrüchen und geothermischen Quellen wurden Spuren von fluororganischen Verbindungen unklarer Herkunft nachgewiesen. Das Vorhandensein von gasförmigem Fluor in Kristallen, das durch den Geruch von zerkleinertem Antozonit nahegelegt wird, ist umstritten; in einer Studie aus dem Jahr 2012 wurde das Vorhandensein von 0,04 % F
2 nach Gewicht in Antozonit, wobei diese Einschlüsse auf die Strahlung durch das Vorhandensein winziger Mengen von Uran zurückgeführt werden. ⓘ
Geschichte
Frühe Entdeckungen

1529 beschrieb Georgius Agricola Fluorit als einen Zusatzstoff, der zur Senkung des Schmelzpunkts von Metallen beim Schmelzen verwendet wird. Er prägte das lateinische Wort fluorēs (fluor, fließen) für Fluoritgestein. Der Name entwickelte sich später zu Flussspat (immer noch gebräuchlich) und dann zu Fluorit. Die Zusammensetzung von Fluorit wurde später als Calciumdifluorid bestimmt. ⓘ
Flusssäure wurde ab 1720 zum Ätzen von Glas verwendet. Andreas Sigismund Marggraf charakterisierte sie erstmals 1764, als er Fluorit mit Schwefelsäure erhitzte und die daraus resultierende Lösung den Glasbehälter ätzte. Der schwedische Chemiker Carl Wilhelm Scheele wiederholte das Experiment 1771 und nannte das saure Produkt fluss-spats-syran (Flussspat-Säure). Im Jahr 1810 schlug der französische Physiker André-Marie Ampère vor, dass Wasserstoff und ein dem Chlor ähnliches Element die Flusssäure bildeten. In einem Brief an Sir Humphry Davy vom 26. August 1812 schlug er außerdem vor, diese damals noch unbekannte Substanz nach der Flusssäure und dem Suffix -ine anderer Halogene als Fluor zu bezeichnen. Dieses Wort wird, oft mit Abwandlungen, in den meisten europäischen Sprachen verwendet; das Griechische, das Russische und einige andere Sprachen verwenden jedoch, dem späteren Vorschlag von Ampère folgend, den Namen ftor oder Ableitungen vom griechischen φθόριος (phthorios, zerstörerisch). Der neulateinische Name fluorum gab dem Element sein heutiges Symbol F; Fl wurde in frühen Arbeiten verwendet. ⓘ
Isolierung

Die ersten Versuche mit Fluor waren so gefährlich, dass mehrere Experimentatoren des 19. Jahrhunderts nach Missgeschicken mit Flusssäure als "Fluormärtyrer" bezeichnet wurden. Die Isolierung von elementarem Fluor scheiterte an der extremen Korrosivität sowohl des elementaren Fluors selbst als auch des Fluorwasserstoffs sowie am Fehlen eines einfachen und geeigneten Elektrolyten. Edmond Frémy postulierte, dass die Elektrolyse von reinem Fluorwasserstoff zur Erzeugung von Fluor durchführbar sei, und entwickelte eine Methode zur Herstellung wasserfreier Proben aus angesäuertem Kaliumbifluorid; er stellte jedoch fest, dass der resultierende (trockene) Fluorwasserstoff keinen Strom leitete. Frémys ehemaliger Schüler Henri Moissan blieb hartnäckig und fand nach vielen Versuchen und Irrtümern heraus, dass eine Mischung aus Kaliumbifluorid und trockenem Fluorwasserstoff leitfähig war und die Elektrolyse ermöglichte. Um eine schnelle Korrosion des Platins in seinen elektrochemischen Zellen zu verhindern, kühlte er die Reaktion in einem speziellen Bad auf extrem niedrige Temperaturen ab, schmiedete Zellen aus einer widerstandsfähigeren Mischung aus Platin und Iridium und verwendete Fluoritstopfen. 1886 isolierte Moissan nach 74 Jahren Arbeit vieler Chemiker elementares Fluor. ⓘ
Im Jahr 1906, zwei Monate vor seinem Tod, erhielt Moissan den Nobelpreis für Chemie mit folgender Begründung:
[in Anerkennung der großen Verdienste, die er sich bei der Erforschung und Isolierung des Elements Fluor erworben hat ... Die ganze Welt hat das große experimentelle Geschick bewundert, mit dem Sie diese wilde Bestie unter den Elementen untersucht haben. ⓘ
Spätere Verwendungen

Die Frigidaire-Abteilung von General Motors (GM) experimentierte in den späten 1920er Jahren mit Fluorchlorkohlenwasserstoff-Kältemitteln, und 1930 wurde Kinetic Chemicals als Joint Venture zwischen GM und DuPont in der Hoffnung gegründet, Freon-12 (CCl
2F
2) als ein solches Kältemittel zu vermarkten. Es ersetzte frühere und giftigere Verbindungen, steigerte die Nachfrage nach Küchenkühlschränken und wurde rentabel; 1949 hatte DuPont Kinetic aufgekauft und vermarktete mehrere andere Freon-Verbindungen. Polytetrafluorethylen (Teflon) wurde 1938 zufällig von Roy J. Plunkett entdeckt, als er bei Kinetic an Kühlmitteln arbeitete. Aufgrund seiner hervorragenden chemischen und thermischen Beständigkeit konnte es 1941 schnell vermarktet und in Serie produziert werden. ⓘ
Die großtechnische Produktion von elementarem Fluor begann während des Zweiten Weltkriegs. Deutschland nutzte die Hochtemperaturelektrolyse zur Herstellung von Tonnen des geplanten Brandstoffs Chlortrifluorid, und das Manhattan-Projekt verwendete riesige Mengen zur Herstellung von Uranhexafluorid für die Urananreicherung. Da UF
6 ebenso korrosiv ist wie Fluor, wurden für Gasdiffusionsanlagen spezielle Materialien benötigt: Nickel für Membranen, Fluorpolymere für Dichtungen und flüssige Fluorkohlenwasserstoffe als Kühl- und Schmiermittel. Die aufblühende Atomindustrie trieb später die Entwicklung der Fluorchemie in der Nachkriegszeit voran. ⓘ
Verbindungen
Die Chemie des Fluors ist reichhaltig und umfasst sowohl organische als auch anorganische Bereiche. Es verbindet sich mit Metallen, Nichtmetallen, Metalloiden und den meisten Edelgasen und nimmt fast ausschließlich eine Oxidationsstufe von -1 an. Die hohe Elektronenaffinität von Fluor führt zu einer Vorliebe für ionische Bindungen; wenn es kovalente Bindungen eingeht, sind diese polar und fast immer einfach. ⓘ
Metalle
Alkalimetalle bilden ionische und gut lösliche Monofluoride; diese haben die kubische Anordnung von Natriumchlorid und analogen Chloriden. Erdalkalidifluoride besitzen starke Ionenbindungen, sind aber in Wasser unlöslich, mit Ausnahme von Berylliumdifluorid, das auch einen gewissen kovalenten Charakter aufweist und eine quarzähnliche Struktur besitzt. Die Elemente der Seltenen Erden und viele andere Metalle bilden meist ionische Trifluoride. ⓘ
Die kovalente Bindung tritt zuerst bei den Tetrafluoriden in den Vordergrund: Die Tetrafluoride von Zirkonium, Hafnium und verschiedenen Actiniden sind ionisch und haben einen hohen Schmelzpunkt, während die Tetrafluoride von Titan, Vanadium und Niob polymer sind und bei höchstens 350 °C schmelzen oder sich zersetzen. Pentafluoride setzen diesen Trend mit ihren linearen Polymeren und oligomeren Komplexen fort. Dreizehn Metallhexafluoride sind bekannt, alle oktaedrisch, und sind meist flüchtige Feststoffe, mit Ausnahme der flüssigen MoF
6 und ReF
6, und gasförmiges WF
6. Rheniumheptafluorid, das einzige charakterisierte Metallheptafluorid, ist ein niedrigschmelzender molekularer Feststoff mit pentagonaler bipyramidaler Molekülgeometrie. Metallfluoride mit mehr Fluoratomen sind besonders reaktiv. ⓘ
| Strukturelle Entwicklung der Metallfluoride ⓘ | ||

|

|

|
| Natriumfluorid, ionisch | Bismutpentafluorid, polymer | Rheniumheptafluorid, molekular |
Wasserstoff

Wasserstoff und Fluor verbinden sich zu Fluorwasserstoff, in dem diskrete Moleküle durch Wasserstoffbrückenbindungen Cluster bilden, die mehr an Wasser als an Chlorwasserstoff erinnern. Es siedet bei einer viel höheren Temperatur als schwerere Halogenwasserstoffe und ist im Gegensatz zu diesen mit Wasser mischbar. Fluorwasserstoff hydratisiert leicht bei Kontakt mit Wasser und bildet wässrigen Fluorwasserstoff, der auch als Flusssäure bezeichnet wird. Im Gegensatz zu den anderen Halogenwasserstoffsäuren, die stark sind, ist Flusssäure bei niedrigen Konzentrationen eine schwache Säure. Sie kann jedoch Glas angreifen, was die anderen Säuren nicht können. ⓘ
Andere reaktive Nichtmetalle

Binäre Fluoride von Metalloiden und p-Block-Nichtmetallen sind im Allgemeinen kovalent und flüchtig und weisen unterschiedliche Reaktivitäten auf. Periode 3 und schwerere Nichtmetalle können hypervalente Fluoride bilden. ⓘ
Bortrifluorid ist planar und besitzt ein unvollständiges Oktett. Es fungiert als Lewis-Säure und verbindet sich mit Lewis-Basen wie Ammoniak zu Addukten. Kohlenstofftetrafluorid ist tetraedrisch und inert; seine Gruppenanaloga, Silizium- und Germaniumtetrafluorid, sind ebenfalls tetraedrisch, verhalten sich aber wie Lewis-Säuren. Die Pntogene bilden Trifluoride, deren Reaktivität und Basizität mit höherem Molekulargewicht zunimmt, wobei Stickstofftrifluorid hydrolysebeständig und nicht basisch ist. Die Pentafluoride von Phosphor, Arsen und Antimon sind reaktiver als ihre jeweiligen Trifluoride, wobei Antimonpentafluorid die stärkste bekannte neutrale Lewis-Säure ist. ⓘ
Chalkogene weisen verschiedene Fluoride auf: instabile Difluoride wurden für Sauerstoff (die einzige bekannte Verbindung mit Sauerstoff in der Oxidationsstufe +2), Schwefel und Selen gemeldet; Tetrafluoride und Hexafluoride existieren für Schwefel, Selen und Tellur. Letztere werden durch mehr Fluoratome und leichtere Zentralatome stabilisiert, so dass Schwefelhexafluorid besonders inert ist. Chlor, Brom und Jod können jeweils Mono-, Tri- und Pentafluoride bilden, aber von den möglichen Interhalogenheptafluoriden ist nur Jodheptafluorid charakterisiert worden. Viele von ihnen sind starke Quellen von Fluoratomen, und industrielle Anwendungen, bei denen Chlortrifluorid verwendet wird, erfordern ähnliche Vorsichtsmaßnahmen wie bei der Verwendung von Fluor. ⓘ
Edelgase

Edelgase, die über vollständige Elektronenhüllen verfügen, konnten bis 1962 nicht mit anderen Elementen reagieren, bis Neil Bartlett über die Synthese von Xenonhexafluoroplatinat berichtete; seitdem wurden Xenondifluorid, -tetrafluorid, -hexafluorid und mehrere Oxyfluoride isoliert. Von anderen Edelgasen bildet Krypton ein Difluorid, und Radon und Fluor bilden einen Feststoff, bei dem es sich vermutlich um Radondifluorid handelt. Binäre Fluoride von leichteren Edelgasen sind außerordentlich instabil: Argon und Fluorwasserstoff verbinden sich unter extremen Bedingungen zu Argonfluorhydrid. Bei Helium und Neon gibt es keine langlebigen Fluoride, und es wurde nie ein Neonfluorid beobachtet; Heliumfluorhydrid wurde bei hohem Druck und niedrigen Temperaturen für Millisekunden nachgewiesen. ⓘ
Organische Verbindungen
Es existiert eine Reihe von organischen Fluorverbindungen. Eine der bekanntesten fluorhaltigen Stoffgruppen sind die Fluorchlorkohlenwasserstoffe (FCKW). Die niedermolekularen FCKW mit einem oder zwei Kohlenstoffatomen sind gasförmige Stoffe und dienten früher als Kältemittel in Kühlschränken und Treibgas für Spraydosen. Da diese Stoffe den Ozonabbau verstärken und somit die Ozonschicht schädigen, ist ihre Herstellung und Verwendung mit dem Montreal-Protokoll stark eingeschränkt worden. Dagegen sind Fluorkohlenwasserstoffe für die Ozonschicht ungefährlich. Eine weitere umweltschädliche Auswirkung fluorhaltiger organischer Verbindungen ist ihre Absorptionsfähigkeit für Infrarotstrahlung. Daher wirken sie als Treibhausgase. ⓘ
Eine aus dem Alltag bekannte organische Fluorverbindung ist Polytetrafluorethen (PTFE), die unter dem Handelsnamen Teflon® als Beschichtung von Bratpfannen verwendet wird. Perfluorierte Tenside, die unter anderem bei der Herstellung von PTFE verwendet werden, und andere perfluorierte Verbindungen verfügen über eine äußerst stabile Kohlenstoff-Fluor-Bindung. Diese Bindung verleiht den Stoffen eine hohe chemische und thermische Beständigkeit, was aber auch dazu führt, dass die Substanzen in der Umwelt persistent sind und kaum abgebaut werden. ⓘ
Siehe auch :Kategorie:Organofluorverbindung ⓘ

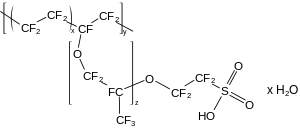
Diskrete Moleküle
Die Substitution von Wasserstoffatomen in einem Alkan durch immer mehr Fluoratome verändert schrittweise mehrere Eigenschaften: Schmelz- und Siedepunkt werden gesenkt, die Dichte steigt, die Löslichkeit in Kohlenwasserstoffen nimmt ab und die Gesamtstabilität nimmt zu. Perfluorkohlenwasserstoffe, bei denen alle Wasserstoffatome ersetzt sind, sind in den meisten organischen Lösungsmitteln unlöslich und reagieren bei Umgebungsbedingungen nur mit Natrium in flüssigem Ammoniak. ⓘ
Der Begriff perfluorierte Verbindung wird für etwas verwendet, das ohne das Vorhandensein einer funktionellen Gruppe, häufig einer Carbonsäure, ein perfluorierter Kohlenstoff wäre. Diese Verbindungen haben viele Eigenschaften mit den Perfluorkohlenwasserstoffen gemeinsam, wie z. B. Stabilität und Hydrophobie, während die funktionelle Gruppe ihre Reaktivität erhöht und es ihnen ermöglicht, an Oberflächen zu haften oder als Tenside zu wirken; insbesondere Fluortenside können die Oberflächenspannung von Wasser stärker senken als ihre Analoga auf Kohlenwasserstoffbasis. Fluortelomere, die einige nicht fluorierte Kohlenstoffatome in der Nähe der funktionellen Gruppe aufweisen, werden ebenfalls als perfluoriert bezeichnet. ⓘ
Polymere
Polymere weisen die gleiche Stabilitätssteigerung auf, die durch die Substitution von Fluor (anstelle von Wasserstoff) in einzelnen Molekülen erreicht wird; auch ihre Schmelzpunkte steigen im Allgemeinen an. Polytetrafluorethylen (PTFE), das einfachste Fluorpolymer und Perfluoranalogon von Polyethylen mit der Struktureinheit -CF
2-, zeigt diese Veränderung erwartungsgemäß, aber sein sehr hoher Schmelzpunkt erschwert die Formgebung. Verschiedene PTFE-Derivate sind weniger temperaturtolerant, aber leichter zu formen: fluoriertes Ethylenpropylen ersetzt einige Fluoratome durch Trifluormethylgruppen, Perfluoralkoxyalkane tun dasselbe mit Trifluormethoxygruppen, und Nafion enthält Perfluorether-Seitenketten, die mit Sulfonsäuregruppen versehen sind. Andere Fluorpolymere behalten einige Wasserstoffatome; Polyvinylidenfluorid hat die Hälfte der Fluoratome von PTFE und Polyvinylfluorid hat ein Viertel, aber beide verhalten sich ähnlich wie perfluorierte Polymere. ⓘ
Fluoride

Fluoride sind die Salze des Fluorwasserstoffs. Sie sind die wichtigsten und verbreitetsten Fluorsalze. In der Natur kommt vor allem das schwerlösliche Calciumfluorid CaF2 in Form des Minerals Fluorit vor. Technisch spielen auch andere Fluoride eine Rolle. Beispiele sind das unter Verwendung erwähnte Uranhexafluorid oder Natriumfluorid, das unter anderem als Holzschutzmittel verwendet wird und vor etwa 100 Jahren als Rattengift und Insektizid vermarktet wurde. ⓘ
Ein in der organischen Chemie häufig verwendetes Fluorid ist das Tetrabutylammoniumfluorid (TBAF). Da TBAF in organischen Lösungsmitteln löslich ist und das Fluoridion nicht durch Kationen beeinflusst wird (sogenanntes „nacktes Fluorid“) wird es als Fluoridquelle in organischen Reaktionen benutzt. Eine weitere wichtige Reaktion des Tetrabutylammoniumfluorids ist die Abspaltung von Silylethern, die als Schutzgruppe für Alkohole verwendet werden. ⓘ
Weitere Fluorverbindungen
Mit den anderen Halogenen bildet Fluor eine Reihe von Interhalogenverbindungen. Ein wichtiges Beispiel hierfür ist Chlortrifluorid, ein giftiges Gas, das vor allem als Fluorierungsmittel eingesetzt wird. ⓘ
Fluor ist elektronegativer als Sauerstoff, weshalb die Verbindungen zwischen Fluor und Sauerstoff nicht wie die anderen Halogen-Sauerstoffverbindungen als Halogenoxide, sondern als Sauerstofffluoride bezeichnet werden. ⓘ
Im Gegensatz zu den schwereren Halogenen existiert nur eine Fluorsauerstoffsäure, die Hypofluorige Säure HOF. Der Grund hierfür liegt darin, dass Fluor keine Drei-Zentren-vier-Elektronen-Bindungen ausbildet. ⓘ
Fluor bildet auch mit den Edelgasen Krypton, Xenon, und Argon einige Verbindungen wie Xenon(II)-fluorid. Kryptondifluorid, die einzige bekannte Kryptonverbindung, ist das stärkste bekannte Oxidationsmittel. Weitere Edelgasverbindungen des Fluor enthalten oft auch noch Atome anderer Elemente, wie beispielsweise das Argonhydrogenfluorid (HArF), die einzige bekannte Argonverbindung. ⓘ
Herstellung
Für Fluoridionen existieren mehrere Nachweise. Bei der sogenannten Kriechprobe wird in einem Reagenzglas aus Glas eine fluoridhaltige Substanz mit konzentrierter Schwefelsäure versetzt. ⓘ
- Fluorid-Ionen reagieren mit Schwefelsäure zu Sulfat-Ionen und Fluorwasserstoff. ⓘ
Es steigen Fluorwasserstoffdämpfe auf, die das Glas anätzen. Gleichzeitig ist die Schwefelsäure aufgrund der Veränderung der Oberfläche nicht mehr in der Lage, das Glas zu benetzen. ⓘ

Eine zweite Nachweismöglichkeit ist die sogenannte Wassertropfenprobe. Dabei wird die fluoridhaltige Substanz mit Kieselsäure und Schwefelsäure zusammengebracht. Es entsteht gasförmiges Siliciumtetrafluorid. Über das Gefäß mit der Probe wird ein Wassertropfen gehalten. Durch Reaktion von Siliciumtetrafluorid mit dem Wasser bildet sich Siliciumdioxid, das als charakteristischer weißer Rand um den Tropfen kristallisiert. ⓘ
- Bildung des Siliciumtetrafluorids. ⓘ
- Reaktion im Wassertropfen ⓘ
Siehe auch: Nachweise für Fluorid ⓘ
In der modernen Analytik, insbesondere für organische Fluorverbindungen spielt die NMR-Spektroskopie eine große Rolle. Fluor besitzt den Vorteil, zu 100 % aus einem Isotop (Reinelement) zu bestehen, das durch NMR-Spektroskopie nachweisbar ist. ⓘ
Elementares Fluor und praktisch alle Fluorverbindungen werden aus Fluorwasserstoff oder seinen wässrigen Lösungen, der Flusssäure, hergestellt. Fluorwasserstoff wird in Brennöfen durch die endotherme Reaktion von Fluorit (CaF2) mit Schwefelsäure hergestellt:
- CaF2 + H2SO4 → 2 HF(g) + CaSO4 ⓘ
Das gasförmige HF kann dann in Wasser absorbiert oder verflüssigt werden. ⓘ
Industrielle Wege zu F2

Mit der Moissan-Methode wird Fluor in industriellen Mengen durch Elektrolyse eines Kaliumfluorid-Fluorwasserstoff-Gemischs hergestellt: Wasserstoff- und Fluoridionen werden an einer Stahlbehälterkathode und einer Kohlenstoffblockanode unter 8-12 Volt reduziert und oxidiert, um Wasserstoff bzw. Fluorgas zu erzeugen. Die Temperaturen sind erhöht, KF-2HF schmilzt bei 70 °C (158 °F) und wird bei 70-130 °C (158-266 °F) elektrolysiert. KF, das für die elektrische Leitfähigkeit sorgt, ist unerlässlich, da reines HF nicht elektrolysiert werden kann, da es praktisch nicht leitfähig ist. Fluor kann in Stahlflaschen gelagert werden, die innen passiviert sind, und zwar bei Temperaturen unter 200 °C (392 °F); ansonsten kann Nickel verwendet werden. Regulierventile und Rohrleitungen werden aus Nickel hergestellt, wobei für letztere möglicherweise Monel verwendet wird. Eine häufige Passivierung sowie der strikte Ausschluss von Wasser und Fetten sind zu beachten. Im Labor können Glasgeräte unter niedrigem Druck und wasserfreien Bedingungen Fluorgas führen; einige Quellen empfehlen stattdessen Nickel-Monel-PTFE-Systeme. ⓘ
Wege im Labor
Bei der Vorbereitung einer Konferenz zum hundertjährigen Jubiläum von Moissans Errungenschaft im Jahr 1986 kam Karl O. Christe zu dem Schluss, dass die chemische Erzeugung von Fluor möglich sein müsste, da einige Metallfluoridanionen keine stabilen neutralen Gegenstücke haben; ihre Ansäuerung könnte stattdessen eine Oxidation auslösen. Er entwickelte eine Methode, mit der Fluor mit hoher Ausbeute und bei Atmosphärendruck erzeugt werden kann:
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑ ⓘ
Christe kommentierte später, dass die Reaktanten "seit mehr als 100 Jahren bekannt waren und sogar Moissan auf dieses Schema hätte kommen können." Noch 2008 wurde in einigen Quellen behauptet, Fluor sei zu reaktiv für eine chemische Isolierung. ⓘ
Industrielle Anwendungen
Der Fluoritabbau, der den größten Teil des weltweiten Fluorbedarfs deckt, erreichte 1989 mit einer Förderung von 5,6 Millionen Tonnen Erz seinen Höhepunkt. Aufgrund von Beschränkungen für Fluorchlorkohlenwasserstoffe sank diese Menge auf 3,6 Millionen Tonnen im Jahr 1994; seitdem steigt die Produktion wieder an. Im Jahr 2003 wurden etwa 4,5 Millionen Tonnen Erz und Einnahmen in Höhe von 550 Millionen US-Dollar erzielt; in späteren Berichten wurde der weltweite Umsatz mit Fluorchemikalien für 2011 auf 15 Milliarden US-Dollar geschätzt und für 2016-18 werden Produktionszahlen von 3,5 bis 5,9 Millionen Tonnen und Einnahmen von mindestens 20 Milliarden US-Dollar prognostiziert. Bei der Schaumflotation wird der abgebaute Flussspat in zwei metallurgische Hauptqualitäten mit gleichem Anteil getrennt: 60-85 % reiner Metspat wird fast ausschließlich in der Eisenverhüttung verwendet, während über 97 % reiner Säurespat hauptsächlich zu dem wichtigen industriellen Zwischenprodukt Fluorwasserstoff verarbeitet wird.
<imagemap>-Fehler: Am Ende von Zeile 6 wurde kein gültiger Link gefunden
Jährlich werden mindestens 17.000 Tonnen Fluor hergestellt. In Form von Uran oder Schwefelhexafluorid kostet es nur 5-8 $ pro Kilogramm, als Element jedoch ein Vielfaches davon, da die Handhabung schwierig ist. Die meisten Prozesse, bei denen freies Fluor in großen Mengen verwendet wird, nutzen die In-situ-Erzeugung unter vertikaler Integration. ⓘ
Die größte Anwendung von Fluorgas, bei der jährlich bis zu 7.000 Tonnen verbraucht werden, ist die Herstellung von UF
6 für den Kernbrennstoffkreislauf. Fluor wird zur Fluorierung von Uran-Tetrafluorid verwendet, das seinerseits aus Urandioxid und Fluorwasserstoffsäure hergestellt wird. Fluor ist monoisotop, so dass alle Massenunterschiede zwischen UF
6-Molekülen sind auf das Vorhandensein von 235
U oder 238
U zurückzuführen, was eine Urananreicherung durch Gasdiffusion oder Gaszentrifuge ermöglicht. Etwa 6.000 Tonnen pro Jahr werden für die Herstellung des inerten Dielektrikums SF
6 für Hochspannungstransformatoren und Leistungsschalter, wodurch die gefährlichen polychlorierten Biphenyle, die bei ölgefüllten Geräten verwendet werden, überflüssig werden. In der Elektronik werden mehrere Fluorverbindungen verwendet: Rhenium und Wolframhexafluorid bei der chemischen Gasphasenabscheidung, Tetrafluormethan beim Plasmaätzen und Stickstofftrifluorid in Reinigungsgeräten. Fluor wird auch in der Synthese von organischen Fluoriden verwendet, aber aufgrund seiner Reaktivität muss es oft zuerst in die sanfteren Stoffe ClF
3, BrF
3 oder IF
5, die zusammen eine kalibrierte Fluorierung ermöglichen. In fluorierten Arzneimitteln wird stattdessen Schwefeltetrafluorid verwendet. ⓘ
Anorganische Fluoride

Wie bei anderen Eisenlegierungen werden jeder Tonne Stahl etwa 3 kg Metspat zugesetzt, dessen Fluoridionen den Schmelzpunkt und die Viskosität des Stahls senken. Neben seiner Rolle als Zusatzstoff in Materialien wie Emaillen und Schweißdrahtbeschichtungen wird der meiste Säurespat mit Schwefelsäure zu Flusssäure umgesetzt, die zum Beizen von Stahl, zum Ätzen von Glas und zum Cracken von Alkanen verwendet wird. Ein Drittel der HF wird für die Synthese von Kryolith und Aluminiumtrifluorid verwendet, beides Flussmittel im Hall-Héroult-Verfahren zur Aluminiumgewinnung, deren Nachschub durch gelegentliche Reaktionen mit den Schmelzapparaten erforderlich ist. Für eine Tonne Aluminium werden etwa 23 kg Flussmittel benötigt. Der zweitgrößte Anteil entfällt auf Fluorsilikate, wobei Natriumfluorsilikat in der Wasserfluoridierung und bei der Behandlung von Wäscheabwässern sowie als Zwischenprodukt bei der Herstellung von Kryolith und Siliziumtetrafluorid verwendet wird. Andere wichtige anorganische Fluoride sind Kobalt-, Nickel- und Ammoniumfluoride. ⓘ
Organische Fluoride
Organofluoride verbrauchen über 20 % des abgebauten Fluorits und über 40 % der Fluorwasserstoffsäure, wobei Kühlgase dominieren und Fluorpolymere ihren Marktanteil erhöhen. Tenside sind eine unbedeutende Anwendung, erzielen aber einen Jahresumsatz von über 1 Milliarde Dollar. Aufgrund der Gefahr direkter Kohlenwasserstoff-Fluor-Reaktionen oberhalb von -150 °C (-240 °F) erfolgt die industrielle Herstellung von Fluorkohlenwasserstoffen indirekt, zumeist durch Halogenaustauschreaktionen wie die Swarts-Fluorierung, bei der Chlorkohlenwasserstoffe unter Verwendung von Katalysatoren durch Fluorwasserstoff ersetzt werden. Bei der elektrochemischen Fluorierung werden Kohlenwasserstoffe einer Elektrolyse in Fluorwasserstoff unterzogen, und beim Fowler-Verfahren werden sie mit festen Fluorträgern wie Kobalttrifluorid behandelt. ⓘ
Kältetreibende Gase
Halogenierte Kältemittel, die in informellen Zusammenhängen als Freone bezeichnet werden, sind durch R-Nummern gekennzeichnet, die den Anteil an Fluor, Chlor, Kohlenstoff und Wasserstoff angeben. Fluorchlorkohlenwasserstoffe (FCKW) wie R-11, R-12 und R-114 dominierten einst die fluororganischen Gase und erreichten ihren Produktionshöhepunkt in den 1980er Jahren. Ihre Produktion, die für Klimaanlagen, Treibstoffe und Lösungsmittel verwendet wurde, lag Anfang der 2000er Jahre, nach einem weit verbreiteten internationalen Verbot, bei weniger als einem Zehntel dieses Spitzenwertes. Als Ersatz wurden teilhalogenierte Fluorchlorkohlenwasserstoffe (HFCKW) und teilhalogenierte Fluorkohlenwasserstoffe (HFKW) entwickelt, bei deren Synthese mehr als 90 % des Fluors in der organischen Industrie verbraucht werden. Zu den wichtigsten HFCKWs gehören R-22, Chlordifluormethan und R-141b. Das wichtigste HFKW ist R-134a, wobei eine neue Art von Molekül, HFO-1234yf, ein Hydrofluorolefin (HFO), aufgrund seines Treibhauspotenzials von weniger als 1 % im Vergleich zu HFC-134a an Bedeutung gewonnen hat. ⓘ
Polymere

In den Jahren 2006 und 2007 wurden etwa 180.000 Tonnen Fluorpolymere hergestellt, die einen Umsatz von über 3,5 Milliarden Dollar pro Jahr generierten. Der Weltmarkt wurde 2011 auf knapp 6 Milliarden Dollar geschätzt und soll bis 2016 um 6,5 % pro Jahr wachsen. Fluorpolymere können nur durch die Polymerisation freier Radikale gebildet werden. ⓘ
Polytetrafluorethylen (PTFE), manchmal auch unter seinem DuPont-Namen Teflon bekannt, macht 60-80 % der weltweiten Fluorpolymerproduktion aus. Die größte Anwendung ist die elektrische Isolierung, da PTFE ein ausgezeichnetes Dielektrikum ist. Es wird auch in der chemischen Industrie verwendet, wo Korrosionsbeständigkeit erforderlich ist, zur Beschichtung von Rohren, Schläuchen und Dichtungen. Eine weitere wichtige Anwendung sind PFTE-beschichtete Glasfasertücher für Stadiondächer. Die wichtigste Verbraucheranwendung ist Antihaft-Kochgeschirr. Aus gerissener PTFE-Folie wird expandiertes PTFE (ePTFE), eine feinporige Membran, die manchmal unter dem Markennamen Gore-Tex bekannt ist und für Regenkleidung, Schutzkleidung und Filter verwendet wird; ePTFE-Fasern können zu Dichtungen und Staubfiltern verarbeitet werden. Andere Fluorpolymere, darunter fluoriertes Ethylenpropylen, ahmen die Eigenschaften von PTFE nach und können es ersetzen; sie sind besser formbar, aber auch teurer und haben eine geringere thermische Stabilität. Folien aus zwei verschiedenen Fluorpolymeren ersetzen Glas in Solarzellen. ⓘ
Die chemisch resistenten (aber teuren) fluorierten Ionomere werden als elektrochemische Zellmembranen verwendet, deren erstes und bekanntestes Beispiel Nafion ist. Es wurde in den 1960er Jahren entwickelt und zunächst als Brennstoffzellenmaterial in Raumfahrzeugen eingesetzt und ersetzte dann die Chloralkalizellen auf Quecksilberbasis. In jüngster Zeit ist die Brennstoffzellenanwendung mit den Bestrebungen, Protonenaustauschmembran-Brennstoffzellen in Kraftfahrzeuge einzubauen, wieder aufgetaucht. Fluorelastomere wie Viton sind vernetzte Fluorpolymermischungen, die hauptsächlich in O-Ringen verwendet werden; Perfluorbutan (C4F10) wird als Feuerlöschmittel eingesetzt. ⓘ
Tenside
Fluortenside sind kleine fluororganische Moleküle, die zum Abweisen von Wasser und Flecken verwendet werden. Obwohl sie teuer sind (vergleichbar mit Pharmazeutika mit 200-2000 $ pro Kilogramm), haben sie bis 2006 einen Jahresumsatz von über 1 Milliarde $ erzielt; allein Scotchgard hat im Jahr 2000 über 300 Millionen $ eingebracht. Fluortenside sind auf dem Gesamtmarkt für Tenside in der Minderheit; der größte Teil davon wird von wesentlich billigeren Produkten auf Kohlenwasserstoffbasis eingenommen. Anwendungen in Farben werden durch die Kosten für die Zusammensetzung belastet; diese Verwendung wurde 2006 auf nur 100 Millionen Dollar geschätzt. ⓘ
Agrarchemikalien
Etwa 30 % der Agrarchemikalien enthalten Fluor, die meisten davon sind Herbizide und Fungizide, einige wenige sind Pflanzenschutzmittel. Die Fluorsubstitution, in der Regel ein einzelnes Atom oder höchstens eine Trifluormethylgruppe, ist eine robuste Modifikation mit Wirkungen, die denen von fluorierten Arzneimitteln entsprechen: verlängerte biologische Verweildauer, Membranüberquerung und Veränderung der molekularen Erkennung. Ein bekanntes Beispiel ist Trifluralin, das in den USA in großem Umfang als Unkrautbekämpfungsmittel eingesetzt wird, aber unter dem Verdacht steht, krebserregend zu sein, und in vielen europäischen Ländern verboten wurde. Natriummonofluoracetat (1080) ist ein Säugetiergift, bei dem zwei Wasserstoffatome der Essigsäure durch Fluor und Natrium ersetzt werden; es stört den Zellstoffwechsel, indem es das Acetat im Zitronensäurezyklus ersetzt. Erstmals im späten 19. Jahrhundert synthetisiert, wurde es Anfang des 20. Jahrhunderts als Insektizid erkannt und später in seiner heutigen Form eingesetzt. Neuseeland, der größte Verbraucher von 1080, verwendet es zum Schutz der Kiwis vor dem invasiven australischen Buschschwanz-Opossum. Europa und die Vereinigten Staaten haben 1080 verboten. ⓘ
Medizinische Anwendungen
Zahnpflege

Bevölkerungsstudien aus der Mitte des 20. Jahrhunderts zeigen, dass topisches Fluorid die Zahnkaries reduziert. Dies wurde zunächst auf die Umwandlung von Hydroxylapatit im Zahnschmelz in das widerstandsfähigere Fluorapatit zurückgeführt, aber Studien an vorfluoridierten Zähnen widerlegten diese Hypothese, und aktuelle Theorien gehen davon aus, dass Fluorid das Wachstum des Zahnschmelzes bei kleiner Karies fördert. Nach Studien an Kindern in Gegenden, in denen Fluorid natürlich im Trinkwasser vorhanden war, wurde in den 1940er Jahren mit der kontrollierten Fluoridierung der öffentlichen Wasserversorgung zur Bekämpfung von Karies begonnen, und heute werden 6 % der Weltbevölkerung, darunter zwei Drittel der Amerikaner, mit Fluorid versorgt. Eine Überprüfung der wissenschaftlichen Literatur in den Jahren 2000 und 2007 brachte die Wasserfluoridierung mit einer deutlichen Verringerung des Kariesbefalls bei Kindern in Verbindung. Trotz dieser Befürwortungen und des Nachweises, dass es außer der meist gutartigen Zahnfluorose keine negativen Auswirkungen gibt, gibt es aus ethischen und sicherheitstechnischen Gründen immer noch Widerstand. Der Nutzen der Fluoridierung hat sich verringert, was möglicherweise auf andere Fluoridquellen zurückzuführen ist, ist aber in einkommensschwachen Gruppen immer noch messbar. Natriummonofluorphosphat und manchmal auch Natrium- oder Zinn(II)-fluorid sind häufig in fluoridhaltigen Zahnpasten enthalten, die erstmals 1955 in den USA eingeführt wurden und heute in den Industrieländern neben fluoridierten Mundspülungen, Gelen, Schäumen und Lacken allgegenwärtig sind. ⓘ
Pharmazeutische Produkte
Zwanzig Prozent der modernen Pharmazeutika enthalten Fluor. Eines davon, der Cholesterinsenker Atorvastatin (Lipitor), erzielte mehr Umsatz als jedes andere Medikament, bis es 2011 generisch wurde. Das verschreibungspflichtige Asthmamittel Seretide, das Mitte der 2000er Jahre zu den zehn umsatzstärksten Medikamenten zählte, enthält zwei Wirkstoffe, von denen einer - Fluticason - fluoriert ist. Viele Medikamente werden fluoriert, um die Inaktivierung zu verzögern und die Einnahmezeit zu verlängern, da die Kohlenstoff-Fluor-Bindung sehr stabil ist. Die Fluorierung erhöht auch die Lipophilie, da die Bindung hydrophober ist als die Kohlenstoff-Wasserstoff-Bindung, was oft zur Durchdringung der Zellmembran und damit zur Bioverfügbarkeit beiträgt. ⓘ
Trizyklika und andere Antidepressiva aus der Zeit vor 1980 hatten aufgrund ihrer nicht-selektiven Interferenz mit anderen Neurotransmittern als dem Serotonin-Target verschiedene Nebenwirkungen; das fluorierte Fluoxetin war selektiv und eines der ersten, die dieses Problem vermieden. Viele der heutigen Antidepressiva werden auf die gleiche Weise behandelt, darunter die selektiven Serotonin-Wiederaufnahmehemmer: Citalopram, sein Isomer Escitalopram sowie Fluvoxamin und Paroxetin. Chinolone sind künstliche Breitbandantibiotika, die häufig fluoriert werden, um ihre Wirkung zu verstärken. Dazu gehören Ciprofloxacin und Levofloxacin. Fluor findet auch in Steroiden Verwendung: Fludrocortison ist ein blutdrucksteigerndes Mineralocorticoid, und Triamcinolon und Dexamethason sind starke Glucocorticoide. Die meisten Inhalationsanästhetika sind stark fluoriert; der Prototyp Halothan ist viel träger und stärker als seine Zeitgenossen. Spätere Verbindungen wie die fluorierten Ether Sevofluran und Desfluran sind besser als Halothan und nahezu unlöslich im Blut, was eine schnellere Aufwachzeit ermöglicht. ⓘ
PET-Untersuchung

F-PET-Scan mit Glukose, die mit radioaktivem Fluor-18 markiert ist. Das normale Gehirn und die Nieren nehmen genug Glukose auf, um abgebildet zu werden. Im Oberbauch wird ein bösartiger Tumor festgestellt. Radioaktives Fluor wird im Urin in der Blase nachgewiesen. ⓘ
Fluor-18 ist häufig in radioaktiven Tracern für die Positronen-Emissions-Tomographie enthalten, da seine Halbwertszeit von fast zwei Stunden lang genug ist, um den Transport von den Produktionsanlagen zu den Bildgebungszentren zu ermöglichen. Der gebräuchlichste Tracer ist die Fluordesoxyglukose, die nach intravenöser Injektion von glukosebedürftigen Geweben wie dem Gehirn und den meisten bösartigen Tumoren aufgenommen wird; anschließend kann die computergestützte Tomographie für eine detaillierte Bildgebung eingesetzt werden. ⓘ
Sauerstoffträger
Flüssige Fluorkohlenwasserstoffe können große Mengen an Sauerstoff oder Kohlendioxid aufnehmen, mehr als Blut, und haben wegen ihrer möglichen Verwendung in künstlichem Blut und in der Flüssigkeitsatmung Aufmerksamkeit erregt. Da sich Fluorkohlenwasserstoffe normalerweise nicht mit Wasser vermischen, müssen sie in Emulsionen (kleine, in Wasser suspendierte Perfluorkohlenstofftröpfchen) gemischt werden, um als Blut verwendet zu werden. Ein solches Produkt, Oxycyte, hat erste klinische Versuche durchlaufen. Diese Substanzen können Ausdauersportlern helfen und sind im Sport verboten; der Beinahe-Tod eines Radfahrers im Jahr 1998 veranlasste eine Untersuchung über ihren Missbrauch. Zu den Anwendungen der Flüssigkeitsbeatmung mit reinem Perfluorkohlenstoff (bei der reine Perfluorkohlenstoff-Flüssigkeit und keine Wasseremulsion verwendet wird) gehören die Unterstützung von Verbrennungsopfern und Frühgeborenen mit unzureichender Lunge. Es wurden sowohl eine teilweise als auch eine vollständige Lungenfüllung in Erwägung gezogen, wobei jedoch nur die erste Variante in nennenswertem Umfang am Menschen getestet wurde. Ein Versuch von Alliance Pharmaceuticals erreichte klinische Studien, wurde aber aufgegeben, da die Ergebnisse nicht besser waren als bei normalen Therapien. ⓘ
Biologische Rolle

Fluor ist für den Menschen und andere Säugetiere nicht essenziell, aber es ist bekannt, dass geringe Mengen zur Stärkung des Zahnschmelzes beitragen (durch die Bildung von Fluorapatit wird der Zahnschmelz widerstandsfähiger gegen Säuren, die bei der bakteriellen Fermentation von Zucker entstehen). Geringe Mengen an Fluor können sich positiv auf die Knochenfestigkeit auswirken, was jedoch noch nicht endgültig nachgewiesen ist. Sowohl die WHO als auch das Institute of Medicine der US-amerikanischen National Academies veröffentlichen eine empfohlene Tagesdosis (RDA) und eine zulässige Höchstmenge für die Aufnahme von Fluor, die je nach Alter und Geschlecht variiert. ⓘ
Natürliche Organofluorine wurden in Mikroorganismen und Pflanzen, aber nicht in Tieren gefunden. Das häufigste ist Fluoracetat, das von mindestens 40 Pflanzen in Afrika, Australien und Brasilien als Abwehrmittel gegen Pflanzenfresser eingesetzt wird. Weitere Beispiele sind endständig fluorierte Fettsäuren, Fluoraceton und 2-Fluorocitrat. Ein Enzym, das Fluor an Kohlenstoff bindet - Adenosylfluorid-Synthase - wurde 2002 in Bakterien entdeckt. ⓘ
Toxizität
Elementares Fluor ist für lebende Organismen hochgiftig. Seine Auswirkungen auf den Menschen beginnen bei Konzentrationen, die unter den 50 ppm von Blausäure liegen, und ähneln denen von Chlor: Erhebliche Reizungen der Augen und des Atmungssystems sowie Leber- und Nierenschäden treten oberhalb von 25 ppm auf, dem unmittelbar lebens- und gesundheitsgefährlichen Wert für Fluor. Augen und Nase werden bei 100 ppm schwer geschädigt, und das Einatmen von 1.000 ppm Fluor führt innerhalb von Minuten zum Tod, im Vergleich zu 270 ppm bei Blausäure. ⓘ
| Gefahren | |
|---|---|
| GHS-Kennzeichnung: | |
Piktogramme
|
   
|
Signalwort
|
Gefahr |
Gefahrenhinweise
|
H270, H314, H330 |
| NFPA 704 (Feuerdiamant) | |
Fluorwasserstoffsäure

Flusssäure ist die schwächste der Halogenwasserstoffsäuren und hat einen pKa-Wert von 3,2 bei 25 °C. Sie ist eine flüchtige Flüssigkeit, da Wasserstoffbrücken vorhanden sind (während die anderen Halogenwasserstoffsäuren gasförmig sind). Sie ist in der Lage, Glas, Beton, Metalle und organische Stoffe anzugreifen. ⓘ
Flusssäure ist ein Kontaktgift mit größeren Gefahren als viele starke Säuren wie Schwefelsäure, obwohl sie schwach ist: Sie bleibt in wässriger Lösung neutral und dringt daher schneller in das Gewebe ein, sei es durch Einatmen, Verschlucken oder über die Haut. Zwischen 1984 und 1994 starben mindestens neun US-Arbeiter bei solchen Unfällen. Es reagiert mit Kalzium und Magnesium im Blut und führt zu Hypokalzämie und möglicherweise zum Tod durch Herzrhythmusstörungen. Die Bildung von unlöslichem Calciumfluorid löst starke Schmerzen aus, und Verbrennungen, die größer als 160 cm2 sind, können eine schwere systemische Toxizität verursachen. ⓘ
Bei 50 %iger HF ist die Exposition möglicherweise erst nach acht Stunden erkennbar, bei niedrigeren Konzentrationen nach 24 Stunden, und eine Verbrennung kann zunächst schmerzlos sein, da Fluorwasserstoff die Nervenfunktion beeinträchtigt. Wenn die Haut mit HF in Berührung gekommen ist, kann der Schaden verringert werden, indem sie 10-15 Minuten lang unter einem Wasserstrahl abgespült wird und kontaminierte Kleidung entfernt wird. Anschließend wird häufig Kalziumglukonat aufgetragen, das Kalziumionen zur Bindung mit dem Fluorid bereitstellt; Hautverätzungen können mit 2,5%igem Kalziumglukonatgel oder speziellen Spüllösungen behandelt werden. Die Absorption von Flusssäure erfordert eine weitere medizinische Behandlung; Kalziumglukonat kann injiziert oder intravenös verabreicht werden. Die Verwendung von Calciumchlorid - einem üblichen Laborreagenz - anstelle von Calciumgluconat ist kontraindiziert und kann zu schweren Komplikationen führen. Eine Exzision oder Amputation der betroffenen Stellen kann erforderlich sein. ⓘ
Fluoridionen
Lösliche Fluoride sind mäßig toxisch: 5-10 g Natriumfluorid bzw. 32-64 mg Fluoridionen pro Kilogramm Körpermasse stellen für Erwachsene eine tödliche Dosis dar. Ein Fünftel der tödlichen Dosis kann gesundheitsschädlich sein, und ein chronischer Überkonsum kann zu Skelettfluorose führen, von der Millionen Menschen in Asien und Afrika betroffen sind. Verschlucktes Fluorid bildet im Magen Fluorwasserstoffsäure, die leicht vom Darm aufgenommen wird, wo sie die Zellmembranen durchdringt, sich mit Kalzium verbindet und verschiedene Enzyme beeinträchtigt, bevor sie mit dem Urin ausgeschieden wird. Die Expositionsgrenzen werden durch Urinuntersuchungen der Fähigkeit des Körpers, Fluoridionen auszuscheiden, bestimmt. ⓘ
In der Vergangenheit wurden die meisten Fälle von Fluoridvergiftungen durch die versehentliche Einnahme von Insektiziden mit anorganischen Fluoriden verursacht. Die meisten aktuellen Anrufe bei Giftnotrufzentralen wegen möglicher Fluoridvergiftungen gehen auf die Einnahme von fluoridhaltiger Zahnpasta zurück. Eine weitere Ursache sind schlecht funktionierende Fluoridierungsanlagen: Bei einem Vorfall in Alaska waren fast 300 Menschen betroffen und eine Person starb. Die Zentren für Krankheitskontrolle und Prävention empfehlen, Kinder unter sechs Jahren beim Zähneputzen zu beaufsichtigen, damit sie keine Zahnpasta verschlucken. Eine regionale Studie untersuchte ein Jahr lang Berichte über Fluoridvergiftungen im Vorschulalter mit insgesamt 87 Fällen, darunter ein Todesfall durch Verschlucken eines Insektizids. Die meisten hatten keine Symptome, aber etwa 30 % hatten Magenschmerzen. Eine größere Studie in den Vereinigten Staaten kam zu ähnlichen Ergebnissen: 80 % der Fälle betrafen Kinder unter sechs Jahren, und es gab nur wenige schwere Fälle. ⓘ
Bedenken hinsichtlich der Umwelt
Atmosphäre

Das 1987 unterzeichnete Montrealer Protokoll legte strenge Vorschriften für Fluorchlorkohlenwasserstoffe (FCKW) und Fluorbromkohlenwasserstoffe aufgrund ihres Ozonschädigungspotenzials (ODP) fest. Die hohe Stabilität, die sie für ihre ursprünglichen Anwendungen auszeichnete, bedeutete auch, dass sie sich erst in größeren Höhen zersetzten, wo die freigesetzten Chlor- und Bromatome die Ozonmoleküle angriffen. Trotz des Verbots und der frühen Hinweise auf seine Wirksamkeit wurde vorausgesagt, dass bis zur vollständigen Erholung mehrere Generationen vergehen würden. Die derzeitigen Ersatzstoffe sind teilhalogenierte Fluorchlorkohlenwasserstoffe (H-FCKW) mit einem Zehntel des Ozonabbaupotenzials von FCKW, die ihrerseits bis 2030-2040 durch teilhalogenierte Fluorkohlenwasserstoffe (HFKW) ohne Chlor und ohne Ozonabbaupotenzial ersetzt werden sollen. Im Jahr 2007 wurde dieser Termin für die Industrieländer auf 2020 vorverlegt; die Umweltschutzbehörde hatte bereits 2003 die Produktion eines HFCKWs verboten und die von zwei anderen gedeckelt. Fluorkohlenwasserstoffgase sind im Allgemeinen Treibhausgase mit einem Treibhauspotenzial (GWP) von etwa 100 bis 10.000; Schwefelhexafluorid hat einen Wert von etwa 20.000. Ein Ausreißer ist HFO-1234yf, ein neuartiges Kältemittel, das als Hydrofluorolefin (HFO) bezeichnet wird und aufgrund seines GWP von weniger als 1 im Vergleich zu 1.430 für das derzeitige Standard-Kältemittel HFC-134a weltweit nachgefragt wird. ⓘ
Biopersistenz

Fluororganische Stoffe weisen aufgrund der Stärke der Kohlenstoff-Fluor-Bindung eine Biopersistenz auf. Perfluoralkylsäuren (PFAA), die aufgrund ihrer sauren funktionellen Gruppen nur schwer wasserlöslich sind, gelten als persistente organische Schadstoffe; Perfluoroctansulfonsäure (PFOS) und Perfluoroctansäure (PFOA) werden am häufigsten untersucht. PFAAs wurden weltweit in Spuren gefunden, von Eisbären bis hin zu Menschen, wobei PFOS und PFOA bekanntermaßen in der Muttermilch und im Blut von Neugeborenen vorkommen. Eine Untersuchung aus dem Jahr 2013 ergab eine leichte Korrelation zwischen den PFAA-Konzentrationen im Grundwasser und im Boden und den menschlichen Aktivitäten; es gab kein eindeutiges Muster, bei dem eine Chemikalie dominierte, und höhere PFOS-Mengen waren mit höheren PFOA-Mengen korreliert. Im Körper binden sich PFAAs an Proteine wie Serumalbumin; sie konzentrieren sich beim Menschen in der Regel in der Leber und im Blut, bevor sie über die Nieren ausgeschieden werden. Die Verweildauer im Körper ist von Tierart zu Tierart sehr unterschiedlich, mit Halbwertszeiten von Tagen bei Nagetieren und Jahren beim Menschen. Hohe Dosen von PFOS und PFOA führen bei neugeborenen Nagetieren zu Krebs und Tod, in Studien am Menschen wurden jedoch keine Auswirkungen bei den derzeitigen Expositionswerten festgestellt. ⓘ
Verwendung
Aufgrund der hohen Reaktivität und des schwierigen Umgangs mit Fluor kann elementares Fluor nur eingeschränkt verwendet werden. Es wird überwiegend zu fluorierten Verbindungen weiterverarbeitet, die auf andere Weise nicht hergestellt werden können. Der größte Teil des produzierten Fluors wird für die Herstellung von Uranhexafluorid benötigt, was infolge seiner Leichtflüchtigkeit die Anreicherung von 235U mit Gaszentrifugen oder durch das Gasdiffusionsverfahren ermöglicht. Dieses Isotop ist für die Kernspaltung wichtig. Ein zweites wichtiges Produkt, das nur mit Hilfe von elementarem Fluor hergestellt werden kann, ist Schwefelhexafluorid. Dieses dient als gasförmiger Isolator beispielsweise in Hochspannungsschaltern und gasisolierten Rohrleitern. ⓘ
Fluor dient zudem zur Oberflächenfluorierung von Kunststoffen. Dies wird unter anderem bei Kraftstofftanks in Automobilen eingesetzt, wobei sich eine fluorierte Barriereschicht ausbildet, die unter anderem eine niedrigere Benzindurchlässigkeit bewirkt. Diese Anwendung der Fluorierung steht in Konkurrenz zur Koextrusionstechnologien und dem Metalltank. Eine zweite Wirkung der Fluorierung ist, dass die Oberflächenenergie vieler Kunststoffe erhöht werden kann. Dies findet vor allem Anwendungen, wo Farben, Lacke oder Klebstoffe auf ansonsten hydrophobe Kunststoffoberflächen (Polyolefine) aufgebracht werden sollen. Die Vorteile der Fluorierung von Kunststoffoberflächen liegen in der Behandelbarkeit von Körpern mit ausgeprägten 3D-Strukturen und Hohlräumen. Zudem lassen sich Kleinteile als Schüttgut behandeln und der Effekt bleibt über eine lange Zeit erhalten. Die Fluorierung wird eingesetzt, wenn weiter verbreitete und kostengünstigere Methoden, wie z. B. die Beflammung, nicht einsetzbar sind. Weiter mögliche Effekte, die durch Fluorierung von Kunststoffoberflächen erreicht werden können, sind: verbesserte Faser-Matrix-Haftung, verringerte Reibung und verbesserte Selektivitäten in der Membrantechnik. ⓘ
Werden Fluor und Graphit zusammen erhitzt, entsteht Graphitfluorid, das als Trockenschmiermittel und Elektrodenmaterial eingesetzt werden kann. ⓘ
Biologische Bedeutung
Fluor selbst kommt wegen seiner starken Reaktivität nicht elementar vor und hat daher keine biologische Bedeutung. Dagegen spielen die Salze des Fluors, Fluoride, eine Rolle, da sie natürlicherseits und durch technische Zugabe („Fluoridierung“) in Nahrungsmitteln und Trinkwasser enthalten sind. ⓘ
Toxikologie
Fluor und viele Fluorverbindungen sind für den Menschen und andere Lebewesen sehr giftig, die letale Dosis (LD50, eine Stunde) liegt bei elementarem Fluor bei 150–185 ppm. Elementares Fluor wirkt auf Lunge, Haut und besonders auf die Augen stark verbrennend und verätzend. Schon bei einem fünfminütigen Kontakt mit 25 ppm Fluor kommt es zu einer erheblichen Reizung der Augen. Gleichzeitig entsteht durch Reaktion mit Wasser (Luftfeuchtigkeit, Hautoberfläche) der ebenfalls giftige Fluorwasserstoff. Eine akute Fluorvergiftung äußert sich je nachdem, über welchen Weg, in welcher Verbindung und Dosis das Fluor in den Körper gelangt ist, mit unterschiedlichen Beschwerden. Eine gastrointestinal entstandene akute Vergiftung mit Fluoriden führt zu Schleimhautverätzungen, Übelkeit, anfänglich schleimigem, später blutigem Erbrechen, unstillbarem Durst, heftigen Leibschmerzen und blutigem Durchfall. Teilweise versterben Betroffene. Bei Aufnahme von Fluorwasserstoff und staubförmigen Fluoriden mit der Atemluft folgen Tränenfluss, Niesen, Husten, Atemnot, Lungenödem bis hin zum Tod unter Krämpfen. Eine über die Haut entstandene Vergiftung mit Fluorwasserstoff (auch in sauren Lösungen von Fluoriden) hat tiefgreifende Nekrosen und schlecht heilende Ulzera zur Folge. ⓘ
Sicherheitshinweise
Auf Grund seiner hohen Reaktivität muss Fluor in speziellen Behältnissen aufbewahrt werden. Die Werkstoffe müssen dabei so beschaffen sein, dass sie durch den Kontakt mit Fluor eine Passivierungsschicht ausbilden und so eine Weiterreaktion verhindern. Beispiele für geeignete Werkstoffe sind Stahl oder die Nickel-Kupfer-Legierung Monel. Nicht geeignet sind beispielsweise Glas, das durch entstandenen Fluorwasserstoff angegriffen wird, oder Aluminium. Brennbare Stoffe wie Fett dürfen ebenfalls nicht in Kontakt mit Fluor kommen, da sie unter heftiger Reaktion verbrennen. ⓘ
Fluor brennt zwar selbst nicht, wirkt aber brandfördernd. Brände bei Anwesenheit von Fluor können nicht mit Löschmitteln gelöscht werden, es muss zunächst der weitere Zutritt von Fluor verhindert werden. ⓘ


















