Zinkoxid

| |
| Bezeichnungen | |
|---|---|
| Andere Namen
Zinkweiß, Galmei, Philosophenwolle, Chinesisches Weiß, Zinkblume
| |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
| EC-Nummer |
|
Gmelin Referenz
|
13738 |
| KEGG | |
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII | |
| UN-Nummer | 3077 |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
ZnO |
| Molekulare Masse | 81,406 g/mol |
| Erscheinungsbild | Weißer Feststoff |
| Geruch | Geruchlos |
| Dichte | 5.606 g/cm3 |
| Schmelzpunkt | 1.974 °C (3.585 °F; 2.247 K) (zersetzt sich) |
| Siedepunkt | 2,360 °C (4,280 °F; 2,630 K) (zersetzt sich) |
Löslichkeit in Wasser
|
0.0004% (17.8°C) |
| Bandlücke | 3,3 eV (direkt) |
Magnetische Suszeptibilität (χ)
|
-27,2-10-6 cm3/mol |
Brechungsindex (nD)
|
n1=2,013, n2=2,029 |
| Struktur | |
Kristallstruktur
|
Wurtzit |
Raumgruppe
|
C6v4-P63mc |
Gitterkonstante
|
a = 3,2495 Å, c = 5,2069 Å
|
Formeleinheiten (Z)
|
2 |
Koordinationsgeometrie
|
Tetraedrisch |
| Thermochemie | |
Wärmekapazität (C)
|
40,3 J-K-1mol-1 |
Std. molare
Entropie (S |
43,7±0,4 J-K-1mol-1 |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-350,5±0,3 kJ mol-1 |
Gibbssche freie Energie (ΔfG˚)
|
-320,5 kJ mol-1 |
| Pharmakologie | |
ATCvet-Code
|
QA07XA91 (WHO) |
| Gefahren | |
| GHS-Kennzeichnung: | |
Piktogramme
|

|
Signalwort
|
Warnhinweis |
Gefahrenhinweise
|
H400, H401 |
Sicherheitshinweise
|
P273, P391, P501 |
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | 1.436 °C (2.617 °F; 1.709 K) |
| Letale Dosis oder Konzentration (LD, LC): | |
LD50 (mittlere Dosis)
|
240 mg/kg (intraperitoneal, Ratte) 7950 mg/kg (Ratte, oral) |
LC50 (mittlere Konzentration)
|
2500 mg/m3 (Maus) |
LCLo (niedrigste veröffentlichte)
|
2500 mg/m3 (Meerschweinchen, 3-4 h) |
| NIOSH (US-Grenzwerte für die Gesundheit): | |
PEL (Zulässig)
|
TWA 5 mg/m3 (Rauch) TWA 15 mg/m3 (Gesamtstaub) TWA 5 mg/m3 (bzw. Staub) |
REL (Empfohlen)
|
Staub: TWA 5 mg/m3 C 15 mg/m3 Rauchgase: TWA 5 mg/m3 ST 10 mg/m3 |
IDLH (Unmittelbare Gefahr)
|
500 mg/m3 |
| Sicherheitsdatenblatt (SDS) | ICSC 0208 |
| Verwandte Verbindungen | |
Andere Anionen
|
Zinksulfid Zinkselenid Zinks tellurid |
Andere Kationen
|
Kadmiumoxid Quecksilber(II)-oxid |
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Zinkoxid ist eine anorganische Verbindung mit der Formel ZnO. Es ist ein weißes Pulver, das in Wasser unlöslich ist. ZnO wird als Zusatzstoff in zahlreichen Materialien und Produkten verwendet, z. B. in Kosmetika, Nahrungsergänzungsmitteln, Gummi, Kunststoffen, Keramik, Glas, Zement, Schmiermitteln, Farben, Salben, Klebstoffen, Dichtungsmitteln, Pigmenten, Lebensmitteln, Batterien, Ferriten, Feuerschutzmitteln und Erste-Hilfe-Bändern. Obwohl es in der Natur als Mineral Zinkit vorkommt, wird das meiste Zinkoxid synthetisch hergestellt. ⓘ
ZnO ist ein Halbleiter mit breiter Bandlücke aus der Gruppe der II-VI-Halbleiter. Die native Dotierung des Halbleiters durch Sauerstoffleerstellen oder Zinkzwischengitter ist n-leitend. Weitere vorteilhafte Eigenschaften sind die gute Transparenz, die hohe Elektronenbeweglichkeit, die große Bandlücke und die starke Lumineszenz bei Raumtemperatur. Diese Eigenschaften machen ZnO wertvoll für eine Vielzahl neuer Anwendungen: transparente Elektroden in Flüssigkristallbildschirmen, energiesparende oder hitzeschützende Fenster und Elektronik in Form von Dünnschichttransistoren und Licht emittierenden Dioden. ⓘ
| Kristallstruktur ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| _ Zn2+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinkoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | ZnO | ||||||||||||||||||
| Kurzbeschreibung |
farblose, hexagonale Kristalle oder weißes, lockeres Pulver | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
D02AB | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 81,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
5,61 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
1975 °C (unter Druck) | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Zinkoxid auch Zinkoxyd (ZnO) ist eine chemische Verbindung aus Zink und Sauerstoff, die einerseits farblose, hexagonale Kristalle bildet oder andererseits, aufgrund der Lichtbrechung bei sehr kleinen Kristallen, als lockeres, weißes Pulver vorliegt. ⓘ
Die traditionelle Bezeichnung Zinkweiß (Chinesischweiß, Ewigweiß, Schneeweiß) stammt von der Verwendung als weißes Farbmittel in Malerfarbe. ⓘ
Medizinische Präparate zur Haut- und Wundbehandlung enthalten oft Zinkoxid wegen dessen antiseptischer Wirkung. Es wird häufig in der Zahnheilkunde (z. B. bei Wurzelkanalbehandlungen) eingesetzt und gilt als Biomaterial. ⓘ
Chemische Eigenschaften
Reines ZnO ist ein weißes Pulver, aber in der Natur kommt es als das seltene Mineral Zinkit vor, das in der Regel Mangan und andere Verunreinigungen enthält, die ihm eine gelbe bis rote Farbe verleihen. ⓘ
Kristallines Zinkoxid ist thermochrom, d. h. es verfärbt sich bei Erwärmung an der Luft von weiß nach gelb und kehrt beim Abkühlen wieder zu weiß zurück. Dieser Farbwechsel wird durch einen geringen Verlust von Sauerstoff an die Umgebung bei hohen Temperaturen verursacht, wobei sich das nicht-stöchiometrische Zn1+xO bildet, wobei bei 800 °C x = 0,00007 ist. ⓘ
Zinkoxid ist ein amphoteres Oxid. Es ist nahezu unlöslich in Wasser, löst sich jedoch in den meisten Säuren, wie z. B. Salzsäure:
- ZnO + 2 HCl → ZnCl2 + H2O
Festes Zinkoxid löst sich auch in Alkalien auf, wobei lösliche Zinkate entstehen:
- ZnO + 2 NaOH + H2O → Na2[Zn(OH)4] ⓘ
ZnO reagiert langsam mit den Fettsäuren in Ölen und bildet die entsprechenden Carboxylate, wie Oleat oder Stearat. In Verbindung mit einer starken wässrigen Lösung von Zinkchlorid bildet ZnO zementartige Produkte, die am besten als Zinkhydroxychloride beschrieben werden. Dieser Zement wurde in der Zahnmedizin verwendet. ⓘ

ZnO bildet auch zementähnliches Material, wenn es mit Phosphorsäure behandelt wird; ähnliche Materialien werden in der Zahnmedizin verwendet. Ein Hauptbestandteil des durch diese Reaktion hergestellten Zinkphosphatzements ist Hopeit, Zn3(PO4)2-4H2O. ⓘ
ZnO zerfällt bei ca. 1975 °C und einem Standardsauerstoffdruck in Zinkdampf und Sauerstoff. Bei einer karbothermischen Reaktion wird das Oxid durch Erhitzen mit Kohlenstoff bei einer viel niedrigeren Temperatur (etwa 950 °C) in Zinkdampf umgewandelt.
- ZnO + C → Zn(Dampf) + CO ⓘ
Zinkoxid ist ein direkter Halbleiter mit einer Bandlücke von 3,2…3,4 eV. Es absorbiert demzufolge UV-Strahlung und ist für sichtbares Licht transparent. Bedingt durch die nichtzentrosymmetrische Elementarzelle ist Zinkoxid piezoelektrisch. ⓘ
Die elektrische Leitfähigkeit von Zinkoxid kann durch Dotierung mit geeigneten Elementen erhöht werden. Häufig wird dazu Aluminium (Aluminiumdotiertes Zinkoxid, AZO) oder Bor benutzt. Andere Elemente für eine N-Dotierung wie Indium oder Gallium werden momentan nicht eingesetzt. P-dotiertes Zinkoxid ist schwieriger herzustellen und ein Bereich der aktuellen Forschung. ⓘ
Wird die Verbindung mit Cobalt(II)-oxid (CoO) erhitzt, so entsteht eine grüne feste Lösung von Cobaltoxid in Zinkoxid (Rinmans Grün). ⓘ
Physikalische Eigenschaften


Struktur
Zinkoxid kristallisiert in zwei Hauptformen, hexagonalem Wurtzit und kubischer Zinkblende. Die Wurtzit-Struktur ist bei Umgebungsbedingungen am stabilsten und daher am weitesten verbreitet. Die Zinkblende-Form kann durch Züchtung von ZnO auf Substraten mit kubischer Gitterstruktur stabilisiert werden. In beiden Fällen sind die Zink- und Oxidzentren tetraedrisch, die charakteristischste Geometrie für Zn(II). ZnO wandelt sich bei relativ hohem Druck (etwa 10 GPa) in das Steinsalzmotiv um. Die vielen bemerkenswerten medizinischen Eigenschaften von ZnO-haltigen Cremes lassen sich durch ihre elastische Weichheit erklären, die für tetraedrisch koordinierte binäre Verbindungen nahe dem Übergang zu oktaedrischen Strukturen charakteristisch ist. ⓘ
Hexagonale und Zinkblende-Polymorphe weisen keine Inversionssymmetrie auf (die Spiegelung eines Kristalls relativ zu einem bestimmten Punkt verwandelt ihn nicht in sich selbst). Diese und andere Gittersymmetrieeigenschaften führen zur Piezoelektrizität von hexagonalem und Zinkblende-ZnO und zur Pyroelektrizität von hexagonalem ZnO. ⓘ
Die hexagonale Struktur hat die Punktgruppe 6 mm (Hermann-Mauguin-Notation) oder C6v (Schoenflies-Notation), und die Raumgruppe ist P63mc oder C6v4. Die Gitterkonstanten sind a = 3,25 Å und c = 5,2 Å; ihr Verhältnis c/a ~ 1,60 liegt nahe am Idealwert für hexagonale Zellen c/a = 1,633. Wie in den meisten Materialien der Gruppe II-VI ist die Bindung in ZnO weitgehend ionisch (Zn2+O2-) mit den entsprechenden Radien von 0,074 nm für Zn2+ und 0,140 nm für O2-. Diese Eigenschaft erklärt die bevorzugte Bildung der Wurtzit- statt der Zinkblende-Struktur sowie die starke Piezoelektrizität von ZnO. Aufgrund der polaren Zn-O-Bindungen sind die Zink- und Sauerstoff-Ebenen elektrisch geladen. Um die elektrische Neutralität aufrechtzuerhalten, werden diese Ebenen in den meisten verwandten Materialien auf atomarer Ebene rekonstruiert, nicht jedoch in ZnO - seine Oberflächen sind atomar flach, stabil und weisen keine Rekonstruktion auf. Studien mit wurtzoiden Strukturen erklärten jedoch den Ursprung der Oberflächenebenheit und das Fehlen der Rekonstruktion auf ZnO-Wurtzit-Oberflächen zusätzlich zum Ursprung der Ladungen auf den ZnO-Ebenen. ⓘ
Mechanische Eigenschaften
ZnO ist ein relativ weiches Material mit einer ungefähren Härte von 4,5 auf der Mohs-Skala. Seine Elastizitätskonstanten sind kleiner als die von relevanten III-V-Halbleitern wie GaN. Die hohe Wärmekapazität und Wärmeleitfähigkeit, die geringe Wärmeausdehnung und die hohe Schmelztemperatur von ZnO sind für Keramiken von Vorteil. Das optische E2-Phonon in ZnO weist eine ungewöhnlich lange Lebensdauer von 133 ps bei 10 K auf. ⓘ
Unter den tetraedrisch gebundenen Halbleitern hat ZnO den höchsten piezoelektrischen Tensor oder zumindest einen, der mit dem von GaN und AlN vergleichbar ist. Diese Eigenschaft macht es zu einem technologisch wichtigen Material für viele piezoelektrische Anwendungen, die eine große elektromechanische Kopplung erfordern. Daher ist ZnO in Form von Dünnschichten eines der am meisten untersuchten Resonatormaterialien für akustische Dünnschicht-Resonatoren. ⓘ
Elektrische und optische Eigenschaften
ZnO hat eine relativ große direkte Bandlücke von ~3,3 eV bei Raumtemperatur. Zu den Vorteilen einer großen Bandlücke gehören höhere Durchbruchsspannungen, die Fähigkeit, großen elektrischen Feldern standzuhalten, geringeres elektronisches Rauschen sowie Betrieb bei hohen Temperaturen und hoher Leistung. Die Bandlücke von ZnO kann durch Legierung mit Magnesiumoxid oder Cadmiumoxid auf ~3-4 eV eingestellt werden. ⓘ
Das meiste ZnO hat n-Typ-Charakter, auch wenn es nicht absichtlich dotiert ist. Die Nichtstöchiometrie ist in der Regel der Grund für den n-Typ-Charakter, aber das Thema bleibt umstritten. Auf der Grundlage theoretischer Berechnungen wurde eine alternative Erklärung vorgeschlagen, wonach unbeabsichtigte substitutionelle Wasserstoffverunreinigungen dafür verantwortlich sind. Eine kontrollierbare n-Typ-Dotierung lässt sich leicht erreichen, indem man Zn durch Elemente der Gruppe III wie Al, Ga oder In oder Sauerstoff durch Elemente der Gruppe VII wie Chlor oder Jod ersetzt. ⓘ
Eine zuverlässige p-Typ-Dotierung von ZnO ist nach wie vor schwierig. Dieses Problem ist auf die geringe Löslichkeit von p-Dotierstoffen und deren Kompensation durch reichlich n-Verunreinigungen zurückzuführen. Dieses Problem wird auch bei GaN und ZnSe beobachtet. Die Messung des p-Typs in "intrinsisch" n-Typ-Materialien wird durch die Inhomogenität der Proben erschwert. ⓘ
Die derzeitigen Beschränkungen der p-Dotierung begrenzen elektronische und optoelektronische Anwendungen von ZnO, die in der Regel Übergänge zwischen n- und p-Material erfordern. Zu den bekannten p-Dotierstoffen gehören die Gruppe-I-Elemente Li, Na, K, die Gruppe-V-Elemente N, P und As sowie Kupfer und Silber. Viele von ihnen bilden jedoch tiefe Akzeptoren und erzeugen bei Raumtemperatur keine nennenswerte p-Typ-Leitung. ⓘ
Die Elektronenbeweglichkeit von ZnO schwankt stark mit der Temperatur und hat ein Maximum von ~2000 cm2/(V-s) bei 80 K. Daten über die Lochbeweglichkeit sind rar und liegen im Bereich von 5-30 cm2/(V-s). ⓘ
ZnO-Scheiben, die als Varistor wirken, sind das aktive Material in den meisten Überspannungsableitern. ⓘ
Zinkoxid ist bekannt für seine stark nichtlinearen optischen Eigenschaften, insbesondere in der Masse. Die Nichtlinearität von ZnO-Nanopartikeln kann je nach ihrer Größe fein abgestimmt werden. ⓘ
Herstellung
Für die industrielle Nutzung wird ZnO in einer Größenordnung von 105 Tonnen pro Jahr in drei Hauptverfahren hergestellt: ⓘ
Indirektes Verfahren
Beim indirekten oder französischen Verfahren wird metallisches Zink in einem Graphittiegel geschmolzen und bei Temperaturen über 907 °C (in der Regel um 1000 °C) verdampft. Der Zinkdampf reagiert mit dem Luftsauerstoff zu ZnO, wobei seine Temperatur sinkt und es hell leuchtet. Die Zinkoxidpartikel werden in einen Kühlkanal befördert und in einem Sackhaus aufgefangen. Diese indirekte Methode wurde 1844 von LeClaire (Frankreich) populär gemacht und ist daher allgemein als das französische Verfahren bekannt. Das Produkt besteht normalerweise aus agglomerierten Zinkoxidpartikeln mit einer durchschnittlichen Größe von 0,1 bis einigen Mikrometern. Gemessen am Gewicht wird der größte Teil des weltweit hergestellten Zinkoxids nach dem französischen Verfahren hergestellt. ⓘ
Direktes Verfahren
Das direkte oder amerikanische Verfahren geht von verschiedenen verunreinigten Zinkverbindungen aus, z. B. von Zinkerzen oder Hüttennebenprodukten. Die Zinkvorprodukte werden durch Erhitzen mit einer Kohlenstoffquelle wie Anthrazit reduziert (karbothermische Reduktion), um Zinkdampf zu erzeugen, der dann wie beim indirekten Verfahren oxidiert wird. Aufgrund der geringeren Reinheit des Ausgangsmaterials ist das Endprodukt beim direkten Verfahren auch von geringerer Qualität als beim indirekten Verfahren. ⓘ
Nasschemisches Verfahren
Ein kleiner Teil der industriellen Produktion erfolgt in nasschemischen Verfahren, die mit wässrigen Lösungen von Zinksalzen beginnen, aus denen Zinkcarbonat oder Zinkhydroxid ausgefällt wird. Der feste Niederschlag wird dann bei Temperaturen um 800 °C kalziniert. ⓘ
Synthese im Labor

Es gibt zahlreiche spezialisierte Verfahren zur Herstellung von ZnO für wissenschaftliche Studien und Nischenanwendungen. Diese Methoden lassen sich nach der resultierenden ZnO-Form (Masse, Dünnschicht, Nanodraht), der Temperatur ("niedrig", d. h. nahe der Raumtemperatur oder "hoch", d. h. T ~ 1000 °C), der Art des Verfahrens (Aufdampfen oder Wachstum aus Lösung) und anderen Parametern klassifizieren. ⓘ
Große Einkristalle (viele Kubikzentimeter) können durch Gastransport (Abscheidung aus der Gasphase), hydrothermale Synthese oder Schmelzwachstum gezüchtet werden. Aufgrund des hohen Dampfdrucks von ZnO ist die Züchtung aus der Schmelze jedoch problematisch. Das Wachstum durch Gastransport ist schwer zu kontrollieren, so dass die hydrothermale Methode zu bevorzugen ist. Dünne Schichten können durch chemische Gasphasenabscheidung, metallorganische Gasphasenepitaxie, Elektroabscheidung, gepulste Laserabscheidung, Sputtern, Sol-Gel-Synthese, Atomlagenabscheidung, Sprühpyrolyse usw. hergestellt werden. ⓘ
Gewöhnliches weißes pulverförmiges Zinkoxid kann im Labor durch Elektrolyse einer Natriumbicarbonatlösung mit einer Zinkanode hergestellt werden. Dabei entstehen Zinkhydroxid und Wasserstoffgas. Das Zinkhydroxid zersetzt sich beim Erhitzen zu Zinkoxid:
- Zn + 2 H2O → Zn(OH)2 + H2 ⓘ
- Zn(OH)2 → ZnO + H2O ⓘ
ZnO-Nanostrukturen
ZnO-Nanostrukturen können in einer Vielzahl von Morphologien synthetisiert werden, darunter Nanodrähte, Nanostäbchen, Tetrapoden, Nanoblüten, Nanopartikel usw. Nanostrukturen lassen sich mit den meisten der oben genannten Techniken unter bestimmten Bedingungen herstellen, aber auch mit der Dampf-Flüssig-Fest-Methode. Die Synthese erfolgt in der Regel bei Temperaturen von etwa 90 °C in einer äquimolaren wässrigen Lösung von Zinknitrat und Hexamin, wobei letzteres das basische Milieu bildet. Bestimmte Zusätze, wie Polyethylenglykol oder Polyethylenimin, können das Seitenverhältnis der ZnO-Nanodrähte verbessern. Die Dotierung der ZnO-Nanodrähte wurde durch Zugabe anderer Metallnitrate zur Wachstumslösung erreicht. Die Morphologie der resultierenden Nanostrukturen kann durch Änderung der Parameter für die Zusammensetzung des Vorläufers (z. B. Zinkkonzentration und pH-Wert) oder für die thermische Behandlung (z. B. Temperatur und Heizrate) eingestellt werden. ⓘ
Ausgerichtete ZnO-Nanodrähte auf vorimprägnierten Silizium-, Glas- und Galliumnitrid-Substraten wurden mit wässrigen Zinksalzen wie Zinknitrat und Zinkacetat in basischer Umgebung gezüchtet. Die Vorimpfung von Substraten mit ZnO schafft die Voraussetzungen für eine homogene Keimbildung von ZnO-Kristallen während der Synthese. Zu den gängigen Pre-Seeding-Methoden gehören die thermische Zersetzung von Zinkacetatkristalliten vor Ort, das Aufbringen von ZnO-Nanopartikeln durch Schleudern und die Anwendung von Methoden der physikalischen Gasphasenabscheidung zur Abscheidung dünner ZnO-Schichten. Das Pre-Seeding kann in Verbindung mit Top-Down-Methoden wie der Elektronenstrahllithografie und der Nanosphärenlithografie durchgeführt werden, um vor dem Wachstum Keimbildungsstellen zu markieren. Ausgerichtete ZnO-Nanodrähte können in Farbstoffsolarzellen und Feldemissionsgeräten verwendet werden. ⓘ
Geschichte
Zinkverbindungen wurden wahrscheinlich schon von den frühen Menschen in verarbeiteter und unverarbeiteter Form als Farbe oder medizinische Salbe verwendet, aber ihre Zusammensetzung ist ungewiss. Die Verwendung von Pushpanjan, wahrscheinlich Zinkoxid, als Salbe für Augen und offene Wunden wird in dem indischen medizinischen Text Charaka Samhita erwähnt, der vermutlich auf 500 v. Chr. oder früher datiert wird. Zinkoxidsalbe wird auch von dem griechischen Arzt Dioskurides (1. Jahrhundert n. Chr.) erwähnt. Galen schlug die Behandlung von Krebsgeschwüren mit Zinkoxid vor, ebenso wie Avicenna in seinem Kanon der Medizin. Es wird als Inhaltsstoff in Produkten wie Babypuder und Cremes gegen Windelausschlag, Galmei-Creme, Shampoos gegen Schuppen und antiseptischen Salben verwendet. ⓘ
Die Römer stellten bereits 200 v. Chr. beträchtliche Mengen an Messing (eine Legierung aus Zink und Kupfer) durch ein Zementierungsverfahren her, bei dem Kupfer mit Zinkoxid reagiert wurde. Es wird angenommen, dass das Zinkoxid durch Erhitzen von Zinkerz in einem Schachtofen hergestellt wurde. Dabei wurde metallisches Zink in Form von Dämpfen freigesetzt, die aus dem Schornstein aufstiegen und als Oxid kondensierten. Dieser Prozess wurde von Dioskurides im 1. Jahrhundert nach Christus beschrieben. Zinkoxid wurde auch in den Zinkminen von Zawar in Indien gefunden, die aus der zweiten Hälfte des ersten Jahrtausends vor Christus stammen. ⓘ
Vom 12. bis zum 16. Jahrhundert wurden Zink und Zinkoxid in Indien erkannt und in einer primitiven Form des Direktsyntheseverfahrens hergestellt. Im 17. Jahrhundert verlagerte sich die Zinkherstellung von Indien nach China. Jahrhundert nach China. 1743 wurde die erste europäische Zinkhütte in Bristol, Vereinigtes Königreich, errichtet. Um 1782 schlug Louis-Bernard Guyton de Morveau vor, Bleiweiß durch Zinkoxid zu ersetzen. ⓘ
Die Hauptverwendung von Zinkoxid (Zinkweiß) war die Verwendung in Farben und als Zusatz zu Salben. Zinkweiß wurde 1834 als Pigment in Ölgemälden akzeptiert, mischte sich aber nicht gut mit Öl. Dieses Problem wurde durch die Optimierung der Synthese von ZnO gelöst. Im Jahr 1845 stellte LeClaire in Paris die Ölfarbe in großem Maßstab her, und um 1850 wurde Zinkweiß in ganz Europa produziert. Der Erfolg der Zinkweißfarbe beruhte auf ihren Vorteilen gegenüber dem traditionellen Bleiweiß: Zinkweiß ist im Wesentlichen beständig im Sonnenlicht, wird durch schwefelhaltige Luft nicht geschwärzt, ist ungiftig und wirtschaftlicher. Da Zinkweiß so "sauber" ist, eignet es sich gut für die Herstellung von Tönungen mit anderen Farben, aber es bildet einen ziemlich spröden Trockenfilm, wenn es nicht mit anderen Farben gemischt wird. In den späten 1890er und frühen 1900er Jahren verwendeten beispielsweise einige Künstler Zinkweiß als Grundierung für ihre Ölgemälde. All diese Gemälde bekamen im Laufe der Jahre Risse. ⓘ
In jüngerer Zeit wurde Zinkoxid vor allem in der Gummiindustrie verwendet, um Korrosion zu verhindern. In den 1970er Jahren war die zweitwichtigste Anwendung von ZnO das Fotokopieren. Hochwertiges ZnO, das nach dem "französischen Verfahren" hergestellt wurde, diente als Füllstoff für Fotokopierpapier. Diese Anwendung wurde bald durch Titan verdrängt. ⓘ
Anwendungen
Es gibt zahlreiche Anwendungen für Zinkoxidpulver, von denen die wichtigsten im Folgenden zusammengefasst werden. Bei den meisten Anwendungen wird die Reaktivität des Oxids als Vorstufe zu anderen Zinkverbindungen genutzt. Für materialwissenschaftliche Anwendungen hat Zinkoxid einen hohen Brechungsindex, eine hohe Wärmeleitfähigkeit, bindende, antibakterielle und UV-schützende Eigenschaften. Daher wird es Materialien und Produkten wie Kunststoffen, Keramik, Glas, Zement, Gummi, Schmiermitteln, Farben, Salben, Klebstoffen, Dichtungsmitteln, Betonherstellung, Pigmenten, Lebensmitteln, Batterien, Ferriten, Feuerschutzmitteln usw. zugesetzt. ⓘ
Herstellung von Kautschuk
Zwischen 50 und 60 % des ZnO werden in der Gummiindustrie verwendet. Zinkoxid wird zusammen mit Stearinsäure bei der Vulkanisierung von Gummi verwendet. ZnO-Zusatzstoffe schützen Gummi auch vor Pilzen (siehe medizinische Anwendungen) und UV-Licht. ⓘ
Keramische Industrie
In der keramischen Industrie wird eine erhebliche Menge an Zinkoxid verbraucht, insbesondere in keramischen Glasuren und Frittenzusammensetzungen. Die relativ hohe Wärmekapazität, die Wärmeleitfähigkeit und die hohe Temperaturstabilität von ZnO in Verbindung mit einem vergleichsweise niedrigen Ausdehnungskoeffizienten sind wünschenswerte Eigenschaften bei der Herstellung von Keramiken. ZnO beeinflusst den Schmelzpunkt und die optischen Eigenschaften von Glasuren, Emaillen und keramischen Formulierungen. Zinkoxid als sekundäres Flussmittel mit niedrigem Ausdehnungskoeffizienten verbessert die Elastizität von Glasuren, indem es die Veränderung der Viskosität in Abhängigkeit von der Temperatur verringert, und trägt dazu bei, Rissbildung und Zitterbildung zu verhindern. Durch den Ersatz von BaO und PbO durch ZnO wird die Wärmekapazität verringert und die Wärmeleitfähigkeit erhöht. Zink in geringen Mengen verbessert die Entwicklung glänzender und brillanter Oberflächen. In mäßigen bis hohen Mengen führt es jedoch zu matten und kristallinen Oberflächen. In Bezug auf die Farbe hat Zink einen komplizierten Einfluss. ⓘ
Medizin
Zinkoxid in einer Mischung mit etwa 0,5 % Eisen(III)-oxid (Fe2O3) wird als Galmei bezeichnet und in Galmei-Lotion verwendet. Zwei Mineralien, Zinkit und Hemimorphit, wurden historisch als Galmei bezeichnet. In Verbindung mit Eugenol, einem Liganden, entsteht Zinkoxid-Eugenol, das in der Zahnmedizin als Restaurations- und Prothetikmittel verwendet wird. ⓘ
In Anlehnung an die grundlegenden Eigenschaften von ZnO haben feine Partikel des Oxids desodorierende und antibakterielle Eigenschaften und werden daher Materialien wie Baumwollgewebe, Gummi, Mundpflegeprodukten und Lebensmittelverpackungen zugesetzt. Die verstärkte antibakterielle Wirkung feiner Partikel im Vergleich zum Bulkmaterial ist nicht nur bei ZnO zu beobachten, sondern auch bei anderen Materialien, wie z. B. Silber. Diese Eigenschaft ist auf die größere Oberfläche der feinen Partikel zurückzuführen. ⓘ
Zinkoxid wird in Mundspülungen und Zahnpasten als antibakterielles Mittel eingesetzt, das die Bildung von Plaque und Zahnstein verhindern und Mundgeruch durch die Reduzierung flüchtiger Gase und flüchtiger Schwefelverbindungen (VSC) im Mund bekämpfen soll. Neben Zinkoxid oder Zinksalzen enthalten diese Produkte häufig auch andere Wirkstoffe wie Cetylpyridiniumchlorid, Xylitol, Hinokitiol, ätherische Öle und Pflanzenextrakte. ⓘ
Zinkoxid wird häufig zur Behandlung einer Reihe von Hautkrankheiten eingesetzt, darunter atopische Dermatitis, Kontaktdermatitis, Juckreiz aufgrund von Ekzemen, Windelausschlag und Akne. Zinkoxid wird auch häufig in Sonnenschutzmitteln verwendet. ⓘ
Es wird in Produkten wie Babypuder und Barrierecremes zur Behandlung von Windelausschlag, Galmei-Creme, Anti-Schuppen-Shampoos und antiseptischen Salben verwendet. Es ist auch Bestandteil von Tape (Zinkoxid-Tape" genannt), das von Sportlern als Verband verwendet wird, um Weichteilschäden beim Training zu verhindern. ⓘ
Zinkoxid kann in Salben, Cremes und Lotionen zum Schutz vor Sonnenbrand und anderen durch ultraviolettes Licht verursachten Hautschäden verwendet werden (siehe Sonnenschutzmittel). Es ist der UVA- und UVB-Absorber mit dem breitesten Spektrum, der von der US-amerikanischen Food and Drug Administration (FDA) als Sonnenschutzmittel zugelassen ist, und ist vollständig photostabil. Als Bestandteil von Sonnenschutzmitteln blockiert Zinkoxid sowohl UVA- (320-400 nm) als auch UVB-Strahlen (280-320 nm) des ultravioletten Lichts. Zinkoxid und das andere am häufigsten verwendete physikalische Sonnenschutzmittel, Titandioxid, gelten als nicht reizend, nicht allergen und nicht komedogen. Zink aus Zinkoxid wird jedoch leicht von der Haut aufgenommen. ⓘ
Viele Sonnenschutzmittel verwenden Nanopartikel aus Zinkoxid (zusammen mit Nanopartikeln aus Titandioxid), weil diese kleinen Partikel das Licht nicht streuen und daher nicht weiß erscheinen. Die Nanopartikel werden nicht so stark von der Haut aufgenommen wie Zinkoxidpartikel normaler Größe und gelangen nur in die äußerste Schicht der Haut, nicht aber in den Körper. ⓘ
Zinkoxid-Nanopartikel können die antibakterielle Wirkung von Ciprofloxacin verstärken. Es hat sich gezeigt, dass Nano-ZnO mit einer durchschnittlichen Größe zwischen 20 nm und 45 nm die antibakterielle Aktivität von Ciprofloxacin gegen Staphylococcus aureus und Escherichia coli in vitro verstärken kann. Die verstärkende Wirkung dieses Nanomaterials ist bei allen Teststämmen konzentrationsabhängig. Diese Wirkung kann auf zwei Gründe zurückzuführen sein. Erstens können Zinkoxid-Nanopartikel mit dem NorA-Protein interferieren, das für die Übertragung von Resistenzen in Bakterien entwickelt wurde und eine Pumpaktivität besitzt, die den Efflux von hydrophilen Fluorchinolonen aus einer Zelle vermittelt. Zweitens können Zinkoxid-Nanopartikel mit dem Omf-Protein interferieren, das für die Permeation von Chinolon-Antibiotika in die Zelle verantwortlich ist. ⓘ
Als Bestandteil pharmazeutischer Zinksalben bzw. -pasten (z. B. Penaten-Creme), Sonnenschutzmitteln und Zinkleimverbänden führt Zinkoxid zu einer Austrocknung der Hautoberfläche. Dies nutzt man zum Beispiel bei Intertrigo, Windeldermatitis und anderen nässenden Wunden. ⓘ
Bei Fußpilz und anderen Dermatomykosen unterstützt Zinkoxid die Heilung. Zinkoxid wirkt antibakteriell und adstringierend. ⓘ
Seit 1888 wird Zinkoxid auch in Deodorants verwendet, da es leicht antibakteriell wirkt. ⓘ
Zigarettenfilter
Zinkoxid ist ein Bestandteil von Zigarettenfiltern. Ein Filter, der aus mit Zinkoxid und Eisenoxid imprägnierter Holzkohle besteht, entfernt erhebliche Mengen an Blausäure (HCN) und Schwefelwasserstoff (H2S) aus dem Tabakrauch, ohne dessen Geschmack zu beeinträchtigen. ⓘ
Lebensmittelzusatzstoff
Zinkoxid wird vielen Lebensmitteln, einschließlich Frühstückscerealien, als Quelle für Zink, einen notwendigen Nährstoff, zugesetzt. (Zinksulfat wird ebenfalls für den gleichen Zweck verwendet.) Einige vorverpackte Lebensmittel enthalten auch Spuren von ZnO, selbst wenn es nicht als Nährstoff vorgesehen ist. ⓘ
Während der chilenischen Schweinefleischkrise 2008 wurde Zinkoxid mit einer Dioxinkontamination von Schweinefleischexporten in Verbindung gebracht. Es wurde festgestellt, dass die Verunreinigung auf mit Dioxin kontaminiertes Zinkoxid zurückzuführen war, das in Schweinefutter verwendet wurde. ⓘ
Farbstoff
Zinkoxid (Zinkweiß) wird als Pigment in Farben verwendet und ist undurchsichtiger als Lithopon, aber weniger undurchsichtig als Titandioxid. Es wird auch in Beschichtungen für Papier verwendet. Chinesisches Weiß ist eine spezielle Qualität von Zinkweiß, die in Künstlerpigmenten verwendet wird. Die Verwendung von Zinkweiß als Pigment in der Ölmalerei begann in der Mitte des 18. Jahrhunderts. Es hat das giftige Bleiweiß teilweise ersetzt und wurde von Malern wie Böcklin, Van Gogh, Manet, Munch und anderen verwendet. Es ist auch ein Hauptbestandteil von Mineral-Make-up (CI 77947). ⓘ
UV-Absorber
Mikronisiertes und nanoskaliges Zinkoxid und Titandioxid bieten einen starken Schutz gegen UVA- und UVB-Ultraviolettstrahlung und werden in Sonnenmilch, aber auch in UV-blockierenden Sonnenbrillen für den Einsatz im Weltraum und zum Schutz beim Schweißen verwendet, wie Wissenschaftler des Jet Propulsion Laboratory (JPL) herausgefunden haben. ⓘ
Anstriche
Farben, die Zinkoxidpulver enthalten, werden seit langem als Korrosionsschutzbeschichtungen für Metalle verwendet. Sie sind besonders wirksam für verzinktes Eisen. Eisen ist schwer zu schützen, da seine Reaktivität mit organischen Beschichtungen zu Sprödigkeit und mangelnder Haftung führt. Zinkoxidfarben behalten ihre Flexibilität und Haftung auf solchen Oberflächen über viele Jahre hinweg. ⓘ
Mit Aluminium, Gallium oder Indium hoch n-dotiertes ZnO ist transparent und leitfähig (Transparenz ~90%, niedrigster spezifischer Widerstand ~10-4 Ω-cm). ZnO:Al-Beschichtungen werden für energiesparende oder wärmeschützende Fenster verwendet. Die Beschichtung lässt den sichtbaren Teil des Spektrums durch, reflektiert aber die Infrarotstrahlung (IR) entweder in den Raum zurück (Energiesparen) oder lässt die IR-Strahlung nicht in den Raum (Wärmeschutz), je nachdem, welche Seite des Fensters die Beschichtung aufweist. ⓘ
Kunststoffe, wie z. B. Polyethylennaphthalat (PEN), können durch das Aufbringen einer Zinkoxidbeschichtung geschützt werden. Die Beschichtung verringert die Diffusion von Sauerstoff mit PEN. Zinkoxidschichten können auch auf Polycarbonat in Außenanwendungen verwendet werden. Die Beschichtung schützt Polycarbonat vor Sonneneinstrahlung und verringert die Oxidationsrate und das Vergilben durch Licht. ⓘ
Korrosionsschutz in Kernreaktoren
An 64Zn (dem Zinkisotop mit der Atommasse 64) abgereichertes Zinkoxid wird zum Korrosionsschutz in Druckwasserreaktoren eingesetzt. Die Abreicherung ist notwendig, weil 64Zn unter der Bestrahlung durch die Reaktorneutronen in radioaktives 65Zn umgewandelt wird. ⓘ
Methan-Reformierung
Zinkoxid (ZnO) wird als Vorbehandlungsstufe zur Entfernung von Schwefelwasserstoff (H2S) aus Erdgas nach der Hydrierung von Schwefelverbindungen vor einem Methanreformer verwendet, die den Katalysator vergiften können. Bei Temperaturen zwischen etwa 230-430 °C (446-806 °F) wird H2S durch die folgende Reaktion in Wasser umgewandelt:
- H2S + ZnO → H2O + ZnS ⓘ
Das Zinksulfid (ZnS) wird durch frisches Zinkoxid ersetzt, wenn das Zinkoxid verbraucht ist. ⓘ
Mögliche Anwendungen
Elektronik
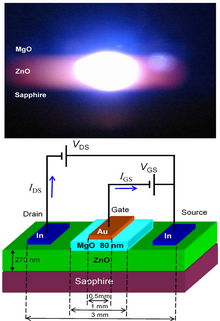

ZnO hat eine breite direkte Bandlücke (3,37 eV oder 375 nm bei Raumtemperatur). Daher sind seine häufigsten potenziellen Anwendungen in Laserdioden und Leuchtdioden (LEDs). Außerdem wurde über ultraschnelle Nichtlinearitäten und photoleitende Funktionen von ZnO berichtet. Einige optoelektronische Anwendungen von ZnO überschneiden sich mit denen von GaN, das eine ähnliche Bandlücke hat (~3,4 eV bei Raumtemperatur). Im Vergleich zu GaN hat ZnO eine größere Exzitonenbindungsenergie (~60 meV, das 2,4-fache der thermischen Energie bei Raumtemperatur), was zu einer hellen Emission von ZnO bei Raumtemperatur führt. ZnO kann mit GaN für LED-Anwendungen kombiniert werden. So sorgen beispielsweise eine transparente leitende Oxidschicht und ZnO-Nanostrukturen für eine bessere Lichtauskopplung. Weitere Eigenschaften von ZnO, die für elektronische Anwendungen vorteilhaft sind, sind seine Stabilität gegenüber energiereicher Strahlung und seine Möglichkeit, durch nasschemisches Ätzen strukturiert zu werden. Die Strahlungsbeständigkeit macht ZnO zu einem geeigneten Kandidaten für Weltraumanwendungen. ZnO ist der vielversprechendste Kandidat auf dem Gebiet der Zufallslaser zur Herstellung einer elektronisch gepumpten UV-Laserquelle. ⓘ
Die spitzen Spitzen der ZnO-Nanostäbchen führen zu einer starken Verstärkung eines elektrischen Feldes. Daher können sie als Feldemitter verwendet werden. ⓘ
Aluminiumdotierte ZnO-Schichten werden als transparente Elektroden verwendet. Die Komponenten Zn und Al sind viel billiger und weniger giftig als das allgemein verwendete Indium-Zinn-Oxid (ITO). Eine Anwendung, die inzwischen kommerziell verfügbar ist, ist die Verwendung von ZnO als Frontkontakt für Solarzellen oder Flüssigkristallanzeigen. ⓘ
Transparente Dünnschichttransistoren (TTFT) können mit ZnO hergestellt werden. Als Feldeffekttransistoren benötigen sie sogar keinen p-n-Übergang, wodurch das Problem der p-Typ-Dotierung von ZnO vermieden wird. Einige der Feldeffekttransistoren verwenden sogar ZnO-Nanostäbchen als leitende Kanäle. ⓘ
Zinkoxid-Nanostäbchen-Sensor
Zinkoxid-Nanostäbchen-Sensoren sind Geräte, die Änderungen des elektrischen Stroms, der durch Zinkoxid-Nanodrähte fließt, aufgrund der Adsorption von Gasmolekülen erkennen. Die Selektivität für Wasserstoffgas wurde durch das Aufsprühen von Palladiumclustern auf die Nanostäbchenoberfläche erreicht. Der Zusatz von Palladium scheint die katalytische Dissoziation von Wasserstoffmolekülen in atomaren Wasserstoff zu bewirken, wodurch die Empfindlichkeit des Sensors erhöht wird. Der Sensor erkennt Wasserstoffkonzentrationen von bis zu 10 Teilen pro Million bei Raumtemperatur, während er auf Sauerstoff nicht anspricht. ZnO wurden als Immobilisierungsschichten in Immunsensoren verwendet, die die Verteilung von Antikörpern über den gesamten Bereich ermöglichen, der von dem an die Mikroelektroden angelegten elektrischen Messfeld erfasst wird. ⓘ
Spintronik
ZnO wurde auch für spintronische Anwendungen in Betracht gezogen: Wenn ZnO mit 1-10 % magnetischen Ionen (Mn, Fe, Co, V usw.) dotiert ist, könnte es sogar bei Raumtemperatur ferromagnetisch werden. Ein solcher Ferromagnetismus bei Raumtemperatur wurde in ZnO:Mn beobachtet, aber es ist noch nicht klar, ob er von der Matrix selbst oder von sekundären Oxidphasen herrührt. ⓘ
Piezoelektrizität
Die Piezoelektrizität in mit ZnO beschichteten Textilfasern hat gezeigt, dass sie in der Lage sind, "selbstversorgte Nanosysteme" mit alltäglicher mechanischer Belastung durch Wind oder Körperbewegungen herzustellen. ⓘ
Im Jahr 2008 berichtete das Center for Nanostructure Characterization am Georgia Institute of Technology über die Herstellung eines stromerzeugenden Geräts (ein so genannter flexibler Ladungspumpengenerator), der durch Dehnung und Freigabe von Zinkoxid-Nanodrähten Wechselstrom liefert. Dieser Mini-Generator erzeugt eine oszillierende Spannung von bis zu 45 Millivolt und wandelt fast sieben Prozent der zugeführten mechanischen Energie in Strom um. Die Forscher verwendeten Drähte mit einer Länge von 0,2 bis 0,3 mm und einem Durchmesser von drei bis fünf Mikrometern, aber das Gerät könnte auch auf eine kleinere Größe verkleinert werden. ⓘ

In Form einer Dünnschicht wurde ZnO in miniaturisierten Hochfrequenz-Dünnschichtresonatoren, Sensoren und Filtern nachgewiesen. ⓘ
Li-Ionen-Batterie und Superkondensatoren
ZnO ist ein vielversprechendes Anodenmaterial für Lithium-Ionen-Batterien, da es billig, biokompatibel und umweltfreundlich ist. ZnO hat eine höhere theoretische Kapazität (978 mAh g-1) als viele andere Übergangsmetalloxide wie CoO (715 mAh g-1), NiO (718 mAh g-1) und CuO (674 mAh g-1). ZnO wird auch als Elektrode in Superkondensatoren verwendet. ⓘ
Sicherheit
Als Lebensmittelzusatzstoff steht Zinkoxid auf der Liste der allgemein als sicher anerkannten Substanzen (GRAS) der amerikanischen FDA. ⓘ
Zinkoxid selbst ist ungiftig; gefährlich ist jedoch das Einatmen von Zinkoxiddämpfen, wie sie beim Schmelzen und Oxidieren von Zink oder Zinklegierungen bei hohen Temperaturen entstehen. Dieses Problem tritt beim Schmelzen von messinghaltigen Legierungen auf, da der Schmelzpunkt von Messing in der Nähe des Siedepunkts von Zink liegt. Die Exposition gegenüber Zinkoxid in der Luft, die auch beim Schweißen von verzinktem Stahl auftritt, kann zu einer Krankheit namens Metalldampffieber führen. Aus diesem Grund wird verzinkter Stahl in der Regel nicht geschweißt, oder das Zink wird vorher entfernt. ⓘ
Forscher, die sich mit der Sicherheit von Zinkoxid in Sonnenschutzmitteln befassten, stellten fest, dass Zinkoxid als solches zwar ein sicherer UV-Absorber ist, in Sonnenschutzmitteln, die andere UV-Absorber enthalten, jedoch zu einem Photoabbau von UV-Absorbern mit kleinen Molekülen führt, die in Versuchen mit embryonalen Zebrabärblingen ein höheres Maß an Toxizität aufweisen. ⓘ
Fotografie
Einseitig mit Zinkoxid beschichtetes Papier fand früher (bis um 1970) beim direkten Verfahren der Elektrofotografie (elektrostatisches Kopierverfahren) Verwendung. ⓘ
Das sogenannte ZINK-Papier der („Zero-Ink“) Zink-Drucktechnik enthält hingegen kein Zink. ⓘ
Zitierte Quellen
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92. Aufl.). CRC Press. ISBN . 978-1439855119. ⓘ
Rezensionen
- Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, et al. (2005). "Eine umfassende Übersicht über ZnO-Materialien und -Geräte". Journal of Applied Physics. 98 (4): 041301-041301-103. Bibcode:2005JAP....98d1301O. doi:10.1063/1.1992666.
- Bakin A, Waag A (29. März 2011). "ZnO Epitaxial Growth". In Bhattacharya P, Fornari R, Kamimura H (eds.). Comprehensive Semiconductor Science and Technology 6 Volume Encyclopaedia. Elsevier. ISBN 978-0-444-53143-8.
- Baruah S, Dutta J (Februar 2009). "Hydrothermales Wachstum von ZnO-Nanostrukturen". Wissenschaft und Technologie fortgeschrittener Materialien. 10 (1): 013001. Bibcode:2009STAdM..10a3001B. doi:10.1088/1468-6996/10/1/013001. PMC 5109597. PMID 27877250.
- Janisch R (2005). "Übergangsmetall-dotiertes TiO 2 und ZnO - aktueller Stand des Feldes". Journal of Physics: Condensed Matter. 17 (27): R657-R689. Bibcode:2005JPCM...17R.657J. doi:10.1088/0953-8984/17/27/R01.
- Heo YW (2004). "Wachstum von ZnO-Nanodrähten und Bauelemente". Materialwissenschaft und -technik: R: Reports. 47 (1-2): 1–47. doi:10.1016/j.mser.2004.09.001.
- Klingshirn C (2007). "ZnO: From basics towards applications". Physica Status Solidi B. 244 (9): 3027-3073. Bibcode:2007PSSBR.244.3027K. doi:10.1002/pssb.200743072.
- Klingshirn C (April 2007). "ZnO: Material, Physik und Anwendungen". ChemPhysChem. 8 (6): 782–803. doi:10.1002/cphc.200700002. ID 17429819.
- Lu JG, Chang P, Fan Z (2006). "Quasi-eindimensionale Metalloxidmaterialien - Synthese, Eigenschaften und Anwendungen". Materialwissenschaft und -technik: R: Reports. 52 (1-3): 49-91. CiteSeerX 10.1.1.125.7559. doi:10.1016/j.mser.2006.04.002.
- Xu S, Wang ZL (2011). "One-dimensional ZnO nanostructures: Solution growth and functional properties". Nano Research. 4 (11): 1013-1098. CiteSeerX 10.1.1.654.3359. doi:10.1007/s12274-011-0160-7. S2CID 137014543.
- Xu S, Wang ZL (2011). "Oxide nanowire arrays for light-emitting diodes and piezoelectric energy harvesters". Pure and Applied Chemistry. 83 (12): 2171–2198. doi:10.1351/PAC-CON-11-08-17. S2CID 18770461. ⓘ
Vorkommen
Natürliche Vorkommen von Zinkoxid sind in Form des Minerals Zinkit (Rotzinkerz) zu finden. ⓘ
Gewinnung und Darstellung
Je nach Herstellungsverfahren gewinnt man Zinkweiß oder Zinkoxid. Zinkweiß wird nach dem sogenannten französischen Verfahren aus Zinkdampf und Luftsauerstoff hergestellt. ⓘ
Zinkoxid dagegen gewinnt man entweder aus der Durchführung der Herstellung nach dem sogenannten amerikanischen Verfahren aus Zinkerzen oder -Schrott durch Röstung, durch Reduktion mit Kohle und direkte anschließende Reoxidation oder nasschemisch durch Fällung als Hydroxid oder Carbonat aus Zinksalzlösungen und anschließende Calcination. ⓘ
Zinkoxid entsteht durch die Verbrennung von Zink. Dabei kann sich das Oxid in feinfilziger, wollartiger Form (Lana philosophica) bilden. ⓘ
- Zink verbrennt bei Anwesenheit von Sauerstoff zu Zinkoxid. ⓘ
Es kann aber auch durch Glühen (Pyrolyse) von Zinkhydroxid, Zinkcarbonat oder Zinknitrat gewonnen werden:
- Aus Zinkcarbonat entstehen beim Glühen Zinkoxid und Kohlenstoffdioxid. ⓘ
Beim Rösten von Zinksulfid entsteht ebenfalls Zinkoxid:
Je nach Anwendungsbereich kann durch Variieren der Reaktionsbedingungen Zinkoxid in unterschiedlichen Qualitäten hergestellt werden. Industriell produzierte Zinkoxidpigmente sind häufig bleihaltig und somit zusätzlich mit dem Gefahrensymbol Xn (gesundheitsschädlich) zu kennzeichnen. ⓘ
Dünne Schichten von Zinkoxid stellt man durch physikalische Abscheideverfahren (PVD) wie Sputtern und chemische Gasphasenabscheidung (CVD) her. CVD ermöglicht die Entstehung rauer Oberflächen, die sich dadurch auszeichnen, einfallendes Licht zu streuen und z. B. Solarzellen einen höheren Wirkungsgrad zu verleihen. ⓘ
Produktion
Die weltweite Produktion von Zinkoxid wird auf 1,5 Mio. t geschätzt. In Europa werden 240.000 t pro Jahr verbraucht. ⓘ
Verwendung
Halbleiter
Zinkoxid findet Verwendung als Deckschicht bei der Herstellung blauer Leuchtdioden (LED), von Flüssigkristallanzeigen (LCD), Varistoren (VDR) und Dünnschicht-Solarzellen. Hierzu wird es meist mit Aluminium dotiert ZnO:Al, (ZOA =Zinkoxid-Aluminium). Die Dotierung erhöht die Leitfähigkeit um mehrere Größenordnungen. ⓘ
Nano-Whisker aus Zinkoxid zeigen Photoleitung im Ultraviolettbereich. ⓘ
Zinkoxid-Keramik wird üblicherweise zur Herstellung von Metalloxid-Varistoren verwendet. Es zeigt hier aufgrund von halbleitenden Effekten an den Korngrenzen einen stark nichtlinear von der angelegten Spannung abhängigen Widerstand und dient als Überspannungsschutz. ⓘ
Wärmeleitpaste
Zinkoxidpulver ist ein gängiger Zusatz von Wärmeleitpasten und erhöht erheblich deren Wirksamkeit. ⓘ
Weitere Anwendungen
Als Zusatz bei der Vulkanisation von Kautschuk findet Zinkoxid Verwendung. ⓘ
Zinkoxid kommt als Leuchtstoff in Leuchtstofflampen zum Einsatz. Selbstaktiviertes Zinkoxid (ZnO:Zn) findet als Kathodolumineszenz-Leuchtstoff im Magischen Auge Verwendung; es zeigt blaugrüne Lumineszenz. ⓘ
Abgereichertes Zinkoxid (DZO) wird dem Kühlwasser von Kernreaktoren (Siedewasserreaktoren) beigegeben, um das Korrosionsverhalten der mit dem Kühlwasser in Berührung kommenden Komponenten zu verbessern. ⓘ
Zinkoxid-Nanopartikel können als UV-Absorber in Lebensmittelverpackungen dienen. ⓘ
Forscher des Schweizer Paul-Scherrer-Instituts versuchen, die Sonnenkraft in chemische Energie umzusetzen. Sie fokussieren dazu Sonnenstrahlen auf einen Schmelztiegel. Das Licht trifft bei über 1200 °C auf Zinkoxid, das daraufhin verdampft und zu metallischem Zink umgewandelt wird, wenn dafür gesorgt wird, dass das entstehende Zink nicht sofort wieder oxidiert. Da dieses gelagert und transportiert werden kann, lässt sich so die Energie der Sonne speichern und später z. B. in Zink-Luft-Batterien direkt als elektrische Energie oder zur Produktion von Wasserstoff nutzen. Das ist vereinfacht dargestellt, denn aus den Zink-Luft-Batterien wird das entladene Zn-ZnO zusammen mit Kaliumhydroxid entnommen. ⓘ
Sicherheitshinweise
Zinkoxidrauch oder -aerosole können die Schleimhäute reizen. ⓘ
Das Einatmen von Zinkoxid kann zu Metalldampffieber führen. Insbesondere beim Arbeiten mit Zinkschmelzen oder Erhitzen (z. B. Schweißen) von zinkhaltigen Materialien kann sich Zinkdampf bilden, der sich sofort in Zinkoxidrauch umwandelt. Es ist daher auf gute Lüftung und Atemschutz zu achten. ⓘ
Risikobewertung
Zinkoxid wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Zinkoxid waren die Besorgnisse bezüglich Verbraucherverwendung, Umweltexposition, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung läuft seit 2017 und wird von Deutschland durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert. ⓘ





