Vanadium
 | ||||||||||||||||||||||||||||
| Vanadium | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aussprache | /vəˈneɪdiəm/ (və-NAY-dee-əm) | |||||||||||||||||||||||||||
| Erscheinungsbild | blau-silbergraues Metall | |||||||||||||||||||||||||||
| Standard-Atomgewicht Ar°(V) |
| |||||||||||||||||||||||||||
| Vanadium im Periodensystem | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Ordnungszahl (Z) | 23 | |||||||||||||||||||||||||||
| Gruppe | Gruppe 5 | |||||||||||||||||||||||||||
| Periode | Periode 4 | |||||||||||||||||||||||||||
| Block | d-Block | |||||||||||||||||||||||||||
| Elektronen-Konfiguration | [[[Argon|Ar]]] 3d3 4s2 | |||||||||||||||||||||||||||
| Elektronen pro Schale | 2, 8, 11, 2 | |||||||||||||||||||||||||||
| Physikalische Eigenschaften | ||||||||||||||||||||||||||||
| Phase bei STP | fest | |||||||||||||||||||||||||||
| Schmelzpunkt | 2183 K (1910 °C, 3470 °F) | |||||||||||||||||||||||||||
| Siedepunkt | 3680 K (3407 °C, 6165 °F) | |||||||||||||||||||||||||||
| Dichte (nahe r.t.) | 6,11 g/cm3 | |||||||||||||||||||||||||||
| in flüssigem Zustand (bei mittlerem Druck) | 5,5 g/cm3 | |||||||||||||||||||||||||||
| Schmelzwärme | 21,5 kJ/mol | |||||||||||||||||||||||||||
| Verdampfungswärme | 444 kJ/mol | |||||||||||||||||||||||||||
| Molare Wärmekapazität | 24,89 J/(mol-K) | |||||||||||||||||||||||||||
Verdampfungsdruck
| ||||||||||||||||||||||||||||
| Atomare Eigenschaften | ||||||||||||||||||||||||||||
| Oxidationsstufen | -3, -1, 0, +1, +2, +3, +4, +5 (ein amphoteres Oxid) | |||||||||||||||||||||||||||
| Elektronegativität | Pauling-Skala: 1.63 | |||||||||||||||||||||||||||
| Ionisierungsenergien |
| |||||||||||||||||||||||||||
| Atomradius | empirisch: 134 pm | |||||||||||||||||||||||||||
| Kovalenter Radius | 153±8 pm | |||||||||||||||||||||||||||
| Spektrallinien von Vanadium | ||||||||||||||||||||||||||||
| Andere Eigenschaften | ||||||||||||||||||||||||||||
| Natürliches Vorkommen | primordial | |||||||||||||||||||||||||||
| Kristallstruktur | kubisch-raumzentriert (bcc) | |||||||||||||||||||||||||||
| Schallgeschwindigkeit dünner Stab | 4560 m/s (bei 20 °C) | |||||||||||||||||||||||||||
| Thermische Ausdehnung | 8,4 µm/(m⋅K) (bei 25 °C) | |||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 30,7 W/(m⋅K) | |||||||||||||||||||||||||||
| Elektrischer Widerstand | 197 nΩ⋅m (bei 20 °C) | |||||||||||||||||||||||||||
| Magnetische Ordnung | paramagnetisch | |||||||||||||||||||||||||||
| Molare magnetische Suszeptibilität | +255,0×10-6 cm3/mol (298 K) | |||||||||||||||||||||||||||
| Elastizitätsmodul | 128 GPa | |||||||||||||||||||||||||||
| Schermodul | 47 GPa | |||||||||||||||||||||||||||
| Elastizitätsmodul | 160 GPa | |||||||||||||||||||||||||||
| Poissonzahl | 0.37 | |||||||||||||||||||||||||||
| Mohs-Härte | 6.7 | |||||||||||||||||||||||||||
| Vickers-Härte | 628-640 MPa | |||||||||||||||||||||||||||
| Brinell-Härte | 600-742 MPa | |||||||||||||||||||||||||||
| CAS-Nummer | 7440-62-2 | |||||||||||||||||||||||||||
| Geschichte | ||||||||||||||||||||||||||||
| Entdeckung | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||
| Erste Isolierung | Henry Enfield Roscoe (1867) | |||||||||||||||||||||||||||
| Benannt nach | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||
| Hauptisotope von Vanadium | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Vanadium ist ein chemisches Element mit dem Symbol V und der Ordnungszahl 23. Es ist ein hartes, silbrig-graues, verformbares Übergangsmetall. Das elementare Metall kommt in der Natur nur selten vor, aber wenn es künstlich isoliert wird, stabilisiert die Bildung einer Oxidschicht (Passivierung) das freie Metall in gewisser Weise gegen weitere Oxidation. ⓘ
Der spanische Wissenschaftler Andrés Manuel del Río entdeckte Vanadiumverbindungen im Jahr 1801 in Mexiko, als er ein neues bleihaltiges Mineral analysierte, das er "Braunblei" nannte. Obwohl er zunächst annahm, dass die Eigenschaften des Minerals auf das Vorhandensein eines neuen Elements zurückzuführen seien, wurde er später von dem französischen Chemiker Hippolyte Victor Collet-Descotils fälschlicherweise davon überzeugt, dass es sich bei dem Element lediglich um Chrom handelte. 1830 stellte Nils Gabriel Sefström Chloride des Vanadiums her, womit er das Vorhandensein eines neuen Elements nachwies, und benannte es nach der skandinavischen Göttin der Schönheit und Fruchtbarkeit, Vanadís (Freyja), Vanadium". Der Name beruhte auf der breiten Palette von Farben, die in Vanadiumverbindungen vorkommen. Del Rios Bleimineral wurde schließlich aufgrund seines Vanadiumgehalts Vanadinit genannt. Im Jahr 1867 gewann Henry Enfield Roscoe das reine Element. ⓘ
Vanadium kommt in der Natur in etwa 65 Mineralien und in Lagerstätten fossiler Brennstoffe vor. In China und Russland wird es aus Stahlhüttenschlacke gewonnen. In anderen Ländern wird es entweder direkt aus Magnetit, Rauchgas von Schweröl oder als Nebenprodukt des Uranbergbaus gewonnen. Es wird hauptsächlich zur Herstellung von Spezialstahllegierungen wie Schnellarbeitsstählen und einigen Aluminiumlegierungen verwendet. Die wichtigste industrielle Vanadiumverbindung, Vanadiumpentoxid, wird als Katalysator für die Herstellung von Schwefelsäure verwendet. Die Vanadium-Redox-Batterie zur Energiespeicherung könnte in Zukunft eine wichtige Anwendung sein. ⓘ
In einigen Organismen werden große Mengen von Vanadiumionen gefunden, möglicherweise als Gift. Das Oxid und einige andere Salze des Vanadiums haben eine mäßige Toxizität. Vor allem im Meer wird Vanadium von einigen Lebewesen als aktives Zentrum von Enzymen verwendet, z. B. von der Vanadium-Bromoperoxidase einiger Meeresalgen. ⓘ
Vanadium, veraltet auch Vanadin, ist ein chemisches Element mit dem Symbol V und der Ordnungszahl 23. Es ist ein stahlgraues, bläulich schimmerndes, in reinem Zustand sehr weiches Übergangsmetall. Im Periodensystem bildet das Metall zusammen mit den schwereren Niob, Tantal und Dubnium die 5. IUPAC-Gruppe oder Vanadiumgruppe. Der Großteil des Vanadiums wird als sogenanntes Ferrovanadium in der Stahlherstellung eingesetzt. Der Zusatz von Vanadium in Chrom-Vanadium-Stählen führt zu einer Erhöhung der Zähigkeit und damit zu einer erhöhten Widerstandsfähigkeit des Stahls. ⓘ
Das Element besitzt verschiedene biologische Bedeutungen und ist für viele Lebewesen essentiell. So spielt es eine Rolle bei der Steuerung von Enzymen der Phosphorylierung und wird von Bakterien zur Stickstofffixierung genutzt. Andererseits steht es oder seine Verbindungen in Verdacht, als mutagenes Klastogen Chromosomenaberrationen hervorzurufen und somit als Gift und Karzinogen zu wirken. ⓘ
Die bekannteste Verbindung des Vanadiums ist Vanadium(V)-oxid, das als Katalysator für die Produktion von Schwefelsäure eingesetzt wird. ⓘ
Geschichte
Vanadium wurde im Jahr 1801 von dem spanischen Mineralogen Andrés Manuel del Río entdeckt. Del Río extrahierte das Element aus einer Probe des mexikanischen "Braunbleierzes", das später Vanadinit genannt wurde. Er stellte fest, dass seine Salze eine große Vielfalt an Farben aufweisen, und nannte das Element daraufhin Panchromium (griechisch παγχρώμιο "alle Farben"). Später benannte Del Río das Element in Erythronium (griechisch: ερυθρός "rot") um, weil die meisten Salze beim Erhitzen rot wurden. Im Jahr 1805 erklärte der französische Chemiker Hippolyte Victor Collet-Descotils, unterstützt von del Ríos Freund Baron Alexander von Humboldt, fälschlicherweise, dass del Ríos neues Element eine unreine Chromprobe sei. Del Río akzeptierte die Aussage von Collet-Descotils und zog seine Behauptung zurück. ⓘ
1831 entdeckte der schwedische Chemiker Nils Gabriel Sefström das Element in einem neuen Oxid wieder, das er bei der Arbeit mit Eisenerzen fand. Später im selben Jahr bestätigte Friedrich Wöhler del Ríos frühere Arbeit. Sefström wählte einen Namen, der mit V begann, das bis dahin noch keinem Element zugeordnet worden war. Er nannte das Element Vanadium nach dem altnordischen Vanadís (ein anderer Name für die nordische Vanir-Göttin Freyja, zu deren Attributen Schönheit und Fruchtbarkeit gehören), wegen der vielen farbigen chemischen Verbindungen, die es hervorbringt. Im Jahr 1831 schlug der Geologe George William Featherstonhaugh vor, Vanadium nach del Río in "Rionium" umzubenennen, doch dieser Vorschlag wurde nicht aufgegriffen. ⓘ

Die Isolierung von Vanadiummetall war schwierig. Im Jahr 1831 berichtete Berzelius über die Herstellung des Metalls, doch Henry Enfield Roscoe zeigte, dass Berzelius das Nitrid, Vanadiumnitrid (VN), hergestellt hatte. Roscoe stellte das Metall schließlich 1867 durch Reduktion von Vanadium(II)-chlorid, VCl2, mit Wasserstoff her. Im Jahr 1927 wurde reines Vanadium durch Reduktion von Vanadiumpentoxid mit Calcium hergestellt. ⓘ
Die erste großtechnische Verwendung von Vanadium war das Fahrgestell aus einer Stahllegierung des Ford Model T, das von französischen Rennwagen inspiriert wurde. Vanadiumstahl ermöglichte eine Gewichtsreduzierung bei gleichzeitiger Erhöhung der Zugfestigkeit (ca. 1905). Im ersten Jahrzehnt des 20. Jahrhunderts wurde der größte Teil des Vanadiumerzes von der American Vanadium Company in den Minas Ragra in Peru abgebaut. Später stieg die Nachfrage nach Uran, was zu einem verstärkten Abbau der Erze dieses Metalls führte. Ein wichtiges Uranerz war Carnotit, das auch Vanadium enthält. So wurde Vanadium als Nebenprodukt der Uranproduktion verfügbar. Schließlich begann der Uranbergbau einen großen Teil der Nachfrage nach Vanadium zu decken. ⓘ
1911 entdeckte der deutsche Chemiker Martin Henze Vanadium in den Hämovanadin-Proteinen, die in den Blutzellen (oder Coelomzellen) der Ascidiacea (Seescheiden) vorkommen. ⓘ
Vanadium wurde erstmals 1903 verwendet, als in England der erste vanadiumhaltige Stahl produziert wurde. Die stärkere Verwendung des Elements in der Stahlindustrie begann ab 1905, als Henry Ford Vanadiumstähle für den Bau von Automobilen einsetzte. ⓘ
Vorkommen


Vanadium ist auf der Erde ein häufiges Element, sein Anteil an der kontinentalen Erdkruste beträgt etwa 120 ppm. Eine ähnliche Elementhäufigkeit besitzen Zirconium, Chlor und Chrom. Das Element kommt überwiegend gebunden in verschiedenen Mineralen vor. Trotz der Häufigkeit des Vanadiums sind Lagerstätten mit hohen Konzentrationen des Elements selten, viele Vanadiumminerale kommen nicht häufig vor. Im Vergleich zur Erdkruste ist der Gehalt im Meerwasser deutlich geringer, er liegt bei etwa 1,3 μg/l. ⓘ
Zu den wichtigsten Vanadiummineralen zählen vor allem Vanadate wie Vanadinit [Pb5(VO4)3Cl], Descloizit Pb(Zn,Cu) [OH|VO4] und Carnotit [K2(UO2)2(VO4)2·3H2O], sowie das Vanadiumsulfid Patrónit VS4. Der größte Teil des Vanadiums findet sich in Spuren in anderen Mineralen, vor allem Eisenerzen wie Magnetit. Der Vanadiumgehalt von Titan-Magnetit-Erzen beträgt meist zwischen 0,3 und 0,8 %, kann aber in manchen südafrikanischen Erzen bis zu 1,7 % erreichen. ⓘ
Tiere und Pflanzen enthalten Vanadium, so enthält der Mensch etwa 0,3 mg/kg. Dieses befindet sich zumeist in Zellkernen oder Mitochondrien. Einige Lebewesen, vor allem einige Seescheidenarten und der Fliegenpilz, sind in der Lage, Vanadium anzureichern. In Seescheiden ist der Vanadiumgehalt bis zu 107-mal so groß wie im umgebenden Meerwasser. Auf Grund des Vanadiumgehaltes von Lebewesen sind auch Kohle und Erdöl, die aus diesen entstehen, vanadiumhaltig. Der Gehalt beträgt bis zu 0,1 %. Besonders hohe Vanadiumgehalte findet man in Erdöl aus Venezuela und Kanada. ⓘ
Im Jahr 2015 wurden insgesamt 79.400 Tonnen Vanadiumerz gefördert (gerechnet als Vanadiummetall). Die wichtigsten Förderländer sind Südafrika, China und Russland. Bei bekannten Reserven von insgesamt 15 Millionen Tonnen (Stand 2015) ist ein Lieferengpass bei Vanadium auf absehbare Zeit nicht zu erwarten. ⓘ
→ :Kategorie:Vanadiummineral ⓘ
Universum
Die kosmische Häufigkeit von Vanadium im Universum beträgt 0,0001 %, womit das Element fast so häufig vorkommt wie Kupfer oder Zink. Vanadium wird spektroskopisch im Licht der Sonne und manchmal auch im Licht anderer Sterne nachgewiesen. ⓘ
Wasser
Das Vanadyl-Ion ist im Meerwasser reichlich vorhanden und hat eine durchschnittliche Konzentration von 30 nM (1,5 mg/m3). Auch einige Mineralwasserquellen enthalten das Ion in hohen Konzentrationen. So enthalten Quellen in der Nähe des Mount Fuji bis zu 54 μg pro Liter. ⓘ
Vanadium als Mineral
Seit 2012 ist Vanadium von der International Mineralogical Association (IMA) als Mineral anerkannt. Es konnte erstmals durch Mikhail Ostrooumov als Resublimationsprodukt in Hochtemperatur-Fumarolen des mexikanischen Vulkans Colima entdeckt werden. Als Begleitminerale traten das ebenfalls erstmals dort entdeckte Kalium-Vanadium-Sulfid Colimait (K3VS4) und das Vanadiumoxid Shcherbinait (V5+2O5) auf. ⓘ
Die Publikation der Erstbeschreibung erfolgte durch Ostrooumov und Yuri Taran 2015 zunächst in der Macla. Revista de la Sociedad Española de Mineralogía und 2016 im Mineralogical Magazine. ⓘ
Neben seiner Typlokalität am Vulkan Colima konnte Vanadium gediegen bisher nur noch an einer nicht näher benannten Hibonit-Fundstätte in der argentinischen Sierra de los Comechingones entdeckt werden. Ein weiterer Fund im Vanadiumerz-Tagebau Rhovan bei Rustenburg in der südafrikanischen Provinz Nordwest wurde bisher nicht bestätigt. ⓘ
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Vanadium unter der System-Nr. 1.AF.05 (Elemente – Metalle und intermetallische Verbindungen – Eisen-Chrom-Familie – Eisengruppe) eingeordnet. ⓘ
Gewinnung und Darstellung



Die Darstellung von Vanadium läuft in mehreren Schritten ab. Zunächst muss aus verschiedenen Ausgangsstoffen Vanadium(V)-oxid gewonnen werden. Dieses lässt sich dann zum elementaren Metall reduzieren und gegebenenfalls reinigen. ⓘ
Mögliche Ausgangsstoffe, aus denen Vanadium gewonnen werden kann, sind Vanadiumerze wie Carnotit oder Patronit, vanadiumhaltige Titan-Magnetit-Erze und Erdöl. Vanadiumerze waren in früherer Zeit für die Produktion wichtig, spielen jedoch keine wichtige Rolle mehr und sind vor allem von den Titan-Magnetit-Erzen abgelöst worden. ⓘ
Werden vanadiumhaltige Eisenerze im Hochofenprozess zu Eisen reduziert, bleibt das Vanadium zunächst im Roheisen. Um das Roheisen weiter zu Stahl zu verarbeiten, wird während des Frischens Sauerstoff eingeblasen. Dabei geht das Vanadium in die Schlacke über. Diese enthält bis zu 25 % Vanadium(V)-oxid und ist die wichtigste Quelle für die Gewinnung des Metalls. Um das reine Vanadium(V)-oxid zu gewinnen, wird die feingemahlene Schlacke mit Natriumsalzen wie Natriumchlorid oder Natriumcarbonat oxidierend geröstet. Dabei bildet sich wasserlösliches Natriummetavanadat, das von der restlichen Schlacke durch Auslaugen abgetrennt wird. Durch Zugabe von Säure und Ammoniumsalzen fällt das entstandene unlösliche Ammoniumpolyvanadat aus der Lösung aus. Dieses kann durch Rösten zu Vanadium(V)-oxid umgewandelt werden. Auch aus anderen vanadiumhaltigen Erzen kann auf identischem Weg das Oxid gewonnen werden. Aus Erdöl kann das Vanadium durch Bildung einer Emulsion unter Zugabe von Wasser und Magnesiumnitrat extrahiert werden. Die weitere Aufarbeitung geschieht wie bei der Gewinnung aus Eisenerzen. ⓘ
Die eigentliche Vanadiumgewinnung findet durch Reduktion des Vanadium(V)-oxids mit anderen Metallen statt. Als Reduktionsmittel können Aluminium, Calcium, Ferrosilicium oder Kohlenstoff verwendet werden; mit letzterem bilden sich jedoch bei der Reaktion Carbide, die schwer vom Metall abgetrennt werden können.
- Reduktion mit Calcium ⓘ
Um reines Vanadium zu erhalten, wird teures Calcium oder Aluminium als Reduktionsmittel verwendet, da mit dem billigeren Ferrosilicium keine hohe Reinheit zu erreichen ist. Während mit Calcium direkt reines Vanadium gewonnen wird, bildet sich mit Aluminium zunächst eine Vanadium-Aluminium-Legierung, aus der durch Sublimation im Vakuum reines Vanadium gewonnen wird. ⓘ
Ein Großteil des Vanadiums wird jedoch nicht als reines Metall, sondern in Form der Eisen-Vanadium-Legierung Ferrovanadium, die mindestens 50 % Vanadium enthält, verwendet. Um diese herzustellen, ist es nicht nötig, vorher das reine Vanadium zu gewinnen. Stattdessen wird die vanadium- und eisenhaltige Schlacke mit Ferrosilicium und Kalk zu Ferrovanadium reduziert. Diese Legierung reicht für die meisten technischen Anwendungen aus. ⓘ
Reinstes Vanadium kann entweder elektrochemisch oder nach dem Van-Arkel-de-Boer-Verfahren dargestellt werden. Dazu wird das reine Vanadium zusammen mit Iod in eine luftleere Glasampulle eingeschmolzen. Das in der geheizten Ampulle gebildete Vanadium(III)-iodid zersetzt sich an einem heißen Wolframdraht zu hochreinem Vanadium und Iod.
- Reaktion im Van-Arkel-de-Boer-Verfahren ⓘ

China ist der größte Vanadiumproduzent der Welt. ⓘ
Eigenschaften
Physikalische Eigenschaften

Vanadium ist ein nichtmagnetisches, zähes, schmiedbares und deutlich stahlblaues Schwermetall mit einer Dichte von 6,11 g/cm3. Reines Vanadium ist relativ weich, wird aber durch Beimengungen anderer Elemente härter und besitzt dann eine hohe mechanische Festigkeit. In den meisten Eigenschaften ähnelt es seinem Nachbarn im Periodensystem, dem Titan. Der Schmelzpunkt von reinem Vanadium liegt bei 1910 °C, dieser wird jedoch durch Verunreinigungen wie Kohlenstoff deutlich erhöht. Bei einem Gehalt von 10 % Kohlenstoff liegt er bei etwa 2700 °C. Vanadium kristallisiert wie Chrom oder Niob in einer kubisch-raumzentrierten Kristallstruktur mit der Raumgruppe Im3m (Raumgruppen-Nr. 229) und dem Gitterparameter a = 302,4 pm sowie zwei Formeleinheiten pro Elementarzelle. ⓘ
Unterhalb einer Sprungtemperatur von 5,13 K wird Vanadium zum Supraleiter. Ebenso wie reines Vanadium sind auch Legierungen des Vanadiums mit Gallium, Niob und Zirconium supraleitend. Bei Temperaturen unter 5,13 K zeigt Vanadium, ebenso wie die Vanadiumgruppenmetalle Niob und Tantal, in kleinsten Klümpchen bis 200 Atomen eine bisher nicht erklärte, spontane elektrische Polarisation, wie sie sonst nur nichtmetallische Stoffe aufweisen. ⓘ
Chemische Eigenschaften
Vanadium ist ein unedles Metall und in der Lage, mit vielen Nichtmetallen zu reagieren. An der Luft bleibt es wochenlang metallisch glänzend. Bei der Betrachtung über längere Zeiträume wird deutlich sichtbarer grüner Rost wahrgenommen. Soll Vanadium konserviert bleiben, so muss es unter Argon aufbewahrt werden. In der Hitze wird es von Sauerstoff angegriffen und zu Vanadium(V)-oxid oxidiert. Während Kohlenstoff und Stickstoff mit Vanadium erst bei Weißglut reagieren, findet die Reaktion mit Fluor und Chlor schon in der Kälte statt. ⓘ
Gegenüber Säuren und Basen ist Vanadium bei Raumtemperatur meist stabil auf Grund einer dünnen passivierenden Oxidschicht; angegriffen wird es in diesem Zustand nur von Flusssäure sowie stark oxidierend wirkenden Säuren wie heißer Salpetersäure, konzentrierter Schwefelsäure und Königswasser. ⓘ
Bis zu einer Temperatur von 500 °C ist Vanadium in der Lage, Wasserstoff zu absorbieren. Dabei wird das Metall spröde und lässt sich leicht pulvern. Entfernen lässt sich der Wasserstoff bei 700 °C im Vakuum. ⓘ
Isotope
Das natürlich vorkommende Vanadium besteht aus einem stabilen Isotop, 51V, und einem radioaktiven Isotop, 50V. Letzteres hat eine Halbwertszeit von 1,5×1017 Jahren und eine natürliche Häufigkeit von 0,25 %. 51V hat einen Kernspin von 7⁄2, der für die NMR-Spektroskopie nützlich ist. Es wurden vierundzwanzig künstliche Radioisotope charakterisiert, deren Massenzahl zwischen 40 und 65 liegt. Die stabilsten dieser Isotope sind 49V mit einer Halbwertszeit von 330 Tagen und 48V mit einer Halbwertszeit von 16,0 Tagen. Die übrigen radioaktiven Isotope haben Halbwertszeiten von weniger als einer Stunde, die meisten unter 10 Sekunden. Mindestens vier Isotope haben metastabile angeregte Zustände. Bei Isotopen, die leichter als 51 V sind, ist der Elektroneneinfang der wichtigste Zerfallsmodus. Bei den schwereren Isotopen ist der Betazerfall die häufigste Form. Die Elektroneneinfangreaktionen führen zur Bildung von Isotopen des Elements 22 (Titan), während der Betazerfall zur Bildung von Isotopen des Elements 24 (Chrom) führt. ⓘ
Verwendung

Reines Vanadium wird nur zu einem geringen Prozentsatz aufgrund seines geringen Neutroneneinfangquerschnitts als Hüllwerkstoff für Kernbrennstoffe verwendet. Es können aber auch beständigere Vanadiumlegierungen genutzt werden. Über 90 % der Produktion werden in einer Vielzahl von Legierungen, meist mit den Metallen Eisen, Titan, Nickel, Chrom, Aluminium oder Mangan eingesetzt. Nur ein kleiner Teil wird in Verbindungen, meist als Vanadium(V)-oxid genutzt. ⓘ

Mit 85 % des produzierten Vanadiums wird der weitaus größte Teil in der Stahlindustrie verbraucht. Da hierfür keine hohen Reinheiten nötig sind, wird Ferrovanadium als Rohstoff genutzt. Vanadium steigert schon in kleinen Mengen die Festigkeit und Zähigkeit von Stählen und dadurch deren Verschleißfestigkeit deutlich. Dies wird durch die Bildung von hartem Vanadiumcarbid bewirkt. Je nach Anwendung werden unterschiedliche Mengen Vanadium beigegeben; so enthalten Baustähle und Werkzeugstähle nur geringe Mengen (0,2 bis 0,5 %) Vanadium, Schnellarbeitsstahl bis zu 5 %. Vanadiumhaltige Stähle werden vor allem für mechanisch beanspruchte Werkzeuge und Federn genutzt. ⓘ
Titanlegierungen, die Vanadium und meist auch Aluminium enthalten, sind besonders stabil und hitzebeständig und werden im Flugzeugbau für tragende Teile und Turbinenblätter von Flugzeugtriebwerken eingesetzt. ⓘ
Vanadiumverbindungen können zur elektrochemischen Energiespeicherung in Redox-Flow-Zellen dienen, siehe Vanadium-Redox-Akkumulator. Dabei werden Vanadiumsalze in sauren wässrigen Lösungen eingesetzt, die in Tanks gespeichert werden. ⓘ
Nachweis
Eine Vorprobe liefert die Phosphorsalzperle, bei der Vanadium in der Reduktionsflamme charakteristisch grün erscheint. Die Oxidationsflamme ist schwach gelb und damit zu unspezifisch. ⓘ
Ein qualitativer Nachweis für Vanadium beruht auf der Bildung von Peroxovanadiumionen. Dazu wird eine saure Lösung, die Vanadium in der Oxidationsstufe +5 enthält, mit wenig Wasserstoffperoxid versetzt. Es bildet sich das rötlich-braune [V(O2)]3+-kation. Dieses reagiert mit größeren Mengen Wasserstoffperoxid zur schwach gelben Peroxovanadiumsäure H3[VO2(O2)2]. ⓘ
Quantitativ kann Vanadium durch Titration bestimmt werden. Dazu wird eine vanadiumhaltige schwefelsaure Lösung mit Kaliumpermanganat zu fünfwertigem Vanadium oxidiert und anschließend mit einer Eisen(II)-sulfatlösung und Diphenylamin als Indikator rücktitriert. Auch eine Reduktion von vorliegenden fünfwertigem Vanadium mit Eisen(II)-sulfat zum vierwertigen Oxidationszustand und anschließender potentiometrischer Titration mit Kaliumpermanganatlösung ist möglich. ⓘ
In der modernen Analytik kann Vanadium mit mehreren Methoden nachgewiesen werden. Dies sind beispielsweise die Atomabsorptionsspektrometrie bei 318,5 nm und die Spektralphotometrie mit N-Benzoyl-N-phenylhydroxylamin als Farbreagenz bei 546 nm. ⓘ
Biologische Bedeutung

Vanadiumverbindungen besitzen verschiedene biologische Bedeutungen. Charakteristisch für Vanadium ist, dass es sowohl anionisch als Vanadat, als auch kationisch als VO2+, VO2+ oder V3+ vorkommt. Vanadate besitzen große Ähnlichkeit zu Phosphaten und haben dementsprechend ähnliche Wirkungen. Da Vanadat stärker an geeignete Enzyme bindet als Phosphat, ist es in der Lage, Enzyme der Phosphorylierung zu blockieren und so zu steuern. Dies betrifft beispielsweise die Natrium-Kalium-ATPase, die den Transport von Natrium und Kalium in Zellen steuert. Diese Blockierung kann mit Desferrioxamin B, das einen stabilen Komplex mit Vanadat bildet, schnell wieder aufgehoben werden. Weiterhin beeinflusst Vanadium die Glucoseaufnahme. Es ist in der Lage, in der Leber die Glykolyse zu stimulieren und den Konkurrenzprozess der Gluconeogenese zu hemmen. Dadurch kommt es zu einer Senkung des Glucose-Spiegels im Blut. Daher wird untersucht, ob Vanadiumverbindungen für die Behandlung von Diabetes mellitus Typ 2 geeignet sind. Es sind jedoch noch keine eindeutigen Ergebnisse gefunden worden. Daneben stimuliert Vanadium auch die Oxidation von Phospholipiden und unterdrückt die Synthese von Cholesterin durch Hemmung der Squalensynthase, einem mikrosomalen Enzymsystem der Leber. Folgerichtig verursacht ein Mangel erhöhte Konzentrationen von Cholesterin und Triglyceriden im Blutplasma. ⓘ
In Pflanzen spielt Vanadium eine Rolle in der Photosynthese. Es ist in der Lage, die Reaktion zur Bildung von 5-Aminolävulinsäure ohne Enzym zu katalysieren. Diese ist eine wichtige Vorstufe zur Bildung von Chlorophyll. ⓘ
In einigen Organismen kommen vanadiumhaltige Enzyme vor, so besitzen einige Bakterienarten zur Stickstofffixierung vanadiumhaltige Nitrogenasen. Dies sind beispielsweise Arten der Gattung Azotobacter sowie das Cyanobakterium Anabaena variabilis. Diese Nitrogenasen sind jedoch nicht so leistungsfähig wie die häufigeren Molybdän-Nitrogenasen und werden daher nur bei Molybdänmangel aktiviert. Weitere vanadiumhaltige Enzyme finden sich in Braunalgen und Flechten. Diese besitzen vanadiumhaltige Haloperoxidasen, mit denen sie Chlor-, Brom- oder Iod-organische Verbindungen aufbauen. ⓘ
Die Funktion des in großen Mengen in Seescheiden als Metalloproteine Vanabine vorhandenen Vanadiums ist noch nicht bekannt. Ursprünglich wurde vermutet, dass das Vanadium ähnlich dem Hämoglobin als Sauerstofftransporter dient; dies hat sich jedoch als falsch herausgestellt. ⓘ
Gefährdungen
Wie andere Metallstäube ist auch Vanadiumstaub entzündlich. Vanadium und seine anorganischen Verbindungen haben sich im Tierversuch als karzinogen erwiesen. Sie werden von der MAK-Kommission als karzinogen, Kategorie 2 und keimzellenmutagen, Kategorie 2 eingestuft. Wird Vanadiumstaub etwa von Arbeitern in der Metallverhüttung über längere Zeit eingeatmet, kann es zum sogenannten Vanadismus kommen. Diese anerkannte Berufskrankheit kann sich in Schleimhautreizung, grünschwarzer Verfärbung der Zunge sowie chronischen Bronchial-, Lungen- und Darmerkrankungen äußern. ⓘ
Verbindungen
In Verbindungen kann Vanadium in verschiedenen Oxidationsstufen vorliegen. Häufig sind die Stufen +5, +4, +3 und +2, seltener sind +1, 0, −1 und −3. Die wichtigsten und stabilsten Oxidationsstufen sind +5 und +4. ⓘ
→ :Kategorie:Vanadiumverbindung ⓘ
Wässrige Lösung
In wässriger Lösung lässt sich Vanadium leicht in verschiedene Oxidationsstufen überführen. Da die verschiedenen Vanadiumionen charakteristische Farben besitzen, kommt es dabei zu Farbänderungen. ⓘ
In saurer Lösung bildet fünfwertiges Vanadium farblose VO2+-Ionen, die bei der Reduktion zunächst zu blauen vierwertigen VO2+-Ionen werden. Die dreiwertige Stufe mit V3+-Ionen ist von grüner Farbe, die tiefste, in wässriger Lösung erreichbare Stufe, das zweiwertige V2+-Ion ist grauviolett. ⓘ
Sauerstoffverbindungen
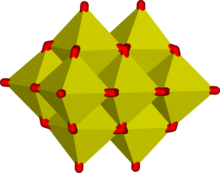
In wässriger Lösung bildet Vanadium(V) eine umfangreiche Familie von Oxyanionen, die durch 51V-NMR-Spektroskopie nachgewiesen wurde. Die Zusammenhänge in dieser Familie werden durch das Dominanzdiagramm beschrieben, das je nach pH-Wert und Konzentration mindestens 11 Arten zeigt. Das tetraedrische Orthovanadat-Ion, VO3-
4, ist die wichtigste Spezies, die bei pH 12-14 vorhanden ist. Vanadium(V) ähnelt in Größe und Ladung dem Phosphor(V) und weist auch Parallelen in der Chemie und Kristallographie auf. Orthovanadat VO3-
4 wird in der Proteinkristallographie verwendet, um die Biochemie von Phosphat zu untersuchen. Darüber hinaus hat sich gezeigt, dass dieses Anion mit der Aktivität einiger spezifischer Enzyme interagiert. Das Tetrathiovanadat [VS4]3- ist analog zum Orthovanadat-Ion. ⓘ
Bei niedrigeren pH-Werten werden das Monomer [HVO4]2- und das Dimer [V2O7]4- gebildet, wobei das Monomer bei einer Vanadiumkonzentration von weniger als ca. 10-2M überwiegt (pV > 2, wobei pV gleich dem Minuswert des Logarithmus der Gesamtvanadiumkonzentration/M ist). Die Bildung des Divanadat-Ions erfolgt analog zur Bildung des Dichromat-Ions. Bei sinkendem pH-Wert kommt es zu einer weiteren Protonierung und Kondensation zu Polyvanadaten: bei pH 4-6 überwiegt [H2VO4]- bei einem pV von mehr als ca. 4, während bei höheren Konzentrationen Trimere und Tetramere gebildet werden. Zwischen pH 2-4 überwiegt Dekavanadat, dessen Bildung aus Orthovanadat durch diese Kondensationsreaktion dargestellt wird:
- 10 [VO4]3- + 24 H+ → [V10O28]6- + 12 H2O ⓘ
Im Dekavanadat ist jedes V(V)-Zentrum von sechs Oxidliganden umgeben. Vanadinsäure, H3VO4, kommt nur in sehr geringen Konzentrationen vor, da die Protonierung der tetraedrischen Spezies [H2VO4]- zur bevorzugten Bildung der oktaedrischen Spezies [VO2(H2O)4]+ führt. In stark sauren Lösungen, pH < 2, ist [VO2(H2O)4]+ die vorherrschende Spezies, während das Oxid V2O5 bei hohen Konzentrationen aus der Lösung ausscheidet. Das Oxid ist formell das Säureanhydrid der Vanadinsäure. Die Strukturen vieler Vanadatverbindungen wurden durch Röntgenkristallographie bestimmt. ⓘ

Vanadium(V) bildet verschiedene Peroxokomplexe, vor allem im aktiven Zentrum der vanadiumhaltigen Bromoperoxidase-Enzyme. Die Spezies VO(O)2(H2O)4+ ist in sauren Lösungen stabil. In alkalischen Lösungen sind Spezies mit 2, 3 und 4 Peroxidgruppen bekannt; die letzte bildet violette Salze mit der Formel M3V(O2)4 nH2O (M= Li, Na, etc.), in denen das Vanadium eine dodekaedrische Struktur mit 8 Koordinaten aufweist. ⓘ

Die wichtigste und stabilste Vanadium-Sauerstoff-Verbindung ist Vanadium(V)-oxid V2O5. Diese orangefarbene Verbindung wird in größeren Mengen als Katalysator für die Schwefelsäureherstellung verwendet. Sie wirkt dort als Sauerstoffüberträger und wird während der Reaktion zu einem weiteren Vanadiumoxid, dem Vanadium(IV)-oxid VO2 reduziert. Weitere bekannte Vanadiumoxide sind Vanadium(III)-oxid V2O3 und Vanadium(II)-oxid VO. ⓘ
Halogenverbindungen
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Vanadium eine Vielzahl von Verbindungen. In den Oxidationsstufen +4, +3 und +2 existieren Verbindungen mit allen Halogenen, lediglich mit Iod sind nur Verbindungen in den Stufen +2 und +3 bekannt. Von diesen Halogeniden sind jedoch nur die Chloride Vanadium(IV)-chlorid und Vanadium(III)-chlorid technisch relevant. Sie dienen unter anderem als Katalysator für die Herstellung von Ethylen-Propylen-Dien-Kautschuk. ⓘ
Vanadiumoxidchloride
Vanadium bildet auch Mischsalze mit Sauerstoff und Chlor, die sogenannten Vanadiumoxidchloride. Vanadium(III)-oxidchlorid, VOCl, ist ein gelbbraunes, wasserlösliches Pulver. Das in der Photographie und als Textilbeize eingesetzte Vanadium(IV)-oxidchlorid, VOCl2 besteht aus grünen, hygroskopischen Kristalltafeln, die sich in Wasser mit blauer Farbe lösen. Vanadium(V)-oxidchlorid, VOCl3 schließlich ist eine gelbe Flüssigkeit, die durch Wasser sehr leicht hydrolysiert wird. VOCl3 dient als Katalysatorkomponente bei der Niederdruckethenpolymerisation. ⓘ
Weitere Vanadiumverbindungen
In organischen Vanadiumverbindungen erreicht Vanadium seine niedrigsten Oxidationsstufen 0, −I und −III. Hier sind vor allem die Metallocene, die sogenannten Vanadocene, wichtig. Diese werden als Katalysator für die Polymerisation von Alkinen verwendet. ⓘ
Vanadiumcarbid VC wird in Pulverform unter anderem zum Plasmaspritzen bzw. Plasma-Pulver-Auftragschweißen eingesetzt. Weiterhin wird Vanadiumcarbid Hartmetallen zugesetzt, um das Kornwachstum zu verringern. ⓘ
Halogenid-Derivate
Zwölf binäre Halogenide, Verbindungen mit der Formel VXn (n=2..5), sind bekannt. VI4, VCl5, VBr5 und VI5 existieren nicht oder sind extrem instabil. In Kombination mit anderen Reagenzien wird VCl4 als Katalysator für die Polymerisation von Dienen verwendet. Wie alle binären Halogenide sind auch die Vanadiumhalogenide Lewis-sauer, insbesondere V(IV) und V(V). Viele der Halogenide bilden oktaedrische Komplexe mit der Formel VXnL6-n (X= Halogenid; L= anderer Ligand). ⓘ
Es sind viele Vanadiumoxyhalogenide (Formel VOmXn) bekannt. Die Oxytrichloride und Oxytrifluoride (VOCl3 und VOF3) sind die am besten untersuchten. Ähnlich wie POCl3 sind sie flüchtig, nehmen in der Gasphase tetraedrische Strukturen an und sind Lewis-sauer. ⓘ
Koordinationsverbindungen

Vanadium(II)- und (III)-Komplexe sind relativ austauschinert und reduzierend. Die von V(IV) und V(V) sind Oxidationsmittel. Das Vanadium-Ion ist relativ groß und einige Komplexe erreichen Koordinationszahlen von mehr als 6, wie z. B. [V(CN)7]4-. Oxovanadium(V) bildet auch 7-Koordinaten-Koordinationskomplexe mit tetradentaten Liganden und Peroxiden, und diese Komplexe werden für oxidative Bromierungen und Thioetheroxidationen verwendet. Die Koordinationschemie von V4+ wird durch das Vanadylzentrum, VO2+, dominiert, das vier andere Liganden stark und einen schwach bindet (derjenige, der trans zum Vanadylzentrum steht). Ein Beispiel ist Vanadylacetylacetonat (V(O)(O2C5H7)2). In diesem Komplex ist das Vanadium 5-koordiniert und quadratisch pyramidenförmig verzerrt, was bedeutet, dass ein sechster Ligand, wie z. B. Pyridin, gebunden werden kann, obwohl die Assoziationskonstante dieses Prozesses gering ist. Viele 5-koordinierte Vanadylkomplexe haben eine trigonale bipyramidale Geometrie, wie z. B. VOCl2(NMe3)2. Die Koordinationschemie von V5+ wird von den relativ stabilen Dioxovanadium-Koordinationskomplexen beherrscht, die häufig durch Luftoxidation der Vanadium(IV)-Vorstufen gebildet werden, was auf die Stabilität der Oxidationsstufe +5 und die leichte Umwandlung zwischen den Zuständen +4 und +5 hinweist. ⓘ
Metallorganische Verbindungen
Die metallorganische Chemie des Vanadiums ist gut entwickelt, obwohl sie hauptsächlich nur akademische Bedeutung hat. Vanadocendichlorid ist ein vielseitiges Ausgangsreagenz und findet Anwendung in der organischen Chemie. Vanadiumcarbonyl, V(CO)6, ist ein seltenes Beispiel für ein paramagnetisches Metallcarbonyl. Durch Reduktion erhält man V(CO)-
6 (isoelektronisch mit Cr(CO)6), das mit Natrium in flüssigem Ammoniak weiter reduziert werden kann, wobei man V(CO)3-
5 (isoelektronisch mit Fe(CO)5). ⓘ
Merkmale

Vanadium ist ein mittelhartes, duktiles, stahlblaues Metall. Es ist elektrisch leitfähig und thermisch isolierend. In einigen Quellen wird Vanadium als "weich" bezeichnet, vielleicht weil es dehnbar, verformbar und nicht spröde ist. Vanadium ist härter als die meisten Metalle und Stähle (siehe Härtegrade der Elemente (Datenseite) und Eisen). Es weist eine gute Korrosionsbeständigkeit auf und ist beständig gegen Laugen, Schwefel- und Salzsäuren. Es wird an der Luft bei etwa 933 K (660 °C, 1220 °F) oxidiert, obwohl sich bereits bei Raumtemperatur eine Oxidpassivierungsschicht bildet. ⓘ
Anwendungen

Katalysatoren

Vanadiumverbindungen werden in großem Umfang als Katalysatoren eingesetzt; Vanadiumpentoxid V2O5 wird als Katalysator bei der Herstellung von Schwefelsäure nach dem Kontaktverfahren verwendet. Bei diesem Verfahren wird Schwefeldioxid (SO
2) zu Schwefeltrioxid (SO
3): Bei dieser Redoxreaktion wird der Schwefel von +4 zu +6 oxidiert und das Vanadium von +5 zu +4 reduziert:
- V2O5 + SO2 → 2 VO2 + SO3 ⓘ
Der Katalysator wird durch Oxidation mit Luft regeneriert:
- 4 VO2 + O2 → 2 V2O5
Ähnliche Oxidationen werden bei der Herstellung von Maleinsäureanhydrid eingesetzt:
- C4H10 + 3,5 O2 → C4H2O3 + 4 H2O
Phthalsäureanhydrid und mehrere andere organische Massenverbindungen werden auf ähnliche Weise hergestellt. Diese Verfahren der grünen Chemie wandeln kostengünstige Ausgangsstoffe in hochfunktionalisierte, vielseitige Zwischenprodukte um. ⓘ
Vanadium ist ein wichtiger Bestandteil von Mischmetalloxid-Katalysatoren, die bei der Oxidation von Propan und Propylen zu Acrolein und Acrylsäure oder bei der Ammoxidation von Propylen zu Acrylnitril eingesetzt werden. Im Betrieb ändert sich der Oxidationszustand von Vanadium dynamisch und reversibel mit dem Sauerstoff- und Wasserdampfgehalt des reagierenden Gemisches. ⓘ
Glasbeschichtungen und Keramiken
Ein weiteres Vanadiumoxid, Vanadiumdioxid VO2, wird für die Herstellung von Glasbeschichtungen verwendet, die bei einer bestimmten Temperatur Infrarotstrahlung (und nicht sichtbares Licht) blockieren. Vanadiumoxid kann verwendet werden, um Farbzentren in Korund zu erzeugen und so Alexandrit-Schmuck zu simulieren, obwohl Alexandrit in der Natur ein Chrysoberyll ist. Vanadiumpentoxid wird in Keramiken verwendet. ⓘ
Andere Verwendungen
Die Vanadium-Redox-Batterie, eine Art Durchflussbatterie, ist eine elektrochemische Zelle, die aus wässrigen Vanadium-Ionen in verschiedenen Oxidationsstufen besteht. Batterien dieses Typs wurden erstmals in den 1930er Jahren vorgeschlagen und ab den 1980er Jahren kommerziell entwickelt. Die Zellen verwenden Ionen der formalen Oxidationsstufen +5 und +2. Vanadium-Redox-Batterien werden kommerziell für die Energiespeicherung im Netz verwendet. ⓘ
Vanadat kann zum Schutz von Stahl gegen Rost und Korrosion durch Konversionsbeschichtung verwendet werden. Vanadiumfolie wird für die Verkleidung von Titan mit Stahl verwendet, da sie sowohl mit Eisen als auch mit Titan kompatibel ist. Der moderate thermische Neutroneneinfangquerschnitt und die kurze Halbwertszeit der durch Neutroneneinfang erzeugten Isotope machen Vanadium zu einem geeigneten Material für die innere Struktur eines Fusionsreaktors. ⓘ
Vorgeschlagen
Lithium-Vanadium-Oxid wurde für die Verwendung als Anode mit hoher Energiedichte für Lithium-Ionen-Batterien vorgeschlagen, mit 745 Wh/L, wenn es mit einer Lithium-Kobalt-Oxid-Kathode gepaart wird. Vanadiumphosphate wurden als Kathode in der Lithium-Vanadium-Phosphat-Batterie, einer anderen Art von Lithium-Ionen-Batterie, vorgeschlagen. ⓘ
Biologische Rolle
Vanadium ist in der Meeresumwelt wichtiger als auf dem Lande. ⓘ


Vanadoenzyme
Eine Reihe von Meeresalgenarten produzieren Vanadium-Bromoperoxidase sowie die eng verwandten Chloroperoxidasen (die einen Häm- oder Vanadium-Cofaktor verwenden können) und Jodoperoxidasen. Die Bromoperoxidase produziert jährlich schätzungsweise 1-2 Millionen Tonnen Bromoform und 56.000 Tonnen Brommethan. Die meisten natürlich vorkommenden Organobromverbindungen werden von diesem Enzym hergestellt, das die folgende Reaktion katalysiert (R-H ist ein Kohlenwasserstoffsubstrat):
- R-H + Br- + H2O2 → R-Br + H2O + OH- ⓘ
Eine Vanadium-Stickstoffase wird von einigen stickstofffixierenden Mikroorganismen, wie z. B. Azotobacter, verwendet. In dieser Funktion ersetzt Vanadium das übliche Molybdän oder Eisen und verleiht der Nitrogenase etwas andere Eigenschaften. ⓘ
Vanadiumakkumulation in Manteltieren
Vanadium ist essentiell für Manteltiere, wo es in den stark angesäuerten Vakuolen bestimmter Blutzelltypen, den Vanadozyten, gespeichert wird. Im Zytoplasma dieser Zellen wurden Vanabine (vanadiumbindende Proteine) nachgewiesen. Die Vanadiumkonzentration im Blut von Manteltieren ist bis zu zehn Millionen Mal höher als die des umgebenden Meerwassers, das normalerweise 1 bis 2 µg/l enthält. Die Funktion dieses Vanadium-Konzentrationssystems und dieser Vanadium-tragenden Proteine ist noch unbekannt, aber die Vanadozyten werden später direkt unter der äußeren Oberfläche der Tunika abgelagert, wo sie möglicherweise Raubtiere abschrecken. ⓘ
Pilze
Amanita muscaria und verwandte Arten von Makropilzen akkumulieren Vanadium (bis zu 500 mg/kg Trockengewicht). Vanadium ist in dem Koordinationskomplex Amavadin in den Fruchtkörpern der Pilze enthalten. Die biologische Bedeutung dieser Anreicherung ist unbekannt. Es wird vermutet, dass sie toxische oder Peroxidase-Enzymfunktionen hat. ⓘ
Säugetiere
Ein Mangel an Vanadium führt bei Ratten zu einem verminderten Wachstum. Das U.S. Institute of Medicine hat nicht bestätigt, dass Vanadium ein essentieller Nährstoff für den Menschen ist, so dass weder eine empfohlene noch eine angemessene Zufuhr festgelegt wurde. Die Aufnahme über die Nahrung wird auf 6 bis 18 µg/Tag geschätzt, wobei weniger als 5 % absorbiert werden. Die zulässige Höchstmenge (UL) an Vanadium in der Nahrung, bei deren Überschreitung schädliche Wirkungen auftreten können, wurde auf 1,8 mg/Tag festgelegt. ⓘ
Forschung
Vanadylsulfat als Nahrungsergänzungsmittel wurde als Mittel zur Erhöhung der Insulinempfindlichkeit oder zur Verbesserung der Blutzuckerkontrolle bei Diabetikern erforscht. Einige der Studien wiesen signifikante Behandlungseffekte auf, wurden aber als von schlechter Studienqualität eingestuft. Die in diesen Studien verwendeten Vanadiummengen (30 bis 150 mg) lagen weit über der sicheren Obergrenze. Die Schlussfolgerung der systematischen Überprüfung lautete: "Es gibt keine stichhaltigen Beweise dafür, dass eine orale Vanadium-Supplementierung die Blutzuckerkontrolle bei Typ-2-Diabetes verbessert. Die routinemäßige Einnahme von Vanadium zu diesem Zweck kann nicht empfohlen werden". ⓘ
In der Astrobiologie wurde vorgeschlagen, dass diskrete Vanadiumansammlungen auf dem Mars in Verbindung mit Raman-Spektroskopie und Morphologie eine potenzielle mikrobielle Biosignatur darstellen könnten. ⓘ
Sicherheit
Alle Vanadiumverbindungen sollten als giftig angesehen werden. Tetravalentes VOSO4 ist Berichten zufolge mindestens fünfmal so giftig wie trivalentes V2O3. Die Occupational Safety and Health Administration (OSHA) hat einen Grenzwert von 0,05 mg/m3 für Vanadiumpentoxid-Staub und 0,1 mg/m3 für Vanadiumpentoxid-Dämpfe in der Luft am Arbeitsplatz bei einem 8-Stunden-Arbeitstag und einer 40-Stunden-Arbeitswoche festgelegt. Das National Institute for Occupational Safety and Health (NIOSH) hat empfohlen, dass 35 mg/m3 Vanadium als unmittelbar lebens- und gesundheitsgefährdend gelten, d. h. wahrscheinlich zu dauerhaften Gesundheitsschäden oder zum Tod führen. ⓘ
Vanadiumverbindungen werden über den Magen-Darm-Trakt nur schlecht resorbiert. Das Einatmen von Vanadium und Vanadiumverbindungen führt in erster Linie zu schädlichen Auswirkungen auf das Atmungssystem. Die quantitativen Daten sind jedoch unzureichend, um eine subchronische oder chronische Referenzdosis für die Inhalation abzuleiten. Andere Wirkungen wurden nach oraler oder inhalativer Exposition auf Blutparameter, Leber, neurologische Entwicklung und andere Organe bei Ratten berichtet. ⓘ
Es gibt kaum Hinweise darauf, dass Vanadium oder Vanadiumverbindungen Reproduktionstoxine oder Teratogene sind. Vanadiumpentoxid wurde in einer NTP-Studie bei männlichen Ratten sowie bei männlichen und weiblichen Mäusen durch Inhalation als krebserregend eingestuft, obwohl die Interpretation der Ergebnisse in letzter Zeit umstritten ist. Die Karzinogenität von Vanadium wurde von der United States Environmental Protection Agency nicht festgestellt. ⓘ
Vanadiumspuren in Dieselkraftstoffen sind die wichtigste Kraftstoffkomponente bei Hochtemperaturkorrosion. Bei der Verbrennung oxidiert Vanadium und reagiert mit Natrium und Schwefel, wobei Vanadatverbindungen mit Schmelzpunkten von bis zu 530 °C entstehen, die die Passivierungsschicht auf Stahl angreifen und ihn korrosionsanfällig machen. Die festen Vanadiumverbindungen reiben auch Motorenteile ab. ⓘ



