Zöliakie
| Zöliakie ⓘ | |
|---|---|
| Andere Bezeichnungen | Zöliakie, nichttropische Sprue, endemische Sprue, Gluten-Enteropathie |
 | |
| Dünndarmbiopsie mit Zöliakie, die sich durch Zottenstumpfheit, Kryptenhypertrophie und Lymphozyteninfiltration der Krypten äußert | |
| Aussprache |
|
| Fachgebiet | Gastroenterologie, Innere Medizin |
| Symptome | Keine oder unspezifisch, abdominale Blähungen, Durchfall, Verstopfung, Malabsorption, Gewichtsverlust, Dermatitis herpetiformis |
| Komplikationen | Eisenmangelanämie, Osteoporose, Unfruchtbarkeit, Krebserkrankungen, neurologische Probleme, andere Autoimmunerkrankungen |
| Gewöhnlicher Ausbruch | Jedes Alter |
| Dauer | Lebenslang |
| Ursachen | Reaktion auf Gluten |
| Risikofaktoren | Genetische Veranlagung, Typ-1-Diabetes, Autoimmunerkrankung der Schilddrüse, Down- und Turner-Syndrom |
| Diagnostische Methode | Familienanamnese, Antikörpertests im Blut, Darmbiopsien, Gentests, Reaktion auf Glutenentzug |
| Differentialdiagnose | Entzündliche Darmerkrankungen, Darmparasiten, Reizdarmsyndrom, Mukoviszidose |
| Behandlung | Glutenfreie Diät |
| Häufigkeit | ~1 von 135 |
Zöliakie (Zöliakie im amerikanischen Englisch) ist eine langfristige Autoimmunerkrankung, die vor allem den Dünndarm betrifft und bei der die Betroffenen eine Unverträglichkeit gegenüber Gluten entwickeln, das in Lebensmitteln wie Weizen, Roggen und Gerste enthalten ist. Zu den klassischen Symptomen gehören Magen-Darm-Beschwerden wie chronischer Durchfall, Blähungen, Malabsorption, Appetitlosigkeit und bei Kindern auch Wachstumsstörungen. Dies beginnt häufig zwischen dem sechsten Lebensmonat und dem zweiten Lebensjahr. Nicht-klassische Symptome sind häufiger, vor allem bei Menschen, die älter als zwei Jahre sind. Es kann zu leichten oder fehlenden gastrointestinalen Symptomen kommen, zu einer Vielzahl von Symptomen, die jeden Teil des Körpers betreffen, oder zu keinen offensichtlichen Symptomen. Die Zöliakie wurde erstmals im Kindesalter beschrieben, kann jedoch in jedem Alter auftreten. Sie tritt in Verbindung mit anderen Autoimmunerkrankungen auf, wie z. B. Diabetes mellitus Typ 1 und Hashimoto-Thyreoiditis. ⓘ
Zöliakie wird durch eine Reaktion auf Gluten verursacht, eine Gruppe verschiedener Proteine, die in Weizen und anderen Getreidesorten wie Gerste und Roggen vorkommen. Mäßige Mengen von Hafer, der nicht mit anderen glutenhaltigen Getreidesorten verunreinigt ist, werden in der Regel vertragen. Das Auftreten von Problemen kann von der Hafersorte abhängen. Sie tritt bei Menschen auf, die eine genetische Veranlagung haben. Bei Kontakt mit Gluten kann eine abnorme Immunreaktion zur Bildung verschiedener Autoantikörper führen, die eine Reihe von Organen angreifen können. Im Dünndarm verursacht dies eine Entzündungsreaktion und kann zu einer Verkürzung der Dünndarmzotten (Zottenatrophie) führen. Dies beeinträchtigt die Aufnahme von Nährstoffen und führt häufig zu Blutarmut (Anämie). ⓘ
Die Diagnose wird in der Regel durch eine Kombination aus Blutantikörpertests und Darmbiopsien gestellt, die durch spezifische Gentests unterstützt werden. Die Diagnose ist nicht immer einfach zu stellen. In etwa 10 % der Fälle sind die Autoantikörper im Blut negativ, und viele Menschen haben nur geringfügige Darmveränderungen mit normalen Darmzotten. Manche Menschen haben schwere Symptome und werden jahrelang untersucht, bevor die Diagnose gestellt wird. In zunehmendem Maße wird die Diagnose auch bei Menschen ohne Symptome gestellt, was auf ein Screening zurückzuführen ist. Die Erkenntnisse über die Auswirkungen des Screenings reichen jedoch nicht aus, um seinen Nutzen zu bestimmen. Die Krankheit wird zwar durch eine dauerhafte Unverträglichkeit von Glutenproteinen verursacht, unterscheidet sich aber von der Weizenallergie, die sehr viel seltener vorkommt. ⓘ
Die einzige bekannte wirksame Behandlung ist eine strenge, lebenslange glutenfreie Diät, die zu einer Erholung der Darmschleimhaut führt, die Symptome verbessert und bei den meisten Menschen das Risiko von Komplikationen verringert. Bleibt die Krankheit unbehandelt, kann sie zu Krebserkrankungen wie Darmlymphomen und einem leicht erhöhten Risiko eines frühen Todes führen. Die Raten schwanken zwischen den verschiedenen Regionen der Welt und reichen von 1:300 bis 1:40, wobei der Durchschnitt zwischen 1:100 und 1:170 liegt. Man schätzt, dass 80 % der Fälle nicht diagnostiziert werden, in der Regel aufgrund geringer oder fehlender gastrointestinaler Beschwerden und mangelnder Kenntnis der Symptome und Diagnosekriterien. Zöliakie tritt bei Frauen etwas häufiger auf als bei Männern. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| K90.0 | Zöliakie |
| ICD-10 online (WHO-Version 2019) | |
Die Zöliakie (Synonyme: glutensensitive oder gluteninduzierte Enteropathie, einheimische Sprue, nichttropische Sprue, selten auch intestinaler Infantilismus, Heubner-Herter-Krankheit) ist eine durch Glutenunverträglichkeit verursachte langfristige Autoimmunerkrankung, die hauptsächlich den Dünndarm betrifft. Sie ist im eigentlichen Sinn keine Allergie, sondern eine chronische Entzündung der Dünndarmschleimhaut aufgrund einer Überempfindlichkeit gegen Bestandteile von Gluten, dem vor allem in den Körnern (Samen) vieler Getreidesorten vorkommenden Klebereiweiß. Auch andere Organe können betroffen sein. Die Glutenunverträglichkeit ist zum Teil erblich, kann derzeit nicht ursächlich behandelt werden und bleibt lebenslang bestehen. ⓘ
Durch glutenhaltige Nahrungsmittel entsteht eine Entzündung der Dünndarmschleimhaut mit oft ausgedehnter Zerstörung der Darmepithelzellen. Dadurch können Nährstoffe nur schlecht aufgenommen werden, sie verbleiben großteils unverdaut im Darm. Die Symptome und die Schwere des Krankheitsbildes können sehr unterschiedlich sein, was das Erkennen erschwert. Mögliche Symptome sind Gewichtsverlust, Durchfall, Erbrechen, Appetitlosigkeit, Müdigkeit, Depressionen, Blutungsneigung (durch Vitamin-K-Mangel) und im Kindesalter eine Gedeihstörung (verlangsamte körperliche Entwicklung); auch neurologische Störungen können auftreten. Eine nicht therapierte Zöliakie erhöht die Gefahr eines Non-Hodgkin-Lymphoms (ein Lymphknoten-Krebs) sowie wahrscheinlich auch von Karzinomen des Verdauungstrakts. Zöliakie geht bei fünf bis zehn Prozent der Patienten mit einem Diabetes mellitus Typ 1 einher. Die Behandlung der Zöliakie besteht derzeit ausschließlich aus einer glutenfreien Ernährung. ⓘ
Anzeichen und Symptome
Zu den klassischen Symptomen einer unbehandelten Zöliakie gehören blasser, lockerer oder fettiger Stuhl (Steatorrhoe) sowie Gewichtsverlust oder fehlende Gewichtszunahme. Andere häufige Symptome können unauffällig sein oder hauptsächlich in anderen Organen als dem Darm selbst auftreten. Es ist auch möglich, an Zöliakie zu erkranken, ohne dass eines der klassischen Symptome auftritt. Dies ist bei Kindern in mindestens 43 % der Fälle der Fall. Darüber hinaus können viele Erwachsene mit subtiler Erkrankung nur mit Müdigkeit oder Anämie auftreten. Viele nicht diagnostizierte Personen, die sich für asymptomatisch halten, sind es in Wirklichkeit nicht, sondern haben sich daran gewöhnt, in einem Zustand chronisch eingeschränkter Gesundheit zu leben. Nachdem sie mit einer glutenfreien Diät begonnen haben und eine Besserung eingetreten ist, sind diese Menschen oft in der Lage, sich im Nachhinein an frühere Symptome ihrer unbehandelten Krankheit zu erinnern, die sie fälschlicherweise ignoriert hatten. ⓘ
Gastrointestinales
Der für die Zöliakie charakteristische Durchfall ist chronisch, manchmal blass, großvolumig und hat einen abnormalen, üblen Geruch. Es können Bauchschmerzen, Krämpfe, Blähungen mit Blähungen im Bauchraum (die vermutlich durch die fermentative Produktion von Darmgasen verursacht werden) und Mundgeschwüre vorhanden sein. Wenn der Darm stärker geschädigt wird, kann sich eine gewisse Laktoseintoleranz entwickeln. Häufig werden die Symptome zunächst dem Reizdarmsyndrom zugeschrieben, um dann später als Zöliakie erkannt zu werden. In Bevölkerungsgruppen mit Reizdarmsymptomen kann die Diagnose Zöliakie in etwa 3,3 % der Fälle gestellt werden, d. h. viermal häufiger als in der Allgemeinbevölkerung. Ein Zöliakie-Screening wird vom National Institute for Health and Clinical Excellence (NICE), der British Society of Gastroenterology und dem American College of Gastroenterology empfohlen, ist aber in Nordamerika von unklarem Nutzen. ⓘ
Zöliakie führt zu einem erhöhten Risiko sowohl für Adenokarzinome als auch für Lymphome des Dünndarms (Enteropathie-assoziiertes T-Zell-Lymphom (EATL) oder andere Non-Hodgkin-Lymphome). Dieses Risiko ist auch bei Verwandten ersten Grades wie Geschwistern, Eltern und Kindern höher. Es ist nicht klar, ob eine glutenfreie Ernährung dieses Risiko auf den Ausgangswert zurückführt. Eine lang andauernde und unbehandelte Erkrankung kann zu anderen Komplikationen führen, wie z. B. ulzerative Jejunitis (Geschwürsbildung im Dünndarm) und Strikturierung (Verengung infolge von Narbenbildung mit Darmverschluss). ⓘ
Malabsorptionsbedingte
Die Veränderungen im Darm vermindern seine Fähigkeit, Nährstoffe, Mineralien und die fettlöslichen Vitamine A, D, E und K zu absorbieren. ⓘ
- Die Malabsorption von Kohlenhydraten und Fetten kann zu Gewichtsverlust (bei Kindern auch zu Gedeihstörung oder Kleinwuchs) und Müdigkeit oder Energiemangel führen.
- Anämie kann sich auf verschiedene Weise entwickeln: Eisenmalabsorption kann eine Eisenmangelanämie verursachen, und Folsäure- und Vitamin-B12-Malabsorption kann zu einer megaloblastischen Anämie führen.
- Eine Kalzium- und Vitamin-D-Malabsorption (und ein kompensatorischer sekundärer Hyperparathyreoidismus) kann zu Osteopenie (verminderter Mineralgehalt des Knochens) oder Osteoporose (Schwächung des Knochens und Gefahr von Frakturen) führen.
- Die Selen-Malabsorption bei Zöliakie in Verbindung mit dem geringen Selengehalt in vielen glutenfreien Lebensmitteln birgt das Risiko eines Selenmangels.
- Auch Kupfer- und Zinkmangel wurden mit Zöliakie in Verbindung gebracht.
- Ein kleiner Teil der Zöliakiebetroffenen weist aufgrund eines Vitamin-K-Mangels eine gestörte Blutgerinnung auf und hat ein geringes Risiko für abnorme Blutungen. ⓘ
Sonstiges
Die Zöliakie wird mit vielen Krankheiten in Verbindung gebracht. In vielen Fällen ist unklar, ob die gluteninduzierte Darmerkrankung ein ursächlicher Faktor ist oder ob diese Erkrankungen eine gemeinsame Prädisposition aufweisen. ⓘ
- Ein IgA-Mangel liegt bei 2,3 % der Zöliakie-Betroffenen vor und ist mit einem zehnfach erhöhten Zöliakie-Risiko verbunden. Weitere Merkmale dieser Erkrankung sind ein erhöhtes Risiko für Infektionen und Autoimmunkrankheiten.
- Dermatitis herpetiformis, eine juckende Hauterkrankung, die mit einem Transglutaminase-Enzym in der Haut in Verbindung gebracht wird, weist Dünndarmveränderungen auf, die mit denen der Zöliakie identisch sind, und kann auf einen Glutenentzug ansprechen, auch wenn keine gastrointestinalen Symptome vorhanden sind.
- Wachstumsstörungen und/oder Pubertätsverzögerungen im späteren Kindesalter können auch ohne offensichtliche Darmsymptome oder schwere Unterernährung auftreten. Die Beurteilung von Wachstumsstörungen schließt häufig ein Zöliakie-Screening ein.
- Bei bereits bestehender oder später erworbener Zöliakie kann es zu Schwangerschaftskomplikationen kommen, die unter anderem Fehlgeburten, intrauterine Wachstumsstörungen, niedriges Geburtsgewicht und Frühgeburten zur Folge haben können.
- Hyposplenismus (eine kleine und unteraktive Milz) tritt in etwa einem Drittel der Fälle auf und kann angesichts der Rolle der Milz beim Schutz vor schädlichen Bakterien zu Infektionen führen.
- Abnormale Leberfunktionstests (die zufällig bei Blutuntersuchungen festgestellt werden) können vorkommen. ⓘ
Zöliakie ist mit mehreren anderen Erkrankungen verbunden, von denen viele Autoimmunerkrankungen sind: Diabetes mellitus Typ 1, Hypothyreose, primär biliäre Cholangitis, mikroskopische Kolitis, Glutenataxie, Psoriasis, Vitiligo, Autoimmunhepatitis, primär sklerosierende Cholangitis und andere. ⓘ
Ursache
Zöliakie wird durch eine Entzündungsreaktion auf Gliadine und Glutenine (Glutenproteine) verursacht, die in Weizen und ähnlichen Proteinen in den Getreidearten des Stammes Triticeae (zu dem auch andere gängige Getreidesorten wie Gerste und Roggen gehören) und des Stammes Aveneae (Hafer) vorkommen. Weizenunterarten (wie Dinkel, Hartweizen und Kamut) und Weizenhybride (wie Triticale) verursachen ebenfalls Symptome der Zöliakie. ⓘ
Eine kleine Anzahl von Zöliakiebetroffenen reagiert auf Hafer. Die Hafertoxizität bei Zöliakiebetroffenen hängt von der verzehrten Hafersorte ab, da die Prolamingene, die Protein-Aminosäuresequenzen und die Immunreaktivität der toxischen Prolamine bei den verschiedenen Hafersorten unterschiedlich sind. Außerdem ist Hafer häufig mit anderen glutenhaltigen Getreidesorten kreuzkontaminiert. Der Begriff "reiner Hafer" bezieht sich auf Hafer, der nicht mit anderen glutenhaltigen Getreidesorten kontaminiert ist. Die langfristigen Auswirkungen des Verzehrs von reinem Hafer sind noch unklar, und es sind weitere Studien zur Identifizierung der verwendeten Getreidesorten erforderlich, bevor endgültige Empfehlungen für eine glutenfreie Ernährung ausgesprochen werden können. Zöliakiebetroffene, die sich für den Verzehr von Hafer entscheiden, benötigen eine strengere lebenslange Überwachung, die möglicherweise auch regelmäßige Darmbiopsien einschließt. ⓘ
Andere Getreidesorten
Die Allergene sind die Gliadine (die alkohollösliche Fraktion des Glutens) und Glutenine. Je nach Getreideart haben diese Allergene eine unterschiedliche Zusammensetzung:
- Weizen, Dinkel (inkl. Grünkern), Khorasan, Durum: α-/β/ω-Gliadin und Glutenine, C-C-Allergen (Bäckerasthma), CBP2
- Gerste: Hordenin Amylase-Inhibitoren IAM1 und CMb (beide Bäckerasthma)
- Hafer: Avenin A, E und F
- Roggen: Secalinin
Glutenfrei hingegen sind die folgenden Getreidearten:
Auch alle Pseudogetreidearten sind glutenfrei:
- Amarant
- Buchweizen
- Quinoa
Da unterschiedliche Getreidearten oft im selben Betrieb verarbeitet werden, sind Kreuzkontaminationen nicht auszuschließen. Glutenfreie Ware signalisiert z. B. das gf-Logo (durchgestrichene Ähre), ansonsten meist der Warnhinweis „kann Spuren von Gluten enthalten“ (siehe Abschnitt EU-Verordnung). ⓘ
Andere Getreidearten wie Mais, Hirse, Sorghum, Teff, Reis und Wildreis können von Zöliakiebetroffenen unbedenklich verzehrt werden, ebenso wie Nichtgetreidearten wie Amaranth, Quinoa und Buchweizen. Getreidefreie, kohlenhydratreiche Lebensmittel wie Kartoffeln und Bananen enthalten kein Gluten und lösen keine Symptome aus. ⓘ
Risikomodifikatoren
Es gibt verschiedene Theorien darüber, was dafür ausschlaggebend ist, ob eine genetisch anfällige Person eine Zöliakie entwickelt. Zu den wichtigsten Theorien gehören Operationen, Schwangerschaft, Infektionen und emotionaler Stress. ⓘ
Der Verzehr von Gluten in den ersten Lebensmonaten eines Babys scheint das Zöliakierisiko nicht zu erhöhen, eine spätere Aufnahme nach dem sechsten Lebensmonat kann es jedoch verstärken. Es ist ungewiss, ob das Stillen das Risiko verringert. Eine Verlängerung des Stillens bis zur Einführung von glutenhaltigem Getreide in die Ernährung scheint mit einem um 50 % verringerten Zöliakierisiko im Säuglingsalter verbunden zu sein; ob dies auch im Erwachsenenalter gilt, ist nicht klar. Möglicherweise beeinflussen diese Faktoren nur den Zeitpunkt des Ausbruchs. ⓘ
Pathophysiologie
Bei den betroffenen Personen können Proteine wie das Gliadin die Epithelzellschicht der Darmschleimhaut passieren. Das im Endomysium lokalisierte Enzym Tissue-Transglutaminase (tTG) modifiziert die Gliadinpeptide, die eine lokale Immunreaktion auslösen und intestinale T-Zellen aktivieren. Umweltfaktoren wie eine Infektion mit dem Pilz Candida albicans, Stress oder hoher Alkoholkonsum können eine erhöhte Aktivität der tTG bewirken und so die Entstehung der Zöliakie fördern. ⓘ
Eine familiäre Häufung bei Verwandten ersten Grades und insbesondere eineiigen Zwillingen legt einen erblichen Faktor bei der Entstehung einer Zöliakie nahe. Verwandte ersten Grades von Zöliakiepatienten sind zu 5 bis 15 Prozent ebenfalls betroffen; dieser Anteil liegt für eineiige Zwillinge bei 70 Prozent. Tatsächlich findet sich bei mehr als 99 Prozent der betroffenen Menschen auch eine bestimmte Konstellation von sogenannten Histokompatibilitätsantigenen (HLA), nämlich HLA DQ2, DQ7 und DQ8. Allerdings haben insgesamt 25 Prozent aller Menschen diese HLA-Konstellation, wobei etwa 98 Prozent von ihnen das Klebereiweiß ohne Probleme vertragen, sie entwickeln eine Toleranz gegen die schädigenden Anteile, die von den übrigen zwei Prozent offenbar nicht erreicht wird. Warum das so ist, kann noch nicht sicher beantwortet werden. Die Forschungen richten sich auf weitere genetische Merkmale, aber auch auf Infektionen als mögliche mitauslösende Faktoren. ⓘ
Eine Zöliakie kann zu 99 Prozent ausgeschlossen werden, wenn bei einem symptomatischen Patienten kein entsprechender Genotyp nachgewiesen werden kann. Die genetische Diagnostik wird nur in Ausnahmesituationen wie z. B. im Rahmen genetischer Beratungen hinzugezogen, oder wenn bei typischer Symptomatik und positiven Antikörpern eine histologische Abklärung nicht möglich ist. ⓘ
Eine Studie legt nahe, dass Infektionen mit Reoviren in jungen Jahren die Krankheit triggern. ⓘ
Die Zöliakie scheint multifaktoriell bedingt zu sein, d. h., dass mehr als ein genetischer Faktor die Krankheit verursachen kann und dass mehr als ein Faktor notwendig ist, damit sich die Krankheit bei einer Person manifestiert. ⓘ
Genetik
Die überwiegende Mehrheit der Zöliakiebetroffenen hat einen von zwei Typen (von insgesamt sieben) des HLA-DQ-Proteins. HLA-DQ ist Teil des MHC-Klasse-II-Antigen-präsentierenden Rezeptorsystems (auch humanes Leukozytenantigen genannt) und unterscheidet für das Immunsystem zwischen eigenen und fremden Zellen. Die beiden Untereinheiten des HLA-DQ-Proteins werden von den Genen HLA-DQA1 und HLA-DQB1 kodiert, die sich auf dem kurzen Arm von Chromosom 6 befinden. ⓘ
Es gibt sieben HLA-DQ-Varianten (DQ2 und DQ4-DQ9). Mehr als 95 % der Zöliakiebetroffenen haben die Isoform DQ2 oder DQ8, die in Familien vererbt wird. Der Grund für die Erhöhung des Zöliakierisikos durch diese Gene liegt darin, dass die von diesen Genen gebildeten Rezeptoren stärker an Gliadinpeptide binden als andere Formen des Antigen-präsentierenden Rezeptors. Daher ist es wahrscheinlicher, dass diese Formen des Rezeptors T-Lymphozyten aktivieren und den Autoimmunprozess auslösen. ⓘ

Die meisten Menschen mit Zöliakie tragen einen HLA-DQ2-Haplotyp mit zwei Genen, den so genannten DQ2.5-Haplotyp. Dieser Haplotyp setzt sich aus zwei benachbarten Genallelen zusammen, DQA1*0501 und DQB1*0201, die für die beiden Untereinheiten DQ α5 und DQ β2 kodieren. Bei den meisten Personen wird diese DQ2.5-Isoform von einem der beiden von den Eltern vererbten Chromosomen 6 kodiert (DQ2.5cis). Die meisten Zöliakiebetroffenen erben nur eine Kopie dieses DQ2.5-Haplotyps, während einige ihn von beiden Eltern erben; letztere sind besonders gefährdet, an Zöliakie zu erkranken, und auch anfälliger für schwere Komplikationen. ⓘ
Einige Personen erben DQ2.5 von einem Elternteil und einen zusätzlichen Teil des Haplotyps (entweder DQB1*02 oder DQA1*05) vom anderen Elternteil, was das Risiko erhöht. Seltener kommt es vor, dass einige Personen das DQA1*05-Allel von einem Elternteil und das DQB1*02-Allel vom anderen Elternteil erben (DQ2.5trans) (so genannte trans-Haplotyp-Assoziation). Diese Personen haben ein ähnliches Zöliakierisiko wie diejenigen, die nur ein DQ2.5-Chromosom 6 tragen, aber in diesem Fall tritt die Krankheit in der Regel nicht familiär auf. Von den 6 % der europäischen Zöliakiebetroffenen, die weder DQ2.5 (cis oder trans) noch DQ8 (kodiert durch den Haplotyp DQA1*03:DQB1*0302) besitzen, haben 4 % die Isoform DQ2.2, und den restlichen 2 % fehlt DQ2 oder DQ8. ⓘ
Die Häufigkeit dieser Gene variiert geografisch. DQ2.5 ist in Nord- und Westeuropa (Baskenland und Irland mit der höchsten Häufigkeit) und in Teilen Afrikas sehr häufig und wird in Indien mit Krankheiten in Verbindung gebracht, ist aber in Teilen des Westpazifiks nicht zu finden. DQ8 ist weltweit weiter verbreitet als DQ2.5 und besonders häufig in Süd- und Mittelamerika; bis zu 90 % der Menschen in bestimmten indianischen Populationen tragen DQ8 und können daher den Zöliakie-Phänotyp aufweisen. ⓘ
Andere genetische Faktoren wurden bei der Zöliakie wiederholt festgestellt; ihre Beteiligung an der Krankheit ist jedoch geografisch unterschiedlich ausgeprägt. Nur die HLA-DQ-Loci zeigen eine einheitliche Beteiligung in der Weltbevölkerung. Viele der entdeckten Loci wurden auch im Zusammenhang mit anderen Autoimmunkrankheiten gefunden. Ein Locus, das LPP-Gen (lipoma-preferred partner), ist an der Adhäsion der extrazellulären Matrix an der Zelloberfläche beteiligt, und eine Minor-Variante (SNP = rs1464510) erhöht das Krankheitsrisiko um etwa 30 %. Dieses Gen ist stark mit Zöliakie assoziiert (p < 10-39), und zwar in Proben aus einem großen Gebiet in Europa und den USA. ⓘ
Die Prävalenz der Zöliakie-Genotypen in der modernen Bevölkerung ist nicht vollständig bekannt. In Anbetracht der Merkmale der Krankheit und ihrer offensichtlich starken Erblichkeit würde man normalerweise erwarten, dass die Genotypen einer negativen Selektion unterworfen sind und in Gesellschaften, in denen am längsten Landwirtschaft betrieben wird, nicht vorkommen (man vergleiche mit einer ähnlichen Krankheit, der Laktoseintoleranz, die so stark negativ selektiert wurde, dass ihre Prävalenz von ~100 % in den Populationen der Vorfahren auf weniger als 5 % in einigen europäischen Ländern zurückging). Diese Vermutung wurde erstmals von Simoons (1981) geäußert. Inzwischen ist jedoch klar, dass dies nicht der Fall ist; im Gegenteil, es gibt Hinweise auf eine positive Selektion bei Zöliakie-Genotypen. Es wird vermutet, dass einige von ihnen durch den Schutz vor bakteriellen Infektionen von Vorteil waren. ⓘ
Prolamine
Inzwischen ist eine Reihe von schädigenden Abschnitten des Klebereiweißes genau identifiziert worden. Sie gehören alle der alkohollöslichen Fraktion an (sogenannte Prolamine), werden z. B. beim Weizen Gliadin, beim Roggen Secalin, bei der Gerste Hordein genannt und enthalten als Aminosäuren besonders viel Prolin und Glutamin. Bei entsprechend veranlagten Menschen führen diese Eiweißabschnitte (Peptide, Ketten aus 50–100 Aminosäuren) zu einer komplexen Reaktion der Darmschleimhaut und des Immunsystems. Schleimhautzellen des Dünndarmes (Enterozyten) produzieren vermehrt verschiedene HLA-Klassen (HLA I, DR und DQ). Bestimmte Abschnitte des Klebereiweißes (Gliadinpeptide) binden an die vermehrt gebildeten HLA-DQ2-Antigene. Diese Bindung wird dadurch verstärkt, dass aus der zahlreich im Peptid vorhandenen Aminosäure Glutamin Glutaminsäure gebildet wird. Diese Glutaminsäurebildung wird durch das Enzym Gewebstransglutaminase vermittelt. Mit dieser Veränderung passt der entsprechende Abschnitt des Gliadins besser in die „Taschen“ der HLA-Proteine. Der Komplex aus Gliadinpeptid und HLA-DQ2-Antigen bindet wiederum an spezielle Lymphozyten (CD4+-T-Helferzellen) und ruft in diesen eine vermehrte Produktion verschiedener entzündungsauslösender Botenstoffe (Interferon-γ, TNF-α, Interleukin-6 und Interleukin-2) hervor. ⓘ
Im weiteren Prozess der Entzündung werden verschiedene Antikörper gebildet, von denen noch nicht bekannt ist, ob sie ursächlich an der Entstehung der Zöliakie oder anderen, mit Zöliakie assoziierten Autoimmunerkrankungen beteiligt sind. Neben Antikörpern gegen das Klebereiweiß selbst (Gliadin-Antikörper, AGA) treten auch sogenannte Autoantikörper gegen körpereigene Antigene auf. 1997 wurde die Gewebstransglutaminase als hauptsächlich verantwortliches Autoantigen identifiziert. Aufgrund dieser Befunde wird die Zöliakie aus pathophysiologischer Sicht als eine Mischform aus Allergie und Autoimmunerkrankung verstanden. Dabei stellt die allergische Komponente in Form der Überempfindlichkeit gegen das körperfremde Eiweiß Gliadin den auslösenden Faktor dar, während für die Ausprägung der Symptome die autoimmunologische Reaktion gegen körpereigene Strukturen verantwortlich ist. Letztlich endet der Entzündungsvorgang in einem programmierten Zelltod (Apoptose) der Enterozyten, der schließlich zu einem mehr oder weniger ausgeprägten Verlust von Dünndarmzotten (Zottenatrophie) führt. Die so geschädigte Dünndarmschleimhaut ist nun wegen der verkleinerten Resorptionsfläche nicht mehr in der Lage, die zugeführten Nährstoffe in ausreichendem Umfang in die Blutbahn zu überführen. ⓘ
Die meisten der für die Immunreaktion bei Zöliakie verantwortlichen Proteine in der Nahrung sind die Prolamine. Dabei handelt es sich um Speicherproteine, die reich an Prolin (Prol-) und Glutamin (-amin) sind, sich in Alkoholen auflösen und gegen Proteasen und Peptidasen des Darms resistent sind. Prolamine kommen in Getreidekörnern vor, wobei verschiedene Körner unterschiedliche, aber verwandte Prolamine aufweisen: Weizen (Gliadin), Gerste (Hordein), Roggen (Secalin) und Hafer (Avenin). Ein Bereich von α-Gliadin regt die Membranzellen, die Enterozyten, des Darms an, größere Moleküle um die Dichtungsstelle zwischen den Zellen herum zuzulassen. Durch die Unterbrechung der tight junctions können Peptide, die größer als drei Aminosäuren sind, in die Darmschleimhaut eindringen. ⓘ

Das Durchsickern der Membran ermöglicht Gliadinpeptide, die zwei Ebenen der Immunantwort stimulieren: die angeborene Reaktion und die adaptive (T-Helferzellen-vermittelte) Reaktion. Ein proteaseresistentes Peptid aus α-Gliadin enthält eine Region, die Lymphozyten stimuliert und zur Freisetzung von Interleukin-15 führt. Diese angeborene Reaktion auf Gliadin führt zu Signalen des Immunsystems, die Entzündungszellen anlocken und die Freisetzung von Entzündungsstoffen erhöhen. Die stärkste und häufigste adaptive Reaktion auf Gliadin richtet sich gegen ein α2-Gliadinfragment mit einer Länge von 33 Aminosäuren. ⓘ
Die Reaktion auf das 33mer tritt bei den meisten Zöliakiebetroffenen auf, die eine DQ2-Isoform haben. Dieses Peptid weist, wenn es durch intestinale Transglutaminase verändert wird, eine hohe Dichte an überlappenden T-Zell-Epitopen auf. Dies erhöht die Wahrscheinlichkeit, dass die DQ2-Isoform das Peptid bindet und daran gebunden bleibt, wenn es von T-Zellen erkannt wird. Gliadin in Weizen ist das am besten bekannte Mitglied dieser Familie, aber es gibt auch andere Prolamine, und Hordein (aus Gerste), Secalin (aus Roggen) und Avenin (aus Hafer) können zur Zöliakie beitragen. Die Toxizität der Avenine bei Zöliakiepatienten hängt von der verzehrten Hafersorte ab, da die Prolamingene, die Protein-Aminosäuresequenzen und die Immunreaktivität der toxischen Prolamine je nach Hafersorte unterschiedlich sind. ⓘ
Gewebetransglutaminase
Anti-Transglutaminase-Antikörper gegen das Enzym Gewebetransglutaminase (tTG) finden sich im Blut der meisten Menschen mit klassischen Symptomen und kompletter Zottenatrophie, aber nur in 70 % der Fälle mit partieller Zottenatrophie und in 30 % der Fälle mit leichten Schleimhautläsionen. Gewebetransglutaminase modifiziert Glutenpeptide in eine Form, die das Immunsystem effektiver stimulieren kann. Diese Peptide werden durch tTG auf zwei Arten modifiziert: Deamidierung oder Transamidierung. ⓘ
Deamidierung ist die Reaktion, bei der durch Abspaltung der Epsilon-Aminogruppe einer Glutamin-Seitenkette ein Glutamat-Rest entsteht. Transamidierung, die dreimal häufiger vorkommt als Deamidierung, ist die Vernetzung eines Glutaminrests aus dem Gliadinpeptid mit einem Lysinrest des tTg in einer Reaktion, die von der Transglutaminase katalysiert wird. Die Vernetzung kann entweder innerhalb oder außerhalb des aktiven Zentrums des Enzyms stattfinden. Im letzteren Fall entsteht ein dauerhaft kovalent gebundener Komplex zwischen dem Gliadin und dem tTg. Dies führt zur Bildung neuer Epitope, von denen angenommen wird, dass sie die primäre Immunantwort auslösen, durch die sich die Autoantikörper gegen tTg entwickeln. ⓘ
Aufgelagerte Biopsien von Menschen mit Verdacht auf Zöliakie haben gezeigt, dass Autoantikörperablagerungen bei subklinischen Zöliakiekranken vor der klinischen Erkrankung nachgewiesen werden. Diese Ablagerungen finden sich auch bei Menschen, die andere Autoimmunerkrankungen, Anämie oder Malabsorptionserscheinungen aufweisen, und zwar in wesentlich höherem Maße als in der Normalbevölkerung. Man geht davon aus, dass die endomysialen Komponenten von Antikörpern (EMA) gegen tTG gegen die Zelloberflächen-Transglutaminase gerichtet sind, und diese Antikörper werden immer noch zur Bestätigung einer Zöliakie-Diagnose verwendet. Eine Studie aus dem Jahr 2006 hat jedoch gezeigt, dass es sich bei EMA-negativen Zöliakie-Betroffenen eher um ältere Männer mit schwereren Unterleibssymptomen und einer geringeren Häufigkeit "atypischer" Symptome, einschließlich Autoimmunerkrankungen, handelt. In dieser Studie korrelierten die Anti-TTG-Antikörperablagerungen nicht mit dem Schweregrad der Zottenzerstörung. Diese Ergebnisse in Verbindung mit neueren Arbeiten, die zeigen, dass Gliadin eine angeborene Reaktionskomponente hat, lassen vermuten, dass Gliadin eher für die primären Manifestationen der Zöliakie verantwortlich ist, während tTG ein größerer Faktor für sekundäre Auswirkungen wie allergische Reaktionen und sekundäre Autoimmunerkrankungen ist. Bei einem großen Prozentsatz der Zöliakiebetroffenen erkennen die Anti-TTG-Antikörper auch ein Rotavirus-Protein namens VP7. Diese Antikörper stimulieren die Proliferation von Monozyten, und eine Rotavirus-Infektion könnte einige frühe Schritte in der Kaskade der Immunzellproliferation erklären. ⓘ
Frühere Studien über Rotavirus-Schäden im Darm haben nämlich gezeigt, dass diese zu einer Zottenatrophie führen. Dies deutet darauf hin, dass virale Proteine an der anfänglichen Abflachung beteiligt sein könnten und die selbst kreuzreaktive Anti-VP7-Produktion stimulieren. Antikörper gegen VP7 können auch die Heilung verlangsamen, bis die Gliadin-vermittelte tTG-Präsentation eine zweite Quelle für kreuzreaktive Antikörper bietet. ⓘ
Andere Darmerkrankungen können in der Biopsie wie eine Zöliakie aussehen, einschließlich durch Candida verursachte Läsionen. ⓘ
Zottenatrophie und Malabsorption
Der durch T-Zellen vermittelte Entzündungsprozess führt zu einer Störung der Struktur und Funktion der Dünndarmschleimhaut und verursacht eine Malabsorption, da er die Fähigkeit des Körpers beeinträchtigt, Nährstoffe, Mineralien und fettlösliche Vitamine A, D, E und K aus der Nahrung aufzunehmen. Aufgrund der verringerten Darmoberfläche und der verminderten Laktaseproduktion kann es zu einer Laktoseintoleranz kommen, die jedoch in der Regel wieder verschwindet, sobald die Erkrankung behandelt wird. ⓘ
Es wurden alternative Ursachen für diese Gewebeschäden vorgeschlagen, die die Freisetzung von Interleukin 15 und die Aktivierung des angeborenen Immunsystems durch ein kürzeres Glutenpeptid (p31-43/49) betreffen. Dies würde die Abtötung von Enterozyten durch Lymphozyten im Epithel auslösen. Die bei der Biopsie festgestellte Zottenatrophie kann auch auf andere Ursachen zurückzuführen sein, wie z. B. tropische Sprue, Giardiasis und Strahlenenteritis. Ein positiver serologischer Befund und eine typische Biopsie sind zwar höchst suggestiv für eine Zöliakie, doch bei fehlendem Ansprechen auf die Diät müssen diese alternativen Diagnosen in Betracht gezogen werden. ⓘ
Diagnose
Die Diagnose ist oft schwierig, und auch im Jahr 2019 sind die Ärzte noch nicht ausreichend über die unterschiedlichen Erscheinungsformen der Zöliakie und die Diagnosekriterien informiert, so dass die meisten Fälle mit großer Verzögerung diagnostiziert werden. Es kann bis zu 12 Jahre dauern, bis eine Diagnose gestellt wird, und in den meisten Ländern erhält die Mehrheit der Betroffenen nie eine Diagnose. ⓘ
Es können mehrere Tests durchgeführt werden. Das Ausmaß der Symptome kann die Reihenfolge der Tests bestimmen, aber alle Tests verlieren ihren Nutzen, wenn die Person bereits eine glutenfreie Diät einhält. Darmschäden heilen innerhalb weniger Wochen, nachdem Gluten aus der Ernährung gestrichen wurde, und die Antikörperspiegel sinken über Monate hinweg. Bei Personen, die bereits eine glutenfreie Diät begonnen haben, kann es notwendig sein, eine erneute Provokation mit einem glutenhaltigen Lebensmittel in einer Mahlzeit pro Tag über einen Zeitraum von sechs Wochen durchzuführen, bevor die Untersuchungen wiederholt werden. ⓘ
Blutuntersuchungen
Serologische Bluttests sind die erste Untersuchung, die für die Diagnose einer Zöliakie erforderlich ist. Ihre Empfindlichkeit korreliert mit dem Ausmaß der histologischen Läsionen. Bei Personen mit geringfügigen Dünndarmschäden kann ein seronegativer Befund vorliegen, so dass viele Zöliakiepatienten häufig übersehen werden. Bei Patienten mit Zottenatrophie können Anti-Endomysial (EMA)-Antikörper vom Immunglobulin A (IgA)-Typ Zöliakie mit einer Sensitivität und Spezifität von 90 % bzw. 99 % nachweisen. Der serologische Nachweis von Anti-Transglutaminase-Antikörpern (Anti-TTG) wurde ursprünglich mit einer höheren Sensitivität (99 %) und Spezifität (>90 %) angegeben. Inzwischen geht man jedoch davon aus, dass er ähnliche Eigenschaften wie Anti-Endomysial-Antikörper aufweist. Sowohl Anti-Transglutaminase- als auch Anti-Endomysial-Antikörper haben eine hohe Sensitivität für die Diagnose von Personen mit klassischen Symptomen und kompletter Zottenatrophie, werden aber nur in 30-89 % der Fälle mit partieller Zottenatrophie und in weniger als 50 % der Personen mit leichten Schleimhautläsionen (duodenale Lymphozytose) mit normalen Zotten gefunden. ⓘ
Gewebetransglutaminase modifiziert Glutenpeptide in eine Form, die das Immunsystem effektiver stimulieren kann. Diese Peptide werden durch tTG auf zwei Arten modifiziert: Deamidierung oder Transamidierung. Moderne Anti-tTG-Tests basieren auf einem rekombinanten menschlichen Protein als Antigen. tTG-Tests sollten zuerst durchgeführt werden, da sie einfacher durchzuführen sind. Bei einem zweideutigen Ergebnis des tTG-Tests sollten anschließend Anti-Endomysial-Antikörper bestimmt werden. ⓘ
In den Leitlinien wird empfohlen, parallel dazu den IgA-Gesamtserumspiegel zu bestimmen, da Zöliakiebetroffene mit IgA-Mangel möglicherweise nicht in der Lage sind, die Antikörper zu produzieren, von denen diese Tests abhängen ("falsch negativ"). Bei diesen Personen können IgG-Antikörper gegen Transglutaminase (IgG-tTG) diagnostisch sein. ⓘ
Wenn alle diese Antikörper negativ sind, sollten Anti-DGP-Antikörper (Antikörper gegen deamidierte Gliadinpeptide) bestimmt werden. Anti-DGP-Antikörper der Klasse IgG können bei Personen mit IgA-Mangel nützlich sein. Bei Kindern, die jünger als zwei Jahre sind, schneiden Anti-DGP-Antikörper besser ab als Anti-Endomysial- und Anti-Transglutaminase-Antikörper-Tests. ⓘ
Wegen der großen Tragweite der Zöliakie-Diagnose wird in den Leitlinien empfohlen, nach einem positiven Bluttest eine Endoskopie/Gastroskopie und Biopsie durchzuführen. Ein negativer Serologietest kann immer noch eine Empfehlung für eine Endoskopie und eine Zwölffingerdarmbiopsie nach sich ziehen, wenn der klinische Verdacht hoch bleibt. ⓘ
In der Vergangenheit wurden drei weitere Antikörper gemessen: Anti-Reticulin (ARA), Anti-Gliadin (AGA) und Anti-Endomysial (EMA)-Antikörper. Der ARA-Test ist jedoch für die Routinediagnostik nicht genau genug. Bei Kleinkindern kann die Serologie unzuverlässig sein, wobei Anti-Gliadin bei Kindern unter fünf Jahren etwas besser abschneidet als andere Tests. Serologische Tests basieren auf indirekter Immunfluoreszenz (Retikulin, Gliadin und Endomysium) oder ELISA (Gliadin oder Gewebetransglutaminase, tTG). ⓘ
Andere Antikörper wie z. B. Anti-Saccharomyces-cerevisiae-Antikörper treten bei einigen Zöliakiebetroffenen, aber auch bei anderen Autoimmunerkrankungen und bei etwa 5 % der Blutspender auf. ⓘ
Der Antikörpertest kann mit einem HLA-Test kombiniert werden, wenn die Diagnose unklar ist. TGA- und EMA-Tests sind die empfindlichsten Serum-Antikörpertests, aber da ein negativer HLA-DQ-Typ die Diagnose Zöliakie ausschließt, maximiert ein Test auf HLA-DQ2 oder DQ8 die Empfindlichkeit und den negativen Vorhersagewert. Im Vereinigten Königreich empfiehlt das National Institute for Health and Clinical Excellence (NICE) (Stand 2015) die HLA-Typisierung nicht zum Ausschluss der Zöliakie außerhalb einer spezialisierten Einrichtung, z. B. bei Kindern, bei denen keine Biopsie durchgeführt wird, oder bei Patienten, die bereits eine eingeschränkte Glutenaufnahme haben und sich gegen eine Glutenprobe entscheiden. ⓘ
Endoskopie


Es wird eine obere Endoskopie mit Biopsie des Duodenums (jenseits des Bulbus duodeni) oder des Jejunums durchgeführt, um mehrere Proben (vier bis acht) aus dem Duodenum zu gewinnen. Nicht alle Bereiche können gleichermaßen betroffen sein; wenn Biopsien aus gesundem Darmgewebe entnommen werden, wäre das Ergebnis falsch negativ. Selbst in ein und demselben bioptischen Fragment können unterschiedliche Grade der Schädigung vorhanden sein. ⓘ
Die meisten Menschen mit Zöliakie haben einen Dünndarm, der bei der Endoskopie vor der Untersuchung der Biopsien normal zu sein scheint. Fünf Befunde werden jedoch mit einer hohen Spezifität für Zöliakie in Verbindung gebracht: Ausbuchtungen der Dünndarmfalten (siehe Abbildung), ein Mangel an Falten, ein Mosaikmuster in der Schleimhaut (beschrieben als "Cracked-Mud"-Erscheinung), hervorstehende Blutgefäße in der Submukosa und ein knotiges Muster in der Schleimhaut. ⓘ
In den europäischen Leitlinien heißt es, dass bei Kindern und Jugendlichen mit Symptomen, die mit einer Zöliakie vereinbar sind, die Diagnose ohne Darmbiopsie gestellt werden kann, wenn die Titer der anti-tTG-Antikörper sehr hoch sind (das 10-fache der oberen Grenze des Normalbereichs). ⓘ
Bis in die 1970er Jahre wurden Biopsien mit Hilfe von Metallkapseln gewonnen, die an einer Saugvorrichtung befestigt waren. Die Kapsel wurde geschluckt und in den Dünndarm eingeführt. Nachdem die Position der Kapsel durch Röntgenstrahlen überprüft worden war, wurde ein Teil der Darmwand in der Kapsel abgesaugt. Häufig eingesetzte Kapselsysteme waren die Watson-Kapsel und die Crosby-Kugler-Kapsel. Diese Methode ist inzwischen weitgehend durch die faseroptische Endoskopie ersetzt worden, die eine höhere Empfindlichkeit und eine geringere Fehlerhäufigkeit aufweist. ⓘ
Die Kapselendoskopie (CE) ermöglicht die Identifizierung typischer Schleimhautveränderungen, die bei Zöliakie beobachtet werden, hat jedoch eine geringere Empfindlichkeit als die reguläre Endoskopie und die Histologie. Die CE ist daher nicht das primäre Diagnoseinstrument für Zöliakie. Allerdings kann die CE zur Diagnose von T-Zell-Lymphomen, ulzerativer Jejunoileitis und Adenokarzinomen bei refraktärer oder komplizierter Zöliakie eingesetzt werden. ⓘ
Pathologie

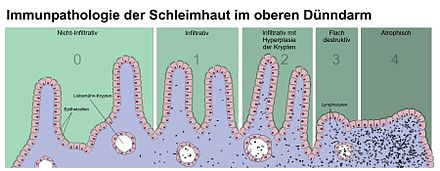
Wird der Verdacht auf das Vorliegen einer Zöliakie durch positive Antikörperbefunde erhärtet, kann die Diagnose entsprechend den Empfehlungen der Europäischen Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN) durch eine Dünndarmbiopsie gesichert werden. Dabei werden – heutzutage zumeist mittels einer Magen- und teilweisen Dünndarmspiegelung (Gastroduodenoskopie) – kleine Schleimhautproben aus dem absteigenden Duodenum entnommen. Es gelingt nicht immer, die geeignete Lokalisation zur Biopsie zu finden. Die entnommenen Gewebestücke werden von einem Pathologen feingeweblich am Mikroskop untersucht, wobei zunächst bei geringer Vergrößerung (50fach) der Aufbau der Dünndarmschleimhaut beurteilt wird. Bei stärkerer Vergrößerung wird anschließend untersucht, ob die Schleimhaut eine Vermehrung von Entzündungszellen aufweist. Für die Diagnose einer Zöliakie sind hierbei die innerhalb der Deckschicht (Epithel) gelegenen Lymphozyten entscheidend. Bei grenzwertigen Befunden kann die histologische Standardfärbung noch um eine Immunhistologie erweitert werden, mit der sich die intraepithelialen Lymphozyten besser quantifizieren lassen. Goldstandard für die Beurteilung der Dünndarmbiopsie sind die sogenannten Marsh-Kriterien: Zahl der in die Schleimhaut eingewanderten Lymphozyten, Zottenlänge im Verhältnis zu den Krypten, Zellteilungsrate, Anzahl der Entzündungszellen in der Lamina propria (Darmwandschicht direkt unterhalb des Epithels) und Beurteilung des Bürstensaums in einer speziellen Färbung (PAS-Färbung). Für die Diagnose Zöliakie sind die Marsh 2- oder Marsh 3-Kriterien erforderlich:
- Marsh 2: ≥ 25 intraepitheliale Lymphozyten / 100 Enterozyten + Hyperplasie der Lieberkühn-Krypten
- Marsh 3: ≥ 25 intraepitheliale Lymphozyten / 100 Enterozyten + Kryptenhyperplasie + Zottenatrophie. ⓘ
Eine andere, beispielsweise infektiöse Ursache der Entzündung sollte durch eine Suche nach Mikroorganismen wie Tropheryma whipplei, Giardien und Kryptosporidien ausgeschlossen werden. Die 1990 revidierten diagnostischen Kriterien der ESPGHAN fordern zudem eine klare klinische Besserung nach Einleitung der Therapie. Kontrollbiopsien, die früher noch üblich waren, sind demnach nur bei spezieller Indikation angezeigt wie zweifelhaftem klinischem Erfolg unter glutenfreier Diät, Zweifel an der Initialdiagnose oder zur Abgrenzung gegen eine vorübergehende Glutenintoleranz. ⓘ
Die 1992 eingeführte Marsh-Klassifikation wurde 1999 auf sechs Stadien geändert, wobei das bisherige Stadium 3 in drei Unterstadien aufgeteilt wurde. Weitere Studien zeigten, dass dieses System nicht immer zuverlässig war und dass die bei Zöliakie beobachteten Veränderungen in einem der drei Stadien beschrieben werden konnten:
- A steht für eine lymphozytäre Infiltration mit normalem Zottenbild;
- B1, das eine partielle Zottenatrophie beschreibt, und
- B2, das eine vollständige Zottenatrophie beschreibt. ⓘ
Die Veränderungen verbessern sich in der Regel oder kehren sich um, wenn Gluten aus der Ernährung gestrichen wird. In den meisten Leitlinien wird jedoch keine erneute Biopsie empfohlen, es sei denn, die Symptome bessern sich unter der Diät nicht. In einigen Fällen kann eine gezielte Glutenbelastung mit anschließender Biopsie durchgeführt werden, um die Diagnose zu bestätigen oder zu widerlegen. Eine normale Biopsie und eine normale Serologie nach der Provokation weisen darauf hin, dass die Diagnose möglicherweise falsch gestellt wurde. ⓘ
Bei unbehandelter Zöliakie ist eine Zottenatrophie bei Kindern unter drei Jahren häufiger anzutreffen, während bei älteren Kindern und Erwachsenen häufig kleinere Darmläsionen (duodenale Lymphozytose) mit normalen Darmzotten zu finden sind. ⓘ
Andere diagnostische Tests
Zum Zeitpunkt der Diagnose können weitere Untersuchungen durchgeführt werden, um Komplikationen wie Eisenmangel (durch ein vollständiges Blutbild und Eisenuntersuchungen), Folsäure- und Vitamin-B12-Mangel und Hypokalzämie (niedrige Kalziumwerte, oft aufgrund eines verminderten Vitamin-D-Spiegels) festzustellen. Bei Blutuntersuchungen können Schilddrüsenfunktionstests angefordert werden, um eine Schilddrüsenunterfunktion festzustellen, die bei Zöliakiepatienten häufiger vorkommt. ⓘ
Osteopenie und Osteoporose, d. h. eine leichte und schwere Verminderung der Knochenmineraldichte, sind bei Zöliakiepatienten häufig anzutreffen. Bei der Diagnosestellung können Untersuchungen zur Messung der Knochendichte durchgeführt werden, z. B. eine Dual-Energy-Röntgenabsorptiometrie (DXA), um das Frakturrisiko und den Bedarf an Knochenschutzmitteln zu ermitteln. ⓘ
Glutenentzug
Obwohl Blutantikörpertests, Biopsien und Gentests in der Regel eine eindeutige Diagnose liefern, wird gelegentlich die Reaktion auf einen Glutenentzug mit einer glutenfreien Diät benötigt, um die Diagnose zu bestätigen. Bei Patienten mit Darmläsionen, die mit Zöliakie vereinbar sind, und einer positiven Reaktion auf eine glutenfreie Diät ist eine Glutenprobe zur Bestätigung der Diagnose derzeit nicht mehr erforderlich. Dennoch kann in einigen Fällen eine Glutenprobe mit anschließender Biopsie zur Unterstützung der Diagnose nützlich sein, z. B. bei Personen mit hohem Zöliakieverdacht ohne Biopsiebestätigung, die negative Blutantikörper haben und bereits eine glutenfreie Diät einhalten. Vor dem Alter von 5 Jahren und während der Pubertät wird von einer Glutenkontrolle abgeraten. Die alternative Diagnose einer Nicht-Zöliakie-Glutensensitivität kann gestellt werden, wenn es nur symptomatische Hinweise auf eine Glutensensitivität gibt. Die gastrointestinalen und extraintestinalen Symptome von Menschen mit nicht-zöliakischer Glutensensitivität können denen der Zöliakie ähneln und bessern sich, wenn Gluten aus der Ernährung gestrichen wird, nachdem Zöliakie und Weizenallergie hinreichend ausgeschlossen wurden. ⓘ
Bei bis zu 30 % der Betroffenen treten die Symptome nach Beginn einer glutenfreien Diät weiterhin auf oder entwickeln sich neu. Eine sorgfältige Interpretation der symptomatischen Reaktion ist erforderlich, da ein Ausbleiben der Reaktion bei einer Person mit Zöliakie auf die fortgesetzte Aufnahme kleiner Mengen von Gluten, entweder freiwillig oder versehentlich, oder auf andere, häufig damit verbundene Erkrankungen wie bakterielle Überwucherung des Dünndarms (SIBO), Laktoseintoleranz, Fruktose-, Saccharose- und Sorbit-Malabsorption, exokrine Pankreasinsuffizienz und mikroskopische Kolitis zurückzuführen sein kann, neben anderen. Bei unbehandelter Zöliakie handelt es sich häufig um vorübergehende Zustände, die auf die Darmschädigung zurückzuführen sind. Sie bilden sich in der Regel einige Monate nach Beginn einer glutenfreien Diät zurück oder bessern sich, erfordern aber möglicherweise vorübergehende Maßnahmen wie die Supplementierung mit Pankreasenzymen, die Einschränkung von laktose-, fructose-, sucrose- oder sorbithaltigen Lebensmitteln oder die Behandlung mit oralen Antibiotika im Falle einer damit verbundenen bakteriellen Überwucherung. Zusätzlich zum Glutenentzug müssen manche Menschen eine FODMAP-arme Diät einhalten oder den Verzehr kommerzieller glutenfreier Produkte vermeiden, die in der Regel reich an Konservierungs- und Zusatzstoffen (wie Sulfite, Glutamate, Nitrate und Benzoate) sind und bei der Auslösung funktioneller gastrointestinaler Symptome eine Rolle spielen könnten. ⓘ
Screening
Der Nutzen eines Screenings ist umstritten. Im Jahr 2017 fand die United States Preventive Services Task Force keine ausreichenden Beweise, um eine Empfehlung für Personen ohne Symptome auszusprechen. Im Vereinigten Königreich empfiehlt das National Institute for Health and Clinical Excellence (NICE) Tests auf Zöliakie bei Verwandten ersten Grades von Personen, bei denen die Krankheit bereits bestätigt wurde, bei Menschen mit anhaltender Müdigkeit, Bauch- oder Magen-Darm-Symptomen, Wachstumsverzögerungen, unerklärlichem Gewichtsverlust oder Eisen-, Vitamin-B12- oder Folsäuremangel, schweren Mundgeschwüren und bei Diagnosen von Typ-1-Diabetes, Autoimmunerkrankungen der Schilddrüse sowie bei neu diagnostiziertem chronischem Müdigkeitssyndrom und Reizdarmsyndrom. Die Dermatitis herpetiformis ist in anderen Empfehlungen enthalten. Das NICE empfiehlt außerdem, serologische Tests auf Zöliakie bei Menschen mit metabolischen Knochenerkrankungen (verminderte Knochenmineraldichte oder Osteomalazie), ungeklärten neurologischen Störungen (wie peripherer Neuropathie und Ataxie), Fruchtbarkeitsstörungen oder wiederholten Fehlgeburten, anhaltend erhöhten Leberenzymen unbekannter Ursache, Zahnschmelzdefekten und der Diagnose Down-Syndrom oder Turner-Syndrom anzubieten. ⓘ
Es gibt Hinweise darauf, dass eine frühzeitige Erkennung das Risiko für gesundheitliche Komplikationen wie Osteoporose, Anämie, bestimmte Krebsarten, neurologische Störungen, Herz-Kreislauf-Erkrankungen und Fortpflanzungsprobleme verringern kann. Sie empfehlen daher ein Screening bei Menschen mit bestimmten Gesundheitsproblemen. ⓘ
Die Serologie wurde als Screening-Maßnahme vorgeschlagen, da das Vorhandensein von Antikörpern einige bisher nicht diagnostizierte Fälle von Zöliakie aufdecken und deren Komplikationen bei diesen Personen verhindern könnte. Serologische Tests haben jedoch nur bei Personen mit vollständiger Zottenatrophie eine hohe Sensitivität und sind nur in sehr geringem Maße in der Lage, Fälle mit partieller Zottenatrophie oder kleineren Darmläsionen zu erkennen. Die Untersuchung auf Zöliakie kann Personen angeboten werden, die häufig an einer Zöliakie erkrankt sind. ⓘ
Behandlung
Ernährung
Derzeit besteht die einzige wirksame Behandlung in einer lebenslangen glutenfreien Diät. Es gibt keine Medikamente, die Schäden verhindern oder den Körper daran hindern, den Darm anzugreifen, wenn Gluten vorhanden ist. Die strikte Einhaltung der Diät unterstützt die Heilung des Darms, was in den meisten Fällen zum Verschwinden aller Symptome führt und, je nachdem, wie schnell mit der Diät begonnen wird, auch das erhöhte Risiko von Osteoporose und Darmkrebs sowie in einigen Fällen Sterilität beseitigen kann. Die Diät kann mühsam sein; die Nichteinhaltung der Diät kann zu Rückfällen führen. ⓘ
In der Regel wird ein Diätassistent hinzugezogen, um sicherzustellen, dass der Betroffene weiß, welche Lebensmittel Gluten enthalten, welche Lebensmittel unbedenklich sind und wie er sich trotz der Einschränkungen ausgewogen ernähren kann. In vielen Ländern sind glutenfreie Produkte auf Rezept erhältlich und können von den Krankenkassen erstattet werden. Glutenfreie Produkte sind in der Regel teurer und schwieriger zu finden als herkömmliche glutenhaltige Lebensmittel. Da Fertigerzeugnisse oft Spuren von Gluten enthalten, müssen manche Zöliakiebetroffene selbst kochen. ⓘ
Der Begriff "glutenfrei" wird in der Regel verwendet, um auf einen vermeintlich unbedenklichen Glutengehalt hinzuweisen und nicht auf die völlige Abwesenheit von Gluten. Der genaue Wert, ab dem Gluten unbedenklich ist, ist unsicher und umstritten. Eine kürzlich durchgeführte systematische Überprüfung kam zu dem vorläufigen Schluss, dass es unwahrscheinlich ist, dass der Verzehr von weniger als 10 mg Gluten pro Tag histologische Anomalien verursacht, obwohl nur wenige zuverlässige Studien durchgeführt wurden. Die Kennzeichnung "glutenfrei" ist unterschiedlich geregelt. In der Europäischen Union hat die Europäische Kommission 2009 Vorschriften erlassen, die die Verwendung der Kennzeichnung "glutenfrei" für Lebensmittel auf Produkte mit weniger als 20 mg/kg Gluten und die Kennzeichnung "sehr geringer Glutengehalt" für Produkte mit weniger als 100 mg/kg Gluten beschränken. In den Vereinigten Staaten hat die FDA 2013 Vorschriften erlassen, die die Verwendung der Kennzeichnung "glutenfrei" für Lebensmittel auf Produkte mit weniger als 20 ppm Gluten beschränken. Die aktuelle internationale Norm des Codex Alimentarius erlaubt 20 ppm Gluten in sogenannten glutenfreien" Lebensmitteln. ⓘ
Eine glutenfreie Ernährung verbessert die gesundheitsbezogene Lebensqualität, und eine strikte Einhaltung der Diät bringt mehr Vorteile als eine unvollständige Einhaltung. Dennoch führt eine glutenfreie Ernährung nicht zu einer vollständigen Normalisierung der Lebensqualität. ⓘ
Refraktäre Krankheit
Zwischen 0,3 % und 10 % der Menschen leiden an einer refraktären Erkrankung, d. h. sie haben eine anhaltende Zottenatrophie bei glutenfreier Ernährung, obwohl sie seit mehr als 12 Monaten keinem Gluten mehr ausgesetzt sind. Dennoch ist eine unbeabsichtigte Glutenexposition die Hauptursache für eine persistierende Zottenatrophie und muss ausgeschlossen werden, bevor die Diagnose einer refraktären Erkrankung gestellt wird. Menschen mit unzureichender Grundausbildung und mangelndem Verständnis der glutenfreien Ernährung glauben oft, dass sie die Diät strikt einhalten, machen aber regelmäßig Fehler. Auch das Fehlen von Symptomen ist kein zuverlässiger Indikator für eine Erholung des Darms. ⓘ
Wenn andere Ursachen für die Zottenatrophie ausgeschlossen wurden, können in diesem Fall Steroide oder Immunsuppressiva (wie Azathioprin) in Betracht gezogen werden. ⓘ
Nicht zu verwechseln ist die refraktäre Zöliakie mit dem Fortbestehen von Symptomen trotz Glutenentzug, die durch vorübergehende, von der Darmschädigung herrührende Zustände verursacht werden, die sich in der Regel einige Monate nach Beginn einer glutenfreien Diät zurückbilden oder bessern, wie z. B. bakterielle Überwucherung des Dünndarms, Laktoseintoleranz, Fruktose-, Saccharose- und Sorbitmalabsorption, exokrine Pankreasinsuffizienz und mikroskopische Kolitis. ⓘ
Epidemiologie
Weltweit ist zwischen 1 von 100 und 1 von 170 Personen von Zöliakie betroffen. Die Raten variieren jedoch zwischen den verschiedenen Regionen der Welt und reichen von 1:300 bis zu 1:40. In den Vereinigten Staaten geht man davon aus, dass zwischen 1 von 1750 (definiert als klinische Erkrankung einschließlich Dermatitis herpetiformis mit begrenzten Symptomen im Verdauungstrakt) und 1 von 105 (definiert durch das Vorhandensein von IgA TG bei Blutspendern) betroffen ist. Aufgrund der unterschiedlichen Anzeichen und Symptome geht man davon aus, dass etwa 85 % der Betroffenen nicht diagnostiziert werden. Der Prozentsatz der Menschen mit klinisch diagnostizierter Krankheit (Symptome, die zu einer diagnostischen Untersuchung führen) liegt in verschiedenen Studien bei 0,05-0,27 %. Bevölkerungsstudien aus Teilen Europas, Indiens, Südamerikas, Australasiens und der USA (unter Verwendung von Serologie und Biopsie) deuten jedoch darauf hin, dass der Prozentsatz der Erkrankten bei Kindern zwischen 0,33 und 1,06 % (in einer Studie mit Kindern des prädisponierten Volkes der Sahrauis jedoch 5,66 %) und bei Erwachsenen 0,18 bis 1,2 % betragen kann. Unter den Personen in der Primärversorgung, die über gastrointestinale Symptome berichten, liegt die Zöliakie-Rate bei etwa 3 %. In Australien leidet etwa 1 von 70 Personen an dieser Krankheit. In Iran, Israel, Syrien und der Türkei liegt die Rate bei erwachsenen Blutspendern bei 0,60 %, 0,64 %, 1,61 % bzw. 1,15 %. ⓘ
Bei Menschen afrikanischer, japanischer und chinesischer Abstammung wird die Krankheit nur selten diagnostiziert, was auf eine wesentlich geringere Prävalenz der genetischen Risikofaktoren, wie z. B. HLA-B8, zurückzuführen ist. Menschen indischer Abstammung scheinen ein ähnliches Risiko zu haben wie Menschen westlich-kaukasischer Abstammung. Bevölkerungsstudien deuten auch darauf hin, dass ein großer Teil der Zöliakiekranken nicht diagnostiziert wird, was zum Teil darauf zurückzuführen ist, dass viele Kliniker mit der Krankheit nicht vertraut sind, und auch darauf, dass sie asymptomatisch sein kann. Zöliakie tritt bei Frauen etwas häufiger auf als bei Männern. Eine große multizentrische Studie in den USA ergab eine Prävalenz von 0,75 % in Nicht-Risikogruppen, die auf 1,8 % bei symptomatischen Personen, 2,6 % bei Verwandten zweiten Grades (wie Großeltern, Tante oder Onkel, Enkelkinder usw.) einer Person mit Zöliakie und 4,5 % bei Verwandten ersten Grades (Geschwister, Eltern oder Kinder) anstieg. Dieses Profil ist mit der Prävalenz in Europa vergleichbar. Andere Bevölkerungsgruppen mit einem erhöhten Zöliakie-Risiko, deren Prävalenzraten zwischen 5 und 10 % liegen, sind Personen mit Down- und Turner-Syndrom, Typ-1-Diabetes und Autoimmunerkrankungen der Schilddrüse, einschließlich Hyperthyreose (Schilddrüsenüberfunktion) und Hypothyreose (Schilddrüsenunterfunktion). ⓘ
In der Vergangenheit galt die Zöliakie mit einer Prävalenz von etwa 0,02 % als selten. Der Grund für den jüngsten Anstieg der gemeldeten Fälle ist unklar. Möglicherweise ist er zumindest teilweise auf Veränderungen in der diagnostischen Praxis zurückzuführen. Außerdem scheint es einen etwa 4,5-fachen Anstieg zu geben, der möglicherweise auf eine geringere Exposition gegenüber Bakterien und anderen Krankheitserregern in der westlichen Umwelt zurückzuführen ist. In den Vereinigten Staaten liegt das Durchschnittsalter bei der Diagnose bei 38 Jahren. Bei etwa 20 Prozent der Zöliakiepatienten wird die Diagnose nach dem 60. ⓘ
Die Häufigkeit der Erkrankung schwankt in verschiedenen Ländern erheblich. Außerdem unterscheiden sich die Häufigkeitsangaben danach, ob die Diagnose erst aufgrund von klinischen Symptomen oder schon aufgrund eines Suchtests im Serum gestellt wird. Unter alleiniger Berücksichtigung der symptomatischen Fälle reicht die Häufigkeit (Prävalenz) von 1:10.000 (Dänemark, USA) bis zu 1:300 (Schweden, Großbritannien). Weltweit wird eine durchschnittliche Häufigkeit von etwa 1:3350 angegeben. Zieht man auch die durch Screeninguntersuchungen diagnostizierten Fälle hinzu, erhöht sich die Prävalenz auf 1:500 in Deutschland und Dänemark und etwa 1:110 in den USA und Großbritannien, im weltweiten Durchschnitt ungefähr auf 1:270. Steigende Erkrankungszahlen in Schweden bei gleichzeitig konstant bleibender Häufigkeit im genetisch verwandten Norddänemark werden auf eine in Schweden übliche frühe Zufütterung von getreidehaltiger Beikost im Säuglingsalter zurückgeführt. Allzu frühes Zufüttern scheint das Risiko für eine Zöliakie zu erhöhen. Bei Menschen mit dem Down-Syndrom (Trisomie 21) wird das Auftreten einer Zöliakie zudem etwas häufiger beobachtet als bei Menschen ohne diese chromosomale Fehlbildung. ⓘ
Die Zöliakie hat zwei Manifestationsgipfel: einen im Säuglingsalter und einen im vierten Lebensjahrzehnt. Frauen sind häufiger betroffen als Männer. ⓘ
Eine Untersuchung von Blutkonserven, die um das Jahr 1950 angelegt wurden, und von Blutproben einer vergleichbaren Bevölkerungsgruppe aus dem Jahr 2005 zeigte auf, dass sich die Erkrankungsrate in diesem Zeitraum verfünffacht hat. Zudem ergab die Kohortenanalyse, dass langfristig betrachtet das Sterberisiko von Personen mit unerkannter und daher nicht mit glutenfreier Diät behandelter Zöliakie um ein Vielfaches höher lag als das von Personen ohne Zöliakie. ⓘ
Geschichte
Der Begriff "Zöliakie" stammt aus dem Griechischen κοιλιακός (koiliakós, "Bauch") und wurde im 19. Jahrhundert in einer Übersetzung dessen eingeführt, was allgemein als eine altgriechische Beschreibung der Krankheit durch Aretaeus von Kappadokien gilt. ⓘ
Die Menschen begannen in der Jungsteinzeit (ab ca. 9500 v. Chr.) im Fruchtbaren Halbmond in Westasien mit dem Getreideanbau, und wahrscheinlich trat die Zöliakie vor dieser Zeit nicht auf. Aretaeus von Kappadokien, der im zweiten Jahrhundert in der gleichen Gegend lebte, berichtete über ein malabsorptives Syndrom mit chronischem Durchfall, das eine Schwächung des gesamten Körpers zur Folge hatte. Seine "Cœliac Affection" (coeliac von griechisch κοιλιακός koiliakos, "abdominal") erregte die Aufmerksamkeit der westlichen Medizin, als Francis Adams 1856 der Sydenham Society eine Übersetzung von Aretaeus' Werk vorstellte. Der in Aretaeus' Werk beschriebene Patient litt unter Bauchschmerzen und war atrophiert, blass, kraftlos und arbeitsunfähig. Der Durchfall äußerte sich in lockerem Stuhl, der weiß, übelriechend und blähend war, und die Krankheit war hartnäckig und kehrte immer wieder zurück. Das Problem, so glaubte Aretaeus, war ein Mangel an Wärme im Magen, die für die Verdauung der Nahrung notwendig ist, und eine verminderte Fähigkeit, die Verdauungsprodukte im Körper zu verteilen, wobei diese unvollständige Verdauung zu Durchfall führt. Diese unvollständige Verdauung führe zu Durchfall. Er betrachtete dies als ein Leiden der alten Menschen, das vor allem Frauen betraf, wobei er Kinder ausdrücklich ausschloss. Die Ursache, so Aretaeus, sei manchmal entweder eine andere chronische Krankheit oder auch der Genuss "eines reichlichen Zuges kalten Wassers". ⓘ
Der Kinderarzt Samuel Gee beschrieb 1887 in einer Vorlesung im Hospital for Sick Children, Great Ormond Street, London, erstmals die Krankheit bei Kindern in der heutigen Zeit. Gee erkannte frühere Beschreibungen und Bezeichnungen für die Krankheit an und übernahm den gleichen Begriff wie Aretaeus (Zöliakie). Er stellte scharfsinnig fest: "Wenn der Patient überhaupt geheilt werden kann, dann nur durch eine Diät". Gee erkannte, dass Milchunverträglichkeiten bei Zöliakie-Kindern ein Problem darstellen und dass stark gestärkte Nahrungsmittel vermieden werden sollten. Er verbot jedoch Reis, Sago, Obst und Gemüse, die alle unbedenklich zu essen gewesen wären, und empfahl rohes Fleisch sowie dünne Scheiben getoastetes Brot. Gee berichtete von besonderen Erfolgen bei einem Kind, "das täglich mit einem Viertel der besten holländischen Muscheln gefüttert wurde". Allerdings konnte das Kind diese Diät nicht länger als eine Saison ertragen. ⓘ
Christian Archibald Herter, ein amerikanischer Arzt, schrieb 1908 ein Buch über Kinder mit Zöliakie, die er "intestinal infantilism" nannte. Er stellte fest, dass ihr Wachstum verzögert war und dass Fett besser vertragen wurde als Kohlenhydrate. Der Name Gee-Herter-Krankheit wurde manchmal verwendet, um beide Beiträge zu würdigen. Sidney V. Haas, ein amerikanischer Kinderarzt, berichtete 1924 über die positiven Auswirkungen einer Bananendiät. Diese Diät blieb so lange in Mode, bis die tatsächliche Ursache der Zöliakie geklärt war. ⓘ
Zwar wurde eine Rolle der Kohlenhydrate vermutet, doch erst in den 1940er Jahren stellte der niederländische Kinderarzt Dr. Willem Karel Dicke einen Zusammenhang mit Weizen her. Es ist wahrscheinlich, dass die klinische Verbesserung seiner Patienten während der niederländischen Hungersnot von 1944 (während der Mehl knapp war) zu seiner Entdeckung beigetragen hat. Dicke stellte fest, dass der Mangel an Brot dazu führte, dass die Sterblichkeitsrate bei Kindern, die an Zöliakie erkrankt waren, von mehr als 35 % auf praktisch null sank. Er berichtete auch, dass die Sterblichkeitsrate wieder auf das frühere Niveau anstieg, sobald nach dem Konflikt wieder Weizen verfügbar war. Der Zusammenhang mit dem Glutenanteil im Weizen wurde 1952 von einem Team aus Birmingham, England, hergestellt. Der britische Arzt John W. Paulley beschrieb 1954 die Zottenatrophie anhand von Proben, die bei einer Operation entnommen wurden. Dies ebnete den Weg für die Entnahme von Biopsieproben durch Endoskopie. ⓘ
In den 1960er Jahren wurden weitere Merkmale der Zöliakie aufgeklärt. Ihr erblicher Charakter wurde 1965 anerkannt. Im Jahr 1966 wurde die Dermatitis herpetiformis mit der Glutensensitivität in Verbindung gebracht. ⓘ
Der Ausdruck Zöliakie leitet sich vom altgriechischen κοιλία koilia, deutsch ‚Bauch‘, ‚Unterleib‘ (von κοίλος koilos, deutsch ‚hohl‘) ab. Die „bauchige Krankheit“ wurde von Aretaios von Kappadokien schon im zweiten Jahrhundert nach Christus erwähnt. Im Jahr 1725 starb Christian Henrich Heineken nach mehrmonatiger Leidensphase vermutlich an der seinerzeit unbekannten Zöliakie. Allgemein gilt Samuel Gee als Erstbeschreiber der Krankheit. Er berichtete 1888 von der „coeliac affection“ und meinte damit eine Verdauungsstörung, die vor allem Kleinkinder betraf. Erst 1950 wurde schließlich von Willem Karel Dicke das Weizengliadin als entscheidender schädlicher Faktor identifiziert. Erste Untersuchungen publizierte Dicke bereits 1941, nachdem ihm plötzliche Verbesserungen des Zustands an Zöliakie (seinerzeit als Gee-Herter-Syndrom bezeichnet) leidender Kinder aufgefallen waren, nachdem sie infolge der Mangelversorgung während des Krieges kaum mehr Getreideprodukte erhielten. Die Zottenatrophie wurde von Margot Shiner aus London 1957 erstmals beschrieben. Ein Jahr später erfolgte mit der Erstbeschreibung der Gliadin-Antikörper durch E. Berger aus Basel die Einführung der serologischen Diagnostik. ⓘ
Die neuen Erkenntnisse über das Krankheitsbild führten erstmals 1969 zur Verabschiedung der diagnostischen Kriterien für die Zöliakie durch die Europäische Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN), die sogenannten „Interlaken-Kriterien“. Diese gelten heute in der revidierten Fassung von 1990. Aus den 1980er Jahren datiert die Entdeckung der Endomysium-Antikörper als hochspezifischem serologischem Marker. Schließlich wurde 1997 die Gewebetransglutaminase (tTG) als entscheidendes Antigen für diese Antikörper erkannt. ⓘ
Gesellschaft und Kultur
Mehrere Zöliakie-Organisationen haben den Mai zum Monat der Sensibilisierung für Zöliakie" erklärt. ⓘ
Christliche Kirchen und die Eucharistie
Im Allgemeinen feiern die verschiedenen christlichen Konfessionen eine Eucharistie, bei der eine Oblate oder ein kleines Stück sakramentales Brot aus Weizenbrot gesegnet und dann gegessen wird. Eine typische Oblate wiegt etwa ein halbes Gramm. Weizenmehl enthält etwa 10 bis 13 % Gluten, so dass eine einzige Hostie mehr als 50 mg Gluten enthalten kann, eine Menge, die für viele Zöliakiebetroffene schädlich ist, vor allem, wenn sie täglich verzehrt wird (siehe Ernährung oben). ⓘ
Viele christliche Kirchen bieten ihren Kommunikanten glutenfreie Alternativen an, meist in Form von Crackern auf Reisbasis oder glutenfreiem Brot. Dazu gehören die Vereinigten Methodisten, die Christlich-Reformierten, die Episkopalen, die Anglikanische Kirche (Kirche von England, Vereinigtes Königreich) und die Lutheraner. Katholiken können aus dem Kelch allein empfangen oder um glutenreduzierte Hostien bitten; glutenfreie Hostien werden jedoch nicht als Weizenbrot betrachtet und sind daher ungültig. ⓘ
Römisch-katholischer Standpunkt
Die römisch-katholische Lehre besagt, dass für eine gültige Eucharistie das Brot, das in der Messe verwendet wird, aus Weizen hergestellt sein muss. Glutenarme Hostien erfüllen alle Anforderungen der katholischen Kirche, sind aber nicht völlig glutenfrei. Anträge auf Verwendung von Reisoblaten wurden abgelehnt. ⓘ
Für Priester ist die Angelegenheit noch komplizierter. Als Zelebrant ist ein Priester für die Fülle des Messopfers unbedingt verpflichtet, unter beiden Gestalten zu empfangen. Am 24. Juli 2003 erklärte die Glaubenskongregation: "Angesichts der zentralen Bedeutung der Eucharistiefeier im Leben eines Priesters muss man mit großer Vorsicht vorgehen, bevor man Kandidaten, die weder Gluten noch Alkohol ohne ernsthaften Schaden zu sich nehmen können, zu den heiligen Weihen zulässt." ⓘ
Seit Januar 2004 sind in den Vereinigten Staaten, Italien und Australien von der Kirche zugelassene Hostien mit extrem niedrigem Glutengehalt erhältlich. Im Juli 2017 verbot der Vatikan noch immer die Verwendung von glutenfreiem Brot für die Heilige Kommunion. ⓘ
Pessach
Das jüdische Pessachfest (Pessach) kann Probleme mit der Verpflichtung zum Verzehr von Matze bereiten, einem ungesäuerten Brot, das unter strengen Auflagen aus Weizen, Gerste, Dinkel, Hafer oder Roggen hergestellt wird. Dies schließt viele andere Getreidesorten aus, die normalerweise als Ersatz für Menschen mit Glutenempfindlichkeit verwendet werden, insbesondere für aschkenasische Juden, die auch Reis meiden. Viele koschere Pessach-Produkte enthalten überhaupt kein Getreide und sind daher glutenfrei. Als Getreidesubstitut wird hauptsächlich Kartoffelstärke verwendet. ⓘ
Schreibweise
Zöliakie ist die bevorzugte Schreibweise im britischen Englisch, während im nordamerikanischen Englisch in der Regel Zöliakie verwendet wird. ⓘ
Forschungsrichtungen
Die Suche nach Umweltfaktoren, die dafür verantwortlich sein könnten, dass genetisch anfällige Menschen eine Glutenunverträglichkeit entwickeln, hat zu einer zunehmenden Forschungsaktivität geführt, die sich mit Magen-Darm-Infektionen befasst. Im April 2017 veröffentlichte Forschungsergebnisse deuten darauf hin, dass eine oft symptomlose Infektion mit einem weit verbreiteten Reovirusstamm die Empfindlichkeit gegenüber Lebensmitteln wie Gluten erhöhen kann. ⓘ
Es werden verschiedene Behandlungsansätze untersucht, darunter auch solche, die eine Diät überflüssig machen würden. Alle befinden sich noch in der Entwicklungsphase und werden der breiten Öffentlichkeit voraussichtlich erst in einiger Zeit zur Verfügung stehen. ⓘ
Drei Hauptansätze wurden als neue therapeutische Modalitäten für die Zöliakie vorgeschlagen: die Entgiftung von Gluten, die Modulation der Darmpermeabilität und die Modulation der Immunreaktion. ⓘ
Die Verwendung von gentechnisch veränderten Weizensorten oder von Weizensorten, die selektiv so gezüchtet wurden, dass sie minimal immunogen sind, könnte den Verzehr von Weizen ermöglichen. Dies könnte jedoch die Auswirkungen von Gliadin auf die Qualität des Teigs beeinträchtigen. Alternativ kann die Glutenexposition durch die Einnahme einer Kombination von Enzymen (Prolyl-Endopeptidase und eine Gerstenglutamin-spezifische Cystein-Endopeptidase (EP-B2)) minimiert werden, die das mutmaßliche 33-mer-Peptid im Zwölffingerdarm abbauen. ⓘ
Zu den alternativen Behandlungsmethoden, die derzeit untersucht werden, gehört die Hemmung von Zonulin, einem körpereigenen Signalprotein, das mit einer erhöhten Permeabilität der Darmwand und damit einer verstärkten Präsentation von Gliadin für das Immunsystem verbunden ist. Ein Hemmstoff für diesen Signalweg ist Larazotidacetat, das derzeit für klinische Versuche der Phase 3 vorgesehen ist. Andere Modifikatoren anderer gut verstandener Schritte in der Pathogenese der Zöliakie, wie die Wirkung von HLA-DQ2 oder Gewebetransglutaminase und die MICA/NKG2D-Interaktion, die möglicherweise an der Abtötung von Enterozyten beteiligt sind. ⓘ
Versuche, die Immunreaktion bei Zöliakie zu modulieren, befinden sich meist noch in der Phase I der klinischen Erprobung; ein Wirkstoff (CCX282-B) wurde in einer klinischen Studie der Phase II auf der Grundlage von Dünndarmbiopsien untersucht, die von Zöliakiepatienten vor und nach einer Glutenbelastung entnommen wurden. ⓘ
Obwohl eine glutenfreie Ernährung häufig als alternative Behandlungsmethode für Menschen mit Autismus eingesetzt wird, gibt es keine stichhaltigen Beweise dafür, dass eine glutenfreie Ernährung bei der Behandlung von Autismus von Nutzen ist. Für die Untergruppe der Menschen mit einer Glutensensitivität gibt es begrenzte Hinweise darauf, dass eine glutenfreie Ernährung einige autistische Verhaltensweisen verbessern kann. ⓘ
Namensherkunft
Zöliakie ist die deutsche Entsprechung zur neulateinischen fachsprachlichen Bezeichnung coeliacia. Das Wort leitet sich vom lateinischen Adjektiv coeliacus her, mit der Grundbedeutung ‚den Unterleib betreffend‘, das aber in einer weiteren Bedeutung auch mit ‚unterleibskrank’ übersetzt wird (rein lat. ventriculosus). Das lateinische coeliacus geht wiederum auf das griechische Adjektiv κοιλιακός koiliakós, deutsch ‚an der Verdauung leidend‘ zurück, das sich von κοιλία koilía, deutsch ‚Bauchhöhle‘, ‚Bauch‘, ‚Unterleib‘ herleitet. ⓘ
Komorbiditäten
Als Autoimmunerkrankung ist die Zöliakie mit anderen Erkrankungen, bei denen sich das Immunsystem gegen körpereigenes Gewebe richtet, häufig vergesellschaftet. Die häufigsten Begleiterkrankungen einer Zöliakie sind verschiedene neurologische Beschwerden, die aufgrund ihrer selbständigen Pathogenese nicht als Symptom der Zöliakie zu sehen sind, wie beispielsweise die Gluten-Ataxie. Die zweithäufigste Begleiterkrankung ist der Diabetes mellitus Typ 1, bei dem Antikörper gegen die insulinproduzierenden Zellen der Bauchspeicheldrüse gebildet werden. Etwa fünf bis zehn Prozent aller Personen mit Zöliakie sind auch an einem Typ-1-Diabetes erkrankt und umgekehrt ebenso etwa der gleiche Anteil Typ-1-Diabetiker an einer Zöliakie. Auch für eine entzündliche Erkrankung der Schilddrüse, die Hashimoto-Thyreoiditis, die ebenfalls als Autoimmunerkrankung gilt, wurde ein wechselseitig gehäuftes Auftreten zusammen mit einer Zöliakie beschrieben. Eher bei Erwachsenen kann es zu Dermatitis herpetiformis Duhring, einem bläschenbildenden Hautausschlag mit starkem Juckreiz, kommen, wobei nur etwa ein Zehntel dieser Patienten Symptome seitens des Magen-Darm-Traktes hat. ⓘ
Diagnostik
Der Anfangsverdacht ergibt sich aus der Symptomatik (auch unspezifische Beschwerden), der Anamnese (Erhebung der Vorgeschichte) und der körperlichen Untersuchung. Zur weiteren Klärung erfolgt heute meist eine Bestimmung spezifischer Antikörper im Blutserum. Im Zweifelsfall wird zur Sicherung der Diagnose ggf. eine Gewebebiopsie (siehe Histologie) aus dem unteren Zwölffingerdarm entnommen. ⓘ
Dass die Zöliakie in den Industrienationen heute schätzungsweise ein Prozent der Bevölkerung betrifft, liegt unter anderem daran, dass es leistungsfähige serologische Tests gibt, mit deren Hilfe sich auch atypische Formen der Krankheit diagnostizieren lassen. Da es sich gezeigt hat, dass ein großer Teil der Zöliakie-Patienten nicht unter den klassischen gastrointestinalen Symptomen leidet, hat die European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) ihre Richtlinien zur Diagnose Gluten-induzierter Enteropathien erweitert und die spezifischen serologischen Tests aufgenommen. ⓘ
Differentialdiagnose
Obwohl das Krankheitsbild bei typischem Verlauf recht eindeutig ist, ergeben sich selbst aus einer anscheinend typischen, aber eben nicht spezifischen Histologie der Dünndarmschleimhaut noch einige mögliche Differentialdiagnosen. Auch Nahrungsmittelallergien (vor allem Kuhmilch- und Sojaeiweiß) oder verschiedene Infektionen des Darmtraktes können zu einer ähnlichen Schleimhautschädigung führen. Weitere seltene Ursachen für Nahrungsmittelunverträglichkeiten, Durchfallerkrankungen u. a. sind andere autoimmune Magen-Darm-Erkrankungen, Immundefekte, AIDS, Abstoßungsreaktionen nach Transplantation, Bestrahlung oder Behandlung mit Zytostatika, erhebliche Mangelernährung oder die sehr seltene Mikrovillusatrophie des Kleinkindes. ⓘ
Eine weitere wichtige Differentialdiagnose ist die zystische Fibrose, die durch den Schweißtest (Pilocarpin-Iontophorese-Test) durch den gemessenen Chlorid-Gehalt im Schweiß, ausgeschlossen werden sollte. Weiterhin sollte an angeborene Pankreasinsuffizienz, angeborene intestinale Enzymdefekte (beispielsweise Laktase- oder Saccharasemangel), tropische Sprue, kollagene Sprue, Morbus Crohn und Morbus Whipple gedacht werden. ⓘ
Im Zweifelsfall kann probeweise eine glutenfreie Diät vorgeschlagen werden. Ein Erfolg mit Verschwinden der Beschwerden wäre ein Hinweis auf Zöliakie oder eine häufiger vorkommende Unverträglichkeit gegenüber anderen Proteinen. ⓘ
Risikopatienten
Bei folgenden Problemen ist besonderes Augenmerk darauf zu richten, ob eine Zöliakie vorliegen könnte: Verwandte 1. Grades von Zöliakiekranken, Diabetes mellitus Typ 1, selektiver IgA-Mangel, Morbus Down (Trisomie 21), Turner-Syndrom, Williams-Beuren-Syndrom, Dermatitis herpetiformis Duhring, Vitiligo, autoimmune Schilddrüsenerkrankungen, Autoimmunhepatitis, rheumatoide Arthritis. ⓘ
Prävention
Um das Risiko für das Auftreten einer Zöliakie zu minimieren, empfiehlt die Europäische Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN) auf der Basis von Studiendaten, Gluten in der Säuglingsernährung nicht vor Abschluss des vierten Lebensmonats einzusetzen. ⓘ
Eine Studie aus dem Jahr 2019 belegt, dass eine ballaststoffreiche Ernährung der werdenden Mutter in der Schwangerschaft das Zöliakie-Risiko des Kindes senken kann. ⓘ
Forschung
Ein 2006 vorgestellter Forschungsansatz zur Entwicklung einer weiteren Behandlungsmöglichkeit der Zöliakie bestand in einer Enzymersatztherapie. Aus keimendem Getreide oder einem Pilz isolierte Enzyme konnten das Gluten in kleine Stücke zerschneiden, so dass die Bruchteile vom Immunsystem nicht mehr erkannt und dementsprechend keine Entzündung mehr ausgelöst werden könne. (Bis 2014 finden sich keine weiteren Publikationen zu dieser Therapie, und auch die AWMF-Leitlinie von 2009 erwähnt diese Therapieform nicht.) ⓘ
Als eine Enzymkombination, die eine Glutenverdauung unter Darmbedingungen ermöglichen könnte, wird zum Beispiel eine Kombination aus einer glutaminspezifischen Endoprotease (EP-B2 aus Gerste) und einer Prolylendopeptidase (SC PEP aus Sphingomonas capsulata) genannt. ⓘ
Eine 2011 vorgestellte Labormethode erlaubt, die Bewertung verschiedener Enzyme (Prolylendopeptidase) hinsichtlich Stabilität und Wirkung im Verdauungstrakt in Echtzeit zu verfolgen. Dank dieses Verfahrens konnten einige entscheidende Unterschiede zwischen Enzymen ähnlicher Art festgestellt werden, die bei Untersuchungen im Reagenzglas verborgen geblieben sind. ⓘ
Einige der Behandlungsansätze sind Gegenstand klinischer Studien in Phase II. ⓘ
Sonstiges
Im Jahre 2016 startete das Projekt „Focus IN CD“ - Innovative patient centered health care services - advantages of establishing a close CE network in celiac disease patient health care, das überwiegend aus Mitteln des Europäischen Regionalentwicklungsprogramms "Interreg Central Europe" und anderer gemeinnütziger Träger über einen Zeitraum von 36 Monaten gefördert wird (Projektnummer CE111). Das Insgesamt sind 12 Partnerinstitutionen aus den Bereichen Medizin und Forschung, Patientenselbsthilfe, Projektentwicklung und Verwaltung beteiligt, die das Projekt in Slowenien, Deutschland, Ungarn, Kroatien und Italien umsetzen. Projektpartner in Deutschland sind das Klinikum der Universität München (Dr. von Haunersches Kinderspital) sowie die Stiftung Kindergesundheit. Hauptziel von Focus IN CD ist es, anhand von verschiedenen Teilprojekten die Versorgung von Patienten mit Zöliakie in Zentraleuropa wesentlich und nachhaltig zu verbessern. Insbesondere die Wissensvermittlung zu Zöliakie und glutenfreier Ernährung steht dabei im Mittelpunkt, um sowohl Ärzte und medizinisches Personal als auch die Patienten selbst besser über Zöliakie zu informieren und so mehr Sicherheit für die Zöliakiebetroffenen zu schaffen. Dazu wurde 2018 ein erster Online-Kurs für Patienten mit Zöliakie mit dem Titel Zoeliakie-verstehen.de veröffentlicht, der ausführliche, unabhängige und aktuelle Informationen zu Zöliakie anschaulich darstellt. ⓘ
Seit 2002 findet in der Regel am dritten Wochenende im Mai der Welt-Zöliakie-Tag (WZT) statt. Er ist von der Dachorganisation der Europäischen Zöliakie-Gesellschaften (AOECS – Association of European Coeliac Societies) ins Leben gerufen worden. Mit vielfältigen Aktionen soll an diesem Tag das Thema „Zöliakie und glutenfreie Ernährung“ einer möglichst breiten Öffentlichkeit näher gebracht werden. In Deutschland wird der WZT von der Deutschen Zöliakie-Gesellschaft (DZG) veranstaltet. ⓘ
Darüber hinaus findet im Wechsel mit dem Welt-Zöliakie-Tag jedes zweite Jahr das glutenfreie Oktoberfest statt, das ebenfalls von der Deutschen Zöliakie-Gesellschaft (DZG) ausgerichtet wird. ⓘ

