Adenoviridae
| Adenoviridae ⓘ | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Adenoviridae | ||||||||||||||
| Systematik | ||||||||||||||
| ||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
| ||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Adenoviridae | ||||||||||||||
| Links | ||||||||||||||
|
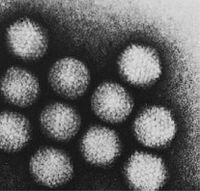
Die Familie Adenoviridae (von altgriechisch ἀδήν ‚Drüse‘) oder Adenoviren (Einzahl: Adenovirus) umfasst unbehüllte Viren mit einer doppelsträngigen, linearen DNA (Desoxyribonukleinsäure) als Genom. Ihr Kapsid hat eine ikosaedrische Symmetrie und besitzt einen besonderen, die Virusfamilie charakterisierenden Aufbau aus Penton- und Hexon-Kapsomeren. An den Pentonen sind typische, antennenartige Fiberproteine verankert, die den Virionen der Familie ihr „satellitenartiges“ Erscheinungsbild geben. Die Familie beinhaltet derzeit 47 human- und tierpathogene Virusspezies mit zahlreichen Subtypen bei Säugetieren, Vögeln, Reptilien und Fischen. Beim Menschen verursachen die humanen Adenoviren überwiegend Erkrankungen der Atemwege. ⓘ
Die ersten Adenoviren wurden 1953 von einer Arbeitsgruppe um Wallace P. Rowe und Robert J. Huebner aus Tonsillen und anderem adenoidem Drüsengewebe von Kindern isoliert und in einer Zellkultur vermehrt. Diese unter anderem bei Erkältungskrankheiten vorgefundenen Viren wurden auch als Adenoidal-Pharyngeal-Conjunctival-Viren (APC-Viren) und Adenoid Degeneration Agents (A-D-Agents, im Deutschen AD-Agens) bezeichnet, da sie in adenoidem Gewebe nekrotische Veränderungen verursachen. ⓘ
In der Geschichte der Molekularbiologie spielen die Adenoviridae eine bedeutende Rolle, da bei ihnen 1977 ein grundlegender Prozess der Genexpression entdeckt wurde, das so genannte Spleißen. In der Gentechnik und der virologischen Forschung sind Adenoviren für das Einschleusen von DNA als viraler Vektor in Zellen und Organismen von gewisser Bedeutung. ⓘ
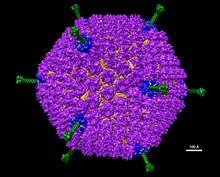
Adenoviren (Mitglieder der Familie Adenoviridae) sind mittelgroße (90-100 nm), unbehüllte (ohne äußere Lipiddoppelschicht) Viren mit einem ikosaedrischen Nukleokapsid, das ein doppelsträngiges DNA-Genom enthält. Ihr Name leitet sich von ihrer ersten Isolierung aus menschlichen Adenoiden im Jahr 1953 ab. ⓘ
Sie haben ein breites Spektrum an Wirbeltieren als Wirte; beim Menschen wurden mehr als 50 verschiedene Adenoviren-Serotypen gefunden, die ein breites Spektrum von Krankheiten verursachen, von leichten Atemwegsinfektionen bei Kleinkindern (bekannt als Erkältung) bis hin zu lebensbedrohlichen Multiorganerkrankungen bei Menschen mit geschwächtem Immunsystem. ⓘ
Virologie
Systematik
Die Systematik nach ICTV (Stand November 2018) beinhaltet u. a. folgende Spezies:
- Genus Atadenovirus
- Bovine atadenovirus D bei Rindern
- Possum atadenovirus A beim Opossum
- Ovine atadenovirus D bei Schafen
- Deer atadenovirus A beim Reh
- Lizard atadenovirus A bei Bartagamen, Chamäleon, Gecko
- Snake atadenovirus A bei Schlangen
- Psittacine atadenovirus A bei Papageien
- Duck atadenovirus A bei Enten
- Genus Aviadenovirus
- Fowl aviadenovirus A – E (Geflügeladenoviren) bei Gänse- und Hühnervögeln
- Goose aviadenovirus A bei Gänsen
- Duck aviadenovirus B bei Enten
- Pigeon aviadenovirus A und B bei Tauben
- Falcon aviadenovirus A bei Falken
- Psittacine aviadenovirus B bei Papageien
- Turkey aviadenovirus B bis D bei Truthühnern
- Genus Ichtadenovirus
- Sturgeon ichtadenovirus A alias White sturgeon adenovirus beim Weißen Stör
- Genus Mastadenovirus
- Humanes Mastadenovirus A–F (HAdV-A bis HAdV-F) beim Menschen
- Bovine mastadenovirus A bis C bei Rindern
- Canine mastadenovirus A
- Equine mastadenovirus A bei Pferden
- Ovine mastadenovirus A und B bei Schafen
- Porcine mastadenovirus A bei Schweinen
- Simian mastadenovirus A bei Affen
- Tree shrew mastadenovirus A bei Tupaias
- Caprines Adenovirus (Goat adenovirus 2, GAdV-2) bei Ziegen
- Guinea Pig Adenovirus bei Meerschweinchen
- Ovines Adenovirus C (Ovine adenovirus 6, OAdV-6) bei Schafen
- Genus Siadenovirus
Schimpansen-Adenoviren: Aus Schimpansen isolierte Adenoviren werden aufgrund ihrer großen Ähnlichkeit mit bestimmten Humanen Adenoviren (HAdVs) in „menschliche“ Adenovirus-Arten klassifiziert. So gehören die Simian-Adenoviren SAdV-22 bis SAdV-25 zur Spezies Human-Mastadenovirus E und SAdV-21 zur Spezies Human-Mastadenovirus B. ⓘ
Diese Familie umfasst die folgenden Gattungen:
- Atadenovirus
- Aviadenovirus
- Ichtadenovirus
- Mastadenovirus (einschließlich aller menschlichen Adenoviren)
- Siadenovirus
- Testadenovirus ⓘ
Vielfalt
Beim Menschen gibt es derzeit 88 humane Adenoviren (HAdVs) in sieben Spezies (Humane Adenoviren A bis G):
- A: 12, 18, 31
- B: 3, 7, 11, 14, 16, 21, 34, 35, 50, 55
- C: 1, 2, 5, 6, 57
- D: 8, 9, 10, 13, 15, 17, 19, 20, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 36, 37, 38, 39, 42, 43, 44, 45, 46, 47, 48, 49, 51, 53, 54, 56, 58, 59, 60, 62, 63, 64, 65, 67, 69, 70, 71, 72, 73, 74, 75
- E: 4
- F: 40, 41
- G: 52 ⓘ
Verschiedene Typen/Serotypen werden mit verschiedenen Erkrankungen in Verbindung gebracht:
- Atemwegserkrankungen (hauptsächlich Arten HAdV-B und C)
- Bindehautentzündung (HAdV-B und D)
- Gastroenteritis (HAdV-F Typen 40, 41, HAdV-G Typ 52)
- Fettleibigkeit oder Adipogenese (HAdV-A Typ 31, HAdV-C Typ 5, HAdV-D Typen 9, 36, 37) ⓘ
Alle diese Typen werden von der ICTV als Humane Mastadenoviren A-G bezeichnet, da sie alle zur Gattung der Mastadenoviren gehören. ⓘ
Struktur

Adenoviren sind mittelgroß (90-100 nm). Die Virionen bestehen aus einem linearen Stück doppelsträngiger DNA im Inneren eines ikosaedrischen Kapsids. 240 Hexon-Proteine bilden den Großteil des Kapsids, während zwölf Penton-Basen die Ecken des Ikosaeders abdecken. Die Pentonbasen sind mit abstehenden Fasern verbunden, die die Anheftung an die Wirtszelle über den Rezeptor auf der Zelloberfläche erleichtern. ⓘ
Im Jahr 2010 wurde die Struktur des menschlichen Adenovirus auf atomarer Ebene gelöst, was es zum größten hochauflösenden Modell aller Zeiten macht. Das Virus besteht aus rund 1 Million Aminosäureresten und wiegt etwa 150 MDa. ⓘ
Genom
Das Genom des Adenovirus ist eine lineare, nicht segmentierte, doppelsträngige (ds) DNA mit einer Länge zwischen 26 und 48 Kbp. Damit kann das Virus theoretisch 22 bis 40 Gene tragen. Obwohl es damit deutlich größer ist als andere Viren seiner Baltimore-Gruppe, ist es immer noch ein sehr einfaches Virus, das zum Überleben und zur Replikation stark von der Wirtszelle abhängig ist. Ein interessantes Merkmal dieses viralen Genoms ist ein terminales 55 kDa-Protein, das mit jedem der 5'-Enden der linearen dsDNA assoziiert ist. Diese dienen als Primer bei der viralen Replikation und stellen sicher, dass die Enden des linearen Genoms des Virus angemessen repliziert werden. ⓘ
Replikation
Adenoviren besitzen ein lineares dsDNA-Genom und sind in der Lage, sich mit Hilfe der Replikationsmaschinerie des Wirts im Zellkern von Wirbeltierzellen zu replizieren. Das Eindringen von Adenoviren in die Wirtszelle beinhaltet zwei Arten von Wechselwirkungen zwischen dem Virus und der Wirtszelle. Der größte Teil des Geschehens findet an den Knotenpunkten statt. Der Eintritt in die Wirtszelle wird durch die Bindung der Noppendomäne des Faserproteins an den Zellrezeptor eingeleitet. Die beiden derzeit bekannten Rezeptoren sind: CD46 für die humanen Adenovirus-Serotypen der Gruppe B und der Coxsackievirus/Adenovirus-Rezeptor (CAR) für alle anderen Serotypen. Es gibt einige Berichte, die darauf hindeuten, dass auch MHC-Moleküle und Sialinsäurereste in dieser Funktion fungieren. Es folgt eine sekundäre Interaktion, bei der ein Motiv des Penton-Basisproteins (siehe Kapsomer) mit einem Integrin-Molekül interagiert. Es ist die Co-Rezeptor-Interaktion, die den Eintritt des Adenovirus stimuliert. Dieses Co-Rezeptor-Molekül ist das αV-Integrin. Die Bindung an αV-Integrin führt zur Endozytose des Viruspartikels über Clathrin-beschichtete Gruben. Die Bindung an αV-Integrin stimuliert die Zellsignalisierung und induziert so die Aktinpolymerisation, die die Clathrin-vermittelte Endozytose erleichtert und zum Eintritt des Virions in die Wirtszelle innerhalb eines Endosoms führt. ⓘ
Sobald das Virus erfolgreich in die Wirtszelle eingedrungen ist, kommt es zu einer Ansäuerung des Endosoms, die die Topologie des Virus verändert, indem sie die Auflösung der Kapsidkomponenten bewirkt. Das Kapsid wird destabilisiert, und das Protein VI, einer der Bestandteile des Kapsids (siehe Adenovirus-Genom), wird aus dem Kapsid freigesetzt. Diese Veränderungen sowie die toxische Natur der Pentone zerstören das Endosom, was zur Bewegung des Virions in das Zytoplasma führt. Mit Hilfe der zellulären Mikrotubuli wird das Virus zum Kernporenkomplex transportiert, wobei sich das Adenoviruspartikel zerlegt. Anschließend wird die virale DNA freigesetzt, die über die Kernpore in den Zellkern gelangen kann. Danach assoziiert die DNA mit bereits im Kern vorhandenen Histonmolekülen, wodurch sie mit der Transkriptionsmaschinerie der Wirtszelle interagieren kann. Dann kann die virale Genexpression stattfinden, ohne dass das virale Genom in die Chromosomen der Wirtszelle integriert wird, und es können neue Viruspartikel gebildet werden. ⓘ
Der Lebenszyklus des Adenovirus wird durch den DNA-Replikationsprozess in zwei Phasen unterteilt: eine frühe und eine späte Phase. In beiden Phasen wird ein primäres Transkript erzeugt, das alternativ gespleißt wird, um monocistronische mRNAs zu erzeugen, die mit dem Ribosom des Wirts kompatibel sind, so dass die Produkte übersetzt werden können. ⓘ
Die frühen Gene sind für die Expression von hauptsächlich nicht-strukturellen, regulatorischen Proteinen verantwortlich. Diese Proteine haben ein dreifaches Ziel: Sie verändern die Expression von Wirtsproteinen, die für die DNA-Synthese notwendig sind, sie aktivieren andere Virusgene (z. B. die vom Virus kodierte DNA-Polymerase) und sie verhindern den vorzeitigen Tod der infizierten Zelle durch die Wirts-Immunabwehr (Blockierung der Apoptose, Blockierung der Interferon-Aktivität und Blockierung der MHC-Klasse-I-Translokation und -Expression). ⓘ
Einige Adenoviren können unter speziellen Bedingungen Zellen mit Hilfe ihrer frühen Genprodukte transformieren. E1A (bindet das Retinoblastoma-Tumorsuppressorprotein) immortalisiert primäre Zellen in vitro, so dass E1B (bindet den Tumorsuppressor p53) die Zellen unterstützen und stabil transformieren kann. Dennoch sind sie aufeinander angewiesen, um die Wirtszelle erfolgreich zu transformieren und Tumore zu bilden. E1A ist ein größtenteils intrinsisch ungeordnetes Protein und enthält eine CR3-Domäne, die für die Transkriptionsaktivierung entscheidend ist. ⓘ
Bei der DNA-Replikation werden die frühe und die späte Phase unterschieden. Sobald die frühen Gene adäquate Virusproteine, Replikationsmaschinen und Replikationssubstrate freigesetzt haben, kann die Replikation des Adenovirus-Genoms erfolgen. Ein terminales Protein, das kovalent an das 5'-Ende des Adenovirus-Genoms gebunden ist, dient als Primer für die Replikation. Die virale DNA-Polymerase nutzt dann einen Strangverdrängungsmechanismus, im Gegensatz zu den herkömmlichen Okazaki-Fragmenten, die bei der DNA-Replikation in Säugetieren verwendet werden, um das Genom zu replizieren. ⓘ
In der späten Phase des Lebenszyklus des Adenovirus geht es darum, ausreichende Mengen an Strukturprotein zu produzieren, um das gesamte durch die DNA-Replikation erzeugte genetische Material zu verpacken. Nach erfolgreicher Replikation der viralen Komponenten wird das Virus in seine Proteinhüllen eingebaut und durch die viral induzierte Zelllyse aus der Zelle freigesetzt. ⓘ
Reaktivierung der Multiplizität
Das Adenovirus ist zur Multiplikationsreaktivierung (MR) fähig (Yamamoto und Shimojo, 1971). MR ist der Prozess, bei dem zwei oder mehr Virusgenome, die tödliche Schäden aufweisen, innerhalb der infizierten Zelle interagieren und ein lebensfähiges Virusgenom bilden. Eine solche MR wurde für das Adenovirus 12 nachgewiesen, nachdem Virionen mit UV-Licht bestrahlt worden waren und eine Mehrfachinfektion von Wirtszellen durchlaufen hatten. In einer Übersichtsarbeit wurden zahlreiche Beispiele für MR in verschiedenen Viren beschrieben, und es wurde vermutet, dass MR eine häufige Form der sexuellen Interaktion ist, die den Überlebensvorteil der rekombinanten Reparatur von Genomschäden bietet. ⓘ
Epidemiologie
Übertragung
Adenoviren sind ungewöhnlich stabil gegenüber chemischen oder physikalischen Einwirkungen und ungünstigen pH-Bedingungen, was ein längeres Überleben außerhalb des Körpers und des Wassers ermöglicht. Adenoviren werden in erster Linie über Tröpfcheninhalation verbreitet, können aber auch über fäkale Wege übertragen werden. Die Erforschung der molekularen Mechanismen, die der Übertragung von Adenoviren zugrunde liegen, liefert empirische Belege für die Hypothese, dass Coxsackievirus/Adenovirus-Rezeptoren (CARs) für den Transport von Adenoviren in bestimmte naive/progenitorische Zelltypen erforderlich sind. ⓘ
Menschen
Menschen, die mit Adenoviren infiziert sind, zeigen ein breites Spektrum an Reaktionen, von keinerlei Symptomen bis hin zu schweren Infektionen, wie sie für den Adenovirus-Serotyp 14 typisch sind. ⓘ
Tiere
Das Fledermaus-Adenovirus TJM (Bt-AdV-TJM) ist eine neue Spezies der Gattung Mastadenovirus, die aus Myotis und Scotophilus kuhlii in China isoliert wurde. Es ist am engsten mit den AdVs der Spitzhörnchen und der Hunde verwandt. ⓘ
Es sind zwei Typen von Hunde-Adenoviren bekannt, Typ 1 und 2. Typ 1 (CAdV-1) verursacht infektiöse Hundehepatitis, eine potenziell tödliche Erkrankung mit Vaskulitis und Hepatitis. Eine Infektion mit Typ 1 kann auch Infektionen der Atemwege und der Augen verursachen. CAdV-1 befällt auch Füchse (Vulpes vulpes und Vulpes lagopus) und kann Hepatitis und Enzephalitis verursachen. Das kanine Adenovirus 2 (CAdV-2) ist eine der möglichen Ursachen für Zwingerhusten. Die wichtigsten Impfstoffe für Hunde umfassen abgeschwächte CAdV-2-Lebendimpfstoffe, die eine Immunität gegen CAdV-1 und CAdV-2 erzeugen. CAdV-1 wurde ursprünglich in einem Impfstoff für Hunde verwendet, aber Hornhautödeme waren eine häufige Komplikation. ⓘ
Das Eichhörnchen-Adenovirus (SqAdV) verursacht Berichten zufolge bei roten Eichhörnchen in Europa Enteritis, während graue Eichhörnchen offenbar resistent sind. SqAdV ist am engsten mit dem Adenovirus der Meerschweinchen (GpAdV) verwandt. ⓘ
Über Adenoviren bei Reptilien ist nur wenig bekannt, aber die Forschung ist im Gange. ⓘ
Adenoviren sind auch als Verursacher von Atemwegsinfektionen bei Pferden, Rindern, Schweinen, Schafen und Ziegen bekannt. Das Equine Adenovirus 1 kann bei immungeschwächten Araberfohlen eine tödliche Erkrankung mit Lungenentzündung und Zerstörung von Pankreas- und Speicheldrüsengewebe verursachen. Das Tupaia-Adenovirus (TAV) (Adenovirus 1 der Baumspitzmaus) wurde von Baumspitzmäusen isoliert. ⓘ
Das Otarine Adenovirus 1 wurde von Seelöwen (Zalophus californianus) isoliert. ⓘ
Die Geflügel-Adenoviren werden mit vielen Krankheiten bei Hausgeflügel in Verbindung gebracht, wie z. B. Einschlusskörper-Hepatitis, Hydroperikard-Syndrom, Egg-Drop-Syndrom, Wachtel-Bronchitis, Muskelmagen-Erosionen und vielen Atemwegserkrankungen. Sie wurden auch von wilden Schwarzmilanen (Milvus migrans) isoliert. ⓘ
Das Adenovirus des Titi-Affen wurde aus einer Affenkolonie isoliert. ⓘ
Vorbeugung
Derzeit gibt es einen Impfstoff gegen Adenoviren des Typs 4 und 7 nur für US-Militärpersonal. Dieser Impfstoff ist für Angehörige des US-Militärs bestimmt, da bei ihnen ein höheres Infektionsrisiko bestehen kann. Der Impfstoff enthält ein lebendes Virus, das über den Stuhl ausgeschieden werden und zur Übertragung führen kann. Der Impfstoff ist nicht für die Verwendung außerhalb des Militärs zugelassen, da er nicht in Studien an der Allgemeinbevölkerung oder an Menschen mit geschwächtem Immunsystem getestet worden ist. ⓘ
In der Vergangenheit wurden Rekruten des US-Militärs gegen zwei Serotypen des Adenovirus geimpft, was zu einem entsprechenden Rückgang der durch diese Serotypen verursachten Krankheiten führte. Dieser Impfstoff wird nicht mehr hergestellt. Das U.S. Army Medical Research and Materiel Command gab am 31. Oktober 2011 bekannt, dass ein neuer Adenovirus-Impfstoff, der die ältere Version, die seit über zehn Jahren nicht mehr hergestellt wird, ersetzt, am 18. Oktober 2011 an die Grundausbildungsstätten ausgeliefert wurde. Weitere Informationen finden Sie hier. ⓘ
Zur Vorbeugung gegen Adenoviren und andere Atemwegserkrankungen ist es wichtig, sich häufig und länger als 20 Sekunden die Hände zu waschen, Augen, Gesicht und Nase nicht mit ungewaschenen Händen zu berühren und engen Kontakt mit Personen mit symptomatischer Adenovirusinfektion zu vermeiden. Personen mit symptomatischer Adenovirus-Infektion wird außerdem empfohlen, in den Arm oder Ellbogen statt in die Hand zu husten oder zu niesen, keine Tassen und kein Essgeschirr gemeinsam zu benutzen und andere nicht zu küssen. Die Chlorung von Schwimmbädern kann Ausbrüche einer durch Adenoviren verursachten Bindehautentzündung verhindern. ⓘ
Diagnose
Die Diagnose wird anhand der Symptome und der Krankengeschichte gestellt. Tests sind nur in sehr schweren Fällen erforderlich. Zu den Tests gehören Blutuntersuchungen, Abstriche von Augen, Nase oder Rachen, Stuhlproben und Röntgenaufnahmen der Brust. Im Labor kann das Adenovirus durch Antigennachweis, Polymerase-Kettenreaktion (PCR), Virusisolierung und Serologie nachgewiesen werden. Selbst wenn ein Adenovirus nachgewiesen wird, ist es möglicherweise nicht die Ursache der Symptome. Einige immungeschwächte Personen können das Virus wochenlang ausscheiden und keine Symptome zeigen. ⓘ
Infektionen
Die meisten Infektionen mit Adenoviren führen zu Infektionen der oberen Atemwege. Adenovirus-Infektionen äußern sich häufig in Form einer Bindehautentzündung, einer Mandelentzündung (die genau wie eine Streptokokkeninfektion aussehen kann und nur durch eine Rachenkultur von einer Streptokokkeninfektion unterschieden werden kann), einer Ohrenentzündung oder eines Krupps. Die Adenoviren der Typen 40 und 41 können auch eine Gastroenteritis verursachen. Eine Kombination aus Bindehautentzündung und Mandelentzündung ist bei Adenovirus-Infektionen besonders häufig. ⓘ
Einige Kinder (vor allem die jüngsten) können eine Adenovirus-Bronchiolitis oder Lungenentzündung entwickeln, die beide schwerwiegend sein können. Bei Säuglingen können Adenoviren auch Hustenanfälle verursachen, die fast genauso aussehen wie Keuchhusten. Adenoviren können auch eine virale Meningitis oder Enzephalitis verursachen. In seltenen Fällen können Adenoviren eine hämorrhagische Zystitis (Entzündung der Harnblase - eine Form der Harnwegsinfektion - mit Blut im Urin) verursachen. ⓘ
Die meisten Menschen erholen sich von Adenovirus-Infektionen von selbst, aber Menschen mit Immunschwäche sterben manchmal an Adenovirus-Infektionen, und - selten - können sogar zuvor gesunde Menschen an diesen Infektionen sterben. Dies mag daran liegen, dass eine Adenovirusinfektion manchmal zu Herzstörungen führen kann. In einer Studie wurden zum Beispiel in einigen Herzproben von Patienten mit dilatativer Kardiomyopathie Adenoviren des Typs 8 nachgewiesen. ⓘ
Adenoviren werden häufig durch Aushusten (z. B. Aerosole) übertragen, können aber auch durch Kontakt mit einer infizierten Person oder durch Viruspartikel auf Gegenständen wie Handtüchern und Wasserhahngriffen übertragen werden. Manche Menschen mit Adenovirus-Gastroenteritis können das Virus noch Monate nach dem Abklingen der Symptome in ihrem Stuhl ausscheiden. Das Virus kann durch Wasser in Schwimmbädern übertragen werden, das nicht ausreichend gechlort ist. ⓘ
Wie bei vielen anderen Krankheiten ist gutes Händewaschen eine Möglichkeit, die Übertragung von Adenoviren von Mensch zu Mensch zu verhindern. Hitze und Bleichmittel können Adenoviren auf Gegenständen abtöten. ⓘ
Behandlung
Es gibt keine bewährten antiviralen Medikamente zur Behandlung von Adenovirus-Infektionen, so dass die Behandlung weitgehend auf die Symptome ausgerichtet ist (z. B. Paracetamol gegen Fieber). Das antivirale Medikament Cidofovir hat einigen Patienten geholfen, die schwere Krankheitsfälle hatten; die Anzahl und der Grad der Hilfe sowie die besonderen Komplikationen oder Symptome, bei denen es geholfen hat, und wann und wo dies geschah, wurden in der Quelle nicht angegeben. Ein Arzt kann bei Bindehautentzündung antibiotische Augentropfen verabreichen, während er die Ergebnisse der Bakterienkulturen abwartet, um bakterielle Sekundärinfektionen zu verhindern. Gegenwärtig ist für die Allgemeinheit kein Impfstoff gegen Adenoviren erhältlich, aber für das US-Militär ist ein Impfstoff gegen die Typen 4 und 7 verfügbar. ⓘ
Verwendung in der Gentherapie und bei Impfungen
Gentherapie
Adenoviren sind seit langem ein beliebter viraler Vektor für die Gentherapie, da sie in der Lage sind, sowohl replizierende als auch nicht-replizierende Zellen zu beeinflussen, große Transgene aufzunehmen und für Proteine zu kodieren, ohne sich in das Genom der Wirtszelle zu integrieren. Insbesondere werden sie als Vehikel für die Verabreichung gezielter Therapien in Form von rekombinanter DNA oder Proteinen verwendet. Diese Therapie hat sich als besonders nützlich bei der Behandlung von monogenen Krankheiten (z. B. Mukoviszidose, X-chromosomaler SCID, Alpha1-Antitrypsin-Mangel) und Krebs erwiesen. In China ist das onkolytische Adenovirus eine zugelassene Krebstherapie. Spezifische Modifikationen der Faserproteine werden verwendet, um das Adenovirus auf bestimmte Zelltypen auszurichten; es werden große Anstrengungen unternommen, um die Hepatotoxizität zu begrenzen und das Versagen mehrerer Organe zu verhindern. Das Adenovirus-Dodekaeder kann als wirksame Plattform für die Übertragung fremder Antigene auf menschliche myeloische dendritische Zellen (MDC) dienen, und es wird von den MDC effizient an M1-spezifische CD8+ T-Lymphozyten übertragen. ⓘ
Adenoviren wurden bereits für die Verabreichung von CRISPR/Cas9-Gene-Editing-Systemen verwendet, aber die hohe Immunreaktivität auf virale Infektionen stellte eine Herausforderung für die Anwendung bei Patienten dar. ⓘ
Impfstoffe
Modifizierte (rekombinante) Adenovirus-Vektoren, einschließlich replikationsinkompetenter Typen, können DNA liefern, die für spezifische Antigene kodiert. ⓘ
Adenoviren wurden zur Herstellung von COVID-19-Virusimpfstoffen verwendet. "In vier COVID-19-Impfstoffkandidaten ... Ad5... dient als 'Vektor' für den Transport des Oberflächenproteingens von SARS-CoV-2". Ziel ist die genetische Expression des Spike-Glykoproteins des schweren akuten respiratorischen Syndroms Coronavirus 2 (SARS-CoV-2). Der zugelassene Impfstoff COVID-19 von Oxford-AstraZeneca verwendet einen replikationsdefizienten Adenovirus-Vektor (ChAdOx1) für Schimpansen. Der COVID-19-Impfstoff von Janssen verwendet ein modifiziertes rekombinantes Adenovirus vom Typ 26 (Ad26). Rekombinante Adenoviren vom Typ 5 (Ad5) werden von Ad5-nCoV, ImmunityBio und UQ-CSL V451 verwendet. Das Produkt Gam-COVID-Vac (auch bekannt als Sputnik-V) ist innovativ, da am ersten Tag ein Impfstoff auf Ad26-Basis und am Tag 21 ein Ad5-Impfstoff verwendet wird. Ein weiteres Produkt ist ChAd-SARS-CoV-2-S; der Impfstoff verhinderte Berichten zufolge die Infektion von Mäusen mit SARS-CoV-2, die gentechnisch so verändert wurden, dass sie humane ACE2-Rezeptoren (hACE2) haben, vermutlich Rezeptoren, die das Eindringen des Virus in die Zellen ermöglichen. ⓘ
Mögliche Probleme bei der Verwendung von Adenoviren als Impfstoffvektoren sind: Der menschliche Körper entwickelt eine Immunität gegen den Vektor selbst, was spätere Auffrischungsimpfungen schwierig oder unmöglich macht. In einigen Fällen sind Menschen bereits immun gegen Adenoviren, so dass die Verabreichung über den Vektor unwirksam ist. ⓘ
Bedenken hinsichtlich einer HIV-Infektion
Die Verwendung von Ad5-Impfstoffen für COVID-19 beunruhigte die Forscher, die bereits Erfahrungen mit zwei fehlgeschlagenen Versuchen mit einem Ad5-Impfstoff (Phambili und STEP) gemacht hatten, weil für unbeschnittene männliche Patienten ein erhöhtes Risiko bestand, sich über ungeschützten Analverkehr mit HIV-1 zu infizieren. Damals kam man zu dem Schluss, dass bei jedem Impfstoff mit Ad5-Vektor ein erhöhtes Risiko der HIV-Aufnahme zu beobachten ist. Im Oktober 2020 schrieben die Forscher in der Fachzeitschrift The Lancet: "Aufgrund dieser Ergebnisse sind wir besorgt, dass die Verwendung eines Ad5-Vektors für die Immunisierung gegen SARS-CoV-2 in ähnlicher Weise das Risiko des Erwerbs von HIV-1 bei Männern, die den Impfstoff erhalten, erhöhen könnte." Impfstoffe mit anderen Technologien wären davon nicht betroffen, wohl aber Sputnik V, Convidecia und hAd5 von ImmunityBio. In zwei Studien wurde festgestellt, dass Ad5-spezifische CD4-T-Zellen anfälliger für HIV-Infektionen sind als CD4-T-Zellen, die für bestimmte andere Vektoren wie Cytomegalovirus und Canarypox spezifisch sind. ⓘ
Zum Vergleich: In einem Science-Artikel wurde berichtet, dass China den auf einem Ad5-Vektor basierenden Ebola-Impfstoff von CanSino zugelassen hat. Der Impfstoff wurde in Sierra Leone getestet, einem Land mit hoher HIV-Prävalenz, was die Wahrscheinlichkeit erhöht, dass derartige Probleme entdeckt werden. Der CEO von CanSino sagte: "Wir haben mit dem Ebola-Impfstoff nichts gesehen" und spekulierte, dass die HIV-Anfälligkeit möglicherweise auf Ad5-Impfstoffe beschränkt ist, die HIV-Proteine produzieren. In einem Forschungsbericht, der im Mai in The Lancet veröffentlicht wurde, räumten die Forscher des Unternehmens diese Möglichkeit ein, bezeichneten sie als "umstritten" und erklärten, dass sie bei den Versuchen mit dem Impfstoffkandidaten COVID-19 des Unternehmens darauf achten würden. Es ist nicht bekannt, inwieweit die LGBT-Diskriminierung in Sierra Leone dazu beigetragen haben könnte, einen möglichen Kausalzusammenhang in der Ebola-Impfstoffstudie zu verschleiern; während an der Step-Studie hauptsächlich homosexuelle und bisexuelle Männer teilnahmen, wurden an der Phambili-Studie hauptsächlich heterosexuelle Männer und Frauen beteiligt, und dennoch wurde ein offensichtlicher Zusammenhang festgestellt. ⓘ
Ähnlichkeiten zu anderen Viren
Der Phage PRD1 (Familie Tectiviridae) zeigt in der Struktur des Kapsids und der Schwanzfibern auffällige Ähnlichkeiten mit Adenoviren. Auch die Anordnung einiger Gene auf dem Genom dieses Phagen (DNA-Polymerase, Terminales Protein) und das Vorhandensein zweier ITRs (Inverted terminal repeats) zeigt Analogien, was insgesamt auf einen stammesgeschichtlichen Zusammenhang mit den Adenoviren hindeutet. Beide Familien wurden daher vom ICTV im März 2020 in dieselbe Klasse Tectiliviricetes gestellt. ⓘ
In Pflanzen und Pilzen findet sich, teils im Cytoplasma oder innerhalb der Mitochondrien, ein lineares Plasmid (z. B. das „Killer-Plasmid“ der Hefe), das eine ähnliche Anordnung der Gene für die ITRs, die Polymerase und das Terminale Protein zeigt. ⓘ
Die Schwanzfibern vieler Mitglieder der Adenoviridae und das Coxsackievirus B nutzen den gleichen Rezeptor CAR (Coxsackie-Adenovirus-Rezeptor) zur Erkennung von Zielzellen. Darüber hinaus haben die adenoviralen Schwanzfibern strukturelle Ähnlichkeiten mit einem Anheftungsprotein innerhalb der Reoviridae. ⓘ
Gesundheitliche Folgen beim Menschen
Humane Adenoviren verursachen eine Vielzahl von unterschiedlichen Erkrankungen. Die unterschiedlichen Spezies A–G der Adenoviren sind nicht eindeutig einem Krankheitsbild zuzuordnen. Die Erkrankungen, die durch humane Adenoviren ausgelöst werden, können von leichten bis schweren Atemwegsinfektionen, über disseminierte (verteilte) Infektionen bei immunsupprimierten Kindern, als auch Durchfälle sein. Vor allem ist das humane Adenovirus (Typ 19) bekannt dafür Keratokonjunctivitiden (Augenentzündung mit Beteiligung der Cornea) auszulösen. Nach einer US-Studie soll das Adenovirus 36 menschliches Fettgewebe dazu veranlassen, sich in besonders große Fettzellen zu verwandeln, wodurch eine Dickleibigkeit hervorgerufen werden kann. ⓘ