Lösungsmittel

Ein Lösungsmittel (vom lateinischen solvō, "lösen, entfesseln, auflösen") ist ein Stoff, der eine gelöste Substanz auflöst, so dass eine Lösung entsteht. Ein Lösungsmittel ist normalerweise eine Flüssigkeit, kann aber auch ein Feststoff, ein Gas oder ein überkritisches Fluid sein. Wasser ist ein Lösungsmittel für polare Moleküle und das am häufigsten von Lebewesen verwendete Lösungsmittel; alle Ionen und Proteine in einer Zelle sind in der Zelle in Wasser aufgelöst. ⓘ
Die Menge des gelösten Stoffes, die sich in einem bestimmten Volumen des Lösungsmittels auflösen kann, variiert mit der Temperatur. Lösungsmittel werden hauptsächlich in Farben, Farbentfernern, Tinten und in der chemischen Reinigung verwendet. Organische Lösungsmittel werden insbesondere in der chemischen Reinigung (z. B. Tetrachlorethylen), als Farbverdünner (Toluol, Terpentin), als Nagellackentferner und Klebstofflöser (Aceton, Methylacetat, Ethylacetat), in Fleckenentfernern (Hexan, Petrolether), in Reinigungsmitteln (Zitrusterpene) und in Parfüms (Ethanol) verwendet. Lösungsmittel werden in der chemischen und pharmazeutischen Industrie sowie in der Erdöl- und Erdgasindustrie auf vielfältige Weise eingesetzt, unter anderem bei chemischen Synthesen und Reinigungsprozessen. ⓘ
Lösungen und Solvatisierung
Wenn ein Stoff in einem anderen gelöst wird, entsteht eine Lösung. Dies steht im Gegensatz zur Situation, in der die Verbindungen unlöslich sind, wie Sand in Wasser. In einer Lösung sind alle Bestandteile gleichmäßig auf molekularer Ebene verteilt, und es bleibt kein Rückstand zurück. Ein Lösungsmittel-Lösungsmittel-Gemisch besteht aus einer einzigen Phase, in der alle gelösten Moleküle als Solvate (Lösungsmittel-Lösungsmittel-Komplexe) vorkommen, im Gegensatz zu getrennten kontinuierlichen Phasen wie in Suspensionen, Emulsionen und anderen Arten von Nicht-Lösungs-Gemischen. Die Fähigkeit einer Verbindung, sich in einer anderen zu lösen, wird als Löslichkeit bezeichnet; wenn dies in allen Verhältnissen der Fall ist, nennt man es mischbar. ⓘ
Neben der Vermischung interagieren die Stoffe in einer Lösung auch auf molekularer Ebene miteinander. Wenn etwas gelöst wird, ordnen sich die Moleküle des Lösungsmittels um die Moleküle des gelösten Stoffes an. Dabei kommt es zur Wärmeübertragung und zur Erhöhung der Entropie, wodurch die Lösung thermodynamisch stabiler wird als der gelöste Stoff und das Lösungsmittel getrennt. Diese Anordnung wird durch die jeweiligen chemischen Eigenschaften des Lösungsmittels und des gelösten Stoffes, wie Wasserstoffbrückenbindung, Dipolmoment und Polarisierbarkeit, vermittelt. Die Solvatation führt nicht zu einer chemischen Reaktion oder einer Änderung der chemischen Konfiguration des gelösten Stoffes. Die Solvatisierung ähnelt jedoch einer Reaktion zur Bildung eines Koordinationskomplexes, die oft mit erheblichem Energieaufwand verbunden ist (Solvatationswärme und Solvatationsentropie), und ist daher alles andere als ein neutraler Prozess. ⓘ
Wenn sich ein Stoff in einem anderen auflöst, entsteht eine Lösung. Eine Lösung ist ein homogenes Gemisch, das aus einem gelösten Stoff und einem Lösungsmittel besteht. Der gelöste Stoff ist die Substanz, die gelöst wird, während das Lösungsmittel das Lösungsmedium ist. Lösungen können mit vielen verschiedenen Arten und Formen von gelösten Stoffen und Lösungsmitteln gebildet werden. ⓘ
Die wichtigsten Aufgaben des Lösemittels bei chemischen Reaktionen sind
- konvektiver Wärme- und Stofftransport
- Stabilisierung von Übergangszuständen der Reaktion
- Verdünnung zur Vermeidung von Nebenreaktionen ⓘ
Für die Reinigung und Prozessierung von Reaktionsgemischen (Downstream-Prozess) spielen Lösungsmittel eine weitere wichtige Rolle. Hier seien exemplarisch einige wichtige Verfahrensweisen benannt:
- Fällung
- Kristallisation
- Umkristallisation
- Extraktion
- Chromatographie ⓘ
Klassifizierung von Lösungsmitteln
Lösungsmittel lassen sich grob in zwei Kategorien einteilen: polare und unpolare. Ein Sonderfall ist Quecksilber, dessen Lösungen als Amalgame bezeichnet werden; es gibt auch andere Metalllösungen, die bei Raumtemperatur flüssig sind. ⓘ
Im Allgemeinen liefert die Dielektrizitätskonstante des Lösungsmittels ein grobes Maß für die Polarität eines Lösungsmittels. Die starke Polarität von Wasser wird durch seine hohe Dielektrizitätskonstante von 88 (bei 0 °C) angezeigt. Lösungsmittel mit einer Dielektrizitätskonstante von weniger als 15 gelten im Allgemeinen als unpolar. ⓘ
Die Dielektrizitätskonstante misst die Tendenz des Lösungsmittels, die Feldstärke des elektrischen Feldes eines in das Lösungsmittel eingetauchten geladenen Teilchens teilweise aufzuheben. Diese Verringerung wird dann mit der Feldstärke des geladenen Teilchens im Vakuum verglichen. Heuristisch gesehen kann man sich die Dielektrizitätskonstante eines Lösungsmittels als seine Fähigkeit vorstellen, die effektive innere Ladung des gelösten Stoffes zu reduzieren. Im Allgemeinen ist die Dielektrizitätskonstante eines Lösungsmittels ein akzeptabler Prädiktor für die Fähigkeit des Lösungsmittels, gängige ionische Verbindungen, wie z. B. Salze, aufzulösen. ⓘ
Andere Polaritätsskalen
Die Dielektrizitätskonstante ist nicht das einzige Maß für die Polarität. Da Lösungsmittel von Chemikern zur Durchführung chemischer Reaktionen oder zur Beobachtung chemischer und biologischer Phänomene verwendet werden, sind spezifischere Maße für die Polarität erforderlich. Die meisten dieser Maße sind empfindlich gegenüber der chemischen Struktur. ⓘ
Die mY-Skala von Grunwald-Winstein misst die Polarität im Hinblick auf den Einfluss des Lösungsmittels auf die Bildung einer positiven Ladung eines gelösten Stoffes während einer chemischen Reaktion. ⓘ
Die Z-Skala von Kosower misst die Polarität anhand des Einflusses des Lösungsmittels auf die UV-Absorptionsmaxima eines Salzes, in der Regel Pyridiniumiodid oder das Pyridiniumzwitterion. ⓘ
Die Donor-Zahl- und Donor-Akzeptor-Skala misst die Polarität im Hinblick darauf, wie ein Lösungsmittel mit bestimmten Substanzen interagiert, z. B. mit einer starken Lewis-Säure oder einer starken Lewis-Base. ⓘ
Der Hildebrand-Parameter ist die Quadratwurzel der Kohäsionsenergiedichte. Er kann für unpolare Verbindungen verwendet werden, ist aber für komplexe chemische Zusammenhänge nicht geeignet. ⓘ
Der Reichardt-Farbstoff, ein solvatochromer Farbstoff, der seine Farbe in Abhängigkeit von der Polarität ändert, liefert eine Skala von ET(30)-Werten. ET ist die Übergangsenergie zwischen dem Grundzustand und dem niedrigsten angeregten Zustand in kcal/mol, und (30) kennzeichnet den Farbstoff. Eine weitere, grob korrelierte Skala (ET(33)) kann mit Nilrot definiert werden. ⓘ
Die Polarität, das Dipolmoment, die Polarisierbarkeit und die Wasserstoffbrückenbindungen eines Lösungsmittels bestimmen, welche Art von Verbindungen es lösen kann und mit welchen anderen Lösungsmitteln oder flüssigen Verbindungen es mischbar ist. Im Allgemeinen lösen polare Lösungsmittel polare Verbindungen am besten auf und unpolare Lösungsmittel lösen unpolare Verbindungen am besten auf; daher "Gleiches löst Gleiches". Stark polare Verbindungen wie Zucker (z. B. Saccharose) oder ionische Verbindungen wie anorganische Salze (z. B. Kochsalz) lösen sich nur in sehr polaren Lösungsmitteln wie Wasser, während stark unpolare Verbindungen wie Öle oder Wachse sich nur in sehr unpolaren organischen Lösungsmitteln wie Hexan auflösen. Ebenso sind Wasser und Hexan (oder Essig und Pflanzenöl) nicht miteinander mischbar und trennen sich auch nach kräftigem Schütteln schnell in zwei Schichten. ⓘ
Die Polarität kann zu verschiedenen Beiträgen getrennt werden. Die Kamlet-Taft-Parameter sind zum Beispiel Dipolarität/Polarisierbarkeit (π*), wasserstoffbindende Azidität (α) und wasserstoffbindende Basizität (β). Diese können aus den Wellenlängenverschiebungen von 3-6 verschiedenen solvatochromen Farbstoffen im Lösungsmittel berechnet werden, zu denen in der Regel Reichardt-Farbstoff, Nitroanilin und Diethylnitroanilin gehören. Eine weitere Möglichkeit sind die Hansen-Parameter, die die Kohäsionsenergiedichte in Dispersions-, Polar- und Wasserstoffbrückenbindungsbeiträge aufteilen. ⓘ
Polare protische und polare aprotische
Lösungsmittel mit einer Dielektrizitätskonstante (genauer: relativen statischen Dielektrizitätskonstante) von mehr als 15 (d. h. polare oder polarisierbare Lösungsmittel) können weiter in protische und aprotische unterteilt werden. Protische Lösungsmittel lösen Anionen (negativ geladene gelöste Stoffe) stark über Wasserstoffbrückenbindungen. Wasser ist ein protisches Lösungsmittel. Aprotische Lösungsmittel wie Aceton oder Dichlormethan haben in der Regel große Dipolmomente (Trennung von teilweise positiven und teilweise negativen Ladungen innerhalb desselben Moleküls) und lösen positiv geladene Spezies über ihren negativen Dipol. Bei chemischen Reaktionen begünstigt die Verwendung von polaren protischen Lösungsmitteln den SN1-Reaktionsmechanismus, während polare aprotische Lösungsmittel den SN2-Reaktionsmechanismus begünstigen. Diese polaren Lösungsmittel sind in der Lage, Wasserstoffbrückenbindungen mit Wasser zu bilden, um sich in Wasser zu lösen, während unpolare Lösungsmittel nicht zu starken Wasserstoffbrückenbindungen fähig sind. ⓘ
Mehrkomponentige Lösungsmittel
Mehrkomponentige Lösungsmittel kamen nach dem Zweiten Weltkrieg in der UdSSR auf und werden auch in den postsowjetischen Staaten weiterhin verwendet und hergestellt. Diese Lösungsmittel können eine oder mehrere Anwendungen haben, sind aber keine Universalpräparate. ⓘ
Lösungsmittel
| Bezeichnung | Zusammensetzung ⓘ |
|---|---|
| Lösungsmittel 645 | Toluol 50%, Butylacetat 18%, Ethylacetat 12%, Butanol 10%, Ethanol 10%. |
| Lösungsmittel 646 | Toluol 50%, Ethanol 15%, Butanol 10%, Butyl- oder Amylacetat 10%, Ethylcellosolve 8%, Aceton 7% |
| Lösungsmittel 647 | Butyl- oder Amylacetat 29,8%, Ethylacetat 21,2%, Butanol 7,7%, Toluol oder Pyrobenzol 41,3% |
| Lösungsmittel 648 | Butylacetat 50%, Ethanol 10%, Butanol 20%, Toluol 20% |
| Lösungsmittel 649 | Ethylcellosolve 30%, Butanol 20%, Xylol 50% |
| Lösungsmittel 650 | Ethylcellosolve 20%, Butanol 30%, Xylol 50% |
| Lösungsmittel 651 | Testbenzin 90%, Butanol 10% |
| Lösungsmittel KR-36 | Butylacetat 20%, Butanol 80% |
| Lösungsmittel R-4 | Toluol 62%, Aceton 26%, Butylacetat 12%. |
| Lösungsmittel R-10 | Xylol 85%, Aceton 15%. |
| Lösungsmittel R-12 | Toluol 60%, Butylacetat 30%, Xylol 10%. |
| Lösungsmittel R-14 | Cyclohexanon 50%, Toluol 50%. |
| Lösungsmittel R-24 | Lösungsmittel 50%, Xylol 35%, Aceton 15%. |
| Lösungsmittel R-40 | Toluol 50%, Ethylcellosolve 30%, Aceton 20%. |
| Lösungsmittel R-219 | Toluol 34%, Cyclohexanon 33%, Aceton 33%. |
| Lösungsmittel R-3160 | Butanol 60%, Ethanol 40%. |
| Lösungsmittel RCC | Xylol 90%, Butylacetat 10%. |
| Lösungsmittel RML | Ethanol 64%, Ethylcellosolve 16%, Toluol 10%, Butanol 10%. |
| Lösungsmittel PML-315 | Toluol 25%, Xylol 25%, Butylacetat 18%, Ethylcellosolve 17%, Butanol 15%. |
| Lösungsmittel PC-1 | Toluol 60%, Butylacetat 30%, Xylol 10%. |
| Lösungsmittel PC-2 | Testbenzin 70%, Xylol 30%. |
| Lösungsmittel RFG | Ethanol 75%, Butanol 25%. |
| Lösungsmittel RE-1 | Xylol 50%, Aceton 20%, Butanol 15%, Ethanol 15%. |
| Lösungsmittel RE-2 | Lösungsmittel 70%, Ethanol 20%, Aceton 10%. |
| Lösungsmittel RE-3 | Lösungsmittel 50%, Ethanol 20%, Aceton 20%, Ethylcellosolve 10%. |
| Lösungsmittel RE-4 | Lösungsmittel 50%, Aceton 30%, Ethanol 20%. |
| Lösungsmittel FK-1 (?) | absoluter Alkohol (99,8%) 95%, Ethylacetat 5% |
Verdünnungsmittel
| Bezeichnung | Zusammensetzung ⓘ |
|---|---|
| Verdünner RKB-1 | Butanol 50%, Xylol 50% |
| Verdünnung RKB-2 | Butanol 95%, Xylol 5% |
| Verdünnung RKB-3 | Xylol 90%, Butanol 10% |
| Verdünnung M | Ethanol 65%, Butylacetat 30%, Ethylacetat 5%. |
| Verdünnung P-7 | Cyclohexanon 50%, Ethanol 50%. |
| Verdünnung R-197 | Xylol 60%, Butylacetat 20%, Ethylcellosolve 20%. |
| Verdünnung von WFD | Toluol 50%, Butylacetat (oder Amylacetat) 18%, Butanol 10%, Ethanol 10%, Ethylacetat 9%, Aceton 3%. |
Physikalische Eigenschaften
Tabelle der Eigenschaften gängiger Lösungsmittel
Die Lösungsmittel werden in unpolare, polare aprotische und polare protische Lösungsmittel eingeteilt, wobei jede Gruppe nach zunehmender Polarität geordnet ist. Die Eigenschaften von Lösungsmitteln, die die von Wasser übertreffen, sind fett gedruckt. ⓘ
| Lösungsmittel | Chemische Formel | Siedepunkt (°C) |
Dielektrische Konstante | Dichte (g/ml) |
Dipolmoment (D) ⓘ |
|---|---|---|---|---|---|
|
Unpolare Kohlenwasserstofflösungsmittel | |||||
| Pentan | 
CH3CH2CH2CH2CH3 |
36.1 | 1.84 | 0.626 | 0.00 |
| Hexan | 
CH3CH2CH2CH2CH2CH3 |
69 | 1.88 | 0.655 | 0.00 |
| Benzol |  C6H6 |
80.1 | 2.3 | 0.879 | 0.00 |
| Heptan | 
H3C(CH2)5CH3 |
98.38 | 1.92 | 0.680 | 0.0 |
| Toluol | 
C6H5-CH3 |
111 | 2.38 | 0.867 | 0.36 |
|
Unpolare Ether-Lösungsmittel | |||||
| 1,4-Dioxan |  C4H8O2 |
101.1 | 2.3 | 1.033 | 0.45 |
| Diethylether | 
CH3CH2-O-CH2CH3 |
34.6 | 4.3 | 0.713 | 1.15 |
| Tetrahydrofuran (THF) |  C4H8O |
66 | 7.5 | 0.886 | 1.75 |
|
Unpolare Chlorkohlenwasserstoff-Lösungsmittel | |||||
| Chloroform | 
CHCl3 |
61.2 | 4.81 | 1.498 | 1.04 |
| Polare aprotische Lösungsmittel | |||||
| Dichlormethan (DCM) | 
CH2Cl2 |
39.6 | 9.1 | 1.3266 | 1.60 |
| Ethylacetat |  CH3-C(=O)-O-CH2-CH3 |
77.1 | 6.02 | 0.894 | 1.78 |
| Aceton |  CH3-C(=O)-CH3 |
56.1 | 21 | 0.786 | 2.88 |
| Dimethylformamid (DMF) |  H-C(=O)N(CH3)2 |
153 | 38 | 0.944 | 3.82 |
| Acetonitril (MeCN) | CH3-C≡N |
82 | 37.5 | 0.786 | 3.92 |
| Dimethylsulfoxid (DMSO) |  CH3-S(=O)-CH3 |
189 | 46.7 | 1.092 | 3.96 |
| Nitromethan | 
CH3-NO2 |
100–103 | 35.87 | 1.1371 | 3.56 |
| Propylencarbonat | 
C4H6O3 |
240 | 64.0 | 1.205 | 4.9 |
|
Polare protische Lösungsmittel | |||||
| Ammoniak | 
NH3 |
-33.3 | 17 | 0.674
(bei -33,3 °C) |
1.42 |
| Ameisensäure |  H-C(=O)OH |
100.8 | 58 | 1.21 | 1.41 |
| n-Butanol | CH3CH2CH2CH2OH |
117.7 | 18 | 0.810 | 1.63 |
| Isopropylalkohol (IPA) |  CH3-CH(-OH)-CH3 |
82.6 | 18 | 0.785 | 1.66 |
| n-Propanol | 
CH3CH2CH2OH |
97 | 20 | 0.803 | 1.68 |
| Ethanol | CH3CH2OH |
78.2 | 24.55 | 0.789 | 1.69 |
| Methanol | 
CH3OH |
64.7 | 33 | 0.791 | 1.70 |
| Essigsäure |  CH3-C(=O)OH |
118 | 6.2 | 1.049 | 1.74 |
| Wasser | 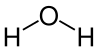 H-O-H |
100 | 80 | 1.000 | 1.85 |
Das ACS Green Chemistry Institute unterhält ein Tool für die Auswahl von Lösungsmitteln auf der Grundlage einer Hauptkomponentenanalyse der Lösungsmitteleigenschaften. ⓘ
Hansen-Löslichkeitsparameter-Werte
Die Hansen-Löslichkeitsparameterwerte basieren auf Dispersionsbindungen (δD), polaren Bindungen (δP) und Wasserstoffbrückenbindungen (δH). Sie enthalten Informationen über die intermolekularen Wechselwirkungen mit anderen Lösungsmitteln und auch mit Polymeren, Pigmenten, Nanopartikeln usw. Dies ermöglicht rationelle Formulierungen, wenn man beispielsweise weiß, dass es eine gute HSP-Übereinstimmung zwischen einem Lösungsmittel und einem Polymer gibt. Rationale Substitutionen können auch für "gute" Lösungsmittel (die den gelösten Stoff wirksam auflösen), die "schlecht" sind (teuer oder gesundheits- oder umweltschädlich), vorgenommen werden. Die folgende Tabelle zeigt, dass die Intuitionen von "unpolaren", "polaren aprotischen" und "polaren protischen" Molekülen in Zahlen ausgedrückt werden - die "polaren" Moleküle haben höhere δP-Werte und die protischen Lösungsmittel haben höhere δH-Werte. Da numerische Werte verwendet werden, können Vergleiche auf rationale Weise durch den Vergleich von Zahlen durchgeführt werden. Zum Beispiel ist Acetonitril viel polarer als Aceton, weist aber etwas weniger Wasserstoffbrückenbindung auf. ⓘ
| Lösungsmittel | Chemische Formel | δD Dispersion | δP Polar | δH Wasserstoffbrückenbindungen ⓘ |
|---|---|---|---|---|
|
Unpolare Lösungsmittel | ||||
| n-Hexan | CH3CH2CH2CH2CH2CH3 | 14.9 | 0.0 | 0.0 |
| Benzol | C6H6 | 18.4 | 0.0 | 2.0 |
| Toluol | C6H5-CH3 | 18.0 | 1.4 | 2.0 |
| Diethylether | CH3CH2-O-CH2CH3 | 14.5 | 2.9 | 4.6 |
| Chloroform | CHCl3 | 17.8 | 3.1 | 5.7 |
| 1,4-Dioxan | /-CH2-CH2-O-CH2-CH2-O-\ | 17.5 | 1.8 | 9.0 |
|
Polare aprotische Lösungsmittel | ||||
| Ethylacetat | CH3-C(=O)-O-CH2-CH3 | 15.8 | 5.3 | 7.2 |
| Tetrahydrofuran (THF) | /-CH2-CH2-O-CH2-CH2-\ | 16.8 | 5.7 | 8.0 |
| Dichlormethan | CH2Cl2 | 17.0 | 7.3 | 7.1 |
| Aceton | CH3-C(=O)-CH3 | 15.5 | 10.4 | 7.0 |
| Acetonitril (MeCN) | CH3-C≡N | 15.3 | 18.0 | 6.1 |
| Dimethylformamid (DMF) | H-C(=O)N(CH3)2 | 17.4 | 13.7 | 11.3 |
| Dimethylsulfoxid (DMSO) | CH3-S(=O)-CH3 | 18.4 | 16.4 | 10.2 |
|
Polare protische Lösungsmittel | ||||
| Essigsäure | CH3-C(=O)OH | 14.5 | 8.0 | 13.5 |
| n-Butanol | CH3CH2CH2CH2OH | 16.0 | 5.7 | 15.8 |
| Isopropanol | CH3-CH(-OH)-CH3 | 15.8 | 6.1 | 16.4 |
| n-Propanol | CH3CH2CH2OH | 16.0 | 6.8 | 17.4 |
| Ethanol | CH3CH2OH | 15.8 | 8.8 | 19.4 |
| Methanol | CH3OH | 14.7 | 12.3 | 22.3 |
| Ameisensäure | H-C(=O)OH | 14.6 | 10.0 | 14.0 |
| Wasser | H-O-H | 15.5 | 16.0 | 42.3 |
Wenn aus Umwelt- oder anderen Gründen ein Lösungsmittel oder ein Lösungsmittelgemisch ein anderes mit gleichwertiger Löslichkeit ersetzen muss, kann die Substitution auf der Grundlage der Hansen-Löslichkeitsparameter der einzelnen Stoffe erfolgen. Die Werte für Gemische werden als gewichtete Mittelwerte der Werte für die reinen Lösungsmittel genommen. Dies kann durch Versuch und Irrtum, eine Wertetabelle oder eine HSP-Software berechnet werden. Ein 1:1-Gemisch aus Toluol und 1,4-Dioxan hat δD-, δP- und δH-Werte von 17,8, 1,6 und 5,5, vergleichbar mit denen von Chloroform (17,8, 3,1 und 5,7). Aufgrund der Gesundheitsgefahren, die von Toluol selbst ausgehen, können andere Lösungsmittelgemische unter Verwendung eines vollständigen HSP-Datensatzes gefunden werden. ⓘ
Siedepunkt
| Lösungsmittel | Siedepunkt (°C) ⓘ |
|---|---|
| Ethylendichlorid | 83.48 |
| Pyridin | 115.25 |
| Methylisobutylketon | 116.5 |
| Methylenchlorid | 39.75 |
| Isooktan | 99.24 |
| Kohlenstoffdisulfid | 46.3 |
| Tetrachlorkohlenstoff | 76.75 |
| o-Xylol | 144.42 |
Der Siedepunkt ist eine wichtige Eigenschaft, da er die Geschwindigkeit der Verdampfung bestimmt. Kleine Mengen von Lösungsmitteln mit niedrigem Siedepunkt wie Diethylether, Dichlormethan oder Aceton verdampfen bei Raumtemperatur innerhalb von Sekunden, während Lösungsmittel mit hohem Siedepunkt wie Wasser oder Dimethylsulfoxid für eine schnelle Verdampfung höhere Temperaturen, einen Luftstrom oder die Anwendung von Vakuum benötigen.
- Niedrige Siedepunkte: Siedepunkt unter 100 °C (Siedepunkt von Wasser)
- Mittlere Siedepunkte: zwischen 100 °C und 150 °C
- Hochsieder: über 150 °C ⓘ
Dichte
Die meisten organischen Lösungsmittel haben eine geringere Dichte als Wasser, d. h. sie sind leichter als dieses und bilden eine Schicht auf dem Wasser. Wichtige Ausnahmen sind die meisten halogenierten Lösungsmittel wie Dichlormethan oder Chloroform, die auf den Boden eines Behälters sinken und Wasser als oberste Schicht zurücklassen. Dies ist von entscheidender Bedeutung, wenn man bei chemischen Synthesen die Verbindungen in einem Scheidetrichter zwischen Lösungsmitteln und Wasser aufteilt. ⓘ
Häufig wird anstelle der Dichte das spezifische Gewicht angegeben. Die spezifische Schwerkraft ist definiert als die Dichte des Lösungsmittels geteilt durch die Dichte von Wasser bei derselben Temperatur. Das spezifische Gewicht ist also ein Wert ohne Einheit. Sie gibt Aufschluss darüber, ob ein wasserunlösliches Lösungsmittel schwimmt (SG < 1,0) oder sinkt (SG > 1,0), wenn es mit Wasser gemischt wird. ⓘ
| Lösungsmittel | Spezifische Schwerkraft ⓘ |
|---|---|
| Pentan | 0.626 |
| Petrolether | 0.656 |
| Hexan | 0.659 |
| Heptan | 0.684 |
| Diethylamin | 0.707 |
| Diethylether | 0.713 |
| Triethylamin | 0.728 |
| Tert-Butylmethylether | 0.741 |
| Cyclohexan | 0.779 |
| Tert.-Butylalkohol | 0.781 |
| Isopropanol | 0.785 |
| Acetonitril | 0.786 |
| Ethanol | 0.789 |
| Aceton | 0.790 |
| Methanol | 0.791 |
| Methylisobutylketon | 0.798 |
| Isobutylalkohol | 0.802 |
| 1-Propanol | 0.803 |
| Methylethylketon | 0.805 |
| 2-Butanol | 0.808 |
| Isoamylalkohol | 0.809 |
| 1-Butanol | 0.810 |
| Diethylketon | 0.814 |
| 1-Octanol | 0.826 |
| p-Xylol | 0.861 |
| m-Xylol | 0.864 |
| Toluol | 0.867 |
| Dimethoxyethan | 0.868 |
| Benzol | 0.879 |
| Butylacetat | 0.882 |
| 1-Chlorbutan | 0.886 |
| Tetrahydrofuran | 0.889 |
| Ethylacetat | 0.895 |
| o-Xylol | 0.897 |
| Hexamethylphosphortriamid | 0.898 |
| 2-Ethoxyethylether | 0.909 |
| N,N-Dimethylacetamid | 0.937 |
| Diethylenglykol-Dimethylether | 0.943 |
| N,N-Dimethylformamid | 0.944 |
| 2-Methoxyethanol | 0.965 |
| Pyridin | 0.982 |
| Propancarbonsäure | 0.993 |
| Wasser | 1.000 |
| 2-Methoxyethylacetat | 1.009 |
| Benzonitril | 1.01 |
| 1-Methyl-2-pyrrolidinon | 1.028 |
| Hexamethylphosphoramid | 1.03 |
| 1,4-Dioxan | 1.033 |
| Essigsäure | 1.049 |
| Essigsäureanhydrid | 1.08 |
| Dimethylsulfoxid | 1.092 |
| Chlorbenzol | 1.1066 |
| Deuteriumoxid | 1.107 |
| Ethylenglykol | 1.115 |
| Diethylenglykol | 1.118 |
| Propylencarbonat | 1.21 |
| Ameisensäure | 1.22 |
| 1,2-Dichlorethan | 1.245 |
| Glyzerin | 1.261 |
| Kohlenstoffdisulfid | 1.263 |
| 1,2-Dichlorbenzol | 1.306 |
| Methylenchlorid | 1.325 |
| Nitromethan | 1.382 |
| 2,2,2-Trifluorethanol | 1.393 |
| Chloroform | 1.498 |
| 1,1,2-Trichlortrifluorethan | 1.575 |
| Tetrachlorkohlenstoff | 1.594 |
| Tetrachlorethylen | 1.623 |
Sicherheit
Feuer
Die meisten organischen Lösungsmittel sind je nach ihrer Flüchtigkeit brennbar oder leicht brennbar. Ausnahmen sind einige chlorierte Lösungsmittel wie Dichlormethan und Chloroform. Gemische aus Lösungsmitteldämpfen und Luft können explodieren. Lösungsmitteldämpfe sind schwerer als Luft; sie sinken auf den Boden und können fast unverdünnt große Entfernungen zurücklegen. Lösungsmitteldämpfe können sich auch in vermeintlich leeren Fässern und Kanistern befinden und stellen eine Brandgefahr dar; daher sollten leere Behälter mit flüchtigen Lösungsmitteln offen und auf dem Kopf stehend gelagert werden. ⓘ
Sowohl Diethylether als auch Schwefelkohlenstoff haben außergewöhnlich niedrige Selbstentzündungstemperaturen, die das Brandrisiko im Zusammenhang mit diesen Lösungsmitteln stark erhöhen. Die Selbstentzündungstemperatur von Schwefelkohlenstoff liegt unter 100 °C (212 °F), so dass Gegenstände wie Dampfleitungen, Glühbirnen, Kochplatten und kürzlich gelöschte Bunsenbrenner die Dämpfe entzünden können. ⓘ
Außerdem können einige Lösungsmittel, wie z. B. Methanol, mit einer sehr heißen Flamme brennen, die unter bestimmten Beleuchtungsbedingungen fast unsichtbar sein kann. Dadurch kann das rechtzeitige Erkennen eines gefährlichen Brandes verzögert oder verhindert werden, bis die Flammen auf andere Materialien übergreifen. ⓘ
Explosive Peroxidbildung
Ether wie Diethylether und Tetrahydrofuran (THF) können bei Einwirkung von Sauerstoff und Licht hochexplosive organische Peroxide bilden. Bei THF ist die Wahrscheinlichkeit der Bildung solcher Peroxide normalerweise größer als bei Diethylether. Eines der empfindlichsten Lösungsmittel ist Diisopropylether, aber alle Ether gelten als potenzielle Peroxidquellen. ⓘ
Das Heteroatom (Sauerstoff) stabilisiert die Bildung eines freien Radikals, das durch die Abstraktion eines Wasserstoffatoms durch ein anderes freies Radikal entsteht. Das auf diese Weise gebildete kohlenstoffzentrierte freie Radikal kann mit einem Sauerstoffmolekül reagieren und eine Peroxidverbindung bilden. Der Prozess der Peroxidbildung wird schon durch geringe Lichteinwirkung stark beschleunigt, kann aber auch im Dunkeln langsam ablaufen. ⓘ
Sofern kein Trockenmittel verwendet wird, das die Peroxide zerstören kann, konzentrieren sie sich bei der Destillation aufgrund ihres höheren Siedepunkts. Wenn sich genügend Peroxide gebildet haben, können sie an der Mündung eines Behälters oder einer Flasche einen kristallinen, stoßempfindlichen festen Niederschlag bilden. Geringfügige mechanische Störungen, wie z. B. das Kratzen an der Innenseite eines Gefäßes oder das Lösen einer Ablagerung, oder das bloße Drehen des Deckels können genügend Energie liefern, um das Peroxid explodieren oder detonieren zu lassen. Die Bildung von Peroxiden ist kein großes Problem, wenn frische Lösungsmittel schnell verbraucht werden; sie sind eher ein Problem in Labors, in denen es Jahre dauern kann, bis eine einzige Flasche aufgebraucht ist. Anwender mit geringen Mengen sollten nur kleine Mengen peroxidanfälliger Lösungsmittel erwerben und alte Lösungsmittel in regelmäßigen Abständen entsorgen. ⓘ
Um eine explosive Peroxidbildung zu vermeiden, sollten Ether in einem luftdicht verschlossenen Behälter und vor Licht geschützt gelagert werden, da sowohl Licht als auch Luft die Peroxidbildung fördern können. ⓘ
Um das Vorhandensein eines Peroxids in einem Ether nachzuweisen, kann eine Reihe von Tests durchgeführt werden; einer davon ist die Verwendung einer Kombination aus Eisen(II)-sulfat und Kaliumthiocyanat. Das Peroxid ist in der Lage, das Fe2+-Ion zu einem Fe3+-Ion zu oxidieren, das dann einen tiefroten Koordinationskomplex mit dem Thiocyanat bildet. ⓘ
Peroxide können durch Waschen mit saurem Eisen(II)-sulfat, Filtrieren durch Tonerde oder Destillieren von Natrium/Benzophenon entfernt werden. Tonerde baut die Peroxide ab, aber einige können darin intakt bleiben, weshalb sie ordnungsgemäß entsorgt werden müssen. Der Vorteil der Verwendung von Natrium/Benzophenon ist, dass auch Feuchtigkeit und Sauerstoff entfernt werden. ⓘ
Gesundheitliche Auswirkungen
Zu den allgemeinen Gesundheitsgefahren im Zusammenhang mit der Exposition gegenüber Lösungsmitteln gehören Toxizität für das Nervensystem, Fortpflanzungsschäden, Leber- und Nierenschäden, Beeinträchtigung der Atemwege, Krebs und Dermatitis. ⓘ
Akute Exposition
Viele Lösungsmittel können zu einem plötzlichen Bewusstseinsverlust führen, wenn sie in großen Mengen eingeatmet werden. Lösungsmittel wie Diethylether und Chloroform werden in der Medizin seit langem als Anästhetika, Sedativa und Hypnotika verwendet. Ethanol (Getreidealkohol) ist eine weit verbreitete und missbrauchte psychoaktive Droge. Diethylether, Chloroform und viele andere Lösungsmittel, z. B. aus Benzin oder Klebstoffen, werden in der Freizeit zum Klebstoffschnüffeln missbraucht, oft mit gesundheitsschädlichen Langzeitfolgen wie Neurotoxizität oder Krebs. Die betrügerische Substitution von 1,5-Pentandiol durch das psychoaktive 1,4-Butandiol durch einen Zulieferer war der Grund für den Rückruf der Bindeez-Produkte. Die so genannten toxischen Alkohole (mit Ausnahme von Ethanol) wie Methanol, Propanol und Ethylenglykol verwandeln sich bei Einnahme in toxische Aldehyde und Säuren, die eine potenziell tödliche metabolische Azidose verursachen. Das handelsübliche alkoholische Lösungsmittel Methanol kann bei Verschlucken zu dauerhafter Erblindung oder zum Tod führen. Das Lösungsmittel 2-Butoxyethanol, das in Fracking-Flüssigkeiten verwendet wird, kann zu Hypotonie und metabolischer Azidose führen. ⓘ
Chronische Exposition
Einige Lösungsmittel, darunter Chloroform und Benzol, ein häufiger Bestandteil von Benzin, sind als krebserregend bekannt, während viele andere von der Weltgesundheitsorganisation als wahrscheinlich krebserregend eingestuft werden. Lösungsmittel können innere Organe wie die Leber, die Nieren, das Nervensystem oder das Gehirn schädigen. Die kumulativen Auswirkungen einer langfristigen oder wiederholten Exposition gegenüber Lösungsmitteln werden als chronische lösungsmittelinduzierte Enzephalopathie (CSE) bezeichnet. ⓘ
Die chronische Exposition gegenüber organischen Lösungsmitteln in der Arbeitsumgebung kann eine Reihe von negativen neuropsychiatrischen Auswirkungen haben. So wurde beispielsweise die berufliche Exposition gegenüber organischen Lösungsmitteln mit einer höheren Zahl von alkoholkranken Malern in Verbindung gebracht. Ethanol hat eine synergistische Wirkung, wenn es in Kombination mit vielen Lösungsmitteln eingenommen wird; so verursacht beispielsweise eine Kombination aus Toluol/Benzol und Ethanol stärkere Übelkeit/Erbrechen als eine der beiden Substanzen allein. ⓘ
Von vielen Lösungsmitteln ist bekannt oder wird vermutet, dass sie kataraktogen sind, d. h., dass sie das Risiko der Entwicklung von Katarakten in der Augenlinse stark erhöhen. Die Exposition gegenüber Lösemitteln wurde auch mit neurotoxischen Schäden in Verbindung gebracht, die zu Hörverlust und Verlust des Farbsehens führen. ⓘ
Umweltverschmutzung
Ein wichtiger Weg, um gesundheitliche Auswirkungen zu verursachen, ergibt sich aus verschütteten oder ausgelaufenen Lösungsmitteln, die in den Boden gelangen. Da Lösungsmittel leicht über große Entfernungen wandern, ist eine weitreichende Bodenverunreinigung nicht ungewöhnlich; dies ist insbesondere dann ein Gesundheitsrisiko, wenn Grundwasserleiter betroffen sind. Das Eindringen von Dämpfen kann an Standorten mit ausgedehnter unterirdischer Verunreinigung durch Lösungsmittel auftreten. ⓘ
„Lösungsmittel“ oder „Lösemittel“
Beide Bezeichnungen finden sich seit über 200 Jahren in der Literatur. Im Forschungs- und Laborbereich hat sich Lösungsmittel etabliert, in der industriellen und technischen Großchemie dagegen Lösemittel. Beispielsweise spricht das Römpp Lexikon Chemie von Lösungsmittel, während die TRGS (Technische Regeln für Gefahrstoffe) Lösemittel bevorzugen. ⓘ
Definition im Alltag
Das wohl bekannteste Lösungsmittel ist Wasser. Im Hinblick auf Farben, Lacke, Klebstoffe usw. denkt man jedoch bei dem Begriff „Lösungsmittel“ eher an Stoffe, die unangenehme Gerüche, Gesundheits- und Umweltschäden verursachen, oder sogar explosive Dämpfe freisetzen können. Gemeint sind hierbei Lösemittel im Sinne der TRGS (Technische Regeln für Gefahrstoffe) 610, nach der nur flüchtige organische Lösemittel mit einem Siedepunkt bis 200 °C als Lösemittel bezeichnet werden. ⓘ
Als lösemittelfrei gelten Produkte, wenn der Lösemittelgehalt des verarbeitungsfertigen Produktes kleiner ist als 0,5 %. ⓘ
Die als „Hochsieder“, bezeichneten, nur wenig flüchtigen Substanzen mit Siedepunkten über 200 °C, gelten daher rechtlich nicht als Lösemittel. Während klassische Lösemittel aufgrund ihrer Flüchtigkeit schon wenige Stunden bis Tage nach der Verarbeitung vollständig verdunstet sind, können die in manchen als „lösemittelfrei bezeichneten“ Produkten ersatzweise enthaltenen Hochsieder unter Umständen noch über Monate oder Jahre an die Raumluft abgegeben werden. Sie werden daher teils sogar deutlich kritischer beurteilt als Produkte, die klassische, leicht flüchtige Lösemittel enthalten. Gerade die Vermeidung von giftigen, langfristig haltbaren, umweltschädlichen Substanzen ist Bestandteil der Grünen Chemie. ⓘ
Marktwirtschaftliche Aspekte
Die wichtigste Lösungsmittel-Gruppe sind Alkohole, wie Ethanol, n-Butanol, Isopropanol und Methanol. Im Jahr 2011 wurden hiervon weltweit ca. 6,4 Mio. Tonnen nachgefragt. Ein überdurchschnittlicher Verbrauchsanstieg von jährlich mehr als 3 % wird in der Periode 2011 bis 2019 bei Ethanol sowie bei den Ethern erwartet. Neben den halogenierten Lösungsmitteln, die in Westeuropa und Nordamerika ihren Abwärtstrend fortsetzen, werden auch Aromaten und reine Kohlenwasserstoffe langfristig weiter an Bedeutung verlieren. ⓘ
Einteilungen
Aprotische Lösungsmittel
Aprotisch-unpolar
Alkane sind wegen des geringen Unterschieds in der Elektronegativität zwischen Kohlenstoff und Wasserstoff unpolar. Dies macht alle Stoffe dieser Gruppen ineinander leicht löslich; sie sind sehr lipophil (eigentlich noch lipophiler als die sehr schwach polaren, namensgebenden Fette) und sehr hydrophob (wasserabweisend). Aber nicht nur Wasser kann sich nicht lösen, sondern alle anderen stark polaren Stoffe auch nicht, wie z. B. kurzkettige Alkohole, Chlorwasserstoff oder Salze. In der Flüssigkeit werden die Teilchen lediglich von Van-der-Waals-Kräften zusammengehalten. Deshalb fallen bei dieser Stoffgruppe die Siedetemperaturen im Vergleich zu Molekülgröße und -masse wesentlich niedriger aus als bei permanenten Dipolen. Da eine Abspaltung von Protonen unter Bildung von Carbanionen nur mit extrem starken Basen möglich ist, sind sie aprotisch. Ebenfalls zur Gruppe der aprotisch-unpolaren Lösungsmittel gezählt werden außerdem Verbindungen wie etwa Carbonsäureester oder Ether, die zwar polare Bindungen enthalten, aufgrund ihrer niedrigen Permittivität jedoch nicht in der Lage sind, ionische Verbindungen aufzulösen. ⓘ
Vertreter dieser Gruppe sind:
- Alkane (Paraffine)
- Alkene (Olefine), Alkine
- Benzol und andere Aromaten mit aliphatischen und aromatischen Substituenten
- Carbonsäureester
- Ether, z. B. Diethylether
- völlig symmetrisch gebaute Moleküle wie etwa Tetramethylsilan oder Tetrachlorkohlenstoff
- Kohlenstoffdisulfid, bei hohem Druck auch Kohlenstoffdioxid ⓘ
- halogenierte Kohlenwasserstoffe, die entweder (wie Tetrachlorkohlenstoff) völlig unpolar oder aber trotz der hohen Elektronegativität des betreffenden Halogens, z. B. Chlors, nur wenig polar (Methylenchlorid) sind ⓘ
- Eine spezielle Untergruppe halogenierter Kohlenwasserstoffe bilden dabei die perfluorierten Kohlenwasserstoffe (z. B. Hexafluorbenzol), die nicht nur selber unpolar, sondern auch sehr schlecht von außen polarisierbar sind und sich daher auch mit den übrigen unpolaren Lösungsmitteln eher schlecht vertragen. ⓘ
Tabelle mit alkoholischen Lösungsmitteln und ihren Verdunstungsraten
relativ zu Essigsäure-n-butylester (= 1) ⓘ
| Lösungsmittel | Siedep. [°C] |
Verdunstungsrate ⓘ |
|---|---|---|
| Methanol | 65 | 2,1 |
| Ethanol | 78 | 1,6 |
| 2-Propanol | 82 | 1,4 |
| tert-Butanol | 83 | 0,95 |
| tert-Amylalkohol | 102 | 0,93 |
| 1-Propanol | 97 | 0,86 |
| 2-Butanol | 100 | 0,81 |
| 2-Methyl-1-propanol | 108 | 0,62 |
| 1-Butanol | 118 | 0,44 |
| 4-Methyl-2-pentanol (MIBC) | 132 | 0,3 |
| 1-Pentanol (Amylalkohol) | 137 | 0,2 |
| Diacetonalkohol | 166 | 0,14 |
| 2-Ethyl-1-butanol | 146 | 0,11 |
| Hexanol | 148 | 0,096 |
| Cyclohexanol | 161 | 0,05 |
| Tetrahydrofurfurylalkohol | 178 | 0,03 |
| 2-Ethylhexanol | 185 | 0,02 |
| 2-Octanol | 177 | 0,018 |
| 1-Octanol | 196 | 0,007 |
| Benzylalkohol | 205 | 0,007 |
| 1-Decanol | 231 | 0,001 |
Indifferente Lösungsmittel
Unter einem indifferenten bzw. neutralen Lösungsmittel wird in der Polymerchemie ein Medium verstanden, das
- Abbruch- und Übertragungsreaktionen von Polymerisationen und dadurch auch Polymerisationsgeschwindigkeit und -grad wenig bis nicht beeinflusst.
- für alle Domänen eines Blockcopolymers gleiche Lösungseigenschaften aufweist (das Gegenteil ist ein selektives Lösungsmittel). ⓘ
„Schwere“ und „leichte“ Lösemittel
Speziell bei Extraktionen mit oder aus Wasser unterscheidet man zwischen schweren und leichten Lösemitteln, weil je nach Dichte des Lösemittels ggf. andere Methoden oder andere Apparaturen anzuwenden sind. Die Bezeichnung schwer oder leicht bezieht sich auf die Dichte von Wasser. Lösemittel werden als schwer bezeichnet, wenn die Dichte größer als die von Wasser, und als leicht, wenn sie niedriger ist. ⓘ