Hämoglobin
| Hämoglobin ⓘ | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (Heterotetramer, (αβ)2) | |||||||||||||
 Struktur des menschlichen Hämoglobins. α- und β-Untereinheiten sind in rot bzw. blau dargestellt, die eisenhaltigen Hämgruppen in grün. Aus PDB: 1GZX Proteopedia Hämoglobin | |||||||||||||
| Protein-Typ | Metalloprotein, Globulin | ||||||||||||
| Funktion | Sauerstofftransport | ||||||||||||
| Kofaktor(en) | Häm (4) | ||||||||||||
| |||||||||||||
Hämoglobin (Hämoglobin BrE) (vom griechischen Wort αἷμα, haîma 'Blut' + lateinisch globus 'Ball, Kugel' + -in) (/ˌhiːməˈɡloʊbɪn, ˈhɛmoʊˌ-/), abgekürzt Hb oder Hgb, ist das eisenhaltige sauerstofftransportierende Metalloprotein in den roten Blutkörperchen (Erythrozyten) fast aller Wirbeltiere (mit Ausnahme der Fischfamilie Channichthyidae) sowie in den Geweben einiger Wirbeltiere. Das Hämoglobin im Blut transportiert den Sauerstoff von den Atmungsorganen (z. B. Lunge oder Kiemen) zum Rest des Körpers (d. h. zu den Geweben). Dort setzt es den Sauerstoff frei, um die aerobe Atmung zu ermöglichen, die Energie für die Funktionen eines Organismus im so genannten Stoffwechselprozess bereitstellt. Ein gesunder Mensch hat 12 bis 20 Gramm Hämoglobin pro 100 ml Blut. ⓘ
Bei Säugetieren macht das Chromoprotein etwa 96 % des Trockengehalts (nach Gewicht) der roten Blutkörperchen aus, und etwa 35 % des Gesamtgehalts (einschließlich Wasser). Hämoglobin hat eine Sauerstoffbindungskapazität von 1,34 mL O2 pro Gramm, was die Gesamtsauerstoffkapazität des Blutes im Vergleich zu gelöstem Sauerstoff im Blut um das Siebzigfache erhöht. Das Hämoglobinmolekül eines Säugetiers kann bis zu vier Sauerstoffmoleküle binden (transportieren). ⓘ
Hämoglobin ist auch am Transport von anderen Gasen beteiligt: Es transportiert einen Teil des Kohlendioxids aus der Atmung (etwa 20-25 % der Gesamtmenge) als Carbamino-Hämoglobin, bei dem das CO2 an das Häm-Protein gebunden ist. Das Molekül enthält auch das wichtige Regulierungsmolekül Stickstoffmonoxid, das an eine Thiolgruppe im Globinprotein gebunden ist und gleichzeitig mit dem Sauerstoff freigesetzt wird. ⓘ
Hämoglobin findet sich auch außerhalb der roten Blutkörperchen und ihrer Vorläuferlinien. Weitere Zellen, die Hämoglobin enthalten, sind die dopaminergen A9-Neuronen in der Substantia nigra, Makrophagen, Alveolarzellen, die Lunge, das Pigmentepithel der Netzhaut, Hepatozyten, Mesangialzellen in der Niere, Endometriumzellen, Gebärmutterhalszellen und Vaginalepithelzellen. In diesen Geweben hat Hämoglobin eine nicht sauerstofftragende Funktion als Antioxidans und als Regulator des Eisenstoffwechsels. Überschüssige Glukose im Blut kann sich an Hämoglobin anlagern und den Hämoglobin-A1c-Wert erhöhen. ⓘ
Hämoglobin und hämoglobinähnliche Moleküle finden sich auch in vielen wirbellosen Tieren, Pilzen und Pflanzen. In diesen Organismen können Hämoglobine Sauerstoff transportieren oder auch andere kleine Moleküle und Ionen wie Kohlendioxid, Stickstoffoxid, Schwefelwasserstoff und Sulfid transportieren und regulieren. Eine Variante des Moleküls, das so genannte Leghämoglobin, wird verwendet, um Sauerstoff aus anaeroben Systemen wie den Stickstoff fixierenden Knöllchen von Leguminosen zu entfernen, damit der Sauerstoff das System nicht vergiftet (deaktiviert). ⓘ
Hämoglobinämie ist ein medizinischer Zustand, bei dem es zu einem Überschuss an Hämoglobin im Blutplasma kommt. Dies ist eine Folge der intravaskulären Hämolyse, bei der sich das Hämoglobin von den roten Blutkörperchen löst, eine Form der Anämie. ⓘ
Das Hämoglobin von Säugetieren ist ein Tetramer, es besteht aus vier Globinen als Untereinheiten. Beim erwachsenen Menschen sind dies je zwei Hb α und Hb β im Hämoglobin A (Hb A0), der häufigsten Form. Die vier den Komplex bildenden Proteine sind Aminosäureketten (α-Kette 141 AS; β-Kette 146 AS) in der für Globine typischen Faltung mit jeweils einer Tasche, in der ein Eisen-II-Komplex, das Häm, gebunden ist. Dessen Eisenion vermag ein Sauerstoffmolekül zu binden. Dabei ändert sich die Farbe des Häms von dunkel- zu hellrot. Die Bindungsstärke hängt empfindlich von der Konformation der Proteinumgebung des Häms ab. Wechselwirkungen zwischen den vier Globinen begünstigen die beiden extremen Zustände, in denen der Gesamtkomplex entweder mit vier Molekülen Sauerstoff gesättigt ist (in der Lunge bzw. den Kiemen) oder allen Sauerstoff abgegeben hat. Wechselwirkungen mit anderen Molekülen unterstützen die Beladung wie die Entladung. ⓘ
Zum Vorkommen von Hämoglobin und ähnlicher Globine im Tierreich siehe Sauerstofftransporter. ⓘ
Geschichte der Forschung

1825 entdeckte Johann Friedrich Engelhart, dass das Verhältnis von Eisen zu Eiweiß in den Hämoglobinen verschiedener Arten identisch ist. Aus der bekannten Atommasse des Eisens errechnete er die Molekülmasse des Hämoglobins zu n × 16000 (n = Anzahl der Eisenatome pro Hämoglobin, heute bekanntlich 4), die erste Bestimmung der Molekülmasse eines Proteins. Diese "voreilige Schlussfolgerung" zog damals viel Spott von Wissenschaftlern auf sich, die nicht glauben konnten, dass ein Molekül so groß sein konnte. Gilbert Smithson Adair bestätigte Engelharts Ergebnisse 1925 durch Messung des osmotischen Drucks von Hämoglobinlösungen. ⓘ
Obwohl der Sauerstofftransport im Blut seit mindestens 1794 bekannt war, wurde die sauerstofftransportierende Eigenschaft des Hämoglobins 1840 von Hünefeld beschrieben. 1851 veröffentlichte der deutsche Physiologe Otto Funke eine Reihe von Artikeln, in denen er die Züchtung von Hämoglobinkristallen durch sukzessives Verdünnen roter Blutkörperchen mit einem Lösungsmittel wie reinem Wasser, Alkohol oder Äther und anschließendes langsames Verdampfen des Lösungsmittels aus der resultierenden Proteinlösung beschrieb. Die reversible Sauerstoffanreicherung des Hämoglobins wurde einige Jahre später von Felix Hoppe-Seyler beschrieben. ⓘ
Mit der Entwicklung der Röntgenkristallographie wurde es möglich, Proteinstrukturen zu sequenzieren. 1959 bestimmte Max Perutz die Molekularstruktur des Hämoglobins. Für diese Arbeit teilte er sich 1962 den Nobelpreis für Chemie mit John Kendrew, der das kugelförmige Protein Myoglobin sequenziert hatte. ⓘ
Die Rolle des Hämoglobins im Blut wurde von dem französischen Physiologen Claude Bernard aufgeklärt. Der Name Hämoglobin leitet sich von den Wörtern Häm und Globin ab und spiegelt die Tatsache wider, dass jede Untereinheit des Hämoglobins ein kugelförmiges Protein mit einer eingebetteten Häm-Gruppe ist. Jede Hämgruppe enthält ein Eisenatom, das durch ioneninduzierte Dipolkräfte ein Sauerstoffmolekül binden kann. Der bei Säugetieren am häufigsten vorkommende Hämoglobintyp enthält vier solcher Untereinheiten. ⓘ
Genetik
Hämoglobin besteht aus Proteinuntereinheiten (den Globinmolekülen), und diese Proteine wiederum sind gefaltete Ketten aus einer großen Anzahl verschiedener Aminosäuren, die als Polypeptide bezeichnet werden. Die Aminosäuresequenz eines jeden von einer Zelle gebildeten Polypeptids wird wiederum durch die DNA-Abschnitte, die Gene, bestimmt. Bei allen Proteinen ist es die Aminosäuresequenz, die die chemischen Eigenschaften und die Funktion des Proteins bestimmt. ⓘ
Es gibt mehr als ein Hämoglobin-Gen: Beim Menschen wird Hämoglobin A (die Hauptform des Hämoglobins bei Erwachsenen) von den Genen HBA1, HBA2 und HBB codiert. Die Hämoglobin-Untereinheiten alpha 1 und alpha 2 werden von den Genen HBA1 bzw. HBA2 kodiert, die sich beide auf Chromosom 16 befinden und nahe beieinander liegen. Die Hämoglobin-Untereinheit beta wird durch das HBB-Gen kodiert, das sich auf Chromosom 11 befindet. Die Aminosäuresequenzen der Globinproteine in Hämoglobinen unterscheiden sich in der Regel zwischen den Arten. Diese Unterschiede nehmen mit dem evolutionären Abstand zwischen den Arten zu. So sind beispielsweise die häufigsten Hämoglobinsequenzen bei Menschen, Bonobos und Schimpansen völlig identisch, ohne auch nur einen einzigen Aminosäureunterschied in den Alpha- oder Beta-Globin-Proteinketten. Während sich das Hämoglobin von Mensch und Gorilla in den Alpha- und Betaketten um eine Aminosäure unterscheidet, werden diese Unterschiede zwischen weniger eng verwandten Arten größer. ⓘ
Selbst innerhalb der Arten gibt es Varianten von Hämoglobin, obwohl eine Sequenz in jeder Art am häufigsten vorkommt. Mutationen in den Genen für das Hämoglobinprotein einer Art führen zu Hämoglobinvarianten. Viele dieser mutierten Hämoglobinformen verursachen keine Krankheit. Einige dieser mutierten Formen von Hämoglobin verursachen jedoch eine Gruppe von Erbkrankheiten, die als Hämoglobinopathien bezeichnet werden. Die bekannteste Hämoglobinopathie ist die Sichelzellkrankheit, die die erste menschliche Krankheit war, deren Mechanismus auf molekularer Ebene verstanden wurde. Eine (größtenteils) separate Gruppe von Krankheiten, die Thalassämien genannt werden, beinhaltet eine Unterproduktion normaler und manchmal abnormaler Hämoglobine aufgrund von Problemen und Mutationen in der Globin-Genregulation. Alle diese Krankheiten führen zu Anämie. ⓘ

Variationen in den Aminosäuresequenzen von Hämoglobin können, wie bei anderen Proteinen auch, adaptiv sein. So hat man beispielsweise festgestellt, dass sich Hämoglobin auf unterschiedliche Weise an große Höhenlagen anpasst. Organismen, die in großen Höhen leben, haben einen niedrigeren Sauerstoffpartialdruck als Organismen auf Meereshöhe. Dies stellt eine Herausforderung für die Organismen dar, die in solchen Umgebungen leben, da Hämoglobin, das normalerweise bei hohem Sauerstoffpartialdruck Sauerstoff bindet, in der Lage sein muss, Sauerstoff zu binden, wenn dieser bei einem niedrigeren Druck vorhanden ist. Verschiedene Organismen haben sich an eine solche Herausforderung angepasst. Jüngste Studien haben zum Beispiel genetische Varianten bei Hirschmäusen aufgezeigt, die erklären, wie Hirschmäuse, die in den Bergen leben, in der dünnen Luft, die in großen Höhen herrscht, überleben können. Ein Forscher der University of Nebraska-Lincoln fand Mutationen in vier verschiedenen Genen, die für die Unterschiede zwischen Hirschmäusen, die in Flachlandprärien leben, und solchen, die in den Bergen leben, verantwortlich sind. Nach der Untersuchung von Wildmäusen, die sowohl im Hochland als auch im Tiefland gefangen wurden, wurde festgestellt, dass die Gene der beiden Rassen "praktisch identisch sind - mit Ausnahme der Gene, die die Sauerstofftransportkapazität ihres Hämoglobins bestimmen". "Der genetische Unterschied ermöglicht es den Hochlandmäusen, ihren Sauerstoff effizienter zu nutzen", da in höheren Lagen, wie etwa in den Bergen, weniger Sauerstoff zur Verfügung steht. Das Hämoglobin der Mammuts wies Mutationen auf, die eine Sauerstoffversorgung bei niedrigeren Temperaturen ermöglichten, so dass die Mammuts während des Pleistozäns in höhere Breitengrade ziehen konnten. Dies wurde auch bei Kolibris, die in den Anden leben, festgestellt. Kolibris verbrauchen bereits sehr viel Energie und haben daher einen hohen Sauerstoffbedarf, und dennoch gedeihen Andenkolibris in großen Höhen. Nicht-synonyme Mutationen im Hämoglobin-Gen mehrerer Arten, die in großen Höhen leben (Oreotrochilus, A. castelnaudii, C. violifer, P. gigas und A. viridicuada), haben dazu geführt, dass das Protein eine geringere Affinität für Inositolhexaphosphat (IHP) hat, ein Molekül, das bei Vögeln eine ähnliche Rolle spielt wie 2,3-BPG beim Menschen; dies führt dazu, dass Sauerstoff bei niedrigeren Partialdrücken gebunden werden kann. ⓘ
Die einzigartige Kreislauflunge der Vögel begünstigt auch die effiziente Nutzung von Sauerstoff bei niedrigen Partialdrücken von O2. Diese beiden Anpassungen verstärken sich gegenseitig und erklären die bemerkenswerte Leistung der Vögel in großen Höhen. ⓘ
Die Anpassung des Hämoglobins gilt auch für den Menschen. Bei tibetischen Frauen mit einem Genotyp mit hoher Sauerstoffsättigung, die in 4.000 m Höhe leben, ist die Überlebensrate der Nachkommen höher. Die natürliche Auslese scheint die Hauptkraft zu sein, die auf dieses Gen einwirkt, da die Sterblichkeitsrate der Nachkommen von Frauen mit einer höheren Hämoglobin-Sauerstoff-Affinität deutlich niedriger ist als die Sterblichkeitsrate der Nachkommen von Frauen mit einer niedrigen Hämoglobin-Sauerstoff-Affinität. Obwohl der genaue Genotyp und der Mechanismus, durch den dies geschieht, noch nicht klar sind, wirkt die Selektion auf die Fähigkeit dieser Frauen, Sauerstoff bei niedrigen Partialdrücken zu binden, was es ihnen insgesamt ermöglicht, wichtige Stoffwechselprozesse besser aufrechtzuerhalten. ⓘ
Synthese
Hämoglobin (Hb) wird in einer komplexen Reihe von Schritten synthetisiert. Der Häm-Teil wird in einer Reihe von Schritten in den Mitochondrien und im Zytosol unreifer roter Blutkörperchen synthetisiert, während die Globin-Proteinteile von Ribosomen im Zytosol synthetisiert werden. Die Hb-Produktion wird in der Zelle während ihrer gesamten frühen Entwicklung vom Proerythroblasten bis zum Retikulozyten im Knochenmark fortgesetzt. Zu diesem Zeitpunkt geht der Zellkern bei den roten Blutkörperchen von Säugetieren verloren, nicht jedoch bei Vögeln und vielen anderen Arten. Selbst nach dem Verlust des Zellkerns bei Säugetieren ermöglicht ein Rest der ribosomalen RNA die weitere Synthese von Hämoglobin, bis der Retikulozyt seine RNA kurz nach dem Eintritt in das Blutgefäßsystem verliert (diese hämoglobinsynthetische RNA verleiht dem Retikulozyten sein netzartiges Aussehen und seinen Namen). ⓘ
Struktur des Häms

Hämoglobin hat eine quaternäre Struktur, die für viele mehrgliedrige globuläre Proteine charakteristisch ist. Die meisten Aminosäuren im Hämoglobin bilden Alpha-Helices, die durch kurze nicht-helikale Segmente miteinander verbunden sind. Wasserstoffbrücken stabilisieren die schraubenförmigen Abschnitte im Inneren des Proteins und bewirken Anziehungskräfte innerhalb des Moleküls, die dann dazu führen, dass sich jede Polypeptidkette in eine bestimmte Form faltet. Die quaternäre Struktur des Hämoglobins ergibt sich aus seinen vier Untereinheiten, die in etwa eine tetraedrische Anordnung aufweisen. ⓘ
Bei den meisten Wirbeltieren besteht das Hämoglobinmolekül aus vier kugelförmigen Proteinuntereinheiten. Jede Untereinheit besteht aus einer Proteinkette, die eng mit einer nicht-proteinhaltigen prosthetischen Häm-Gruppe verbunden ist. Jede Proteinkette ist in einer Reihe von Alpha-Helix-Struktursegmenten angeordnet, die in einer Globin-Faltung miteinander verbunden sind. Diese Bezeichnung wurde gewählt, weil diese Anordnung das gleiche Faltungsmotiv ist, das auch in anderen Häm/Globin-Proteinen wie Myoglobin verwendet wird. Dieses Faltmuster enthält eine Tasche, die die Häm-Gruppe stark bindet. ⓘ
Eine Häm-Gruppe besteht aus einem Eisen (Fe)-Ion, das in einem heterozyklischen Ring, dem so genannten Porphyrin, gehalten wird. Dieser Porphyrinring besteht aus vier Pyrrolmolekülen, die zyklisch miteinander verbunden sind (durch Methinbrücken), wobei das Eisenion in der Mitte gebunden ist. Das Eisenion, an das der Sauerstoff gebunden ist, koordiniert mit den vier Stickstoffatomen in der Mitte des Rings, die alle in einer Ebene liegen. Das Häm ist über die N-Atome des Imidazolrings des F8-Histidinrests (auch als proximales Histidin bezeichnet) unterhalb des Porphyrinrings fest (kovalent) an das globuläre Protein gebunden. An einer sechsten Position kann Sauerstoff durch eine koordinative kovalente Bindung reversibel gebunden werden, wodurch die oktaedrische Gruppe von sechs Liganden vervollständigt wird. Diese reversible Bindung mit Sauerstoff ist der Grund, warum Hämoglobin so nützlich für den Sauerstofftransport im Körper ist. Sauerstoff bindet in einer "end-on bent"-Geometrie, bei der ein Sauerstoffatom an Fe bindet und das andere in einem Winkel herausragt. Wenn der Sauerstoff nicht gebunden ist, füllt ein sehr schwach gebundenes Wassermolekül die Stelle aus und bildet ein verzerrtes Oktaeder. ⓘ
Obwohl Kohlendioxid vom Hämoglobin transportiert wird, konkurriert es nicht mit dem Sauerstoff um die eisenbindenden Plätze, sondern ist an die Amingruppen der Proteinketten gebunden, die mit den Hämgruppen verbunden sind. ⓘ
Das Eisenion kann entweder im eisenhaltigen Fe2+- oder im eisenhaltigen Fe3+-Zustand vorliegen, aber Ferrihämoglobin (Methämoglobin) (Fe3+) kann keinen Sauerstoff binden. Bei der Bindung oxidiert Sauerstoff vorübergehend und reversibel (Fe2+) zu (Fe3+), während sich der Sauerstoff vorübergehend in ein Superoxid-Ion verwandelt, so dass Eisen in der Oxidationsstufe +2 vorliegen muss, um Sauerstoff zu binden. Wenn das mit Fe3+ verbundene Superoxid-Ion protoniert wird, bleibt das Hämoglobin-Eisen oxidiert und kann keinen Sauerstoff binden. In solchen Fällen kann das Enzym Methämoglobin-Reduktase das Methämoglobin schließlich durch Reduktion des Eisenzentrums reaktivieren. ⓘ
Beim erwachsenen Menschen ist der häufigste Hämoglobintyp ein Tetramer (mit vier Untereinheiten) namens Hämoglobin A, das aus zwei α- und zwei β-Untereinheiten besteht, die nicht kovalent gebunden sind und jeweils aus 141 bzw. 146 Aminosäureresten bestehen. Dies wird als α2β2 bezeichnet. Die Untereinheiten sind strukturell ähnlich und haben etwa die gleiche Größe. Jede Untereinheit hat ein Molekulargewicht von etwa 16.000 Dalton, so dass das Gesamtmolekulargewicht des Tetramers etwa 64.000 Dalton (64.458 g/mol) beträgt. Somit ist 1 g/dL = 0,1551 mmol/L. Hämoglobin A ist das am intensivsten untersuchte der Hämoglobinmoleküle. ⓘ
Bei menschlichen Säuglingen besteht das Hämoglobinmolekül aus 2 α-Ketten und 2 γ-Ketten. Die γ-Ketten werden im Laufe des Wachstums des Kindes allmählich durch β-Ketten ersetzt. ⓘ
Die vier Polypeptidketten sind durch Salzbrücken, Wasserstoffbrücken und den hydrophoben Effekt aneinander gebunden. ⓘ
Sauerstoffsättigung
Im Allgemeinen kann Hämoglobin mit Sauerstoffmolekülen gesättigt (Oxyhämoglobin) oder mit Sauerstoffmolekülen entsättigt (Desoxyhämoglobin) sein. ⓘ
Oxyhämoglobin
Oxyhämoglobin entsteht bei der physiologischen Atmung, wenn sich Sauerstoff an die Häm-Komponente des Proteins Hämoglobin in den roten Blutkörperchen bindet. Dieser Vorgang findet in den Lungenkapillaren statt, die an die Alveolen der Lunge angrenzen. Der Sauerstoff wandert dann durch den Blutkreislauf und wird an den Zellen abgesetzt, wo er als terminaler Elektronenakzeptor bei der Produktion von ATP durch den Prozess der oxidativen Phosphorylierung verwendet wird. Einem Absinken des pH-Werts im Blut wird dadurch jedoch nicht entgegengewirkt. Die Beatmung oder Atmung kann diesen Zustand umkehren, indem Kohlendioxid entfernt wird, was zu einem Anstieg des pH-Wertes führt. ⓘ
Hämoglobin existiert in zwei Formen, einer gespannten Form (T) und einer entspannten Form (R). Verschiedene Faktoren wie ein niedriger pH-Wert, ein hoher CO2-Gehalt und ein hoher 2,3-BPG-Gehalt in den Geweben begünstigen die gespannte Form, die eine geringe Sauerstoffaffinität aufweist und Sauerstoff in den Geweben freisetzt. Umgekehrt begünstigen ein hoher pH-Wert, ein niedriger CO2-Gehalt oder ein niedriger 2,3 BPG-Gehalt die entspannte Form, die Sauerstoff besser binden kann. Der Partialdruck des Systems wirkt sich ebenfalls auf die O2-Affinität aus, wobei bei hohen Sauerstoffpartialdrücken (wie sie in den Alveolen herrschen) der entspannte Zustand (hohe Affinität, R) bevorzugt wird. Umgekehrt wird bei niedrigen Partialdrücken (wie sie in atmenden Geweben herrschen) der angespannte Zustand (niedrige Affinität, T) begünstigt. Außerdem zieht die Bindung von Sauerstoff an das Eisen(II)-Häm das Eisen in die Ebene des Porphyrinrings, was eine leichte Konformationsverschiebung bewirkt. Diese Verschiebung begünstigt die Bindung von Sauerstoff an die drei verbleibenden Häm-Einheiten im Hämoglobin (die Sauerstoffbindung ist also kooperativ). ⓘ
Desoxygeniertes Hämoglobin
Desoxygeniertes Hämoglobin (Desoxyhämoglobin) ist die Form des Hämoglobins ohne den gebundenen Sauerstoff. Die Absorptionsspektren von Oxyhämoglobin und Desoxyhämoglobin unterscheiden sich. Das Oxyhämoglobin hat eine deutlich geringere Absorption bei 660 nm Wellenlänge als das Desoxyhämoglobin, während seine Absorption bei 940 nm etwas höher ist. Dieser Unterschied wird für die Messung der Sauerstoffmenge im Blut eines Patienten mit einem Gerät namens Pulsoximeter genutzt. Dieser Unterschied ist auch für die Zyanose verantwortlich, die blaue bis violette Färbung, die das Gewebe bei Hypoxie entwickelt. ⓘ
Desoxygeniertes Hämoglobin ist paramagnetisch, d. h. es wird von Magnetfeldern nur schwach angezogen. Im Gegensatz dazu ist sauerstoffhaltiges Hämoglobin diamagnetisch, d. h. es stößt sich schwach von einem Magnetfeld ab. ⓘ
Evolution des Hämoglobins der Wirbeltiere
Die Wissenschaftler sind sich einig, dass die Trennung von Myoglobin und Hämoglobin nach der Abspaltung der Neunaugen von den Kieferwirbeltieren stattfand. Diese Trennung von Myoglobin und Hämoglobin ermöglichte die Entstehung und Entwicklung der unterschiedlichen Funktionen der beiden Moleküle: Myoglobin hat mehr mit der Sauerstoffspeicherung zu tun, während Hämoglobin für den Sauerstofftransport zuständig ist. Die α- und β-ähnlichen Globin-Gene kodieren für die einzelnen Untereinheiten des Proteins. Die Vorgänger dieser Gene entstanden durch ein weiteres Duplikationsereignis, ebenfalls nachdem sich der gemeinsame Vorfahre der Gnathosomen von kieferlosen Fischen ableitete, vor etwa 450-500 Millionen Jahren. Studien zur Rekonstruktion der Vorfahren deuten darauf hin, dass der Vorgänger der α- und β-Gene vor der Duplikation ein Dimer aus identischen Globin-Untereinheiten war, das sich nach der Duplikation zu einer tetrameren Architektur zusammensetzte. Die Entwicklung der α- und β-Gene schuf die Möglichkeit, dass Hämoglobin aus mehreren unterschiedlichen Untereinheiten besteht, eine physikalische Zusammensetzung, die für die Fähigkeit des Hämoglobins, Sauerstoff zu transportieren, von zentraler Bedeutung ist. Das Vorhandensein mehrerer Untereinheiten trägt dazu bei, dass Hämoglobin in der Lage ist, Sauerstoff kooperativ zu binden und allosterisch reguliert zu werden. In der Folge wurde das α-Gen ebenfalls dupliziert, wodurch die Gene HBA1 und HBA2 entstanden. Diese weiteren Duplikationen und Divergenzen haben eine Vielzahl von α- und β-ähnlichen Globin-Genen hervorgebracht, die so reguliert werden, dass bestimmte Formen in verschiedenen Entwicklungsstadien auftreten. ⓘ
Die meisten Eisfische der Familie Channichthyidae haben ihre Hämoglobin-Gene als Anpassung an das kalte Wasser verloren. ⓘ
Die Oxidationsstufe des Eisens im Oxyhämoglobin
Die Bestimmung der Oxidationsstufe von sauerstoffhaltigem Hämoglobin ist schwierig, da Oxyhämoglobin (Hb-O2) nach experimentellen Messungen diamagnetisch ist (keine ungepaarten Elektronen), während die Elektronenkonfigurationen mit der niedrigsten Energie (Grundzustand) sowohl bei Sauerstoff als auch bei Eisen paramagnetisch sind (was auf mindestens ein ungepaartes Elektron im Komplex hindeutet). Die energieärmste Form von Sauerstoff und die energieärmsten Formen der relevanten Oxidationsstufen von Eisen sind die folgenden:
- Triplett-Sauerstoff, die energieärmste molekulare Sauerstoffspezies, hat zwei ungepaarte Elektronen in antibindenden π*-Molekülorbitalen.
- Eisen(II) neigt dazu, in einer spinstarken 3d6-Konfiguration mit vier ungepaarten Elektronen zu existieren.
- Eisen(III) (3d5) hat eine ungerade Anzahl von Elektronen und muss daher in jedem Energiezustand ein oder mehrere ungepaarte Elektronen haben. ⓘ
Alle diese Strukturen sind paramagnetisch (haben ungepaarte Elektronen), nicht diamagnetisch. Es muss also eine nicht-intuitive (z. B. eine höhere Energie für mindestens eine Spezies) Verteilung der Elektronen in der Kombination von Eisen und Sauerstoff vorliegen, um den beobachteten Diamagnetismus und das Fehlen ungepaarter Elektronen zu erklären. ⓘ
Die beiden logischen Möglichkeiten zur Erzeugung von diamagnetischem Hb-O2 (ohne Nettospin) sind:
- Spinarmes Fe2+ bindet sich an Singulett-Sauerstoff. Sowohl spinarmes Eisen als auch Singulett-Sauerstoff sind diamagnetisch. Die Singulettform des Sauerstoffs ist jedoch die energiereichere Form des Moleküls.
- Fe3+ mit niedrigem Spin bindet sich an O2-- (das Superoxid-Ion), und die beiden ungepaarten Elektronen koppeln antiferromagnetisch, was zu den beobachteten diamagnetischen Eigenschaften führt. In diesem Fall wurde das Eisen oxidiert (hat ein Elektron verloren) und der Sauerstoff reduziert (hat ein Elektron gewonnen). ⓘ
Ein anderes mögliches Modell, bei dem Fe4+ mit niedrigem Spin an Peroxid, O22-, bindet, kann von vornherein ausgeschlossen werden, da das Eisen paramagnetisch ist (obwohl das Peroxidion diamagnetisch ist). In diesem Fall wurde das Eisen mit zwei Elektronen oxidiert und der Sauerstoff mit zwei Elektronen reduziert. ⓘ
Direkte experimentelle Daten:
- Die Röntgen-Photoelektronenspektroskopie legt nahe, dass Eisen eine Oxidationsstufe von etwa 3,2 hat.
- Infrarot-Schwingungsfrequenzen der O-O-Bindung deuten darauf hin, dass die Bindungslänge mit der von Superoxid übereinstimmt (eine Bindungsordnung von etwa 1,6, wobei Superoxid 1,5 ist).
- Röntgenabsorption in der Nähe von Kantenstrukturen an der Eisen-K-Kante. Die Energieverschiebung von 5 eV zwischen Desoxyhämoglobin und Oxyhämoglobin deutet, wie bei allen Methämoglobin-Spezies, stark auf eine tatsächliche lokale Ladung hin, die näher an Fe3+ als an Fe2+ liegt.
Die nächstgelegene formale Oxidationsstufe des Eisens in Hb-O2 ist also die +3-Stellung, während der Sauerstoff die -1-Stellung einnimmt (als Superoxid .O2-). Der Diamagnetismus in dieser Konfiguration entsteht durch das einzelne ungepaarte Elektron auf dem Superoxid, das sich antiferromagnetisch mit dem einzelnen ungepaarten Elektron auf dem Eisen (in einem d5-Zustand mit niedrigem Spin) ausrichtet, so dass die gesamte Konfiguration keinen Nettospin hat, was mit dem diamagnetischen Oxyhämoglobin aus dem Experiment übereinstimmt. ⓘ
Die zweite der oben genannten logischen Möglichkeiten für diamagnetisches Oxyhämoglobin, die sich im Experiment als richtig erwiesen hat, ist nicht überraschend: Singulett-Sauerstoff (Möglichkeit 1) ist ein unrealistisch hoher Energiezustand. Modell 3 führt zu einer ungünstigen Ladungstrennung (und stimmt nicht mit den magnetischen Daten überein), obwohl es als Resonanzform einen kleinen Beitrag leisten könnte. Die Verschiebung des Eisens in eine höhere Oxidationsstufe in Hb-O2 verringert die Größe des Atoms und lässt es in die Ebene des Porphyrinrings eindringen, wodurch es auf den koordinierten Histidinrest zieht und die allosterischen Veränderungen in den Globulinen auslöst. ⓘ
Frühe Postulate von bioanorganischen Chemikern besagten, dass Möglichkeit 1 (oben) richtig sei und dass Eisen im Oxidationszustand II vorliegen müsse. Diese Schlussfolgerung schien wahrscheinlich, da die Oxidationsstufe III des Eisens als Methämoglobin, wenn es nicht von Superoxid O2 begleitet wird, um das Oxidationselektron zu "halten", bekanntlich das Hämoglobin unfähig macht, normales Triplett-O2 zu binden, wie es in der Luft vorkommt. Es wurde daher angenommen, dass Eisen als Fe(II) verbleibt, wenn Sauerstoffgas in der Lunge gebunden wird. Die Eisenchemie in diesem früheren klassischen Modell war elegant, aber die erforderliche Anwesenheit des diamagnetischen, hochenergetischen Singulett-Sauerstoffmoleküls wurde nie erklärt. Klassischerweise wurde argumentiert, dass die Bindung eines Sauerstoffmoleküls Eisen(II) mit hohem Spin in ein oktaedrisches Feld von Liganden mit starkem Feld platziert; diese Veränderung des Feldes würde die Spaltungsenergie des Kristallfeldes erhöhen und die Elektronen des Eisens dazu veranlassen, sich in die Low-Spin-Konfiguration zu paaren, die in Fe(II) diamagnetisch wäre. Man nimmt an, dass diese erzwungene Low-Spin-Paarung im Eisen tatsächlich stattfindet, wenn Sauerstoff gebunden wird, aber sie reicht nicht aus, um die Größenänderung des Eisens zu erklären. Der Entzug eines zusätzlichen Elektrons aus Eisen durch Sauerstoff ist erforderlich, um sowohl die geringere Größe von Eisen und die beobachtete höhere Oxidationsstufe als auch die schwächere Bindung von Sauerstoff zu erklären. ⓘ
Die Zuweisung einer ganzzahligen Oxidationsstufe ist ein Formalismus, da die kovalenten Bindungen keine perfekte Bindungsordnung aufweisen müssen, die einen vollständigen Elektronentransfer beinhaltet. Daher können alle drei Modelle für paramagnetisches Hb-O2 in geringem Maße (durch Resonanz) zur tatsächlichen elektronischen Konfiguration von Hb-O2 beitragen. Das Modell, wonach Eisen in Hb-O2 Fe(III) ist, ist jedoch korrekter als die klassische Vorstellung, dass es Fe(II) bleibt. ⓘ
Kooperativität

Wenn sich der Sauerstoff an den Eisenkomplex bindet, bewegt sich das Eisenatom zurück zur Mitte der Ebene des Porphyrinrings (siehe Bewegungsdiagramm). Gleichzeitig wird die Imidazol-Seitenkette des Histidin-Restes, der am anderen Pol des Eisens interagiert, in Richtung des Porphyrin-Rings gezogen. Diese Wechselwirkung zwingt die Ebene des Rings seitwärts zur Außenseite des Tetramers und verursacht auch eine Dehnung in der Proteinhelix, die das Histidin enthält, da es sich dem Eisenatom nähert. Diese Spannung wird auf die übrigen drei Monomere im Tetramer übertragen, wo sie eine ähnliche Konformationsänderung in den anderen Häm-Stellen bewirkt, so dass die Bindung von Sauerstoff an diese Stellen erleichtert wird. ⓘ
Wenn sich Sauerstoff an ein Hämoglobinmonomer bindet, verschiebt sich die Konformation des Tetramers vom T-Zustand (angespannt) in den R-Zustand (entspannt). Diese Verschiebung fördert die Bindung von Sauerstoff an die Häm-Gruppen der verbleibenden drei Monomere, wodurch das Hämoglobinmolekül mit Sauerstoff gesättigt wird. ⓘ
In der tetrameren Form des normalen erwachsenen Hämoglobins ist die Bindung von Sauerstoff also ein kooperativer Prozess. Die Bindungsaffinität des Hämoglobins für Sauerstoff wird durch die Sauerstoffsättigung des Moleküls erhöht, wobei die ersten gebundenen Sauerstoffmoleküle die Form der Bindungsstellen für die nächsten Moleküle in einer für die Bindung günstigen Weise beeinflussen. Diese positive kooperative Bindung wird durch sterische Konformationsänderungen des Hämoglobin-Proteinkomplexes erreicht, wie oben beschrieben; d. h., wenn eine Untereinheit des Hämoglobins mit Sauerstoff angereichert wird, wird eine Konformations- oder Strukturänderung des gesamten Komplexes eingeleitet, wodurch die anderen Untereinheiten eine erhöhte Affinität für Sauerstoff erhalten. Infolgedessen ist die Sauerstoffbindungskurve von Hämoglobin sigmoidal oder S-förmig, im Gegensatz zu der normalen hyperbolischen Kurve, die mit einer nicht-kooperativen Bindung verbunden ist. ⓘ
Der dynamische Mechanismus der Kooperativität in Hämoglobin und sein Zusammenhang mit der Niederfrequenzresonanz wurden erörtert. ⓘ

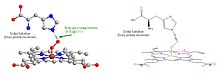
Bei der Bindung von Sauerstoff wird ein Disauerstoffmolekül (O2) in das Zentrum des Häm-Komplexes aufgenommen. Das Atom des zentralen Eisenions (FeII) geht durch die Sauerstoffbindung in einen low-spin-Zustand über. Dabei verringert sich seine Größe und es rutscht in die Ebene des Porphyrinrings. ⓘ
Stabilisiert wird das gebundene Sauerstoffmolekül über eine Wasserstoffbrücke. Diese wird mit der Seitenkette des Globinproteins gebildet: einem distal gelegenen Histidinrest, der sich in der Nähe des Zentralatoms befindet. Jener proximale Histidinrest, über den das Eisenatom des Häms an die Proteinmatrix gebunden ist, liegt auf der anderen Seite der Ringebene. ⓘ
Bindung für andere Liganden als Sauerstoff
Neben dem Sauerstoffliganden, der kooperativ an Hämoglobin bindet, gehören zu den Hämoglobinliganden auch kompetitive Inhibitoren wie Kohlenmonoxid (CO) und allosterische Liganden wie Kohlendioxid (CO2) und Stickstoffmonoxid (NO). Das Kohlendioxid wird an Aminogruppen der Globinproteine gebunden, um Carbaminhämoglobin zu bilden; man nimmt an, dass dieser Mechanismus für etwa 10 % des Kohlendioxidtransports bei Säugetieren verantwortlich ist. Stickstoffmonoxid kann auch durch Hämoglobin transportiert werden; es wird an spezifische Thiolgruppen im Globinprotein gebunden, um ein S-Nitrosothiol zu bilden, das in freies Stickstoffmonoxid und Thiol dissoziiert, wenn das Hämoglobin Sauerstoff aus seinem Häm-Bereich freisetzt. Es wird angenommen, dass dieser Stickoxidtransport zu peripheren Geweben den Sauerstofftransport in den Geweben unterstützt, indem gefäßerweiterndes Stickoxid in Geweben mit niedrigem Sauerstoffgehalt freigesetzt wird. ⓘ
Kompetitiv
Die Bindung von Sauerstoff wird durch Moleküle wie Kohlenmonoxid (z. B. durch Tabakrauchen, Abgase und unvollständige Verbrennung in Öfen) beeinträchtigt. CO konkurriert mit Sauerstoff an der Häm-Bindungsstelle. Die Bindungsaffinität von Hämoglobin für CO ist 250-mal größer als seine Affinität für Sauerstoff, was bedeutet, dass kleine Mengen CO die Fähigkeit des Hämoglobins, Sauerstoff an das Zielgewebe zu liefern, drastisch verringern. Da Kohlenmonoxid ein farb-, geruch- und geschmackloses Gas ist und eine potenziell tödliche Bedrohung darstellt, sind inzwischen Kohlenmonoxiddetektoren im Handel erhältlich, die vor gefährlichen Konzentrationen in Wohnungen warnen. Wenn sich Hämoglobin mit CO verbindet, bildet es eine sehr leuchtend rote Verbindung namens Carboxyhämoglobin, die dazu führen kann, dass die Haut von Opfern einer CO-Vergiftung im Todesfall rosa statt weiß oder blau erscheint. Bei einem CO-Gehalt in der Atemluft von nur 0,02 % treten Kopfschmerzen und Übelkeit auf; bei einer Erhöhung der CO-Konzentration auf 0,1 % kommt es zur Bewusstlosigkeit. Bei starken Rauchern können bis zu 20 % der sauerstoffaktiven Stellen durch CO blockiert werden. ⓘ
In ähnlicher Weise hat Hämoglobin auch eine konkurrierende Bindungsaffinität für Cyanid (CN-), Schwefelmonoxid (SO) und Sulfid (S2-), einschließlich Schwefelwasserstoff (H2S). Alle diese Stoffe binden sich an das Eisen im Häm, ohne dessen Oxidationszustand zu verändern, hemmen aber dennoch die Sauerstoffbindung und verursachen schwere Toxizität. ⓘ
Das Eisenatom in der Häm-Gruppe muss sich zunächst in der Oxidationsstufe Eisen (Fe2+) befinden, um die Bindung und den Transport von Sauerstoff und anderen Gasen zu unterstützen (während der Bindung von Sauerstoff wechselt es vorübergehend in die Oxidationsstufe Eisen, wie oben erläutert). Die anfängliche Oxidation in den Eisen(Fe3+)-Zustand ohne Sauerstoff verwandelt Hämoglobin in "Hämiglobin" oder Methämoglobin, das keinen Sauerstoff binden kann. Hämoglobin in normalen roten Blutkörperchen wird durch ein Reduktionssystem geschützt, um dies zu verhindern. Stickstoffmonoxid ist in der Lage, einen kleinen Teil des Hämoglobins in den roten Blutkörperchen in Methämoglobin umzuwandeln. Die letztgenannte Reaktion ist ein Überbleibsel der älteren Stickstoffoxid-Dioxygenase-Funktion der Globine. ⓘ
Allosterisch
Kohlendioxid nimmt eine andere Bindungsstelle auf dem Hämoglobin ein. In Geweben, in denen die Kohlendioxidkonzentration höher ist, bindet das Kohlendioxid an die allosterische Stelle des Hämoglobins und erleichtert so die Entladung des Sauerstoffs aus dem Hämoglobin und schließlich seine Entfernung aus dem Körper, nachdem der Sauerstoff an die im Stoffwechsel befindlichen Gewebe abgegeben worden ist. Diese erhöhte Affinität des venösen Blutes für Kohlendioxid ist als Bohr-Effekt bekannt. Durch das Enzym Kohlensäureanhydrase reagiert Kohlendioxid mit Wasser zu Kohlensäure, die sich in Bikarbonat und Protonen aufspaltet:
- CO2 + H2O → H2CO3 → HCO3- + H+ ⓘ

Daher hat Blut mit hohem Kohlendioxidgehalt auch einen niedrigeren pH-Wert (saurer). Hämoglobin kann Protonen und Kohlendioxid binden, was eine Konformationsänderung des Proteins bewirkt und die Freisetzung von Sauerstoff erleichtert. Protonen binden an verschiedenen Stellen des Proteins, während Kohlendioxid an der α-Aminogruppe gebunden wird. Das Kohlendioxid bindet sich an das Hämoglobin und bildet Carbaminohemoglobin. Diese Abnahme der Affinität des Hämoglobins für Sauerstoff durch die Bindung von Kohlendioxid und Säure wird als Bohr-Effekt bezeichnet. Der Bohr-Effekt begünstigt eher den T-Zustand als den R-Zustand. (Verschiebung der O2-Sättigungskurve nach rechts). Umgekehrt werden bei abnehmendem Kohlendioxidgehalt im Blut (z. B. in den Lungenkapillaren) Kohlendioxid und Protonen aus dem Hämoglobin freigesetzt, wodurch sich die Sauerstoffaffinität des Proteins erhöht. Eine Verringerung der Gesamtbindungskapazität von Hämoglobin für Sauerstoff (d. h. eine Verschiebung der Kurve nach unten, nicht nur nach rechts) aufgrund eines niedrigeren pH-Werts wird als Wurzeleffekt bezeichnet. Dies ist bei Knochenfischen zu beobachten. ⓘ
Das Hämoglobin muss den Sauerstoff, den es bindet, auch wieder abgeben, sonst hat es keinen Sinn, ihn zu binden. Die sigmoidale Kurve des Hämoglobins macht es effizient bei der Bindung (Aufnahme von O2 in der Lunge) und effizient bei der Entladung (Abgabe von O2 in den Geweben). ⓘ
Bei Menschen, die sich an große Höhen akklimatisiert haben, ist die Konzentration von 2,3-Bisphosphoglycerat (2,3-BPG) im Blut erhöht, was es diesen Personen ermöglicht, unter Bedingungen mit geringerer Sauerstoffspannung eine größere Menge an Sauerstoff an das Gewebe abzugeben. Dieses Phänomen, bei dem Molekül Y die Bindung von Molekül X an ein Transportmolekül Z beeinflusst, wird als heterotrope allosterische Wirkung bezeichnet. Das Hämoglobin von Organismen in großen Höhen hat sich auch so angepasst, dass es eine geringere Affinität für 2,3-BPG hat, so dass das Protein mehr in Richtung seines R-Zustands verschoben wird. Im R-Zustand bindet das Hämoglobin leichter Sauerstoff, so dass die Organismen die notwendigen Stoffwechselprozesse durchführen können, wenn Sauerstoff bei niedrigen Partialdrücken vorhanden ist. ⓘ
Andere Tiere als der Mensch verwenden andere Moleküle, um an Hämoglobin zu binden und dessen O2-Affinität unter ungünstigen Bedingungen zu verändern. Fische verwenden sowohl ATP als auch GTP. Diese binden sich an eine Phosphat-"Tasche" auf dem Hämoglobinmolekül der Fische, was den gespannten Zustand stabilisiert und somit die Sauerstoffaffinität verringert. GTP reduziert die Sauerstoffaffinität des Hämoglobins viel stärker als ATP, was vermutlich auf eine zusätzliche Wasserstoffbrücke zurückzuführen ist, die den gespannten Zustand weiter stabilisiert. Unter hypoxischen Bedingungen wird die Konzentration sowohl von ATP als auch von GTP in den roten Blutkörperchen der Fische verringert, um die Sauerstoffaffinität zu erhöhen. ⓘ
Eine Variante des Hämoglobins, das so genannte fetale Hämoglobin (HbF, α2γ2), ist im sich entwickelnden Fötus zu finden und bindet Sauerstoff mit größerer Affinität als das erwachsene Hämoglobin. Dies bedeutet, dass die Sauerstoffbindungskurve für fetales Hämoglobin im Vergleich zu der von erwachsenem Hämoglobin nach links verschoben ist (d. h. ein höherer Prozentsatz des Hämoglobins bindet Sauerstoff bei niedrigerer Sauerstoffspannung). Infolgedessen kann das fötale Blut in der Plazenta Sauerstoff aus dem mütterlichen Blut aufnehmen. ⓘ
Hämoglobin enthält im Globin-Teil des Moleküls auch Stickstoffmonoxid (NO). Dies verbessert die Sauerstoffversorgung in der Peripherie und trägt zur Steuerung der Atmung bei. NO bindet reversibel an einen bestimmten Cysteinrest im Globin; die Bindung hängt vom Zustand (R oder T) des Hämoglobins ab. Das resultierende S-nitrosylierte Hämoglobin beeinflusst verschiedene NO-bezogene Aktivitäten wie die Kontrolle des Gefäßwiderstands, des Blutdrucks und der Atmung. NO wird nicht im Zytoplasma der roten Blutkörperchen freigesetzt, sondern durch einen Anionenaustauscher namens AE1 aus den Zellen transportiert. ⓘ
Typen beim Menschen
Hämoglobinvarianten sind Teil der normalen embryonalen und fötalen Entwicklung. Es kann sich aber auch um pathologische Hämoglobin-Mutationen in einer Population handeln, die durch genetische Variationen verursacht werden. Einige bekannte Hämoglobinvarianten, wie die Sichelzellenanämie, sind für Krankheiten verantwortlich und werden als Hämoglobinopathien bezeichnet. Andere Varianten verursachen keine nachweisbare Pathologie und werden daher als nicht-pathologische Varianten bezeichnet. ⓘ
Im Embryo:
- Gower 1 (ζ2ε2)
- Gower 2 (α2ε2) (PDB: 1A9W)
- Hämoglobin Portland I (ζ2γ2)
- Hämoglobin Portland II (ζ2β2). ⓘ
Beim Fötus:
Nach der Geburt:
- Hämoglobin A (Erwachsenenhämoglobin) (α2β2) (PDB: 1BZ0) - Das häufigste mit einer normalen Menge von über 95%.
- Hämoglobin A2 (α2δ2) - Die Synthese der δ-Kette beginnt spät im dritten Trimester und liegt bei Erwachsenen im Normalbereich von 1,5-3,5%.
- Hämoglobin F (fetales Hämoglobin) (α2γ2) - Bei Erwachsenen ist das Hämoglobin F auf eine begrenzte Population von Erythrozyten, die F-Zellen, beschränkt. Bei Personen mit Sichelzellanämie und Beta-Thalassämie kann der Hb F-Spiegel jedoch erhöht sein. ⓘ

Abweichende Formen, die Krankheiten verursachen:
- Hämoglobin D-Punjab - (α2βD2) - Eine abweichende Form des Hämoglobins.
- Hämoglobin H (β4) - Eine abweichende Form von Hämoglobin, die durch ein Tetramer von β-Ketten gebildet wird und bei Varianten der α-Thalassämie vorkommen kann.
- Hämoglobin Barts (γ4) - Eine abweichende Form von Hämoglobin, die durch ein Tetramer von γ-Ketten gebildet wird und bei Varianten der α-Thalassämie vorkommen kann.
- Hämoglobin S (α2βS2) - Eine abweichende Form von Hämoglobin, die bei Menschen mit Sichelzellkrankheit vorkommt. Es liegt eine Variation im β-Ketten-Gen vor, die eine Veränderung der Eigenschaften des Hämoglobins bewirkt, was zu einer Sichelzellbildung der roten Blutkörperchen führt.
- Hämoglobin C (α2βC2) - Eine weitere Variante, die auf eine Variation im β-Ketten-Gen zurückzuführen ist. Diese Variante verursacht eine leichte chronische hämolytische Anämie.
- Hämoglobin E (α2βE2) - Eine weitere Variante, die auf eine Variation im β-Ketten-Gen zurückzuführen ist. Diese Variante verursacht eine leichte chronische hämolytische Anämie.
- Hämoglobin AS - Eine heterozygote Form, die eine Sichelzellenanämie mit einem Gen für Erwachsene und einem Gen für die Sichelzellenkrankheit verursacht.
- Hämoglobin SC-Krankheit - Eine heterozygote Form mit einem Sichel-Gen und einem weiteren, das für Hämoglobin C kodiert.
- Hämoglobin Hopkins-2 - Eine abweichende Form von Hämoglobin, die manchmal in Kombination mit Hämoglobin S gesehen wird, um die Sichelzellenkrankheit hervorzurufen. ⓘ
Degradation bei Wirbeltieren
Wenn rote Blutkörperchen aufgrund von Alterung oder Defekten das Ende ihrer Lebensdauer erreichen, werden sie durch die phagozytische Aktivität von Makrophagen in der Milz oder der Leber aus dem Kreislauf entfernt oder hämolysieren im Kreislauf. Freies Hämoglobin wird dann über den Hämoglobintransporter CD163, der ausschließlich auf Monozyten oder Makrophagen exprimiert wird, aus dem Kreislauf entfernt. In diesen Zellen wird das Hämoglobinmolekül aufgespalten, und das Eisen wird recycelt. Bei diesem Prozess entsteht außerdem für jedes abgebaute Häm-Molekül ein Molekül Kohlenmonoxid. Der Häm-Abbau ist die einzige natürliche Quelle für Kohlenmonoxid im menschlichen Körper und verantwortlich für den normalen Kohlenmonoxid-Spiegel im Blut von Menschen, die normale Luft atmen. ⓘ
Das andere wichtige Endprodukt des Häm-Abbaus ist Bilirubin. Erhöhte Werte dieser Chemikalie werden im Blut festgestellt, wenn die roten Blutkörperchen schneller als gewöhnlich zerstört werden. Unzureichend abgebautes Hämoglobinprotein oder Hämoglobin, das zu schnell aus den Blutzellen freigesetzt wurde, kann kleine Blutgefäße verstopfen, insbesondere die empfindlichen Blutfiltergefäße der Nieren, was zu Nierenschäden führen kann. Eisen wird aus dem Häm entfernt und für eine spätere Verwendung wiedergewonnen, es wird als Hämosiderin oder Ferritin in den Geweben gespeichert und von den Betaglobulinen als Transferrine in das Plasma transportiert. Wenn der Porphyrinring aufgespalten wird, werden die Fragmente normalerweise als gelbes Pigment namens Bilirubin ausgeschieden, das als Galle in den Darm abgegeben wird. Im Darm wird Bilirubin in Urobilinogen umgewandelt. Das Urobilinogen verlässt den Körper mit den Fäkalien in Form eines Pigments namens Stercobilin. Globulin wird in Aminosäuren umgewandelt, die dann in den Blutkreislauf abgegeben werden. ⓘ
Krankheiten im Zusammenhang mit Hämoglobin
Hämoglobinmangel kann entweder durch eine verminderte Anzahl von Hämoglobinmolekülen verursacht werden, wie bei Anämie, oder durch eine verminderte Fähigkeit der einzelnen Moleküle, Sauerstoff bei gleichem Sauerstoffpartialdruck zu binden. Hämoglobinopathien (genetische Defekte, die zu einer abnormen Struktur des Hämoglobinmoleküls führen) können beide Ursachen haben. In jedem Fall vermindert ein Hämoglobinmangel die Fähigkeit des Blutes, Sauerstoff zu transportieren. Hämoglobinmangel ist im Allgemeinen streng von Hypoxämie zu unterscheiden, die als verminderter Sauerstoffpartialdruck im Blut definiert ist, obwohl beide Ursachen für Hypoxie (unzureichende Sauerstoffversorgung des Gewebes) sind. ⓘ
Andere häufige Ursachen für einen niedrigen Hämoglobinwert sind Blutverlust, Nährstoffmangel, Knochenmarksprobleme, Chemotherapie, Nierenversagen oder abnormales Hämoglobin (wie bei der Sichelzellenkrankheit). ⓘ
Die Fähigkeit der einzelnen Hämoglobinmoleküle, Sauerstoff zu transportieren, wird normalerweise durch einen veränderten pH-Wert oder CO2 im Blut verändert, was zu einer veränderten Sauerstoff-Hämoglobin-Dissoziationskurve führt. Sie kann jedoch auch pathologisch verändert sein, z. B. bei einer Kohlenmonoxidvergiftung. ⓘ
Eine Abnahme des Hämoglobins, mit oder ohne absolute Abnahme der roten Blutkörperchen, führt zu den Symptomen einer Anämie. Anämie hat viele verschiedene Ursachen, obwohl Eisenmangel und die daraus resultierende Eisenmangelanämie die häufigsten Ursachen in der westlichen Welt sind. Da Eisenmangel die Häm-Synthese vermindert, sind die roten Blutkörperchen bei Eisenmangelanämie hypochrom (es fehlt das rote Hämoglobinpigment) und mikrozytär (kleiner als normal). Andere Anämien sind seltener. Bei der Hämolyse (beschleunigter Abbau der roten Blutkörperchen) wird die damit verbundene Gelbsucht durch den Hämoglobin-Metaboliten Bilirubin verursacht, und das zirkulierende Hämoglobin kann zu Nierenversagen führen. ⓘ
Einige Mutationen in der Globinkette werden mit den Hämoglobinopathien in Verbindung gebracht, wie z. B. die Sichelzellkrankheit und die Thalassämie. Andere Mutationen sind, wie zu Beginn des Artikels erläutert, gutartig und werden lediglich als Hämoglobinvarianten bezeichnet. ⓘ
Es gibt eine Gruppe von genetischen Störungen, die als Porphyrien bekannt sind und durch Fehler in den Stoffwechselwegen der Häm-Synthese gekennzeichnet sind. König Georg III. des Vereinigten Königreichs war wahrscheinlich der berühmteste Porphyrie-Patient. ⓘ
In geringem Umfang verbindet sich Hämoglobin A langsam mit Glukose am terminalen Valin (einer Alpha-Aminosäure) jeder β-Kette. Das daraus resultierende Molekül wird oft als Hb A1c bezeichnet, ein glykiertes Hämoglobin. Die Bindung von Glukose an die Aminosäuren im Hämoglobin erfolgt bei vielen Proteinen spontan (ohne die Hilfe eines Enzyms) und ist nicht für einen nützlichen Zweck bekannt. Mit zunehmender Glukosekonzentration im Blut steigt jedoch der Prozentsatz des Hb A, der sich in Hb A1c umwandelt. Bei Diabetikern, deren Blutzucker normalerweise hoch ist, ist auch der prozentuale Anteil von Hb A1c hoch. Da sich Hb A nur langsam mit Glukose verbindet, spiegelt der Hb A1c-Prozentsatz einen gewichteten Durchschnitt der Blutzuckerspiegel über die Lebensdauer der Erythrozyten wider, die etwa 120 Tage beträgt. Die Messung des glykosylierten Hämoglobins dient daher der Überwachung der langfristigen Kontrolle der chronischen Erkrankung Diabetes mellitus Typ 2 (T2DM). Eine schlechte Kontrolle des T2DM führt zu hohen Werten von glykiertem Hämoglobin in den roten Blutkörperchen. Der normale Referenzbereich liegt bei 4,0-5,9 %. Auch wenn es schwierig ist, Werte unter 7 % zu erreichen, werden sie für Menschen mit T2DM empfohlen. Werte über 9 % werden mit einer schlechten Kontrolle des glykosylierten Hämoglobins in Verbindung gebracht, und Werte über 12 % mit einer sehr schlechten Kontrolle. Diabetiker, die ihren glykosylierten Hämoglobinwert nahe bei 7 % halten, haben eine viel bessere Chance, die Komplikationen, die mit Diabetes einhergehen können, zu vermeiden (als diejenigen, deren Werte bei 8 % oder höher liegen). Darüber hinaus erhöht ein erhöhter glykosylierter Hämoglobinwert seine Affinität für Sauerstoff, wodurch dessen Freisetzung im Gewebe verhindert und im Extremfall eine Hypoxie hervorgerufen wird. ⓘ
Erhöhte Hämoglobinwerte sind mit einer erhöhten Anzahl oder Größe roter Blutkörperchen verbunden, die als Polyzythämie bezeichnet wird. Diese Erhöhung kann durch eine angeborene Herzerkrankung, ein Cor pulmonale, eine Lungenfibrose, zu viel Erythropoietin oder eine Polyzythämie vera verursacht werden. Erhöhte Hämoglobinwerte können auch durch Höhenaufenthalte, Rauchen, Dehydrierung (künstlich durch Anreicherung von Hb), fortgeschrittene Lungenerkrankungen und bestimmte Tumore verursacht werden. ⓘ
Eine kürzlich in Pondicherry, Indien, durchgeführte Studie zeigt die Bedeutung des Hämoglobins bei koronaren Herzkrankheiten. ⓘ
Diagnostische Anwendungen

Die Messung der Hämoglobinkonzentration gehört zu den am häufigsten durchgeführten Blutuntersuchungen, in der Regel im Rahmen eines vollständigen Blutbildes. Sie wird zum Beispiel typischerweise vor oder nach einer Blutspende durchgeführt. Die Ergebnisse werden in g/L, g/dL oder mol/L angegeben. 1 g/dL entspricht etwa 0,6206 mmol/L, obwohl die letztgenannten Einheiten aufgrund der Unsicherheiten hinsichtlich des polymeren Zustands des Moleküls nicht so häufig verwendet werden. Für die Hämoglobinkonzentration im Blut ist dieser Umrechnungsfaktor unter Verwendung des Molekulargewichts einer einzigen Globineinheit von 16.000 Da gebräuchlicher. Für MCHC (mittlere korpuskuläre Hämoglobinkonzentration) ist der Umrechnungsfaktor 0,155, der das Tetramergewicht von 64 500 Da verwendet, gebräuchlicher. Normale Werte sind:
- Männer: 13,8 bis 18,0 g/dL (138 bis 180 g/L, oder 8,56 bis 11,17 mmol/L)
- Frauen: 12,1 bis 15,1 g/dL (121 bis 151 g/L, oder 7,51 bis 9,37 mmol/L)
- Kinder: 11 bis 16 g/dL (110 bis 160 g/L, oder 6,83 bis 9,93 mmol/L)
- Schwangere: 11 bis 14 g/dL (110 bis 140 g/L, oder 6,83 bis 8,69 mmol/L) (9,5 bis 15 üblicher Wert während der Schwangerschaft) ⓘ
Der Normalwert des Hämoglobins muss bei Schwangeren im 1. und 3. Trimenon mindestens 11 g/dL und im 2. Trimenon mindestens 10,5 g/dL betragen. ⓘ
Dehydratation oder Hyperhydratation können die gemessenen Hämoglobinwerte stark beeinflussen. Albumin kann den Hydratationsstatus anzeigen. ⓘ
Liegt die Konzentration unter dem Normalwert, spricht man von einer Anämie. Anämien werden nach der Größe der roten Blutkörperchen, der Zellen, die bei Wirbeltieren das Hämoglobin enthalten, klassifiziert. Die Anämie wird als "mikrozytär" bezeichnet, wenn die roten Blutkörperchen klein sind, als "makrozytär", wenn sie groß sind, und ansonsten als "normozytär". ⓘ
Der Hämatokrit, der Anteil der roten Blutkörperchen am Blutvolumen, beträgt in der Regel etwa das Dreifache der Hämoglobinkonzentration, die in g/dL gemessen wird. Wird zum Beispiel ein Hämoglobinwert von 17 g/dL gemessen, so entspricht dies einem Hämatokrit von 51 %. ⓘ
Für Labortests auf Hämoglobin ist eine Blutprobe (arteriell, venös oder kapillar) und eine Analyse mit einem Hämatologie-Analysegerät und einem CO-Oximeter erforderlich. Darüber hinaus gibt es eine neue nicht-invasive Hämoglobin-Testmethode (SpHb) namens Puls-CO-Oximetrie, die eine vergleichbare Genauigkeit wie invasive Methoden aufweist. ⓘ
Die Konzentrationen von Oxy- und Desoxyhämoglobin können mit NIRS kontinuierlich, regional und nichtinvasiv gemessen werden. Die NIRS kann sowohl am Kopf als auch an den Muskeln eingesetzt werden. Diese Technik wird häufig in der Forschung eingesetzt, z. B. im Spitzensporttraining, in der Ergonomie, in der Rehabilitation, in der Patientenüberwachung, in der Neugeborenenforschung, in der funktionellen Gehirnüberwachung, in der Gehirn-Computer-Schnittstelle, in der Urologie (Blasenkontraktion), in der Neurologie (neurovaskuläre Kopplung) und in anderen Bereichen. ⓘ
Die langfristige Kontrolle der Blutzuckerkonzentration kann anhand der Konzentration von Hb A1c gemessen werden. Eine direkte Messung würde viele Proben erfordern, da die Blutzuckerwerte im Laufe des Tages stark schwanken. Hb A1c ist das Produkt der irreversiblen Reaktion von Hämoglobin A mit Glukose. Eine höhere Glukosekonzentration führt zu mehr Hb A1c. Da die Reaktion langsam abläuft, entspricht der Hb A1c-Anteil dem Glukosespiegel im Blut, gemittelt über die Halbwertszeit der roten Blutkörperchen, die in der Regel etwa 120 Tage beträgt. Ein Hb A1c-Anteil von 6,0 % oder weniger zeigt eine gute langfristige Blutzuckereinstellung an, während Werte über 7,0 % erhöht sind. Dieser Test ist besonders für Diabetiker nützlich. ⓘ
Die funktionelle Magnetresonanztomographie (fMRI) nutzt das Signal von Desoxyhämoglobin, das für Magnetfelder empfindlich ist, da es paramagnetisch ist. Die kombinierte Messung mit NIRS zeigt eine gute Korrelation sowohl mit dem Oxy- als auch mit dem Desoxyhämoglobinsignal im Vergleich zum BOLD-Signal. ⓘ
Verfolgung von Sportlern und Selbstverfolgung
Hämoglobin kann nichtinvasiv verfolgt werden, um einen individuellen Datensatz zu erstellen, der die Auswirkungen von Hämokonzentration und Hämodilution bei täglichen Aktivitäten verfolgt und so ein besseres Verständnis von sportlicher Leistung und Training ermöglicht. Athleten sind oft besorgt über die Ausdauer und die Intensität des Trainings. Der Sensor verwendet Leuchtdioden, die rotes und infrarotes Licht durch das Gewebe zu einem Lichtdetektor senden, der dann ein Signal an einen Prozessor sendet, um die Absorption von Licht durch das Hämoglobinprotein zu berechnen. Dieser Sensor ähnelt einem Pulsoximeter, das aus einem kleinen Messgerät besteht, das an den Finger geklemmt wird. ⓘ
Analoga in nicht-vertebratenen Organismen
In Organismen des gesamten Tier- und Pflanzenreichs gibt es eine Vielzahl von Proteinen, die Sauerstoff transportieren und binden. Organismen wie Bakterien, Protozoen und Pilze verfügen alle über hämoglobinähnliche Proteine, zu deren bekannten und vorhergesagten Aufgaben die reversible Bindung von gasförmigen Liganden gehört. Da viele dieser Proteine Globine und den Häm-Anteil (Eisen in einem flachen Porphyrinträger) enthalten, werden sie oft als Hämoglobine bezeichnet, auch wenn sich ihre tertiäre Gesamtstruktur stark von der des Hämoglobins der Wirbeltiere unterscheidet. Insbesondere ist die Unterscheidung zwischen "Myoglobin" und Hämoglobin bei niederen Tieren oft unmöglich, da einige dieser Organismen keine Muskeln haben. Oder sie verfügen zwar über ein erkennbares separates Kreislaufsystem, aber nicht über eines, das für den Sauerstofftransport zuständig ist (z. B. viele Insekten und andere Gliederfüßer). In all diesen Gruppen werden häm-/globinhaltige Moleküle (auch monomere Globine), die für die Gasbindung zuständig sind, als Oxyhämoglobine bezeichnet. Sie sind nicht nur für den Transport und die Erkennung von Sauerstoff zuständig, sondern auch für NO, CO2, Sulfidverbindungen und sogar für die O2-Bindung in anaeroben Umgebungen. Möglicherweise sind sie sogar für die Entgiftung von chlorierten Stoffen zuständig, ähnlich wie die hämatopoetischen P450-Enzyme und Peroxidasen. ⓘ

Die Struktur der Hämoglobine ist von Art zu Art unterschiedlich. Hämoglobin kommt in allen Reichen der Organismen vor, aber nicht in allen Organismen. Primitive Arten wie Bakterien, Protozoen, Algen und Pflanzen haben oft Hämoglobine mit einem einzigen Globin. Viele Fadenwürmer, Weichtiere und Krustentiere enthalten sehr große Moleküle mit mehreren Untereinheiten, die viel größer sind als die von Wirbeltieren. Insbesondere chimäre Hämoglobine, die in Pilzen und Riesenringelwürmern vorkommen, können sowohl Globin als auch andere Arten von Proteinen enthalten. ⓘ
Eines der auffälligsten Vorkommen und die Verwendung von Hämoglobin in Organismen ist der Riesenröhrenwurm (Riftia pachyptila, auch Vestimentifera genannt), der bis zu 2,4 Meter lang werden kann und vulkanische Schlote im Meer besiedelt. Anstelle eines Verdauungstrakts enthalten diese Würmer eine Bakterienpopulation, die die Hälfte des Gewichts des Organismus ausmacht. Die Bakterien oxidieren H2S aus dem Schlot mit O2 aus dem Wasser, um Energie zu erzeugen und Nahrung aus H2O und CO2 herzustellen. Das obere Ende der Würmer ist eine tiefrote, fächerartige Struktur ("Plume"), die in das Wasser hineinragt und H2S und O2 für die Bakterien und CO2 zur Verwendung als synthetisches Rohmaterial ähnlich wie bei photosynthetischen Pflanzen aufnimmt. Die Strukturen sind leuchtend rot, weil sie mehrere außerordentlich komplexe Hämoglobine mit bis zu 144 Globinketten und dazugehörigen Hämstrukturen enthalten. Diese Hämoglobine zeichnen sich dadurch aus, dass sie in der Lage sind, in Gegenwart von Sulfid Sauerstoff zu transportieren und sogar Sulfid zu transportieren, ohne dabei vollständig "vergiftet" oder gehemmt zu werden, wie es bei den Hämoglobinen der meisten anderen Arten der Fall ist. ⓘ
Andere sauerstoffbindende Proteine
- Myoglobin
- Es kommt im Muskelgewebe vieler Wirbeltiere, einschließlich des Menschen, vor und verleiht dem Muskelgewebe eine deutlich rote oder dunkelgraue Farbe. Es ist dem Hämoglobin in Struktur und Sequenz sehr ähnlich, ist aber kein Tetramer, sondern ein Monomer, dem die kooperative Bindung fehlt. Es dient eher der Speicherung als dem Transport von Sauerstoff. ⓘ
- Hämocyanin
- Das zweithäufigste sauerstofftransportierende Protein in der Natur, das im Blut vieler Gliederfüßer und Weichtiere vorkommt. Es verwendet prosthetische Kupfergruppen anstelle von Eisenhämgruppen und ist blau, wenn es mit Sauerstoff angereichert wird. ⓘ
- Hemerythrin
- Einige wirbellose Meerestiere und einige Arten von Ringelwürmern verwenden dieses eisenhaltige Nicht-Häm-Protein für den Sauerstofftransport in ihrem Blut. Erscheint rosa/violett, wenn es mit Sauerstoff angereichert ist, und klar, wenn nicht. ⓘ
- Chlorocruorin
- Es kommt in vielen Anneliden vor und ist dem Erythrocruorin sehr ähnlich, aber die Häm-Gruppe unterscheidet sich deutlich in der Struktur. Erscheint bei Desoxygenierung grün und bei Sauerstoffanreicherung rot. ⓘ
- Vanabine
- Auch als Vanadium-Chromagene bekannt, kommen sie im Blut von Seescheiden vor. Früher ging man davon aus, dass sie das Metall Vanadium als sauerstoffbindende prosthetische Gruppe verwenden. Obwohl sie vorzugsweise Vanadium enthalten, binden sie offenbar nur wenig Sauerstoff und haben daher eine andere Funktion, die noch nicht geklärt ist (Seescheiden enthalten auch etwas Hämoglobin). Sie können als Toxine wirken. ⓘ
- Erythrocruorin
- Es handelt sich um ein riesiges, frei schwimmendes Blutprotein, das viele Dutzend - möglicherweise Hunderte - von eisen- und hämhaltigen Proteinuntereinheiten enthält, die zu einem einzigen Proteinkomplex mit einer Molekülmasse von mehr als 3,5 Millionen Dalton zusammengebunden sind. ⓘ
- Pinnaglobin
- Kommt nur in der Molluske Pinna nobilis vor. Braunes Porphyrinprotein auf Manganbasis. ⓘ
- Leghämoglobin
- In Hülsenfrüchten wie Alfalfa oder Sojabohnen werden die stickstofffixierenden Bakterien in den Wurzeln durch dieses eisenhaltige, sauerstoffbindende Protein vor Sauerstoff geschützt. Das spezifische Enzym, das geschützt wird, ist die Nitrogenase, die in Gegenwart von freiem Sauerstoff kein Stickstoffgas reduzieren kann. ⓘ
- Koboglobin
- Ein synthetisches Porphyrin auf Kobaltbasis. Koboprotein erscheint farblos, wenn es mit Sauerstoff angereichert ist, aber gelb, wenn es in Venen vorkommt. ⓘ
Vorkommen in nicht-erythroiden Zellen
Einige nicht-erythroide Zellen (d. h. Zellen, die nicht zu den roten Blutkörperchen gehören) enthalten Hämoglobin. Im Gehirn gehören dazu die dopaminergen A9-Neuronen in der Substantia nigra, Astrozyten in der Großhirnrinde und im Hippocampus sowie alle reifen Oligodendrozyten. Es wurde vermutet, dass das Hämoglobin in diesen Zellen die "Speicherung von Sauerstoff ermöglicht, um einen homöostatischen Mechanismus unter anoxischen Bedingungen zu schaffen, was besonders für A9-DA-Neuronen wichtig ist, die einen erhöhten Stoffwechsel mit einem hohen Bedarf an Energieproduktion haben". Ferner wurde festgestellt, dass "dopaminerge A9-Neuronen besonders gefährdet sein könnten, da sie zusätzlich zu ihrer hohen Mitochondrienaktivität unter starkem oxidativem Stress stehen, der durch die Produktion von Wasserstoffperoxid durch Autoxidation und/oder Monoaminoxidase (MAO)-vermittelte Desaminierung von Dopamin und die anschließende Reaktion des zugänglichen Eisens zur Erzeugung hochtoxischer Hydroxylradikale verursacht wird". Dies könnte das Risiko der Degeneration dieser Zellen bei der Parkinson-Krankheit erklären. Das aus dem Hämoglobin stammende Eisen in diesen Zellen ist nicht die Ursache für die postmortale Dunkelheit dieser Zellen (daher der lateinische Name Substantia nigra), sondern ist vielmehr auf Neuromelanin zurückzuführen. ⓘ
Außerhalb des Gehirns hat Hämoglobin nicht-sauerstofftragende Funktionen als Antioxidans und als Regulator des Eisenstoffwechsels in Makrophagen, Alveolarzellen und Mesangialzellen in der Niere. ⓘ
In Geschichte, Kunst und Musik

Historisch gesehen besteht eine Verbindung zwischen der Farbe von Blut und Rost in der Assoziation des Planeten Mars mit dem römischen Gott des Krieges, da der Planet eine orangerote Farbe hat, die die Alten an Blut erinnerte. Obwohl die Farbe des Planeten auf Eisenverbindungen in Verbindung mit Sauerstoff im Marsboden zurückzuführen ist, ist es ein weit verbreiteter Irrglaube, dass das Eisen im Hämoglobin und seinen Oxiden dem Blut seine rote Farbe verleiht. Die Farbe ist in Wirklichkeit auf den Porphyrinanteil des Hämoglobins zurückzuführen, an den das Eisen gebunden ist, und nicht auf das Eisen selbst, obwohl die Bindung und der Redoxzustand des Eisens die elektronischen Übergänge von pi zu pi* oder n zu pi* des Porphyrins und damit seine optischen Eigenschaften beeinflussen können. ⓘ
Der Künstler Julian Voss-Andreae schuf 2005 eine Skulptur mit dem Titel Heart of Steel (Hemoglobin), die auf dem Rückgrat des Proteins basiert. Die Skulptur wurde aus Glas und verwittertem Stahl gefertigt. Das absichtliche Rosten des ursprünglich glänzenden Kunstwerks spiegelt die grundlegende chemische Reaktion des Hämoglobins wider, bei der Sauerstoff an Eisen gebunden wird. ⓘ
Der Montrealer Künstler Nicolas Baier schuf Lustre (Hémoglobine), eine Skulptur aus rostfreiem Stahl, die die Struktur des Hämoglobinmoleküls zeigt. Sie ist im Atrium des Forschungszentrums der McGill University Health Centre in Montreal ausgestellt. Die Skulptur misst etwa 10 m × 10 m × 10 m. ⓘ
- Der deutsch-amerikanische Künstler Julian Voss-Andreae hat 2005 eine Skulptur geschaffen, die auf der Struktur des Hämoglobins beruht. Das beabsichtigte Rosten des Werks ist eine Anspielung auf die Oxygenierung im Häm.
- Die britische Rockband Placebo nahm ein Lied mit dem Titel Haemoglobin auf.
- Der französische Rapper MC Solaar veröffentlichte im Jahr 1994 eine erfolgreiche Single mit dem Titel La concubine de l'hémoglobine.
- Die deutsche Melodic-Death-Metalband Deadlock hat auf ihrem Album "The Arrival" ein Lied mit dem Namen "Killing The Time With Haemoglobin" mit einer Länge von 11 Minuten. ⓘ
Struktur
Posttranslationale Modifikationen
Neben verschiedenen seltenen Modifikationen einzelner Aminosäuren in den Hämoglobin-Untereinheiten des Menschen tritt häufig die Glykation beider Untereinheiten an speziellen Aminosäuren auf. Dies ist die Folge einer hohen Glucosekonzentration im Blut und kann daher in der Labordiagnostik verwendet werden, um den durchschnittlichen Blutzuckerspiegel der letzten Monate zu ermitteln. ⓘ
Bei der Glykation des Hämoglobins wird Glucose kovalent an Lysin-8, -17, -41, -62 der α-Untereinheit, sowie Valin-2, Lysin-9, -18, -67, -121 oder -145 der β-Untereinheit gebunden. Ist ein glykiertes β-Hämoglobin an Valin-2 modifiziert und hat sich der Glucoserest über ein Aldimin und eine Amadori-Umlagerung zu einem stabilen Ketoamin gewandelt, wird es als HbA1c bezeichnet. ⓘ
Sauerstofftransport
Leistungsfähigkeit

Hämoglobin ist ein globuläres Protein mit sehr guter Löslichkeit in Wasser (Löslichkeit bis zu 5 mmol/l Hämoglobin (34 %)). 1 g Hb kann in vitro 1,389 ml Sauerstoff binden, in vivo jedoch nur 1,34 ml (Hüfnersche Zahl), somit können 100 ml Blut, die etwa 15 g Hb enthalten, bei 100-prozentiger Sättigung bis zu 15 × 1,34 ml = 20,1 ml Sauerstoff aufnehmen. ⓘ
Auffällig ist der sigmoidale (S-förmige) Verlauf der Bindungskurve. Normalerweise würde man erwarten, dass die Sauerstoffbeladung mit steigendem Sauerstoffpartialdruck wie beim Myoglobin zunächst stark und dann immer langsamer zunimmt (hyperbolischer Verlauf). Für Hämoglobin verläuft die Sauerstoffbindungskurve im Bereich des in der Lunge herrschenden Sauerstoffpartialdrucks ungewöhnlich flach und im Bereich des im Gewebe herrschenden Sauerstoffpartialdrucks ungewöhnlich steil. Der flache Verlauf der Bindungskurve im Endteil verhindert einen stärkeren Abfall der Sauerstoffsättigung im Alter, bei Lungenfunktionsstörungen und in Höhenlagen, und der steilere Verlauf im Mittelteil sorgt dafür, dass bei einem sinkenden venösen Sauerstoffpartialdruck viel Sauerstoff abgegeben wird. ⓘ
Hämoglobin-Typen
Embryonale Hämoglobine
Die embryonalen Hämoglobine werden in der Embryonalphase, den ersten 8 Wochen nach der Befruchtung, in Blutinseln des Dottersacks gebildet und tragen Eigennamen:
- Gower-1 (ζ2ε2) („zeta-epsilon“)
- Gower-2 (α2ε2) („alpha-epsilon“)
- Portland-1 (ζ2γ2) („zeta-gamma“)
- Portland-2 (ζ2β2) („zeta-beta“) ⓘ
Glykohämoglobine
Glykohämoglobine entstehen durch Bindung von Glucose an Aminogruppen der Globine. Dies geschieht unter physiologischen Bedingungen nicht-enzymatisch durch den Kontakt des Hämoglobins mit dem Blutzucker (Glykierung). Die Hauptkomponente HbA0 des Hämoglobins A wird dabei vorwiegend in HbA1c umgewandelt, bei dem Glucose an die N-terminale Aminosäure Valin der β-Kette gebunden vorliegt. Der jeweilige Anteil von HbA1c am Gesamthämoglobin wird als Hinweis auf die durchschnittliche Blutzuckerhöhe der vergangenen Wochen interpretiert. ⓘ
Methämoglobin
Methämoglobin (Met-Hb) ist eine deaktivierte, nicht sauerstoffaffine Form des Hämoglobins, in der das Eisenion sich in der Oxidationsstufe III statt II befindet. Das NADH-abhängige Enzym Methämoglobin-Reduktase (Diaphorase I) ist in der Lage, Methämoglobin wieder in Hämoglobin zu überführen. In der Regel liegen beim Menschen zwei Prozent des Hämoglobins als Methämoglobin vor. Ein höherer Anteil kann entweder genetisch bedingt oder Folge einer Vergiftung sein. Ein hoher Methämoglobinanteil hat eine mangelhafte Sauerstoffversorgung des Organismus zur Folge. ⓘ
Nachweis
Der Nachweis von Hämoglobin erfolgt durch den Teichmann-Test, bei dem Blut vorsichtig mit Kochsalz und Eisessig erwärmt wird, wobei sich Hämin (Teichmann-Kristalle) abscheidet, oder mit der Luminolreaktion, bei der eine Lösung aus Luminol sowie Natronlauge und eine Lösung aus Wasserstoffperoxid verwendet wird. Diese Reaktion findet nur in Anwesenheit eines Katalysators statt, im Nachweisfalle von Hämoglobin wäre dieser das Eisen(II)-Ion im Häm-Komplex. ⓘ