Opioide
| Opioid ⓘ | |
|---|---|
| Medikamentenklasse | |
 Chemische Struktur von Morphin, dem Prototyp des Opioids. | |
| Identifikatoren der Klasse | |
| Verwendung | Schmerzlinderung |
| ATC-Code | N02A |
| Wirkungsweise | Opioid-Rezeptor |
| Externe Links | |
| MeSH | D000701 |
Opioide sind Substanzen, die auf Opioidrezeptoren wirken und morphinähnliche Wirkungen erzeugen. Medizinisch werden sie in erster Linie zur Schmerzlinderung, einschließlich Anästhesie, eingesetzt. Weitere medizinische Verwendungszwecke sind die Unterdrückung von Durchfall, die Substitutionstherapie bei Opioidkonsumstörungen, die Umkehrung einer Opioidüberdosierung und die Unterdrückung von Husten. Extrem starke Opioide wie Carfentanil sind nur für den Einsatz in der Tiermedizin zugelassen. Opioide werden auch häufig nichtmedizinisch wegen ihrer euphorisierenden Wirkung oder zur Verhinderung eines Entzugs eingesetzt. Opioide können zum Tod führen und wurden in den Vereinigten Staaten für Hinrichtungen verwendet. ⓘ
Zu den Nebenwirkungen von Opioiden können Juckreiz, Sedierung, Übelkeit, Atemdepression, Verstopfung und Euphorie gehören. Langfristiger Konsum kann zu Toleranz führen, was bedeutet, dass höhere Dosen erforderlich sind, um die gleiche Wirkung zu erzielen, und zu körperlicher Abhängigkeit, was bedeutet, dass ein abruptes Absetzen der Droge zu unangenehmen Entzugserscheinungen führt. Die Euphorie verlockt zum Freizeitkonsum, und der häufige, eskalierende Freizeitkonsum von Opioiden führt in der Regel zur Abhängigkeit. Eine Überdosis oder der gleichzeitige Konsum mit anderen depressiven Drogen wie Benzodiazepinen führt häufig zum Tod durch Atemdepression. ⓘ
Opioide wirken durch Bindung an Opioidrezeptoren, die vor allem im zentralen und peripheren Nervensystem sowie im Magen-Darm-Trakt zu finden sind. Diese Rezeptoren vermitteln sowohl die psychoaktiven als auch die somatischen Wirkungen von Opioiden. Zu den Opioid-Arzneimitteln gehören partielle Agonisten wie das Medikament Loperamid gegen Durchfall und Antagonisten wie Naloxegol gegen opioidbedingte Verstopfung, die die Blut-Hirn-Schranke nicht überwinden, aber andere Opioide von der Bindung an diese Rezeptoren abhalten können. ⓘ
Da Opioide süchtig machen und zu einer tödlichen Überdosierung führen können, sind die meisten von ihnen kontrollierte Substanzen. Im Jahr 2013 haben zwischen 28 und 38 Millionen Menschen Opioide illegal konsumiert (0,6 % bis 0,8 % der Weltbevölkerung im Alter zwischen 15 und 65 Jahren). Im Jahr 2011 konsumierten schätzungsweise 4 Millionen Menschen in den Vereinigten Staaten Opioide als Freizeitdroge oder waren von ihnen abhängig. Seit 2015 werden die steigenden Raten des Freizeitkonsums und der Abhängigkeit auf die übermäßige Verschreibung von Opioidmedikamenten und billiges illegales Heroin zurückgeführt. Umgekehrt werden Ängste vor übermäßiger Verschreibung, übertriebenen Nebenwirkungen und Abhängigkeit von Opioiden ebenfalls für die Unterbehandlung von Schmerzen verantwortlich gemacht. ⓘ
Opioide (von altgriechisch ὄπιον ópion [ˈɔpiɔn], deutsch ‚Mohnsaft, Opium‘ und mittelgriechisch εἶδος eidos [ˈiðɔs], deutsch ‚Gestalt‘, zusammen „dem Opium ähnlich“) ist ein Sammelbegriff für eine chemisch heterogene (uneinheitliche) Gruppe natürlicher und synthetischer sowie semisynthetischer Substanzen, die morphinartige Eigenschaften aufweisen und an Opioidrezeptoren wirksam sind. Der Begriff Opiat steht hingegen nur für die natürlicherweise im Opium vorkommenden Stoffe mit dieser Wirkung, die chemisch Alkaloide darstellen und aus dem Schlafmohn (Papaver somniferum) gewonnen werden. ⓘ
Man unterscheidet körpereigene (endogene) Opioide, die eine Rolle bei der Schmerzunterdrückung im Rahmen der Stressreaktion spielen, von therapeutisch oder missbräuchlich zugeführten (exogenen) Opioiden. ⓘ
Das Wirkspektrum von Opioiden ist komplex und sehr unterschiedlich. Die wichtigste Wirkung ist eine starke Schmerzlinderung (Analgesie) bei geringen kardiovaskulären Nebenwirkungen, was Opioide, genannt dann auch Opioid-Analgetika, zu unverzichtbaren und vielgenutzten Arzneimitteln in der Schmerztherapie, Anästhesie und anderen Einsatzbereichen macht. Unter den vielfältigen weiteren Wirkungen sind Sedierung und der euphorisierende Effekt zu nennen; die wichtigsten Nebenwirkungen sind Vigilanzminderung und Atemdepression, v. a. bei Überdosierung, sowie Obstipation (Verstopfung) und Entwicklung einer Abhängigkeit. ⓘ
Terminologie
Zu den Opioiden gehören Opiate, ein älterer Begriff, der sich auf die aus Opium gewonnenen Medikamente, einschließlich Morphin, bezieht. Andere Opioide sind halbsynthetische und synthetische Drogen wie Hydrocodon, Oxycodon und Fentanyl, Antagonisten wie Naloxon und körpereigene Peptide wie die Endorphine. Die Begriffe Opiat und Narkotikum werden manchmal als Synonyme für Opioid verwendet. Der Begriff Opiat beschränkt sich auf die natürlichen Alkaloide, die im Harz des Schlafmohns vorkommen, obwohl auch halbsynthetische Derivate darunter fallen. Narkotikum, abgeleitet von Wörtern, die "Betäubung" oder "Schlaf" bedeuten, bezieht sich als amerikanischer Rechtsbegriff auf Kokain und Opioide sowie deren Ausgangsstoffe; er wird auch lose auf alle illegalen oder kontrollierten psychoaktiven Drogen angewendet. In einigen Gerichtsbarkeiten werden alle kontrollierten Drogen rechtlich als Betäubungsmittel eingestuft. Der Begriff kann eine abwertende Konnotation haben, und in solchen Fällen wird von seiner Verwendung im Allgemeinen abgeraten. ⓘ
Medizinische Anwendungen
Schmerzen
Das schwache Opioid Codein ist in niedrigen Dosen und in Kombination mit einem oder mehreren anderen Medikamenten in der Regel rezeptfrei erhältlich und kann zur Behandlung leichter Schmerzen eingesetzt werden. Andere Opioide sind in der Regel für die Linderung mittelschwerer bis starker Schmerzen reserviert. ⓘ
Akute Schmerzen
Opioide sind wirksam bei der Behandlung akuter Schmerzen (z. B. nach einer Operation). Zur sofortigen Linderung mäßiger bis starker akuter Schmerzen sind Opioide aufgrund ihres raschen Wirkeintritts, ihrer Wirksamkeit und ihres geringeren Abhängigkeitsrisikos häufig die Behandlung der Wahl. Einem neuen Bericht zufolge besteht jedoch ein deutliches Risiko für einen längeren Opioidkonsum, wenn Opioidanalgetika zur akuten Schmerzbehandlung nach einer Operation oder einem Trauma eingesetzt werden. Sie haben sich auch in der Palliativmedizin als wichtig erwiesen, um die schweren, chronischen, behindernden Schmerzen zu lindern, die bei einigen unheilbaren Krankheiten wie Krebs und degenerativen Erkrankungen wie rheumatoider Arthritis auftreten können. In vielen Fällen sind Opioide eine erfolgreiche Langzeitbehandlungsstrategie für Menschen mit chronischen Krebsschmerzen. ⓘ
Etwas mehr als die Hälfte aller US-Bundesstaaten hat Gesetze erlassen, die die Verschreibung oder Abgabe von Opioiden bei akuten Schmerzen einschränken. ⓘ
Chronische Schmerzen ohne Krebs
In den Leitlinien wird darauf hingewiesen, dass bei den meisten chronischen Erkrankungen, die nicht auf Krebs zurückzuführen sind, einschließlich Kopfschmerzen, Rückenschmerzen und Fibromyalgie, das Risiko von Opioiden wahrscheinlich größer ist als ihr Nutzen. Daher sollten sie bei chronischen Schmerzen, die nicht auf Krebs zurückzuführen sind, nur mit Vorsicht eingesetzt werden. Wenn sie eingesetzt werden, sollten Nutzen und Schaden mindestens alle drei Monate neu bewertet werden. ⓘ
Bei der Behandlung chronischer Schmerzen sind Opioide eine Option, die ausprobiert werden sollte, nachdem andere, weniger riskante Schmerzmittel in Betracht gezogen wurden, darunter Paracetamol/Acetaminophen oder NSAIDs wie Ibuprofen oder Naproxen. Einige Arten von chronischen Schmerzen, darunter die durch Fibromyalgie oder Migräne verursachten Schmerzen, werden vorzugsweise mit anderen Medikamenten als Opioiden behandelt. Die Wirksamkeit des Einsatzes von Opioiden zur Linderung chronischer neuropathischer Schmerzen ist ungewiss. ⓘ
Opioide sind als Erstbehandlung von Kopfschmerzen kontraindiziert, da sie die Aufmerksamkeit beeinträchtigen, das Risiko einer Abhängigkeit mit sich bringen und das Risiko erhöhen, dass episodische Kopfschmerzen chronisch werden. Opioide können auch eine erhöhte Schmerzempfindlichkeit bei Kopfschmerzen hervorrufen. Wenn andere Behandlungsmethoden versagen oder nicht zur Verfügung stehen, können Opioide zur Behandlung von Kopfschmerzen geeignet sein, wenn der Patient überwacht werden kann, um die Entwicklung chronischer Kopfschmerzen zu verhindern. ⓘ
Opioide werden immer häufiger bei der Behandlung von nicht-malignen chronischen Schmerzen eingesetzt. Diese Praxis hat nun zu einem neuen und wachsenden Problem der Abhängigkeit und des Missbrauchs von Opioiden geführt. Aufgrund verschiedener negativer Auswirkungen ist der Einsatz von Opioiden zur langfristigen Behandlung chronischer Schmerzen nicht angezeigt, es sei denn, andere weniger riskante Schmerzmittel haben sich als unwirksam erwiesen. Chronische Schmerzen, die nur periodisch auftreten, wie z. B. Nervenschmerzen, Migräne und Fibromyalgie, lassen sich häufig besser mit anderen Medikamenten als Opioiden behandeln. Paracetamol und nichtsteroidale Antirheumatika wie Ibuprofen und Naproxen gelten als sicherere Alternativen. Sie werden häufig in Kombination mit Opioiden eingesetzt, z. B. Paracetamol in Kombination mit Oxycodon (Percocet) und Ibuprofen in Kombination mit Hydrocodon (Vicoprofen), was die Schmerzlinderung verstärkt, aber auch vom Freizeitkonsum abhalten soll. ⓘ
Andere
Husten
Kodein galt einst als der "Goldstandard" bei Hustenmitteln, doch wird diese Position inzwischen in Frage gestellt. Einige neuere placebokontrollierte Studien haben ergeben, dass es bei einigen Ursachen, einschließlich akutem Husten bei Kindern, nicht besser als ein Placebo ist. Daher wird es für Kinder nicht empfohlen. Außerdem gibt es keine Belege dafür, dass Hydrocodon bei Kindern nützlich ist. Auch in einer niederländischen Leitlinie aus dem Jahr 2012 zur Behandlung von akutem Husten wird die Verwendung von Hydrocodon nicht empfohlen. (Das Opioidanalogon Dextromethorphan, das lange Zeit als ebenso wirksamer Hustenstiller wie Codein galt, hat in mehreren neueren Studien ebenfalls keinen Nutzen gezeigt.) ⓘ
Morphin in niedriger Dosierung kann bei chronischem Husten helfen, aber seine Verwendung ist durch Nebenwirkungen eingeschränkt. ⓘ
Durchfall und Verstopfung
Bei einem durchfallbedingten Reizdarmsyndrom können Opioide zur Unterdrückung der Diarrhö eingesetzt werden. Loperamid ist ein peripher selektives Opioid, das rezeptfrei erhältlich ist und zur Unterdrückung von Durchfall eingesetzt wird. ⓘ
Die Fähigkeit, Durchfall zu unterdrücken, führt auch zu Verstopfung, wenn Opioide über mehrere Wochen hinweg eingenommen werden. Naloxegol, ein peripher-selektiver Opioid-Antagonist, ist jetzt zur Behandlung opioidbedingter Verstopfung erhältlich. ⓘ
Atemnottherapie in der Palliativmedizin
Opioide können gerade in der Behandlung einer Dyspnoe als Folge fortgeschrittener Erkrankungen wie einer COPD zumindest im Terminalstadium einer Erkrankung verabreicht werden, sofern die Symptomlinderung und nicht die Beschleunigung des Sterbeprozesses angestrebt wird. Darüber hinaus sind Opioide auch zur Linderung einer anderweitig nicht zu behandelnden Atemnot von COPD-Patienten außerhalb eines Terminalstadiums hilfreich. Zum Einsatz kann z. B. Morphin mittels intravenöser oder subcutaner Injektion erfolgen, eine andere Möglichkeit ist die Gabe von nasal zu verabreichendem Fentanyl. ⓘ
Hyperalgesie ⓘ
Opioid-induzierte Hyperalgesie (OIH) wurde bei Patienten nach chronischer Opioidexposition festgestellt. ⓘ
Unerwünschte Wirkungen
Häufig und kurzzeitig
- Juckreiz
- Übelkeit
- Erbrechen
- Verstopfung
- Schläfrigkeit
- Trockener Mund
Andere
- Kognitive Auswirkungen
- Opioid-Abhängigkeit
- Schwindel
- Appetitlosigkeit
- Verzögerte Magenentleerung
- Verminderter Sexualtrieb
- Beeinträchtigte sexuelle Funktion
- Verminderter Testosteronspiegel
- Depressionen
- Immunschwäche
- Erhöhte Schmerzempfindlichkeit
- Unregelmäßige Menstruation
- Erhöhtes Risiko von Stürzen
- Verlangsamte Atmung
- Koma ⓘ
Jedes Jahr sterben weltweit 69 000 Menschen an einer Überdosis Opioide, und 15 Millionen Menschen sind opioidabhängig. ⓘ
Bei älteren Erwachsenen geht der Opioidkonsum mit vermehrten unerwünschten Wirkungen wie "Sedierung, Übelkeit, Erbrechen, Verstopfung, Harnverhalt und Stürzen" einher. Infolgedessen sind ältere Erwachsene, die Opioide einnehmen, einem höheren Verletzungsrisiko ausgesetzt. Im Gegensatz zu vielen anderen Medikamenten wie Aspirin und Paracetamol verursachen Opioide keine spezifische Organtoxizität. Sie werden nicht mit oberen gastrointestinalen Blutungen und Nierentoxizität in Verbindung gebracht. ⓘ
Die Verschreibung von Opioiden bei akuten Kreuzschmerzen und zur Behandlung von Osteoarthritis scheint langfristige negative Auswirkungen zu haben ⓘ
Nach Angaben des USCDC war Methadon zwischen 1999 und 2010 an 31 % der opioidbedingten Todesfälle in den USA beteiligt, 40 % davon als alleinige Droge - weit mehr als andere Opioide. Studien über die Langzeiteinnahme von Opioiden haben ergeben, dass viele diese absetzen und dass geringfügige Nebenwirkungen üblich waren. Bei etwa 0,3 % trat eine Abhängigkeit auf. In den Vereinigten Staaten starben 2016 1,7 von 10.000 Menschen an einer Überdosis Opioide. ⓘ
In den nachstehenden US-Tabellen sind viele Todesfälle auf mehrere Opioide zurückzuführen: ⓘ
Jährliche Todesfälle in den USA durch alle Opioiddrogen. In dieser Zahl enthalten sind opioidhaltige Analgetika sowie Heroin und illegale synthetische Opioide.
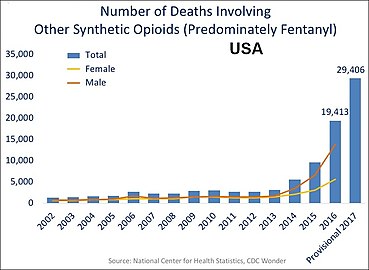
Jährliche Todesfälle in den USA durch andere synthetische Opioide, vor allem Fentanyl.
Jährliche Todesfälle in den USA durch verschreibungspflichtige Opioide. Synthetische Opioide, die nicht unter Methadon hergestellt werden, sind eine Kategorie, die von illegal erworbenem Fentanyl dominiert wird, und wurden daher nicht berücksichtigt.
Jährliche US-Todesfälle durch Überdosierung mit Heroin. ⓘ
Verstärkungsstörungen
Toleranz
Toleranz ist ein Prozess, der durch Neuroadaptionen gekennzeichnet ist, die zu einer verminderten Drogenwirkung führen. Während die Hochregulierung von Rezeptoren oft eine wichtige Rolle spielt, sind auch andere Mechanismen bekannt. Die Toleranz ist bei einigen Wirkungen ausgeprägter als bei anderen; Toleranz tritt langsam bei den Wirkungen auf die Stimmung, den Juckreiz, den Harnverhalt und die Atemdepression auf, aber schneller bei der Analgesie und anderen körperlichen Nebenwirkungen. Die Toleranz entwickelt sich jedoch nicht bei Verstopfung oder Miosis (Verengung der Augenpupille auf weniger als oder gleich zwei Millimeter). Diese Vorstellung wurde jedoch von einigen Autoren in Frage gestellt, die die Auffassung vertreten, dass sich eine Toleranz gegenüber Miosis entwickelt. ⓘ
Die Toleranz gegenüber Opioiden wird durch eine Reihe von Substanzen abgeschwächt, darunter:
- Kalziumkanalblocker
- intrathekales Magnesium und Zink
- NMDA-Antagonisten, wie z. B. Dextromethorphan, Ketamin und Memantin
- Cholecystokinin-Antagonisten, wie z. B. Proglumid
- Neuere Wirkstoffe wie der Phosphodiesterase-Hemmer Ibudilast wurden ebenfalls für diese Anwendung erforscht. ⓘ
Toleranz ist ein physiologischer Prozess, bei dem sich der Körper an ein häufig eingenommenes Medikament gewöhnt und in der Regel mit der Zeit höhere Dosen desselben Medikaments benötigt, um die gleiche Wirkung zu erzielen. Sie tritt häufig bei Personen auf, die über einen längeren Zeitraum hohe Dosen von Opioiden einnehmen, steht jedoch in keinem Zusammenhang mit Missbrauch oder Abhängigkeit. ⓘ
Toleranz, Abhängigkeit und Entzug
Die Toleranzentwicklung (Gewöhnung) bei Opioiden bezeichnet die Wirkungsabschwächung und Verkürzung der Wirkdauer bei wiederholter Zufuhr, die durch eine Dosiserhöhung ausgeglichen wird. Es handelt sich um eine pharmakodynamische Toleranz, die hauptsächlich auf einer gesteigerten Enzymaktivität der intrazellulären Adenylatzyklase beruht. ⓘ
Die Toleranzausbildung ist charakteristischerweise für die analgetische, euphorische und atemdepressive Wirkung schneller als für die spasmogenen peripheren Effekte und die Miosis. Bei endogenen Opioiden wird die Toleranzentwicklung durch eine Aufnahme und Aufarbeitung der Rezeptoren in die Zelle verhindert. Bei unterbrochener Opioidzufuhr kommt es zur Entzugssymptomatik, die auf einer vermehrten Freisetzung von Noradrenalin beruht. Die Entzugssymptomatik ist ein Diagnosekriterium für eine entstandene Abhängigkeit. ⓘ
Ein Entzug von Opioiden kann im ambulanten oder stationären Bereich bzw. ohne ärztliche Hilfe als sog. „kalter Entzug“ oder mit „qualifizierten“ Methoden durchgeführt werden. Der Schweregrad des Opioidentzugssyndrom kann mittels verschiedener validierter Beurteilungsbögen erhoben werden und ist abhängig von mehreren Faktoren. Eine psychosoziale Betreuung, die im Übrigen auch ein begünstigender Faktor für einen erfolgreichen Entzug an und für sich ist, soll diesem folgen, da damit eine länger dauernde bzw. anhaltende Abstinenz erleichtert wird. Eine psychosoziale Betreuung wird auch für Personen, die sich in Substitutionsprogrammen befinden, gefordert. Letztere sind die anerkannte Therapie für eine Abhängigkeit von Opioiden, insbesondere der Heroin-Abhängigkeit. ⓘ
Werden Opioide zur Schmerztherapie eingesetzt, tritt eine Toleranzentwicklung und Abhängigkeit (bei ausreichender und zeitkonstanter Dosierung) nicht auf. Ein lautstarkes Verlangen nach vermehrten Opioidgaben ist hier als Zeichen einer Unterdosierung zu werten. ⓘ
Physische Abhängigkeit ist die physiologische Anpassung des Körpers an eine Substanz, in diesem Fall an ein Opioid. Sie ist definiert durch das Auftreten von Entzugserscheinungen, wenn die Substanz abgesetzt wird, wenn die Dosis abrupt reduziert wird oder, speziell im Fall von Opioiden, wenn ein Antagonist (z. B. Naloxon) oder ein Agonist-Antagonist (z. B. Pentazocin) verabreicht wird. Körperliche Abhängigkeit ist ein normaler und zu erwartender Aspekt bestimmter Medikamente und bedeutet nicht unbedingt, dass der Patient süchtig ist. ⓘ
Zu den Entzugssymptomen bei Opiaten können starke Dysphorie, Verlangen nach einer weiteren Opiatdosis, Reizbarkeit, Schwitzen, Übelkeit, Rhinorea, Zittern, Erbrechen und Myalgie gehören. Eine langsame Reduzierung der Opioideinnahme über Tage und Wochen kann die Entzugssymptome verringern oder beseitigen. Die Geschwindigkeit und Schwere des Entzugs hängt von der Halbwertszeit des Opioids ab; der Entzug von Heroin und Morphin erfolgt schneller als der von Methadon. Auf die akute Entzugsphase folgt oft eine langwierige Phase der Depression und Schlaflosigkeit, die sich über Monate hinziehen kann. Die Symptome des Opioid-Entzugs können mit anderen Medikamenten, wie z. B. Clonidin, behandelt werden. Die körperliche Abhängigkeit ist keine Vorhersage für Drogenmissbrauch oder echte Abhängigkeit und hängt eng mit demselben Mechanismus wie die Toleranz zusammen. Zwar gibt es anekdotische Behauptungen über den Nutzen von Ibogain, aber die Datenlage zur Unterstützung seiner Verwendung bei Drogenabhängigkeit ist dürftig. ⓘ
Bei kritischen Patienten, die regelmäßig Opioide eingenommen haben, tritt häufig ein iatrogener Entzug auf. ⓘ
Drogensucht
Drogenabhängigkeit ist eine komplexe Reihe von Verhaltensweisen, die typischerweise mit dem Missbrauch bestimmter Drogen einhergehen und sich im Laufe der Zeit und bei höheren Dosierungen entwickeln. Zur Sucht gehört ein psychischer Zwang, der dazu führt, dass der Betroffene auf Handlungen besteht, die zu gefährlichen oder ungesunden Ergebnissen führen. Zur Opioidabhängigkeit gehört die Insufflation oder Injektion, anstatt Opioide wie aus medizinischen Gründen verschrieben oral einzunehmen. ⓘ
In europäischen Ländern wie Österreich, Bulgarien und der Slowakei werden orale Morphinformulierungen mit langsamer Wirkstofffreisetzung im Rahmen der Opiatsubstitutionstherapie (OST) für Patienten verwendet, die die Nebenwirkungen von Buprenorphin oder Methadon nicht gut vertragen. Buprenorphin kann auch zusammen mit Naloxon für eine längere Behandlung der Abhängigkeit eingesetzt werden. / In anderen europäischen Ländern, einschließlich des Vereinigten Königreichs, wird dies ebenfalls legal für OST verwendet, wenn auch mit unterschiedlicher Akzeptanz. ⓘ
Langsam freisetzende Formulierungen von Medikamenten sollen den Missbrauch eindämmen und die Abhängigkeitsrate senken, während gleichzeitig versucht wird, Schmerzpatienten weiterhin eine legitime Schmerzlinderung und eine einfache Anwendung zu bieten. Es gibt jedoch noch Fragen zur Wirksamkeit und Sicherheit dieser Art von Präparaten. Weitere fälschungssichere Medikamente werden derzeit von der FDA im Rahmen von Versuchen zur Marktzulassung geprüft. ⓘ
Die vorliegenden Erkenntnisse lassen nur eine schwache Schlussfolgerung zu, aber sie legen nahe, dass ein Arzt, der die Einnahme von Opioiden bei Patienten ohne Vorgeschichte einer Substanzkonsumstörung richtig handhabt, eine langfristige Schmerzlinderung mit geringem Risiko der Entwicklung einer Abhängigkeit oder anderer schwerwiegender Nebenwirkungen erreichen kann. ⓘ
Zu den Problemen mit Opioiden gehören die folgenden:
- Manche Menschen stellen fest, dass Opioide nicht alle ihre Schmerzen lindern.
- Manche Menschen stellen fest, dass die Nebenwirkungen von Opioiden Probleme verursachen, die den Nutzen der Therapie überwiegen.
- Manche Menschen entwickeln mit der Zeit eine Toleranz gegenüber Opioiden. Dies führt dazu, dass sie ihre Medikamentendosis erhöhen müssen, um den Nutzen aufrechtzuerhalten, was wiederum auch die unerwünschten Nebenwirkungen verstärkt.
- Langfristiger Opioidkonsum kann zu einer opioidinduzierten Hyperalgesie führen, d. h. zu einer erhöhten Schmerzempfindlichkeit des Patienten. ⓘ
Alle Opioide können Nebenwirkungen hervorrufen. Zu den häufigsten Nebenwirkungen bei Patienten, die Opioide zur Schmerzlinderung einnehmen, gehören Übelkeit und Erbrechen, Schläfrigkeit, Juckreiz, Mundtrockenheit, Schwindel und Verstopfung. ⓘ
Übelkeit und Erbrechen
Die Toleranz gegenüber Übelkeit tritt innerhalb von 7-10 Tagen ein, wobei Antiemetika (z. B. niedrig dosiertes Haloperidol einmal pro Nacht) sehr wirksam sind. Aufgrund schwerer Nebenwirkungen wie Spätdyskinesien wird Haloperidol nur noch selten eingesetzt. Ein verwandtes Medikament, Prochlorperazin, wird häufiger eingesetzt, obwohl es ähnliche Risiken birgt. Stärkere Antiemetika wie Ondansetron oder Tropisetron werden manchmal eingesetzt, wenn die Übelkeit schwer oder anhaltend und störend ist, obwohl sie teurer sind. Eine weniger teure Alternative sind Dopaminantagonisten wie Domperidon und Metoclopramid. Domperidon überwindet nicht die Blut-Hirn-Schranke und erzeugt keine nachteiligen zentralen antidopaminergen Wirkungen, sondern blockiert die Brechreiz auslösende Wirkung von Opioiden in der Chemorezeptorenzone. (Das Medikament ist in den USA nicht erhältlich.) Einige Antihistaminika mit anticholinergen Eigenschaften (z. B. Orphenadrin oder Diphenhydramin) können ebenfalls wirksam sein. Das Antihistaminikum der ersten Generation, Hydroxyzin, wird sehr häufig verwendet. Es hat den zusätzlichen Vorteil, dass es keine Bewegungsstörungen hervorruft und auch keine analgetischen Eigenschaften besitzt. Δ9-Tetrahydrocannabinol lindert Übelkeit und Erbrechen; es erzeugt auch eine Analgesie, die niedrigere Dosen von Opioiden bei geringerer Übelkeit und weniger Erbrechen ermöglichen kann.
- 5-HT3-Antagonisten (z. B. Ondansetron)
- Dopamin-Antagonisten (z. B. Domperidon)
- Anticholinergische Antihistaminika (z. B. Diphenhydramin)
- Δ9-Tetrahydrocannabinol (z. B. Dronabinol) ⓘ
Das Erbrechen ist auf eine Magenstauung zurückzuführen (Erbrechen großer Mengen, kurzzeitige Übelkeit, die durch Erbrechen beseitigt wird, ösophagealer Reflux, epigastrisches Völlegefühl, frühzeitige Sättigung), außerdem auf eine direkte Wirkung auf die chemorezeptorische Triggerzone der Area postrema, dem Brechzentrum des Gehirns. Das Erbrechen kann daher durch prokinetische Mittel (z. B. Domperidon oder Metoclopramid) verhindert werden. Wenn das Erbrechen bereits eingesetzt hat, müssen diese Medikamente auf einem nicht-oralen Weg verabreicht werden (z. B. subkutan bei Metoclopramid, rektal bei Domperidon).
- Prokinetische Mittel (z. B. Domperidon)
- Anticholinergika (z. B. Orphenadrin) ⓘ
Es gibt Hinweise darauf, dass eine Opioid-haltige Anästhesie mit postoperativer Übelkeit und Erbrechen verbunden ist. ⓘ
Bei Patienten mit chronischen Schmerzen, die Opioide einnahmen, kam es zu einer geringen Verbesserung der Schmerzen und der körperlichen Funktionsfähigkeit und zu einem erhöhten Risiko für Erbrechen. ⓘ
Durch die Stimulation Dopamin-abhängiger Rezeptoren in der Triggerzone der Area postrema am Boden des IV. Ventrikels wird das Brechzentrum in der Formatio reticularis stimuliert und so Übelkeit und Erbrechen (emetische Wirkung) ausgelöst. Im Rahmen einer Narkose kann dies postoperativ auftreten (postoperative nausea and vomiting, PONV). Diese Wirkung kann durch Antiemetika gemildert werden. In höherer Dosierung dämpfen Opioide das Brechzentrum jedoch, so dass dann eine antiemetische (übelkeitsmindernde) Wirkung resultiert. ⓘ
Das dem Morphin verwandte Apomorphin hat eine ausgeprägte Wirkung an den Dopamin-2-Rezeptoren der Area postrema. Es kann aus diesem Grund zum Auslösen von Erbrechen bei manchen Vergiftungen genutzt werden, ist jedoch in Deutschland für diese Indikation (beim Menschen) nicht mehr zugelassen. ⓘ
Schläfrigkeit
Die Toleranz gegenüber der Schläfrigkeit entwickelt sich in der Regel im Laufe von 5 bis 7 Tagen, doch wenn sie als störend empfunden wird, hilft oft ein Wechsel zu einem anderen Opioid. Bestimmte Opioide wie Fentanyl, Morphin und Diamorphin (Heroin) wirken tendenziell besonders sedierend, während andere wie Oxycodon, Tilidin und Meperidin (Pethidin) vergleichsweise weniger sedierend wirken. Ansonsten ist die Behandlung mit ZNS-Stimulanzien im Allgemeinen wirksam.
- Stimulanzien (z. B. Koffein, Modafinil, Amphetamin, Methylphenidat) ⓘ
Juckreiz
Juckreiz ist in der Regel kein schwerwiegendes Problem, wenn Opioide zur Schmerzlinderung eingesetzt werden, aber Antihistaminika sind nützlich, um dem Juckreiz entgegenzuwirken, wenn er auftritt. Nicht sedierende Antihistaminika wie Fexofenadin werden häufig bevorzugt, da sie die opioidbedingte Schläfrigkeit nicht verstärken. Einige sedierende Antihistaminika wie Orphenadrin können jedoch eine synergistische schmerzlindernde Wirkung haben, die den Einsatz geringerer Dosen von Opioiden ermöglicht. Aus diesem Grund wurden mehrere Kombinationspräparate aus Opioiden und Antihistaminika auf den Markt gebracht, wie z. B. Meprozin (Meperidin/Promethazin) und Diconal (Dipipanon/Cyclizin), die auch die opioidinduzierte Übelkeit verringern können.
- Antihistaminika (z. B. Fexofenadin) ⓘ
Verstopfung
Opioid-induzierte Verstopfung (OIC) tritt bei 90 bis 95 % der Personen auf, die Opioide langfristig einnehmen. Da sich in der Regel keine Toleranz gegenüber diesem Problem entwickelt, müssen die meisten Menschen, die langfristig Opioide einnehmen, ein Abführmittel oder Einläufe einnehmen. ⓘ
Die Behandlung der OIC erfolgt schrittweise und hängt vom Schweregrad ab. Die erste Behandlungsform ist nicht-pharmakologisch und umfasst Änderungen des Lebensstils wie die Erhöhung der Ballaststoffzufuhr, der Flüssigkeitszufuhr (etwa 1,5 Liter pro Tag) und der körperlichen Aktivität. Wenn nicht-pharmakologische Maßnahmen unwirksam sind, können Abführmittel, einschließlich Stuhlweichmacher (z. B. Polyethylenglykol), volumenbildende Abführmittel (z. B. Ballaststoffpräparate), stimulierende Abführmittel (z. B. Bisacodyl, Sennes) und/oder Einläufe eingesetzt werden. Ein gängiges Abführmittel für OIC ist die Kombination von Docusat und Bisacodyl. Osmotische Abführmittel, einschließlich Laktulose, Polyethylenglykol und Magnesiumhydroxid, sowie Mineralöl (ein gleitendes Abführmittel) werden ebenfalls häufig bei OIC eingesetzt. ⓘ
Wenn Abführmittel nicht ausreichend wirksam sind (was häufig der Fall ist), können Opioid-Formulierungen oder -Schemata, die einen peripher-selektiven Opioid-Antagonisten wie Methylnaltrexonbromid, Naloxegol, Alvimopan oder Naloxon (wie in Oxycodon/Naloxon) enthalten, ausprobiert werden. Ein Cochrane-Review aus dem Jahr 2018 ergab, dass die Beweise für Alvimopan, Naloxon oder Methylnaltrexonbromid nicht eindeutig sind. Naloxon, das oral verabreicht wird, scheint am wirksamsten zu sein. Eine tägliche Dosis von 0,2 mg Naldemedin führt nachweislich zu einer deutlichen Verbesserung der Symptome bei Patienten mit OIC. ⓘ
Ein Wechsel der Opioide ist eine Methode, um die Auswirkungen der Verstopfung bei Langzeitkonsumenten zu minimieren. Studien deuten darauf hin, dass Tramadol, Tapentadol, Methadon und Fentanyl vergleichsweise weniger Verstopfung verursachen, während bei Codein, Morphin, Oxycodon oder Hydromorphon die Verstopfung vergleichsweise stärker ausfallen kann. ⓘ
Atemdepression
Die Atemdepression ist eine schwerwiegende Nebenwirkung und der Hauptmortalitätsfaktor herkömmlicher Opioide. Sie ist direkt proportional zur analgetischen Potenz des Opioids. Atemfrequenz und Atemzugvolumen nehmen ab. ⓘ
μ1-Opioidrezeptoren (MOR1) sind weit verbreitet im Netzwerk jener Hirnareale, die der Steuerung der Atmung und motorischen Kontrolle der oberen Atemwege, einschließlich der Funktion des Schluckens, dienen. Diese Areale sind sensibel für die opioidinduzierte Atemdepression (OIAD). Die für die OIAD bedeutendste Hirnstruktur ist der im Hirnstamm gelegene Prä-Bötzingerkomplex, der als inspirativer Rhythmusgenerator Kraft und Timing der Einatmung und den Ausdruck der aktiven Ausatmung bestimmt. Rund 70–140 glutamaterge Neuronen innerhalb dieses Komplexes sind verantwortlich für die wesentlichsten Merkmale der OIAD. Der parabrachiale Kern (Kölliker-Fuse-Komplex) spielt bei der OIAD eine additive Rolle. Die G-Protein-Aktivierung der MOR1 in diesem Komplex und in weiteren Hirnregionen führt durch Kopplung an den postsynaptischen Effektor GIRK zur Hyperpolarisation betroffener Neuronen und damit zur Hemmung ihrer Erregbarkeit durch Transmitter wie Glutamat. Experimentell konnte durch genetische Auslöschung der MOR1 in den beiden genannten Arealen die Ausprägung einer Atemdepression, selbst gegenüber extremen Fentanyldosen, drastisch reduziert, insbesondere ein natürliches Atemrhythmusmuster aufrechterhalten werden. Toleranz in Bezug auf die Atemdepression entwickelt sich langsamer und schwächer als gegenüber der analgetischen Wirkung. Der parabrachiale Kern ist kein Objekt langfristiger opioiderger Toleranzentwicklung. Zur Entwicklung nebenwirkungsreduzierter Opioide werden mehrere Konzepte verfolgt, von denen es die funktionelle Selektivität bis zur Marktreife geschafft hat. Für die Annahme indes, eine bevorzugte G-Protein Aktivierung (im Englischen „G protein biased agonism“) am MOR1 ginge mechanistisch ohne weiteres einher mit der Minderung der Atemdepression, fehlt der Beweis. ⓘ
Indirekt hat die Atemdepression durch eine Vasodilatation (Gefäßweitstellung) auch eine Erhöhung des intrakraniellen Drucks (Hirndruck) zur Folge. Als milde Verlaufsform tritt eine Hypoventilation (verminderte Atmung) mit nur wenigen Atemzügen pro Minute auf. Typisch für diese ist, dass der Betroffene einer Aufforderung zum aktiven Atmen nachkommt (sogenannte Kommandoatmung). Bei höherer Dosierung kommt die Atmung zum Stillstand. Durch den Einsatz des Antagonisten Naloxon ist eine Atemdepression aufhebbar. Bei schmerzorientierter Gabe von Opioiden tritt in der Regel keine klinisch relevante Atemdepression auf, solange sich die Opioidgabe am Ausmaß der Schmerzreduktion orientiert und eine Überdosierung vermieden wird. Schmerz ist bezüglich Atemdepression ein Opioidantagonist. ⓘ
Atemdepression ist die schwerwiegendste unerwünschte Wirkung im Zusammenhang mit der Einnahme von Opioiden, sie tritt jedoch in der Regel bei einer einzigen intravenösen Dosis bei einem Opioid-unerfahrenen Patienten auf. Bei Patienten, die Opioide regelmäßig zur Schmerzlinderung einnehmen, tritt rasch eine Toleranz gegenüber der Atemdepression ein, so dass sie kein klinisches Problem darstellt. Es wurden mehrere Medikamente entwickelt, die die Atemdepression teilweise blockieren können. Das einzige derzeit für diesen Zweck zugelassene Atemstimulans ist Doxapram, das in dieser Anwendung nur eine begrenzte Wirksamkeit aufweist. Neuere Medikamente wie BIMU-8 und CX-546 könnten wesentlich wirksamer sein.
- Atemstimulanzien: Agonisten der Karotis-Chemorezeptoren (z. B. Doxapram), 5-HT4-Agonisten (z. B. BIMU8), δ-Opioid-Agonisten (z. B. BW373U86) und AMPAkine (z. B. CX717) können die durch Opioide hervorgerufene Atemdepression verringern, ohne die Analgesie zu beeinträchtigen, aber die meisten dieser Arzneimittel sind nur mäßig wirksam oder haben Nebenwirkungen, die eine Verwendung beim Menschen ausschließen. 5-HT1A-Agonisten wie 8-OH-DPAT und Repinotan wirken ebenfalls der opioidbedingten Atemdepression entgegen, verringern aber gleichzeitig die Analgesie, was ihren Nutzen für diese Anwendung einschränkt.
- Opioid-Antagonisten (z. B. Naloxon, Nalmefen, Diprenorphin) ⓘ
Die ersten 24 Stunden nach der Verabreichung von Opioiden scheinen die kritischsten im Hinblick auf eine lebensbedrohliche OIRD zu sein, können aber durch einen vorsichtigeren Ansatz bei der Opioidverwendung vermieden werden. ⓘ
Bei Patienten mit Herz- oder Atemwegserkrankungen und/oder obstruktiver Schlafapnoe besteht ein erhöhtes Risiko für OIRD. ⓘ
Erhöhte Schmerzempfindlichkeit
Bei einigen Menschen wurde eine opioidinduzierte Hyperalgesie beobachtet, bei der Personen, die Opioide zur Schmerzlinderung einnehmen, paradoxerweise mehr Schmerzen als Folge der Medikation empfinden. Dieses Phänomen ist zwar ungewöhnlich, tritt aber bei einigen Palliativpatienten auf, vor allem wenn die Dosis schnell erhöht wird. Falls dieses Phänomen auftritt, kann ein Wechsel zwischen verschiedenen Opioid-Schmerzmedikamenten das Auftreten verstärkter Schmerzen verringern. Eine opioidinduzierte Hyperalgesie tritt häufiger bei chronischem Gebrauch oder kurzzeitigen hohen Dosen auf, aber einige Untersuchungen deuten darauf hin, dass sie auch bei sehr niedrigen Dosen auftreten kann. ⓘ
Nebenwirkungen wie Hyperalgesie und Allodynie, die manchmal mit einer Verschlimmerung der neuropathischen Schmerzen einhergehen, können Folgen einer Langzeitbehandlung mit Opioid-Analgetika sein, insbesondere wenn die zunehmende Toleranz zu einem Verlust der Wirksamkeit und folglich zu einer progressiven Dosiseskalation geführt hat. Dies scheint weitgehend auf die Wirkung von Opioiden an anderen Zielen als den drei klassischen Opioidrezeptoren zurückzuführen zu sein, darunter der Nozizeptinrezeptor, der Sigma-Rezeptor und der Toll-like-Rezeptor 4, und kann in Tiermodellen durch Antagonisten an diesen Zielen wie J-113,397, BD-1047 bzw. (+)-Naloxon bekämpft werden. Derzeit sind keine Medikamente zugelassen, die speziell der opioidinduzierten Hyperalgesie beim Menschen entgegenwirken, und in schweren Fällen kann die einzige Lösung darin bestehen, die Einnahme von Opioid-Analgetika einzustellen und sie durch nicht-opioidhaltige Analgetika zu ersetzen. Da jedoch die individuelle Empfindlichkeit für das Auftreten dieser Nebenwirkung stark dosisabhängig ist und je nach verwendetem Opioid-Analgetikum variieren kann, können viele Patienten diese Nebenwirkung einfach durch eine Dosisreduzierung des Opioids (in der Regel zusammen mit einem zusätzlichen Nicht-Opioid-Analgetikum), einen Wechsel zwischen verschiedenen Opioiden oder durch die Umstellung auf ein milderes Opioid mit gemischter Wirkungsweise, das auch neuropathischen Schmerzen entgegenwirkt, insbesondere Tramadol oder Tapentadol, vermeiden. ⓘ
- NMDA-Rezeptor-Antagonisten wie Ketamin
- SNRIs wie z. B. Milnacipran
- Antikonvulsiva wie Gabapentin oder Pregabalin ⓘ
Andere unerwünschte Wirkungen
Niedrige Sexualhormonspiegel
Klinische Studien haben durchweg einen Zusammenhang zwischen medizinischem und Freizeit-Opioidkonsum und Hypogonadismus (niedriger Sexualhormonspiegel) bei verschiedenen Geschlechtern hergestellt. Die Wirkung ist dosisabhängig. Die meisten Studien deuten darauf hin, dass die Mehrheit (vielleicht sogar 90 %) der chronischen Opioidkonsumenten Hypogonadismus entwickelt. Opioide können auch die Menstruation bei Frauen beeinträchtigen, indem sie die Produktion des luteinisierenden Hormons (LH) einschränken. Opioid-induzierter Hypogonadismus ist wahrscheinlich die Ursache für die starke Assoziation von Opioidkonsum mit Osteoporose und Knochenbrüchen, die auf einen Mangel an Östradiol zurückzuführen ist. Sie kann auch die Schmerzen verstärken und dadurch die beabsichtigte klinische Wirkung der Opioidbehandlung beeinträchtigen. Opioid-induzierter Hypogonadismus wird wahrscheinlich durch die Agonisierung von Opioidrezeptoren im Hypothalamus und in der Hypophyse verursacht. In einer Studie wurde festgestellt, dass sich der erniedrigte Testosteronspiegel von Heroinabhängigen innerhalb eines Monats nach der Abstinenz wieder normalisierte, was darauf hindeutet, dass die Wirkung leicht reversibel und nicht dauerhaft ist. Seit 2013 ist die Auswirkung eines niedrig dosierten oder akuten Opioidkonsums auf das endokrine System unklar. Ein langfristiger Opioidkonsum kann sich auch auf andere Hormonsysteme auswirken. ⓘ
Beeinträchtigung der Arbeit
Der Konsum von Opioiden kann ein Risikofaktor für die Nichtwiederaufnahme der Arbeit sein. ⓘ
Personen, die sicherheitsrelevante Aufgaben ausführen, sollten keine Opioide einnehmen. Gesundheitsdienstleister sollten Arbeitnehmern, die schwere Geräte wie Kräne oder Gabelstapler fahren oder bedienen, nicht empfehlen, chronische oder akute Schmerzen mit Opioiden zu behandeln. Unternehmen, die Arbeitnehmer beschäftigen, die sicherheitsempfindliche Tätigkeiten ausführen, sollten diesen Arbeitnehmern weniger empfindliche Aufgaben zuweisen, solange diese Arbeitnehmer von ihrem Arzt mit Opioiden behandelt werden. ⓘ
Bei Personen, die Opioide über einen längeren Zeitraum einnehmen, ist die Wahrscheinlichkeit, arbeitslos zu werden, erhöht. Die Einnahme von Opioiden kann das Leben der Patienten weiter beeinträchtigen, und die unerwünschten Wirkungen der Opioide selbst können ein erhebliches Hindernis für ein aktives Leben, die Aufnahme einer Beschäftigung und die Aufrechterhaltung einer Karriere darstellen. ⓘ
Darüber hinaus kann eine fehlende Beschäftigung ein Prädiktor für einen abweichenden Gebrauch von verschreibungspflichtigen Opioiden sein. ⓘ
Erhöhte Unfallwahrscheinlichkeit
Opioidkonsum kann das Unfallrisiko erhöhen. Opioide können das Risiko von Verkehrsunfällen und Stürzen erhöhen. ⓘ
Verminderte Aufmerksamkeit ⓘ
Es hat sich gezeigt, dass Opioide die Aufmerksamkeit beeinträchtigen, vor allem wenn sie zusammen mit Antidepressiva und/oder Antikonvulsiva eingenommen werden. ⓘ
Seltene Nebenwirkungen
Zu den seltenen Nebenwirkungen bei Patienten, die Opioide zur Schmerzlinderung einnehmen, gehören: dosisabhängige Atemdepression (insbesondere bei stärkeren Opioiden), Verwirrtheit, Halluzinationen, Delirium, Urtikaria, Hypothermie, Bradykardie/Tachykardie, orthostatische Hypotonie, Schwindel, Kopfschmerzen, Harnverhalt, Harnleiter- oder Gallenkrampf, Muskelstarre, Myoklonus (bei hohen Dosen) und Flush (aufgrund von Histaminfreisetzung, außer bei Fentanyl und Remifentanil). Sowohl der therapeutische als auch der chronische Einsatz von Opioiden kann die Funktion des Immunsystems beeinträchtigen. Opioide verringern die Proliferation von Makrophagen-Vorläuferzellen und Lymphozyten und beeinträchtigen die Zelldifferenzierung (Roy & Loh, 1996). Opioide können auch die Migration von Leukozyten hemmen. Es ist jedoch nicht bekannt, welche Bedeutung dies im Zusammenhang mit der Schmerzlinderung hat. ⓘ
Wechselwirkungen
Ärzte, die Patienten behandeln, die Opioide in Kombination mit anderen Medikamenten einnehmen, dokumentieren kontinuierlich, dass eine weitere Behandlung angezeigt ist, und sind sich der Möglichkeiten bewusst, die Behandlung anzupassen, wenn sich der Zustand des Patienten so verändert, dass eine weniger riskante Therapie angezeigt ist. ⓘ
Mit anderen depressiv machenden Medikamenten

Die gleichzeitige Einnahme von Opioiden mit anderen depressiv machenden Medikamenten wie Benzodiazepinen oder Ethanol erhöht die Raten von unerwünschten Ereignissen und Überdosierungen. Wie bei einer Überdosis eines Opioids allein kann auch die Kombination eines Opioids mit einem anderen Beruhigungsmittel zu einer Atemdepression führen, die häufig tödlich ist. Diese Risiken werden durch eine engmaschige Überwachung durch den Arzt verringert, der die Patienten kontinuierlich auf Veränderungen im Verhalten und in der Therapietreue überprüfen kann. ⓘ
Opioid-Antagonist
Die (unerwünschten oder sonstigen) Wirkungen von Opioiden lassen sich mit einem Opioid-Antagonisten wie Naloxon oder Naltrexon aufheben. Diese kompetitiven Antagonisten binden an die Opioidrezeptoren mit höherer Affinität als Agonisten, aktivieren die Rezeptoren aber nicht. Dadurch wird der Agonist verdrängt, wodurch die Wirkung des Agonisten abgeschwächt oder aufgehoben wird. Die Eliminationshalbwertszeit von Naloxon kann jedoch kürzer sein als die des Opioids selbst, so dass eine wiederholte Verabreichung oder eine Dauerinfusion erforderlich sein kann, oder es kann ein länger wirkender Antagonist wie Nalmefene verwendet werden. Bei Patienten, die regelmäßig Opioide einnehmen, ist es von entscheidender Bedeutung, dass das Opioid nur teilweise abgesetzt wird, um eine schwere und belastende Reaktion, nämlich das Aufwachen mit quälenden Schmerzen, zu vermeiden. Dies wird erreicht, indem nicht die volle Dosis verabreicht wird, sondern diese in kleinen Dosen, bis sich die Atemfrequenz verbessert hat. Dann wird eine Infusion gestartet, um die Umkehrung der Dosis auf diesem Niveau zu halten und gleichzeitig die Schmerzlinderung aufrechtzuerhalten. Opioidantagonisten sind nach wie vor die Standardbehandlung bei Atemdepression nach einer Opioidüberdosierung, wobei Naloxon bei weitem am häufigsten eingesetzt wird, obwohl der länger wirkende Antagonist Nalmefen zur Behandlung von Überdosierungen lang wirkender Opioide wie Methadon eingesetzt werden kann und Diprenorphin zur Umkehrung der Wirkung extrem potenter Opioide, die in der Tiermedizin verwendet werden, wie Etorphin und Carfentanil, verwendet wird. Da Opioid-Antagonisten jedoch auch die positiven Wirkungen von Opioid-Analgetika blockieren, sind sie im Allgemeinen nur zur Behandlung von Überdosierungen nützlich, wobei die Verwendung von Opioid-Antagonisten neben Opioid-Analgetika zur Verringerung von Nebenwirkungen eine sorgfältige Dosistitration erfordert und bei Dosen, die niedrig genug sind, um die Analgesie aufrechtzuerhalten, oft nur wenig wirksam ist. ⓘ
Naltrexon scheint das Risiko für schwerwiegende unerwünschte Ereignisse nicht zu erhöhen, was die Sicherheit von oralem Naltrexon bestätigt. Mortalität oder schwerwiegende unerwünschte Ereignisse aufgrund von Rebound-Toxizität waren bei Patienten mit Naloxon selten. ⓘ
Pharmakologie
| Droge | Relativ Potenz |
Nichtionisierte Fraktion |
Protein Bindung |
Lipid Löslichkeit |
|---|---|---|---|---|
| Morphin | 1 | ++ | ++ | ++ |
| Pethidin (Meperidin) | 0.1 | + | +++ | +++ |
| Hydromorphon | 10 | + | +++ | |
| Alfentanil | 10–25 | ++++ | ++++ | +++ |
| Fentanyl | 75–125 | + | +++ | ++++ |
| Remifentanil | 250 | +++ | +++ | ++ |
| Sufentanil | 500–1000 | ++ | ++++ | ++++ |
| Etorphin | 1000–3000 | |||
| Carfentanil | 10000 |
Opioide binden an spezifische Opioidrezeptoren im Nervensystem und in anderen Geweben. Es gibt drei Hauptklassen von Opioidrezeptoren, μ, κ, δ (mu, kappa und delta), obwohl bis zu siebzehn bekannt sind, darunter die ε-, ι-, λ- und ζ-Rezeptoren (Epsilon, Iota, Lambda und Zeta). Die σ-(Sigma)-Rezeptoren hingegen werden nicht mehr als Opioidrezeptoren angesehen, da ihre Aktivierung durch den Opioid-Inversantagonisten Naloxon nicht aufgehoben wird, sie keine hochaffine Bindung für klassische Opioide aufweisen und sie stereoselektiv für rechtsdrehende Isomere sind, während die anderen Opioidrezeptoren stereoselektiv für linksdrehende Isomere sind. Darüber hinaus gibt es drei Subtypen von μ-Rezeptoren: μ1 und μ2 sowie den neu entdeckten μ3. Ein weiterer Rezeptor von klinischer Bedeutung ist der opioidrezeptorähnliche Rezeptor 1 (ORL1), der an Schmerzreaktionen beteiligt ist und eine wichtige Rolle bei der Entwicklung von Toleranz gegenüber μ-Opioid-Agonisten spielt, die als Analgetika eingesetzt werden. Dies sind alles G-Protein-gekoppelte Rezeptoren, die auf die GABA-erge Neurotransmission einwirken. ⓘ

Die pharmakodynamische Reaktion auf ein Opioid hängt von dem Rezeptor ab, an den es bindet, von seiner Affinität zu diesem Rezeptor und davon, ob das Opioid ein Agonist oder ein Antagonist ist. So werden beispielsweise die supraspinalen analgetischen Eigenschaften des Opioid-Agonisten Morphin durch die Aktivierung des μ1-Rezeptors, die Atemdepression und körperliche Abhängigkeit durch den μ2-Rezeptor und die Sedierung und spinale Analgesie durch den κ-Rezeptor vermittelt. Jede Gruppe von Opioidrezeptoren löst eine Reihe unterschiedlicher neurologischer Reaktionen aus, wobei die Rezeptor-Subtypen (wie z. B. μ1 und μ2) noch spezifischere Reaktionen hervorrufen. Einzigartig für jedes Opioid ist seine unterschiedliche Bindungsaffinität zu den verschiedenen Klassen von Opioidrezeptoren (z. B. werden die μ-, κ- und δ-Opioidrezeptoren je nach den spezifischen Rezeptorbindungsaffinitäten des Opioids in unterschiedlichem Maße aktiviert). Das Opiatalkaloid Morphin bindet beispielsweise mit hoher Affinität an den μ-Opioidrezeptor, während Ketazocin eine hohe Affinität zu ĸ-Rezeptoren aufweist. Dieser kombinatorische Mechanismus ermöglicht die Existenz einer so breiten Klasse von Opioiden und molekularen Designs, die jeweils ein einzigartiges Wirkungsprofil aufweisen. Ihre individuelle molekulare Struktur ist auch für ihre unterschiedliche Wirkdauer verantwortlich, wobei der metabolische Abbau (z. B. N-Dealkylierung) für den Opioid-Stoffwechsel verantwortlich ist. ⓘ

Funktionelle Selektivität
Eine neue Strategie der Arzneimittelentwicklung berücksichtigt die Signalübertragung der Rezeptoren. Diese Strategie zielt darauf ab, die Aktivierung erwünschter Signalwege zu verstärken und gleichzeitig die Auswirkungen auf unerwünschte Signalwege zu verringern. Für diese differenzierte Strategie gibt es mehrere Bezeichnungen, darunter funktionelle Selektivität und verzerrter Agonismus. Das erste Opioid, das absichtlich als voreingenommener Agonist konzipiert und in die klinische Bewertung aufgenommen wurde, ist das Medikament Oliceridin. Es hat eine analgetische Wirkung und weniger unerwünschte Wirkungen. ⓘ
Opioid-Vergleich
Es wurden umfangreiche Forschungsarbeiten durchgeführt, um Äquivalenzverhältnisse zu ermitteln, die die relative Wirksamkeit von Opioiden vergleichen. Bei einer bestimmten Dosis eines Opioids wird eine Äquivalenztabelle verwendet, um die äquivalente Dosis eines anderen Opioids zu ermitteln. Solche Tabellen werden in der Praxis der Opioidrotation und zur Beschreibung eines Opioids im Vergleich zu Morphin, dem Referenzopioid, verwendet. In den Äquianalgesie-Tabellen sind in der Regel die Halbwertszeiten der Wirkstoffe und manchmal auch die äquianalgesischen Dosen desselben Wirkstoffs nach Verabreichungsart aufgeführt, z. B. Morphin: oral und intravenös. ⓘ
Bindungsprofile
| Substanz | MOR | DOR | KOR | Ref | |
|---|---|---|---|---|---|
| 7-Hydroxymitragynin | 13.5 | 155 | 123 | ||
| β-Chlornaltrexamin | 0.90 | 115 | 0.083 | ||
| β-Endorphin | 1.0 | 1.0 | 52 | ||
| β-Funaltrexamin | 0.33 | 48 | 2.8 | ||
| Alazocin | 2.7 | 4.1 | 3.2 | ||
| (-)-Alazocin | 3.0 | 15 | 4.7 | ||
| (+)-Alazocin | 1,900 | 19,000 | 1,600 | ||
| Alfentanil | 39 | 21,200 | ND | ||
| Binaltorphimin | 1.3 | 5.8 | 0.79 | ||
| BNTX | 18 | 0.66 | 55 | ||
| Bremazocin | 0.75 | 2.3 | 0.089 | ||
| (-)-Bremazocin | 0.62 | 0.78 | 0.075 | ||
| Buprenorphin | 4.18 | 25.8 | 12.9 | ||
| Butorphanol | 1.7 | 13 | 7.4 | ||
| BW-3734 | 26 | 0.013 | 17 | ||
| Carfentanil | 0.024 | 3.3 | 43 | ||
| Kodein | 79 | >1,000 | >1,000 | ||
| CTOP | 0.18 | >1,000 | >1,000 | ||
| Cyclazocin | 0.45 | 6.3 | 5.9 | ||
| Cyprodim | 9.4 | 356 | 176 | ||
| DADLE | 16 | 0.74 | >1,000 | ||
| DAMGO | 2.0 | >1,000 | >1,000 | ||
| [D-Ala2]Deltorphin II | >1,000 | 3.3 | >1,000 | ||
| Dermorphin | 0.33 | >1,000 | >1,000 | ||
| (+)-Desmetramadol | 17 | 690 | 1,800 | ||
| Dextropropoxyphen | 34.5 | 380 | 1,220 | ||
| Dezocin | 3.6 | 290 | 460 | ||
| Dihydroetorphin | 0.45 | 1.82 | 0.57 | ||
| Diprenorphin | 0.072 | 0.23 | 0.017 | ||
| DPDPE | >1,000 | 14 | >1,000 | ||
| DSLET | 39 | 4.8 | >1,000 | ||
| Dynorphin A | 32 | >1,000 | 0.5 | ||
| Ethylketazocin | 3.1 | 101 | 0.40 | ||
| (-)-Ethylketazocin | 2.3 | 5.2 | 2.2 | ||
| (+)-Ethylketazocin | 2,500 | >10,000 | 1,600 | ||
| Etorphin | 0.23 | 1.4 | 0.13 | ||
| Fentanyl | 0.39 | >1,000 | 255 | ||
| Hydrocodon | 11.1 | 962 | 501 | ||
| Hydromorphon | 0.47 | 18.5 | 24.9 | ||
| ICI-204488 | >1,000 | >1,000 | 0.71 | ||
| Leu-Enkephalin | 3.4 | 4.0 | >1,000 | ||
| Levacetylmethadol | 9.86 | 169 | 1,020 | ||
| Lofentanil | 0.68 | 5.5 | 5.9 | ||
| Met-Enkephalin | 0.65 | 1.7 | >1,000 | ||
| Metazocin | 3.8 | 44.3 | 13.3 | ||
| Methadon | 1.7 | 435 | 405 | ||
| Dextromethadon | 19.7 | 960 | 1,370 | ||
| Levomethadon | 0.945 | 371 | 1,860 | ||
| Methallorphan | ND | ND | ND | ND | |
| Dextrallorphan | 1,140 | 2,660 | 34.6 | ||
| Levallorphan | 0.213 | 2.18 | 1,100 | ||
| Methorphan | ND | ND | ND | ND | |
| Dextromethorphan | 1,280 | 11,500 | 7,000 | ||
| Levomethorphan | 11.2 | 249 | 225 | ||
| Mitragynin | 7.24 | 60.3 | 1,100 | ||
| Mitragynin Pseudoindoxyl | 0.087 | 3.02 | 79.4 | ||
| Morphanol | ND | ND | ND | ND | |
| Dextrorphan | 420 | 34,700 | 5,950 | ||
| Levorphanol | 0.42 | 3.61 | 4.2 | ||
| Morphiceptin | 56 | >1,000 | >1,000 | ||
| Morphin | 1.8 | 90 | 317 | ||
| Morphin, (-)- | 1.24 | 145 | 23.4 | ||
| Morphin, (+)- | >10,000 | >100,000 | >300,000 | ||
| MR-2266 | 1.0 | 3.0 | 0.16 | ||
| Nalbuphin | 11 | >1,000 | 3.9 | ||
| Nalmefen | 0.24 | 16 | 0.083 | ||
| Nalorphin | 0.97 | 148 | 1.1 | ||
| Naloxonazin | 0.054 | 8.6 | 11 | ||
| Naloxon | 1.1 | 16 | 12 | ||
| (-)-Naloxon | 0.93 | 17 | 2.3 | ||
| (+)-Naloxon | >1,000 | >1,000 | >1,000 | ||
| Naltrexon | 1.0 | 149 | 3.9 | ||
| Naltriben | 12 | 0.013 | 13 | ||
| Naltrindol | 64 | 0.02 | 66 | ||
| Norbinaltorphimin | 2.2 | 65 | 0.027 | ||
| Normorphin | 4.0 | 310 | 149 | ||
| Ohmefentanyl | 0.0079 | 10 | 32 | ||
| Oxycodon | 8.69 | 901 | 1,350 | ||
| Oxymorphindol | 111 | 0.7 | 228 | ||
| Oxymorphon | 0.78 | 50 | 137 | ||
| Pentazocin | 5.7 | 31 | 7.2 | ||
| Pethidin (Meperidin) | 385 | 4,350 | 5,140 | ||
| Phenazocin | 0.20 | 5.0 | 2.0 | ||
| PLO17 | 30 | >1,000 | >1,000 | ||
| Quadazocin | 0.99 | 2.6 | 0.5 | ||
| Salvinorin A | >10,000 | >10,000 | 16 | ||
| Samidorphan | 0.052 | 2.6 | 0.23 | ||
| SIOM | 33 | 1.7 | >1,000 | ||
| Spiradolin | 21 | >1,000 | 0.036 | ||
| Sufentanil | 0.15 | 50 | 75 | ||
| Tianeptin | 383 | >10,000 | >10,000 | ||
| Tifluadom | 32 | 189 | 2.1 | ||
| Tramadol | 2,120 | 57,700 | 42,700 | ||
| (+)-Tramadol | 1,330 | 62,400 | 54,000 | ||
| (-)-Tramadol | 24,800 | 213,000 | 53,500 | ||
| U-50488 | >1,000 | >1,000 | 0.12 | ||
| U-69593 | >1,000 | >1,000 | 0.59 | ||
| Xorphanol | 0.25 | 1.0 | 0.4 | ||
| Die Werte sind Ki (nM), sofern nicht anders angegeben. Je kleiner der Wert, desto stärker bindet die Droge an die Stelle. Die Tests wurden meist mit geklonten oder gezüchteten Rezeptoren von Nagetieren durchgeführt. | |||||
Verwendung
| Substanz | Beste Schätzung |
Niedrig Schätzung |
Hoch Schätzung ⓘ |
|---|---|---|---|
| Amphetamin- Typ Stimulanzien |
34.16 | 13.42 | 55.24 |
| Cannabis | 192.15 | 165.76 | 234.06 |
| Kokain | 18.20 | 13.87 | 22.85 |
| Ecstasy | 20.57 | 8.99 | 32.34 |
| Opiate | 19.38 | 13.80 | 26.15 |
| Opioide | 34.26 | 27.01 | 44.54 |
Die Zahl der Verschreibungen von Opioiden in den USA stieg von 76 Millionen im Jahr 1991 auf 207 Millionen im Jahr 2013. ⓘ
In den 1990er Jahren nahm die Verschreibung von Opioiden erheblich zu. Wurden Opioide früher fast ausschließlich zur Behandlung akuter oder krebsbedingter Schmerzen eingesetzt, so werden sie heute in großem Umfang für Menschen mit chronischen Schmerzen verschrieben. Gleichzeitig steigt die Zahl der Fälle von unbeabsichtigter Abhängigkeit und unbeabsichtigter Überdosierung mit Todesfolge. Nach Angaben des Internationalen Suchtstoffkontrollamtes stehen die Vereinigten Staaten und Kanada beim Pro-Kopf-Verbrauch von verschreibungspflichtigen Opioiden an der Spitze. Die Zahl der Opioidverschreibungen pro Kopf ist in den Vereinigten Staaten und Kanada doppelt so hoch wie in der Europäischen Union, Australien und Neuseeland. Bestimmte Bevölkerungsgruppen sind von der Opioid-Krise stärker betroffen als andere, darunter Gemeinschaften aus der Ersten Welt und Bevölkerungsgruppen mit niedrigem Einkommen. Nach Ansicht von Fachleuten des öffentlichen Gesundheitswesens kann dies darauf zurückzuführen sein, dass alternative Methoden zur Behandlung chronischer Schmerzen nicht zur Verfügung stehen oder zu teuer sind. Opioide wurden als kosteneffiziente Behandlung für chronische Schmerzen beschrieben, aber die Auswirkungen der Opioid-Epidemie und die durch Opioid-Überdosierungen verursachten Todesfälle sollten bei der Bewertung ihrer Kosteneffizienz berücksichtigt werden. Daten aus dem Jahr 2017 deuten darauf hin, dass in den USA etwa 3,4 Prozent der US-Bevölkerung Opioide zur täglichen Schmerzbehandlung verschrieben werden. Die Forderung nach einem Verzicht auf die Verschreibung von Opioiden hat dazu geführt, dass Opioide in großem Umfang abgesetzt werden, ohne dass die Sicherheit oder der Nutzen für Patienten mit chronischen Schmerzen wissenschaftlich belegt sind. ⓘ
Geschichte
Natürlich vorkommende Opioide

Opioide gehören zu den ältesten bekannten Drogen der Welt. Der früheste bekannte Nachweis von Papaver somniferum in einer menschlichen archäologischen Stätte stammt aus der Jungsteinzeit (ca. 5.700-5.500 v. Chr.). Seine Samen wurden in der Cueva de los Murciélagos auf der iberischen Halbinsel und in La Marmotta auf der italienischen Halbinsel gefunden. ⓘ
Die Verwendung des Schlafmohns zu medizinischen, erholsamen und religiösen Zwecken lässt sich bis ins vierte Jahrhundert v. Chr. zurückverfolgen, als Ideogramme auf sumerischen Tontafeln die Verwendung von "Hul Gil", einer "Pflanze der Freude", erwähnen. Opium war den Ägyptern bekannt und wird im Papyrus Ebers als Bestandteil einer Mischung zur Beruhigung von Kindern und zur Behandlung von Brustabszessen erwähnt. ⓘ
Auch bei den Griechen war Opium bekannt. Hippokrates (ca. 460 - ca. 370 v. Chr.) und seine Schüler schätzten es wegen seiner schlaffördernden Wirkung und verwendeten es zur Behandlung von Schmerzen. Der lateinische Spruch "Sedare dolorem opus divinum est", übersetzt. "Schmerzen zu lindern ist das Werk des Göttlichen", wird auf verschiedene Weise Hippokrates und Galen von Pergamon zugeschrieben. Die medizinische Verwendung von Opium wird später von Pedanius Dioskurides (ca. 40 - 90 n. Chr.), einem griechischen Arzt im Dienste der römischen Armee, in seinem fünfbändigen Werk De Materia Medica behandelt. ⓘ
Während des islamischen Goldenen Zeitalters wurde die Verwendung von Opium von Avicenna (ca. 980 - Juni 1037 n. Chr.) in Der Kanon der Medizin ausführlich behandelt. Die fünf Bände des Buches enthalten Informationen über die Zubereitung von Opium, eine Reihe von körperlichen Wirkungen, seine Verwendung zur Behandlung einer Vielzahl von Krankheiten, Gegenanzeigen für seine Verwendung, seine potenzielle Gefahr als Gift und sein Potenzial zur Abhängigkeit. Avicenna riet davon ab, Opium nur als letzten Ausweg zu verwenden, und zog es vor, die Ursachen von Schmerzen zu bekämpfen, anstatt zu versuchen, sie mit Analgetika zu lindern. Viele von Avicennas Beobachtungen wurden durch die moderne medizinische Forschung bestätigt. ⓘ
Wann genau die Welt von Opium in Indien und China erfuhr, ist ungewiss, aber Opium wurde im chinesischen medizinischen Werk K'ai-pao-pen-tsdo (973 n. Chr.) erwähnt. 1590 n. Chr. war Schlafmohn in der Region Subahs of Agra eine wichtige Frühjahrspflanze. ⓘ
Der Arzt Paracelsus (ca. 1493-1541) wird häufig dafür verantwortlich gemacht, dass Opium während der deutschen Renaissance in Westeuropa wieder in der Medizin eingesetzt wurde. Er pries die Vorteile des Opiums für die medizinische Verwendung an. Er behauptete auch, ein "Arkanum" zu besitzen, eine Pille, die er Laudanum nannte und die allen anderen überlegen war, insbesondere wenn es darum ging, den Tod zu überlisten. ("Ich hab' ein Arcanum - heiss' ich Laudanum, ist über das Alles, wo es zum Tode reichen will.") Spätere Autoren haben behauptet, dass Paracelsus' Rezept für Laudanum Opium enthielt, aber seine Zusammensetzung bleibt unbekannt. ⓘ
Laudanum
Der Begriff Laudanum wurde bis zum 17. Jahrhundert als Oberbegriff für eine nützliche Medizin verwendet. Nachdem Thomas Sydenham die erste flüssige Opiumtinktur auf den Markt gebracht hatte, wurde der Begriff Laudanum" für eine Mischung aus Opium und Alkohol verwendet. In Sydenhams Rezept für Laudanum aus dem Jahr 1669 wird Opium mit Wein, Safran, Nelken und Zimt gemischt. Sydenhams Laudanum war bis ins 20. Jahrhundert sowohl in Europa als auch in Amerika weit verbreitet. Andere populäre Arzneimittel auf Opiumbasis waren Paregoric, ein viel milderes flüssiges Präparat für Kinder, Black-drop, ein stärkeres Präparat, und Dover's powder. ⓘ
Der Opiumhandel
Opium wurde zu einer wichtigen Kolonialware, die legal und illegal durch Handelsnetze transportiert wurde, an denen u. a. Indien, die Portugiesen, die Niederländer, die Briten und China beteiligt waren. Die Britische Ostindien-Kompanie sah den Opiumhandel 1683 n. Chr. als Investitionsmöglichkeit. Im Jahr 1773 errichtete der Gouverneur von Bengalen im Namen der Ostindien-Kompanie ein Monopol für die Herstellung von bengalischem Opium. Der Anbau und die Herstellung von indischem Opium wurden zwischen 1797 und 1949 durch eine Reihe von Gesetzen weiter zentralisiert und kontrolliert. Die Briten glichen ein wirtschaftliches Defizit durch die Einfuhr von chinesischem Tee aus, indem sie indisches Opium verkauften, das unter Missachtung der Verbote der chinesischen Regierung nach China geschmuggelt wurde. Dies führte zum Ersten (1839-1842) und Zweiten Opiumkrieg (1856-1860) zwischen China und Großbritannien. ⓘ
Morphin
Im 19. Jahrhundert wurden zwei große wissenschaftliche Fortschritte erzielt, die weitreichende Auswirkungen hatten. Um 1804 isolierte der deutsche Pharmazeut Friedrich Sertürner Morphin aus Opium. Er beschrieb seine Kristallisation, Struktur und pharmakologischen Eigenschaften in einer viel beachteten Abhandlung im Jahr 1817. Morphin war das erste Alkaloid, das aus einer Heilpflanze isoliert wurde, und damit der Beginn der modernen wissenschaftlichen Arzneimittelforschung. ⓘ
Der zweite Fortschritt, fast fünfzig Jahre später, war die Verfeinerung der Injektionsnadel durch Alexander Wood und andere. Die Entwicklung einer Glasspritze mit einer subkutanen Nadel ermöglichte die einfache Verabreichung kontrollierter, messbarer Dosen eines primären Wirkstoffs. ⓘ
Morphin wurde anfangs als Wundermittel gepriesen, weil es Schmerzen lindern konnte. Es half beim Einschlafen und hatte weitere nützliche Nebenwirkungen, darunter die Kontrolle von Husten und Durchfall. Es wurde in großem Umfang von Ärzten verschrieben und von Apothekern ohne Einschränkung abgegeben. Während des amerikanischen Bürgerkriegs wurden Opium und Laudanum in großem Umfang zur Behandlung von Soldaten eingesetzt. Auch Frauen wurde es häufig gegen Menstruationsbeschwerden und Krankheiten mit "nervösem Charakter" verschrieben. Zunächst ging man (fälschlicherweise) davon aus, dass diese neue Art der Anwendung nicht süchtig machen würde. ⓘ
Kodein
Codein wurde 1832 von Pierre Jean Robiquet entdeckt. Robiquet überprüfte eine Methode zur Morphinextraktion, die der schottische Chemiker William Gregory (1803-1858) beschrieben hatte. Bei der Verarbeitung der Rückstände von Gregorys Verfahren isolierte Robiquet eine kristalline Substanz aus den anderen aktiven Bestandteilen des Opiums. Er schrieb über seine Entdeckung: "Hier ist eine neue Substanz im Opium gefunden ... Wir wissen, dass das Morphin, von dem man bisher annahm, es sei der einzige Wirkstoff des Opiums, nicht alle Wirkungen erklärt, und seit langem behaupten die Physiologen, dass es eine Lücke gibt, die gefüllt werden muss." Die Entdeckung des Alkaloids führte zur Entwicklung einer ganzen Generation von Medikamenten gegen Husten und Durchfall auf der Grundlage von Codein. ⓘ
Semisynthetische und synthetische Opioide
Synthetische Opioide wurden im 20. Jahrhundert erfunden und die biologischen Mechanismen ihrer Wirkung entdeckt. Die Wissenschaftler haben nach nicht süchtig machenden Formen von Opioiden gesucht, aber stattdessen stärkere Opioide entwickelt. In England entwickelte Charles Romley Alder Wright auf der Suche nach einem nicht süchtig machenden Opiumderivat Hunderte von Opiatverbindungen. Im Jahr 1874 gelang es ihm als erstem, Diamorphin (Heroin) zu synthetisieren, indem er ein Verfahren namens Acetylierung anwendete, bei dem Morphin mehrere Stunden lang mit Essigsäureanhydrid gekocht wurde. ⓘ
Heroin wurde wenig beachtet, bis es von Felix Hoffmann (1868-1946), der für Heinrich Dreser (1860-1924) in den Bayer-Laboratorien arbeitete, unabhängig synthetisiert wurde. Dreser brachte die neue Droge 1898 als Analgetikum und Hustenmittel gegen Tuberkulose, Bronchitis und Asthma auf den Markt. Bayer stellte die Produktion 1913 ein, nachdem das Suchtpotenzial von Heroin erkannt worden war. ⓘ
In den 1910er Jahren wurden in Deutschland mehrere halbsynthetische Opioide entwickelt. Das erste, Oxymorphon, wurde 1914 aus Thebain, einem opioiden Alkaloid des Schlafmohns, synthetisiert. Martin Freund und Edmund Speyer entwickelten dann 1916 an der Universität Frankfurt Oxycodon, ebenfalls aus Thebain. 1920 stellten Carl Mannich und Helene Löwenheim Hydrocodon her, das sie aus Codein ableiteten. Im Jahr 1924 wurde Hydromorphon durch Zugabe von Wasserstoff zu Morphin synthetisiert. Etorphin wurde 1960 aus dem Oripavin des Schlafmohnstrohs synthetisiert. Buprenorphin wurde 1972 entdeckt. ⓘ
Das erste vollsynthetische Opioid war Meperidin (später Demerol), das 1932 zufällig von dem deutschen Chemiker Otto Eisleb (oder Eislib) bei der IG Farben entdeckt wurde. Meperidin war das erste Opiat mit einer Struktur, die nicht mit Morphin verwandt war, aber opiatähnliche Eigenschaften aufwies. Seine schmerzlindernde Wirkung wurde 1939 von Otto Schaumann entdeckt. Gustav Ehrhart und Max Bockmühl, ebenfalls bei der IG Farben, bauten auf den Arbeiten von Eisleb und Schaumann auf. Sie entwickelten um 1937 "Hoechst 10820" (später Methadon). Im Jahr 1959 entwickelte der belgische Arzt Paul Janssen Fentanyl, eine synthetische Droge mit der 30- bis 50-fachen Wirkstärke von Heroin. Inzwischen sind fast 150 synthetische Opioide bekannt. ⓘ
Kriminalisierung und medizinische Verwendung
Der nicht-klinische Gebrauch von Opium wurde in den Vereinigten Staaten durch den Harrison Narcotics Tax Act von 1914 und durch viele andere Gesetze kriminalisiert. Die Verwendung von Opioiden wurde stigmatisiert und als gefährliche Substanz angesehen, die nur als letzter Ausweg für sterbende Patienten verschrieben werden sollte. Mit dem Controlled Substances Act von 1970 wurde die Strenge des Harrison Acts schließlich gelockert. ⓘ
Im Vereinigten Königreich bekräftigte der Bericht des Departmental Committee on Morphine and Heroin Addiction unter dem Vorsitz des Präsidenten des Royal College of Physicians aus dem Jahr 1926 die medizinische Kontrolle und begründete das britische Kontrollsystem", das bis in die 1960er Jahre Bestand hatte. ⓘ
In den 1980er Jahren veröffentlichte die Weltgesundheitsorganisation Richtlinien für die Verschreibung von Medikamenten, einschließlich Opioiden, für verschiedene Schmerzgrade. In den USA wurden Kathleen Foley und Russell Portenoy zu führenden Befürwortern eines liberalen Einsatzes von Opioiden als Schmerzmittel bei "hartnäckigen, nicht bösartigen Schmerzen". Mit wenig oder gar keinen wissenschaftlichen Beweisen zur Untermauerung ihrer Behauptungen suggerierten die Wissenschaftler und Befürworter der Industrie, dass Menschen mit chronischen Schmerzen resistent gegen eine Abhängigkeit seien. ⓘ
Die Markteinführung von OxyContin im Jahr 1996 wurde von einer aggressiven Marketingkampagne begleitet, die für die Verwendung von Opioiden zur Schmerzlinderung warb. Die zunehmende Verschreibung von Opioiden förderte einen wachsenden Schwarzmarkt für Heroin. Zwischen 2000 und 2014 kam es zu einem "alarmierenden Anstieg des Heroinkonsums im ganzen Land und zu einer Epidemie von Todesfällen durch Überdosierung". ⓘ
Infolgedessen haben Organisationen des Gesundheitswesens und Gruppen des öffentlichen Gesundheitswesens wie Physicians for Responsible Opioid Prescribing (Ärzte für die verantwortungsvolle Verschreibung von Opioiden) dazu aufgerufen, die Verschreibung von Opioiden zu reduzieren. Im Jahr 2016 haben die Centers for Disease Control and Prevention (CDC) neue Richtlinien für die Verschreibung von Opioiden "bei chronischen Schmerzen außerhalb der aktiven Krebsbehandlung, in der Palliativmedizin und bei der Betreuung am Lebensende" sowie für das verstärkte Tapering von Opioiden herausgegeben. ⓘ
"Das Risiko beseitigen"
Im April 2019 kündigte die U.S. Food and Drug Administration (FDA) den Start einer neuen Aufklärungskampagne an, um den Amerikanern zu verdeutlichen, welche wichtige Rolle sie bei der Entfernung und ordnungsgemäßen Entsorgung unbenutzter verschreibungspflichtiger Opioide in ihrem Haushalt spielen. Diese neue Initiative ist Teil der anhaltenden Bemühungen der FDA, die landesweite Opioidkrise zu bekämpfen (siehe unten) und soll dazu beitragen, den unnötigen Kontakt mit Opioiden zu verringern und neue Abhängigkeiten zu verhindern. Die "Remove the Risk"-Kampagne richtet sich an Frauen im Alter von 35 bis 64 Jahren, die am ehesten die Entscheidungen über die Gesundheitsversorgung im Haushalt treffen und oft als Türsteherinnen für Opioide und andere verschreibungspflichtige Medikamente im Haushalt fungieren. ⓘ
Gesellschaft und Kultur
Definition
Der Begriff "Opioid" entstand in den 1950er Jahren. Er setzt sich aus "Opium" und "-oid" zusammen und bedeutet "opiatähnlich" ("Opiate" sind Morphin und ähnliche vom Opium abgeleitete Drogen). Die erste wissenschaftliche Veröffentlichung, die den Begriff 1963 verwendete, enthielt eine Fußnote, in der es hieß: "In dieser Arbeit wird der Begriff 'Opioid' in dem Sinne verwendet, wie er ursprünglich von George H. Acheson (persönliche Mitteilung) vorgeschlagen wurde, um jede chemische Verbindung mit morphinähnlichen Aktivitäten zu bezeichnen". In den späten 1960er Jahren fand die Forschung heraus, dass die Wirkung von Opiaten durch die Aktivierung spezifischer molekularer Rezeptoren im Nervensystem vermittelt wird, die als "Opioidrezeptoren" bezeichnet wurden. Die Definition des Begriffs "Opioid" wurde später dahingehend verfeinert, dass er sich auf Substanzen bezieht, die morphinähnliche Wirkungen haben, die durch die Aktivierung von Opioidrezeptoren vermittelt werden. In einem modernen Lehrbuch der Pharmakologie heißt es: "Der Begriff Opioid gilt für alle Agonisten und Antagonisten mit morphinähnlicher Wirkung sowie für die natürlich vorkommenden und synthetischen Opioidpeptide". In einem anderen Pharmakologie-Referenzwerk wird das Erfordernis der Morphinähnlichkeit gestrichen: "Opioid, ein modernerer Begriff, wird verwendet, um alle natürlichen und synthetischen Substanzen zu bezeichnen, die an Opioidrezeptoren binden (einschließlich Antagonisten)". In einigen Quellen wird der Begriff Opioid so definiert, dass er Opiate ausschließt, und in anderen wird anstelle des Begriffs Opioid der Begriff Opiat verwendet, aber der Begriff Opioid gilt als modern, wird bevorzugt und ist weit verbreitet. ⓘ
Bemühungen zur Reduzierung des Freizeitkonsums in den USA
Im Jahr 2011 veröffentlichte die Obama-Regierung ein Weißbuch, in dem der Plan der Regierung zur Bewältigung der Opioid-Krise beschrieben wurde. Die Bedenken der Regierung in Bezug auf Sucht und versehentliche Überdosierungen wurden von zahlreichen anderen medizinischen und staatlichen Beratungsgremien auf der ganzen Welt aufgegriffen. ⓘ
Seit 2015 gibt es in allen Bundesstaaten außer Missouri Programme zur Überwachung verschreibungspflichtiger Medikamente. Diese Programme ermöglichen es Apothekern und verschreibenden Ärzten, auf die Verschreibungshistorie von Patienten zuzugreifen, um einen verdächtigen Konsum zu erkennen. Eine 2015 veröffentlichte Umfrage unter US-amerikanischen Ärzten ergab jedoch, dass nur 53 % der Ärzte diese Programme nutzen, während 22 % nicht wussten, dass ihnen diese Programme zur Verfügung stehen. Die Centers for Disease Control and Prevention (Zentren für Krankheitskontrolle und -prävention) wurden mit der Ausarbeitung und Veröffentlichung einer neuen Leitlinie beauftragt und erhielten starke Lobbyarbeit. Im Jahr 2016 veröffentlichten die US-amerikanischen Centers for Disease Control and Prevention (Zentren für Krankheitskontrolle und -prävention) ihre Leitlinie für die Verschreibung von Opioiden bei chronischen Schmerzen. Darin wird empfohlen, Opioide nur dann zu verschreiben, wenn der erwartete Nutzen für Schmerzen und Funktion die Risiken überwiegt, und zwar in der niedrigsten wirksamen Dosierung, wobei die gleichzeitige Einnahme von Opioiden und Benzodiazepinen nach Möglichkeit vermieden werden sollte. Forschungsergebnisse deuten darauf hin, dass die Verschreibung hoher Opioiddosen im Zusammenhang mit der chronischen Opioidtherapie (COT) in manchen Fällen durch staatliche gesetzliche Richtlinien und Bemühungen von Gesundheitsplänen verhindert werden kann, die Ressourcen bereitstellen und gemeinsame Erwartungen für die Reduzierung höherer Dosen festlegen. ⓘ
Am 10. August 2017 erklärte Donald Trump die Opioid-Krise zu einem nationalen Gesundheitsnotstand (ohne FEMA). ⓘ
Weltweite Verknappung
Morphin und andere Arzneimittel auf Mohnbasis wurden von der Weltgesundheitsorganisation als unverzichtbar für die Behandlung starker Schmerzen eingestuft. Im Jahr 2002 verbrauchten sieben Länder (USA, Vereinigtes Königreich, Italien, Australien, Frankreich, Spanien und Japan) 77 % der weltweiten Morphinvorräte, so dass es in vielen Schwellenländern an schmerzlindernden Medikamenten mangelt. Das derzeitige System der Lieferung von Mohnrohmaterial zur Herstellung von Arzneimitteln auf Mohnbasis wird vom Internationalen Suchtstoffkontrollamt gemäß den Bestimmungen des Einheitsübereinkommens über Suchtstoffe von 1961 geregelt. Die Menge an Mohnrohstoffen, die jedes Land auf der Grundlage dieser Bestimmungen jährlich nachfragen kann, muss einer Schätzung des Bedarfs des Landes entsprechen, die sich aus dem nationalen Verbrauch der vorangegangenen zwei Jahre ergibt. In vielen Ländern wird wegen der hohen Preise und der mangelnden Ausbildung in der Verschreibung von Arzneimitteln auf Mohnbasis zu wenig Morphium verschrieben. Die Weltgesundheitsorganisation arbeitet nun mit den Behörden verschiedener Länder zusammen, um das Gesundheitspersonal zu schulen und nationale Vorschriften für die Verschreibung von Arzneimitteln zu entwickeln, um die Verschreibung von Medikamenten auf Mohnbasis zu erleichtern. ⓘ
Eine weitere Idee zur Verbesserung der Morphinverfügbarkeit stammt vom Senlis-Rat, der mit seinem Vorschlag für afghanisches Morphin vorschlägt, dass Afghanistan den Schwellenländern im Rahmen eines zweitrangigen Versorgungssystems billige Lösungen zur Schmerzlinderung anbieten könnte, die das derzeitige, vom INCB geregelte System ergänzen würden, indem sie das Gleichgewicht und das geschlossene System, das es schafft, aufrechterhalten und gleichzeitig Morphin als Fertigprodukt für diejenigen bereitstellen, die starke Schmerzen haben und im Rahmen des derzeitigen Systems keinen Zugang zu mohnbasierten Medikamenten haben. ⓘ
Erholungskonsum
Opioide können ein starkes Gefühl der Euphorie hervorrufen und werden häufig als Freizeitdroge konsumiert. Verschreibungspflichtige Opioide, die traditionell mit illegalen Opioiden wie Heroin in Verbindung gebracht werden, werden auch als Freizeitdroge missbraucht. ⓘ
Drogenmissbrauch und nichtmedizinischer Gebrauch umfassen den Gebrauch von Drogen aus anderen Gründen oder in anderen als den vorgeschriebenen Dosierungen. Zum Opioidmissbrauch kann auch die Abgabe von Medikamenten an Personen gehören, für die sie nicht verschrieben wurden. Eine solche Abzweigung kann als Straftat behandelt werden, die in vielen Ländern mit einer Freiheitsstrafe geahndet wird. Im Jahr 2014 missbrauchten fast 2 Millionen Amerikaner verschreibungspflichtige Opioide oder waren von ihnen abhängig. ⓘ
Einstufung
Es gibt mehrere große Klassen von Opioiden:
- Natürliche Opiate: Alkaloide, die im Harz des Schlafmohns enthalten sind, in erster Linie Morphin, Codein und Thebain, nicht aber Papaverin und Noscapin, die einen anderen Wirkmechanismus haben; als natürliche Opiate können gelten: Die Blätter von Mitragyna speciosa (auch bekannt als Kratom) enthalten einige natürlich vorkommende Opioide, die über Mu- und Delta-Rezeptoren wirken. Salvinorin A, das natürlich in der Pflanze Salvia divinorum vorkommt, ist ein Agonist der Kappa-Opioidrezeptoren.
- Ester von Morphinopiaten: chemisch leicht verändert, aber natürlicher als die Halbsynthetika, da die meisten von ihnen Morphin-Prodrugs sind: Diacetylmorphin (Morphin-Diacetat; Heroin), Nicomorphin (Morphin-Dinicotinat), Dipropanoylmorphin (Morphin-Dipropionat), Desomorphin, Acetylpropionylmorphin, Dibenzoylmorphin, Diacetyldihydromorphin;
- Halbsynthetische Opioide: Sie werden entweder aus natürlichen Opiaten oder Morphinestern hergestellt, wie z. B. Hydromorphon, Hydrocodon, Oxycodon, Oxymorphon, Ethylmorphin und Buprenorphin;
- Vollsynthetische Opioide: wie Fentanyl, Pethidin, Levorphanol, Methadon, Tramadol, Tapentadol und Dextropropoxyphen;
- Endogene, körpereigene Opioidpeptide, wie Endorphine, Enkephaline, Dynorphine und Endomorphine. Morphin und einige andere Opioide, die in geringen Mengen im Körper produziert werden, gehören zu dieser Kategorie.
Tramadol und Tapentadol, die als Monoamin-Aufnahmehemmer wirken, wirken auch als schwache bzw. starke Agonisten des μ-Opioidrezeptors. Beide Medikamente bewirken eine Analgesie, auch wenn Naloxon, ein Opioid-Antagonist, verabreicht wird. ⓘ
Einige kleinere Opiumalkaloide und verschiedene Substanzen mit opioider Wirkung kommen auch anderswo vor, darunter Moleküle in Kratom-, Corydalis- und Salvia divinorum-Pflanzen sowie in einigen Mohnarten neben Papaver somniferum. Es gibt auch Stämme, die große Mengen an Thebain produzieren, einem wichtigen Rohstoff für die Herstellung vieler halbsynthetischer und synthetischer Opioide. Von den mehr als 120 Mohnarten produzieren nur zwei Morphin. ⓘ
Unter den Analgetika gibt es eine kleine Anzahl von Wirkstoffen, die zwar auf das zentrale Nervensystem, nicht aber auf das Opioidrezeptorsystem wirken und daher keine der anderen (narkotischen) Eigenschaften der Opioide aufweisen, obwohl sie durch die Schmerzlinderung eine Euphorie hervorrufen können - eine Euphorie, die aufgrund ihrer Entstehungsweise nicht die Grundlage für Gewöhnung, körperliche Abhängigkeit oder Sucht bildet. Dazu gehören vor allem Nefopam, Orphenadrin und vielleicht Phenyltoloxamin oder einige andere Antihistaminika. Trizyklische Antidepressiva haben ebenfalls eine schmerzstillende Wirkung, aber es wird angenommen, dass sie dies über eine indirekte Aktivierung des endogenen Opioidsystems tun. Paracetamol ist in erster Linie ein zentral wirkendes Analgetikum (kein Narkotikum), das seine Wirkung über absteigende serotonerge (5-Hydroxytriptaminerge) Bahnen vermittelt, um die 5-HT-Freisetzung zu erhöhen (die die Freisetzung von Schmerzmediatoren hemmt). Außerdem verringert es die Aktivität der Cyclooxygenase. Kürzlich wurde entdeckt, dass die therapeutische Wirksamkeit von Paracetamol größtenteils oder vollständig auf einen Metaboliten, AM404, zurückzuführen ist, der die Freisetzung von Serotonin steigert und die Aufnahme von Anandamid hemmt. ⓘ
Andere Analgetika wirken peripher (d. h. nicht auf das Gehirn oder Rückenmark). Die Forschung beginnt zu zeigen, dass Morphin und verwandte Medikamente tatsächlich auch periphere Wirkungen haben können, wie z. B. Morphin-Gel bei Verbrennungen. In jüngsten Untersuchungen wurden Opioidrezeptoren an peripheren sensorischen Neuronen entdeckt. Ein erheblicher Teil (bis zu 60 %) der Opioidanalgesie kann durch solche peripheren Opioidrezeptoren vermittelt werden, insbesondere bei entzündlichen Erkrankungen wie Arthritis, traumatischen oder chirurgischen Schmerzen. Entzündliche Schmerzen werden auch durch endogene Opioidpeptide, die periphere Opioidrezeptoren aktivieren, gedämpft. ⓘ
1953 wurde entdeckt, dass Menschen und einige Tiere zusätzlich zu den endogenen Opioidpeptiden auch winzige Mengen von Morphin, Codein und möglicherweise einige ihrer einfacheren Derivate wie Heroin und Dihydromorphin produzieren. Einige Bakterien sind in der Lage, einige halbsynthetische Opioide wie Hydromorphon und Hydrocodon zu produzieren, wenn sie in einer morphin- bzw. codeinhaltigen Lösung leben. ⓘ
Viele der Alkaloide und anderen Derivate des Schlafmohns sind keine Opioide oder Narkotika; das beste Beispiel ist das die glatte Muskulatur entspannende Papaverin. Noscapin ist ein Grenzfall, da es zwar ZNS-Wirkungen hat, die aber nicht unbedingt mit denen von Morphin vergleichbar sind, und es gehört wahrscheinlich in eine eigene Kategorie. ⓘ
Dextromethorphan (das Stereoisomer von Levomethorphan, einem halbsynthetischen Opioidagonisten) und sein Metabolit Dextrorphan haben trotz ihrer strukturellen Ähnlichkeit mit anderen Opioiden überhaupt keine opioidanalgetische Wirkung; stattdessen sind sie potente NMDA-Antagonisten und Sigma-1- und -2-Rezeptor-Agonisten und werden in vielen rezeptfreien Hustenmitteln verwendet. ⓘ
Salvinorin A ist ein einzigartiger selektiver, starker ĸ-Opioidrezeptor-Agonist. Dennoch wird es nicht als Opioid angesehen, weil:
- es chemisch gesehen kein Alkaloid ist; und
- es hat keine typischen Opioid-Eigenschaften, d. h. es wirkt weder angstlösend noch hustenstillend. Stattdessen ist es ein starkes Halluzinogen. ⓘ
| Opioide Peptide | Molekulare Bilder des Skeletts ⓘ |
|---|---|
| Adrenorphin | 
|
| Amidorphin | 
|
| Casomorphin | |
| DADLE | |
| DAMGO | 
|
| Dermorphin | |
| Endomorphin | 
|
| Morphiceptin | 
|
| Nozizeptin | 
|
| Octreotid | 
|
| Opiorphin | 
|
| TRIMU 5 | 
|
Endogene Opioide
Die endogenen Opioide sind körpereigene Peptide, die im Rahmen der Stressantwort ausgeschüttet werden und zur akuten Schmerz- und Hungerunterdrückung dienen, jedoch auch mit den Sexualhormonen interagieren und an der Entstehung von Euphorie sowie der Regulation von gastrointestinaler Funktionen, Atmung, Thermoregulation und Immunreaktionen beteiligt sind. Sie werden bei Verletzungen, jedoch auch durch emotionale Stimuli und UV-Licht ausgeschüttet. Auch bei Übergewicht, psychischen Störungen, aber auch Opioidgabe ist ihre Sekretion verändert. Ein genaues Verständnis dieser komplexen Funktionen und Regulationsvorgänge fehlt bisher. ⓘ
Die endogenen Opioide lassen sich in drei Gruppen einteilen. Das Vorläuferpeptid der Endorphine ist das Pro-Opiomelanocortine (POMC), woraus die Endorphine α, β und γ hervorgehen. Aus der Gruppe der Enkephaline sind die Varianten Met-Enkephalin, Leu-Enkephalin und Met-Arg-Phe-Enkephalin, die sich durch die N-terminalen Aminosäuren unterscheiden. Die Dynorphine unterteilen sich in Dynorphin A und B sowie α- und β-Neoendorphin. ⓘ
Die endogenen Opioide (Neuropeptide) werden bei Säugetieren in Hypothalamus und Hypophyse produziert und unterscheiden sich in Verteilung und Rezeptoraffinität. ⓘ
met-Enkephalin ist im ZNS und in Immunzellen weit verbreitet; [met]-Enkephalin ist ein Produkt des Proenkephalin-Gens und wirkt über μ- und δ-Opioidrezeptoren. leu-Enkephalin, ebenfalls ein Produkt des Proenkephalin-Gens, wirkt über δ-Opioidrezeptoren. ⓘ
Dynorphin wirkt über κ-Opioidrezeptoren und ist im ZNS weit verbreitet, unter anderem im Rückenmark und im Hypothalamus, insbesondere im Nucleus arcuatus und in den Oxytocin- und Vasopressin-Neuronen im Nucleus supraopticus. ⓘ
Endomorphin wirkt über μ-Opioidrezeptoren und ist an diesen Rezeptoren stärker als andere endogene Opioide. ⓘ
Opiumalkaloide und Derivate
Opium-Alkaloide
Natürlich in (Opium) vorkommende Phenanthrene:
Zubereitungen aus gemischten Opiumalkaloiden, einschließlich Papaveretum, werden gelegentlich noch verwendet. ⓘ
Ester des Morphins
- Diacetylmorphin (Morphin-Diacetat; Heroin)
- Nicomorphin (Morphin-Dinicotinat)
- Dipropanoylmorphin (Morphin-Dipropionat)
- Diacetyldihydromorphin
- Acetylpropionylmorphin
- Desomorphin
- Methyldesorphin
- Dibenzoylmorphin ⓘ
Ether von Morphin
- Dihydrocodein
- Ethylmorphin
- Heterocodein ⓘ
Halbsynthetische Alkaloid-Derivate
- Buprenorphin
- Etorphin
- Hydrocodon
- Hydromorphon
- Oxycodon (verkauft als OxyContin)
- Oxymorphon ⓘ
Synthetische Opioide
Anilidopiperidine
Phenylpiperidine
- Pethidin (Meperidin)
- Ketobemidon
- MPPP
- Allylprodine
- Prodine
- PEPAP
- Promedol ⓘ
Diphenylpropylamin-Derivate
- Propoxyphen
- Dextropropoxyphen
- Dextromoramid
- Bezitramid
- Piritramid
- Methadon
- Dipipanon
- Levomethadylacetat (LAAM)
- Difenoxin
- Diphenoxylat
- Loperamid (überwindet zwar die Blut-Hirn-Schranke, wird aber durch P-Glykoprotein schnell in das nicht zentrale Nervensystem gepumpt. Diese Wirkung wird in Tiermodellen bei leichtem Opiatentzug nach anhaltendem und längerem Gebrauch beobachtet, darunter Rhesusaffen, Mäuse und Ratten). ⓘ
Benzomorphan-Derivate
- Dezocin-Agonist/-antagonist
- Pentazocin-Agonist/Agonist
- Phenazocin ⓘ
Oripavin-Derivate
- Buprenorphin-Teilagonist
- Dihydroetorphin
- Etorphin ⓘ
Morphinan-Derivate
- Butorphanol-Agonist/Antagonist
- Nalbuphin-Agonist/Agonist
- Levorphanol
- Levomethorphan
- Racemethorphan ⓘ
Andere
- Lefetamin
- Meptazinol
- Mitragynin
- Tilidin
- Tramadol
- Tapentadol
- Eluxadolin
- AP-237
- 7-Hydroxymitragynin ⓘ
Allosterische Modulatoren
Einfache allosterische Modulatoren gehören nicht zu den Opioiden, sondern werden als Opioidergika eingestuft. ⓘ
Opioid-Antagonisten
- Nalmefen
- Naloxon
- Naltrexon
- Methylnaltrexon (Methylnaltrexon ist nur peripher aktiv, da es die Blut-Hirn-Schranke nicht in ausreichender Menge überwindet, um zentral aktiv zu sein. Als solches kann es als Gegenstück zu Loperamid betrachtet werden).
- Naloxegol (Naloxegol ist nur peripher wirksam, da es die Blut-Hirn-Schranke nicht in ausreichender Menge überwindet, um zentral wirksam zu sein. Als solches kann es als Gegenspieler von Loperamid betrachtet werden). ⓘ
Tabellen der Opioide
Tabelle der Morphinan-Opioide
| Tabelle der Morphinan-Opioide: klicken Sie hier ⓘ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabelle der nicht-morphinischen Opioide
| Tabelle der nicht-morphinischen Opioide: Klicken Sie auf ⓘ |
|---|
Wirkungsweise
Die Gruppe der Opioide ist eine chemisch heterogene Untergruppe der Analgetika. Opioide wirken als Liganden (Bindungspartner) an der orthosterischen Bindungsstelle der nach ihnen benannten Rezeptoren. Diese Opioidrezeptoren befinden sich auf der Oberfläche von Nervenzellen und weiteren Zellen im ganzen Körper, sie kommen am häufigsten im Gehirn am Boden des vierten Ventrikels, in anderen Gehirnregionen und im Rückenmark vor. Sie sind zudem in der Peripherie, unter anderem im Darm, zu finden. ⓘ
Opioide entfalten ihre analgetische Wirkung vorrangig im Zentralnervensystem. Ein Beispiel für ein Opioid mit ausschließlich peripherer Wirkung ist Loperamid, ein Mittel gegen Durchfall, das die Blut-Hirn-Schranke normalerweise nicht überwindet. Es bewirkt eine Verlangsamung der Darmperistaltik. ⓘ
Atypische Opioide
Eine große Anzahl von Opioidagonisten wie Morphin, Fentanyl und nahezu alle gegenwärtig (2020) eingesetzten opioid-analgetischen Arzneistoffe, haben eine Bandbreite ausgeprägter, typischer Nebenwirkungen. Sie werden als Typika bezeichnet. Atypische Opioide sind Opioidanalgetika, welche ein bedeutend günstigeres Nebenwirkungsprofil als Typika haben. Der Begriff Atypika wird nicht immer ganz einheitlich verwendet, auch ist eine trennscharfe Einteilung schwierig. Beispiele für Atypika sind das Hauptalkaloid des Kratoms Mitragynin, bzw. der besonders potente Metabolit Pseudoindoxylmitragynin. Atypika können eigene „off-target“ Nebenwirkungen haben. Mitragynin etwa hemmt in hohen Dosen hERG-Kanäle. Die Ursachen der Nebenwirkungsarmut von Atypika sind nicht immer eindeutig bekannt, gleichwohl wurden in den letzten Jahrzehnten Erklärungs- und Entwicklungskonzepte erarbeitet. ⓘ
Perspektiven zur Entwicklung nebenwirkungsreduzierter Opioide
Da Opioide wichtige Therapeutika sind, aber mit problematischen Nebenwirkungen behaftet, gibt es ein Bedürfnis diese durch optimierte Wirkstoffgestaltung zu reduzieren. Entsprechende Konzepte sind in Übersichtsarbeiten gründlich begutachtet worden. ⓘ
Agonisten und Antagonisten
Partialagonisten
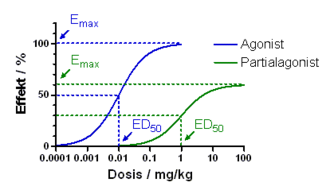
Die einzige pharmakologisch relevante Substanz ist das Buprenorphin, das an μ-Rezeptoren eine sehr hohe Affinität, eine etwa 30-mal stärkere Aktivität und längere analgetische Wirkdauer (6 bis 8 Stunden) als Morphin aufweist. Es unterliegt ebenfalls einem Ceiling-Effekt, wobei dieser aber keine therapeutische Relevanz hat, sondern nur das Risiko einer Atemdepression senkt. Buprenorphin hat die längste Wirkdauer aller Opioide. ⓘ
Weitere Vertreter
Weitere Beispiele für Opioide sind Acetorphin, Acetyl-α-methylfentanyl, Acetyldihydrocodein, Allylprodin, Etonitazen, Levomethorphan, Lofentanil, MDAN-21, PZM21 und Nicomorphin. ⓘ
Natürliche Opioide und Opiate
Opiate/Opium-Alkaloide
Als Opiate werden natürliche Substanzen, die im Opium vorkommen, bezeichnet. Das Opium, das aus Schlafmohn (Papaver somniferum) gewonnen wird, besteht zu etwa 25 % aus diesen Alkaloiden. Die wichtigsten Stoffe sind Morphin (10 %), Codein (0,5 %) und Thebain (0,2 %) aus der Gruppe der Phenantrane sowie das Isochinolinderivat Noscapin (6 %), Papaverin (0,8 bis 1 %) und Narcein (0,3 %), die Benzylisochinoline sind. ⓘ
Kratom-Alkaloide
Die Blätter des Kratombaums (Mitragyna speciosa) enthalten die opioiden Alkaloide Mitragynin und 7-Hydroxymitragynin. ⓘ
In geringerer Konzentration finden sich diese Alkaloide auch in anderen Vertretern der Gattung Mitragyna. ⓘ
Akuamma
Die Samen des afrikanischen Akuamma Baumes (Picralima nitida) enthalten das Opioid Akuammin, welches strukturähnlich zu den Kratomalkaloiden ist. ⓘ
Eckdaten gebräuchlicher Opioide
| Name | relative Potenz | minimale Wirkdauer | Klassifikation | Anmerkungen | Betäubungsmittelrechtliche Einordnung (Deutschland) |
|---|---|---|---|---|---|
| [[N-[(3R,4S)-1-[(2S)-2-Hydroxy-2-phenyl-ethyl]-3-carboethoxy-4-piperidyl]-N-phenyl-propanamid]] | 30000 | ? | Agonist | Agonist | Stärkstes bekanntes Analgetikum, nicht verschreibungsfähig (siehe Ohmefentanyl) |
| [[N-[(3R,4S)-1-[(2S)-2-Hydroxy-(2-{4-fluor-}phenyl-ethyl)]-3-methyl-4-piperidyl]-N-phenyl-propanamid]] | 18000 | ? | Agonist | Agonist | nicht verschreibungsfähig (siehe Ohmefentanyl) |
| Carfentanyl | 10000 | ? | Agonist | Agonist, zur Betäubung großer Tiere | Stärkstes veterinärmedizinisches Analgetikum, BtMG |
| Dihydroetorphin | <10000 | ? | Agonist | Agonist, findet Verwendung in China | |
| Ohmefentanyl | 6300 | ? | Agonist | Agonist | |
| Etorphin | 2000 | ? | Agonist | Agonist | |
| Sufentanil | ≈1000 | 30 min | Agonist | Stärkstes humanmedizinisches Analgetikum | verschreibungsfähiges Betäubungsmittel (BtM) |
| Remifentanil | ≈100–200 | 8–10 min | Agonist | Sehr kurze Halbwertszeit, deshalb sehr gut steuerbar. Vor allem im Rahmen der TIVA eingesetzt. | verschreibungsfähiges BtM |
| Fentanyl | 120 | 30 min | Agonist | transdermal anwendbar | verschreibungsfähiges BtM |
| Alfentanil | 30–40 | 10 min | Agonist | transdermal anwendbar | verschreibungsfähiges BtM |
| Buprenorphin | ≈30 | 6–8 h | partieller Agonist | wirkt bei alleiniger Gabe schmerzstillend, in Kombination mit Agonisten antagonistisch; Ceiling-Effekt | verschreibungsfähiges BtM |
| Hydromorphon | 7,5 | 3–5 h (unretardiert) | Agonist | sedierende Wirkung ist im Vergleich zu Morphin deutlich geringer | verschreibungsfähiges BtM |
| Levomethadon | 4 | 5–7 h | Agonist | Kumulation und starke Halbwertszeiterhöhung bei täglicher Verabreichung. | verschreibungsfähiges BtM |
| Diacetylmorphin (Heroin) / Diamorphin (DAM) | 2,5 | 3–4 h (Metabolite) | Agonist | sehr hohes Abhängigkeitspotential | ausschließlich zur Herstellung von Zubereitungen zu medizinischen Zwecken verkehrsfähiges BtM, ausschließlich zur Substitutionstherapie verschreibungsfähiges BtM |
| Methadon | 2 | 5–7 h | Agonist | siehe Levomethadon | verschreibungsfähiges BtM |
| Oxycodon | 1,5–2 | 3,5–7 h (unretardiert) | Agonist | verschreibungsfähiges BtM | |
| Hydrocodon | 1,5 | 4–8 h | Agonist | verschreibungsfähiges BtM | |
| Morphin | 1 | 2–4 h | Agonist | Referenzsubstanz der Opioide, eigentlich ein Opiat | verschreibungsfähiges BtM |
| Piritramid | 0,7 | 4–6 h | Agonist | verschreibungsfähiges BtM | |
| Nalbuphin | 0,5–0,7 | 3–6 h | gemischter Agonist-Antagonist | nicht betäubungsmittelrechtlich geregelt | |
| Tapentadol | 0,3–0,5 | 4 h (für unretardiertes Tapentadol) | Agonist am μ-Opioidrezeptor, selektiver Noradrenalin-Wiederaufnahmehemmer | verschreibungsfähiges BtM | |
| Pentazocin | 0,3 | 2–4 h | gemischter Agonist-Antagonist | verschreibungsfähiges BtM | |
| Dihydrocodein | 0,2 | 3–4 h | Agonist | verschreibungsfähiges BtM, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze | |
| Pethidin | 0,1–0,2 | 2–4 h | Agonist | verschreibungsfähiges BtM | |
| Tilidin | 0,1–0,2 | 3–4 h | Agonist | trans-Tilidin: verschreibungsfähiges Betäubungsmittel, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze und in Kombination mit Naloxon; cis-Tilidin: verkehrs-, aber nicht verschreibungsfähig. | |
| Codein | 0,1 | 4 h | Agonist | ein Opiat | verschreibungsfähiges BtM, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze |
| Meptazinol | 0,1 | 3–4 h | my2-Agonist | nicht betäubungsmittelrechtlich geregelt | |
| Tramadol | 0,1 | 4 h | Agonist | nicht betäubungsmittelrechtlich geregelt | |
| Naloxon | gegen 0 | 1–4 h | reiner Antagonist | Wirkdauer gilt nur für intravenöse Gabe | nicht betäubungsmittelrechtlich geregelt |
| Naltrexon | gegen 0 | bis 24 h | reiner Antagonist | orale Gabe | nicht betäubungsmittelrechtlich geregelt |
| Diprenorphin | gegen 0 | ? h | reiner Antagonist | stärkster Opioid-Antagonist und somit auch bei hochpotenten Opioiden wie Buprenorphin oder Etorphin wirksam | nicht betäubungsmittelrechtlich geregelt |
| Loperamid | gegen 0 | nur an peripheren Opioid-Rezeptoren wirksam, Behandlung des Durchfalls | nicht betäubungsmittelrechtlich geregelt | ||
| Apomorphin | gegen 0 | Brechmittel, an Dopamin-Rezeptoren der Area postrema | nicht betäubungsmittelrechtlich geregelt |
Wirkungen
Analgesie
Die Schmerzbekämpfung ist die gewünschte Wirkung beim Einsatz von Opioid-Analgetika. Sie wird hauptsächlich über die μ-Rezeptoren, insbesondere μ1, jedoch auch über κ vermittelt. ⓘ
Die Wirkstärke der einzelnen Substanzen wird als analgetische Potenz bezeichnet, die relativ zu Morphin angegeben wird, dessen Wert als 1 festgelegt ist. Je höher die analgetische Potenz ist, desto niedriger ist die benötigte Dosis eines Pharmakons, um eine vergleichbare Analgesie herzustellen. Pharmakodynamisch kann die Potenz mit der Effektivdosis ED50 angegeben werden.
Die maximal erreichbare Analgesie besagt, dass bei niedrigpotenten Opioiden die analgetische Wirkung im Gegensatz zu hochpotenten Substanzen nur bis zu einer bestimmten Dosissteigerung zunimmt, eine weitere Erhöhung dann jedoch keine stärkere Analgesie bewirkt, jedoch eine Zunahme der unerwünschten Wirkungen. Pharmakodynamisch ist die maximal erreichbare Analgesie ein Maß der intrinsischen Aktivität eines Wirkstoffs. Diese Werte sind auch in hohem Maß genetisch bestimmt. ⓘ
Opioid-Analgetika sind Bestandteil des WHO-Stufenschemas zur Therapie chronischer Schmerzen. Dieses sieht in der zweiten Stufe die Gabe eines niederpotenten Opioids zusätzlich zu einem nicht-Opioid-Analgetikum (erste Stufe), in der dritten Stufe die Anwendung einer hochpotenten Substanz vor. Daneben werden Opioid-Analgetika in vielen weiteren Bereichen der Medizin therapeutisch eingesetzt, so zur Narkoseeinleitung in der Anästhesie und vielen akuten schmerzassoziierten Erkrankungen und Verletzungen in der Notfall- und Intensivmedizin, die mit Nicht-Opioid-Schmerzmitteln nicht beherrscht werden können. Opioide sind oft in Sicherheitsblistern verpackt und nicht in regulären Durchdrückblistern. Dies dient der Prävention der versehentlichen Einnahme bzw. als Kindersicherung. ⓘ
Zur Langzeittherapie chronischer, nicht-tumorbedingter Schmerzen sind Opioide nur eingeschränkt wirksam und nur unter Berücksichtigung der tatsächlichen Schmerzlinderung (erfassbar mittels der visuellen Analogskala), der möglichen Nebenwirkungen auch der niedrigpotenteren Schmerzmedikamente und unter zusätzlichem Einsatz zusätzlicher schmerzlindernder Maßnahmen angezeigt (siehe auch Schmerztherapie). ⓘ
Psychotrope Effekte
Eine Sedierung (Beruhigung) wird über κ-Rezeptoren bewirkt. Sie ist teilweise erwünscht (Narkose, Analgosedierung), teilweise unerwünscht (langfristige Schmerztherapie). Auch bei hoher Dosierung von Opioid-Analgetika kommt es jedoch nicht zur sicheren Ausschaltung des Bewusstseins, so dass Opioide im Rahmen einer Allgemeinanästhesie (Narkose) mit inhalativen oder intravenösen Hypnotika im Allgemeinen kombiniert werden, um Wachheits-Phänomene (Awareness) zu vermeiden. ⓘ
Opioide haben weiterhin angstlösende und euphorisierende Effekte, die als verantwortlich für die psychische Komponente einer Opioid-Abhängigkeit angesehen werden. Daneben können über σ-Rezeptoren jedoch auch Dysphorie und Halluzinationen verursacht werden, was bei den gemischten Agonisten-Antagonisten eine Rolle spielt. ⓘ
Obstipation
Spastische Obstipationen des Darms (Verstopfung) werden durch die Stimulierung von μ-Rezeptoren des Plexus myentericus der Darmwand mit einer Konstriktion der glatten Muskulatur bewirkt. Sie sind die relevanteste Nebenwirkung bei langfristiger Schmerzbehandlung und unterliegen nur einer geringen Toleranzentwicklung. Prophylaktisch kann die Gabe von Laktulose erfolgen. ⓘ
Gewünscht ist die obstipierende Wirkung beim Einsatz des Morphin-Abkömmlings Loperamid, das als Antidiarrhoikum zur symptomatischen Therapie von schwerem Durchfall dient. ⓘ
Weitere Wirkungen
Weiter kommt es zu einer Konstriktion des Sphincter oddi, wodurch der Druck im Gallengangsystem erhöht wird, was zu kolikartigen Schmerzen führen kann. Daneben ist eine Sekretstauung des Pankreas und in der Folge eine Pankreatitis möglich. ⓘ
Durch denselben Mechanismus treten Entleerungsstörungen der Harnblase mit Harnverhalt auf. ⓘ
Durch die Dämpfung des Hustenzentrums kommt es zu einer antitussiven (hustenmildernden) Wirkung. (Selektiv ist diese auch für das nicht morphinähnliche Opiumalkaloid und Isochinolinderivat Noscapin beschrieben). Diese Wirkung wird bei dem Antitussivum Codein und Derivaten genutzt. Bei der schnellen Injektion von hochpotenten synthetischen Opioiden wie Fentanyl bei der Narkoseeinleitung kann es initial jedoch zu einem Hustenreiz kommen. ⓘ
Opioide bewirken eine zentrale Sympathikolyse (Aktivitätsminderung des sympathischen Nervensystems). Durch diese sowie eine Erhöhung der Aktivität des Nervus vagus sowie einer direkten Vasodilatation kommt es zu einem Abfall der Herzfrequenz (Bradykardie), des Blutdruckes (Hypotonie) sowie des Herzzeitvolumens. In therapeutisch üblicher Dosierung ist die Beeinträchtigung der Herz-Kreislauf-Funktion nur gering. Bei eingeschränkter Kreislaufregulation wie bei Volumenmangel (Schock), Narkose sowie unter Antihypertensiva (blutdrucksenkende Medikamente) ist jedoch ein krisenhafter Blutdruckabfall möglich. Bei der Therapie des akuten Myokardinfarktes (Herzinfarkt) und der akuten Linksherzinsuffizienz (Herzschwäche) nutzt man die kreislaufdämpfende Wirkung zur Entlastung der Herzfunktion und zur Senkung des myokardialen Sauerstoffverbrauchs. ⓘ
Eine Miosis (Verengung der Pupille) wird durch die Stimulation des parasympathischen Edinger-Westphal-Kern im Mittelhirn und die dadurch verursachte Kontraktion des Musculus sphincter pupillae ausgelöst. Beim Vorliegen einer Opioid-Vergiftung mit Sauerstoffmangel (s. u.) kann auch eine Mydriasis (Erweiterung der Pupille) auftreten. ⓘ
Bolusinjektionen hochpotenter Opioide im Rahmen der Narkose können eine Muskelrigidität (Muskelsteifigkeit) auslösen, die vor allem Thorax (Brustkorb) und Abdomen (Bauch) betrifft (wooden chest), wodurch die Maskenbeatmung bei der Narkoseeinleitung erschwert wird. Der Mechanismus ist unklar. Besonders ausgeprägt ist diese unerwünschte Wirkung bei Alfentanil und Remifentanil. Im Rahmen der modernen Kombinationsnarkose spielt dieses Phänomen aufgrund der eingesetzten Muskelrelaxanzien nur noch eine untergeordnete Rolle. ⓘ
Opioide können weiterhin Juckreiz (Pruritus) auslösen. Dies kommt durch eine Überlappung von Schmerz- und Juckreiz-assoziierten peripheren Mediatoren und Rezeptoren zustande. ⓘ
Opioide sind keine Trigger für die maligne Hyperthermie und haben keine toxische (giftige) Wirkung auf Leber und Niere. Sie setzen Histamin frei. ⓘ
Intoxikation
Eine akute Intoxikation mit Opioiden kann im Rahmen einer Überdosierung bei Abhängigkeit, meist in Unkenntnis der Opioid-Konzentration sowie in suizidaler Absicht, akzidentiell (unabsichtlich), iatrogen (als Folge einer medizinischen Behandlung) oder auch bei einem Body-Packer-Syndrom bei Drogenkurieren vorkommen. Zudem ist bei gleichzeitiger Einnahme von Benzodiazepinen das Risiko einer Opioid-assoziierten Überdosierung bis zu fünfmal so hoch wie bei alleiniger Einnahme von Opioiden. ⓘ
Die typische Symptomen-Trias der Opioid-Intoxikation besteht aus Atemdepression, nicht erweckbarem Koma und Miosis mit stecknadelkopfgroßen Pupillen. Bei tiefer Bewusstlosigkeit kann jedoch auch eine Mydriasis auftreten. Durch die insuffiziente Atmung besteht eine Hypoxie (Sauerstoffmangel) mit Zyanose, unter Umständen kann es zu einem Lungenödem kommen. Eventuell kann eine Cheyne-Stokes-Atmung beobachtet werden. Weiterhin tritt eine Kreislaufschwäche mit Bradykardie (Pulsverlangsamung) und Hypotension (Blutdruckabfall) ein. Der Muskeltonus ist herabgesetzt, die Reflexe sind abgeschwächt oder aufgehoben. Differenzialdiagnostisch kommt eine Vergiftung mit Clonidin in Betracht, deren Erscheinungsbild sehr ähnlich sein kann. ⓘ
Die Therapie einer Opioid-Vergiftung ist primär symptomatisch und besteht in der Sicherung der Vitalfunktionen. Die wichtigste Maßnahme ist das Freihalten der Atemwege bei Ateminsuffizienz, falls erforderlich durch eine endotracheale Intubation und kontrollierte Beatmung mit Sauerstoff. Die Kreislaufinsuffizienz macht eine Schockbehandlung mit Volumengabe über großlumige Venenverweilkanülen erforderlich. Auftretende Krämpfe werden mit Benzodiazepinen behandelt. ⓘ
Als spezifisches Antidot wird Naloxon eingesetzt, das als Antagonist an allen Opioid-Rezeptoren wirkt. Dieses wird in repetitiven Gaben bis zur deutlichen Besserung der klinischen Symptomatik eingesetzt (Titrationsantagonisierung). Vorsicht ist bei Abhängigen geboten, bei denen dadurch ein akutes Entzugssyndrom ausgelöst werden kann. Bei der Antagonisierung von länger wirksamen Opioiden kann es wegen der recht kurzen Halbwertszeit von Naloxon zu einem Rebound-Phänomen, der Remorphinisierung, kommen. ⓘ
Laut Weltdrogenbericht 2017 sind Opioide im Zusammenhang mit illegalem Drogenmissbrauch die schädlichsten Rauschdrogen und weltweit für 70 % aller negativen Gesundheitsfolgen verantwortlich. ⓘ
Rechtliche Aspekte
Den nationalen Gesetzen liegt das Einheitsabkommen über die Betäubungsmittel zugrunde, vormals Internationales Opiumabkommen. ⓘ
In Deutschland wird die Verkehrsfähigkeit von Betäubungsmitteln durch das Betäubungsmittelgesetz (BtMG) geregelt; in der Schweiz (Betäubungsmittelgesetz) und Österreich (Suchtmittelgesetz) gelten entsprechende Gesetze. Opioide sind je nach Sucht- bzw. Missbrauchspotential entweder in allen Konzentrationen (siehe auch Übersichtstabelle), ab einer bestimmten Konzentration (Codein, Tilidin mit Naloxon, Dextropropoxyphen) oder aber überhaupt nicht (Tramadol und Nalbuphin) beschränkt. ⓘ