Hypothalamus
| Hypothalamus ⓘ | |
|---|---|
 Lage des menschlichen Hypothalamus | |
 Lage des Hypothalamus (blau) im Verhältnis zur Hypophyse und zum übrigen Gehirn | |
| Einzelheiten | |
| Teil des | Gehirn |
| Bezeichnungen | |
| Lateinisch | Hypothalamus |
| Anatomische Begriffe der Neuroanatomie [Bearbeiten auf Wikidata] | |
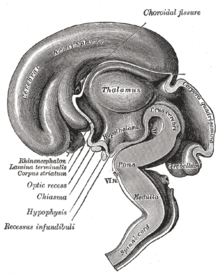
Der Hypothalamus (von altgriechisch ὑπό (hupó) "unter" und θάλαμος (thálamos) "Kammer") ist ein Teil des Gehirns, der eine Reihe kleiner Kerne mit einer Vielzahl von Funktionen enthält. Eine der wichtigsten Funktionen des Hypothalamus ist die Verbindung zwischen dem Nervensystem und dem endokrinen System über die Hirnanhangdrüse. Der Hypothalamus befindet sich unterhalb des Thalamus und ist Teil des limbischen Systems. In der Terminologie der Neuroanatomie bildet er den ventralen Teil des Zwischenhirns. Alle Wirbeltiergehirne enthalten einen Hypothalamus. Beim Menschen ist er etwa so groß wie eine Mandel. ⓘ
Der Hypothalamus ist für die Steuerung bestimmter Stoffwechselvorgänge und anderer Aktivitäten des autonomen Nervensystems verantwortlich. Er synthetisiert und sezerniert bestimmte Neurohormone, so genannte Releasing-Hormone oder hypothalamische Hormone, die wiederum die Sekretion von Hormonen aus der Hypophyse stimulieren oder hemmen. Der Hypothalamus steuert Körpertemperatur, Hunger, wichtige Aspekte des Erziehungs- und Bindungsverhaltens, Durst, Müdigkeit, Schlaf und zirkadiane Rhythmen. ⓘ

Der Hypothalamus steuert im Zusammenwirken mit der Hypophyse andere endokrine Drüsen. Er bildet besondere Steuerhormone (Releasing- und Inhibiting-Hormone), verschiedene Neuropeptide sowie Dopamin und regelt hierüber maßgeblich die vegetativen Funktionen des Körpers. ⓘ
Aufbau
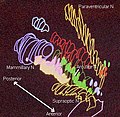
Der Hypothalamus ist in der Parasagittalebene in drei Regionen (supraoptisch, tuberal, mammillär) unterteilt, die die Lage von vorne nach hinten angeben, und in der Koronalebene in drei Bereiche (periventrikulär, medial, lateral), die die Lage von medial nach lateral angeben. Die Hypothalamuskerne befinden sich innerhalb dieser spezifischen Regionen und Bereiche. Sie sind in allen Nervensystemen der Wirbeltiere zu finden. Bei Säugetieren produzieren magnozelluläre neurosekretorische Zellen im paraventrikulären Kern und im supraoptischen Kern des Hypothalamus die neurohypophysären Hormone Oxytocin und Vasopressin. Diese Hormone werden in der Hypophysenhinterwand in das Blut abgegeben. Viel kleinere parvozelluläre neurosekretorische Zellen, die Neuronen des Nucleus paraventricularis, geben Corticotropin-Releasing-Hormon und andere Hormone in das hypophysäre Portalsystem ab, von wo aus diese Hormone in den Hypophysenvorderlappen diffundieren. ⓘ
Kerne
Zu den hypothalamischen Kernen gehören die folgenden:
| Region | Bereich | Nukleus | Funktion |
| Anterior (supraoptisch) | Präoptisch | Präoptischer Nukleus |
|
| Medial | Medialer präoptischer Nukleus |
| |
| Supraoptischer Nukleus |
| ||
| Paraventrikulärer Nukleus |
| ||
| Anteriorer Hypothalamus-Kern |
| ||
| Suprachiasmatischer Nukleus |
| ||
| Seitlich | |||
| Lateraler Nukleus | Siehe Lateraler Hypothalamus § Funktion - Hauptquelle der Orexin-Neuronen, die in das gesamte Gehirn und Rückenmark projizieren | ||
| Mittel (tuberal) | Medial | Dorsomedialer hypothalamischer Nukleus |
|
| Ventromedialer Nukleus |
| ||
| Nucleus Arcuatus |
| ||
| Seitlich | Lateraler Nukleus | Siehe Lateraler Hypothalamus § Funktion - Hauptquelle der Orexin-Neuronen, die in das gesamte Gehirn und Rückenmark projizieren | |
| Laterale tuberale Kerne | |||
| Hintere (mammilläre) | Medial | Mammillarkerne (Teil der Mammillarkörper) | |
| Hinterer Nukleus |
| ||
| Seitlich | Lateraler Nukleus | Siehe Lateraler Hypothalamus § Funktion - Hauptquelle der Orexin-Neuronen, die in das gesamte Gehirn und Rückenmark projizieren | |
| Tuberomammillärer Nukleus |
|
- Siehe auch
- ventrolateraler präoptischer Nukleus
- Periventrikulärer Nukleus ⓘ
Hypothalamuskerne auf einer Seite des Hypothalamus, dargestellt in einer 3-D-Computerrekonstruktion ⓘ
Verbindungen
Der Hypothalamus ist eng mit anderen Teilen des Zentralnervensystems verbunden, insbesondere mit dem Hirnstamm und seiner Retikularformation. Als Teil des limbischen Systems hat er Verbindungen zu anderen limbischen Strukturen wie der Amygdala und dem Septum und ist auch mit Bereichen des autonomen Nervensystems verbunden. ⓘ
Der Hypothalamus erhält zahlreiche Inputs vom Hirnstamm, vor allem vom Nucleus tractus solitatis, dem Locus coeruleus und der ventrolateralen Medulla. ⓘ
Die meisten Nervenfasern innerhalb des Hypothalamus verlaufen in zwei Richtungen (bidirektional).
- Projektionen in Gebiete kaudal des Hypothalamus erfolgen über das mediale Vorderhirnbündel, den mammillotegmentalen Trakt und den dorsalen longitudinalen Fasciculus.
- Projektionen in Gebiete rostral des Hypothalamus erfolgen über den mammillothalamischen Trakt, die Fornix und die terminale Stria.
- Projektionen in Bereiche des sympathischen Bewegungsapparats (Seitenhorn-Rückenmarkssegmente T1-L2/L3) werden durch den Tractus hypothalamospinalis geleitet und aktivieren die sympathische Bewegungsbahn. ⓘ
Sexueller Dimorphismus
Mehrere hypothalamische Kerne sind geschlechtsdimorph, d. h., es gibt deutliche Unterschiede in Struktur und Funktion zwischen Männern und Frauen. Einige Unterschiede sind sogar in der groben Neuroanatomie erkennbar: Am bemerkenswertesten ist der geschlechtsdimorphe Kern im präoptischen Areal, in dem die Unterschiede in subtilen Veränderungen der Konnektivität und der chemischen Empfindlichkeit bestimmter Neuronengruppen bestehen. Die Bedeutung dieser Veränderungen lässt sich an funktionellen Unterschieden zwischen Männchen und Weibchen erkennen. So bevorzugen beispielsweise die Männchen der meisten Arten den Geruch und das Aussehen von Weibchen gegenüber Männchen, was maßgeblich zur Stimulierung des männlichen Sexualverhaltens beiträgt. Bei einer Läsion des sexuell dimorphen Kerns nimmt diese Vorliebe der Männchen für Weibchen ab. Auch das Muster der Wachstumshormonausschüttung ist geschlechtsdimorph, weshalb sich bei vielen Arten die Größe der erwachsenen Männchen deutlich von der der Weibchen unterscheidet. ⓘ
Ansprechbarkeit auf Eierstocksteroide
Weitere auffällige funktionelle Dimorphismen betreffen die Verhaltensreaktionen auf Eierstocksteroide bei erwachsenen Tieren. Männchen und Weibchen reagieren unterschiedlich auf Eierstocksteroide, was zum Teil darauf zurückzuführen ist, dass die Expression östrogenempfindlicher Neuronen im Hypothalamus geschlechtsdimorph ist, d. h., die Östrogenrezeptoren werden in verschiedenen Neuronengruppen exprimiert. ⓘ
Östrogen und Progesteron können die Genexpression in bestimmten Neuronen beeinflussen oder Veränderungen des Zellmembranpotenzials und der Kinaseaktivierung hervorrufen, was zu verschiedenen nichtgenomischen Zellfunktionen führt. Östrogen und Progesteron binden an ihre korrespondierenden nuklearen Hormonrezeptoren, die in den Zellkern wandern und mit DNA-Regionen interagieren, die als Hormonreaktionselemente (HREs) bekannt sind, oder sich an die Bindungsstelle eines anderen Transkriptionsfaktors binden. Es hat sich gezeigt, dass der Östrogenrezeptor (ER) andere Transkriptionsfaktoren auf diese Weise transaktivieren kann, obwohl in der proximalen Promotorregion des Gens kein Östrogenreaktionselement (ERE) vorhanden ist. Im Allgemeinen sind ERs und Progesteronrezeptoren (PRs) Genaktivatoren, deren mRNA und anschließende Proteinsynthese nach Hormonexposition zunimmt. ⓘ
Männliche und weibliche Gehirne unterscheiden sich in der Verteilung der Östrogenrezeptoren, und dieser Unterschied ist eine irreversible Folge der neonatalen Steroidexposition. Östrogenrezeptoren (und Progesteronrezeptoren) finden sich vor allem in Neuronen im vorderen und mediobasalen Hypothalamus, insbesondere:
- im präoptischen Bereich (wo sich die LHRH-Neuronen befinden, die die Dopaminreaktionen und das mütterliche Verhalten regulieren)
- der periventrikuläre Nukleus, in dem sich Somatostatin-Neuronen befinden, die den Stresspegel regulieren
- der ventromediale Hypothalamus, der das Hungergefühl und die sexuelle Erregung reguliert. ⓘ
Entwicklung

Im Neugeborenenalter beeinflussen die Keimdrüsensteroide die Entwicklung des neuroendokrinen Hypothalamus. So bestimmen sie beispielsweise die Fähigkeit von Weibchen, einen normalen Fortpflanzungszyklus zu zeigen, und von Männchen und Weibchen, im Erwachsenenalter ein angemessenes Fortpflanzungsverhalten an den Tag zu legen.
- Wird einer weiblichen Ratte in den ersten Tagen ihres postnatalen Lebens (während der "kritischen Periode" des Einflusses der Sexualsteroide) einmal Testosteron injiziert, wird der Hypothalamus irreversibel vermännlicht; die erwachsene Ratte ist nicht in der Lage, als Reaktion auf Östrogen einen LH-Schub zu erzeugen (eine Eigenschaft von Weibchen), ist aber in der Lage, männliches Sexualverhalten zu zeigen (Besteigen eines sexuell empfänglichen Weibchens).
- Im Gegensatz dazu wird eine männliche Ratte, die kurz nach der Geburt kastriert wird, verweiblicht, und das erwachsene Tier zeigt weibliches Sexualverhalten als Reaktion auf Östrogen (sexuelle Empfänglichkeit, Lordoseverhalten). ⓘ
Bei Primaten ist der Einfluss von Androgenen auf die Entwicklung weniger klar, und die Folgen sind weniger gut bekannt. Im Gehirn wird Testosteron aromatisiert (zu Östradiol), das das wichtigste aktive Hormon für Entwicklungseinflüsse ist. Der menschliche Hoden sondert ab der 8. Woche des Fötus bis 5-6 Monate nach der Geburt hohe Mengen an Testosteron ab (ein ähnlicher perinataler Anstieg des Testosterons wird bei vielen Tierarten beobachtet), ein Prozess, der dem männlichen Phänotyp zugrunde zu liegen scheint. Östrogen aus dem mütterlichen Kreislauf ist relativ unwirksam, was zum Teil auf die hohen zirkulierenden Spiegel von steroidbindenden Proteinen in der Schwangerschaft zurückzuführen ist. ⓘ
Geschlechtssteroide sind nicht die einzigen wichtigen Einflüsse auf die hypothalamische Entwicklung; insbesondere präpubertärer Stress im frühen Leben (von Ratten) bestimmt die Fähigkeit des erwachsenen Hypothalamus, auf einen akuten Stressor zu reagieren. Im Gegensatz zu den gonadalen Steroidrezeptoren sind die Glukokortikoidrezeptoren im gesamten Gehirn weit verbreitet; im paraventrikulären Nukleus vermitteln sie eine negative Rückkopplungskontrolle der CRF-Synthese und -Sekretion, aber in anderen Bereichen ist ihre Rolle nicht gut verstanden. ⓘ
Funktion

Der Hypothalamus ist das wichtigste Steuerzentrum des vegetativen Nervensystems, das selbst aus verschiedensten homöostatischen Regelkreisen besteht. Der Hypothalamus ist die wichtigste Hirnregion für die Aufrechterhaltung des inneren Milieus (Synonym: Homöostase) und seiner Anpassung bei Belastungen des Organismus. Selbst geringste Störungen dieses relativ kleinen, äußerst bedeutsamen Zwischenhirnareals wirken sich auf die Lebensfähigkeit des Individuums aus. Das gesamte vegetative System hat unter anderem folgende Aufgaben:
- Aufrechterhalten der Homöostase (Temperatur, Blutdruck, Osmolarität)
- Regulation der Nahrungs- und Wasseraufnahme
- Circadiane Rhythmik und Schlaf
- Steuerung des Sexual- und Fortpflanzungsverhaltens (Sexualzentrum) ⓘ
Um seinen Aufgaben nachzukommen, hat der Hypothalamus zahlreiche neuronale Verbindungen zu anderen Hirnzentren. Außerdem steuert er über Liberine (releasing factors bzw. releasing hormones) und Statine (release inhibiting factors bzw. release inhibiting hormones) die Hormonabgabe der Adenohypophyse (Hypophysenvorderlappen) bzw. produziert selbst die Hormone, die in der Neurohypophyse (Hypophysenhinterlappen), die ebenfalls zum Hypothalamus gezählt wird, ins Blut abgegeben werden. ⓘ
Hormonausschüttung

Der Hypothalamus hat eine zentrale neuroendokrine Funktion, vor allem durch seine Kontrolle der vorderen Hypophyse, die wiederum verschiedene endokrine Drüsen und Organe reguliert. Releasing-Hormone (auch Releasing-Faktoren genannt) werden in hypothalamischen Kernen produziert und dann entlang von Axonen entweder zum Hypophysenvorderlappen oder zum Hypophysenhinterlappen transportiert, wo sie gespeichert und je nach Bedarf freigesetzt werden. ⓘ
- Hypophysenvorderlappen
In der Hypothalamus-Adenohypophysen-Achse werden die Releasing-Hormone, die auch als hypophysiotrope oder hypothalamische Hormone bezeichnet werden, von der Eminenz mediana, einer Verlängerung des Hypothalamus, in das hypophysäre Portalsystem freigesetzt, das sie zum Hypophysenvorderlappen transportiert, wo sie ihre regulierenden Funktionen auf die Sekretion der adenohypophysären Hormone ausüben. Diese hypophysiotropen Hormone werden durch parvozelluläre neurosekretorische Zellen stimuliert, die sich im periventrikulären Bereich des Hypothalamus befinden. Nach ihrer Freisetzung in die Kapillaren des dritten Ventrikels wandern die hypophysiotropen Hormone durch den so genannten hypothalamo-hypophysären Portalkreislauf. Sobald sie ihr Ziel im Hypophysenvorderlappen erreicht haben, binden sich diese Hormone an spezifische Rezeptoren, die sich auf der Oberfläche der Hypophysenzellen befinden. Je nachdem, welche Zellen durch diese Bindung aktiviert werden, beginnt die Hypophyse mit der Sekretion von Hormonen in den übrigen Blutkreislauf oder stellt diese ein. ⓘ
| Sekretiertes Hormon | Abkürzung | Produziert von | Wirkung ⓘ |
|---|---|---|---|
| Thyreotropin-freisetzendes Hormon (Prolaktin-freisetzendes Hormon) |
TRH, TRF, oder PRH | Parvozelluläre neurosekretorische Zellen des paraventrikulären Kerns | Stimulieren die Freisetzung von schilddrüsenstimulierendem Hormon (TSH) aus dem Hypophysenvorderlappen (hauptsächlich) Stimulieren die Freisetzung von Prolaktin aus dem Hypophysenvorderlappen |
| Corticotropin-freisetzendes Hormon | CRH oder CRF | Parvozelluläre neurosekretorische Zellen des paraventrikulären Kerns | Stimuliert die Freisetzung von adrenocorticotropem Hormon (ACTH) aus dem Hypophysenvorderlappen |
| Dopamin (Prolaktin-hemmendes Hormon) |
DA oder PIH | Dopamin-Neuronen des Nucleus arcuatus | Hemmung der Prolaktinfreisetzung aus dem Hypophysenvorderlappen |
| Wachstumshormon-freisetzendes Hormon | GHRH | Neuroendokrine Neuronen des Nucleus Arcuatus | Stimulieren die Freisetzung von Wachstumshormon (GH) aus dem Hypophysenvorderlappen |
| Gonadotropin-freisetzendes Hormon | GnRH oder LHRH | Neuroendokrine Zellen des präoptischen Bereichs | Stimulieren die Freisetzung von follikelstimulierendem Hormon (FSH) aus dem Hypophysenvorderlappen Stimulieren die Freisetzung des luteinisierenden Hormons (LH) aus dem Hypophysenvorderlappen |
| Somatostatin (Wachstumshormon-hemmendes Hormon) |
SS, GHIH, oder SRIF | Neuroendokrine Zellen des Nucleus periventricularis | Hemmung der Freisetzung von Wachstumshormon (GH) aus dem Hypophysenvorderlappen Hemmen (mäßig) die Freisetzung von schilddrüsenstimulierendem Hormon (TSH) aus dem Hypophysenvorderlappen |
Weitere Hormone, die von der Medianeminenz ausgeschüttet werden, sind Vasopressin, Oxytocin und Neurotensin. ⓘ
- Hypophysenhinterlappen
Im Rahmen der Hypothalamus-Hypophysen-Nebennierenrinden-Achse werden neurohypophysäre Hormone aus der Hypophysenhinterwand, die eigentlich eine Verlängerung des Hypothalamus ist, in den Blutkreislauf abgegeben. ⓘ
| Sekretiertes Hormon | Abkürzung | Produziert von | Wirkung ⓘ |
|---|---|---|---|
| Oxytocin | OXY oder OXT | Magnozelluläre neurosekretorische Zellen des Nucleus paraventricularis und des Nucleus supraopticus | Kontraktion der Gebärmutter Laktation (Entleerungsreflex) |
| Vasopressin (antidiuretisches Hormon) |
ADH oder AVP | Magnozelluläre und parvozelluläre neurosekretorische Zellen des Nucleus paraventricularis, magnozelluläre Zellen im Nucleus supraopticus | Erhöht die Wasserdurchlässigkeit der Zellen des distalen Tubulus und des Sammelkanals in der Niere und ermöglicht so die Wasserrückresorption und die Ausscheidung von konzentriertem Urin |
Es ist auch bekannt, dass die Hormone der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) mit bestimmten Hautkrankheiten und der Homöostase der Haut in Zusammenhang stehen. Es gibt Hinweise darauf, dass eine Hyperaktivität der HPA-Hormone mit stressbedingten Hautkrankheiten und Hauttumoren zusammenhängt. ⓘ
Stimulation
Der Hypothalamus koordiniert zahlreiche hormonelle und verhaltensbezogene zirkadiane Rhythmen, komplexe Muster von neuroendokrinen Ausgängen, komplexe homöostatische Mechanismen und wichtige Verhaltensweisen. Der Hypothalamus muss daher auf viele verschiedene Signale reagieren, von denen einige extern und einige intern erzeugt werden. Delta-Wellen-Signale, die entweder im Thalamus oder in der Hirnrinde entstehen, beeinflussen die Sekretion von Releasing-Hormonen; GHRH und Prolaktin werden stimuliert, während TRH gehemmt wird. ⓘ
Der Hypothalamus reagiert auf:
- Licht: Tageslänge und Photoperiode zur Regulierung der zirkadianen und saisonalen Rhythmen
- olfaktorische Reize, einschließlich Pheromone
- Steroide, einschließlich gonadaler Steroide und Kortikosteroide
- Neural übertragene Informationen, die insbesondere vom Herzen, dem enterischen Nervensystem (des Magen-Darm-Trakts) und dem Fortpflanzungstrakt ausgehen.
- Autonome Eingänge
- Stimuli aus dem Blut, einschließlich Leptin, Ghrelin, Angiotensin, Insulin, Hypophysenhormone, Zytokine, Plasmakonzentrationen von Glukose und Osmolarität usw.
- Stress
- Eindringen von Mikroorganismen durch Erhöhung der Körpertemperatur, wodurch der Thermostat des Körpers nach oben korrigiert wird. ⓘ
Olfaktorische Reize
Geruchsreize sind bei vielen Arten wichtig für die sexuelle Fortpflanzung und die neuroendokrine Funktion. Wenn zum Beispiel eine trächtige Maus während einer kritischen Phase nach dem Koitus dem Urin eines "fremden" Männchens ausgesetzt wird, schlägt die Schwangerschaft fehl (Bruce-Effekt). So bildet ein Mäuseweibchen während des Koitus ein präzises "Geruchsgedächtnis" für ihren Partner, das mehrere Tage lang bestehen bleibt. Pheromonale Hinweise helfen bei vielen Tierarten bei der Synchronisierung der Brunst; bei Frauen kann die synchronisierte Menstruation auch auf pheromonale Hinweise zurückzuführen sein, obwohl die Rolle der Pheromone beim Menschen umstritten ist. ⓘ
Stimuli aus dem Blut
Peptidhormone üben einen wichtigen Einfluss auf den Hypothalamus aus, und dazu müssen sie die Blut-Hirn-Schranke passieren. Der Hypothalamus wird zum Teil von spezialisierten Hirnregionen begrenzt, die keine wirksame Blut-Hirn-Schranke haben; das Kapillarendothel an diesen Stellen ist gefenstert, so dass selbst große Proteine und andere Moleküle ungehindert passieren können. Einige dieser Stellen sind die Orte der Neurosekretion - die Neurohypophyse und die Eminenz mediana. Andere wiederum sind Stellen, an denen das Gehirn die Zusammensetzung des Blutes prüft. Zwei dieser Stellen, das SFO (subfornical organ) und das OVLT (organum vasculosum of the lamina terminalis), sind so genannte zirkumventrikuläre Organe, in denen die Neuronen in engem Kontakt mit Blut und Liquor stehen. Diese Strukturen sind dicht vaskularisiert und enthalten osmorezeptive und natriumrezeptive Neuronen, die das Trinken, die Vasopressinfreisetzung, die Natriumausscheidung und den Natriumappetit steuern. Sie enthalten auch Neuronen mit Rezeptoren für Angiotensin, atrialen natriuretischen Faktor, Endothelin und Relaxin, die alle für die Regulierung des Flüssigkeits- und Elektrolythaushalts wichtig sind. Die Neuronen des OVLT und des SFO projizieren in den Nucleus supraopticus und den Nucleus paraventricularis sowie in präoptische hypothalamische Bereiche. Die zirkumventrikulären Organe sind möglicherweise auch der Wirkungsort von Interleukinen, die über Wirkungen auf paraventrikuläre Neuronen sowohl Fieber als auch ACTH-Sekretion auslösen. ⓘ
Es ist nicht klar, wie alle Peptide, die die hypothalamische Aktivität beeinflussen, den notwendigen Zugang erhalten. Im Falle von Prolaktin und Leptin gibt es Hinweise auf eine aktive Aufnahme am Plexus choroideus aus dem Blut in die Zerebrospinalflüssigkeit (CSF). Einige Hypophysenhormone haben einen negativen Rückkopplungseffekt auf die hypothalamische Sekretion; so wirkt beispielsweise das Wachstumshormon auf den Hypothalamus zurück, aber es ist nicht klar, wie es ins Gehirn gelangt. Es gibt auch Hinweise auf eine zentrale Wirkung von Prolaktin. ⓘ
Es gibt Hinweise darauf, dass das Schilddrüsenhormon (T4) von den Gliazellen des Hypothalamus im Nucleus infundibularis/Medianus aufgenommen und dort von der Typ-2-Deo-Dinase (D2) in T3 umgewandelt wird. Anschließend wird T3 in die Thyreotropin-Releasing-Hormon (TRH)-produzierenden Neuronen im Nucleus paraventricularis transportiert. In diesen Neuronen wurden Schilddrüsenhormonrezeptoren gefunden, was darauf hindeutet, dass sie tatsächlich empfindlich auf T3-Stimuli reagieren. Außerdem exprimierten diese Neuronen MCT8, einen Schilddrüsenhormon-Transporter, was die Theorie unterstützt, dass T3 in diese Neuronen transportiert wird. T3 könnte dann an den Schilddrüsenhormonrezeptor in diesen Neuronen binden und die Produktion des Thyreotropin-freisetzenden Hormons beeinflussen, wodurch die Schilddrüsenhormonproduktion reguliert wird. ⓘ
Der Hypothalamus fungiert als eine Art Thermostat für den Körper. Er stellt eine gewünschte Körpertemperatur ein und stimuliert entweder die Wärmeproduktion und -speicherung, um die Bluttemperatur auf einen höheren Wert zu erhöhen, oder das Schwitzen und die Gefäßerweiterung, um das Blut auf eine niedrigere Temperatur abzukühlen. Alle Fieberzustände resultieren aus einer erhöhten Einstellung des Hypothalamus; erhöhte Körpertemperaturen aufgrund anderer Ursachen werden als Hyperthermie eingestuft. In seltenen Fällen kann eine direkte Schädigung des Hypothalamus, z. B. durch einen Schlaganfall, Fieber verursachen; dies wird manchmal als hypothalamisches Fieber bezeichnet. Häufiger ist jedoch, dass eine solche Schädigung zu abnorm niedrigen Körpertemperaturen führt. ⓘ
Steroide
Der Hypothalamus enthält Neuronen, die stark auf Steroide und Glukokortikoide (die Steroidhormone der Nebenniere, die als Reaktion auf ACTH freigesetzt werden) reagieren. Er enthält auch spezialisierte glukoseempfindliche Neuronen (im Nucleus arcuatus und im ventromedialen Hypothalamus), die für den Appetit wichtig sind. Der präoptische Bereich enthält thermosensitive Neuronen, die für die TRH-Sekretion wichtig sind. ⓘ
Neural
Die Oxytocin-Sekretion als Reaktion auf das Stillen oder die vaginozervikale Stimulation wird durch einige dieser Bahnen vermittelt; die Vasopressin-Sekretion als Reaktion auf kardiovaskuläre Reize, die von Chemorezeptoren im Karotiskörper und im Aortenbogen sowie von Niederdruckrezeptoren des Vorhofvolumens ausgehen, wird durch andere vermittelt. Bei der Ratte bewirkt die Stimulation der Vagina auch eine Prolaktinausschüttung, die zu einer Pseudoschwangerschaft nach einer unfruchtbaren Paarung führt. Beim Kaninchen löst der Koitus reflexartig einen Eisprung aus. Beim Schaf kann die Stimulation des Gebärmutterhalses in Anwesenheit hoher Östrogenspiegel bei einem jungfräulichen Mutterschaf mütterliches Verhalten hervorrufen. Alle diese Wirkungen werden vom Hypothalamus vermittelt, und die Informationen werden hauptsächlich über spinale Bahnen im Hirnstamm weitergeleitet. Die Stimulation der Brustwarzen stimuliert die Freisetzung von Oxytocin und Prolaktin und unterdrückt die Freisetzung von LH und FSH. ⓘ
Kardiovaskuläre Reize werden durch den Vagusnerv weitergeleitet. Der Vagus überträgt auch eine Vielzahl viszeraler Informationen, darunter beispielsweise Signale, die aus der Magenüberblähung oder -entleerung resultieren, um die Nahrungsaufnahme zu unterdrücken oder zu fördern, indem er die Freisetzung von Leptin bzw. Gastrin signalisiert. Auch diese Informationen erreichen den Hypothalamus über Relais im Hirnstamm. ⓘ
Darüber hinaus reagiert die Funktion des Hypothalamus auf die Werte aller drei klassischen Monoamin-Neurotransmitter, Noradrenalin, Dopamin und Serotonin (5-Hydroxytryptamin), in den Nervenbahnen, von denen er versorgt wird, und wird durch diese Werte reguliert. So haben beispielsweise noradrenerge Eingänge, die vom Locus coeruleus ausgehen, wichtige regulierende Auswirkungen auf den Spiegel des Corticotropin-Releasing-Hormons (CRH). ⓘ
Kontrolle der Nahrungsaufnahme
| Peptide, die das Fressverhalten |
Peptide, die die Nahrungsaufnahme verringern Fressverhalten ⓘ |
|---|---|
| Ghrelin | Leptin |
| Neuropeptid Y | (α,β,γ)-Melanozyten-stimulierende Hormone |
| Agouti-verwandtes Peptid | Kokain- und Amphetamin-regulierte Transkriptpeptide |
| Orexine (A,B) | Corticotropin-freisetzendes Hormon |
| Melanin-konzentrierendes Hormon | Cholezystokinin |
| Galanin | Insulin |
| Glucagon-ähnliches Peptid 1 |
Der äußerste seitliche Teil des Nucleus ventromedialis des Hypothalamus ist für die Kontrolle der Nahrungsaufnahme zuständig. Eine Stimulation dieses Bereichs führt zu einer erhöhten Nahrungsaufnahme. Eine bilaterale Läsion dieses Bereichs führt zu einer vollständigen Einstellung der Nahrungsaufnahme. Mediale Teile des Nucleus haben eine kontrollierende Wirkung auf den lateralen Teil. Eine bilaterale Läsion des medialen Teils des Nucleus ventromedialis führt zu Hyperphagie und Fettleibigkeit bei den Tieren. Eine weitere Läsion des lateralen Teils des Nucleus ventromedialis bei demselben Tier führt zu einer vollständigen Einstellung der Nahrungsaufnahme. ⓘ
Es gibt verschiedene Hypothesen in Bezug auf diese Regulierung:
- Lipostatische Hypothese: Diese Hypothese besagt, dass das Fettgewebe ein humorales Signal erzeugt, das proportional zur Fettmenge ist und auf den Hypothalamus wirkt, um die Nahrungsaufnahme zu verringern und die Energieabgabe zu erhöhen. Es hat sich gezeigt, dass das Hormon Leptin auf den Hypothalamus wirkt, um die Nahrungsaufnahme zu verringern und die Energieabgabe zu erhöhen.
- Gutpeptid-Hypothese: Magen-Darm-Hormone wie Grp, Glucagon, CCK und andere hemmen angeblich die Nahrungsaufnahme. Die Nahrung, die in den Magen-Darm-Trakt gelangt, löst die Freisetzung dieser Hormone aus, die auf das Gehirn einwirken, um Sättigung zu erzeugen. Im Gehirn gibt es sowohl CCK-A- als auch CCK-B-Rezeptoren.
- Glukostatische Hypothese: Die Aktivität des Sättigungszentrums in den ventromedialen Kernen wird wahrscheinlich durch die Glukoseverwertung in den Neuronen bestimmt. Es wurde postuliert, dass die Aktivität der Neuronen abnimmt, wenn ihre Glukoseverwertung niedrig ist und folglich die arteriovenöse Blutglukosedifferenz in den Neuronen niedrig ist. Unter diesen Bedingungen ist die Aktivität des Fütterungszentrums unkontrolliert und die Person fühlt sich hungrig. Die Nahrungsaufnahme wird durch die intraventrikuläre Verabreichung von 2-Desoxyglukose rasch gesteigert, wodurch die Glukoseverwertung in den Zellen verringert wird.
- Thermostatische Hypothese: Nach dieser Hypothese regt ein Absinken der Körpertemperatur unter einen bestimmten Sollwert den Appetit an, während ein Anstieg über diesen Sollwert den Appetit hemmt. ⓘ
Verarbeitung von Ängsten
Die mediale Zone des Hypothalamus ist Teil eines Schaltkreises, der motivierte Verhaltensweisen, wie z. B. Verteidigungsverhalten, kontrolliert. Analysen der Fos-Markierung haben gezeigt, dass eine Reihe von Kernen in der "Säule der Verhaltenskontrolle" bei der Regulierung der Ausprägung von angeborenem und konditioniertem Abwehrverhalten eine wichtige Rolle spielt. ⓘ
- Antiprädiktatorisches Verteidigungsverhalten ⓘ
Die Begegnung mit einem Raubtier (z. B. einer Katze) löst bei Labornagern ein Abwehrverhalten aus, selbst wenn das Tier noch nie mit einer Katze in Kontakt gekommen ist. Im Hypothalamus führt diese Exposition zu einem Anstieg der mit Fos markierten Zellen im vorderen Hypothalamuskern, im dorsomedialen Teil des ventromedialen Kerns und im ventrolateralen Teil des prämammillären Kerns (PMDvl). Der prämammilläre Kern spielt eine wichtige Rolle bei der Ausprägung des Abwehrverhaltens gegenüber einem Raubtier, da Läsionen in diesem Kern Abwehrverhalten wie Frieren und Flucht aufheben. Der PMD moduliert das Verteidigungsverhalten in anderen Situationen nicht, da Läsionen dieses Kerns nur minimale Auswirkungen auf die Werte für das Einfrieren nach einem Schock haben. Der PMD hat wichtige Verbindungen zum dorsalen periaqueduktalen Grau, einer wichtigen Struktur für den Ausdruck von Angst. Darüber hinaus zeigen die Tiere ein Verhalten zur Risikobewertung der Umgebung, das zuvor mit der Katze in Verbindung gebracht wurde. Die Analyse von Fos-markierten Zellen zeigte, dass der PMDvl die am stärksten aktivierte Struktur im Hypothalamus ist, und die Inaktivierung mit Muscimol vor der Exposition gegenüber der Umgebung hebt das Abwehrverhalten auf. Daher spielt der Hypothalamus, insbesondere der PMDvl, eine wichtige Rolle bei der Ausprägung des angeborenen und konditionierten Abwehrverhaltens gegenüber einem Raubtier. ⓘ
- Soziale Niederlage ⓘ
Ebenso spielt der Hypothalamus eine Rolle bei der sozialen Niederlage: Die Kerne in der medialen Zone werden bei einer Begegnung mit einem aggressiven Artgenossen ebenfalls mobilisiert. Das besiegte Tier weist einen Anstieg der Fos-Werte in geschlechtsdimorphen Strukturen wie dem medialen präoptischen Kern, dem ventrolateralen Teil des ventromedialen Kerns und dem ventralen prämammilären Kern auf. Diese Strukturen sind für andere soziale Verhaltensweisen, wie Sexual- und Aggressionsverhalten, von Bedeutung. Darüber hinaus ist auch der Nucleus premammillaris mobilisiert, und zwar der dorsomediale Teil, nicht aber der ventrolaterale Teil. Läsionen in diesem Kern heben passives Verteidigungsverhalten wie das Einfrieren und die "Rückenlage" auf. ⓘ
Regulation der Körpertemperatur
An der Steuerung der Körpertemperatur ist der Nucleus preopticus beteiligt. Er liegt am rostralen Ende des Hypothalamus in direkter Nachbarschaft der Septumregion und des Organum vasculosum laminae terminalis. Efferent projiziert der Nucleus preopticus GABAerg in das Periaquäduktale Grau (PAG) und den Nucleus raphes magnus, von wo aus die Thermogenese gesteuert wird. Ebenfalls beeinflusst der Nucleus preopticus die Freisetzung von Thyreoliberin (TRH) aus dem Nucleus paraventricularis. TRH wiederum stimuliert die Thyreotropin-Ausschüttung (TSH), was zu einer Steigerung der Stoffwechselaktivität über die Schilddrüsenhormone führt. ⓘ
Homöostase der Osmolarität
Der Nucleus paraventricularis vor allem aber der Nucleus supraopticus produzieren das Nonapeptid Vasopressin (Synonym: Antidiuretisches Hormon, ADH oder Adiuretin). Über den axonalen Transport gelangt dieses in den Hypophysenhinterlappen (Synonym: Neurohypophyse) und wird dort in den Hypophysen-Portalkreislauf abgegeben. ADH führt zu einer verstärkten Resorption von Wasser aus dem Primärharn. Somit kommt es zu einer verminderten Wasserausscheidung über die Niere, was einer Hyperosmolarität entgegenwirkt und den Blutdruck steigert. ⓘ
Schlaf und circadiane Rhythmik
Auch an der Regulation des Schlafs und der circadianen Rhythmik ist der Hypothalamus beteiligt: Der Nucleus tuberomammillaris produziert den Neurotransmitter Histamin und ein Peptid namens Orexin. Orexin wirkt über bestimmte Rezeptoren auf den lateralen Hypothalamus und führt zu gesteigerter Aufmerksamkeit. Mutationen dieses Rezeptors werden für das Krankheitsbild der Narkolepsie verantwortlich gemacht. Außerdem wird Orexin als wake-up-drug z. B. für Kampfjet-Piloten gebraucht. Bemerkenswert ist in diesem Zusammenhang, dass Schlaflosigkeit zu vermehrter Nahrungsaufnahme und gleichzeitiger Gewichtsabnahme führt, und Orexin appetitanregend wirkt. Auch der Nucleus preopticus venterolateralis (VLPO) des Hypothalamus ist an der Schlafeinleitung beteiligt. Läsionen in diesem Kern führen zur Insomnie. ⓘ
Der Nucleus suprachiasmaticus (SCN) enthält direkte Afferenzen aus der Retina. Hier vermuten Forscher den Sitz der „inneren Uhr“, Neurone, die für die circadiane Rhythmik verantwortlich sind. Der SCN kontrolliert sehr stark die Aktivität des Sympathikus. Über dieses vegetative System stimuliert der SCN die Freisetzung von Melatonin aus der Zirbeldrüse. Melatonin wird in den Abendstunden vermehrt ausgeschüttet und trägt zur Schlafeinleitung bei. Die höchste Konzentration findet sich im Blut um drei Uhr morgens. Die anatomische Verbindung vom SCN zur Zirbeldrüse führt über den Nucleus paraventricularis zum Seitenhorn des Thorakalmarks. Von dort aus erreichen sympathische Nervenfasern über eine Verschaltung im Ganglion cervicale superior begleitend mit den arteriellen Gefäßen die Zirbeldrüse. Diese schüttet circadian mit einem Maximum um drei Uhr morgens Melatonin aus. ⓘ
Beeinflussung des Sexualverhaltens und der Pubertät
An der Beeinflussung des Sexualverhaltens ist u. a. das Corpus mamillare beteiligt. Es ist Teil des Papez-Kreis und wird dem Limbischen System zugerechnet. Der Nucleus preopticus medialis ist an der Varietät des sexuellen Verhaltens beteiligt. ⓘ
Ferner geben magnozelluläre neurosekretorische Zellen des Nucleus paraventricularis über Projektionen in die Neurohypophyse (Synonym: Hypophysenhinterlappen) das Hormon Oxytocin in den Blutkreislauf ab. Oxytocin ist während der Geburt an der Kontraktion der Gebärmuttermuskulatur beteiligt, löst die Milchausschüttung aus den Milchdrüsen aus und beeinflusst Partner- und Mutter-Kind-Bindung positiv. ⓘ
Der Hypothalamus ist auch beteiligt an der Einleitung der Pubertät und den damit verbundenen Veränderungen sowie der Auslösung von Eisprüngen (Ovulationen). ⓘ
Zusätzliche Bilder
Lage des Hypothalamus ⓘ