Osteoporose
| Osteoporose ⓘ | |
|---|---|
 | |
| Ältere Frau mit Osteoporose, die aufgrund von Kompressionsfrakturen ihrer Rückenknochen einen gekrümmten Rücken aufweist. | |
| Aussprache |
|
| Fachgebiet | Rheumatologie, Endokrinologie, Orthopädie |
| Symptome | Erhöhtes Risiko eines Knochenbruchs |
| Komplikationen | Chronische Schmerzen |
| Gewöhnlicher Beginn | Älteres Alter |
| Risikofaktoren | Alkoholismus, Anorexie, europäische oder asiatische Ethnizität, Schilddrüsenüberfunktion, Magen-Darm-Erkrankungen, chirurgische Entfernung der Eierstöcke, Nierenerkrankungen, Rauchen, bestimmte Medikamente |
| Diagnostische Methode | Knochendichtemessung |
| Behandlung | Gute Ernährung, Bewegung, Sturzprävention, Raucherentwöhnung |
| Medikamentöse Behandlung | Bisphosphonate |
| Häufigkeit | 15% (über 50-Jährige), 70% (über 80-Jährige) |
Osteoporose ist eine systemische Skeletterkrankung, die durch eine geringe Knochenmasse, eine mikrostrukturelle Verschlechterung des Knochengewebes, die zu Knochenbrüchigkeit führt, und ein erhöhtes Frakturrisiko gekennzeichnet ist. Sie ist der häufigste Grund für einen Knochenbruch bei älteren Menschen. Zu den Knochen, die häufig brechen, gehören die Wirbel der Wirbelsäule, die Knochen des Unterarms und der Hüfte. Bis ein Knochenbruch auftritt, treten in der Regel keine Symptome auf. Die Knochen können so geschwächt sein, dass ein Bruch schon bei geringer Belastung oder spontan auftreten kann. Nach der Heilung des gebrochenen Knochens kann der Betroffene chronische Schmerzen haben und in seiner Fähigkeit eingeschränkt sein, normale Tätigkeiten auszuüben. ⓘ
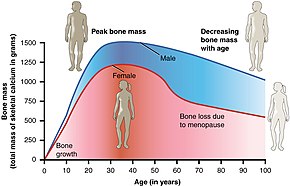
Osteoporose kann durch eine unter dem Normalwert liegende maximale Knochenmasse und einen unter dem Normalwert liegenden Knochenverlust bedingt sein. Der Knochenschwund nimmt nach der Menopause aufgrund des niedrigeren Östrogenspiegels und nach der Andropause aufgrund des niedrigeren Testosteronspiegels zu. Osteoporose kann auch durch eine Reihe von Krankheiten oder Behandlungen ausgelöst werden, z. B. durch Alkoholismus, Anorexie, Schilddrüsenüberfunktion, Nierenerkrankungen und die operative Entfernung der Eierstöcke. Bestimmte Medikamente erhöhen die Rate des Knochenschwunds, darunter einige Medikamente gegen Anfallsleiden, Chemotherapie, Protonenpumpenhemmer, selektive Serotonin-Wiederaufnahmehemmer und Glukokortikosteroide. Rauchen und zu wenig Bewegung sind ebenfalls Risikofaktoren. Osteoporose ist definiert als eine Knochendichte, die 2,5 Standardabweichungen unter der eines jungen Erwachsenen liegt. Diese wird in der Regel mit der Dual-Energy-Röntgenabsorptiometrie (DXA oder DEXA) gemessen. ⓘ
Zur Vorbeugung von Osteoporose gehören eine richtige Ernährung in der Kindheit und die Vermeidung von Medikamenten, die den Knochenabbau beschleunigen. Zu den Maßnahmen zur Vorbeugung von Knochenbrüchen bei Osteoporose gehören eine gesunde Ernährung, Bewegung und die Vermeidung von Stürzen. Änderungen des Lebensstils wie das Aufgeben des Rauchens und der Verzicht auf Alkohol können hilfreich sein. Bisphosphonat-Medikamente sind nützlich, um zukünftige Knochenbrüche bei Personen mit früheren Knochenbrüchen aufgrund von Osteoporose zu verringern. Bei Menschen mit Osteoporose, aber ohne frühere Knochenbrüche, sind sie weniger wirksam. Sie scheinen das Sterberisiko nicht zu beeinflussen. ⓘ
Osteoporose tritt mit zunehmendem Alter häufiger auf. Etwa 15 % der kaukasischen Bevölkerung im Alter von 50 Jahren und 70 % der über 80-Jährigen sind davon betroffen. Sie tritt bei Frauen häufiger auf als bei Männern. In den Industrieländern sind je nach Diagnosemethode 2 bis 8 % der Männer und 9 bis 38 % der Frauen betroffen. Die Erkrankungsraten in den Entwicklungsländern sind unklar. In der Europäischen Union waren im Jahr 2010 etwa 22 Millionen Frauen und 5,5 Millionen Männer an Osteoporose erkrankt. In den Vereinigten Staaten waren im Jahr 2010 etwa 8 Millionen Frauen und zwischen 1 und 2 Millionen Männer an Osteoporose erkrankt. Weiße und asiatische Menschen haben ein höheres Risiko. Das Wort "Osteoporose" stammt aus dem Griechischen und bedeutet "poröse Knochen". ⓘ

| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| M80.- | Osteoporose mit pathologischer Fraktur |
| M81.- | Osteoporose ohne pathologische Fraktur |
| M82.- | Osteoporose bei anderenorts klassifizierten Krankheiten |
| ICD-10 online (WHO-Version 2019) | |
Die Osteoporose (von altgriechisch ὀστέον ostéon, deutsch ‚Knochen‘ und πόρος poros ‚Furt, Pore‘) ist eine Störung im Knochenstoffwechsel und eine häufige Alterserkrankung des Knochens, die ihn dünner und poröser und somit anfällig für Brüche (Frakturen) macht. ⓘ
Die auch als Knochenschwund bezeichnete Krankheit ist gekennzeichnet durch eine Abnahme der Knochendichte infolge eines den Aufbau übersteigenden Abbaus von Knochengewebe im Rahmen des natürlichen Knochenumbaus. Aufgrund der höheren Umsatzrate ist die Spongiosa typischerweise stärker betroffen als die Kortikalis, was sich in den Prädilektionsstellen für Knochenbrüche niederschlägt; die erhöhte Frakturanfälligkeit kann allerdings das ganze Skelett betreffen. ⓘ
Die Osteoporose, welche erstmals 1885 von dem Innsbrucker Pathologen Gustav Adolf Pommer (1851–1935) beschrieben wurde, ist die häufigste Knochenerkrankung im höheren Lebensalter. Am häufigsten (95 Prozent) ist die primäre Osteoporose; diese tritt, im Gegensatz zur sekundären Osteoporose, nicht als Folge einer anderen Erkrankung auf. 80 Prozent aller Osteoporosen betreffen Frauen nach der Menopause (siehe Postmenopause), wobei vor allem kleinknochige Nordeuropäerinnen und Raucherinnen betroffen sind. 30 % aller Frauen entwickeln nach der Menopause eine klinisch relevante Osteoporose. Sekundäre Osteoporosen sind seltener (5 %), wobei Erkrankungen, die eine Behandlung mit Glukokortikoiden während einer längeren Zeitspanne erfordern und/oder zu einer Immobilisation führen, im Vordergrund stehen. ⓘ
Anzeichen und Symptome

Die Osteoporose selbst hat keine Symptome; ihre wichtigste Folge ist das erhöhte Risiko von Knochenbrüchen. Osteoporotische Frakturen treten in Situationen auf, in denen sich gesunde Menschen normalerweise keinen Knochen brechen würden; sie werden daher als Fragilitätsfrakturen bezeichnet. Typische Fragilitätsfrakturen treten an der Wirbelsäule, den Rippen, der Hüfte und dem Handgelenk auf. ⓘ
Frakturen
Frakturen sind ein häufiges Symptom der Osteoporose und können zu Behinderungen führen. Akute und chronische Schmerzen bei älteren Menschen werden häufig auf osteoporosebedingte Frakturen zurückgeführt und können zu weiteren Behinderungen und früher Sterblichkeit führen. Diese Frakturen können auch asymptomatisch sein. Die häufigsten osteoporotischen Frakturen betreffen das Handgelenk, die Wirbelsäule, die Schulter und die Hüfte. Die Symptome eines Wirbelbruchs ("Kompressionsfraktur") sind plötzliche Rückenschmerzen, oft mit radikulären Schmerzen (einschießende Schmerzen aufgrund der Kompression von Nervenwurzeln) und selten mit Rückenmarkskompression oder Cauda-Equina-Syndrom. Mehrfache Wirbelbrüche führen zu einer gebückten Haltung, einem Verlust an Körpergröße und chronischen Schmerzen mit einer daraus resultierenden Einschränkung der Beweglichkeit. ⓘ
Brüche der langen Röhrenknochen beeinträchtigen akut die Beweglichkeit und können eine Operation erfordern. Insbesondere Hüftfrakturen müssen in der Regel sofort operiert werden, da sie mit erheblichen Risiken wie tiefen Venenthrombosen und Lungenembolien sowie einer erhöhten Sterblichkeit verbunden sind. ⓘ
Frakturrisiko-Rechner bewerten das Frakturrisiko anhand verschiedener Kriterien, darunter Knochenmineraldichte, Alter, Rauchen, Alkoholkonsum, Gewicht und Geschlecht. Zu den anerkannten Rechnern gehören FRAX, der Garvan FRC-Rechner und QFracture sowie das frei zugängliche FREM-Tool. Das FRAX-Tool kann auch in einer an routinemäßig erhobene Gesundheitsdaten angepassten Modifikation angewendet werden. ⓘ
Der Begriff "festgestellte Osteoporose" wird verwendet, wenn ein Knochenbruch aufgrund von Osteoporose aufgetreten ist. Osteoporose ist ein Teil des Frailty-Syndroms. ⓘ
Risiko von Stürzen

Mit zunehmendem Alter steigt das Risiko von Stürzen. Diese Stürze können zu Skelettschäden an Handgelenk, Wirbelsäule, Hüfte, Knie, Fuß und Knöchel führen. Ein Teil des Sturzrisikos ist auf die Beeinträchtigung des Sehvermögens aufgrund verschiedener Ursachen (z. B. Glaukom, Makuladegeneration), Gleichgewichtsstörungen, Bewegungsstörungen (z. B. Parkinson-Krankheit), Demenz und Sarkopenie (altersbedingter Verlust von Skelettmuskeln) zurückzuführen. Kollaps (vorübergehender Verlust der Körperhaltung mit oder ohne Bewusstseinsverlust). Die Ursachen für eine Synkope sind vielfältig, können aber Herzrhythmusstörungen (unregelmäßiger Herzschlag), vasovagale Synkope, orthostatische Hypotonie (abnormaler Blutdruckabfall beim Aufstehen) und Krampfanfälle umfassen. Die Beseitigung von Hindernissen und losen Teppichen in der Wohnumgebung kann Stürze erheblich reduzieren. Personen, die schon einmal gestürzt sind, sowie Personen mit Gang- oder Gleichgewichtsstörungen sind besonders gefährdet. ⓘ
Komplikationen
Osteoporose macht Sie nicht nur anfälliger für Brüche und Frakturen, sondern kann auch zu anderen Komplikationen führen. Knochenbrüche, die auf Osteoporose zurückzuführen sind, können zu Behinderungen und sogar zu einem erhöhten Sterberisiko nach der Verletzung führen. ⓘ
Depressionen gelten als eine Komplikation der Osteoporose. Menschen mit Osteoporose verlieren ihre Unabhängigkeit und laufen Gefahr, aufgrund geringerer körperlicher Aktivität isoliert zu werden. Dadurch wird die Fähigkeit, mit gesundheitlichen Problemen umzugehen, weiter beeinträchtigt. ⓘ
Osteoporose wird auch mit Gesundheitsproblemen der Atemwege und des Herz-Kreislauf-Systems in Verbindung gebracht, z. B. mit dem Verlust der Lungenkapazität. Mehrfache Frakturen führen zu einer kollabierten Brustwirbelsäule, wodurch weniger Luft in die Lunge gelangen kann. Jeder zusammengebrochene Brustwirbelkörper führt zu einem Verlust von fast 10 % des Lungenvolumens. ⓘ
Risikofaktoren
Die Risikofaktoren für osteoporotische Frakturen lassen sich in nicht modifizierbare und (potenziell) modifizierbare Faktoren unterteilen. Darüber hinaus ist die Osteoporose eine anerkannte Komplikation bestimmter Krankheiten und Störungen. Die Einnahme von Medikamenten ist theoretisch veränderbar, obwohl in vielen Fällen die Einnahme von Medikamenten, die das Osteoporoserisiko erhöhen, unvermeidbar sein kann. Koffein ist kein Risikofaktor für Osteoporose. ⓘ
Nicht modifizierbar
- Die wichtigsten Risikofaktoren für Osteoporose sind fortgeschrittenes Alter (sowohl bei Männern als auch bei Frauen) und das weibliche Geschlecht; Östrogenmangel nach der Menopause oder der chirurgischen Entfernung der Eierstöcke geht mit einer raschen Abnahme der Knochenmineraldichte einher, während bei Männern ein Rückgang des Testosteronspiegels eine vergleichbare (aber weniger ausgeprägte) Wirkung hat.
- Ethnische Zugehörigkeit: Obwohl Osteoporose bei Menschen aller ethnischen Gruppen auftritt, sind Menschen mit europäischer oder asiatischer Abstammung prädisponiert für Osteoporose.
- Vererbung: Personen mit einer familiären Vorgeschichte von Knochenbrüchen oder Osteoporose haben ein erhöhtes Risiko; die Vererbbarkeit von Knochenbrüchen und einer niedrigen Knochenmineraldichte ist relativ hoch und liegt zwischen 25 und 80 %. Mindestens 30 Gene werden mit der Entwicklung von Osteoporose in Verbindung gebracht.
- Bei Personen, die bereits eine Fraktur erlitten haben, ist die Wahrscheinlichkeit einer weiteren Fraktur mindestens doppelt so hoch wie bei Personen gleichen Alters und Geschlechts.
- Körperbau: Eine kleine Statur ist ebenfalls ein nicht veränderbarer Risikofaktor, der mit der Entwicklung von Osteoporose in Verbindung gebracht wird. ⓘ
Potenziell modifizierbar
- Übermäßiger Alkoholkonsum: Auch wenn kleine Mengen Alkohol von Vorteil sein können (die Knochendichte nimmt mit steigendem Alkoholkonsum zu, obwohl der Zusammenhang nicht eindeutig nachgewiesen wurde), erhöht chronischer starker Alkoholkonsum (mehr als drei Einheiten pro Tag) wahrscheinlich das Frakturrisiko, obwohl er sich positiv auf die Knochendichte auswirkt.
- Vitamin-D-Mangel: Ein niedriger Vitamin-D-Spiegel ist bei älteren Menschen weltweit verbreitet. Eine leichte Vitamin-D-Insuffizienz geht mit einer erhöhten Produktion von Parathormon (PTH) einher. PTH erhöht die Knochenresorption, was zu Knochenverlust führt. Es besteht ein positiver Zusammenhang zwischen dem Serumspiegel von 1,25-Dihydroxycholecalciferol und der Knochenmineraldichte, während PTH negativ mit der Knochenmineraldichte verbunden ist.
- Rauchen: Viele Studien haben das Rauchen mit einer verminderten Knochengesundheit in Verbindung gebracht, aber die Mechanismen sind unklar. Es wird angenommen, dass Rauchen die Aktivität der Osteoblasten hemmt und ein unabhängiger Risikofaktor für Osteoporose ist. Rauchen führt auch zu einem verstärkten Abbau von exogenem Östrogen, einem niedrigeren Körpergewicht und einer früheren Menopause, was alles zu einer geringeren Knochenmineraldichte beiträgt.
- Unterernährung: Die Ernährung spielt eine wichtige und komplexe Rolle bei der Erhaltung guter Knochen. Zu den identifizierten Risikofaktoren gehören eine geringe Zufuhr von Kalzium und/oder Phosphor, Magnesium, Zink, Bor, Eisen, Fluorid, Kupfer, den Vitaminen A, K, E und C (und D, wenn die Haut durch Sonnenlicht unzureichend versorgt wird). Überschüssiges Natrium ist ein Risikofaktor. Ein hoher Säuregehalt im Blut kann ernährungsbedingt sein und ist ein bekannter Antagonist der Knochen. Einige haben festgestellt, dass eine niedrige Proteinzufuhr mit einer geringeren Spitzenknochenmasse im Jugendalter und einer geringeren Knochenmineraldichte bei älteren Menschen in Verbindung steht. Umgekehrt haben einige eine niedrige Proteinzufuhr als positiven Faktor identifiziert, denn Protein ist eine der Ursachen für eine saure Ernährung. Ein Ungleichgewicht zwischen mehrfach ungesättigten Omega-6- und Omega-3-Fettsäuren ist ein weiterer identifizierter Risikofaktor.
- Eine proteinreiche Ernährung kann optimal für die Knochengesundheit sein, da eine proteinreiche Ernährung die Kalziumaufnahme aus der Nahrung erhöht und mit einer höheren Knochendichte einhergeht. Eine Meta-Analyse veröffentlichter medizinischer Studien zeigt, dass eine eiweißreiche Ernährung eine geringfügige Verbesserung der Knochendichte der Wirbelsäule bewirkt, bei anderen Knochen jedoch keine signifikante Verbesserung zeigt.
- Untergewicht/Inaktivität: Der Knochenumbau erfolgt als Reaktion auf körperliche Belastung, so dass körperliche Inaktivität zu einem erheblichen Knochenschwund führen kann. Körperliche Betätigung kann die im Jugendalter erreichte Spitzenknochenmasse erhöhen, und es wurde ein hochsignifikanter Zusammenhang zwischen Knochenstärke und Muskelkraft festgestellt. Die Häufigkeit von Osteoporose ist bei übergewichtigen Menschen geringer.
- Ausdauertraining: Bei Ausdauersportlerinnen können hohe Trainingsumfänge zu einer verminderten Knochendichte und einem erhöhten Osteoporoserisiko führen. Dieser Effekt könnte darauf zurückzuführen sein, dass intensives Training die Menstruation unterdrückt und eine Amenorrhoe hervorruft, und ist Teil der Triade der weiblichen Athleten. Bei männlichen Athleten ist die Situation jedoch weniger eindeutig, und obwohl einige Studien über eine geringe Knochendichte bei männlichen Elite-Ausdauersportlern berichten, haben andere stattdessen eine erhöhte Knochendichte in den Beinen festgestellt.
- Schwermetalle: Es wurde ein starker Zusammenhang zwischen Cadmium und Blei und Knochenerkrankungen festgestellt. Eine niedrige Cadmiumexposition wird bei beiden Geschlechtern mit einem verstärkten Verlust der Knochenmineraldichte in Verbindung gebracht, was zu Schmerzen und einem erhöhten Frakturrisiko führt, insbesondere bei älteren Menschen und bei Frauen. Eine höhere Cadmiumexposition führt zu Osteomalazie (Erweichung der Knochen).
- Erfrischungsgetränke: Einige Studien deuten darauf hin, dass Erfrischungsgetränke (von denen viele Phosphorsäure enthalten) das Osteoporoserisiko erhöhen können, zumindest bei Frauen. Andere Studien deuten darauf hin, dass Softdrinks eher kalziumhaltige Getränke aus der Ernährung verdrängen, als dass sie direkt Osteoporose verursachen.
- Protonenpumpenhemmer (wie Lansoprazol, Esomeprazol und Omeprazol), die die Produktion von Magensäure verringern, sind ein Risikofaktor für Knochenbrüche, wenn sie über zwei oder mehr Jahre eingenommen werden, da sie die Aufnahme von Kalzium im Magen verringern. ⓘ
Medizinische Störungen

Viele Krankheiten und Störungen werden mit Osteoporose in Verbindung gebracht. Bei einigen ist der zugrunde liegende Mechanismus, der den Knochenstoffwechsel beeinflusst, eindeutig, während bei anderen die Ursachen vielfältig oder unbekannt sind.
- Im Allgemeinen führt eine Immobilisierung zu Knochenschwund (nach der Regel "use it or lose it"). So kann beispielsweise nach längerer Ruhigstellung einer gebrochenen Gliedmaße in einem Gipsverband eine örtlich begrenzte Osteoporose auftreten. Auch bei aktiven Menschen mit hohem Knochenumsatz (z. B. bei Sportlern) ist dies häufiger der Fall. Weitere Beispiele sind Knochenverluste während eines Weltraumflugs oder bei Menschen, die aus verschiedenen Gründen bettlägerig sind oder einen Rollstuhl benutzen.
- Hypogonadale Zustände können eine sekundäre Osteoporose verursachen. Dazu gehören das Turner-Syndrom, das Klinefelter-Syndrom, das Kallmann-Syndrom, Anorexia nervosa, Andropause, hypothalamische Amenorrhoe oder Hyperprolaktinämie. Bei Frauen wird die Wirkung des Hypogonadismus durch Östrogenmangel vermittelt. Er kann sich als frühe Menopause (<45 Jahre) oder als verlängerte prämenopausale Amenorrhoe (>1 Jahr) äußern. Die bilaterale Oophorektomie (chirurgische Entfernung der Eierstöcke) und das vorzeitige Versagen der Eierstöcke führen zu einer unzureichenden Östrogenproduktion. Bei Männern ist Testosteronmangel die Ursache (z. B. in der Andropause oder nach operativer Entfernung der Hoden).
- Zu den endokrinen Störungen, die zu Knochenschwund führen können, gehören das Cushing-Syndrom, Hyperparathyreoidismus, Hyperthyreose, Hypothyreose, Diabetes mellitus Typ 1 und 2, Akromegalie und Nebenniereninsuffizienz.
- Mangelernährung, parenterale Ernährung und Malabsorption können zu Osteoporose führen. Zu den Ernährungs- und Magen-Darm-Erkrankungen, die für Osteoporose prädisponieren können, gehören nicht diagnostizierte und unbehandelte Zöliakie (sowohl bei symptomatischen als auch bei asymptomatischen Personen), Morbus Crohn, Colitis ulcerosa, Mukoviszidose, chirurgische Eingriffe (nach Gastrektomie, intestinaler Bypass-Operation oder Darmresektion) und schwere Lebererkrankungen (insbesondere primär biliäre Zirrhose). Menschen mit Laktoseintoleranz oder Milchallergie können aufgrund der Einschränkung von kalziumhaltigen Lebensmitteln Osteoporose entwickeln. Auch Menschen mit Bulimie können eine Osteoporose entwickeln. Menschen mit einer ansonsten ausreichenden Kalziumzufuhr können Osteoporose entwickeln, weil sie kein Kalzium und/oder Vitamin D aufnehmen können. Auch andere Mikronährstoffe wie Vitamin K oder Vitamin B12-Mangel können dazu beitragen.
- Menschen mit rheumatologischen Erkrankungen wie rheumatoider Arthritis, Spondylitis ankylosans, systemischem Lupus erythematodes und polyartikulärer juveniler idiopathischer Arthritis haben ein erhöhtes Osteoporoserisiko, entweder als Teil ihrer Erkrankung oder aufgrund anderer Risikofaktoren (insbesondere einer Kortikosteroidtherapie). Systemische Erkrankungen wie Amyloidose und Sarkoidose können ebenfalls zu Osteoporose führen.
- Chronische Nierenerkrankungen können zu renaler Osteodystrophie führen.
- Zu den hämatologischen Erkrankungen, die mit Osteoporose in Verbindung stehen, gehören das Multiple Myelom und andere monoklonale Gammopathien, Lymphome, Leukämie, Mastozytose, Hämophilie, Sichelzellanämie und Thalassämie.
- Mehrere vererbte oder genetische Erkrankungen wurden mit Osteoporose in Verbindung gebracht. Dazu gehören die Osteogenesis imperfecta, das Multizentrische Karpotarsal-Osteolysesyndrom, die Multizentrische Osteolyse, Nodulose und Arthropathie, das Marfan-Syndrom, die Hämochromatose, die Hypophosphatasie (die häufig fehldiagnostiziert wird), Glykogenspeicherkrankheiten, die Homocystinurie, das Ehlers-Danlos-Syndrom, die Porphyrie, das Menkes-Syndrom, die Epidermolysis bullosa und die Gaucher-Krankheit.
- Menschen mit Skoliose unbekannter Ursache haben ebenfalls ein höheres Risiko für Osteoporose. Knochenschwund kann ein Merkmal des komplexen regionalen Schmerzsyndroms sein. Auch bei Menschen mit Morbus Parkinson und chronisch obstruktiver Lungenerkrankung tritt er häufiger auf.
- Menschen mit Morbus Parkinson haben ein höheres Risiko für Knochenbrüche. Dies hängt mit dem schlechten Gleichgewicht und der geringen Knochendichte zusammen. Bei der Parkinson-Krankheit besteht möglicherweise ein Zusammenhang zwischen dem Verlust dopaminerger Neuronen und einem veränderten Kalziumstoffwechsel (und Eisenstoffwechsel), der eine Versteifung des Skeletts und Kyphose verursacht. ⓘ
Medikamentöse Behandlung
Bestimmte Medikamente werden mit einem erhöhten Osteoporoserisiko in Verbindung gebracht; klassischerweise werden nur Glukokortikosteroide und Antikonvulsiva damit in Verbindung gebracht, aber es gibt auch Hinweise auf andere Medikamente.
- Die Steroid-induzierte Osteoporose (SIOP) entsteht durch die Einnahme von Glukokortikoiden - analog zum Cushing-Syndrom - und betrifft hauptsächlich das Achsenskelett. Das verschreibungspflichtige synthetische Glukokortikoid Prednison ist nach längerer Einnahme ein Hauptkandidat. In einigen Leitlinien wird eine Prophylaxe bei Patienten empfohlen, die mehr als 30 mg Hydrocortison (7,5 mg Prednisolon) einnehmen, vor allem, wenn dies länger als drei Monate der Fall ist. Es wird empfohlen, Kalzium oder Vitamin D zur Vorbeugung zu verwenden. Die Einnahme von Kalzium oder Vitamin D im Tagesrhythmus kann diese Komplikation nicht verhindern.
- Barbiturate, Phenytoin und einige andere enzyminduzierende Antiepileptika - diese beschleunigen wahrscheinlich den Metabolismus von Vitamin D.
- Eine Überdosierung von L-Thyroxin kann ähnlich wie bei der Thyreotoxikose zu Osteoporose beitragen. Dies kann bei subklinischer Hypothyreose von Bedeutung sein.
- Mehrere Medikamente führen zu Hypogonadismus, z. B. Aromatasehemmer, die bei Brustkrebs eingesetzt werden, Methotrexat und andere Antimetaboliten, Depot-Progesteron und Agonisten des Gonadotropin-Releasing-Hormons.
- Antikoagulanzien - die langfristige Einnahme von Heparin wird mit einer Abnahme der Knochendichte in Verbindung gebracht, und Warfarin (und verwandte Cumarine) wurden mit einem erhöhten Risiko für osteoporotische Frakturen bei langfristiger Einnahme in Verbindung gebracht.
- Protonenpumpenhemmer - diese Medikamente hemmen die Produktion von Magensäure, was vermutlich die Kalziumaufnahme beeinträchtigt. Eine chronische Phosphatbindung kann auch bei aluminiumhaltigen Antazida auftreten.
- Thiazolidindione (zur Behandlung von Diabetes) - Rosiglitazon und möglicherweise Pioglitazon, PPARγ-Inhibitoren, wurden mit einem erhöhten Osteoporose- und Frakturrisiko in Verbindung gebracht.
- Eine chronische Lithiumtherapie wurde mit Osteoporose in Verbindung gebracht. ⓘ
Evolutionäre Entwicklung
Altersbedingter Knochenschwund ist beim Menschen weit verbreitet, da er weniger dichte Knochen hat als andere Primatenarten. Aufgrund der poröseren Knochen des Menschen ist die Häufigkeit von schwerer Osteoporose und osteoporosebedingten Frakturen höher. Die Anfälligkeit des Menschen für Osteoporose ist ein offensichtlicher Preis, der jedoch mit dem Vorteil des Zweibeinertums gerechtfertigt werden kann, wenn man davon ausgeht, dass diese Anfälligkeit ein Nebenprodukt davon ist. Es wird vermutet, dass poröse Knochen dazu beitragen, die erhöhte Belastung zu absorbieren, die wir auf zwei Oberflächen ausüben, im Vergleich zu unseren Primaten, die vier Oberflächen haben, um die Kraft zu verteilen. Außerdem sorgt die Porosität für mehr Flexibilität und ein leichteres Skelett, das leichter zu tragen ist. Eine weitere Überlegung könnte sein, dass die heutige Ernährung viel weniger Kalzium enthält als die Ernährung anderer Primaten oder der tetrapedalen Vorfahren des Menschen, was zu einer höheren Wahrscheinlichkeit von Osteoporose führen könnte. ⓘ
Bewertung des Frakturrisikos
Wenn keine anderen Risikofaktoren als Geschlecht und Alter vorliegen, wird für Frauen im Alter von 65 Jahren eine BMD-Messung mittels Dual-Energy-Röntgenabsorptiometrie (DXA) empfohlen. Bei Frauen mit Risikofaktoren wird im Alter von 50 Jahren eine klinische FRAX empfohlen. ⓘ
Pathogenese

Der zugrunde liegende Mechanismus ist in allen Fällen von Osteoporose ein Ungleichgewicht zwischen Knochenresorption und Knochenbildung. In normalen Knochen findet ein ständiger Umbau der Knochenmatrix statt; bis zu 10 % der gesamten Knochenmasse können sich zu jedem Zeitpunkt im Umbau befinden. Der Prozess findet in multizellulären Knocheneinheiten (bone multicellular units, BMUs) statt, die erstmals 1963 von Frost & Thomas beschrieben wurden. Osteoklasten werden durch den Transkriptionsfaktor PU.1 beim Abbau der Knochenmatrix unterstützt, während Osteoblasten die Knochenmatrix wieder aufbauen. Eine geringe Knochenmassendichte kann dann auftreten, wenn die Osteoklasten die Knochenmatrix schneller abbauen als die Osteoblasten den Knochen wieder aufbauen. ⓘ
Die drei Hauptmechanismen, durch die Osteoporose entsteht, sind eine unzureichende Spitzenknochenmasse (das Skelett entwickelt während des Wachstums eine unzureichende Masse und Festigkeit), eine übermäßige Knochenresorption und eine unzureichende Knochenneubildung während des Umbaus, was wahrscheinlich darauf zurückzuführen ist, dass die mesenchymalen Stammzellen sich von den Osteoblasten ab- und der Adipozytenlinie des Knochenmarks zuwenden. Ein Zusammenspiel dieser drei Mechanismen liegt der Entwicklung von brüchigem Knochengewebe zugrunde. Hormonelle Faktoren bestimmen in hohem Maße die Geschwindigkeit der Knochenresorption; Östrogenmangel (z. B. infolge der Menopause) erhöht die Knochenresorption und verringert die Ablagerung neuer Knochen, die normalerweise in gewichtstragenden Knochen stattfindet. Die Östrogenmenge, die zur Unterdrückung dieses Prozesses erforderlich ist, ist geringer als diejenige, die normalerweise zur Stimulierung der Gebärmutter und der Brustdrüse benötigt wird. Die α-Form des Östrogenrezeptors scheint für die Regulierung des Knochenumsatzes am wichtigsten zu sein. Neben Östrogen spielt auch der Kalziumstoffwechsel eine wichtige Rolle beim Knochenumsatz, und ein Mangel an Kalzium und Vitamin D führt zu einer Beeinträchtigung des Knochenaufbaus; außerdem reagieren die Nebenschilddrüsen auf einen niedrigen Kalziumspiegel mit der Ausschüttung von Parathormon (PTH), das die Knochenresorption erhöht, um eine ausreichende Kalziumkonzentration im Blut sicherzustellen. Die Rolle von Calcitonin, einem von der Schilddrüse gebildeten Hormon, das den Knochenabbau verstärkt, ist weniger klar und wahrscheinlich nicht so bedeutend wie die von PTH. ⓘ
Die Aktivierung der Osteoklasten wird durch verschiedene molekulare Signale gesteuert, von denen RANKL (receptor activator of nuclear factor kappa-B ligand) eines der am besten untersuchten ist. Dieses Molekül wird von Osteoblasten und anderen Zellen (z. B. Lymphozyten) produziert und stimuliert den RANK (Rezeptor-Aktivator des Nuklearfaktors κB). Osteoprotegerin (OPG) bindet RANKL, bevor es die Möglichkeit hat, an RANK zu binden, und unterdrückt damit dessen Fähigkeit, die Knochenresorption zu steigern. RANKL, RANK und OPG sind eng mit dem Tumor-Nekrose-Faktor und seinen Rezeptoren verwandt. Die Rolle des Wnt-Signalwegs ist zwar bekannt, aber weniger gut verstanden. Es wird angenommen, dass die lokale Produktion von Eicosanoiden und Interleukinen an der Regulierung des Knochenumsatzes beteiligt ist, und eine übermäßige oder verminderte Produktion dieser Mediatoren kann der Entwicklung von Osteoporose zugrunde liegen. ⓘ
Trabekelknochen (oder Spongiosa) ist der schwammartige Knochen an den Enden der langen Knochen und der Wirbelsäule. Kortikaler Knochen ist die harte äußere Schale der Knochen und die Mitte der langen Knochen. Da Osteoblasten und Osteoklasten die Oberfläche der Knochen besiedeln, ist der trabekuläre Knochen aktiver und unterliegt stärker dem Knochenumsatz und -umbau. Nicht nur die Knochendichte nimmt ab, sondern auch die Mikroarchitektur des Knochens ist gestört. Die schwächeren Spicula des trabekulären Knochens brechen ("Mikrorisse") und werden durch schwächeren Knochen ersetzt. Häufige Stellen für osteoporotische Frakturen, das Handgelenk, die Hüfte und die Wirbelsäule, haben ein relativ hohes Verhältnis von trabekulärem Knochen zu kortikalem Knochen. Diese Bereiche sind für ihre Festigkeit auf den trabekulären Knochen angewiesen, so dass der intensive Umbau diese Bereiche am stärksten degenerieren lässt, wenn der Umbau unausgewogen ist. Im Alter von 30 bis 35 Jahren beginnt der Verlust an spongiösem oder trabekulärem Knochen. Bei Frauen kann der Verlust bis zu 50 % betragen, während er bei Männern etwa 30 % ausmacht. ⓘ
Kollaps des Wirbels rechts, normal links ⓘ
Diagnose
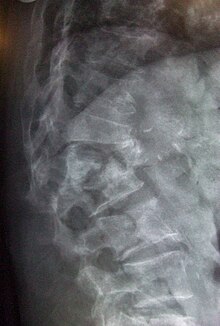
Die Diagnose der Osteoporose kann durch konventionelle Röntgenaufnahmen und durch die Messung der Knochenmineraldichte (BMD) gestellt werden. Die gängigste Methode zur Messung der BMD ist die Dual-Energy-Röntgenabsorptiometrie. ⓘ
Neben der Feststellung einer abnormalen BMD erfordert die Diagnose von Osteoporose auch die Untersuchung von potenziell veränderbaren Ursachen, die durch Bluttests ermittelt werden können. Je nach Wahrscheinlichkeit eines zugrunde liegenden Problems können Untersuchungen auf Krebs mit Knochenmetastasen, ein multiples Myelom, das Cushing-Syndrom und andere oben genannte Ursachen durchgeführt werden. ⓘ
Konventionelle Röntgenuntersuchung
Die konventionelle Röntgenuntersuchung ist sowohl allein als auch in Verbindung mit CT oder MRT nützlich, um Komplikationen der Osteopenie (verminderte Knochenmasse; Prä-Osteoporose), wie z. B. Frakturen, zu erkennen, für die Differenzialdiagnose der Osteopenie oder für Nachuntersuchungen in bestimmten klinischen Situationen, wie z. B. Weichteilverkalkungen, sekundärer Hyperparathyreoidismus oder Osteomalazie bei renaler Osteodystrophie. Die Röntgenuntersuchung ist jedoch relativ unempfindlich, wenn es um die Erkennung eines frühen Krankheitsstadiums geht, und erfordert einen erheblichen Knochenverlust (etwa 30 %), um auf Röntgenbildern sichtbar zu werden. ⓘ
Die wichtigsten radiologischen Merkmale der generalisierten Osteoporose sind eine Ausdünnung der Kortikalis und eine erhöhte Radioluzenz. Eine häufige Komplikation der Osteoporose sind Wirbelbrüche, bei denen die Röntgenaufnahme der Wirbelsäule eine große Hilfe bei der Diagnose und Nachsorge sein kann. Wirbelhöhenmessungen lassen sich objektiv mit Hilfe von Röntgenbildern in Klarsichtfolie durchführen, wobei verschiedene Methoden angewandt werden können, wie z. B. der Höhenverlust in Verbindung mit einer Flächenverkleinerung, insbesondere bei vertikalen Deformitäten in T4-L4, oder die Bestimmung eines Wirbelbruchindexes, der die Anzahl der betroffenen Wirbel berücksichtigt. Die Beteiligung mehrerer Wirbelkörper führt zu einer Kyphose der Brustwirbelsäule und damit zu einem so genannten Witwenbuckel. ⓘ
Zwei-Energie-Röntgen
Die Dual-Energy-Röntgenabsorptiometrie (DEXA-Scan) gilt als Goldstandard für die Diagnose von Osteoporose. Osteoporose wird diagnostiziert, wenn die Knochenmineraldichte weniger als oder gleich 2,5 Standardabweichungen unter der einer jungen (30-40 Jahre alt:58), gesunden erwachsenen Frauen-Referenzpopulation liegt. Dies wird als T-Score ausgedrückt. Da die Knochendichte jedoch mit dem Alter abnimmt, werden mit zunehmendem Alter mehr Menschen osteoporotisch:58 Die Weltgesundheitsorganisation hat die folgenden diagnostischen Richtlinien aufgestellt:
| Kategorie | T-Score-Bereich | % junge Frauen ⓘ |
|---|---|---|
| Normal | T-Score ≥ -1,0 | 85% |
| Osteopenie | -2,5 < T-Score < -1,0 | 14% |
| Osteoporose | T-Score ≤ -2,5 | 0.6% |
| Schwere Osteoporose | T-Score ≤ -2,5 mit Fragilitätsfraktur |
Die Internationale Gesellschaft für klinische Densitometrie vertritt den Standpunkt, dass die Diagnose einer Osteoporose bei Männern unter 50 Jahren nicht allein auf der Grundlage densitometrischer Kriterien gestellt werden sollte. Auch bei Frauen vor der Menopause sollten eher Z-Scores (Vergleich mit der Altersgruppe und nicht mit der maximalen Knochenmasse) als T-Scores verwendet werden, und die Diagnose einer Osteoporose bei diesen Frauen sollte ebenfalls nicht allein auf der Grundlage densitometrischer Kriterien gestellt werden. ⓘ
Biomarker
Chemische Biomarker sind ein nützliches Instrument zum Nachweis von Knochenabbau. Das Enzym Cathepsin K spaltet Typ-I-Kollagen, einen wichtigen Bestandteil des Knochens. Präparierte Antikörper können das dabei entstehende Fragment, ein so genanntes Neoepitop, erkennen und so Osteoporose diagnostizieren. Erhöhte Urinausscheidungen von C-Telopeptiden, einem Abbauprodukt von Typ-I-Kollagen, dienen ebenfalls als Biomarker für Osteoporose. ⓘ
| Zustand | Kalzium | Phosphat | Alkalische Phosphatase | Nebenschilddrüsenhormon | Kommentare |
|---|---|---|---|---|---|
| Osteopenie | unbeeinflusst | unbeeinflusst | normal | unbeeinflusst | verringerte Knochenmasse |
| Osteopetrose | unbeeinflusst | unbeeinflusst | Erhöht | unbeeinflusst | dicke, dichte Knochen, auch bekannt als Marmorknochen |
| Osteomalazie und Rachitis | vermindert | vermindert | Erhöht | Erhöht | weiche Knochen |
| Osteitis fibrosa cystica | Erhöht | vermindert | Erhöht | Erhöht | braune Tumore |
| Paget-Krankheit der Knochen | unbeeinflusst | unbeeinflusst | variabel (je nach Stadium der Erkrankung) | unbeeinflusst | abnorme Knochenarchitektur |
Andere Messinstrumente
Die quantitative Computertomographie (QCT) unterscheidet sich von der DXA dadurch, dass sie getrennte Schätzungen der BMD für den trabekulären und den kortikalen Knochen liefert und die genaue volumetrische Mineraldichte in mg/cm3 anstelle des relativen Z-Scores der BMD angibt. Zu den Vorteilen der QCT gehört, dass sie an axialen und peripheren Stellen durchgeführt werden kann, dass sie aus vorhandenen CT-Scans ohne separate Strahlendosis berechnet werden kann, dass sie empfindlich auf Veränderungen im Laufe der Zeit reagiert, dass sie eine Region beliebiger Größe oder Form analysieren kann, dass sie irrelevantes Gewebe wie Fett, Muskeln und Luft ausschließt und dass sie keine Kenntnis der Subpopulation des Patienten erfordert, um einen klinischen Score zu erstellen (z. B. den Z-Score aller Frauen eines bestimmten Alters). Zu den Nachteilen der QCT gehört, dass sie im Vergleich zur DXA eine hohe Strahlendosis erfordert, dass die CT-Scanner groß und teuer sind und dass ihre Ergebnisse stärker vom Bediener abhängen, da ihre Anwendung weniger standardisiert ist als die BMD. Die periphere QCT wurde eingeführt, um die Einschränkungen von DXA und QCT zu verbessern. ⓘ
Quantitativer Ultraschall hat viele Vorteile bei der Beurteilung von Osteoporose. Die Modalität ist klein, es ist keine ionisierende Strahlung erforderlich, die Messungen können schnell und einfach durchgeführt werden, und die Kosten für das Gerät sind im Vergleich zu DXA- und QCT-Geräten gering. Der Fersenbeinknochen ist die häufigste Skelettstelle für die quantitative Ultraschalluntersuchung, da er einen hohen Anteil an trabekulärem Knochen aufweist, der häufiger ersetzt wird als kortikaler Knochen, was frühe Hinweise auf metabolische Veränderungen liefert. Außerdem ist der Fersenbeinknochen relativ flach und parallel, was Fehler bei der Neupositionierung reduziert. Die Methode kann sowohl bei Kindern, Neugeborenen und Frühgeborenen als auch bei Erwachsenen angewendet werden. Einige Ultraschallgeräte können auch für die Tibia verwendet werden. ⓘ
Vorsorgeuntersuchung
Die U.S. Preventive Services Task Force (USPSTF) empfiehlt, dass alle Frauen ab 65 Jahren mittels Knochendichtemessung untersucht werden. Außerdem wird empfohlen, auch jüngere Frauen mit Risikofaktoren zu untersuchen. Es liegen keine ausreichenden Erkenntnisse vor, um Empfehlungen zu den Intervallen für wiederholte Untersuchungen und zum geeigneten Alter für die Beendigung des Screenings abzugeben. ⓘ
Bei Männern ist das Verhältnis zwischen Schaden und Nutzen eines Osteoporose-Screenings unbekannt. In der Verordnung heißt es, dass die Notwendigkeit eines Osteoporose-Screenings bei Personen, die noch keinen Knochenbruch erlitten haben, unklar ist. Die Internationale Gesellschaft für klinische Densitometrie empfiehlt BMD-Tests für Männer ab 70 Jahren oder für Männer, bei denen das Risiko dem eines 70-Jährigen entspricht. Es gibt eine Reihe von Instrumenten, die dabei helfen, zu bestimmen, bei wem ein Test sinnvoll ist. ⓘ
Prävention
Die Prävention der Osteoporose durch den Lebensstil ist in vielerlei Hinsicht die Umkehrung der potenziell veränderbaren Risikofaktoren. Da das Rauchen und ein hoher Alkoholkonsum mit Osteoporose in Verbindung gebracht werden, wird allgemein empfohlen, das Rauchen aufzugeben und den Alkoholkonsum einzuschränken, um die Osteoporose zu verhindern. ⓘ
Bei Menschen mit Zöliakie verringert die Einhaltung einer glutenfreien Diät das Risiko, an Osteoporose zu erkranken, und erhöht die Knochendichte. Die Ernährung muss eine optimale Kalziumzufuhr (mindestens ein Gramm pro Tag) gewährleisten, und es wird empfohlen, den Vitamin-D-Spiegel zu messen und gegebenenfalls spezifische Ergänzungsmittel einzunehmen. ⓘ
Ernährung
Studien über den Nutzen einer Supplementierung mit Kalzium und Vitamin D sind widersprüchlich, möglicherweise weil in den meisten Studien keine Personen mit geringer Nahrungsaufnahme untersucht wurden. Eine Überprüfung der USPSTF aus dem Jahr 2018 ergab, dass die routinemäßige Einnahme von Kalzium- und Vitamin-D-Präparaten (oder beider Präparate zusammen) das Risiko einer osteoporotischen Fraktur bei männlichen und weiblichen Erwachsenen, die in der Gemeinschaft lebten und bei denen kein Vitamin-D-Mangel, keine Osteoporose oder eine Fraktur in der Vorgeschichte bekannt war, nicht verringert. Die USPSTF empfiehlt keine niedrig dosierte Supplementierung (weniger als 1 g Kalzium und 400 IE Vitamin D) bei postmenopausalen Frauen, da es keinen Unterschied im Frakturrisiko zu geben scheint. Eine Überprüfung aus dem Jahr 2015 ergab, dass es kaum Daten gibt, die belegen, dass eine Kalziumsupplementierung das Frakturrisiko senkt. Einige Meta-Analysen haben zwar einen Nutzen von Vitamin-D-Präparaten in Kombination mit Kalzium bei Frakturen festgestellt, nicht aber einen Nutzen von Vitamin-D-Präparaten (800 IE/Tag oder weniger) allein. Die Supplementierung scheint zwar keinen Einfluss auf das Sterberisiko zu haben, doch wird ein erhöhtes Risiko für Herzinfarkte, Nierensteine und Magenprobleme mit der Einnahme von Kalziumpräparaten in Verbindung gebracht. ⓘ
Vitamin-K-Mangel ist auch ein Risikofaktor für osteoporotische Frakturen. Das Gen Gamma-Glutamyl-Carboxylase (GGCX) ist von Vitamin K abhängig. Funktionelle Polymorphismen in diesem Gen könnten zu Variationen im Knochenstoffwechsel und in der BMD führen. Vitamin K2 wird auch als Mittel zur Behandlung von Osteoporose eingesetzt, und die Polymorphismen von GGCX könnten die individuellen Unterschiede in der Reaktion auf die Behandlung mit Vitamin K erklären. ⓘ
Zu den Kalziumquellen in der Ernährung gehören Milchprodukte, Blattgemüse, Hülsenfrüchte und Bohnen. Es gibt widersprüchliche Belege dafür, ob Milchprodukte eine angemessene Kalziumquelle zur Vorbeugung von Knochenbrüchen sind oder nicht. Die Nationale Akademie der Wissenschaften empfiehlt 1.000 mg Kalzium für Menschen zwischen 19 und 50 Jahren und 1.200 mg für Menschen ab 50 Jahren. Eine Überprüfung der Beweise zeigt, dass eine höhere Proteinzufuhr keine nachteiligen Auswirkungen auf die Knochengesundheit hat. ⓘ
Körperliche Betätigung
Es gibt nur wenige Hinweise darauf, dass körperliche Betätigung die Knochengesundheit fördert. Es gibt einige Hinweise darauf, dass körperliche Bewegung die Knochendichte bei postmenopausalen Frauen verbessern und das Risiko eines Knochenbruchs leicht verringern kann (absolute Differenz 4 %). Eine Stellungnahme kommt zu dem Schluss, dass eine erhöhte Knochenaktivität und gewichtstragende Übungen in jungen Jahren die Knochenbrüchigkeit bei Erwachsenen verhindern. Fahrradfahren und Schwimmen gelten nicht als gewichtstragende Übungen. Beide tragen nicht dazu bei, den altersbedingten Knochenabbau zu verlangsamen, und professionelle Radrennen haben einen negativen Einfluss auf die Knochendichte. ⓘ
Es gibt nur wenige Hinweise darauf, dass Bewegung die Schmerzen und die Lebensqualität von Menschen mit Wirbelbrüchen verbessern kann, und es gibt mäßige Hinweise darauf, dass Bewegung die körperliche Leistungsfähigkeit von Menschen mit Wirbelbrüchen wahrscheinlich verbessert. ⓘ
Physikalische Therapie
Menschen mit Osteoporose haben ein höheres Sturzrisiko, da sie eine schlechte Haltungskontrolle, Muskelschwäche und eine allgemeine Dekonditionierung aufweisen. Die Haltungskontrolle ist wichtig, um funktionelle Bewegungen wie Gehen und Stehen aufrechtzuerhalten. Physiotherapie kann ein wirksames Mittel sein, um Haltungsschwächen zu beheben, die durch Wirbelbrüche entstehen können, die bei Menschen mit Osteoporose häufig auftreten. Zu den physiotherapeutischen Behandlungsplänen für Menschen mit Wirbelbrüchen gehören Gleichgewichtstraining, Haltungskorrekturen, Übungen zur Stärkung der Rumpf- und unteren Extremitätenmuskulatur sowie aerobe körperliche Betätigung mit moderater Intensität. Ziel dieser Maßnahmen ist es, die normale Krümmung der Wirbelsäule wiederherzustellen, die Stabilität der Wirbelsäule zu erhöhen und die funktionelle Leistungsfähigkeit zu verbessern. Physikalische Therapiemaßnahmen wurden auch entwickelt, um die Geschwindigkeit des Knochenabbaus durch Übungsprogramme zu Hause zu verlangsamen. ⓘ
Die Ganzkörper-Vibrationstherapie wurde ebenfalls als physikalische Therapiemaßnahme vorgeschlagen. Mäßige bis schlechte Belege deuten darauf hin, dass die Ganzkörpervibrationstherapie das Sturzrisiko verringern kann. Es gibt widersprüchliche Berichte darüber, ob die Vibrationstherapie die Knochenmineraldichte verbessert. ⓘ
Die Physiotherapie kann durch therapeutische Übungen zur allgemeinen Vorbeugung der Entwicklung von Osteoporose beitragen. Vorgeschriebene mechanische Belastungen oder erhöhte Kräfte auf die Knochen fördern die Knochenbildung und die Gefäßneubildung auf verschiedene Weise und bieten somit eine Präventionsmaßnahme, die nicht auf Medikamente angewiesen ist. Gezieltes Training wirkt auf die Hormone und Signalwege des Körpers ein und fördert so die Erhaltung eines gesunden Skeletts. ⓘ
Verwaltung
Lebensstil
Ausdauertraining mit Gewichten und/oder Übungen zur Stärkung der Muskeln verbessern die Knochenstärke bei Osteoporosepatienten. Aerobic, Krafttraining und Widerstandsübungen erhalten oder erhöhen die BMD bei postmenopausalen Frauen. Sturzprophylaxe kann helfen, Osteoporose-Komplikationen zu verhindern. Es gibt einige Belege für Hüftprotektoren, insbesondere bei Menschen, die in Pflegeheimen leben. ⓘ
Pharmazeutische Therapie
Die Nationale Osteoporose-Stiftung der USA empfiehlt eine pharmakologische Behandlung für Patienten mit Hüft- oder Wirbelsäulenfrakturen, bei denen ein Zusammenhang mit Osteoporose vermutet wird, für Patienten mit einer BMD, die 2,5 SD oder mehr unter dem jungen normalen Mittelwert liegt (T-Score -2,5 oder darunter), und für Patienten mit einer BMD zwischen 1 und 2,5 SD unter dem normalen Mittelwert, deren 10-Jahres-Risiko für eine Hüftfraktur nach FRAX gleich oder größer als 3 % ist. Bisphosphonate sind nützlich, um das Risiko künftiger Frakturen bei Personen zu verringern, die bereits eine osteoporosebedingte Fraktur erlitten haben. Dieser Nutzen ist gegeben, wenn sie über drei bis vier Jahre eingenommen werden. Sie scheinen das Gesamttodesrisiko nicht zu verändern. Vorläufige Erkenntnisse sprechen nicht für den Einsatz von Bisphosphonaten als Standardbehandlung der sekundären Osteoporose bei Kindern. Die verschiedenen Bisphosphonate wurden nicht direkt miteinander verglichen, daher ist nicht bekannt, ob eines besser ist als ein anderes. Die Verringerung des Frakturrisikos liegt je nach betroffenem Knochen zwischen 25 und 70 %. Es gibt Bedenken hinsichtlich atypischer Oberschenkelfrakturen und Osteonekrose des Kiefers bei Langzeitanwendung, aber diese Risiken sind gering. Da bei einer Anwendung von mehr als drei bis fünf Jahren nur ein geringer Nutzen nachgewiesen wurde, kann es angesichts der möglichen unerwünschten Wirkungen sinnvoll sein, die Behandlung nach diesem Zeitraum abzubrechen. Eine medizinische Organisation empfiehlt, dass die Bisphosphonatbehandlung bei Personen mit geringem Risiko nach fünf Jahren oraler oder drei Jahren intravenöser Einnahme beendet werden kann. Bei Personen mit höherem Risiko empfehlen sie eine bis zu zehnjährige Behandlung mit Medikamenten zum Einnehmen oder eine sechsjährige intravenöse Behandlung. ⓘ
Ziel der Osteoporosebehandlung ist es, osteoporotische Frakturen zu verhindern, aber bei Patienten, die bereits eine Fraktur erlitten haben, ist es dringender, eine weitere Fraktur zu verhindern. Denn bei Patienten, die bereits eine Fraktur erlitten haben, ist die Wahrscheinlichkeit eines erneuten Bruchs größer, was mit einem Anstieg der Morbidität und Mortalität einhergeht. Unter den fünf Bisphosphonaten wurden für alle Frakturendpunkte zusammen keine signifikanten Unterschiede in Bezug auf eine sekundäre Fraktur festgestellt. Dennoch erwies sich Alendronat als das wirksamste Mittel zur Sekundärprävention von Wirbel- und Hüftfrakturen, während Zoledronat eine bessere Leistung bei der Prävention von Nicht-Wirbel- und Nicht-Hüftfrakturen zeigte. Es besteht die Sorge, dass viele Menschen nach einer Fraktur mit geringem Schaden keine angemessene pharmakologische Therapie erhalten. ⓘ
Bei Menschen mit Osteoporose, die noch keinen Knochenbruch erlitten haben, gibt es keine Belege für eine Verringerung des Frakturrisikos durch Risedronat oder Etidronat. Alendronat verringert Frakturen der Wirbelsäule, hat aber keine Auswirkungen auf andere Arten von Frakturen. Die Hälfte von ihnen setzt ihre Medikamente innerhalb eines Jahres ab. Während der Behandlung mit Bisphosphonaten ist eine erneute Überprüfung der Knochenmineraldichte nicht erforderlich. Es gibt vorläufige Hinweise auf einen Nutzen bei Männern mit Osteoporose. ⓘ
Eine Fluoridsupplementierung scheint bei postmenopausaler Osteoporose nicht wirksam zu sein, da sie zwar die Knochendichte erhöht, aber das Risiko von Knochenbrüchen nicht verringert. ⓘ
Teriparatid (ein rekombinantes Parathormon) hat sich bei der Behandlung von Frauen mit postmenopausaler Osteoporose als wirksam erwiesen. Einiges deutet auch darauf hin, dass Strontiumranelat das Risiko von Wirbelbrüchen und anderen Knochenbrüchen bei postmenopausalen Frauen mit Osteoporose wirksam verringert. Eine Hormonersatztherapie ist zwar bei Osteoporose wirksam, wird aber nur bei Frauen empfohlen, die auch unter Wechseljahrsbeschwerden leiden. Bei Osteoporose an sich wird sie nicht empfohlen. Raloxifen ist zwar wirksam bei der Verringerung von Wirbelbrüchen, hat aber keinen Einfluss auf das Risiko von nicht-vertebralen Brüchen. Es verringert zwar das Brustkrebsrisiko, erhöht aber das Risiko von Blutgerinnseln und Schlaganfällen. Während Denosumab bei Frauen Frakturen wirksam vorbeugt, gibt es keine eindeutigen Belege für einen Nutzen bei Männern. Bei hypogonadalen Männern hat sich gezeigt, dass Testosteron die Knochenquantität und -qualität verbessert, doch gibt es seit 2008 keine Studien mehr, die die Wirkung auf das Frakturrisiko oder bei Männern mit normalem Testosteronspiegel untersuchen. Calcitonin wurde zwar früher empfohlen, wird aber aufgrund des damit verbundenen Krebsrisikos und der fragwürdigen Wirkung auf das Frakturrisiko nicht mehr empfohlen. Alendronsäure/Colecalciferol kann zur Behandlung dieser Erkrankung bei Frauen nach den Wechseljahren eingenommen werden. ⓘ
Bestimmte Medikamente wie Alendronat, Etidronat, Risedronat, Raloxifen und Strontiumranelat können dazu beitragen, osteoporotische Fragilitätsfrakturen bei postmenopausalen Frauen mit Osteoporose zu verhindern. Erste Hinweise deuten darauf hin, dass chinesische pflanzliche Arzneimittel einen potenziellen Nutzen für die Knochenmineraldichte haben könnten. ⓘ
Prognose
| WHO-Kategorie | Alter 50-64 | Alter > 64 | Insgesamt ⓘ |
|---|---|---|---|
| Normal | 5.3 | 9.4 | 6.6 |
| Osteopenie | 11.4 | 19.6 | 15.7 |
| Osteoporose | 22.4 | 46.6 | 40.6 |
Obwohl Menschen mit Osteoporose eine erhöhte Sterblichkeitsrate aufgrund von Frakturkomplikationen aufweisen, ist die Fraktur selbst selten tödlich. ⓘ
Hüftfrakturen können zu einer eingeschränkten Mobilität und einem zusätzlichen Risiko zahlreicher Komplikationen führen (z. B. tiefe Venenthrombose und/oder Lungenembolie und Lungenentzündung). Die Sechsmonats-Sterblichkeitsrate bei Personen über 50 Jahren nach einer Hüftfraktur liegt bei etwa 13,5 %, wobei ein erheblicher Anteil (fast 13 %) nach einer Hüftfraktur völlige Unterstützung bei der Mobilisierung benötigt. ⓘ
Wirbelbrüche haben zwar einen geringeren Einfluss auf die Sterblichkeit, können aber zu starken chronischen Schmerzen neurogenen Ursprungs führen, die schwer zu kontrollieren sind, sowie zu Deformierungen. Obwohl selten, können multiple Wirbelbrüche zu einem so starken Rundrücken (Kyphose) führen, dass der daraus resultierende Druck auf die inneren Organe die Atmung beeinträchtigen kann. ⓘ
Abgesehen vom Sterberisiko und anderen Komplikationen sind osteoporotische Frakturen mit einer verminderten gesundheitsbezogenen Lebensqualität verbunden. ⓘ
Die Erkrankung ist für Millionen von Frakturen pro Jahr verantwortlich, die meist die Lendenwirbel, die Hüfte und das Handgelenk betreffen. Fragile Rippenfrakturen sind auch bei Männern häufig. ⓘ
Frakturen
Hüftfrakturen sind für die schwerwiegendsten Folgen der Osteoporose verantwortlich. In den Vereinigten Staaten sind jährlich mehr als 250.000 Hüftfrakturen auf Osteoporose zurückzuführen. Eine 50-jährige weiße Frau hat ein geschätztes Lebenszeitrisiko von 17,5 % für eine Fraktur des proximalen Oberschenkels. Die Inzidenz von Hüftfrakturen steigt in jedem Jahrzehnt vom sechsten bis zum neunten Lebensjahrzehnt sowohl bei Frauen als auch bei Männern in allen Bevölkerungsgruppen an. Die höchste Inzidenz ist bei Männern und Frauen im Alter von 80 Jahren oder älter zu verzeichnen. ⓘ
Zwischen 35 und 50 % aller Frauen über 50 hatten mindestens eine Wirbelfraktur. In den Vereinigten Staaten treten jährlich 700.000 Wirbelbrüche auf, aber nur etwa ein Drittel davon wird erkannt. In einer Serie von 9704 Frauen im Alter von durchschnittlich 68,8 Jahren, die 15 Jahre lang untersucht wurden, hatten 324 bereits einen Wirbelbruch erlitten, als sie in die Studie aufgenommen wurden, und 18,2 % entwickelten einen Wirbelbruch, aber dieses Risiko stieg auf 41,4 % bei Frauen, die bereits einen Wirbelbruch hatten. ⓘ
In den Vereinigten Staaten sind jährlich 250.000 Handgelenksfrakturen auf Osteoporose zurückzuführen. Handgelenksfrakturen sind die dritthäufigste Form von osteoporotischen Frakturen. Das Lebenszeitrisiko, eine Colles-Fraktur zu erleiden, beträgt bei weißen Frauen etwa 16 %. Bis zum Alter von 70 Jahren haben etwa 20 % der Frauen mindestens eine Handgelenksfraktur erlitten. ⓘ
Brüchige Rippenfrakturen treten bei Männern bereits im Alter von 35 Jahren auf. Sie werden oft als Anzeichen von Osteoporose übersehen, da diese Männer häufig körperlich aktiv sind und die Fraktur bei einer körperlichen Aktivität, wie einem Sturz beim Wasserskifahren oder Jetskifahren, erleiden. ⓘ
Epidemiologie

Schätzungen zufolge leiden 200 Millionen Menschen an Osteoporose. Die Häufigkeit von Osteoporose nimmt mit dem Alter zu. Etwa 15 % der kaukasischen Bevölkerung in den 50er Jahren und 70 % der über 80-Jährigen sind betroffen. Sie tritt bei Frauen häufiger auf als bei Männern. In den Industrieländern sind je nach Diagnosemethode 2 bis 8 % der Männer und 9 bis 38 % der Frauen betroffen. Die Erkrankungsraten in den Entwicklungsländern sind unklar. ⓘ
Postmenopausale Frauen haben eine höhere Rate an Osteoporose und Knochenbrüchen als ältere Männer. Frauen nach der Menopause haben einen geringeren Östrogenspiegel, was zu ihrer höheren Osteoporoserate beiträgt. Eine 60-jährige Frau hat ein 44%iges Frakturrisiko, während ein 60-jähriger Mann ein 25%iges Frakturrisiko hat. ⓘ
Weltweit gibt es jährlich 8,9 Millionen Frakturen aufgrund von Osteoporose. Weltweit erleidet 1 von 3 Frauen und 1 von 5 Männern im Alter von über 50 Jahren eine osteoporotische Fraktur. Daten aus den Vereinigten Staaten zeigen einen Rückgang der Osteoporose in der Allgemeinbevölkerung und bei weißen Frauen von 18 % im Jahr 1994 auf 10 % im Jahr 2006. Weiße und asiatische Menschen haben ein höheres Risiko. Menschen afrikanischer Abstammung haben ein geringeres Risiko für osteoporosebedingte Frakturen, obwohl sie das höchste Risiko haben, nach einer osteoporotischen Fraktur zu sterben. ⓘ
Es hat sich gezeigt, dass der Breitengrad das Risiko für osteoporotische Frakturen beeinflusst. Gebiete in höheren Breitengraden, wie z. B. Nordeuropa, erhalten weniger Vitamin D durch das Sonnenlicht als Regionen, die näher am Äquator liegen, und haben daher höhere Frakturraten im Vergleich zu niedrigeren Breitengraden. So haben beispielsweise schwedische Männer und Frauen ein Risiko von 13 % bzw. 28,5 %, im Alter von 50 Jahren eine Hüftfraktur zu erleiden, während dieses Risiko bei chinesischen Männern und Frauen nur 1,9 % bzw. 2,4 % beträgt. Möglicherweise ist auch die Ernährung für diesen Unterschied verantwortlich, da Vitamin D, Kalzium, Magnesium und Folsäure alle mit der Knochenmineraldichte in Verbindung stehen. ⓘ
Es besteht auch ein Zusammenhang zwischen Zöliakie und einem erhöhten Osteoporoserisiko. In Studien mit prämenopausalen Frauen und Männern wurde eine Korrelation zwischen Zöliakie und Osteoporose und Osteopenie festgestellt. Zöliakie kann die Aufnahme von Nährstoffen wie Kalzium im Dünndarm vermindern, und eine glutenfreie Ernährung kann Menschen mit Zöliakie helfen, die normale Aufnahme im Darm wiederherzustellen. ⓘ
Im Jahr 2010 litten in der Europäischen Union etwa 22 Millionen Frauen und 5,5 Millionen Männer an Osteoporose. In den Vereinigten Staaten waren im Jahr 2010 etwa 8 Millionen Frauen und ein bis 2 Millionen Männer an Osteoporose erkrankt. Dies stellt aufgrund der Behandlungskosten, der langfristigen Arbeitsunfähigkeit und des Produktivitätsverlusts in der Erwerbsbevölkerung eine große wirtschaftliche Belastung für das Gesundheitssystem dar. Die EU gibt jährlich 37 Milliarden Euro für osteoporosebedingte Gesundheitskosten aus, und die USA geben jährlich schätzungsweise 19 Milliarden US-Dollar für damit verbundene Gesundheitskosten aus. ⓘ
Geschichte
Der Zusammenhang zwischen der altersbedingten Verringerung der Knochendichte geht auf die frühen 1800er Jahre zurück. Der französische Pathologe Jean Lobstein prägte den Begriff Osteoporose. Der amerikanische Endokrinologe Fuller Albright brachte Osteoporose mit der Postmenopause in Verbindung. ⓘ
Anthropologen haben Skelettreste untersucht, die einen Verlust der Knochendichte und damit verbundene strukturelle Veränderungen aufwiesen, die mit einer chronischen Unterernährung in dem landwirtschaftlichen Gebiet, in dem diese Menschen lebten, in Verbindung gebracht wurden. "Daraus folgt, dass die Verformung des Skeletts sowohl auf die schwere Arbeit in der Landwirtschaft als auch auf die chronische Unterernährung zurückzuführen ist", die zu der Osteoporose führte, die bei den Röntgenaufnahmen der Überreste festgestellt wurde. ⓘ
Diagnostik
Anamnese
Aus der Anamnese ergeben sich Rückenschmerzen als Leitsymptom osteoporotischer Wirbelkörperfrakturen, eine Verminderung der Körpergröße durch Sinterung von Wirbelkörpern und Kyphose/Skoliose der Wirbelsäule, Frakturen von Oberschenkelhals und distalem Radius. Hinzu kommt die Erfassung der o. g. Risikofaktoren für Osteoporose, insbesondere eine kalziumarme Ernährung, eine frühe Menopause und familiäre Belastungen sowie Hinweise auf andere systemische Knochenerkrankungen. ⓘ
Klinische Untersuchung
Im Rahmen der klinischen Untersuchung erfolgen die Messung der Körpergröße (Vergleich zu früheren Ergebnissen oder Angaben), die Feststellung einer Kyphose der Brustwirbelsäule beziehungsweise einer Skoliose der Lendenwirbelsäule, typische Hautfalten am Rücken („Tannenbaum-Phänomen“) und eine Verringerung des Abstands von Rippenbogen und Beckenkamm. ⓘ
Röntgen
Mittels einer Röntgenuntersuchung der Brust- und Lendenwirbelsäule werden Frakturen und Höhenminderungen aufgedeckt. Knochenbrüche infolge einer Osteoporose nach ihrer Häufigkeit:
- Wirbelkörper-Einbrüche (Sinterungen, Kompressionsfrakturen),
- Hüftgelenknahe Oberschenkelknochenbrüche (u. a. Schenkelhalsfrakturen),
- Handgelenknahe Speichenbrüche (distale Radiusfrakturen),
- Oberarmkopfbrüche (subcapitale Humerusfrakturen),
- Beckenbrüche. ⓘ
Biomarker
Biomarker, wie die erhöhte Ausscheidung von C-Telopeptiden des Typ I [Kollagen] über den Urin können für die Diagnose von Osteoporose und Osteoarthritis herangezogen werden sowie für die Einschätzung des momentanen Krankheitsverlaufs. ⓘ
Anton Eisenhauer, Physiker am Geomar in Kiel, und Kollegen entwickelten eine nichtinvasive, sensible Diagnosemethode, die frühzeitig den Knochenschwund anzeigt. Das Verfahren misst als Biomarker die Calcium-Konzentration in Blut und Urin anhand von Isotopen. Es erlaubt eine frühere Diagnose als bei der Standarddiagnose, die auf Absorptionsmessung von Röntgenstrahlen (Dual-Röntgen-Absorptiometrie, englisch Dual-energy X-rayabsorptiometry, DXA oder DEXA) beruht. Die Bestimmung der Calcium-Isotopie im Blut und/oder Urin kann zudem zur Verlaufskontrolle einer Osteoporose-Therapie genutzt werden. ⓘ
Knochendichte
Unter der Knochendichte (auch Knochenmineraldichte, englisch Bone density, bone mineral density (BMD)) versteht man das Verhältnis der mineralisierten Knochensubstanz zu einem definierten Knochenvolumen. ⓘ
Screening
Der Dachverband Osteologie empfiehlt eine Basisdiagnostik bei Frauen nach der Menopause und Männern über 60 Jahren, falls ⓘ
- bereits Knochenbrüche aufgetreten sind, die durch schwache Krafteinwirkung entstanden sind,
- Grundkrankheiten bestehen, die Einfluss auf die Knochen haben können, oder
- Risikofaktoren für Wirbelkörperfrakturen oder Hüftfrakturen vorhanden sind (DVO-Risikomodell 2006). ⓘ
Differentialdiagnose
Andere Erkrankungen, die primär mit einer verschlechterten Knochenqualität einhergehen, sind:
- die Osteomalazie
- die Hypophosphatasie (HPP). Diese tritt seltener auf, als die Osteoporose. Manche Formen der Hypophosphatasie werden erst im erwachsenen Alter symptomatisch und könnten zur Fehldiagnose einer Osteoporose führen. Eine erniedrigte Aktivität der alkalischen Phosphatase im Serum, sowie ein früher Milchzahn-Verlust und das Auftreten atypischer Frakturen (z. B. subtrochantäre laterale Femurfraktur) mit verzögerter Frakturheilung weisen auf eine HPP hin. Die Unterscheidung zwischen der Osteoporose und der HPP ist wichtig, da bei der HPP die Gabe von Bisphosphonaten kontraindiziert ist. ⓘ
Behandlungsmöglichkeiten und Prävention
Lebensweise
Körperliche Aktivität schützt vor Knochenschwund. Die Kräfte, die dabei auf den Knochen wirken, regen die knochenaufbauenden Zellen an, neue Knochensubstanz zu bilden. Empfohlen werden dabei vorwiegend gewichttragende Ausdauerübungen und muskelaufbauendes Training, sowie Aerobic. Daneben fördert ausreichende Sonnenlichtexposition, empfohlen wird mindestens eine halbe Stunde täglich, die Vitamin-D-Produktion der Haut. ⓘ
Verhinderung von Brüchen
Hüftprotektoren
Um osteoporotischen Oberschenkelhalsfrakturen vorzubeugen, werden Hüftprotektoren eingesetzt. Ein Cochrane-Review von 2014 kam zu dem Ergebnis, dass Hüftprotektoren das Risiko von Oberschenkelhalsfrakturen bei älteren Menschen reduzieren können. Die geringe Akzeptanz und Nutzung der Protektoren schränkt ihren prophylaktischen Wert ein. ⓘ
Zur Vorbeugung bzw. unterstützenden Behandlung der Osteoporose gibt es auch verschiedene Verfahren der alternativen Medizin. Die Behandlungskosten dieser Verfahren werden jedoch nicht von den gesetzlichen Krankenversicherungen gedeckt. ⓘ
Basische Ernährung
Eine Empfehlung, die jedoch weder wissenschaftlich abgesichert noch in den Leitlinien genannt wird, ist die der sog. basischen Ernährung oder der Einnahme von sog. Basensalzmischungen. Eine vermeintliche Übersäuerung des Körpers soll nach Angaben von Anhängern dieser Behandlungsmethode zu verstärktem Knochenschwund führen, da zur Neutralisation der Säure basische Calciumsalze (deren Existenz wissenschaftlich unbestritten ist) aus dem Knochengewebe gelöst würden (wie der Kalk aus einer Eierschale im Essigbad). Bei dieser Theorie werden allerdings die weitaus bedeutenderen Puffersysteme der Blutpuffer vernachlässigt. Es werden der Verzicht auf Bohnenkaffee, Schwarztee, Alkohol, Cola- und Limonadengetränke, tierisches Eiweiß (Fleisch, Wurst, Fisch), Fast Food und Fertiggerichte, die meisten Milchprodukte, Industriezucker, Süßstoffe, Süßigkeiten, Weißmehl und Weißmehlprodukte, Erdnüsse, Paranüsse usw. empfohlen und eine säurehemmende oder basenbildende Nahrung verordnet, bestehend etwa aus Gemüse- und Fruchtsäften, Kräutertee, Gemüse und Blattsalaten sowie Früchten. Die Regeln, nach denen ein Lebensmittel in säurebildend oder basisch einzuteilen ist, sind dabei nicht immer direkt nachvollziehbar, so wirkt beispielsweise Kaffee im Blut nicht etwa säurebildend, sondern schwach basisch. ⓘ
Eine basenreiche Kost sei demnach besonders förderlich für einen gesunden Knochenstoffwechsel. Es gibt zwar keine Untersuchung, die eine Minderung der Knochenbruchrate oder Steigerung der Knochendichte aufzeigt, aber es wird argumentiert, dass Studien zeigten, dass eine protein- und fleischreiche Kost den Calciumabbau aus den Knochen und die Calciumausscheidung über die Nieren fördere. In diesen Studien wird allerdings mit keinem Wort von einer säure- oder basenbildenden Kost gesprochen. ⓘ
Eine weitere Aussage der basischen Ernährungslehre ist, dass eine säurereiche Kost nicht nur im kranken, sondern auch im gesunden Organismus zu einer systematischen Übersäuerung führe, die im Alter mit abnehmender Nierenfunktion zunimmt. Diese postulierte Übersäuerung ist allerdings im Blut im Rahmen einer Blutgasanalyse nicht messbar. Eine Übersäuerung des Urins ist primär nur ein Zeichen dafür, dass die Blutpuffer und die Niere ihren Aufgaben nachkommen und Säuren ausscheiden. ⓘ
Bei zunehmender Übersäuerung erschöpften sich die Pufferreserven des Körpers, und Mineralstoffdepots in den Knochen würden verstärkt angegriffen. Zudem setze der Körper in einem sauren Milieu vermehrt entzündungsfördernde Proteine wie NF-κB, TNF-α und COX-2 frei, die den Knochenabbau beschleunigen. Diese Übersäuerungen finden sich allerdings nicht in einem gesunden Organismus bei regulärer Nahrungsaufnahme, sondern bei einer deutlichen Einschränkung der Funktion der Blutpuffer und der Ausscheidungsfunktion der Niere. ⓘ
Um dem Verlust von Knochensubstanz entgegenzuwirken, werden sogenannte basische Substanzen wie Kaliumcitrat empfohlen. Für Kaliumcitrat sei in klinischen Studien nachgewiesen, dass es dem Calciumverlust über die Niere und dem Calciumabbau aus den Knochen entgegenwirkt. So zeigte eine prospektive kontrollierte Interventionsstudie bei 161 postmenopausalen Frauen mit Osteopenie, dass die partielle Neutralisierung einer diätinduzierten Säurebelastung (mittels 30 mmol Kaliumcitrat pro Tag, entspricht 1,173 g Kalium) über einen Zeitraum von zwölf Monaten die Knochendichte signifikant erhöhe und die Knochenstruktur deutlich verbessere. Kaliumcitrat wirke dabei genauso effektiv wie Raloxifen, ein Östrogen-Rezeptor-Modulator, der bei der Behandlung und Prävention von Osteoporose bei postmenopausalen Frauen eingesetzt wird. Das Kaliumcitrat solle mit den Knochenmineralien Calcium und Magnesium sowie Vitamin D zugeführt werden, weil sich der Magnesiumgehalt im Knochen laut basischer Lehre genauso stark vermindere wie der des Calciums. ⓘ
Physikalische Verfahren
- Magnetfeldtherapie: pulsierende elektromagnetische Felder sollen den Knochenaufbau stimulieren.
- Vibrationstraining – auch biomechanische Stimulation (BMS): sie wurde ursprünglich zur Behandlung von russischen Kosmonauten entwickelt: Die zu behandelnde Person steht auf einer Platte, die in einem Frequenzbereich von 20 bis etwa 50 Hz vibriert und durch den Dehnreflex Muskelkontraktionen hervorruft. Die dabei auftretenden Kräfte sollen den Knochen zum Wachstum stimulieren (Mechanostat). ⓘ
Wirtschaftliche Aspekte
Mit jährlich etwa 2,5 bis 3 Milliarden Euro an direkten und indirekten Krankheitskosten in Deutschland hat die Osteoporose auch ein großes volkswirtschaftliches Gewicht. Deshalb wurde sie von der Weltgesundheitsorganisation (WHO) auf die Liste der zehn wichtigsten Erkrankungen gesetzt. ⓘ
Von Kritikern wird angeführt, dass die Neubewertung der Osteoporose in den 1990er Jahren durch die Pharmaindustrie und die Hersteller von Diagnostika gesteuert sei, die einen Absatzmarkt für neue diagnostische Geräte und Medikamente schaffen wollen (Disease Mongering). Andererseits lässt sich erst seit etwa 1985 die Knochendichte zuverlässig messen. Erst seitdem ist es überhaupt möglich, das Krankheitsbild schon vor dem Auftreten von Knochenbrüchen adäquat zu erfassen, präventiv zu behandeln und Frakturen zu verhindern. ⓘ


