Noradrenalin
 Skelettformel von Noradrenalin | |
 Kugel-Stab-Modell der zwitterionischen Form von Noradrenalin aus der Kristallstruktur | |
| Klinische Daten | |
|---|---|
| Andere Bezeichnungen |
|
| Physiologische Daten | |
| Quellgewebe | Locus coeruleus; sympathisches Nervensystem; Nebennierenmark |
| Ziel-Gewebe | systemweit |
| Rezeptoren | α1, α2, β1, β3 |
| Agonisten | Sympathomimetika, Clonidin, Isoprenalin |
| Antagonisten | Trizyklische Antidepressiva, Betablocker, Antipsychotika |
| Vorläufer | Dopamin |
| Biosynthese | Dopamin-β-Monooxygenase |
| Stoffwechsel | MAO-A; COMT |
| Bezeichner | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Chemische und physikalische Daten | |
| Formel | C8H11NO3 |
| Molare Masse | 169.180 g-mol-1 |
| 3D-Modell (JSmol) | |
SMILES
| |
InChI
| |
Noradrenalin (NE), auch Noradrenalin (NA) oder Noradrenalin genannt, ist eine organische Chemikalie aus der Familie der Katecholamine, die im Gehirn und im Körper sowohl als Hormon als auch als Neurotransmitter wirkt. Die Bezeichnung "Noradrenalin" (von lateinisch ad, "in der Nähe", und ren, "Niere") ist im Vereinigten Königreich gebräuchlicher, während "Noradrenalin" (von altgriechisch ἐπῐ́ (epí), "auf", und νεφρός (nephrós), "Niere") in den Vereinigten Staaten gewöhnlich bevorzugt wird. "Norepinephrin" ist auch der internationale Freiname für das Medikament. Unabhängig davon, welcher Name für die Substanz selbst verwendet wird, werden die Teile des Körpers, die sie produzieren oder von ihr beeinflusst werden, als noradrenerge bezeichnet. ⓘ
Die allgemeine Funktion von Noradrenalin besteht darin, das Gehirn und den Körper für Aktionen zu mobilisieren. Die Noradrenalinausschüttung ist im Schlaf am niedrigsten, steigt im Wachzustand an und erreicht in Stress- oder Gefahrensituationen, bei der so genannten Kampf-oder-Flucht-Reaktion, wesentlich höhere Werte. Im Gehirn steigert Noradrenalin die Erregung und Wachsamkeit, fördert die Wachsamkeit, verbessert die Bildung und den Abruf des Gedächtnisses und fokussiert die Aufmerksamkeit; es steigert auch Unruhe und Angst. Im übrigen Körper erhöht Noradrenalin die Herzfrequenz und den Blutdruck, löst die Freisetzung von Glukose aus den Energiespeichern aus, erhöht die Durchblutung der Skelettmuskulatur, verringert die Durchblutung des Magen-Darm-Systems und hemmt die Blasenentleerung und die Magen-Darm-Motilität. ⓘ
Im Gehirn wird Noradrenalin in kleinen Kernen produziert, die jedoch starke Auswirkungen auf andere Gehirnbereiche haben. Der wichtigste dieser Kerne ist der Locus coeruleus, der sich in der Pons befindet. Außerhalb des Gehirns wird Noradrenalin als Neurotransmitter von sympathischen Ganglien in der Nähe des Rückenmarks oder im Bauchraum sowie von Merkel-Zellen in der Haut verwendet. Es wird auch von den Nebennieren direkt in den Blutkreislauf abgegeben. Unabhängig davon, wie und wo es freigesetzt wird, wirkt Noradrenalin auf die Zielzellen, indem es an adrenerge Rezeptoren auf der Zelloberfläche bindet und diese aktiviert. ⓘ
Eine Reihe von medizinisch wichtigen Arzneimitteln wirkt, indem sie die Wirkung des Noradrenalinsystems verändern. Noradrenalin selbst wird häufig als injizierbares Medikament zur Behandlung von kritisch niedrigem Blutdruck eingesetzt. Betablocker, die einige der Wirkungen von Noradrenalin aufheben, indem sie dessen Rezeptoren blockieren, werden häufig zur Behandlung von Glaukom, Migräne und einer Reihe von Herz-Kreislauf-Problemen eingesetzt. Alphablocker, die einer anderen Reihe von Noradrenalinwirkungen entgegenwirken, werden zur Behandlung verschiedener kardiovaskulärer und psychiatrischer Erkrankungen eingesetzt. Alpha-2-Agonisten haben oft eine sedierende Wirkung und werden häufig als Anästhesieverstärker in der Chirurgie sowie bei der Behandlung von Drogen- oder Alkoholabhängigkeit eingesetzt. Viele wichtige Psychopharmaka üben starke Wirkungen auf das Noradrenalin-System im Gehirn aus, was zu Nebenwirkungen führt, die hilfreich oder schädlich sein können. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
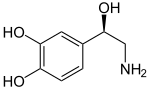
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Norepinephrin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H11NO3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
C01CA03 | ||||||||||||||||||
| Wirkstoffklasse |
| ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Schmelzpunkt |
| ||||||||||||||||||
| Löslichkeit |
in Wasser, Ethanol und Diethylether praktisch unlöslich | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
0,55 mg·kg−1 (LD50, Maus, i.v.) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Noradrenalin oder Norepinephrin (INN) ist ein körpereigener Botenstoff, der als Stresshormon und Neurotransmitter wirkt. Als Körperhormon wird die Substanz im Nebennierenmark gebildet; als Neurotransmitter dagegen im Nervensystem produziert (im Locus caeruleus). ⓘ
Noradrenalin ist ein Katecholamin und eng mit Adrenalin verwandt. Durch Verengung von Blutgefäßen erhöht es den Blutdruck. Wie die Vorsilbe Nor- anzeigt, trägt Noradrenalin im Vergleich zum Adrenalin keine Methylgruppe (-CH3) an seiner Aminogruppe. Daher zeigen Noradrenalin und Adrenalin zum Teil physiologisch unterschiedliche Wirkungen. ⓘ
| Katecholamine (Vergleich) ⓘ |
|---|
 Adrenalin |
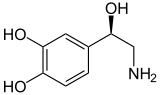 Noradrenalin |
Aufbau
Noradrenalin ist ein Katecholamin und ein Phenethylamin. Seine Struktur unterscheidet sich von der des Epinephrins nur dadurch, dass Epinephrin eine Methylgruppe an seinem Stickstoff trägt, während die Methylgruppe bei Noradrenalin durch ein Wasserstoffatom ersetzt ist. Die Vorsilbe nor- ist eine Abkürzung des Wortes "normal", das eine demethylierte Verbindung kennzeichnet. Norepinephrin besteht aus einer Catechin-Einheit (einem Benzolring mit zwei benachbarten Hydroxylgruppen in meta-para-Position) und einer Ethylamin-Seitenkette, die aus einer in benzylischer Position gebundenen Hydroxylgruppe besteht.
Biochemische Mechanismen
Biosynthese
Biosynthesewege von Katecholaminen und Spurenaminen im menschlichen Gehirn
|
Noradrenalin wird aus der Aminosäure Tyrosin durch eine Reihe von enzymatischen Schritten im Nebennierenmark und den postganglionären Neuronen des sympathischen Nervensystems synthetisiert. Während die Umwandlung von Tyrosin in Dopamin vorwiegend im Zytoplasma stattfindet, erfolgt die Umwandlung von Dopamin in Noradrenalin durch die Dopamin-β-Monooxygenase vorwiegend in den Neurotransmitter-Vesikeln. Der Stoffwechselweg ist:
- Phenylalanin → Tyrosin → L-DOPA → Dopamin → Norepinephrin ⓘ
Die direkte Vorstufe von Noradrenalin ist also Dopamin, das indirekt aus der essenziellen Aminosäure Phenylalanin oder der nicht-essenziellen Aminosäure Tyrosin synthetisiert wird. Diese Aminosäuren sind in fast allen Proteinen enthalten und werden durch die Aufnahme von proteinhaltigen Nahrungsmitteln zugeführt, wobei Tyrosin die häufigste ist. ⓘ
Phenylalanin wird durch das Enzym Phenylalaninhydroxylase in Tyrosin umgewandelt, wobei molekularer Sauerstoff (O2) und Tetrahydrobiopterin als Kofaktoren dienen. Tyrosin wird durch das Enzym Tyrosinhydroxylase in L-DOPA umgewandelt, wobei Tetrahydrobiopterin, O2 und wahrscheinlich Eisen (Fe2+) als Cofaktoren dienen. Die Umwandlung von Tyrosin in L-DOPA wird durch Metyrosin, ein Tyrosin-Analogon, gehemmt. L-DOPA wird durch das Enzym aromatische L-Aminosäure-Decarboxylase (auch DOPA-Decarboxylase genannt) in Dopamin umgewandelt, wobei Pyridoxalphosphat als Cofaktor dient. Dopamin wird dann durch das Enzym Dopamin-β-Monooxygenase (früher bekannt als Dopamin-β-Hydroxylase) in Noradrenalin umgewandelt, wobei O2 und Ascorbinsäure als Kofaktoren dienen. ⓘ
Norepinephrin selbst kann durch das Enzym Phenylethanolamin-N-Methyltransferase mit S-Adenosyl-L-Methionin als Cofaktor in Epinephrin umgewandelt werden. ⓘ
Abbau
Bei Säugetieren wird Noradrenalin rasch zu verschiedenen Metaboliten abgebaut. Der erste Schritt des Abbaus kann durch eines der Enzyme Monoaminoxidase (hauptsächlich Monoaminoxidase A) oder COMT katalysiert werden. Von dort aus kann der Abbau über eine Vielzahl von Wegen erfolgen. Die wichtigsten Endprodukte sind entweder Vanillylmandelsäure oder eine konjugierte Form von MHPG, die beide als biologisch inaktiv gelten und mit dem Urin ausgeschieden werden. ⓘ

Funktionen
Zelluläre Wirkungen
| Familie | Rezeptor | Typ | Mechanismus |
|---|---|---|---|
| Alpha | α1 | Gq-gekoppelt. | Erhöht IP3 und Kalzium durch Aktivierung der Phospholipase C. |
| α2 | Gi/Go-gekoppelt. | Verringert cAMP durch Hemmung der Adenylatcyclase. | |
| Beta | β1 | Gs-gekoppelt. | Erhöht cAMP durch Aktivierung der Adenylatzyklase. |
| β2 | |||
| β3 |
Wie viele andere biologisch aktive Substanzen entfaltet Noradrenalin seine Wirkung durch Bindung an und Aktivierung von Rezeptoren, die sich auf der Oberfläche von Zellen befinden. Es wurden zwei große Familien von Noradrenalinrezeptoren identifiziert, die als adrenerge Alpha- und Beta-Rezeptoren bezeichnet werden. Alpha-Rezeptoren werden in die Subtypen α1 und α2 unterteilt, Beta-Rezeptoren in die Subtypen β1, β2 und β3. Alle diese Rezeptoren funktionieren als G-Protein-gekoppelte Rezeptoren, was bedeutet, dass sie ihre Wirkung über ein komplexes Second-Messenger-System ausüben. Alpha-2-Rezeptoren haben in der Regel hemmende Wirkungen, aber viele von ihnen befinden sich präsynaptisch (d. h. auf der Oberfläche der Zellen, die Noradrenalin freisetzen), so dass der Nettoeffekt der Alpha-2-Aktivierung häufig eine Verringerung der freigesetzten Noradrenalinmenge ist. Alpha-1-Rezeptoren und alle drei Arten von Beta-Rezeptoren haben in der Regel erregende Wirkungen. ⓘ
Speicherung, Freisetzung und Wiederaufnahme

Im Gehirn funktioniert Noradrenalin als Neurotransmitter und wird durch eine Reihe von Mechanismen gesteuert, die allen Monoamin-Neurotransmittern gemeinsam sind. Nach der Synthese wird Noradrenalin durch den vesikulären Monoamintransporter (VMAT) aus dem Zytosol in die synaptischen Vesikel transportiert. VMAT kann durch Reserpin gehemmt werden, was zu einem Rückgang der Neurotransmitterspeicher führt. Noradrenalin wird in diesen Vesikeln gespeichert, bis es in den synaptischen Spalt ausgestoßen wird. Dies geschieht in der Regel, nachdem ein Aktionspotenzial die Vesikel dazu veranlasst, ihren Inhalt durch einen als Exozytose bezeichneten Prozess direkt in den synaptischen Spalt freizusetzen. ⓘ
In der Synapse angekommen, bindet Noradrenalin an Rezeptoren und aktiviert diese. Nach einem Aktionspotenzial werden die Noradrenalinmoleküle schnell von ihren Rezeptoren gelöst. Sie werden dann über die Wiederaufnahme, die hauptsächlich durch den Noradrenalin-Transporter (NET) vermittelt wird, wieder in die präsynaptische Zelle aufgenommen. Zurück im Zytosol kann Noradrenalin entweder durch Monoaminoxidase abgebaut oder durch VMAT in Vesikel verpackt werden, so dass es für eine spätere Freisetzung zur Verfügung steht. ⓘ
Sympathisches Nervensystem

Noradrenalin ist der wichtigste Neurotransmitter des sympathischen Nervensystems, das aus etwa zwei Dutzend sympathischen Kettenganglien neben dem Rückenmark sowie einer Reihe von prävertebralen Ganglien im Brust- und Bauchraum besteht. Diese sympathischen Ganglien sind mit zahlreichen Organen verbunden, darunter Augen, Speicheldrüsen, Herz, Lunge, Leber, Gallenblase, Magen, Darm, Nieren, Harnblase, Fortpflanzungsorgane, Muskeln, Haut und Nebennieren. Die sympathische Aktivierung der Nebennieren bewirkt, dass der als Nebennierenmark bezeichnete Teil Noradrenalin (wie auch Adrenalin) in den Blutkreislauf freisetzt, von wo aus es als Hormon in eine Vielzahl von Geweben gelangt. ⓘ
Im Großen und Ganzen besteht die Wirkung von Noradrenalin auf die einzelnen Zielorgane darin, deren Zustand so zu verändern, dass sie für eine aktive Bewegung des Körpers förderlicher sind, was häufig mit einem erhöhten Energieverbrauch und einem erhöhten Verschleiß einhergeht. Dem gegenüber stehen die durch Acetylcholin vermittelten Wirkungen des Parasympathikus, der die meisten der gleichen Organe in einen Zustand versetzt, der Ruhe, Erholung und Nahrungsverdauung begünstigt und in der Regel weniger Energie verbraucht. ⓘ
Zu den sympathischen Wirkungen des Noradrenalins gehören:
- In den Augen wird die Tränenproduktion erhöht, wodurch die Augen feuchter werden, und die Pupillen erweitern sich durch die Kontraktion des Iris-Dilatators.
- Im Herzen erhöht es die Blutmenge, die gepumpt wird.
- Im braunen Fettgewebe eine Steigerung des Kalorienverbrauchs zur Erzeugung von Körperwärme (Thermogenese).
- Vielfältige Auswirkungen auf das Immunsystem. Das sympathische Nervensystem ist der primäre Weg der Interaktion zwischen dem Immunsystem und dem Gehirn, und mehrere Komponenten erhalten sympathische Inputs, einschließlich Thymus, Milz und Lymphknoten. Die Auswirkungen sind jedoch komplex, wobei einige Immunprozesse aktiviert und andere gehemmt werden.
- In den Arterien kommt es zu einer Verengung der Blutgefäße und damit zu einem Anstieg des Blutdrucks.
- In den Nieren: Freisetzung von Renin und Rückhaltung von Natrium im Blutkreislauf.
- In der Leber kommt es zu einem Anstieg der Glukoseproduktion, entweder durch Glykogenolyse nach einer Mahlzeit oder durch Glukoneogenese, wenn keine Nahrung aufgenommen wurde. Glukose ist unter den meisten Bedingungen die Hauptenergiequelle des Körpers.
- In der Bauchspeicheldrüse wird vermehrt Glukagon ausgeschüttet, ein Hormon, dessen Hauptwirkung darin besteht, die Produktion von Glukose in der Leber zu steigern.
- In der Skelettmuskulatur kommt es zu einer erhöhten Glukoseaufnahme.
- Im Fettgewebe (d. h. in den Fettzellen) kommt es zu einem Anstieg der Lipolyse, d. h. der Umwandlung von Fett in Substanzen, die von den Muskeln und anderen Geweben direkt als Energiequelle genutzt werden können.
- Im Magen und Darm kommt es zu einer Verringerung der Verdauungsaktivität. Dies ist auf eine allgemein hemmende Wirkung von Noradrenalin auf das enterische Nervensystem zurückzuführen, die zu einer Verringerung der Magen-Darm-Beweglichkeit, des Blutflusses und der Sekretion von Verdauungsstoffen führt. ⓘ
Noradrenalin und ATP sind sympathische Co-Transmitter. Es wurde festgestellt, dass das Endocannabinoid Anandamid und das Cannabinoid WIN 55,212-2 die Gesamtreaktion auf die Stimulation des sympathischen Nervs verändern können, was darauf hindeutet, dass präfunktionelle CB1-Rezeptoren die sympatho-inhibitorische Wirkung vermitteln. Somit können Cannabinoide sowohl die noradrenergen als auch die purinergen Komponenten der sympathischen Neurotransmission hemmen. ⓘ
Zentrales Nervensystem

Die noradrenergen Neuronen im Gehirn bilden ein Neurotransmittersystem, das, wenn es aktiviert wird, Wirkungen auf große Bereiche des Gehirns ausübt. Die Wirkungen äußern sich in Wachheit, Erregung und Handlungsbereitschaft. ⓘ
Noradrenerge Neuronen (d. h. Neuronen, deren primärer Neurotransmitter Noradrenalin ist) sind vergleichsweise wenige, und ihre Zellkörper sind auf wenige, relativ kleine Hirnareale beschränkt, aber sie senden Projektionen in viele andere Hirnareale und üben starke Wirkungen auf ihre Ziele aus. Diese noradrenergen Zellgruppen wurden erstmals 1964 von Annica Dahlström und Kjell Fuxe kartiert, die ihnen Bezeichnungen gaben, die mit dem Buchstaben "A" (für "aminerge") beginnen. In ihrem Schema enthalten die Bereiche A1 bis A7 den Neurotransmitter Noradrenalin (A8 bis A14 enthalten Dopamin). Die noradrenerge Zellgruppe A1 befindet sich im kaudalen ventrolateralen Teil der Medulla und spielt eine Rolle bei der Steuerung des Flüssigkeitsstoffwechsels. Die noradrenerge Zellgruppe A2 befindet sich in einem Bereich des Hirnstamms, dem so genannten solitären Kern; diese Zellen werden mit einer Vielzahl von Reaktionen in Verbindung gebracht, einschließlich der Kontrolle der Nahrungsaufnahme und der Reaktion auf Stress. Die Zellgruppen A5 und A7 projizieren hauptsächlich in das Rückenmark. ⓘ
Die wichtigste Quelle für Noradrenalin im Gehirn ist der Locus coeruleus, der die noradrenerge Zellgruppe A6 enthält und an die Zellgruppe A4 angrenzt. Der Locus coeruleus ist in absoluten Zahlen recht klein - bei Primaten enthält er schätzungsweise 15.000 Neuronen, also weniger als ein Millionstel der Neuronen im Gehirn -, aber er sendet Projektionen in jeden größeren Teil des Gehirns und auch in das Rückenmark. ⓘ
Das Aktivitätsniveau des Locus coeruleus korreliert weitgehend mit der Wachsamkeit und Reaktionsgeschwindigkeit. Die Aktivität des LC ist im Schlaf gering und sinkt während der REM-Phase (Träumen) praktisch auf Null. Im Wachzustand bleibt sie auf einem niedrigen Niveau, steigt aber vorübergehend an, wenn eine Person mit irgendeinem Reiz konfrontiert wird, der ihre Aufmerksamkeit erregt. Unangenehme Reize wie Schmerzen, Atembeschwerden, Blasenausdehnung, Hitze oder Kälte führen zu einem stärkeren Anstieg. Extrem unangenehme Zustände wie intensive Angst oder starke Schmerzen sind mit einer sehr hohen LC-Aktivität verbunden. ⓘ
Das vom Locus coeruleus freigesetzte Noradrenalin beeinflusst die Gehirnfunktion auf verschiedene Weise. Es verbessert die Verarbeitung von Sinneseindrücken, die Aufmerksamkeit, die Bildung und den Abruf von Langzeit- und Arbeitsgedächtnis und die Fähigkeit des Gehirns, auf Eingaben zu reagieren, indem es das Aktivitätsmuster im präfrontalen Kortex und anderen Bereichen verändert. Die Kontrolle des Erregungsniveaus ist so stark, dass eine medikamentöse Unterdrückung des LC eine starke sedierende Wirkung hat. ⓘ
Es besteht eine große Ähnlichkeit zwischen Situationen, die den Locus coeruleus im Gehirn aktivieren, und Situationen, die das sympathische Nervensystem in der Peripherie aktivieren: Der LC mobilisiert im Wesentlichen das Gehirn für Aktionen, während das sympathische System den Körper mobilisiert. Es wurde argumentiert, dass diese Ähnlichkeit dadurch entsteht, dass beide zu einem großen Teil von denselben Hirnstrukturen gesteuert werden, insbesondere von einem Teil des Hirnstamms, dem Nucleus gigantocellularis. ⓘ
Haut
Noradrenalin wird auch von den Merkel-Zellen produziert, die Teil des somatosensorischen Systems sind. Es aktiviert das afferente sensorische Neuron. ⓘ
Pharmakologie
Zahlreiche wichtige Arzneimittel entfalten ihre Wirkung durch Wechselwirkung mit dem Noradrenalin-System im Gehirn oder im Körper. Sie werden unter anderem zur Behandlung von Herz-Kreislauf-Problemen, Schockzuständen und einer Reihe von psychiatrischen Erkrankungen eingesetzt. Diese Arzneimittel werden unterteilt in: Sympathomimetika, die zumindest einige der Wirkungen des vom sympathischen Nervensystem freigesetzten Noradrenalins nachahmen oder verstärken; Sympatholytika hingegen blockieren zumindest einige der Wirkungen. Beides sind große Gruppen mit unterschiedlichen Verwendungszwecken, je nachdem, welche Wirkungen genau verstärkt oder blockiert werden. ⓘ
Noradrenalin selbst wird als Sympathomimetikum eingestuft: Seine Wirkung bei intravenöser Verabreichung, die Herzfrequenz und -kraft zu erhöhen und die Blutgefäße zu verengen, macht es sehr nützlich für die Behandlung medizinischer Notfälle, die mit einem kritisch niedrigen Blutdruck einhergehen. Die Surviving Sepsis Campaign empfiehlt Noradrenalin als Mittel der ersten Wahl bei der Behandlung eines septischen Schocks, der nicht auf die Wiederbelebung mit Flüssigkeit anspricht, ergänzt durch Vasopressin und Epinephrin. Dopamin wird nur bei sehr ausgewählten Patienten eingesetzt. ⓘ
Betablocker
Dabei handelt es sich um Sympatholytika, die die Wirkung von Beta-Adrenozeptoren blockieren, während sie auf Alpha-Rezeptoren wenig oder gar keine Wirkung haben. Sie werden manchmal zur Behandlung von Bluthochdruck, Vorhofflimmern und kongestiver Herzinsuffizienz eingesetzt, aber neuere Überprüfungen haben ergeben, dass andere Arten von Medikamenten für diese Zwecke in der Regel besser geeignet sind. Betablocker können aber auch bei anderen kardiovaskulären Erkrankungen wie Angina pectoris und Marfan-Syndrom eine gute Wahl sein. Sie werden auch häufig zur Behandlung des Glaukoms eingesetzt, meist in Form von Augentropfen. Aufgrund ihrer Wirkung bei der Verringerung von Angstsymptomen und Tremor werden sie gelegentlich von Entertainern, Rednern und Sportlern zur Verringerung von Leistungsangst eingesetzt, obwohl sie für diesen Zweck nicht medizinisch zugelassen und vom Internationalen Olympischen Komitee verboten sind. ⓘ
Der Nutzen von Betablockern wird jedoch durch eine Reihe schwerwiegender Nebenwirkungen eingeschränkt, darunter Verlangsamung der Herzfrequenz, Blutdruckabfall, Asthma und reaktive Hypoglykämie. Die negativen Auswirkungen können bei Diabetikern besonders schwerwiegend sein. ⓘ
Alphablocker
Hierbei handelt es sich um Sympatholytika, die die Wirkung der adrenergen Alpharezeptoren blockieren, während sie auf die Betarezeptoren wenig oder gar nicht wirken. Medikamente dieser Gruppe können jedoch sehr unterschiedliche Wirkungen haben, je nachdem, ob sie hauptsächlich Alpha-1-Rezeptoren, Alpha-2-Rezeptoren oder beide blockieren. Alpha-2-Rezeptoren befinden sich, wie an anderer Stelle in diesem Artikel beschrieben, häufig auf den Noradrenalin freisetzenden Neuronen selbst und haben hemmende Wirkungen auf diese; folglich führt die Blockade von Alpha-2-Rezeptoren in der Regel zu einem Anstieg der Noradrenalinfreisetzung. Alpha-1-Rezeptoren befinden sich in der Regel auf den Zielzellen und haben auf diese eine erregende Wirkung; folglich führt eine Blockade der Alpha-1-Rezeptoren in der Regel zu einer Blockierung einiger der Wirkungen von Noradrenalin. Medikamente wie Phentolamin, die auf beide Arten von Rezeptoren wirken, können eine komplexe Kombination beider Wirkungen erzeugen. In den meisten Fällen, in denen der Begriff "Alphablocker" ohne Einschränkung verwendet wird, bezieht er sich auf einen selektiven Alpha-1-Antagonisten. ⓘ
Selektive Alpha-1-Blocker werden auf vielfältige Weise eingesetzt. Da eine ihrer Wirkungen darin besteht, die Kontraktion der glatten Muskulatur in der Prostata zu hemmen, werden sie häufig zur Behandlung der Symptome einer gutartigen Prostatahyperplasie eingesetzt. Alpha-Blocker helfen wahrscheinlich auch beim Abgang von Nierensteinen. Aufgrund ihrer Wirkung auf das zentrale Nervensystem sind sie nützlich bei der Behandlung von generalisierten Angststörungen, Panikstörungen und posttraumatischen Belastungsstörungen. Sie können jedoch erhebliche Nebenwirkungen haben, darunter einen Blutdruckabfall. ⓘ
Einige Antidepressiva wirken teilweise als selektive Alpha-2-Blocker. Das bekannteste Medikament dieser Klasse ist Yohimbin, das aus der Rinde des afrikanischen Yohimbe-Baums gewonnen wird. Yohimbin wirkt als männliches Potenzmittel, aber seine Nützlichkeit für diesen Zweck wird durch schwerwiegende Nebenwirkungen wie Angstzustände und Schlaflosigkeit eingeschränkt. Eine Überdosis kann zu einem gefährlichen Anstieg des Blutdrucks führen. Yohimbin ist in vielen Ländern verboten, aber in den Vereinigten Staaten wird es, da es aus einer Pflanze extrahiert und nicht chemisch synthetisiert wird, als Nahrungsergänzungsmittel frei verkäuflich. ⓘ
Alpha-2-Agonisten
Dies sind Sympathomimetika, die Alpha-2-Rezeptoren aktivieren oder deren Wirkung verstärken. Da Alpha-2-Rezeptoren hemmend wirken und viele von ihnen präsynaptisch auf Noradrenalin freisetzenden Zellen lokalisiert sind, besteht der Nettoeffekt dieser Medikamente in der Regel darin, die Menge des freigesetzten Noradrenalins zu verringern. Medikamente aus dieser Gruppe, die ins Gehirn gelangen können, haben aufgrund ihrer hemmenden Wirkung auf den Locus coeruleus oft eine stark sedierende Wirkung. Clonidin beispielsweise wird zur Behandlung von Angstzuständen und Schlaflosigkeit eingesetzt, aber auch als sedierendes Prämedikationsmittel für Patienten, die sich einer Operation unterziehen müssen. Xylazin, ein weiteres Medikament dieser Gruppe, ist ebenfalls ein starkes Beruhigungsmittel und wird häufig in Kombination mit Ketamin als Vollnarkose bei tierärztlichen Eingriffen eingesetzt - in den Vereinigten Staaten ist es nicht für die Anwendung beim Menschen zugelassen. ⓘ
Stimulanzien und Antidepressiva
Dies sind Medikamente, deren Hauptwirkung vermutlich durch verschiedene Neurotransmittersysteme vermittelt wird (Dopamin bei Stimulanzien, Serotonin bei Antidepressiva), aber viele erhöhen auch den Noradrenalinspiegel im Gehirn. Amphetamin zum Beispiel ist ein Stimulans, das sowohl die Freisetzung von Noradrenalin als auch von Dopamin erhöht. Monoaminoxidase-Hemmer sind Antidepressiva, die den metabolischen Abbau von Noradrenalin sowie von Serotonin und Dopamin hemmen. In einigen Fällen ist es schwierig, die Noradrenalin-vermittelten Wirkungen von den Wirkungen anderer Neurotransmitter zu unterscheiden. ⓘ
Krankheiten und Störungen
Eine Reihe wichtiger medizinischer Probleme ist mit einer Störung des Noradrenalin-Systems im Gehirn oder im Körper verbunden. ⓘ
Überaktivierung des Sympathikus
Eine Überaktivierung des Sympathikus ist keine anerkannte Krankheit an sich, aber sie ist Bestandteil einer Reihe von Erkrankungen sowie eine mögliche Folge der Einnahme von sympathomimetischen Arzneimitteln. Sie verursacht eine Reihe von Symptomen, darunter Schmerzen, Herzrasen, erhöhter Blutdruck, Schwitzen, Herzklopfen, Angstzustände, Kopfschmerzen, Blässe und ein Absinken des Blutzuckerspiegels. Wenn die sympathische Aktivität über einen längeren Zeitraum erhöht ist, kann sie zu Gewichtsverlust und anderen stressbedingten Veränderungen des Körpers führen. ⓘ
Die Liste der Erkrankungen, die eine Überaktivierung des Sympathikus verursachen können, umfasst schwere Hirnverletzungen, Rückenmarksschäden, Herzversagen, Bluthochdruck, Nierenerkrankungen und verschiedene Arten von Stress. ⓘ
Phäochromozytom
Ein Phäochromozytom ist ein selten auftretender Tumor des Nebennierenmarks, der entweder durch genetische Faktoren oder bestimmte Krebsarten verursacht wird. Die Folge ist ein massiver Anstieg der Noradrenalin- und Adrenalinmenge, die in den Blutkreislauf gelangt. Die offensichtlichsten Symptome sind die einer Überaktivierung des Sympathikus, insbesondere ein Anstieg des Blutdrucks, der tödliche Werte erreichen kann. Die wirksamste Behandlung ist die chirurgische Entfernung des Tumors. ⓘ
Stress
Unter Stress versteht der Physiologe jede Situation, die die Stabilität des Körpers und seiner Funktionen bedroht. Stress wirkt sich auf eine Vielzahl von Körpersystemen aus: Die beiden am stärksten aktivierten sind die Hypothalamus-Hypophysen-Nebennieren-Achse und das Noradrenalin-System, zu dem sowohl das sympathische Nervensystem als auch das Locus-Coeruleus-System im Gehirn gehören. Stressoren verschiedenster Art lösen einen Anstieg der noradrenergen Aktivität aus, die das Gehirn und den Körper mobilisiert, um der Bedrohung zu begegnen. Chronischer Stress kann, wenn er über einen längeren Zeitraum anhält, viele Teile des Körpers schädigen. Ein erheblicher Teil der Schäden ist auf die Auswirkungen der anhaltenden Noradrenalinausschüttung zurückzuführen, da Noradrenalin generell die Funktion hat, Ressourcen von der Erhaltung, Regeneration und Reproduktion auf Systeme zu lenken, die für die aktive Bewegung erforderlich sind. Zu den Folgen können eine Verlangsamung des Wachstums (bei Kindern), Schlaflosigkeit, Libidoverlust, Magen-Darm-Probleme, eine geringere Krankheitsresistenz, eine langsamere Heilung von Verletzungen, Depressionen und eine erhöhte Anfälligkeit für Abhängigkeiten gehören. ⓘ
ADHS
Die Aufmerksamkeitsdefizit-Hyperaktivitätsstörung ist eine psychiatrische Erkrankung, die mit Aufmerksamkeitsproblemen, Hyperaktivität und Impulsivität einhergeht. Am häufigsten wird sie mit Stimulanzien wie Methylphenidat (Ritalin) behandelt, deren Hauptwirkung darin besteht, den Dopaminspiegel im Gehirn zu erhöhen. Die Medikamente dieser Gruppe erhöhen jedoch im Allgemeinen auch den Noradrenalinspiegel im Gehirn, und es ist schwierig festzustellen, ob diese Wirkungen an ihrem klinischen Nutzen beteiligt sind. Es gibt auch zahlreiche Hinweise darauf, dass viele Menschen mit ADHS Biomarker aufweisen, die auf eine veränderte Verarbeitung von Noradrenalin hindeuten. Mehrere Medikamente, die in erster Linie auf Noradrenalin wirken, darunter Guanfacin, Clonidin und Atomoxetin, wurden zur Behandlung von ADHS erprobt, und es wurde festgestellt, dass ihre Wirkung mit der von Stimulanzien vergleichbar ist. ⓘ
Autonomes Versagen
Mehrere Erkrankungen, darunter die Parkinson-Krankheit, Diabetes und die so genannte reine autonome Insuffizienz, können zu einem Verlust der Noradrenalin produzierenden Neuronen im sympathischen Nervensystem führen. Die Symptome sind weit verbreitet, wobei die schwerwiegendsten eine Verringerung der Herzfrequenz und ein extremer Abfall des Ruheblutdrucks sind, so dass es für schwer betroffene Menschen unmöglich ist, länger als ein paar Sekunden zu stehen, ohne in Ohnmacht zu fallen. Die Behandlung kann mit einer Ernährungsumstellung oder mit Medikamenten erfolgen. ⓘ
Vergleichende Biologie und Evolution

Norepinephrin kommt bei einer Vielzahl von Tierarten vor, darunter Protozoen, Placozoen und Cnidaria (Quallen und verwandte Arten), nicht aber bei Ctenophoren (Kammquallen), deren Nervensystem sich stark von dem anderer Tiere unterscheidet. In den Deuterostomiern (Wirbeltiere usw.) ist es im Allgemeinen vorhanden, aber in den Protostomiern (Gliederfüßer, Weichtiere, Plattwürmer, Fadenwürmer, Ringelwürmer usw.) wird es durch Octopamin ersetzt, eine eng verwandte Chemikalie mit einem eng verwandten Syntheseweg. Bei Insekten hat Octopamin alarmierende und aktivierende Funktionen, die (zumindest grob) den Funktionen des Noradrenalins bei Wirbeltieren entsprechen. Es wurde behauptet, dass sich das Octopamin entwickelt hat, um das Noradrenalin zu ersetzen, und nicht umgekehrt; allerdings wurde berichtet, dass das Nervensystem von Amphoxus (einem primitiven Chordatier) zwar Octopamin, aber kein Noradrenalin enthält, was diese Hypothese erschwert. ⓘ
Geschichte
Anfang des 20. Jahrhunderts entwickelten Walter Cannon, der die Idee eines sympathoadrenalen Systems, das den Körper auf Kampf und Flucht vorbereitet, populär gemacht hatte, und sein Kollege Arturo Rosenblueth die Theorie zweier Sympathine, Sympathin E (erregend) und Sympathin I (hemmend), die für diese Aktionen verantwortlich sind. Der belgische Pharmakologe Zénon Bacq sowie kanadische und US-amerikanische Pharmakologen schlugen zwischen 1934 und 1938 vor, dass Noradrenalin ein Sympathikustransmitter sein könnte. Im Jahr 1939 identifizierten Hermann Blaschko und Peter Holtz unabhängig voneinander den Biosynthesemechanismus für Noradrenalin im Wirbeltierkörper. 1945 veröffentlichte Ulf von Euler die erste einer Reihe von Arbeiten, die die Rolle von Noradrenalin als Neurotransmitter belegten. Er wies das Vorhandensein von Noradrenalin in sympathisch innervierten Geweben und im Gehirn nach und erbrachte den Nachweis, dass es sich um das Sympathin von Cannon und Rosenblueth handelt. Stanley Peart war der erste, der die Freisetzung von Noradrenalin nach der Stimulation von Sympathikusnerven nachwies. ⓘ
Das Noradrenalin wurde 1948 von Peter Holtz entdeckt, der es zu dieser Zeit noch Norepinephrin nannte. Durch diese Entdeckung konnte wenige Zeit später die physiologische Wirkung der beiden Nebennierenhormone (Noradrenalin und Adrenalin) geklärt werden. 1949 führte M. Goldenberg das Noradrenalin zur Therapie bei schwerem Schock ein. ⓘ
Wirkung als Hormon
Noradrenalin wird neben dem Adrenalin als Hormon in den Nebennieren produziert und ins Blut abgegeben (Fluchtreflex). Es wirkt vorwiegend an den Arteriolen und führt über Aktivierung von Adrenozeptoren zu einer Engstellung dieser Gefäße und damit zu einer Blutdrucksteigerung. ⓘ
Klinische Angaben
Biochemie
Noradrenalin gehört, wie beispielsweise auch Adrenalin und Dopamin, zur Gruppe der Katecholamine. Sein natürliches Stereoisomer ist L-(−)-Noradrenalin [Synonym: (R)-Noradrenalin], und dessen Enantiomer D-(+)-Noradrenalin [Synonym: (S)-Noradrenalin] ist physiologisch unbedeutend. ⓘ
Die Produktion von Noradrenalin erfolgt in den Nebennieren und im Nervensystem aus Dopamin mittels des Enzyms Dopaminhydroxylase. Als Kofaktor und Elektronendonator spielt Vitamin C eine Rolle. ⓘ
Pathologische Relevanz
Eine pathologisch erhöhte Konzentration an Noradrenalin im Blut findet sich beim Krankheitsbild der Herzinsuffizienz. ⓘ
Anwendung als Arzneistoff
Noradrenalin wird als Notfall-Arzneimittel in der Intensivmedizin (bei Erwachsenen in einer Dosierung von 2–16 µg/min) verwendet. Es leistet gute Dienste bei der Behandlung von folgenden Krankheitsbildern:
- anaphylaktischer Schock
- Hypotonie
- kardiogener Schock
- septischer Schock
- Vergiftungen mit Vasodilatation ⓘ
Es wird dabei intravenös meistens mittels Spritzenpumpe verabreicht. Noradrenalin soll so niedrig wie möglich dosiert werden, da es dem Herzen die Pumparbeit erschwert. Hauptzielparameter der Dosierung ist eine ausreichende Nierenausscheidung. Meist wird Noradrenalin mit einer relativ hohen Flüssigkeitsgabe kombiniert, um das intravasale Volumen aufzufüllen. ⓘ
Kontraindikationen
Noradrenalin darf nicht oder nur sehr vorsichtig bei folgenden Zuständen angewandt werden:
- Bluthochdruck (arterielle Hypertonie)
- Cor pulmonale
- Engwinkelglaukom
- Hyperthyreose
- Phäochromozytom
- schwerer Arteriosklerose mit Stenosen
- schwerer Koronarsklerose oder schwerer Herzmuskelinsuffizienz
- schwerer Niereninsuffizienz
- Supraventrikuläre Tachykardie
- Tachyarrhythmie
- Vergrößerung der Prostata mit Restharnbildung ⓘ
Handelsnamen
Monopräparate: Arterenol (D), sowie als Generikum (CH)
Kombinationspräparate: Scandonest (CH) ⓘ



