Immunsystem
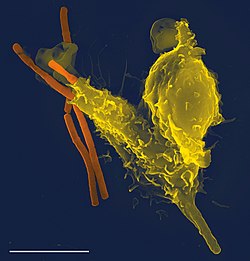
Das Immunsystem ist ein Netzwerk biologischer Prozesse, das einen Organismus vor Krankheiten schützt. Es erkennt und reagiert auf eine Vielzahl von Krankheitserregern, von Viren bis hin zu parasitären Würmern, sowie auf Krebszellen und Gegenstände wie Holzsplitter, und unterscheidet sie vom gesunden Gewebe des Organismus. Bei vielen Arten gibt es zwei große Untersysteme des Immunsystems. Das angeborene Immunsystem bietet eine vorkonfigurierte Reaktion auf eine breite Palette von Situationen und Reizen. Das adaptive Immunsystem liefert eine maßgeschneiderte Antwort auf jeden Reiz, indem es lernt, Moleküle zu erkennen, denen es zuvor begegnet ist. Beide Systeme verwenden Moleküle und Zellen, um ihre Funktionen zu erfüllen. ⓘ
Nahezu alle Organismen verfügen über eine Art von Immunsystem. Bakterien haben ein rudimentäres Immunsystem in Form von Enzymen, die vor Virusinfektionen schützen. Andere grundlegende Immunmechanismen haben sich in alten Pflanzen und Tieren entwickelt und sind auch in ihren modernen Nachkommen erhalten geblieben. Zu diesen Mechanismen gehören die Phagozytose, antimikrobielle Peptide, so genannte Defensine, und das Komplementsystem. Wirbeltiere mit Kiefer, einschließlich des Menschen, verfügen über noch ausgefeiltere Abwehrmechanismen, darunter die Fähigkeit, sich anzupassen, um Krankheitserreger effizienter zu erkennen. Die adaptive (oder erworbene) Immunität schafft ein immunologisches Gedächtnis, das bei späteren Begegnungen mit demselben Krankheitserreger zu einer verstärkten Reaktion führt. Dieser Prozess der erworbenen Immunität ist die Grundlage der Impfung. ⓘ
Eine Störung des Immunsystems kann Autoimmunerkrankungen, entzündliche Erkrankungen und Krebs verursachen. Eine Immunschwäche liegt vor, wenn das Immunsystem weniger aktiv als normal ist, was zu wiederkehrenden und lebensbedrohlichen Infektionen führt. Beim Menschen kann Immundefizienz die Folge einer genetischen Erkrankung wie der schweren kombinierten Immundefizienz, einer erworbenen Erkrankung wie HIV/AIDS oder der Einnahme immunsuppressiver Medikamente sein. Autoimmunität entsteht durch ein hyperaktives Immunsystem, das normales Gewebe angreift, als handele es sich um fremde Organismen. Zu den häufigen Autoimmunkrankheiten gehören die Hashimoto-Thyreoiditis, die rheumatoide Arthritis, Diabetes mellitus Typ 1 und der systemische Lupus erythematodes. Die Immunologie umfasst die Untersuchung aller Aspekte des Immunsystems. ⓘ
Als Immunsystem (von lateinisch immunis ‚unberührt, frei, rein‘ und altgriechisch sýstēma „aus mehreren Einzelteilen zusammengesetztes Ganzes“) wird das biologische Abwehrsystem höherer Lebewesen bezeichnet, das Gewebeschädigungen durch Krankheitserreger verhindert. Dieses körpereigene Abwehrsystem entfernt in den Körper eingedrungene Mikroorganismen, fremde Substanzen und ist außerdem in der Lage, fehlerhaft gewordene körpereigene Zellen zu zerstören. Das Immunsystem ist ein komplexes Netzwerk aus verschiedenen Organen, Zelltypen und Molekülen und der zentrale Forschungsgegenstand der Immunologie. ⓘ
Das Immunsystem hat eine große Bedeutung für die körperliche Unversehrtheit von Lebewesen, denn praktisch alle Organismen sind ständig den Einflüssen der Umwelt ausgesetzt; manche dieser Einflüsse stellen eine Bedrohung dar: Wenn schädliche Mikroorganismen in den Körper eindringen, kann dies zu Funktionsstörungen und Krankheiten führen. Typische Krankheitserreger sind Bakterien, Viren und Pilze sowie einzellige (z. B. Protozoen wie Plasmodien) beziehungsweise mehrzellige Parasiten (z. B. Bandwürmer). ⓘ
Auch Veränderungen im Inneren des Körpers können die Existenz eines Lebewesens bedrohen: Wenn normale Körperzellen im Laufe der Zeit ihre gesunde Funktion verlieren, dann sterben sie meist ab und müssen abgebaut werden (Nekrose) oder bauen sich dabei selbst ab (Apoptose). In seltenen Fällen können sie auch krankhaft entarten und zur Entstehung von Krebs führen. ⓘ
Alle Lebewesen verfügen daher über Schutzfunktionen. Schon einfache Organismen besitzen solche Abwehrmechanismen, die eine sogenannte angeborene Immunantwort vermitteln. Diese entstand bereits sehr früh in der Stammesgeschichte der Lebewesen und wurde seitdem weitgehend unverändert beibehalten. Die Wirbeltiere entwickelten zusätzlich eine adaptive Immunabwehr. Diese komplexe, anpassungsfähige Komponente des Immunsystems schützt noch effektiver als die angeborene Immunantwort vor Infektionskrankheiten. ⓘ
Die pflanzliche Immunantwort hat Ähnlichkeiten mit der angeborenen Immunantwort bei Tieren. Pflanzen besitzen keine adaptive Immunantwort, also auch keine T-Zellen oder Antikörper. ⓘ
Abwehrsysteme gibt es aber nicht nur bei diesen Eukaryoten, sondern auch bei Prokaryoten (CRISPR und SPARTA bei Bakterien und Archaeen gegen Viren und Plasmide) und sogar bei Riesenviren (MIMIVIRE bei den Mimiviridae gegen Virophagen). ⓘ
Vielschichtige Verteidigung
Das Immunsystem schützt seinen Wirt mit einem mehrschichtigen Abwehrsystem von zunehmender Spezifität vor Infektionen. Physikalische Barrieren verhindern, dass Krankheitserreger wie Bakterien und Viren in den Organismus eindringen. Wenn ein Erreger diese Barrieren durchbricht, reagiert das angeborene Immunsystem sofort, aber unspezifisch. Angeborene Immunsysteme gibt es bei allen Tieren. Wenn Krankheitserreger die angeborene Reaktion erfolgreich umgehen, verfügen Wirbeltiere über eine zweite Schutzschicht, das adaptive Immunsystem, das durch die angeborene Reaktion aktiviert wird. Hier passt das Immunsystem seine Reaktion während einer Infektion an, um die Erkennung des Erregers zu verbessern. Diese verbesserte Reaktion wird dann nach der Eliminierung des Erregers in Form eines immunologischen Gedächtnisses beibehalten und ermöglicht es dem adaptiven Immunsystem, bei jedem erneuten Auftreten des Erregers schnellere und stärkere Angriffe durchzuführen. ⓘ
| Angeborenes Immunsystem | Adaptives Immunsystem ⓘ |
|---|---|
| Die Reaktion ist unspezifisch | Erreger- und antigenspezifische Reaktion |
| Exposition führt zu sofortiger maximaler Reaktion | Verzögerungszeit zwischen Exposition und maximaler Reaktion |
| Zellvermittelte und humorale Komponenten | Zellvermittelte und humorale Komponenten |
| Kein immunologisches Gedächtnis | Exposition führt zu immunologischem Gedächtnis |
| Kommt in fast allen Lebensformen vor | Nur bei Kieferwirbeltieren vorhanden |
Sowohl die angeborene als auch die adaptive Immunität hängen von der Fähigkeit des Immunsystems ab, zwischen eigenen und fremden Molekülen zu unterscheiden. In der Immunologie sind Selbstmoleküle Bestandteile des Körpers eines Organismus, die vom Immunsystem von Fremdstoffen unterschieden werden können. Umgekehrt sind Fremdmoleküle solche, die als Fremdmoleküle erkannt werden. Eine Klasse nicht-selbständiger Moleküle wird als Antigene bezeichnet (ursprünglich so benannt, weil sie Antikörper erzeugen) und ist definiert als Substanzen, die an spezifische Immunrezeptoren binden und eine Immunreaktion auslösen. ⓘ
Oberflächenbarrieren
Mehrere Barrieren schützen Organismen vor Infektionen, darunter mechanische, chemische und biologische Barrieren. Die wachsartige Kutikula der meisten Blätter, das Exoskelett von Insekten, die Schalen und Membranen von extern abgelegten Eiern und die Haut sind Beispiele für mechanische Barrieren, die die erste Verteidigungslinie gegen Infektionen bilden. Da Organismen nicht vollständig von ihrer Umgebung abgeschottet werden können, gibt es Systeme, die Körperöffnungen wie die Lunge, den Darm und den Urogenitaltrakt schützen. In der Lunge werden durch Husten und Niesen Krankheitserreger und andere Reizstoffe mechanisch aus den Atemwegen ausgestoßen. Die Spülwirkung von Tränen und Urin vertreibt ebenfalls mechanisch Krankheitserreger, während der von den Atemwegen und dem Magen-Darm-Trakt abgesonderte Schleim dazu dient, Mikroorganismen abzufangen und zu binden. ⓘ
Auch chemische Barrieren schützen vor Infektionen. Die Haut und die Atemwege sezernieren antimikrobielle Peptide wie die β-Defensine. Enzyme wie Lysozym und Phospholipase A2 in Speichel, Tränen und Muttermilch sind ebenfalls antibakteriell. Vaginalsekrete dienen nach der Menarche, wenn sie leicht sauer werden, als chemische Barriere, während Sperma Defensine und Zink zur Abtötung von Krankheitserregern enthält. Im Magen dient die Magensäure als chemische Abwehr gegen aufgenommene Krankheitserreger. ⓘ
Im Urogenitaltrakt und im Magen-Darm-Trakt dient die Kommensalflora als biologische Barriere, indem sie mit pathogenen Bakterien um Nahrung und Platz konkurriert und in einigen Fällen die Bedingungen in ihrer Umgebung verändert, beispielsweise den pH-Wert oder das verfügbare Eisen. Dadurch verringert sich die Wahrscheinlichkeit, dass Krankheitserreger in ausreichender Zahl auftreten, um Krankheiten zu verursachen. ⓘ
Die mechanischen und biochemischen Barrieren und Abwehrmechanismen des Körpers sind die erste Verteidigungslinie gegen Krankheitserreger. Sie sorgen dafür, dass die Pathogene erst gar nicht in den Körper eindringen können oder ihn möglichst schnell wieder verlassen.
Sie sind nicht zur Immunantwort befähigt und daher auch kein Teil des Immunsystems. ⓘ
- Haut – äußere Schicht als Barriere, Talg, Schweiß und Normalflora als Wachstumsbremsen für pathogene Mikroorganismen
- Schleimhaut – Bindefunktion des Schleims
- Augen – Abtransportfunktion der Tränen, antimikrobielles Enzym Lysozym bekämpft Mikroorganismen
- Atemwege – Bindefunktion des Schleims, Abtransportfunktion der Flimmerhärchen
- Mundhöhle – antimikrobielles Enzym Lysozym im Speichel bekämpft Mikroorganismen
- Magen – Magensäure (die Salzsäure enthält) und Eiweiß abbauende Enzyme zerstören fast alle Bakterien und Mikroorganismen
- Darm – Infektabwehr durch anwesende Bakterien (Darmflora), Abtransportfunktion durch ständige Entleerung und das sogenannte darmassoziierte Immunsystem (Gut Associated Lymphoid Tissue, GALT) und antibakterielle Proteine
- Harntrakt – Abtransportfunktion durch ständige Harnausspülung sowie osmotische Effekte der hohen Harnstoffkonzentration. ⓘ
Angeborenes Immunsystem
Mikroorganismen oder Toxine, die erfolgreich in einen Organismus eindringen, treffen auf die Zellen und Mechanismen des angeborenen Immunsystems. Die angeborene Reaktion wird in der Regel ausgelöst, wenn Mikroben von Mustererkennungsrezeptoren identifiziert werden, die Komponenten erkennen, die in großen Gruppen von Mikroorganismen konserviert sind, oder wenn beschädigte, verletzte oder gestresste Zellen Alarmsignale aussenden, von denen viele von denselben Rezeptoren erkannt werden, die auch Krankheitserreger erkennen. Die angeborene Immunabwehr ist unspezifisch, d. h. diese Systeme reagieren auf Krankheitserreger in allgemeiner Weise. Dieses System verleiht keine dauerhafte Immunität gegen einen Krankheitserreger. Das angeborene Immunsystem ist bei den meisten Organismen das dominierende System der Wirtsabwehr und bei Pflanzen das einzige. ⓘ
Immunsensorik
Die Zellen des angeborenen Immunsystems verwenden Mustererkennungsrezeptoren, um molekulare Strukturen zu erkennen, die von Krankheitserregern produziert werden. Es handelt sich dabei um Proteine, die hauptsächlich von Zellen des angeborenen Immunsystems wie dendritischen Zellen, Makrophagen, Monozyten, Neutrophilen und Epithelzellen exprimiert werden, um zwei Klassen von Molekülen zu identifizieren: pathogen-assoziierte molekulare Muster (PAMPs), die mit mikrobiellen Pathogenen assoziiert sind, und schadensassoziierte molekulare Muster (DAMPs), die mit Bestandteilen von Wirtszellen assoziiert sind, die bei Zellschäden oder Zelltod freigesetzt werden. ⓘ
Die Erkennung von extrazellulären oder endosomalen PAMPs wird durch Transmembranproteine vermittelt, die als Toll-like-Rezeptoren (TLRs) bekannt sind. TLRs teilen ein typisches strukturelles Motiv, die leucinreichen Wiederholungen (LRR), die ihnen eine gebogene Form verleihen. Toll-like-Rezeptoren wurden erstmals bei Drosophila entdeckt und lösen die Synthese und Sekretion von Zytokinen und die Aktivierung anderer Abwehrprogramme des Wirts aus, die sowohl für die angeborene als auch für die adaptive Immunantwort erforderlich sind. Beim Menschen sind zehn Toll-like-Rezeptoren beschrieben worden. ⓘ
Die Zellen des angeborenen Immunsystems verfügen über Mustererkennungsrezeptoren, die Infektionen oder Zellschäden erkennen. Drei Hauptklassen dieser "zytosolischen" Rezeptoren sind NOD-ähnliche Rezeptoren, RIG (retinoic acid-inducible gene)-ähnliche Rezeptoren und zytosolische DNA-Sensoren. ⓘ
Angeborene Immunzellen

Einige Leukozyten (weiße Blutkörperchen) verhalten sich wie unabhängige Einzeller und sind der zweite Arm des angeborenen Immunsystems. Zu den angeborenen Leukozyten gehören die "professionellen" Phagozyten (Makrophagen, Neutrophile und dendritische Zellen). Diese Zellen identifizieren und eliminieren Krankheitserreger, indem sie entweder größere Krankheitserreger durch Kontakt angreifen oder Mikroorganismen verschlingen und dann abtöten. Zu den anderen Zellen, die an der angeborenen Reaktion beteiligt sind, gehören angeborene lymphatische Zellen, Mastzellen, Eosinophile, Basophile und natürliche Killerzellen. ⓘ
Die Phagozytose ist ein wichtiges Merkmal der zellulären angeborenen Immunität, die von Zellen, den so genannten Phagozyten, durchgeführt wird, die Krankheitserreger oder Partikel verschlingen. Phagozyten durchstreifen im Allgemeinen den Körper auf der Suche nach Krankheitserregern, können aber durch Zytokine an bestimmte Orte gerufen werden. Sobald ein Krankheitserreger von einem Phagozyten verschlungen wurde, wird er in einem intrazellulären Vesikel, dem Phagosom, gefangen, das anschließend mit einem anderen Vesikel, dem Lysosom, zu einem Phagolysosom verschmilzt. Der Erreger wird durch die Aktivität von Verdauungsenzymen oder durch einen Atmungsstoß, der freie Radikale in das Phagolysosom freisetzt, abgetötet. Die Phagozytose entwickelte sich als Mittel zur Aufnahme von Nährstoffen, aber diese Rolle wurde in den Phagozyten auf das Verschlucken von Krankheitserregern als Abwehrmechanismus ausgedehnt. Die Phagozytose ist wahrscheinlich die älteste Form der Wirtsabwehr, da Phagozyten sowohl bei Wirbeltieren als auch bei wirbellosen Tieren nachgewiesen wurden. ⓘ
Neutrophile und Makrophagen sind Phagozyten, die im ganzen Körper auf der Suche nach eindringenden Krankheitserregern unterwegs sind. Neutrophile befinden sich normalerweise im Blutkreislauf und sind mit 50 bis 60 % der gesamten zirkulierenden Leukozyten die am häufigsten vorkommende Art von Phagozyten. In der akuten Entzündungsphase wandern die Neutrophilen in einem als Chemotaxis bezeichneten Prozess zum Ort der Entzündung und sind in der Regel die ersten Zellen, die am Ort der Infektion eintreffen. Makrophagen sind vielseitige Zellen, die sich im Gewebe aufhalten und eine Reihe von Chemikalien produzieren, darunter Enzyme, Komplementproteine und Zytokine. Sie können auch als Aasfresser fungieren, die den Körper von abgenutzten Zellen und anderen Trümmern befreien, und als Antigen-präsentierende Zellen (APC), die das adaptive Immunsystem aktivieren. ⓘ
Dendritische Zellen sind Phagozyten in Geweben, die mit der äußeren Umgebung in Kontakt stehen; sie befinden sich daher hauptsächlich in der Haut, der Nase, der Lunge, dem Magen und dem Darm. Ihren Namen haben sie aufgrund ihrer Ähnlichkeit mit den Dendriten von Neuronen erhalten, da beide viele stachelartige Fortsätze haben. Dendritische Zellen dienen als Bindeglied zwischen den Körpergeweben und dem angeborenen und dem adaptiven Immunsystem, da sie den T-Zellen, einem der wichtigsten Zelltypen des adaptiven Immunsystems, Antigene präsentieren. ⓘ
Granulozyten sind Leukozyten, die Granula in ihrem Zytoplasma haben. Zu dieser Kategorie gehören Neutrophile, Mastzellen, Basophile und Eosinophile. Mastzellen befinden sich im Bindegewebe und in den Schleimhäuten und regulieren die Entzündungsreaktion. Sie werden am häufigsten mit Allergien und Anaphylaxie in Verbindung gebracht. Basophile und Eosinophile sind mit den Neutrophilen verwandt. Sie scheiden chemische Botenstoffe aus, die an der Abwehr von Parasiten beteiligt sind und eine Rolle bei allergischen Reaktionen, wie z. B. Asthma, spielen. ⓘ
Angeborene lymphatische Zellen (ILC) sind eine Gruppe von Zellen des angeborenen Immunsystems, die von einem gemeinsamen lymphatischen Vorläufer abstammen und zur lymphatischen Linie gehören. Diese Zellen zeichnen sich durch das Fehlen eines antigenspezifischen B- oder T-Zell-Rezeptors (TCR) aus, da ihnen ein rekombinationsaktivierendes Gen fehlt. ILCs exprimieren keine Marker für myeloische oder dendritische Zellen. ⓘ
Natürliche Killerzellen (NK) sind Lymphozyten und eine Komponente des angeborenen Immunsystems, die eindringende Mikroben nicht direkt angreifen. Vielmehr zerstören NK-Zellen geschädigte Wirtszellen, wie z. B. Tumorzellen oder virusinfizierte Zellen, indem sie solche Zellen durch einen Zustand erkennen, der als "missing self" bekannt ist. Dieser Begriff beschreibt Zellen mit geringen Mengen eines Zelloberflächenmarkers namens MHC I (Haupthistokompatibilitätskomplex) - eine Situation, die bei viralen Infektionen von Wirtszellen auftreten kann. Normale Körperzellen werden von NK-Zellen nicht erkannt und angegriffen, da sie intakte eigene MHC-Antigene aufweisen. Diese MHC-Antigene werden von den Immunglobulinrezeptoren der Killerzellen erkannt, die die NK-Zellen im Wesentlichen ausbremsen. ⓘ
Granulozyten (von lateinisch Granulum ‚Körnchen‘) machen den Großteil der weißen Blutkörperchen (Leukozyten) aus. Sie können die Blutbahn verlassen und ins Gewebe einwandern. Granulozyten haben in ihrem Zytoplasma zahlreiche Bläschen (Vesikel oder Granula genannt), die aggressive Stoffe enthalten, mit denen Krankheitserreger unschädlich gemacht werden können. Andere Stoffe (beispielsweise Histamin) spielen bei der Entzündungsreaktion und bei Allergien eine Rolle. Die unterschiedlichen Gruppen von Granulozyten werden nach ihrer Färbereaktion in der Giemsa-Färbung eingeteilt. ⓘ
Basophile Granulozyten (auch: Basophile) besitzen zahlreiche grobe unregelmäßige Granula, die unter anderem Histamin und Heparin enthalten. Im Differentialblutbild machen sie nur einen geringen Anteil aus (< 2 Prozent). Wenn ihre Rezeptoren durch an IgE gebundene Allergene stimuliert werden, schütten Basophile toxische Mediatoren, wie Histamin und Plättchenaktivierenden Faktor (PAF) aus. Über die physiologische Bedeutung der Basophilen besteht aber weitgehend Unklarheit. ⓘ
Entzündung
Eine Entzündung ist eine der ersten Reaktionen des Immunsystems auf eine Infektion. Die Symptome einer Entzündung sind Rötung, Schwellung, Hitze und Schmerzen, die durch einen erhöhten Blutfluss in das Gewebe verursacht werden. Entzündungen werden durch Eicosanoide und Zytokine hervorgerufen, die von verletzten oder infizierten Zellen freigesetzt werden. Zu den Eicosanoiden gehören Prostaglandine, die Fieber und die mit der Entzündung verbundene Erweiterung der Blutgefäße erzeugen, sowie Leukotriene, die bestimmte weiße Blutkörperchen (Leukozyten) anlocken. Zu den gängigen Zytokinen gehören Interleukine, die für die Kommunikation zwischen den weißen Blutkörperchen verantwortlich sind, Chemokine, die die Chemotaxis fördern, und Interferone, die antivirale Wirkungen haben, indem sie z. B. die Proteinsynthese in der Wirtszelle ausschalten. Auch Wachstumsfaktoren und zytotoxische Faktoren können freigesetzt werden. Diese Zytokine und andere Chemikalien rekrutieren Immunzellen an den Ort der Infektion und fördern die Heilung von geschädigtem Gewebe nach der Beseitigung von Krankheitserregern. Die als Inflammasomen bezeichneten Mustererkennungsrezeptoren sind Multiproteinkomplexe (bestehend aus einem NLR, dem Adaptorprotein ASC und dem Effektormolekül Pro-Caspase-1), die sich als Reaktion auf zytosolische PAMPs und DAMPs bilden und deren Aufgabe es ist, aktive Formen der Entzündungszytokine IL-1β und IL-18 zu erzeugen. ⓘ
Humorale Abwehrkräfte
Das Komplementsystem ist eine biochemische Kaskade, die die Oberfläche von Fremdzellen angreift. Es enthält über 20 verschiedene Proteine und ist nach seiner Fähigkeit benannt, die Abtötung von Krankheitserregern durch Antikörper zu "ergänzen". Das Komplement ist die wichtigste humorale Komponente der angeborenen Immunantwort. Viele Arten verfügen über Komplementsysteme, auch Nicht-Säugetiere wie Pflanzen, Fische und einige Wirbellose. Beim Menschen wird diese Reaktion durch die Bindung von Komplement an Antikörper, die sich an diese Mikroben geheftet haben, oder durch die Bindung von Komplementproteinen an Kohlenhydrate auf der Oberfläche von Mikroben aktiviert. Dieses Erkennungssignal löst eine schnelle Abtötungsreaktion aus. Die Geschwindigkeit der Reaktion ist das Ergebnis der Signalverstärkung, die nach der sequentiellen proteolytischen Aktivierung der Komplementmoleküle, die ebenfalls Proteasen sind, erfolgt. Nachdem die Komplementproteine zunächst an die Mikrobe gebunden haben, aktivieren sie ihre Proteaseaktivität, die wiederum andere Komplementproteasen aktiviert, und so weiter. So entsteht eine katalytische Kaskade, die das ursprüngliche Signal durch eine kontrollierte positive Rückkopplung verstärkt. Die Kaskade führt zur Produktion von Peptiden, die Immunzellen anlocken, die Durchlässigkeit der Blutgefäße erhöhen und die Oberfläche eines Krankheitserregers opsonisieren (beschichten), wodurch er für die Zerstörung markiert wird. Diese Ablagerung von Komplement kann Zellen auch direkt abtöten, indem ihre Plasmamembran zerstört wird. ⓘ
Adaptives Immunsystem

Das adaptive Immunsystem hat sich bei frühen Wirbeltieren entwickelt und ermöglicht eine stärkere Immunantwort sowie ein immunologisches Gedächtnis, bei dem sich jeder Erreger durch ein charakteristisches Antigen "einprägt". Die adaptive Immunantwort ist antigenspezifisch und erfordert die Erkennung spezifischer "Nicht-Selbst"-Antigene in einem Prozess, der als Antigenpräsentation bezeichnet wird. Die Antigenspezifität ermöglicht die Erzeugung von Reaktionen, die auf bestimmte Krankheitserreger oder pathogeninfizierte Zellen zugeschnitten sind. Die Fähigkeit, diese maßgeschneiderten Reaktionen auszulösen, wird im Körper durch "Gedächtniszellen" aufrechterhalten. Sollte ein Erreger den Körper mehr als einmal infizieren, werden diese spezifischen Gedächtniszellen eingesetzt, um ihn schnell zu eliminieren. ⓘ
Erkennung von Antigenen
Die Zellen des adaptiven Immunsystems sind spezielle Arten von Leukozyten, die so genannten Lymphozyten. B-Zellen und T-Zellen sind die Haupttypen von Lymphozyten und stammen von hämatopoetischen Stammzellen im Knochenmark ab. B-Zellen sind an der humoralen Immunantwort beteiligt, während T-Zellen an der zellvermittelten Immunantwort beteiligt sind. T-Killerzellen erkennen nur Antigene, die an MHC-Moleküle der Klasse I gekoppelt sind, während T-Helferzellen und regulatorische T-Zellen nur Antigene erkennen, die an MHC-Moleküle der Klasse II gekoppelt sind. Diese beiden Mechanismen der Antigenpräsentation spiegeln die unterschiedlichen Rollen der beiden T-Zell-Typen wider. Ein dritter, kleinerer Subtyp sind die γδ-T-Zellen, die intakte Antigene erkennen, die nicht an MHC-Rezeptoren gebunden sind. Die doppelt-positiven T-Zellen sind im Thymus einer Vielzahl von Selbstantigenen ausgesetzt, wobei Jod für ihre Thymusentwicklung und -aktivität notwendig ist. Im Gegensatz dazu ist der antigenspezifische Rezeptor der B-Zellen ein Antikörpermolekül auf der Oberfläche der B-Zellen und erkennt natives (unverarbeitetes) Antigen, ohne dass eine Antigenverarbeitung erforderlich ist. Bei solchen Antigenen kann es sich um große Moleküle handeln, die auf der Oberfläche von Krankheitserregern zu finden sind, aber auch um kleine Haptene (wie Penicillin), die an Trägermoleküle gebunden sind. Jede Linie von B-Zellen exprimiert einen anderen Antikörper, so dass der gesamte Satz von B-Zell-Antigenrezeptoren alle Antikörper repräsentiert, die der Körper herstellen kann. Wenn B- oder T-Zellen auf ihre verwandten Antigene treffen, vermehren sie sich, und es entstehen viele "Klone" der Zellen, die sich gegen dasselbe Antigen richten. Dies wird als klonale Selektion bezeichnet. ⓘ
Antigenpräsentation für T-Lymphozyten
Sowohl B-Zellen als auch T-Zellen tragen Rezeptormoleküle, die spezifische Ziele erkennen. T-Zellen erkennen ein "Nicht-Selbst"-Ziel, wie z. B. einen Krankheitserreger, erst, nachdem Antigene (kleine Fragmente des Erregers) verarbeitet und in Kombination mit einem "Selbst"-Rezeptor, einem so genannten MHC-Molekül (Major Histocompatibility Complex), präsentiert wurden. ⓘ
Zellvermittelte Immunität
Die Mitte der 1990er erstmals beschriebenen regulatorischen T-Zellen tragen neben dem CD4-Rezeptor noch andere Proteine an ihrer Oberfläche (CD25, FoxP3). Ihre Aufgabe ist die Modulation der Immunreaktion. Des Weiteren sind regulatorische T-Zellen vermutlich für die Unterdrückung einer überschießenden Immunantwort auf ansonsten 'harmlose' Antigene und Toleranzentwicklung gegen körpereigene Strukturen zuständig. ⓘ
Killer-T-Zellen
Killer-T-Zellen sind eine Untergruppe der T-Zellen, die Zellen abtöten, die mit Viren (und anderen Krankheitserregern) infiziert oder anderweitig geschädigt oder funktionsunfähig sind. Wie bei den B-Zellen erkennt jeder T-Zelltyp ein anderes Antigen. T-Killerzellen werden aktiviert, wenn ihr T-Zell-Rezeptor an dieses spezifische Antigen in einem Komplex mit dem MHC-Klasse-I-Rezeptor einer anderen Zelle bindet. Die Erkennung dieses MHC-Antigen-Komplexes wird von einem Co-Rezeptor auf der T-Zelle, dem CD8, unterstützt. Die T-Zelle wandert dann durch den Körper auf der Suche nach Zellen, deren MHC-I-Rezeptoren dieses Antigen tragen. Wenn eine aktivierte T-Zelle mit solchen Zellen in Kontakt kommt, setzt sie Zytotoxine wie Perforin frei, die Poren in der Plasmamembran der Zielzelle bilden, durch die Ionen, Wasser und Toxine eindringen können. Das Eindringen eines anderen Toxins namens Granulysin (eine Protease) veranlasst die Zielzelle, sich der Apoptose zu unterziehen. Die Abtötung von Wirtszellen durch T-Zellen ist besonders wichtig, um die Replikation von Viren zu verhindern. Die Aktivierung von T-Zellen wird streng kontrolliert und erfordert im Allgemeinen ein sehr starkes MHC/Antigen-Aktivierungssignal oder zusätzliche Aktivierungssignale, die von "Helfer"-T-Zellen (siehe unten) bereitgestellt werden. ⓘ
Helfer-T-Zellen
T-Helferzellen regulieren sowohl die angeborene als auch die adaptive Immunantwort und bestimmen mit, welche Immunantwort der Körper auf einen bestimmten Krankheitserreger gibt. Diese Zellen haben keine zytotoxische Aktivität und töten weder infizierte Zellen noch beseitigen sie Krankheitserreger direkt. Stattdessen steuern sie die Immunreaktion, indem sie andere Zellen anweisen, diese Aufgaben zu übernehmen. ⓘ
T-Helferzellen verfügen über T-Zell-Rezeptoren, die an MHC-Moleküle der Klasse II gebundenes Antigen erkennen. Der MHC-Antigen-Komplex wird auch vom CD4-Co-Rezeptor der Helferzelle erkannt, der innerhalb der T-Zelle Moleküle (wie Lck) rekrutiert, die für die Aktivierung der T-Zelle verantwortlich sind. Die Assoziation zwischen Helfer-T-Zellen und dem MHC-Antigen-Komplex ist schwächer als bei Killer-T-Zellen. Das bedeutet, dass viele Rezeptoren (etwa 200-300) auf der Helfer-T-Zelle von einem MHC-Antigen gebunden werden müssen, um die Helfer-Zelle zu aktivieren, während Killer-T-Zellen durch die Bindung eines einzigen MHC-Antigen-Moleküls aktiviert werden können. Die Aktivierung von T-Helferzellen erfordert auch eine längere Dauer der Bindung an eine Antigen-präsentierende Zelle. Die Aktivierung einer ruhenden T-Helferzelle bewirkt, dass sie Zytokine freisetzt, die die Aktivität vieler Zelltypen beeinflussen. Von T-Helferzellen produzierte Zytokinsignale verstärken die mikrobizide Funktion von Makrophagen und die Aktivität von T-Killerzellen. Darüber hinaus bewirkt die Aktivierung von T-Helferzellen eine Hochregulierung von Molekülen, die auf der Oberfläche der T-Zellen exprimiert werden, wie z. B. CD40-Ligand (auch CD154 genannt), die zusätzliche stimulierende Signale liefern, die normalerweise zur Aktivierung von Antikörper produzierenden B-Zellen erforderlich sind. ⓘ
Gamma-Delta-T-Zellen
Gamma-Delta-T-Zellen (γδ-T-Zellen) besitzen einen alternativen T-Zell-Rezeptor (TCR) im Gegensatz zu CD4+ und CD8+ (αβ)-T-Zellen und teilen die Eigenschaften von Helfer-T-Zellen, zytotoxischen T-Zellen und NK-Zellen. Die Bedingungen, unter denen γδ-T-Zellen reagieren, sind noch nicht vollständig geklärt. Wie andere "unkonventionelle" T-Zell-Untergruppen, die invariante TCRs tragen, wie z. B. CD1d-restringierte natürliche Killer-T-Zellen, bewegen sich γδ-T-Zellen an der Grenze zwischen angeborener und adaptiver Immunität. Einerseits sind γδ-T-Zellen eine Komponente der adaptiven Immunität, da sie TCR-Gene neu anordnen, um eine Rezeptordiversität zu erzeugen, und auch einen Gedächtnisphänotyp entwickeln können. Andererseits sind die verschiedenen Untergruppen auch Teil des angeborenen Immunsystems, da beschränkte TCR- oder NK-Rezeptoren als Mustererkennungsrezeptoren verwendet werden können. So reagieren beispielsweise große Mengen menschlicher Vγ9/Vδ2-T-Zellen innerhalb von Stunden auf gängige Moleküle, die von Mikroben produziert werden, und hochgradig eingeschränkte Vδ1+-T-Zellen in Epithelien reagieren auf gestresste Epithelzellen. ⓘ
Humorale Immunantwort
Eine B-Zelle identifiziert Krankheitserreger, wenn Antikörper auf ihrer Oberfläche an ein spezifisches fremdes Antigen binden. Dieser Antigen-Antikörper-Komplex wird von der B-Zelle aufgenommen und durch Proteolyse zu Peptiden verarbeitet. Die B-Zelle zeigt diese antigenen Peptide dann auf ihren Oberflächenmolekülen der MHC-Klasse II an. Diese Kombination aus MHC und Antigen lockt eine passende T-Helferzelle an, die Lymphokine freisetzt und die B-Zelle aktiviert. Wenn sich die aktivierte B-Zelle dann zu teilen beginnt, scheiden ihre Nachkommen (Plasmazellen) Millionen von Kopien des Antikörpers aus, der dieses Antigen erkennt. Diese Antikörper zirkulieren im Blutplasma und in der Lymphe, binden an Erreger, die das Antigen exprimieren, und markieren sie für die Zerstörung durch Komplementaktivierung oder für die Aufnahme und Zerstörung durch Phagozyten. Antikörper können Herausforderungen auch direkt neutralisieren, indem sie an bakterielle Toxine binden oder die Rezeptoren stören, die Viren und Bakterien zur Infektion von Zellen nutzen. ⓘ
Neugeborene sind noch nicht mit Mikroben in Berührung gekommen und daher besonders anfällig für Infektionen. Die Mutter bietet einen mehrschichtigen passiven Schutz. Während der Schwangerschaft wird eine bestimmte Art von Antikörpern, das so genannte IgG, direkt durch die Plazenta von der Mutter auf das Kind übertragen, so dass menschliche Säuglinge bereits bei der Geburt über hohe Antikörperspiegel verfügen, die dieselbe Bandbreite an Antigenspezifitäten aufweisen wie ihre Mutter. Muttermilch oder Kolostrum enthalten ebenfalls Antikörper, die in den Darm des Säuglings übertragen werden und vor bakteriellen Infektionen schützen, bis das Neugeborene seine eigenen Antikörper synthetisieren kann. Dabei handelt es sich um eine passive Immunität, da der Fötus keine eigenen Gedächtniszellen oder Antikörper bildet, sondern sie sich nur ausleiht. Diese passive Immunität ist in der Regel von kurzer Dauer, d. h. von einigen Tagen bis zu mehreren Monaten. In der Medizin kann die schützende passive Immunität auch künstlich von einer Person auf eine andere übertragen werden. ⓘ

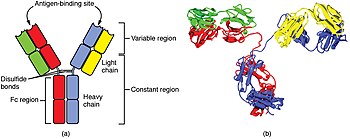
1. Fab-Abschnitt
2. Fc-Abschnitt
3. schwere Ketten
4. leichte Ketten
5. Antigenbindungsstelle (Paratop)
6. hinge-Region (dt. ‚Scharnier‘)
(*) -S-S-Disulfidbrücke ⓘ
Immunologisches Gedächtnis
Wenn B-Zellen und T-Zellen aktiviert werden und sich zu vermehren beginnen, werden einige ihrer Nachkommen zu langlebigen Gedächtniszellen. Während des gesamten Lebens eines Tieres erinnern sich diese Gedächtniszellen an jeden spezifischen Krankheitserreger, dem sie begegnet sind, und können eine starke Reaktion auslösen, wenn der Erreger erneut entdeckt wird. Dies ist "adaptiv", weil es im Laufe des Lebens eines Individuums als Anpassung an die Infektion mit diesem Erreger geschieht und das Immunsystem auf zukünftige Herausforderungen vorbereitet. Das immunologische Gedächtnis kann entweder in Form eines passiven Kurzzeitgedächtnisses oder eines aktiven Langzeitgedächtnisses auftreten. ⓘ
Physiologische Regulierung

Das Immunsystem ist an vielen Aspekten der physiologischen Regulierung im Körper beteiligt. Das Immunsystem steht in enger Wechselwirkung mit anderen Systemen, wie dem endokrinen System und dem Nervensystem. Das Immunsystem spielt auch eine entscheidende Rolle bei der Embryogenese (Entwicklung des Embryos) sowie bei der Gewebereparatur und -regeneration. ⓘ
Hormone
Hormone können als Immunmodulatoren wirken und die Empfindlichkeit des Immunsystems verändern. So sind beispielsweise weibliche Sexualhormone als Immunstimulatoren sowohl für adaptive als auch für angeborene Immunreaktionen bekannt. Einige Autoimmunkrankheiten wie Lupus erythematodes treten bevorzugt bei Frauen auf, und ihr Ausbruch fällt oft mit der Pubertät zusammen. Im Gegensatz dazu scheinen männliche Sexualhormone wie Testosteron immunsuppressiv zu wirken. Auch andere Hormone scheinen das Immunsystem zu regulieren, vor allem Prolaktin, Wachstumshormon und Vitamin D. ⓘ
Vitamin D
Sonnenlicht kann einen Einfluss auf das Immunsystem haben. Bereits vor mehr als 100 Jahren war das tägliche Sonnenbad ein fester Bestandteil der Tuberkulosetherapie (allerdings in Ermangelung von Antibiotika, die erst um 1930 entdeckt und nach 1940 am Menschen erprobt wurden). Hierbei spielt Vitamin D eine wichtige Rolle im Immunsystem. Die Forschung konnte den zugrundeliegenden Mechanismus darstellen: Bestimmte Abwehrzellen besitzen auf ihrer Oberfläche einen sogenannten Toll-like Receptor; dieser wird bei einer Bakterieninfektion aktiviert und veranlasst die Abwehrzelle, eine Vorstufe von Vitamin D (25-Hydroxy-Vitamin-D) zu produzieren. Gleichzeitig bildet dieselbe Zelle verstärkt einen weiteren Rezeptortyp aus, der auf die Erkennung von Vitamin D spezialisiert ist. Das Sonnenlicht wandelt die Vitamin-D-Vorstufe in das aktive Vitamin D um, welches sich nun an den Rezeptor heftet. Dadurch wird die Abwehrzelle dazu angeregt, das antibakteriell wirkende Cathelizidin zu bilden. Der Zusammenhang erklärt auch, warum Menschen mit dunkler Haut für Infektionen wie beispielsweise die Hauttuberkulose besonders empfänglich sind: In ihrem Blut finden sich in der Regel deutlich geringere Mengen der Vitamin-D-Vorstufe, wobei diskutiert wird, ob die zusätzliche Einnahme von Vitamin-D-Präparaten den Mangel ausgleichen kann. ⓘ
Der mögliche Zusammenhang von Vitamin D und Virus-Infektionen ist Gegenstand der Forschung. Eine tägliche, niedrigdosierte Vitamin D-Gabe (400–1000 IU/Tag) kann bei Kleinkindern oder Jugendlichen (1–16 Jahren) einen schwachen Schutzeffekt vor akuten Atemwegsinfektionen (acute respiratory infection) entfalten. Höhere Dosierungen zeigten keinen Vorteil, andere Altersgruppen profitieren nicht. ⓘ
Neben anderen Faktoren ist die (tageszeit- und jahreszeitabhängige) Höhe des Sonnenstands und entscheidend für einen ausreichenden UV-B-Anteil im Sonnenlicht zur Bildung von Vitamin-D3-Bildung, im Winter kann nördlich des 51. Breitengrads (Köln–Erfurt–Dresden) zeitweise selbst zur Mittagszeit bei einem Ganzkörpersonnenbad kein Vitamin D3 in der Haut gebildet werden, was zu Vitamin-D-Mangel führen kann. ⓘ
Eine Schwächung des Immunsystems kann eine Folge der teilweise immunsuppressiven Wirkung der UV-B-Strahlen sein, die die T-Zell-abhängige Immunantwort stört. Eine übermäßige UVB-Belastung der Haut fördert die Entwicklung von bösartigen Hauttumoren wie Basalzellkarzinomen und Plattenepithelkarzinomen und mindert die Abwehr von Krankheitserregern wie Bakterien, Pilzen oder Viren deutlich. ⓘ
Obwohl zelluläre Studien darauf hindeuten, dass Vitamin D Rezeptoren und wahrscheinliche Funktionen im Immunsystem hat, gibt es keine klinischen Beweise dafür, dass ein Vitamin-D-Mangel das Risiko für Immunkrankheiten erhöht oder eine Vitamin-D-Supplementierung das Risiko für Immunkrankheiten senkt. In einem Bericht des US-amerikanischen Institute of Medicine aus dem Jahr 2011 heißt es, dass "Ergebnisse im Zusammenhang mit ... Immunfunktionen und Autoimmunerkrankungen sowie Infektionen ... nicht zuverlässig mit der Kalzium- oder Vitamin-D-Zufuhr in Verbindung gebracht werden konnten und häufig widersprüchlich waren." ⓘ
Schlaf und Ruhe
Das Immunsystem wird durch Schlaf und Ruhe beeinflusst, und Schlafentzug wirkt sich nachteilig auf die Immunfunktion aus. Komplexe Rückkopplungsschleifen, an denen Zytokine wie Interleukin-1 und Tumor-Nekrose-Faktor-α beteiligt sind, die als Reaktion auf eine Infektion gebildet werden, scheinen auch bei der Regulierung des REM-Schlafs (Non-Rapid Eye Movement) eine Rolle zu spielen. So kann die Immunreaktion auf eine Infektion zu Veränderungen im Schlafzyklus führen, einschließlich einer Zunahme des Langsamschlafs im Vergleich zum REM-Schlaf. ⓘ
Bei Menschen mit Schlafmangel können aktive Impfungen eine verminderte Wirkung haben und zu einer geringeren Antikörperproduktion und einer geringeren Immunreaktion führen, als dies bei ausgeruhten Personen der Fall wäre. Darüber hinaus können Proteine wie NFIL3, die nachweislich eng mit der T-Zell-Differenzierung und den zirkadianen Rhythmen verbunden sind, durch die Störung der natürlichen Licht- und Dunkelheitszyklen bei Schlafentzug beeinflusst werden. Diese Störungen können zu einer Zunahme von chronischen Erkrankungen wie Herzkrankheiten, chronischen Schmerzen und Asthma führen. ⓘ
Zusätzlich zu den negativen Folgen des Schlafmangels haben der Schlaf und das damit verbundene zirkadiane System nachweislich starke regulierende Auswirkungen auf immunologische Funktionen, die sowohl die angeborene als auch die adaptive Immunität betreffen. Erstens führt ein plötzlicher Abfall des Cortisol-, Epinephrin- und Norepinephrinspiegels im Blut während der frühen Slow-Wave-Schlafphase zu einem Anstieg der Hormone Leptin, Hypophysenwachstumshormon und Prolaktin im Blut. Diese Signale induzieren einen entzündungsfördernden Zustand durch die Produktion der entzündungsfördernden Zytokine Interleukin-1, Interleukin-12, TNF-alpha und IFN-gamma. Diese Zytokine stimulieren dann Immunfunktionen wie die Aktivierung, Proliferation und Differenzierung von Immunzellen. Während dieser Zeit einer sich langsam entwickelnden adaptiven Immunantwort kommt es zu einem Höchststand an undifferenzierten oder weniger differenzierten Zellen, wie naiven und zentralen Gedächtnis-T-Zellen. Zusätzlich zu diesen Effekten unterstützt das Milieu der in dieser Zeit produzierten Hormone (Leptin, hypophysäres Wachstumshormon und Prolaktin) die Interaktionen zwischen APCs und T-Zellen, eine Verschiebung des Th1/Th2-Zytokin-Gleichgewichts zugunsten von Th1, eine Zunahme der Th-Zell-Proliferation insgesamt und die Migration naiver T-Zellen in die Lymphknoten. Man nimmt an, dass dies auch die Bildung eines lang anhaltenden Immungedächtnisses durch die Initiierung von Th1-Immunreaktionen unterstützt. ⓘ
Während der Wachphasen erreichen die differenzierten Effektorzellen, wie zytotoxische natürliche Killerzellen und zytotoxische T-Lymphozyten, ihren Höchststand, um eine wirksame Reaktion auf eindringende Krankheitserreger auszulösen. Entzündungshemmende Moleküle wie Cortisol und Katecholamine erreichen während der wachen, aktiven Zeit ebenfalls Höchstwerte. Eine Entzündung würde zu schwerwiegenden kognitiven und körperlichen Beeinträchtigungen führen, wenn sie während der Wachzeit auftritt, und eine Entzündung kann aufgrund der Anwesenheit von Melatonin während der Schlafzeit auftreten. Entzündungen verursachen viel oxidativen Stress, und die Anwesenheit von Melatonin während der Schlafenszeit könnte der Produktion freier Radikale in dieser Zeit aktiv entgegenwirken. ⓘ
Reparatur und Regeneration
Das Immunsystem, insbesondere die angeborene Komponente, spielt eine entscheidende Rolle bei der Gewebereparatur nach einem Insult. Zu den Hauptakteuren gehören Makrophagen und Neutrophile, aber auch andere zelluläre Akteure wie γδ-T-Zellen, angeborene lymphatische Zellen (ILCs) und regulatorische T-Zellen (Tregs) sind wichtig. Die Plastizität der Immunzellen und das Gleichgewicht zwischen entzündungsfördernden und entzündungshemmenden Signalen sind entscheidende Aspekte einer effizienten Gewebereparatur. Immunkomponenten und -wege sind auch an der Regeneration beteiligt, zum Beispiel bei Amphibien, wie bei der Regeneration der Gliedmaßen des Axolotl. Eine Hypothese besagt, dass Organismen, die sich regenerieren können (z. B. Axolotl), weniger immunkompetent sein könnten als Organismen, die sich nicht regenerieren können. ⓘ
Störungen der menschlichen Immunität
Störungen der Wirtsabwehr treten auf und lassen sich in drei große Kategorien einteilen: Immundefekte, Autoimmunität und Überempfindlichkeiten. ⓘ
Immundefizienzen
Immundefizienzen treten auf, wenn eine oder mehrere Komponenten des Immunsystems inaktiv sind. Die Fähigkeit des Immunsystems, auf Krankheitserreger zu reagieren, ist sowohl bei jungen als auch bei älteren Menschen vermindert, wobei die Immunantwort im Alter von etwa 50 Jahren aufgrund der Immunoseneszenz zu sinken beginnt. In den Industrieländern sind Fettleibigkeit, Alkoholismus und Drogenkonsum häufige Ursachen für eine schlechte Immunfunktion, während in den Entwicklungsländern Unterernährung die häufigste Ursache für Immunschwäche ist. Eine Ernährung mit unzureichendem Eiweißgehalt wird mit einer Beeinträchtigung der zellvermittelten Immunität, der Komplementaktivität, der Phagozytenfunktion, der IgA-Antikörperkonzentration und der Zytokinproduktion in Verbindung gebracht. Darüber hinaus führt der Verlust der Thymusdrüse in jungen Jahren durch genetische Mutation oder chirurgische Entfernung zu einer schweren Immunschwäche und einer hohen Anfälligkeit für Infektionen. Immundefekte können auch vererbt oder "erworben" werden. Die schwere kombinierte Immunschwäche ist eine seltene genetische Störung, die durch eine gestörte Entwicklung funktioneller T-Zellen und B-Zellen aufgrund zahlreicher genetischer Mutationen gekennzeichnet ist. Die chronische granulomatöse Erkrankung, bei der die Fähigkeit der Fresszellen, Krankheitserreger zu zerstören, eingeschränkt ist, ist ein Beispiel für eine vererbte oder angeborene Immunschwäche. AIDS und einige Krebsarten verursachen eine erworbene Immunschwäche. ⓘ
Fehlen einzelne Komponenten der Immunantwort oder funktionieren diese nicht mehr richtig, so kann das Immunsystem Krankheitserreger nicht mehr effektiv bekämpfen und selbst Erkrankungen, die normalerweise harmlos sind, können lebensbedrohliche Verläufe annehmen. Immundefekte können angeboren oder erworben sein:
- Die schwere kombinierte Immundefizienz (SCID) ist eine Gruppe von angeborenen Immundefekten, die sich durch Beeinträchtigung sowohl der zellulären Immunabwehr als auch der humoralen Immunabwehr auszeichnen, daher die Bezeichnung „kombiniert“.
- Die erworbene Immunschwäche AIDS wird durch das HI-Virus ausgelöst, das sich durch den Befall der T-Helferzellen erfolgreich der Immunabwehr entzieht. Durch die Vermehrung des HI-Virus werden jedoch immer mehr Abwehrzellen zerstört, sodass meist nach einigen Jahren Inkubationszeit eine zunehmende Abwehrschwäche eintritt und die Anzahl von Infekten und Tumorerkrankungen zunimmt.
- Eine Neutropenie oder sogar Agranulozytose kann durch Nebenwirkungen bestimmter Medikamente (z. B. Zytostatika) oder durch Autoimmunerkrankungen ausgelöst werden und führt vor allem zu Schleimhautentzündungen und sogenannten opportunistischen Infekten durch ansonsten harmlose Krankheitserreger.
- Weitere angeborene Immundefekte sind: Morbus Behçet, DiGeorge-Syndrom, selektiver Immunglobulin-A-Mangel und das Wiskott-Aldrich-Syndrom, bei denen jeweils ein bestimmter Anteil der Immunabwehr gestört ist. ⓘ
Autoimmunität
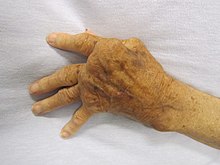
Überaktive Immunreaktionen bilden das andere Ende der Immunstörungen, insbesondere der Autoimmunkrankheiten. Hier kann das Immunsystem nicht richtig zwischen selbst und fremd unterscheiden und greift einen Teil des Körpers an. Unter normalen Umständen reagieren viele T-Zellen und Antikörper mit "eigenen" Peptiden. Eine der Funktionen spezialisierter Zellen (im Thymus und im Knochenmark) besteht darin, jungen Lymphozyten körpereigene Antigene zu präsentieren und jene Zellen zu eliminieren, die Selbstantigene erkennen, um Autoimmunität zu verhindern. Zu den häufigen Autoimmunkrankheiten gehören die Hashimoto-Thyreoiditis, die rheumatoide Arthritis, Diabetes mellitus Typ 1 und der systemische Lupus erythematosus. ⓘ
Überempfindlichkeit
Eine Überempfindlichkeit ist eine Immunreaktion, die körpereigenes Gewebe schädigt. Sie wird anhand der beteiligten Mechanismen und des zeitlichen Verlaufs der Überempfindlichkeitsreaktion in vier Klassen (Typ I - IV) eingeteilt. Bei der Überempfindlichkeit vom Typ I handelt es sich um eine sofortige oder anaphylaktische Reaktion, die häufig mit einer Allergie einhergeht. Die Symptome können von leichtem Unbehagen bis zum Tod reichen. Die Überempfindlichkeit vom Typ I wird durch IgE vermittelt, das die Degranulation von Mastzellen und Basophilen auslöst, wenn es durch ein Antigen vernetzt wird. Eine Überempfindlichkeit vom Typ II tritt auf, wenn Antikörper an Antigene auf den eigenen Zellen binden und diese zur Zerstörung markieren. Dies wird auch als antikörperabhängige (oder zytotoxische) Überempfindlichkeit bezeichnet und wird durch IgG- und IgM-Antikörper vermittelt. Immunkomplexe (Ansammlungen von Antigenen, Komplementproteinen und IgG- und IgM-Antikörpern), die sich in verschiedenen Geweben ablagern, lösen Überempfindlichkeitsreaktionen vom Typ III aus. Überempfindlichkeitsreaktionen vom Typ IV (auch zellvermittelte oder verzögerte Überempfindlichkeitsreaktionen genannt) entwickeln sich in der Regel innerhalb von zwei bis drei Tagen. Typ-IV-Reaktionen sind an vielen Autoimmun- und Infektionskrankheiten beteiligt, können aber auch bei Kontaktdermatitis auftreten. Diese Reaktionen werden durch T-Zellen, Monozyten und Makrophagen vermittelt. ⓘ
Idiopathische Entzündung
Eine Entzündung ist eine der ersten Reaktionen des Immunsystems auf eine Infektion, sie kann jedoch auch ohne bekannte Ursache auftreten. ⓘ
Entzündungen werden durch Eicosanoide und Zytokine hervorgerufen, die von verletzten oder infizierten Zellen freigesetzt werden. Zu den Eicosanoiden gehören Prostaglandine, die Fieber und die mit der Entzündung verbundene Erweiterung der Blutgefäße erzeugen, sowie Leukotriene, die bestimmte weiße Blutkörperchen (Leukozyten) anlocken. Zu den gängigen Zytokinen gehören Interleukine, die für die Kommunikation zwischen den weißen Blutkörperchen verantwortlich sind, Chemokine, die die Chemotaxis fördern, und Interferone, die antivirale Wirkungen haben, indem sie z. B. die Proteinsynthese in der Wirtszelle hemmen. Auch Wachstumsfaktoren und zytotoxische Faktoren können freigesetzt werden. Diese Zytokine und andere Chemikalien rekrutieren Immunzellen an den Ort der Infektion und fördern die Heilung von geschädigtem Gewebe nach der Beseitigung von Krankheitserregern. ⓘ
Manipulation in der Medizin
Die Immunreaktion kann manipuliert werden, um unerwünschte Reaktionen infolge von Autoimmunität, Allergie und Transplantatabstoßung zu unterdrücken und um Schutzreaktionen gegen Krankheitserreger, die sich dem Immunsystem weitgehend entziehen (siehe Immunisierung), oder gegen Krebs zu stimulieren. ⓘ
Immunsuppression
Immunsuppressiva werden eingesetzt, um Autoimmunerkrankungen oder Entzündungen zu kontrollieren, wenn übermäßige Gewebeschäden auftreten, und um Abstoßungsreaktionen nach einer Organtransplantation zu verhindern. ⓘ
Entzündungshemmende Medikamente werden häufig eingesetzt, um die Auswirkungen von Entzündungen zu kontrollieren. Glukokortikoide sind die stärksten dieser Medikamente und können viele unerwünschte Nebenwirkungen haben, wie zentrale Fettleibigkeit, Hyperglykämie und Osteoporose. Ihr Einsatz wird streng kontrolliert. Niedrigere Dosen entzündungshemmender Medikamente werden häufig in Verbindung mit zytotoxischen oder immunsuppressiven Medikamenten wie Methotrexat oder Azathioprin eingesetzt. ⓘ
Zytotoxische Medikamente hemmen die Immunreaktion, indem sie sich teilende Zellen wie aktivierte T-Zellen abtöten. Diese Tötung erfolgt wahllos, so dass auch andere sich ständig teilende Zellen und ihre Organe betroffen sind, was zu toxischen Nebenwirkungen führt. Immunsuppressive Medikamente wie Cyclosporin verhindern, dass T-Zellen korrekt auf Signale reagieren, indem sie die Signaltransduktionswege hemmen. ⓘ
In manchen Situationen ist eine Immunsuppression, also eine medikamentöse Hemmung oder sogar komplette Unterdrückung der Immunantwort, notwendig. Beispielsweise mindert eine immunsuppressive Therapie das Risiko für Abstoßungsreaktionen nach Organtransplantationen. Patienten, die an Autoimmunkrankheiten wie Rheuma, Psoriasis oder Allergien leiden, sind häufig über viele Jahre hinweg auf Behandlungen angewiesen, die ihr überschießendes Immunsystem regulieren. ⓘ
Immunsupprimierte Menschen sind dabei anfälliger für opportunistische Erreger wie Influenza-Viren, Pneumokokken, Meningokokken oder auch Pilzinfektionen. Deshalb werden sie von der Ständigen Impfkommission (STIKO) am Robert Koch-Institut (RKI) als Risikogruppe für diverse Infektionskrankheiten eingestuft. ⓘ
Das am längsten bekannte immunsuppressive Medikament ist Cortison, die Vorstufe des körpereigenen Hormons Cortisol. Neuere Wirkstoffe wie Tacrolimus oder Cyclosporin A sind jedoch teilweise deutlich wirksamer und/oder haben geringere Nebenwirkungen. ⓘ
Immunstimulation
Die Behauptungen von Vermarktern verschiedener Produkte und alternativen Gesundheitsdienstleistern wie Chiropraktikern, Homöopathen und Akupunkteuren, das Immunsystem stimulieren oder "ankurbeln" zu können, entbehren im Allgemeinen einer sinnvollen Erklärung und eines Nachweises der Wirksamkeit. ⓘ
Impfung

Das aktive Langzeitgedächtnis wird nach einer Infektion durch die Aktivierung von B- und T-Zellen erworben. Eine aktive Immunität kann auch künstlich durch eine Impfung erzeugt werden. Das Prinzip der Impfung (auch Immunisierung genannt) besteht darin, ein Antigen eines Krankheitserregers einzuführen, um das Immunsystem zu stimulieren und eine spezifische Immunität gegen diesen bestimmten Erreger zu entwickeln, ohne eine mit diesem Organismus verbundene Krankheit zu verursachen. Diese gezielte Induktion einer Immunreaktion ist erfolgreich, weil sie die natürliche Spezifität des Immunsystems und seine Induzierbarkeit ausnutzt. Da Infektionskrankheiten nach wie vor eine der häufigsten Todesursachen in der menschlichen Bevölkerung sind, stellt die Impfung die wirksamste Manipulation des Immunsystems dar, die die Menschheit entwickelt hat. ⓘ
Viele Impfstoffe basieren auf azellulären Bestandteilen von Mikroorganismen, einschließlich harmloser Toxinbestandteile. Da viele Antigene aus azellulären Impfstoffen keine starke adaptive Reaktion hervorrufen, werden die meisten bakteriellen Impfstoffe mit zusätzlichen Adjuvantien versehen, die die Antigen-präsentierenden Zellen des angeborenen Immunsystems aktivieren und die Immunogenität maximieren. ⓘ
Tumor-Immunologie
Eine weitere wichtige Aufgabe des Immunsystems besteht in der Erkennung und Beseitigung von Tumoren. Dies wird als Immunüberwachung bezeichnet. Die transformierten Zellen von Tumoren exprimieren Antigene, die auf normalen Zellen nicht zu finden sind. Für das Immunsystem erscheinen diese Antigene als fremd, und ihr Vorhandensein veranlasst die Immunzellen, die transformierten Tumorzellen anzugreifen. Die von Tumoren exprimierten Antigene haben verschiedene Quellen; einige stammen von onkogenen Viren wie dem humanen Papillomavirus, das Gebärmutterhals-, Vulva-, Vagina-, Penis-, Anus-, Mund- und Rachenkrebs verursacht, während es sich bei anderen um körpereigene Proteine handelt, die in normalen Zellen nur in geringen Mengen vorkommen, in Tumorzellen jedoch hohe Werte erreichen. Ein Beispiel dafür ist ein Enzym namens Tyrosinase, das, wenn es in hoher Konzentration exprimiert wird, bestimmte Hautzellen (z. B. Melanozyten) in Tumore, sogenannte Melanome, verwandelt. Eine dritte mögliche Quelle für Tumorantigene sind Proteine, die normalerweise für die Regulierung des Zellwachstums und -überlebens wichtig sind und die häufig zu krebsauslösenden Molekülen, den so genannten Onkogenen, mutieren. ⓘ

Die wichtigste Reaktion des Immunsystems auf Tumore ist die Zerstörung der abnormen Zellen durch T-Killerzellen, manchmal mit Unterstützung von T-Helferzellen. Tumorantigene werden auf MHC-Klasse-I-Molekülen in ähnlicher Weise präsentiert wie virale Antigene. Dadurch können die Killer-T-Zellen die Tumorzelle als abnormal erkennen. Auch NK-Zellen töten Tumorzellen auf ähnliche Weise ab, insbesondere wenn die Tumorzellen weniger MHC-Klasse-I-Moleküle auf ihrer Oberfläche haben als normale Zellen; dies ist ein häufiges Phänomen bei Tumoren. Manchmal werden auch Antikörper gegen Tumorzellen gebildet, die deren Zerstörung durch das Komplementsystem ermöglichen. ⓘ
Manche Tumore entziehen sich dem Immunsystem und entwickeln sich zu Krebs. Tumorzellen haben oft eine reduzierte Anzahl von MHC-Klasse-I-Molekülen auf ihrer Oberfläche und entgehen so der Erkennung durch T-Killerzellen. Einige Tumorzellen setzen auch Produkte frei, die die Immunreaktion hemmen, indem sie zum Beispiel das Zytokin TGF-β absondern, das die Aktivität von Makrophagen und Lymphozyten unterdrückt. Darüber hinaus kann sich eine immunologische Toleranz gegen Tumorantigene entwickeln, so dass das Immunsystem die Tumorzellen nicht mehr angreift. ⓘ
Paradoxerweise können Makrophagen das Tumorwachstum fördern, wenn Tumorzellen Zytokine aussenden, die Makrophagen anlocken, die dann Zytokine und Wachstumsfaktoren wie den Tumor-Nekrose-Faktor alpha erzeugen, die die Tumorentwicklung fördern oder eine stammzellartige Plastizität begünstigen. Darüber hinaus veranlasst eine Kombination aus Hypoxie im Tumor und einem von Makrophagen produzierten Zytokin die Tumorzellen dazu, die Produktion eines Proteins zu verringern, das die Metastasierung blockiert und damit die Ausbreitung von Krebszellen unterstützt. M1-Makrophagen, die gegen den Tumor gerichtet sind, werden in frühen Phasen der Tumorentwicklung rekrutiert, differenzieren sich aber nach und nach in M2-Makrophagen mit Pro-Tumor-Wirkung, eine immunsuppressive Umstellung. Die Hypoxie reduziert die Zytokinproduktion für die Antitumorreaktion, und die Makrophagen erwerben nach und nach tumorfreundliche M2-Funktionen, die von der Mikroumgebung des Tumors gesteuert werden, einschließlich IL-4 und IL-10. Die Krebsimmuntherapie umfasst die medizinischen Möglichkeiten, das Immunsystem zur Bekämpfung von Krebstumoren anzuregen. ⓘ
Vorhersage der Immunogenität
Einige Arzneimittel können eine neutralisierende Immunreaktion hervorrufen, d. h. das Immunsystem produziert neutralisierende Antikörper, die der Wirkung der Arzneimittel entgegenwirken, insbesondere wenn die Arzneimittel wiederholt oder in größeren Dosen verabreicht werden. Dies schränkt die Wirksamkeit von Arzneimitteln ein, die auf größeren Peptiden und Proteinen basieren (die in der Regel größer als 6000 Da sind). In einigen Fällen ist das Medikament selbst nicht immunogen, kann aber zusammen mit einer immunogenen Verbindung verabreicht werden, wie es manchmal bei Taxol der Fall ist. Es wurden computergestützte Verfahren zur Vorhersage der Immunogenität von Peptiden und Proteinen entwickelt, die insbesondere bei der Entwicklung therapeutischer Antikörper, der Bewertung der wahrscheinlichen Virulenz von Mutationen in viralen Hüllpartikeln und der Validierung von vorgeschlagenen peptidbasierten Arzneimitteltherapien von Nutzen sind. Frühe Techniken stützten sich hauptsächlich auf die Beobachtung, dass hydrophile Aminosäuren in Epitopregionen überrepräsentiert sind als hydrophobe Aminosäuren; neuere Entwicklungen stützen sich jedoch auf Techniken des maschinellen Lernens, bei denen Datenbanken mit bekannten Epitopen, in der Regel von gut untersuchten Virusproteinen, als Trainingssatz verwendet werden. Eine öffentlich zugängliche Datenbank wurde für die Katalogisierung von Epitopen von Krankheitserregern eingerichtet, von denen bekannt ist, dass sie von B-Zellen erkannt werden können. Das aufkommende Gebiet der bioinformatischen Untersuchungen der Immunogenität wird als Immunoinformatik bezeichnet. Immunoproteomik ist die Untersuchung großer Mengen von Proteinen (Proteomik), die an der Immunantwort beteiligt sind. ⓘ
Evolution und andere Mechanismen
Die Evolution des Immunsystems
Es ist wahrscheinlich, dass ein adaptives Multikomponenten-Immunsystem mit den ersten Wirbeltieren entstanden ist, da wirbellose Tiere keine Lymphozyten oder eine auf Antikörpern basierende humorale Reaktion entwickeln. Viele Arten nutzen jedoch Mechanismen, die Vorläufer dieser Aspekte der Wirbeltierimmunität zu sein scheinen. Immunsysteme kommen sogar in den strukturell einfachsten Lebensformen vor, wobei Bakterien einen einzigartigen Verteidigungsmechanismus, das so genannte Restriktionsmodifikationssystem, nutzen, um sich vor viralen Pathogenen, den so genannten Bakteriophagen, zu schützen. Prokaryonten (Bakterien und Archaeen) verfügen auch über eine erworbene Immunität durch ein System, das CRISPR-Sequenzen verwendet, um Fragmente der Genome von Phagen zu speichern, mit denen sie in der Vergangenheit in Kontakt gekommen sind, wodurch sie die Virusreplikation durch eine Form der RNA-Interferenz blockieren können. Prokaryoten verfügen auch über andere Abwehrmechanismen. Offensiv wirkende Elemente des Immunsystems gibt es auch bei einzelligen Eukaryonten, aber es gibt nur wenige Studien über ihre Rolle bei der Verteidigung. ⓘ
Mustererkennungsrezeptoren sind Proteine, die von fast allen Organismen verwendet werden, um mit Krankheitserregern assoziierte Moleküle zu identifizieren. Antimikrobielle Peptide, so genannte Defensine, sind eine evolutionär konservierte Komponente der angeborenen Immunantwort, die bei allen Tieren und Pflanzen zu finden ist und die Hauptform der systemischen Immunität von Wirbellosen darstellt. Auch das Komplementsystem und phagozytische Zellen werden von den meisten wirbellosen Lebewesen genutzt. Ribonukleasen und der RNA-Interferenzweg sind in allen Eukaryonten konserviert und spielen vermutlich eine Rolle bei der Immunantwort auf Viren. ⓘ
Im Gegensatz zu Tieren haben Pflanzen keine phagozytischen Zellen, aber viele pflanzliche Immunreaktionen beinhalten systemische chemische Signale, die durch die Pflanze gesendet werden. Einzelne Pflanzenzellen reagieren auf Moleküle, die mit Krankheitserregern assoziiert sind und als pathogen-assoziierte molekulare Muster oder PAMPs bezeichnet werden. Wenn ein Teil einer Pflanze infiziert wird, erzeugt die Pflanze eine lokalisierte überempfindliche Reaktion, bei der die Zellen am Ort der Infektion schnell apoptotisch werden, um die Ausbreitung der Krankheit auf andere Teile der Pflanze zu verhindern. Systemische erworbene Resistenz ist eine Art von Abwehrreaktion der Pflanzen, die die gesamte Pflanze gegen einen bestimmten Infektionserreger resistent macht. RNA-Silencing-Mechanismen sind bei dieser systemischen Reaktion besonders wichtig, da sie die Virusreplikation blockieren können. ⓘ
Alternatives adaptives Immunsystem
Die Evolution des adaptiven Immunsystems fand bei einem Vorfahren der Kieferwirbeltiere statt. Viele der klassischen Moleküle des adaptiven Immunsystems (z. B. Immunglobuline und T-Zell-Rezeptoren) gibt es nur bei Kieferwirbeltieren. Bei primitiven, kieferlosen Wirbeltieren wie dem Neunauge und dem Schleimaal wurde ein eigenes, von Lymphozyten abgeleitetes Molekül entdeckt. Diese Tiere besitzen eine große Anzahl von Molekülen, die als variable Lymphozytenrezeptoren (VLR) bezeichnet werden und wie die Antigenrezeptoren der Wirbeltiere mit Kiefer nur von einer kleinen Anzahl (ein oder zwei) von Genen produziert werden. Es wird angenommen, dass diese Moleküle pathogene Antigene auf ähnliche Weise wie Antikörper und mit demselben Grad an Spezifität binden. ⓘ
Manipulation durch Krankheitserreger
Der Erfolg jedes Pathogens hängt von seiner Fähigkeit ab, sich der Immunantwort des Wirts zu entziehen. Daher haben Krankheitserreger verschiedene Methoden entwickelt, die es ihnen ermöglichen, einen Wirt erfolgreich zu infizieren und sich gleichzeitig der Entdeckung oder Zerstörung durch das Immunsystem zu entziehen. Bakterien überwinden physische Barrieren oft, indem sie Enzyme absondern, die die Barriere verdauen, z. B. durch Verwendung eines Typ-II-Sekretionssystems. Alternativ können sie mit Hilfe eines Typ-III-Sekretionssystems eine hohle Röhre in die Wirtszelle einführen, durch die Proteine auf direktem Weg vom Erreger zum Wirt gelangen können. Diese Proteine werden häufig eingesetzt, um die Abwehrkräfte des Wirts auszuschalten. ⓘ
Eine von mehreren Krankheitserregern angewandte Ausweichstrategie, um das angeborene Immunsystem zu umgehen, besteht darin, sich in den Zellen ihres Wirts zu verstecken (auch intrazelluläre Pathogenese genannt). In diesem Fall verbringt der Erreger den größten Teil seines Lebenszyklus innerhalb der Wirtszellen, wo er vor dem direkten Kontakt mit Immunzellen, Antikörpern und Komplement geschützt ist. Einige Beispiele für intrazelluläre Pathogene sind Viren, das Lebensmittelvergiftungsbakterium Salmonella und die eukaryotischen Parasiten, die Malaria (Plasmodium spp.) und Leishmaniose (Leishmania spp.) verursachen. Andere Bakterien, wie Mycobacterium tuberculosis, leben in einer Schutzkapsel, die die Lyse durch Komplement verhindert. Viele Krankheitserreger scheiden Stoffe aus, die die Immunreaktion des Wirts abschwächen oder in die falsche Richtung lenken. Einige Bakterien bilden Biofilme, um sich vor den Zellen und Proteinen des Immunsystems zu schützen. Solche Biofilme treten bei vielen erfolgreichen Infektionen auf, wie z. B. bei den chronischen Infektionen mit Pseudomonas aeruginosa und Burkholderia cenocepacia, die für die Mukoviszidose charakteristisch sind. Andere Bakterien bilden Oberflächenproteine, die an Antikörper binden und diese dadurch unwirksam machen; Beispiele sind Streptococcus (Protein G), Staphylococcus aureus (Protein A) und Peptostreptococcus magnus (Protein L). ⓘ
Die Mechanismen zur Umgehung des adaptiven Immunsystems sind komplizierter. Der einfachste Ansatz besteht darin, unwesentliche Epitope (Aminosäuren und/oder Zucker) auf der Oberfläche des Erregers schnell zu verändern, während wesentliche Epitope verborgen bleiben. Dies wird als antigene Variation bezeichnet. Ein Beispiel ist HIV, das schnell mutiert, so dass sich die Proteine auf seiner Virushülle, die für den Eintritt in die Zielzelle des Wirts unerlässlich sind, ständig verändern. Diese häufigen Veränderungen der Antigene erklären möglicherweise das Scheitern der gegen dieses Virus gerichteten Impfstoffe. Der Parasit Trypanosoma brucei wendet eine ähnliche Strategie an, indem er ständig eine Art von Oberflächenprotein gegen ein anderes austauscht, wodurch er der Antikörperreaktion einen Schritt voraus ist. Die Maskierung von Antigenen durch Wirtsmoleküle ist eine weitere gängige Strategie, um der Erkennung durch das Immunsystem zu entgehen. Bei HIV wird die Hülle, die das Virion bedeckt, aus der äußersten Membran der Wirtszelle gebildet; solche "selbstverhüllten" Viren erschweren es dem Immunsystem, sie als "fremde" Strukturen zu erkennen. ⓘ
Geschichte der Immunologie

Die Immunologie ist eine Wissenschaft, die sich mit der Struktur und Funktion des Immunsystems befasst. Sie hat ihren Ursprung in der Medizin und in frühen Studien über die Ursachen der Immunität gegen Krankheiten. Die früheste bekannte Erwähnung der Immunität erfolgte während der Pest in Athen im Jahr 430 v. Chr. Thukydides stellte fest, dass Menschen, die sich von einem früheren Ausbruch der Krankheit erholt hatten, die Kranken pflegen konnten, ohne sich ein zweites Mal anzustecken. Im 18. Jahrhundert experimentierte Pierre-Louis Moreau de Maupertuis mit Skorpiongift und stellte fest, dass bestimmte Hunde und Mäuse gegen dieses Gift immun waren. Im 10. Jahrhundert verfasste der persische Arzt al-Razi (auch bekannt als Rhazes) die erste aufgezeichnete Theorie der erworbenen Immunität, indem er feststellte, dass eine Pockenerkrankung die Überlebenden vor künftigen Infektionen schützte. Obwohl er die Immunität damit erklärte, dass "überschüssige Feuchtigkeit" aus dem Blut ausgestoßen wird und somit ein erneutes Auftreten der Krankheit verhindert, erklärte diese Theorie viele Beobachtungen über Pocken, die zu dieser Zeit bekannt waren. ⓘ
Diese und andere Beobachtungen über die erworbene Immunität wurden später von Louis Pasteur bei der Entwicklung der Impfung und seiner Keimtheorie der Krankheit genutzt. Pasteurs Theorie stand in direktem Gegensatz zu den zeitgenössischen Krankheitstheorien, wie z. B. der Miasmentheorie. Erst mit den Nachweisen von Robert Koch aus dem Jahr 1891, für die er 1905 den Nobelpreis erhielt, wurden Mikroorganismen als Ursache von Infektionskrankheiten bestätigt. Viren wurden 1901 mit der Entdeckung des Gelbfiebervirus durch Walter Reed als menschliche Krankheitserreger bestätigt. ⓘ
Die Immunologie machte gegen Ende des 19. Jahrhunderts große Fortschritte durch rasche Entwicklungen bei der Erforschung der humoralen und zellulären Immunität. Besonders wichtig war die Arbeit von Paul Ehrlich, der die Seitenkettentheorie vorschlug, um die Spezifität der Antigen-Antikörper-Reaktion zu erklären; seine Beiträge zum Verständnis der humoralen Immunität wurden 1908 durch die Verleihung eines gemeinsamen Nobelpreises zusammen mit dem Begründer der zellulären Immunologie, Elie Metchnikoff, gewürdigt. 1974 entwickelte Niels Kaj Jerne die Theorie der Immunitätsnetzwerke; 1984 erhielt er gemeinsam mit Georges J. F. Köhler und César Milstein den Nobelpreis für Theorien zum Immunsystem. ⓘ
Unspezifisches und spezifisches Immunsystem
Es gibt zwei verschiedene Mechanismen des Immunsystems, zum einen die angeborene und daher erregerunspezifische Abwehr, zum anderen die erworbene erregerspezifische Abwehr. ⓘ
Angeborene oder unspezifische Immunabwehr
Schon sehr früh in der Stammesgeschichte der Lebewesen entwickelte sich die unspezifische oder angeborene Immunabwehr (engl. innate immunity). Dazu zählen anatomische und physiologische Barrieren wie Epithelien, aber auch zellvermittelte Gegenwehr durch Phagozytose, sowie allgemein entzündliche Reaktionen und das Komplementsystem. Die angeborene Immunantwort findet innerhalb von Minuten statt, ist aber durch die Erbinformation lebenslang festgelegt. ⓘ
Bestandteile
Die Bestandteile des Immunsystems sind:
- Zellen, wie zum Beispiel Granulozyten, natürliche Killerzellen (NK-Zellen) oder T-Lymphozyten. Sie sind teilweise zu spezialisierten Organen (→ Lymphatisches System) zusammengefasst.
- Proteine, die als Botenstoffe oder zur Abwehr von Krankheitserregern dienen
- psychische Immunfaktoren. ⓘ
Zelluläre Bestandteile

Die Zellen des Immunsystems zirkulieren in den Blutgefäßen und Lymphbahnen und kommen in den Geweben des Körpers vor. Dringt ein Krankheitserreger in den Körper ein, so können die Abwehrzellen ihn bekämpfen. Neutrophile Granulozyten, Monozyten/Makrophagen und dendritische Zellen können beispielsweise durch Aufnahme und Verdauung (Phagocytose) den Erreger selbst vernichten oder durch die Produktion von Immunmodulatoren und Zytokinen die Immunreaktion des Organismus steuern und andere Abwehrzellen zum Ort der Entzündung locken. ⓘ
Humorale Bestandteile
Die humoralen Bestandteile des Immunsystems (von humor ‚Flüssigkeit‘) bezeichnen verschiedene Plasmaproteine, die passiv im Blut, bzw. der Lymph- und Gewebsflüssigkeit zirkulieren. Sie sind im Gegensatz zu den Abwehrzellen nicht in der Lage, aktiv an den Ort einer Infektion zu wandern. ⓘ
Komplementsystem
Das Komplementsystem ist Teil der angeborenen Immunantwort, es besteht aus einer Gruppe von über 30 Plasmaproteinen mit ganz unterschiedlichen Eigenschaften. Ein Teil der zum Komplementsystem gehörenden Proteine sind zum Beispiel Proteasen, die sich an Mikroorganismen binden können und die Zellwände des Eindringlings schädigen, wodurch der Eindringling zerstört wird. Andere Proteine des Komplementsystems, die Anaphylatoxine, haben gefäßerweiternde Wirkung und fördern die Entzündungsreaktion. Viele Komplementfaktoren können außerdem Abwehrzellen zum Ort der Infektion locken und sind in der Lage, Fresszellen zu aktivieren, die die Eindringlinge dann verschlingen. ⓘ
Interleukine
Die zu den Zytokinen gehörenden Interleukine sind körpereigene Botenstoffe, die von den Zellen des Immunsystems gebildet werden. Man kennt heutzutage bereits eine große Zahl von Interleukinen (IL-1 bis IL-35; Stand November 2009), die jeweils auf ganz unterschiedliche Abwehrzellen wirken – manche regen beispielsweise Leukozyten zu Wachstum, Reifung und Teilung an oder sorgen für deren Aktivierung. ⓘ
Geschlechtsspezifische Unterschiede
Männer und Frauen haben grundsätzlich das gleiche Immunsystem. Die Art und Stärke der Immunreaktionen bei den Geschlechtern sind jedoch verschieden. Dies führt zur geschlechtsspezifischen Prävalenz, Manifestation und Behandlungsergebnis von Malignomen sowie von autoimmunen und infektiösen Erkrankungen. ⓘ
Infektionen
Man findet, dass das Immunsystem teilweise östrogenabhängig ist, sodass Frauen vor einigen Viruserkrankungen möglicherweise besser geschützt sind wie etwa Influenza A-Viruserkrankungen (hierbei spielen jedoch auch noch andere Faktoren eine Rolle). Zellen des angeborenen Immunsystems der Frauen produzieren erheblich mehr Alpha-Interferon bei einer HIV-Exposition als die Zellen der Männer. Auch hier wurde die Frage gestellt, ob dies ein Östrogen-Effekt ist. Hepatitis-B-Folgeerkrankungen (wie das Hepatozelluläre Carcinom) zeigen jedoch eine deutliche Prävalenz des männlichen Geschlechts, wofür ein direkter Einfluss von Sexualhormonen auf die Virusreplikation verantwortlich gemacht wird. ⓘ
Nicht nur die Ausprägung von Viruserkrankungen, sondern auch das Vorkommen und der Behandlungserfolg von parasitären Erkrankungen (Amöbiasis, Leishmaniose, Helminthen-Infektionen) zeigen eine Abhängigkeit zuungunsten des männlichen Geschlechts, die auf eine direkte Androgenwirkung auf das Immunsystem zurückgeführt wird. ⓘ
Eine der häufigsten Bakterieninfektionen des Menschen ist die Tuberkulose, von der überproportional viele Männer betroffen sind, deren Behandlungserfolg zudem auch schlechter ist. Die Ursachen hierfür werden untersucht. In den letzten Jahren hat auch die geschlechtsabhängige Modulation der durch eine Impfung erzeugten Immunantwort das Interesse der Immunologen auf sich gezogen. ⓘ
Autoimmunerkrankungen
Neben biochemischen gibt es auch genetische Unterschiede der Immunsysteme. Einige an der Immunabwehr beteiligten Gene liegen auf dem (bei Frauen doppelt vorhandenen) X-Chromosom. Bei fehlender X-Inaktivierung werden diese, wie das des TLR 7 (Toll-like-Rezeptor 7), verstärkt exprimiert, sodass das Immunsystem bei solchen Frauen überaktiv ist, was zu Autoimmunerkrankungen wie dem Systemischen Lupus erythematodes führen kann. Auch an anderen Autoimmunerkrankungen, wie an der Primär biliären Cholangitis und der Autoimmunhepatitis erkranken Frauen deutlich häufiger. Dasselbe gilt auch für entzündliche Erkrankungen des Zentralnervensystems wie die Multiple Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und die durch neuronale Autoantikörper vermittelte Autoimmunenzephalitis. ⓘ
Malignome
„Geschlechtsabhängige Prävalenz und Manifestation von Erkrankungen sind nicht auf Infektions- und Autoimmunkrankheiten beschränkt, sondern betreffen auch Krebserkrankungen, die als Todesursachen weltweit an der Spitze stehen.“ „Viele solide Tumoren außerhalb der Geschlechtsorgane sind bei Männern häufiger, und auch das Vorkommen hämatologischer Malignome zeigt geschlechtsabhängige Unterschiede,“ deren Mechanismen besonders auch im Hinblick auf die Leukämie und ihre Therapie mit Immuncheckpoint-Inhibitoren diskutiert werden. ⓘ
Weiteres
Darüber hinaus hat auch das Verständnis der entscheidenden Rolle einer Geschlechtsabhängigkeit des menschlichen Darm-Mikrobioms bei der Regulation von Immunprozessen in den letzten Jahren zugenommen. ⓘ
Störungen und Erkrankungen
Wie bei allen biologischen Systemen können sich auch beim Immunsystem Fehler einschleichen. So kann das Immunsystem seine Fähigkeit verlieren, auf Erreger oder körpereigene Zellen angemessen zu reagieren: je nach Ursache der Störung kommt es entweder zu einer zu schwachen oder gar fehlenden Immunantwort oder zu einer zu starken, überschießenden Immunreaktion. Auch die Zellen des Immunsystems können maligne entarten und eine Krebserkrankung auslösen. Ebenso wird ein Einfluss von depressiven Störungen, Stress und anderen psychischen Erkrankungen auf das Immunsystem vermutet. ⓘ
Inadäquate Immunreaktionen
- Autoimmunerkrankungen: Nicht immer funktionieren die Schutzmechanismen der Selbsttoleranz fehlerfrei, sodass es zu gefährlichen Autoimmunkrankheiten kommen kann, bei denen das Immunsystem körpereigene Strukturen angreift. Bei diesen Krankheiten ist das üblicherweise sehr gut ausbalancierte Gleichgewicht zwischen einerseits den potentiell selbstzerstörerisch wirkenden (autoreaktiven) T-Zellen und andererseits den regulatorischen T-Zellen gestört, die die Ersteren eigentlich in „Schach halten“ sollen. Einige Beispiele für Autoimmunerkrankungen sind:
- Diabetes Typ I, verursacht durch Antikörper gegen Beta-Inselzellen der Bauchspeicheldrüse.
- Rheumatoide Arthritis, bei der es durch eine Immunreaktion zu einer Entzündung der Gelenkinnenhaut kommt.
- Multiple Sklerose, verursacht durch Antikörper gegen die Myelinscheide von Nervenfasern.
- Allergie/Heuschnupfen: Das Immunsystem kann die Fähigkeit verlieren, auf fremde Eiweiße angemessen zu reagieren. Die übermäßige Aktivierung von Basophilen (und Eosinophilen), insbesondere aber der ortsständigen Mastzellen, kann zur allergischen Reaktionen, wie zum Beispiel Heuschnupfen, führen. Eine systematische Aktivierung dieser Zellen, also die Aktivierung im ganzen Körper, kann schwere Symptome bis hin zum anaphylaktischen Schock auslösen.
- Zytokinsturm: Eine Überreaktion des Immunsystems, bei der die sonst übliche Regulierung der Bildung von Zytokinen nicht funktioniert. ⓘ
Krebserkrankungen

Auch die Zellen des Immunsystems können bösartig entarten und so zu Krebserkrankungen führen, die meist den gesamten Körper befallen und sich vor allem in den Organen des Immunsystems abspielen und zur Abnahme der Immunabwehr und Verdrängung der normalen Blutbildung im Knochenmark führen. Durch die große Zahl unterschiedlicher Zellen und deren Vorläufer gibt es eine Vielzahl von verschiedenen Krebserkrankungen mit ganz unterschiedlichen Symptomen und Krankheitsverläufen, die aber grob in zwei Gruppen eingeteilt werden können: Geht der Krebs von den Vorläuferzellen im Knochenmark aus, so spricht man von Leukämien, die akut oder chronisch verlaufen können. Bösartige Tumoren der Lymphknoten nennt man Lymphknotenkrebs oder malignes Lymphom. ⓘ
Andererseits ist ein therapeutischer Ansatz bei Krebserkrankungen, die Krebsimmuntherapie, die Aktivierung des Immunsystems gegen Tumorzellen. ⓘ
Sonstige Schwachpunkte
- Haben Viren sich in eine Schicht eingehüllt, die der Körper nicht als fremd erkennt (beispielsweise eine Schicht aus Lipiden), so sind sie nicht erkennbar.
- Einige Bakterien hüllen sich in eine Schutzkapsel, um die Aufnahme in Fresszellen zu erschweren, z. B. Pneumokokken oder Meningokokken. Bekapselte Bakterien haben eine höhere bakterielle Virulenz als unbekapselte Arten.
- Im Gegensatz zu Krankheitserregern verursachen Tumorzellen keine Entzündungsreaktion, es kommt daher nicht zu einer Aktivierung der Immunantwort. Einige Tumoren haben die Eigenschaft, sich regelrecht zu tarnen. Wenn keine tumorassoziierten Antigene (TAA) von den Krebszellen gebildet werden, erkennt das Immunsystem die Krebszelle daher nicht und es kommt zu Krebswachstum und/oder Metastasierung.
- Das Immunsystem schützt nach heutigem Kenntnisstand nicht vor Prionen (infektiöse Proteine), sondern scheint – im Gegenteil – eine Rolle bei der Ausbreitung der Prionenerkrankung zu spielen. So waren beispielsweise in einem Experiment Mäuse mit defektem Immunsystem immun gegen eingebrachte Prionen, während Tiere mit funktionierendem Immunsystem eine Erkrankung entwickelten. ⓘ
Einflüsse
Bei einem intakten Immunsystem spricht man von Immunkompetenz. Die Abwehrfunktion kann auf verschiedene Weise positiv oder negativ beeinflusst werden. ⓘ
Negative Einflussfaktoren
Es gibt viele Verhaltensweisen und Umweltfaktoren, denen ein negativer Einfluss auf das Immunsystem zugeschrieben wird, z. B.:
- Schlafmangel kann den Stoffwechsel und das Immunsystem beeinflussen
- Langzeitbelastung des Körpers mit Genussgiften (Nikotin, Alkohol und Drogen).
- Ungesunde Ernährung, bei der u. a. Mineralstoffe und Vitamine fehlen.
- Chronischer Stress bewirkt die Ausschüttung von Glucocorticoiden, was die Produktion von Zytokinen und damit die Aktivität des adaptiven Immunsystems hemmt.
- Angst
- Aufnahme von Umweltgiften aus der Umgebung,
- Einwirkung ionisierender Strahlung (akute Strahlenkrankheit und vermehrt auftretende Malignome nach Hiroshima und Tschernobyl)
- Unterkühlung.
- Zu häufige erschöpfende körperliche Belastungen (Zwangsarbeit, Leitungssport)
- Virusinfektionen, die mit einer Immunsuppression einhergehen (Masern, HIV), alle sonstigen Virusinfektionen
- Hohes Lebensalter (bei hochbetagten Menschen lässt die Effizienz des Immunsystems nach, siehe Immunoseneszenz)
- Medikamentöse Immunsuppression nach Organtransplantation oder bei Autoimmunkrankheiten. ⓘ
Positive Einflussfaktoren
Die meisten wissenschaftlich fundierten Empfehlungen für eine Stärkung des Immunsystems haben vor allem die Vermeidung oder Reduzierung negativer Einflussfaktoren zum Ziel. ⓘ
Die Ernährung hat zwar eine Wirkung auf die Abwehrkräfte, allerdings sind vor allem negative Effekte durch Mangel- oder einseitige Ernährung bekannt. Darüber hinaus kann einzelnen Lebensmitteln kein gezielter positiver Einfluss bestätigt werden, zumal sich die Darmflora von Mensch zu Mensch sehr unterscheidet. ⓘ
Moderater, regelmäßiger Ausdauersport hat neben der positiven Wirkung auf das Herz-Kreislauf-System auch einen positiven Effekt auf die Funktionalität des Immunsystems. ⓘ
Vielen Haushaltsmitteln und Life-Style-Ratschlägen wie kalt duschen, saunieren, Hühnersuppe, Echinacea etc. konnte in wissenschaftlichen Untersuchungen kein positiver Einfluss auf das Immunsystem attestiert werden. Unstrittig ist allerdings, dass Personen mit therapiebedürftigen Problemen (z. B. durch Laboruntersuchungen nachgewiesene Vitaminmangelerkrankungen wie Skorbut) durch Vitamingaben behandelt werden oder dass im Krankheitsfall alle das Immunsystem potentiell schwächenden Faktoren ausgeschaltet werden können. ⓘ
Die Redewendungen „Stärkung des Immunsystems“ und „Stärkung der Abwehrkräfte“ werden häufig in rechtswidriger Weise als Claim in der Werbung für Nahrungsergänzungsmittel, Functional-Food und alternativmedizinische Heilmittel verwendet. Solche Verweise auf allgemeine, nichtspezifische Vorteile eines Produktes sind nach EU-Recht laut Artikel 10 Absatz 3 der Health-Claims Verordnung verboten, sofern ihnen nicht eine durch die Europäische Behörde für Lebensmittelsicherheit genehmigte spezielle gesundheitsbezogene Angabe beigefügt ist. Für eine Aufnahme in die entsprechende Positivliste genehmigter Angaben muss die Art und Weise, in der das Produkt auf das Immunsystem wirkt, angegeben und die Wirksamkeit wissenschaftlich belegt werden. ⓘ
Einfluss auf die Partnerwahl bei Tieren
Untersuchungen mit Tieren am Max-Planck-Institut für Immunbiologie erbrachten unter anderem Hinweise auf einen Zusammenhang zwischen dem individuellen Immunsystem eines Lebewesens und der Partnerwahl. Über den Geruchssinn kann die genetische Individualität und Verschiedenheit erfasst und bewertet werden. Die Untersuchungen ergaben: MHC-Peptide erlauben dem Immunsystem, durch die Analyse der MHC-Peptidkomplexe an der Zelloberfläche durch die T-Zellrezeptoren Information über den Status von einzelnen Zellen zu erlangen. Und die Analyse der Struktur dieser Peptide ermöglicht über olfaktorische Neuronen Informationen über den genetischen Status eines Gegenübers zu gewinnen. Dies ist möglich, weil die Struktur der Ankerreste von Peptiden Rückschlüsse auf die Struktur von MHC-Molekülen und damit Rückschlüsse auf die Kodierungskapazität von Organismen erlauben. ⓘ
