Flusssäure

| |||
|
| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Fluoran
| |||
| Andere Namen
Fluorwasserstoffsäure
Hydroniumfluorid | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| EC-Nummer |
| ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
HF (aq) | ||
| Erscheinungsbild | Farblose Flüssigkeit | ||
| Dichte | 1,15 g/ml (für 48%ige Lösung) | ||
| Acidität (pKa) | 3.17 | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H280, H300, H310, H314, H330 | ||
Sicherheitshinweise
|
P260, P262, P264, P270, P271, P280, P284, P301+P310, P301+P330+P331, P302+P350, P303+P361+P353, P304+P340, P305+P351+P338, P310, P320, P321, P322, P330, P361, P363, P403+P233, P405, P410+P403, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
Sofern nicht anders angegeben, gelten die Daten für Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Fluorwasserstoffsäure ist eine Lösung von Fluorwasserstoff (HF) in Wasser. Lösungen von HF sind farblos, sauer und stark ätzend. Sie wird zur Herstellung der meisten fluorhaltigen Verbindungen verwendet; Beispiele sind das häufig verwendete pharmazeutische Antidepressivum Fluoxetin (Prozac) und das Material PTFE (Teflon). Aus ihm wird elementares Fluor hergestellt. Es wird häufig zum Ätzen von Glas- und Siliziumwafern verwendet. ⓘ
Wenn Fluorwasserstoffsäure mit der menschlichen Haut in Berührung kommt, verursacht sie tiefe Verbrennungen. ⓘ
ⓘ| Allgemeines | ||||||||
|---|---|---|---|---|---|---|---|---|
| Name | Flusssäure | |||||||
| Andere Namen |
Fluorwasserstoffsäure | |||||||
| Summenformel | HF (aq) | |||||||
| Kurzbeschreibung |
farblose Flüssigkeit | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 20,01 g·mol−1 | |||||||
| Aggregatzustand |
flüssig | |||||||
| Dichte |
1,14 g·cm−3 (38 %, Azeotrop) | |||||||
| Schmelzpunkt |
−44 °C (38–40 %) | |||||||
| Siedepunkt |
112 °C (38 %) | |||||||
| Löslichkeit |
mischbar mit Wasser | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| MAK |
1 ml·m−3 | |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Flusssäure, auch Fluorwasserstoffsäure genannt (zur Namensgebung siehe Fluorit), ist die wässrige Lösung von Fluorwasserstoff (HF). Flusssäure ist eine farblose, stechend riechende, hochgiftige Flüssigkeit. Sie greift selbst Glas stark an und wirkt stark ätzend auf die Haut, die Schleimhäute und die Bindehaut der Augen, wobei schon eine geringe Exposition (bspw. durch dermale Aufnahme) schnell zum Tod führen kann. Eine Lösung von 38,2 % HF in Wasser bildet ein azeotrop siedendes Gemisch mit einem Siedepunkt von 112 °C. Flusssäure wird, abhängig von der Konzentration, entweder in Behältern aus Kunststoff oder aus rostfreiem Stahl aufbewahrt. ⓘ
Verwendungen
Herstellung von fluororganischen Verbindungen
Flusssäure wird hauptsächlich in der fluororganischen Chemie verwendet. Viele fluororganische Verbindungen werden mit HF als Fluorquelle hergestellt, darunter Teflon, Fluorpolymere, Fluorkohlenwasserstoffe und Kühlmittel wie Freon. Viele pharmazeutische Produkte enthalten Fluor. ⓘ
Herstellung von anorganischen Fluoriden
Die meisten in großen Mengen hergestellten anorganischen Fluoridverbindungen werden aus Flusssäure hergestellt. Am bekanntesten sind Na3AlF6, Kryolith, und AlF3, Aluminiumtrifluorid. Eine geschmolzene Mischung dieser Feststoffe dient als Hochtemperaturlösungsmittel für die Herstellung von metallischem Aluminium. Andere anorganische Fluoride, die aus Flusssäure hergestellt werden, sind Natriumfluorid und Uranhexafluorid. ⓘ
Ätzmittel, Reiniger

Es wird in der Halbleiterindustrie als Hauptbestandteil von Wright Etch und Buffered Oxide Etch verwendet, die zur Reinigung von Siliziumwafern eingesetzt werden. In ähnlicher Weise wird es auch zum Ätzen von Glas durch Behandlung mit Siliziumdioxid verwendet, um gasförmige oder wasserlösliche Siliziumfluoride zu bilden. Es kann auch zum Polieren und Mattieren von Glas verwendet werden. ⓘ
- SiO2 + 4 HF → SiF4(g) + 2 H2O
- SiO2 + 6 HF → H2SiF6 + 2 H2O ⓘ
Ein 5 % bis 9 %iges Flusssäuregel wird üblicherweise auch zum Ätzen aller keramischen Zahnrestaurationen verwendet, um die Haftung zu verbessern. Aus ähnlichen Gründen ist verdünnte Flusssäure Bestandteil von Haushalts-Rostentfernern, in Autowaschanlagen in "Felgenreiniger"-Mischungen, in Rostschutzmitteln für Keramik und Textilien und in Wasserfleckenentfernern. Aufgrund ihrer Fähigkeit, Eisenoxide und Verunreinigungen auf Siliziumdioxidbasis aufzulösen, wird Flusssäure bei der Vorinbetriebnahme von Kesseln verwendet, die Hochdruckdampf erzeugen. Flusssäure ist auch nützlich, um Gesteinsproben (in der Regel in Pulverform) vor der Analyse aufzulösen. In ähnlicher Weise wird diese Säure in sauren Mazerationen verwendet, um organische Fossilien aus Silikatgestein zu extrahieren. Das fossile Gestein kann direkt in die Säure getaucht werden, oder es wird ein Film aus Zellulosenitrat (in Amylacetat gelöst) aufgetragen, der an der organischen Komponente haftet und die Auflösung des Gesteins um ihn herum ermöglicht. ⓘ
Ölraffination
In einem Standardverfahren der Erdölraffinerie, der so genannten Alkylierung, wird Isobutan mit niedermolekularen Alkenen (hauptsächlich eine Mischung aus Propylen und Butylen) in Gegenwart eines sauren Katalysators aus Flusssäure alkyliert. Der Katalysator protoniert die Alkene (Propylen, Butylen), um reaktive Carbokationen zu erzeugen, die das Isobutan alkylieren. Die Reaktion wird bei milden Temperaturen (0 und 30 °C) in einer Zweiphasenreaktion durchgeführt. ⓘ
Herstellung
Getrocknetes Fluoritpulver und Schwefelsäure werden zur Reaktion in den Drehrohrofen gegeben. Die Temperatur der Ofengasphase wird auf etwa 280 °C geregelt. Das Nachreaktionsgas tritt in den Rohdestillationsturm ein, um den größten Teil der Schwefelsäure, des Wassers und des Fluoritpulvers zu entfernen. Die Temperatur des Turmkessels wird auf 100 bis 110 °C geregelt und die Kopftemperatur beträgt 35 bis 40 °C. Das rohe Fluorwasserstoffgas wird durch einen Entgasungsturm weiter in einen flüssigen Zustand kondensiert und tritt dann in den Rektifikationsturm zur Rektifikation ein. Der gereinigte Fluorwasserstoff wird von Wasser absorbiert, so dass Flusssäure erhalten wird. Die Reaktionsgleichung lautet:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{HF + H2O -> F^- + H3O^+ <span title="Aus: Deutsche Wikipedia, Abschnitt "Herstellung"" class="plainlinks">[https://de.wikipedia.org/wiki/Flusssäure#Herstellung <span style="color:#dddddd">ⓘ</span>]</span>}}
Das Nebenprodukt Fluoroanhydrit findet in der Baustoffindustrie Verwendung. ⓘ
Flusssäure fällt auch bei der Produktion von Phosphorsäure aus Fluorapatit an, wobei der Reaktionsgang analog zum oben dargestellten ist, jedoch unter Beteiligung von Phosphat. Der hierbei analog anfallende Phosphorgips ist jedoch zumeist zu verunreinigt um wirtschaftlich nutzbar zu sein. ⓘ
Flusssäure wurde erstmals im Jahr 1771 von Carl Wilhelm Scheele hergestellt. Heute wird sie hauptsächlich durch Behandlung des Minerals Fluorit, CaF2, mit konzentrierter Schwefelsäure bei etwa 265 °C hergestellt. ⓘ
- CaF2 + H2SO4 → 2 HF + CaSO4 ⓘ
Die Säure ist auch ein Nebenprodukt bei der Herstellung von Phosphorsäure aus Apatit und Fluorapatit. Beim Aufschluss des Minerals mit Schwefelsäure bei erhöhten Temperaturen wird ein Gasgemisch freigesetzt, darunter auch Fluorwasserstoff, der zurückgewonnen werden kann. ⓘ
Wegen ihrer hohen Reaktivität gegenüber Glas wird Fluorwasserstoffsäure in Behältern aus fluoriertem Kunststoff (häufig PTFE) gelagert. ⓘ
Eigenschaften
In verdünnter wässriger Lösung verhält sich Fluorwasserstoff wie eine schwache Säure, Mit Hilfe der Infrarotspektroskopie konnte gezeigt werden, dass in Lösung die Dissoziation mit der Bildung des Ionenpaares H3O+-F- einhergeht. ⓘ
- H2O + HF ⇌ H3O+⋅F- pKa = 3,17
Dieses Ionenpaar ist im kristallinen Zustand bei sehr niedriger Temperatur charakterisiert worden. Die weitere Assoziation wurde sowohl in Lösung als auch im festen Zustand charakterisiert.
- HF + F- ⇌ HF-
2 log K = 0,6 ⓘ
Es wird angenommen, dass die Polymerisation mit steigender Konzentration erfolgt. Diese Annahme wird gestützt durch die Isolierung eines Salzes eines tetrameren Anions H
3F-
4 und durch Röntgenkristallographie bei niedriger Temperatur gestützt. Die Spezies, die in konzentrierten wässrigen Lösungen von Fluorwasserstoff vorkommen, sind nicht alle charakterisiert; neben HF-
2 ist auch die Bildung anderer polymerer Spezies bekannt, nämlich H
n-1F-
n, ist sehr wahrscheinlich. ⓘ
Die Hammett-Säurefunktion, H0, für 100 % HF wird auf einen Wert zwischen -10,2 und -11 geschätzt, was mit dem Wert -12 für Schwefelsäure vergleichbar ist. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{SiO2 + 6HF -> H2[SiF6] + 2 H2O <span title="Aus: Deutsche Wikipedia, Abschnitt "Eigenschaften"" class="plainlinks">[https://de.wikipedia.org/wiki/Flusssäure#Eigenschaften <span style="color:#dddddd">ⓘ</span>]</span>}}
Säuregrad
Im Gegensatz zu anderen Halogenwasserstoffsäuren, wie z. B. Salzsäure, ist Fluorwasserstoff in verdünnter wässriger Lösung nur eine schwache Säure. Dies ist zum Teil auf die Stärke der Wasserstoff-Fluor-Bindung zurückzuführen, aber auch auf andere Faktoren wie die Tendenz von HF, H
2O und F-
Anionen zur Bildung von Clustern. Bei hohen Konzentrationen gehen HF-Moleküle eine Homoassoziation ein und bilden mehratomige Ionen (z. B. Bifluorid, HF-
2) und Protonen zu bilden, wodurch sich der Säuregrad stark erhöht. Dies führt zur Protonierung sehr starker Säuren wie Salzsäure, Schwefelsäure oder Salpetersäure, wenn konzentrierte Flusssäurelösungen verwendet werden. Obwohl Flusssäure als schwache Säure gilt, ist sie sehr ätzend und greift im hydratisierten Zustand sogar Glas an. ⓘ
Der Säuregrad von Flusssäurelösungen variiert mit der Konzentration, was auf die Wasserstoffbrückenwechselwirkungen des Fluoridions zurückzuführen ist. Verdünnte Lösungen sind schwach sauer mit einer Säureionisationskonstante Ka = 6,6×10-4 (oder pKa = 3,18), im Gegensatz zu den entsprechenden Lösungen der anderen Halogenwasserstoffe, die starke Säuren sind (pKa < 0). Konzentrierte Lösungen von Fluorwasserstoff sind viel stärker sauer als dieser Wert vermuten lässt, wie Messungen der Hammett-Säurefunktion H0 (oder "effektiver pH") zeigen. Der H0-Wert für 100 % HF liegt schätzungsweise zwischen -10,2 und -11, vergleichbar mit dem Wert -12 für Schwefelsäure. ⓘ
Aus thermodynamischer Sicht sind HF-Lösungen höchst ungünstig, da die Aktivität von HF viel schneller zunimmt als ihre Konzentration. Die schwache Acidität in verdünnter Lösung wird manchmal auf die hohe H-F-Bindungsstärke zurückgeführt, die in Verbindung mit der hohen Lösungsenthalpie von HF die negativere Hydratationsenthalpie des Fluoridions aufwiegt. Paul Giguère und Sylvia Turrell haben mit Hilfe der Infrarotspektroskopie gezeigt, dass die vorherrschende gelöste Spezies in verdünnter Lösung das wasserstoffgebundene Ionenpaar H3O+-F- ist. ⓘ
Mit zunehmender HF-Konzentration nimmt auch die Konzentration des Difluorwasserstoff-Ions zu. Die Reaktion
- 3 HF ⇌ HF-
2 + H2F+
ist ein Beispiel für eine Homokonjugation. ⓘ
Gesundheit und Sicherheit
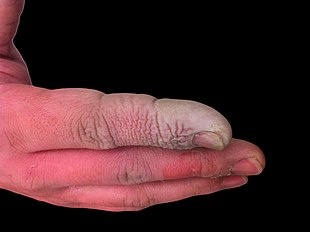
Flusssäure ist nicht nur eine stark ätzende Flüssigkeit, sondern auch ein starkes Kontaktgift. Da Flusssäure in das Gewebe eindringen kann, kann es leicht zu Vergiftungen kommen, wenn die Haut oder die Augen in Berührung kommen oder wenn sie eingeatmet oder verschluckt wird. Die Symptome einer Exposition gegenüber Flusssäure sind möglicherweise nicht sofort erkennbar, was den Opfern eine falsche Sicherheit gibt und sie dazu veranlasst, eine medizinische Behandlung zu verzögern. Obwohl HF einen irritierenden Geruch hat, kann sie auch ohne offensichtlichen Geruch gefährliche Konzentrationen erreichen. HF beeinträchtigt die Nervenfunktion, so dass Verbrennungen anfangs möglicherweise nicht schmerzhaft sind. Unbeabsichtigte Expositionen können unbemerkt bleiben, was die Behandlung verzögert und das Ausmaß und die Schwere der Verletzung vergrößert. Zu den Symptomen einer HF-Exposition gehören Reizungen der Augen, der Haut, der Nase und des Rachens, Augen- und Hautverätzungen, Schnupfen, Bronchitis, Lungenödeme (Flüssigkeitsansammlungen in der Lunge) und Knochenschäden. ⓘ
Verwendung
Für Flusssäure gibt es zahlreiche Verwendungszwecke in Industrie und Wissenschaft. Die industrielle Gesamtproduktion in Europa betrug im Jahre 2015 über 230.000 Tonnen. Diese wurden in neun Produktionsstätten hergestellt. Fünf davon stehen in Deutschland. ⓘ
Industrielle Verwendung
- Fluorchlorkohlenwasserstoffe (FCKW) werden vor allem in der Kältetechnik und zur Verschäumung von Kunststoffen benutzt.
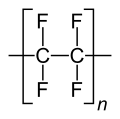 Strukturformel von Polytetrafluorethylen (Teflon)
Strukturformel von Polytetrafluorethylen (Teflon) - 60 % der Flusssäure werden für die Herstellung von Fluorkohlenstoffen (FK) benötigt.
- Fluorpolymere sind Kunststoffe, die sich durch ihre besondere Stabilität auszeichnen. Der bekannteste davon ist PTFE (Teflon).
- Metallgewinnung und -verarbeitung. Flusssäure ist dort z. B. ein Reaktionsprodukt, um Aluminiumfluorid herzustellen oder wird bei der Gewinnung seltener Metalle wie Niob oder Tantal und bei der Oberflächenbehandlung von rostfreiem Edelstahl eingesetzt.
- Ansonsten kommt Flusssäure in der Erdölindustrie als Katalysator, in geringen Maße in der Arzneimittel- und Pflanzenschutzmittelherstellung, zum Einsatz.
- Darüber hinaus wird die glasätzende Wirkung bei der Herstellung von Kristallglas zur Oberflächenpolierung genutzt. ⓘ
Forschung und Wissenschaft

In der Forschung ist Flusssäure unter anderem ein Ätzmittel für Siliciumdioxid, Titan, Niob, Tantal oder Wolfram, z. B. in der Mikrostrukturierung von Oberflächen. Dort wird häufig eine mit Ammoniumfluorid gepufferte Flusssäure verwendet, um den Ablauf des Ätzprozess besser steuern zu können. Daneben wird die Fähigkeit Silicate zu lösen bei Aufschlussverfahren in der Analytik eingesetzt. ⓘ
In der Paläontologie und Pollenkunde wird HF zum Freilegen von unempfindlichen Fossilien oder von Exinen benutzt. ⓘ
Sonstige Verwendung
Eine 10 % wässrige Fluorwasserstofflösung findet Verwendung als Rostentferner für Textilien. ⓘ
Flusssäure wird auch zum „Etching“, dem Zerkratzen von Glasscheiben, häufig an Einrichtungen des Öffentlichen Personenverkehrs, verwendet (siehe dazu auch Scratching). Dabei kann es zu schweren Verletzungen der Haut und der Atemwege kommen, wenn Fahrgäste oder das Reinigungspersonal mit der Flüssigkeit in Berührung kommen. ⓘ
Durch die Populärkultur, wie der US-Fernsehserie Breaking Bad, erlangte Fluorwasserstoffsäure zusätzliche Berühmtheit. Der Mythos, dass diese mühelos Leichen zersetzen kann, gilt allerdings als widerlegt. ⓘ
Toxikologie

Flusssäure ist ein starkes Kontaktgift. Ihre Gefährlichkeit wird dadurch erhöht, dass sie wegen ihrer hohen Lipidlöslichkeit von der Haut sofort resorbiert wird. So ist eine Verätzung tieferer Gewebeschichten und sogar der Knochen möglich, ohne dass die Haut äußerlich sichtbar verletzt ist. Durch sofortiges Unterspritzen des kontaminierten Gewebes mit Calciumgluconat-Lösung kann einem tieferen Eindringen bedingt entgegengewirkt werden. ⓘ
Eine handtellergroße Verätzung durch 40-prozentige Flusssäure ist in aller Regel durch resorptive Giftwirkung tödlich. Besonders tückisch ist, dass ein warnender Schmerz oft erst mit einer Verzögerung von mehreren Stunden auftritt. Schmerzstillende Mittel, selbst Opiate und Opioide wie Morphin und Fentanyl, sind hierbei fast wirkungslos. Im schlimmsten Fall müssen die Gliedmaße oder ein großer Teil davon aufgrund der tödlichen Wirkung von Flusssäure amputiert werden. ⓘ
Neben der ätzenden Wirkung trägt zur Gefährlichkeit von Flusssäure bei, dass die Fluoridionen den Calcium- und Magnesiumstoffwechsel blockieren und wichtige Enzyme hemmen. Dies führt zu akut bedrohlichen Stoffwechselstörungen, die unter multiplem Organversagen tödlich verlaufen können. Flusssäure schädigt auch das Nervensystem. ⓘ