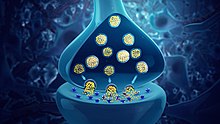
Neurotransmitter
| Struktur einer typischen chemischen Synapse ⓘ |
|---|
Ein Neurotransmitter ist ein Signalmolekül, das von einem Neuron ausgeschüttet wird, um eine andere Zelle über eine Synapse zu beeinflussen. Die Zelle, die das Signal empfängt, ein beliebiger Hauptkörperteil oder eine Zielzelle, kann ein anderes Neuron sein, aber auch eine Drüse oder eine Muskelzelle. ⓘ
Neurotransmitter werden aus synaptischen Vesikeln in den synaptischen Spalt freigesetzt, wo sie mit Neurotransmitter-Rezeptoren auf der Zielzelle interagieren können. Die Wirkung des Neurotransmitters auf die Zielzelle wird durch den Rezeptor bestimmt, an den er bindet. Viele Neurotransmitter werden aus einfachen und reichlich vorhandenen Vorläufern wie Aminosäuren synthetisiert, die leicht verfügbar sind und oft nur wenige Biosyntheseschritte für die Umwandlung erfordern. ⓘ
Neurotransmitter sind für die Funktion komplexer neuronaler Systeme unerlässlich. Die genaue Anzahl der einzelnen Neurotransmitter beim Menschen ist nicht bekannt, aber es wurden bereits mehr als 100 identifiziert. Zu den gängigen Neurotransmittern gehören Glutamat, GABA, Acetylcholin, Glycin und Noradrenalin. ⓘ
Neurotransmitter, auch kurz Transmitter genannt, sind Botenstoffe, die an chemischen Synapsen die Erregung von einer Nervenzelle auf andere Zellen übertragen (synaptische Transmission). ⓘ
Die Transmitterstoffe werden im Zellkörper oder in der Endigung des Axons vom sendenden Neuron produziert, hier innerhalb synaptischer Bläschen in gewisser Menge (Quantum) vorrätig gehalten und bei Erregung in bestimmten Mengen (Quanten) freigesetzt. Ihre Wirkung hängt von der Membranausstattung der empfangenden Zelle mit Rezeptoren und Ionenkanälen ab. ⓘ
Der Ausdruck Neurotransmitter ist abgeleitet von altgriechisch νεῦρον neuron „Sehne, Nerv“ und lateinisch transmittere „hinüber schicken, übertragen“. ⓘ
Mechanismus und Zyklus
Synthese
Neurotransmitter werden im Allgemeinen in den Neuronen synthetisiert und bestehen aus Vorläufermolekülen, die in der Zelle reichlich vorhanden sind, oder werden von diesen abgeleitet. Zu den Klassen von Neurotransmittern gehören Aminosäuren, Monoamine und Peptide. Monoamine werden durch Veränderung einer einzigen Aminosäure synthetisiert. Der Vorläufer von Serotonin ist zum Beispiel die Aminosäure Tryptophan. Peptid-Transmitter oder Neuropeptide sind Protein-Transmitter, die oft zusammen mit anderen Transmittern freigesetzt werden und eine modulierende Wirkung haben. Purin-Neurotransmitter, wie ATP, werden aus Nukleinsäuren gewonnen. Andere Neurotransmitter setzen sich aus Stoffwechselprodukten wie Stickstoffmonoxid und Kohlenmonoxid zusammen. ⓘ
| Beispiele ⓘ | |
|---|---|
| Aminosäure | Glycin, Glutamat |
| Monoamine | Serotonin, Epinephrin, Dopamin |
| Peptide | Substanz P, Opioide |
| Purine | ATP, GTP |
| Andere | Stickstoffmonoxid, Kohlenmonoxid |
Speicherung
Neurotransmitter werden im Allgemeinen in synaptischen Vesikeln gespeichert, die sich nahe der Zellmembran am Axonende des präsynaptischen Neurons befinden. Einige Neurotransmitter, wie die Stoffwechselgase Kohlenmonoxid und Stickstoffmonoxid, werden jedoch synthetisiert und unmittelbar nach einem Aktionspotenzial freigesetzt, ohne jemals in Vesikeln gespeichert zu werden. ⓘ
Freisetzung
Im Allgemeinen wird ein Neurotransmitter am präsynaptischen Terminal als Reaktion auf ein elektrisches Signal, ein so genanntes Aktionspotenzial, im präsynaptischen Neuron freigesetzt. Die Freisetzung auf niedrigem Niveau findet jedoch auch ohne elektrische Stimulation statt. Neurotransmitter werden in den synaptischen Spalt freigesetzt und diffundieren durch ihn, wo sie an spezifische Rezeptoren auf der Membran des postsynaptischen Neurons binden. ⓘ
Interaktion der Rezeptoren
Nach der Freisetzung in den synaptischen Spalt diffundieren die Neurotransmitter über die Synapse, wo sie mit den Rezeptoren der Zielzelle interagieren können. Die Wirkung des Neurotransmitters ist abhängig von der Identität der an der Synapse vorhandenen Rezeptoren der Zielzelle. Je nach Rezeptor kann die Bindung von Neurotransmittern eine Erregung, Hemmung oder Modulation des postsynaptischen Neurons bewirken. Für weitere Informationen siehe unten. ⓘ
Eliminierung
Um eine kontinuierliche Aktivierung von Rezeptoren auf der postsynaptischen oder Zielzelle zu vermeiden, müssen Neurotransmitter aus dem synaptischen Spalt entfernt werden. Die Entfernung von Neurotransmittern erfolgt über einen von drei Mechanismen:
- Diffusion - Neurotransmitter driften aus dem synaptischen Spalt, wo sie von Gliazellen aufgenommen werden. Diese Gliazellen, in der Regel Astrozyten, nehmen die überschüssigen Neurotransmitter auf. In der Gliazelle werden die Neurotransmitter durch Enzyme abgebaut oder in den Körper zurückgepumpt.
- Enzymabbau - Proteine, sogenannte Enzyme, bauen die Neurotransmitter ab.
- Wiederaufnahme - Neurotransmitter werden in das präsynaptische Neuron wiederaufgenommen. Transporter oder Membrantransportproteine pumpen Neurotransmitter aus dem synaptischen Spalt zurück in die Axonendigungen (das präsynaptische Neuron), wo sie zur Wiederverwendung gespeichert werden. ⓘ
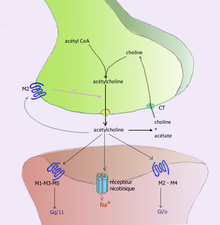
So wird beispielsweise Acetylcholin ausgeschieden, indem seine Acetylgruppe durch das Enzym Acetylcholinesterase gespalten wird; das verbleibende Cholin wird dann vom präsynaptischen Neuron aufgenommen und recycelt, um mehr Acetylcholin zu synthetisieren. Andere Neurotransmitter sind in der Lage, von den synaptischen Knotenpunkten wegzudiffundieren und werden über die Nieren aus dem Körper ausgeschieden oder in der Leber zerstört. Jeder Neurotransmitter hat sehr spezifische Abbauwege an Regulationspunkten, auf die das körpereigene Regulationssystem oder Medikamente abzielen können. Kokain blockiert einen Dopamintransporter, der für die Wiederaufnahme von Dopamin verantwortlich ist. Ohne den Transporter diffundiert das Dopamin viel langsamer aus dem synaptischen Spalt und aktiviert weiterhin die Dopaminrezeptoren auf der Zielzelle. ⓘ
Entdeckung
Bis ins frühe 20. Jahrhundert gingen Wissenschaftler davon aus, dass der Großteil der synaptischen Kommunikation im Gehirn elektrisch erfolgt. Durch histologische Untersuchungen von Ramón y Cajal wurde jedoch ein 20 bis 40 nm großer Spalt zwischen den Neuronen entdeckt, der heute als synaptischer Spalt bekannt ist. Das Vorhandensein eines solchen Spalts ließ auf eine Kommunikation über chemische Botenstoffe schließen, die den synaptischen Spalt durchqueren, und 1921 bestätigte der deutsche Pharmakologe Otto Loewi, dass Neuronen durch die Freisetzung von Chemikalien kommunizieren können. Durch eine Reihe von Experimenten mit den Vagusnerven von Fröschen konnte Loewi die Herzfrequenz von Fröschen manuell verlangsamen, indem er die Menge der Kochsalzlösung um den Vagusnerv herum kontrollierte. Nach Abschluss dieses Experiments behauptete Loewi, dass die sympathische Regulierung der Herzfunktion durch Veränderungen der chemischen Konzentrationen vermittelt werden kann. Darüber hinaus wird Otto Loewi die Entdeckung von Acetylcholin (ACh) zugeschrieben - dem ersten bekannten Neurotransmitter. ⓘ
Identifizierung
Es gibt vier Hauptkriterien für die Identifizierung von Neurotransmittern:
- Die Chemikalie muss in der Nervenzelle synthetisiert werden oder anderweitig in ihr vorhanden sein.
- Wenn das Neuron aktiv ist, muss die Chemikalie freigesetzt werden und bei bestimmten Zielpersonen eine Reaktion hervorrufen.
- Die gleiche Reaktion muss erzielt werden, wenn die Chemikalie experimentell auf das Ziel gebracht wird.
- Es muss ein Mechanismus vorhanden sein, um die Chemikalie nach getaner Arbeit wieder vom Ort der Aktivierung zu entfernen. ⓘ
Angesichts der Fortschritte in der Pharmakologie, Genetik und chemischen Neuroanatomie kann der Begriff "Neurotransmitter" auf Chemikalien angewendet werden, die:
- Botschaften zwischen Neuronen durch Beeinflussung der postsynaptischen Membran übermitteln.
- die keine oder nur geringe Auswirkungen auf die Membranspannung haben, aber eine gemeinsame Übertragungsfunktion haben, wie z. B. die Veränderung der Struktur der Synapse.
- Sie kommunizieren, indem sie Nachrichten in umgekehrter Richtung senden, die die Freisetzung oder Wiederaufnahme von Transmittern beeinflussen. ⓘ
Die anatomische Lokalisierung von Neurotransmittern wird in der Regel mit Hilfe immunzytochemischer Verfahren bestimmt, mit denen entweder die Transmittersubstanzen selbst oder die Enzyme, die an ihrer Synthese beteiligt sind, lokalisiert werden. Immunzytochemische Verfahren haben auch gezeigt, dass viele Transmitter, insbesondere die Neuropeptide, kolokalisiert sind, d. h. ein Neuron kann mehr als einen Transmitter aus seinem synaptischen Terminal freisetzen. Mit verschiedenen Techniken und Experimenten wie Anfärben, Stimulieren und Sammeln lassen sich Neurotransmitter im gesamten zentralen Nervensystem identifizieren. ⓘ
Aktionen
Neuronen bilden ausgeklügelte Netzwerke, durch die Nervenimpulse - Aktionspotenziale - wandern. Jedes Neuron hat bis zu 15.000 Verbindungen mit benachbarten Neuronen. ⓘ
Neuronen berühren sich nicht (außer im Falle einer elektrischen Synapse durch eine Lückenverbindung); stattdessen interagieren Neuronen an Kontaktpunkten, die Synapsen genannt werden: eine Verbindung zwischen zwei Nervenzellen, die aus einer Miniaturlücke besteht, in der Impulse durch einen Neurotransmitter übertragen werden. Ein Neuron transportiert seine Informationen durch einen Nervenimpuls, der als Aktionspotenzial bezeichnet wird. Wenn ein Aktionspotenzial am präsynaptischen Endknopf der Synapse ankommt, kann es die Freisetzung von Neurotransmittern stimulieren. Diese Neurotransmitter werden in den synaptischen Spalt freigesetzt, um sich an die Rezeptoren der postsynaptischen Membran zu binden und eine andere Zelle zu beeinflussen, entweder auf hemmende oder erregende Weise. Das nächste Neuron kann mit vielen weiteren Neuronen verbunden sein, und wenn die Summe der erregenden Einflüsse minus der hemmenden Einflüsse groß genug ist, wird es auch "feuern". Das heißt, es wird an seinem Axonhügel ein neues Aktionspotenzial erzeugen, das Neurotransmitter freisetzt und die Information an ein weiteres benachbartes Neuron weiterleitet. ⓘ
Modulation
Ein Neurotransmitter kann eine erregende, hemmende oder modulierende Wirkung auf die Zielzelle haben. Die Wirkung wird von den Rezeptoren bestimmt, mit denen der Neurotransmitter an der postsynaptischen Membran interagiert. Der Neurotransmitter beeinflusst den Transmembran-Ionenfluss, um die Wahrscheinlichkeit, dass die Zelle, mit der er in Kontakt kommt, ein Aktionspotenzial erzeugt, entweder zu erhöhen (erregend) oder zu verringern (hemmend). Synapsen, die Rezeptoren mit erregender Wirkung enthalten, werden als Typ-I-Synapsen bezeichnet, während Typ-II-Synapsen Rezeptoren mit hemmender Wirkung enthalten. Trotz der großen Vielfalt an Synapsen übermitteln sie also alle nur diese beiden Typen von Nachrichten. Die beiden Typen haben ein unterschiedliches Aussehen und befinden sich vor allem an unterschiedlichen Stellen der Neuronen, die unter ihrem Einfluss stehen. Rezeptoren mit modulierender Wirkung sind über alle synaptischen Membranen verteilt, und die Bindung von Neurotransmittern setzt Signalkaskaden in Gang, die der Zelle helfen, ihre Funktion zu regulieren. Die Bindung von Neurotransmittern an Rezeptoren mit modulierenden Wirkungen kann viele Folgen haben. So kann sie beispielsweise zu einer Erhöhung oder Verringerung der Empfindlichkeit gegenüber künftigen Reizen führen, indem mehr oder weniger Rezeptoren an die synaptische Membran rekrutiert werden. ⓘ
Typ-I-Synapsen (erregende Synapsen) befinden sich in der Regel an den Schäften oder Stacheln der Dendriten, während Typ-II-Synapsen (hemmende Synapsen) in der Regel am Zellkörper liegen. Außerdem haben Synapsen vom Typ I runde synaptische Vesikel, während die Vesikel von Synapsen vom Typ II abgeflacht sind. Das Material auf den präsynaptischen und postsynaptischen Membranen ist bei einer Typ-I-Synapse dichter als bei einer Typ-II-Synapse, und der synaptische Spalt von Typ I ist breiter. Schließlich ist die aktive Zone an einer Synapse vom Typ I größer als an einer Synapse vom Typ II. ⓘ
Die unterschiedliche Lage von Typ-I- und Typ-II-Synapsen unterteilt ein Neuron in zwei Zonen: einen erregenden Dendritenbaum und einen hemmenden Zellkörper. Aus hemmender Sicht kommt die Erregung über die Dendriten herein und breitet sich bis zum Axonhügel aus, um ein Aktionspotenzial auszulösen. Soll die Nachricht gestoppt werden, so geschieht dies am besten durch Hemmung des Zellkörpers in der Nähe des Axonhügels, wo das Aktionspotenzial entsteht. Eine andere Möglichkeit, sich die Interaktion zwischen Erregung und Hemmung vorzustellen, ist die Überwindung der Hemmung durch die Erregung. Wenn sich der Zellkörper normalerweise in einem gehemmten Zustand befindet, ist die einzige Möglichkeit, ein Aktionspotenzial am Axonhügel zu erzeugen, die Verringerung der Hemmung des Zellkörpers. Bei dieser Strategie des "Öffnens der Tore" ist die erregende Nachricht wie ein Rennpferd, das bereit ist, die Rennstrecke hinunterzurennen, aber zuerst muss das hemmende Starttor entfernt werden. ⓘ
Neurotransmitter-Aktionen
Wie oben erläutert, besteht die einzige direkte Wirkung eines Neurotransmitters darin, einen Rezeptor zu aktivieren. Daher hängen die Wirkungen eines Neurotransmittersystems von den Verbindungen der Neuronen ab, die den Transmitter verwenden, sowie von den chemischen Eigenschaften der Rezeptoren. ⓘ
- Glutamat wird an der großen Mehrheit der schnellen erregenden Synapsen im Gehirn und im Rückenmark verwendet. Es wird auch an den meisten Synapsen verwendet, die "modifizierbar" sind, d. h. deren Stärke erhöht oder verringert werden kann. Man geht davon aus, dass modifizierbare Synapsen die wichtigsten Gedächtnisspeicher im Gehirn sind. Eine übermäßige Glutamatfreisetzung kann das Gehirn überstimulieren und zu Exzitotoxizität führen, die ein Absterben der Zellen verursacht, was zu Krampfanfällen oder Schlaganfällen führt. Exzitotoxizität wird bei bestimmten chronischen Krankheiten wie ischämischen Schlaganfällen, Epilepsie, amyotropher Lateralsklerose, Alzheimer, Huntington und Parkinson vermutet.
- GABA wird an der großen Mehrheit der schnellen hemmenden Synapsen in praktisch jedem Teil des Gehirns verwendet. Viele Sedativa/Beruhigungsmittel wirken, indem sie die Wirkung von GABA verstärken. Dementsprechend ist Glycin der hemmende Transmitter im Rückenmark.
- Acetylcholin war der erste Neurotransmitter, der im peripheren und zentralen Nervensystem entdeckt wurde. Es aktiviert die Skelettmuskeln im somatischen Nervensystem und kann die inneren Organe im vegetativen System entweder erregen oder hemmen. Es wird als Transmitter an der neuromuskulären Verbindung zwischen den motorischen Nerven und den Muskeln unterschieden. Das lähmende Pfeilgift Curare wirkt durch Blockierung der Übertragung an diesen Synapsen. Acetylcholin wirkt ebenfalls in vielen Regionen des Gehirns, allerdings über verschiedene Arten von Rezeptoren, darunter nikotinische und muskarinische Rezeptoren.
- Dopamin hat eine Reihe wichtiger Funktionen im Gehirn; dazu gehören die Regulierung des motorischen Verhaltens, der mit der Motivation verbundenen Freuden und auch der emotionalen Erregung. Es spielt eine entscheidende Rolle im Belohnungssystem; die Parkinson-Krankheit wird mit einem niedrigen Dopaminspiegel in Verbindung gebracht, während Schizophrenie mit einem hohen Dopaminspiegel in Verbindung gebracht wird.
- Serotonin ist ein Monoamin-Neurotransmitter. Der größte Teil wird im Darm produziert (ca. 90 %), der Rest in den Neuronen des zentralen Nervensystems. Es reguliert Appetit, Schlaf, Gedächtnis und Lernen, Temperatur, Stimmung, Verhalten, Muskelkontraktion sowie die Funktion des Herz-Kreislauf-Systems und des endokrinen Systems. Es wird vermutet, dass es bei Depressionen eine Rolle spielt, da bei einigen depressiven Patienten niedrigere Konzentrationen von Serotonin-Metaboliten im Liquor und im Hirngewebe festgestellt wurden.
- Noradrenalin, das im zentralen Nervensystem und in den sympathischen Nerven synthetisiert wird, moduliert die Reaktionen des autonomen Nervensystems, das Schlafverhalten, die Konzentration und die Wachsamkeit. Es wird aus Tyrosin synthetisiert.
- Epinephrin, das ebenfalls aus Tyrosin synthetisiert wird, wird in den Nebennieren und im Hirnstamm freigesetzt. Es spielt eine Rolle beim Schlaf, bei der Fähigkeit, wach zu werden und zu bleiben, und bei der "Kampf-oder-Flucht"-Reaktion. ⓘ
Arten
Es gibt viele verschiedene Möglichkeiten, Neurotransmitter zu klassifizieren. Die Unterteilung in Aminosäuren, Peptide und Monoamine ist für einige Klassifizierungszwecke ausreichend. ⓘ
Die wichtigsten Neurotransmitter:
- Aminosäuren: Glutamat, Aspartat, D-Serin, Gamma-Aminobuttersäure (GABA), Glycin
- Gasotransmitter: Stickstoffmonoxid (NO), Kohlenmonoxid (CO), Schwefelwasserstoff (H2S)
- Monoamine: Dopamin (DA), Noradrenalin (NE, NA), Epinephrin (Adrenalin), Histamin, Serotonin (SER, 5-HT)
- Katecholamine: Dopamin, Noradrenalin (Noradrenalin), Epinephrin (Adrenalin)
- Aminspuren: Phenethylamin, N-Methylphenethylamin, Tyramin, 3-Jodthyronamin, Octopamin, Tryptamin, usw.
- Peptide: Oxytocin, Somatostatin, Substanz P, kokain- und amphetaminreguliertes Transkript, Opioidpeptide
- Purine: Adenosintriphosphat (ATP), Adenosin
- Andere: Acetylcholin (ACh), Anandamid, usw. ⓘ
Darüber hinaus wurden über 100 neuroaktive Peptide gefunden, und es werden regelmäßig neue entdeckt. Viele von ihnen werden zusammen mit einem niedermolekularen Transmitter freigesetzt. In einigen Fällen ist jedoch ein Peptid der primäre Transmitter an einer Synapse. Beta-Endorphin ist ein relativ bekanntes Beispiel für einen Peptid-Neurotransmitter, da es hochspezifische Wechselwirkungen mit Opioidrezeptoren im zentralen Nervensystem eingeht. ⓘ
Einzelne Ionen (wie z. B. synaptisch freigesetztes Zink) werden ebenfalls als Neurotransmitter betrachtet, ebenso wie einige gasförmige Moleküle wie Stickstoffmonoxid (NO), Kohlenmonoxid (CO) und Schwefelwasserstoff (H2S). Die Gase werden im neuronalen Zytoplasma produziert und diffundieren sofort durch die Zellmembran in die extrazelluläre Flüssigkeit und in benachbarte Zellen, um die Produktion von Botenstoffen anzuregen. Lösliche Gasneurotransmitter sind schwer zu untersuchen, da sie schnell wirken und sofort abgebaut werden und nur wenige Sekunden lang existieren. ⓘ
Der am weitesten verbreitete Transmitter ist Glutamat, das an weit über 90 % der Synapsen im menschlichen Gehirn erregend wirkt. Der zweithäufigste Transmitter ist Gamma-Aminobuttersäure (GABA), die an mehr als 90 % der Synapsen, die kein Glutamat verwenden, hemmend wirkt. Obwohl andere Transmitter in weniger Synapsen verwendet werden, können sie funktionell sehr wichtig sein: Die große Mehrheit der psychoaktiven Drogen übt ihre Wirkung aus, indem sie die Aktionen einiger Neurotransmittersysteme verändert, die oft über andere Transmitter als Glutamat oder GABA wirken. Suchtmittel wie Kokain und Amphetamine üben ihre Wirkung vor allem auf das Dopaminsystem aus. Die süchtig machenden Opiate entfalten ihre Wirkung in erster Linie als funktionelle Analoga von Opioidpeptiden, die wiederum den Dopaminspiegel regulieren. ⓘ
Liste von Neurotransmittern, Peptiden und gasförmigen Signalmolekülen
|
Neurotransmitter-Systeme im Gehirn
Neuronen, die bestimmte Arten von Neurotransmittern exprimieren, bilden manchmal unterschiedliche Systeme, bei denen die Aktivierung des Systems große Teile des Gehirns beeinflusst, was als Volumenübertragung bezeichnet wird. Zu den wichtigsten Neurotransmittersystemen gehören unter anderem das Noradrenalin- (Noradrenalin-) System, das Dopaminsystem, das Serotoninsystem und das cholinerge System. Spurenamine haben eine modulierende Wirkung auf die Neurotransmission in den Monoaminwegen (d. h. Dopamin-, Noradrenalin- und Serotoninwege) im gesamten Gehirn über die Signalübertragung durch den Spurenamin-assoziierten Rezeptor 1. Es folgt ein kurzer Vergleich dieser Systeme:
| System | Ursprung der Bahnen und Projektionen | Regulierte kognitive Prozesse und Verhaltensweisen |
|---|---|---|
| Noradrenalin-System |
Noradrenerge Bahnen:
|
|
| Dopamin-System |
Dopaminerge Bahnen:
|
|
| Histamin-System |
Histaminerge Bahnen:
|
|
| Serotonin-System |
Serotonerge Bahnen:
Caudale Kerne (CN):
Rostrale Kerne (RN):
|
|
| Acetylcholin-System |
Cholinerge Bahnen:
Cholinerge Kerne des Vorderhirns (FCN):
Striatale tonisch aktive cholinerge Neuronen (TAN)
Cholinerge Hirnstammkerne (BCN):
|
|
| Adrenalin-System |
Adrenerge Bahnen:
|
|
Wirkungen von Arzneimitteln
Das Verständnis der Auswirkungen von Medikamenten auf Neurotransmitter macht einen großen Teil der Forschungsinitiativen auf dem Gebiet der Neurowissenschaften aus. Die meisten Neurowissenschaftler, die sich mit diesem Forschungsgebiet befassen, glauben, dass solche Bemühungen unser Verständnis der Schaltkreise, die für verschiedene neurologische Krankheiten und Störungen verantwortlich sind, sowie die Möglichkeiten zur wirksamen Behandlung und eines Tages möglicherweise zur Vorbeugung oder Heilung solcher Krankheiten weiter voranbringen können. ⓘ
Medikamente können das Verhalten beeinflussen, indem sie die Aktivität von Neurotransmittern verändern. So können Medikamente beispielsweise die Syntheserate von Neurotransmittern verringern, indem sie das/die synthetische(n) Enzym(e) für diesen Neurotransmitter beeinflussen. Wenn die Neurotransmittersynthese blockiert wird, ist die Menge der zur Freisetzung verfügbaren Neurotransmitter wesentlich geringer, was zu einem Rückgang der Neurotransmitteraktivität führt. Einige Medikamente blockieren oder stimulieren die Freisetzung bestimmter Neurotransmitter. Alternativ können Medikamente die Speicherung von Neurotransmittern in synaptischen Vesikeln verhindern, indem sie die Membranen der synaptischen Vesikel zum Auslaufen bringen. Medikamente, die die Bindung eines Neurotransmitters an seinen Rezeptor verhindern, werden als Rezeptorantagonisten bezeichnet. So sind beispielsweise Medikamente zur Behandlung von Schizophreniepatienten wie Haloperidol, Chlorpromazin und Clozapin Antagonisten an Dopaminrezeptoren im Gehirn. Andere Medikamente wirken, indem sie sich an einen Rezeptor binden und den normalen Neurotransmitter imitieren. Solche Medikamente werden als Rezeptor-Agonisten bezeichnet. Ein Beispiel für einen Rezeptoragonisten ist Morphin, ein Opiat, das die Wirkung des körpereigenen Neurotransmitters β-Endorphin nachahmt, um Schmerzen zu lindern. Andere Medikamente greifen in die Deaktivierung eines Neurotransmitters ein, nachdem er freigesetzt wurde, und verlängern so die Wirkung eines Neurotransmitters. Dies kann durch die Blockierung der Wiederaufnahme oder durch die Hemmung der abbauenden Enzyme erreicht werden. Schließlich können Medikamente auch das Auftreten eines Aktionspotenzials verhindern und die neuronale Aktivität im gesamten zentralen und peripheren Nervensystem blockieren. Medikamente wie Tetrodotoxin, die die neuronale Aktivität blockieren, sind in der Regel tödlich. ⓘ
Drogen, die auf die Neurotransmitter der wichtigsten Systeme abzielen, wirken sich auf das gesamte System aus, was die Komplexität der Wirkung einiger Drogen erklären kann. Kokain beispielsweise blockiert die Wiederaufnahme von Dopamin in das präsynaptische Neuron und lässt die Neurotransmittermoleküle für einen längeren Zeitraum im synaptischen Spalt. Da das Dopamin länger in der Synapse verbleibt, bindet der Neurotransmitter weiterhin an die Rezeptoren des postsynaptischen Neurons und löst so eine angenehme emotionale Reaktion aus. Die körperliche Abhängigkeit von Kokain kann aus einer längeren Exposition gegenüber überschüssigem Dopamin in den Synapsen resultieren, was zu einer Herunterregulierung einiger postsynaptischer Rezeptoren führt. Wenn die Wirkung der Droge nachlässt, kann eine Person aufgrund der geringeren Wahrscheinlichkeit, dass der Neurotransmitter an einen Rezeptor bindet, depressiv werden. Fluoxetin ist ein selektiver Serotonin-Wiederaufnahmehemmer (SSRI), der die Wiederaufnahme von Serotonin durch die präsynaptische Zelle blockiert, wodurch die Menge des an der Synapse vorhandenen Serotonins erhöht wird und es dort länger verbleiben kann, wodurch die Wirkung des natürlich freigesetzten Serotonins verstärkt wird. AMPT verhindert die Umwandlung von Tyrosin in L-DOPA, die Vorstufe von Dopamin; Reserpin verhindert die Speicherung von Dopamin in den Vesikeln; und Deprenyl hemmt die Monoaminoxidase (MAO)-B und erhöht so den Dopaminspiegel. ⓘ
| Droge | Interagiert mit: | Rezeptor-Wechselwirkung: | Typ | Wirkungen ⓘ |
|---|---|---|---|---|
| Botulinumtoxin (Botox) | Acetylcholin | – | Antagonist | Blockiert die Freisetzung von Acetylcholin im PNS
Verhindert Muskelkontraktionen |
| Spinnengift der Schwarzen Witwe | Acetylcholin | – | Agonist | Fördert die Acetylcholinfreisetzung im PNS
Stimuliert Muskelkontraktionen |
| Neostigmin | Acetylcholin | – | – | Beeinträchtigt die Aktivität der Acetylcholinerase
Verstärkt die Wirkung von ACh an den Rezeptoren Wird zur Behandlung von Myasthenia gravis eingesetzt |
| Nikotin | Acetylcholin | Nikotinisch (Skelettmuskel) | Agonist | Erhöht die ACh-Aktivität
Erhöht die Aufmerksamkeit Verstärkende Wirkung |
| d-Tubocurarin | Acetylcholin | Nikotinisch (Skelettmuskel) | Antagonist | Verringert die Aktivität an der Rezeptorstelle |
| Curare | Acetylcholin | Nikotinisch (Skelettmuskel) | Antagonist | Verringert die ACh-Aktivität
Verhindert Muskelkontraktionen |
| Muscarin | Acetylcholin | Muscarinisch (Herz und glatte Muskulatur) | Agonist | Erhöht die ACh-Aktivität
Giftig |
| Atropin | Acetylcholin | Muscarinisch (Herz und glatte Muskulatur) | Antagonist | Blockiert die Pupillenverengung
Blockiert die Speichelproduktion |
| Scopolamin (Hyoscin) | Acetylcholin | Muscarinisch (Herz und glatte Muskulatur) | Antagonist | Zur Behandlung von Reisekrankheit und postoperativer Übelkeit und Erbrechen |
| AMPT | Dopamin/Norepinephrin | – | – | Inaktiviert die Tyrosinhydroxylase und hemmt die Dopaminproduktion |
| Reserpin | Dopamin | – | – | Verhindert die Einlagerung von Dopamin und anderen Monoaminen in synaptische Vesikel
Verursacht Sedierung und Depression |
| Apomorphin | Dopamin | D2-Rezeptor (präsynaptische Autorezeptoren/postsynaptische Rezeptoren) | Antagonist (niedrige Dosis)/Direkter Agonist (hohe Dosis) | Niedrige Dosis: blockiert Autorezeptoren
Hohe Dosis: stimuliert postsynaptische Rezeptoren |
| Amphetamin | Dopamin/Norepinephrin | – | Indirekter Agonist | Setzt Dopamin, Noradrenalin und Serotonin frei
Blockiert die Wiederaufnahme |
| Methamphetamin | Dopamin/Norepinephrin | – | – | Setzt Dopamin und Noradrenalin frei
Blockiert die Wiederaufnahme |
| Methylphenidat | Dopamin | – | – | Blockiert die Wiederaufnahme
Verbessert die Aufmerksamkeit und Impulskontrolle bei ADHS |
| Kokain | Dopamin | – | Indirekter Agonist | Blockiert die Wiederaufnahme in die Präsynapse
Blockiert spannungsabhängige Natriumkanäle Kann als topisches Anästhetikum (Augentropfen) verwendet werden |
| Deprenyl | Dopamin | – | Agonist | hemmt MAO-B
Verhindert die Zerstörung von Dopamin |
| Chlorpromazin | Dopamin | D2-Rezeptoren | Antagonist | Blockiert D2-Rezeptoren
Lindert Halluzinationen |
| MPTP | Dopamin | – | – | Führt zu Parkinson-ähnlichen Symptomen |
| PCPA | Serotonin (5-HT) | – | Antagonist | Unterbricht die Serotoninsynthese durch Blockierung der Aktivität der Tryptophanhydroxylase |
| Ondansetron | Serotonin (5-HT) | 5-HT3-Rezeptoren | Antagonist | Reduziert die Nebenwirkungen von Chemotherapie und Bestrahlung
Verringert Übelkeit und Erbrechen |
| Buspiron | Serotonin (5-HT) | 5-HT1A-Rezeptoren | Partieller Agonist | Behandelt Symptome von Angstzuständen und Depressionen |
| Fluoxetin | Serotonin (5-HT) | unterstützt die 5-HT-Wiederaufnahme | SSRI | Hemmt die Wiederaufnahme von Serotonin
Zur Behandlung von Depressionen, einigen Angststörungen und Zwangsstörungen: Prozac und Sarafem |
| Fenfluramin | Serotonin (5-HT) | – | – | Verursacht die Freisetzung von Serotonin
hemmt die Wiederaufnahme von Serotonin Wird als Appetitzügler verwendet |
| Lysergsäurediethylamid | Serotonin (5-HT) | Post-synaptische 5-HT2A-Rezeptoren | Direkter Agonist | Verursacht Verzerrungen der visuellen Wahrnehmung
Stimuliert 5-HT2A-Rezeptoren im Vorderhirn |
| Methylendioxymethamphetamin (MDMA) | Serotonin (5-HT)/Norepinphrin | – | – | Stimuliert die Freisetzung von Serotonin und Norepinephrin und hemmt die Wiederaufnahme
Verursacht erregende und halluzinogene Wirkungen |
| Strychnin | Glycin | – | Antagonist | Verursacht schwere Muskelkrämpfe |
| Diphenhydramin | Histamin | Überwindet die Blut-Hirn-Schranke und verursacht Schläfrigkeit | ||
| Tetrahydrocannabinol (THC) | Endocannabinoide | Cannabinoid (CB)-Rezeptoren | Agonist | Verursacht Analgesie und Sedierung
Steigert den Appetit Kognitive Wirkungen |
| Rimonabant | Endocannabinoide | Cannabinoid (CB)-Rezeptoren | Antagonist | Unterdrückt den Appetit
Wird bei der Raucherentwöhnung eingesetzt |
| MAFP | Endocannabinoide | – | – | Hemmt FAAH
Wird in der Forschung verwendet, um die Aktivität des Cannabinoidsystems zu erhöhen |
| AM1172 | Endocannabinoide | – | – | Blockiert die Wiederaufnahme von Cannabinoiden
Wird in der Forschung verwendet, um die Aktivität des Cannabinoidsystems zu erhöhen |
| Anandamid (endogen) | – | Cannabinoid (CB)-Rezeptoren; 5-HT3-Rezeptoren | – | Reduziert Übelkeit und Erbrechen |
| Koffein | Adenosin | Adenosin-Rezeptoren | Antagonist | Blockiert Adenosinrezeptoren
Erhöht die Wachsamkeit |
| PCP | Glutamat | NMDA-Rezeptor | Indirekter Antagonist | Blockiert die PCP-Bindungsstelle
Verhindert das Eindringen von Kalzium-Ionen in die Neuronen Beeinträchtigt das Lernen |
| AP5 | Glutamat | NMDA-Rezeptor | Antagonist | Blockiert die Glutamat-Bindungsstelle am NMDA-Rezeptor
Beeinträchtigt die synaptische Plastizität und bestimmte Formen des Lernens |
| Ketamin | Glutamat | NMDA-Rezeptor | Antagonist | Wird als Narkosemittel verwendet
Löst einen tranceartigen Zustand aus, hilft bei der Schmerzlinderung und Sedierung |
| NMDA | Glutamat | NMDA-Rezeptor | Agonist | Wird in der Forschung zur Untersuchung des NMDA-Rezeptors verwendet
Ionotroper Rezeptor |
| AMPA | Glutamat | AMPA-Rezeptor | Agonist | Wird in der Forschung zur Untersuchung des AMPA-Rezeptors verwendet
Ionotroper Rezeptor |
| Allyglycin | GABA | – | – | Hemmt die GABA-Synthese
Verursacht Krampfanfälle |
| Muscimol | GABA | GABA-Rezeptor | Agonist | Verursacht Sedierung |
| Bicuculin | GABA | GABA-Rezeptor | Antagonist | Verursacht Krampfanfälle |
| Benzodiazepine | GABA | GABAA-Rezeptor | Indirekte Agonisten | Anxiolytikum, Sedierung, Gedächtnisstörungen, Muskelentspannung |
| Barbiturate | GABA | GABAA-Rezeptor | Indirekte Agonisten | Sedierung, Gedächtnisschwäche, Muskelentspannung |
| Alkohol | GABA | GABA-Rezeptor | Indirekter Agonist | Sedierung, Gedächtnisschwäche, Muskelentspannung |
| Picrotoxin | GABA | GABAA-Rezeptor | Indirekter Antagonist | Hohe Dosen führen zu Krampfanfällen |
| Tiagabin | GABA | – | Antagonist | GABA-Transporter-Antagonist
Erhöht die Verfügbarkeit von GABA Verringert die Wahrscheinlichkeit von Krampfanfällen |
| Moclobemid | Norepinephrin | – | Agonist | Blockiert MAO-A zur Behandlung von Depressionen |
| Idazoxan | Norepinephrin | Alpha-2-adrenerge Autorezeptoren | Agonist | Blockiert Alpha-2-Autorezeptoren
Wird zur Untersuchung des Norepinephrin-Systems verwendet |
| Fusarsäure | Norepinephrin | – | – | Hemmt die Aktivität der Dopamin-Beta-Hydroxylase, die die Produktion von Noradrenalin blockiert
Wird zur Untersuchung des Noradrenalin-Systems verwendet, ohne das Dopamin-System zu beeinträchtigen |
| Opiate (Opium, Morphin, Heroin und Oxycodon) | Opioide | Opioid-Rezeptor | Agonisten | Analgesie, Sedierung und verstärkende Wirkung |
| Naloxon | Opioide | – | Antagonist | Reversiert Opiatintoxikation oder Überdosierungssymptome (z. B. Atemprobleme) |
Agonisten
Ein Agonist ist eine Chemikalie, die an einen Rezeptor, z. B. einen Neurotransmitter-Rezeptor, binden kann und die gleiche Reaktion auslöst, die normalerweise durch die Bindung der endogenen Substanz hervorgerufen wird. Ein Agonist eines Neurotransmitters löst also die gleiche Rezeptorreaktion aus wie der Transmitter. In Neuronen kann ein Agonist entweder direkt oder indirekt Neurotransmitter-Rezeptoren aktivieren. Direkt bindende Agonisten lassen sich weiter charakterisieren als Vollagonisten, Teilagonisten und inverse Agonisten. ⓘ
Direkte Agonisten wirken ähnlich wie ein Neurotransmitter, indem sie direkt an die zugehörige(n) Rezeptorstelle(n) binden, die sich auf dem präsynaptischen Neuron oder dem postsynaptischen Neuron oder auf beiden befinden können. In der Regel befinden sich Neurotransmitter-Rezeptoren auf dem postsynaptischen Neuron, während sich Neurotransmitter-Autorezeptoren auf dem präsynaptischen Neuron befinden, wie dies bei Monoamin-Neurotransmittern der Fall ist; in einigen Fällen nutzt ein Neurotransmitter die retrograde Neurotransmission, eine Art der Rückkopplung in Neuronen, bei der der Neurotransmitter postsynaptisch freigesetzt wird und sich an Zielrezeptoren auf dem präsynaptischen Neuron bindet. Nikotin, eine im Tabak enthaltene Verbindung, ist ein direkter Agonist der meisten nikotinischen Acetylcholinrezeptoren, die sich hauptsächlich in cholinergen Neuronen befinden. Opiate wie Morphin, Heroin, Hydrocodon, Oxycodon, Codein und Methadon sind Agonisten der μ-Opioidrezeptoren; diese Wirkung vermittelt ihre euphorisierenden und schmerzlindernden Eigenschaften. ⓘ
Indirekte Agonisten erhöhen die Bindung von Neurotransmittern an ihren Zielrezeptoren, indem sie die Freisetzung von Neurotransmittern stimulieren oder die Wiederaufnahme von Neurotransmittern verhindern. Einige indirekte Agonisten lösen die Freisetzung von Neurotransmittern aus und verhindern die Wiederaufnahme von Neurotransmittern. Amphetamin zum Beispiel ist ein indirekter Agonist der postsynaptischen Dopamin-, Noradrenalin- und Serotoninrezeptoren in den jeweiligen Neuronen; Es bewirkt sowohl die Freisetzung von Neurotransmittern in das präsynaptische Neuron und anschließend in den synaptischen Spalt als auch die Verhinderung ihrer Wiederaufnahme aus dem synaptischen Spalt, indem es TAAR1, einen präsynaptischen G-Protein-gekoppelten Rezeptor, aktiviert und an eine Stelle auf VMAT2 bindet, einer Art Monoamintransporter, der sich auf synaptischen Vesikeln in Monoamin-Neuronen befindet. ⓘ
Antagonisten
Ein Antagonist ist eine chemische Substanz, die im Körper wirkt, um die physiologische Aktivität einer anderen chemischen Substanz (z. B. eines Opiats) zu verringern; insbesondere eine Substanz, die der Wirkung einer Droge oder einer körpereigenen Substanz auf das Nervensystem entgegenwirkt, indem sie sich mit ihrem Nervenrezeptor verbindet und diesen blockiert. ⓘ
Es gibt zwei Haupttypen von Antagonisten: direkt wirkende Antagonisten und indirekt wirkende Antagonisten:
- Direkt wirkende Antagonisten - sie nehmen den Platz auf den Rezeptoren ein, der sonst von den Neurotransmittern selbst eingenommen wird. Dies führt dazu, dass die Bindung der Neurotransmitter an die Rezeptoren blockiert wird. Das gebräuchlichste ist Atropin.
- Indirekt wirkende Antagonisten - Medikamente, die die Freisetzung/Produktion von Neurotransmittern hemmen (z. B. Reserpin). ⓘ
Medikamentöse Antagonisten
Ein Antagonist ist ein Arzneimittel, das sich an eine Stelle, die als Rezeptor bezeichnet wird, anlagert (oder bindet), ohne den Rezeptor zu aktivieren, um eine biologische Reaktion hervorzurufen. Es wird daher gesagt, dass es keine intrinsische Aktivität hat. Ein Antagonist kann auch als "Rezeptorblocker" bezeichnet werden, da er die Wirkung eines Agonisten an dieser Stelle blockiert. Die pharmakologischen Wirkungen eines Antagonisten bestehen also darin, dass er die Agonisten (z. B. Medikamente, Hormone, Neurotransmitter) daran hindert, sich an die entsprechende Rezeptorstelle zu binden und sie zu aktivieren. Antagonisten können "kompetitiv" oder "irreversibel" sein. ⓘ
Ein kompetitiver Antagonist konkurriert mit einem Agonisten um die Bindung an den Rezeptor. Mit zunehmender Konzentration des Antagonisten wird die Bindung des Agonisten schrittweise gehemmt, was zu einer Abnahme der physiologischen Reaktion führt. Eine hohe Konzentration eines Antagonisten kann die Reaktion vollständig hemmen. Diese Hemmung kann jedoch durch eine Erhöhung der Agonistenkonzentration rückgängig gemacht werden, da Agonist und Antagonist um die Bindung an den Rezeptor konkurrieren. Kompetitive Antagonisten können daher als eine Verschiebung der Dosis-Wirkungs-Beziehung für den Agonisten nach rechts charakterisiert werden. In Anwesenheit eines kompetitiven Antagonisten ist eine höhere Konzentration des Agonisten erforderlich, um die gleiche Reaktion hervorzurufen, die in Abwesenheit des Antagonisten beobachtet wurde. ⓘ
Ein irreversibler Antagonist bindet so stark an den Rezeptor, dass der Rezeptor für die Bindung an den Agonisten nicht mehr zur Verfügung steht. Irreversible Antagonisten können sogar kovalente chemische Bindungen mit dem Rezeptor eingehen. Wenn die Konzentration des irreversiblen Antagonisten hoch genug ist, kann in beiden Fällen die Zahl der für die Bindung des Agonisten verbleibenden ungebundenen Rezeptoren so gering sein, dass selbst hohe Konzentrationen des Agonisten nicht die maximale biologische Reaktion hervorrufen. ⓘ
Vorläuferstoffe
Biosynthesewege für Katecholamine und Spurenamine im menschlichen Gehirn
|
Während die Einnahme von Neurotransmitter-Vorläufern die Neurotransmitter-Synthese erhöht, gibt es unterschiedliche Erkenntnisse darüber, ob die Freisetzung von Neurotransmittern und das Feuern postsynaptischer Rezeptoren erhöht ist. Selbst bei einer erhöhten Neurotransmitterfreisetzung ist unklar, ob dies zu einem langfristigen Anstieg der Neurotransmittersignalstärke führt, da sich das Nervensystem an Veränderungen wie eine erhöhte Neurotransmittersynthese anpassen kann und daher möglicherweise eine konstante Zündung beibehält. Einige Neurotransmitter könnten bei Depressionen eine Rolle spielen, und es gibt Hinweise darauf, dass die Einnahme von Vorläufern dieser Neurotransmitter bei der Behandlung leichter und mittelschwerer Depressionen nützlich sein könnte. ⓘ
Vorstufen von Katecholaminen und Spurenaminen
L-DOPA, eine Vorstufe von Dopamin, die die Blut-Hirn-Schranke überwindet, wird bei der Behandlung der Parkinson-Krankheit eingesetzt. Bei depressiven Patienten, bei denen eine niedrige Aktivität des Neurotransmitters Noradrenalin vermutet wird, gibt es nur wenige Hinweise auf einen Nutzen der Verabreichung von Neurotransmitter-Vorläufern. L-Phenylalanin und L-Tyrosin sind beide Vorstufen von Dopamin, Noradrenalin und Adrenalin. Für diese Umwandlungen sind Vitamin B6, Vitamin C und S-Adenosylmethionin erforderlich. Einige wenige Studien deuten auf mögliche antidepressive Wirkungen von L-Phenylalanin und L-Tyrosin hin, aber es gibt noch viel Raum für weitere Forschung in diesem Bereich. ⓘ
Serotonin-Vorläuferstoffe
Die Verabreichung von L-Tryptophan, einer Vorstufe von Serotonin, verdoppelt die Produktion von Serotonin im Gehirn. Sie ist bei der Behandlung von leichten und mittelschweren Depressionen deutlich wirksamer als ein Placebo. Für diese Umwandlung ist Vitamin C erforderlich. 5-Hydroxytryptophan (5-HTP), ebenfalls eine Vorstufe von Serotonin, ist wirksamer als ein Placebo. ⓘ
Krankheiten und Störungen
Auch Krankheiten und Störungen können bestimmte Neurotransmittersysteme beeinträchtigen. Bei den folgenden Erkrankungen kommt es entweder zu einer Zunahme, Abnahme oder einem Ungleichgewicht bestimmter Neurotransmitter. ⓘ
Dopamin: So können beispielsweise Probleme bei der Dopaminproduktion (hauptsächlich in der Substantia nigra) zur Parkinson-Krankheit führen, einer Erkrankung, die die Fähigkeit eines Menschen beeinträchtigt, sich so zu bewegen, wie er es möchte, was sich in Steifheit, Zittern oder Schütteln und anderen Symptomen äußert. Einige Studien deuten darauf hin, dass zu wenig oder zu viel Dopamin oder Probleme bei der Verwendung von Dopamin in den Denk- und Gefühlsregionen des Gehirns eine Rolle bei Störungen wie Schizophrenie oder Aufmerksamkeitsdefizit-Hyperaktivitätsstörung (ADHS) spielen können. Dopamin spielt auch bei Sucht und Drogenkonsum eine Rolle, da die meisten Freizeitdrogen (insbesondere Opioide und Methamphetamine) einen Dopaminschub im Gehirn verursachen, der ein angenehmes Gefühl hervorruft, weshalb die Konsumenten ständig nach den Drogen verlangen. ⓘ
Serotonin: Nachdem einige Forschungsergebnisse darauf hindeuteten, dass Medikamente, die die Wiederaufnahme von Serotonin blockieren, einigen Menschen mit Depressionen zu helfen schienen, wurde die Theorie aufgestellt, dass Menschen mit Depressionen einen niedrigeren als den normalen Serotoninspiegel haben könnten. Obwohl diese Theorie weit verbreitet ist, hat sie sich in der nachfolgenden Forschung nicht bestätigt. Daher werden selektive Serotonin-Wiederaufnahmehemmer (SSRI) eingesetzt, um die Serotoninmenge in den Synapsen zu erhöhen. ⓘ
Glutamat: Darüber hinaus wurden Probleme bei der Produktion oder Verwendung von Glutamat mit vielen psychischen Störungen in Verbindung gebracht, darunter Autismus, Zwangsstörungen, Schizophrenie und Depressionen. Ein zu hoher Glutamatspiegel wird mit neurologischen Erkrankungen wie der Parkinson-Krankheit, Multipler Sklerose, Alzheimer, Schlaganfall und ALS (Amyotrophe Lateralsklerose) in Verbindung gebracht. ⓘ

Ungleichgewicht der Neurotransmitter
Im Allgemeinen gibt es keine wissenschaftlich fundierten "Normen" für angemessene Konzentrationen oder "Gleichgewichte" verschiedener Neurotransmitter. In den meisten Fällen ist es pragmatisch unmöglich, die Konzentrationen von Neurotransmittern im Gehirn oder im Körper zu bestimmten Zeitpunkten zu messen. Neurotransmitter regulieren gegenseitig ihre Freisetzung, und schwache, konsistente Ungleichgewichte in dieser gegenseitigen Regulierung wurden bei gesunden Menschen mit dem Temperament in Verbindung gebracht . Starke Ungleichgewichte oder Störungen der Neurotransmittersysteme wurden mit vielen Krankheiten und psychischen Störungen in Verbindung gebracht. Dazu gehören Parkinson, Depression, Schlaflosigkeit, Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS), Angstzustände, Gedächtnisverlust, dramatische Gewichtsveränderungen und Süchte. Chronischer körperlicher oder emotionaler Stress kann zu Veränderungen im Neurotransmittersystem beitragen. Auch die Genetik spielt bei den Neurotransmitter-Aktivitäten eine Rolle. Abgesehen vom Freizeitkonsum werden Medikamente, die direkt oder indirekt mit einem oder mehreren Transmittern oder deren Rezeptoren interagieren, häufig für psychiatrische und psychologische Probleme verschrieben. Insbesondere Medikamente, die mit Serotonin und Noradrenalin interagieren, werden Patienten mit Problemen wie Depressionen und Angstzuständen verschrieben - obwohl die Vorstellung, dass es viele solide medizinische Beweise zur Unterstützung solcher Interventionen gibt, weithin kritisiert wurde. Studien haben gezeigt, dass ein Dopamin-Ungleichgewicht einen Einfluss auf Multiple Sklerose und andere neurologische Störungen hat. ⓘ
Chemische Zuordnung
Biochemisch betrachtet sind die meisten bekannten Neurotransmitter neben Acetylcholin (aus Cholin, cholinerge Übertragung) entweder
- Derivate von Aminosäuren (durch bzw. nach Decarboxylierung) – wie Dopamin bzw. Noradrenalin und Adrenalin (aus Tyrosin, katechol-aminerge) oder Histamin (aus Histidin, histaminerge) oder γ-Aminobuttersäure (GABA) (aus Glutamat, GABAerge) bzw. Serotonin (aus Tryptophan, serotoninerge) – oder es sind
- α-Aminosäuren – wie Glycin (glycinerge) oder Glutamat (glutamaterge) – oder es sind
- Oligopeptide, also kurze Ketten zusammengesetzter Aminosäuren, (peptiderge) – so etwa Oxytocin, Vasopressin (ADH), Somatostatin (SIH), Tachykinin, Cholecystokinin, Neurotensin und auch die opioid wirkenden Neuropeptide, Opioidpeptide, wie beispielsweise die Endorphine. ⓘ
Daneben fungieren Phosphorsäureester von Purinen wie Adenosinmonophosphat (AMP), Adenosindiphosphat (ADP), Adenosintriphosphat (ATP) sowie Uridindiphosphat (UDP) und Uridintriphosphat (UTP) auch an Synapsen als (Ko-)Transmitter. ⓘ
Einteilung
Neurotransmitter können zunächst nach Stoffklassen eingeteilt werden. ⓘ
Lösliche Gase
- Stickstoffmonoxid
- Kohlenstoffmonoxid
- Schwefelwasserstoff ⓘ
Amine
- quartäre Amine:
- Biogene Amine
- (Klassische) Monoamine
- Katecholamine:
- Indolamine:
- Serotonin
- Melatonin
- Imidazolamine:
- Histamin (biochemische Struktur jedoch von anderen biogenen Aminen verschieden)
- Spurenamine
- Phenethylamine:
- Phenethylamin (PEA)
- Tyramin
- Indolamine:
- Tryptamin ⓘ
- Phenethylamine:
- (Klassische) Monoamine
Aminosäuren
- Inhibitorische Aminosäuretransmitter
- γ-Aminobuttersäure = GABA = 4-Aminobuttersäure
- Glycin
- β-Alanin
- Taurin
- Exzitatorische Aminosäuretransmitter
- Glutaminsäure
- Asparaginsäure
- Cystein
- Homocystein ⓘ
Neuropeptide
- Endorphine und Enkephaline
- Somatostatin
- Insulin
- Glucagon
- α-Endopsychosin
- Tachykinine
- Substanz P
- Neurokinin A (Substanz K)
- Neuropeptid K (Neurokinin K)
- Neuropeptid γ (Neuropeptid gamma)
- Neurokinin B
- Hemokinin-1
- Endokinin A, B, C und D ⓘ
Endocannabinoide
- Anandamid
- 2-Arachidonylglycerol
- O-Arachidonylethanolamid ⓘ

