Schwefeldioxid

| |

| |

| |
| Bezeichnungen | |
|---|---|
| IUPAC-Bezeichnung
Schwefeldioxid
| |
| Andere Namen
Schwefeliges Anhydrid
Schwefel(IV)-oxid | |
| Bezeichner | |
3D-Modell (JSmol)
|
|
Beilstein-Referenz
|
3535237 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC-Nummer |
|
Gmelin Referenz
|
1443 |
| KEGG | |
| MeSH | Schwefel+Dioxid |
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII | |
| UN-Nummer | 1079, 2037 |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
SO 2 |
| Molekulare Masse | 64,066 g mol-1 |
| Erscheinungsbild | Farbloses Gas |
| Geruch | Stechend; ähnlich wie ein gerade angezündetes Streichholz |
| Dichte | 2,6288 kg m-3 |
| Schmelzpunkt | -72 °C; -98 °F; 201 K |
| Siedepunkt | -10 °C (14 °F; 263 K) |
Löslichkeit in Wasser
|
94 g/L bildet schweflige Säure |
| Dampfdruck | 237,2 kPa |
| Acidität (pKa) | 1.81 |
| Basizität (pKb) | 12.19 |
Magnetische Suszeptibilität (χ)
|
-18,2-10-6 cm3/mol |
| Viskosität | 12,82 μPa-s |
| Struktur | |
Punktgruppe
|
C2v |
Koordinationsgeometrie
|
Digonal |
Molekulare Form
|
Dihedral |
Dipolmoment
|
1.62 D |
| Thermochemie | |
Std. molare
Entropie (S |
248.223 J K-1 mol-1 |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-296,81 kJ mol-1 |
| Gefahren | |
| GHS-Kennzeichnung: | |
Piktogramme
|
 
|
Signalwort
|
Gefahr |
Gefahrenhinweise
|
H314, H331 |
| NFPA 704 (Feuerdiamant) | |
| Tödliche Dosis oder Konzentration (LD, LC): | |
LC50 (mittlere Konzentration)
|
3000 ppm (Maus, 30 min) 2520 ppm (Ratte, 1 Stunde) |
LCLo (niedrigste veröffentlichte)
|
993 ppm (Ratte, 20 min) 611 ppm (Ratte, 5 Std.) 764 ppm (Maus, 20 min) 1000 ppm (Mensch, 10 min) 3000 ppm (Mensch, 5 min) |
| NIOSH (US-Grenzwerte für die Gesundheit): | |
PEL (Zulässig)
|
TWA 5 ppm (13 mg/m3) |
REL (Empfohlen)
|
TWA 2 ppm (5 mg/m3) ST 5 ppm (13 mg/m3) |
IDLH (Unmittelbare Gefahr)
|
100 ppm |
| Verwandte Verbindungen | |
Verwandte Schwefeloxide
|
Schwefelmonoxid Schwefeltrioxid |
Verwandte Verbindungen
|
Ozon Selendioxid |
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Schwefeldioxid (IUPAC-empfohlene Schreibweise) oder Schwefeldioxid (traditionelles Commonwealth-Englisch) ist die chemische Verbindung mit der Formel SO
2. Es handelt sich um ein giftiges Gas, das für den Geruch von verbrannten Streichhölzern verantwortlich ist. Es wird auf natürliche Weise durch vulkanische Aktivitäten freigesetzt und entsteht als Nebenprodukt bei der Kupfergewinnung und der Verbrennung von schwefelhaltigen fossilen Brennstoffen. Schwefeldioxid hat einen stechenden Geruch wie Salpetersäure. ⓘ
| Strukturformel ⓘ | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
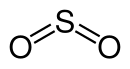
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Schwefeldioxid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | SO2 | ||||||||||||
| Kurzbeschreibung |
farbloses, stechend riechendes, giftiges Gas | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 64,06 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Schmelzpunkt |
−75,5 °C | ||||||||||||
| Siedepunkt |
−10,05 °C | ||||||||||||
| Dampfdruck |
0,3271 MPa (20 °C) | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Dipolmoment | |||||||||||||
| Brechungsindex |
1,000686 (0 °C, 101,325 kPa) | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK |
| ||||||||||||
| Toxikologische Daten |
2520 ppm·1 h (LC50, Ratte, inh.) | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Struktur und Bindung
Schwefeldioxid ist ein farbloses, stechend riechendes und korrodierendes Gas. Es löst sich gut in Wasser, wobei eine schwach saure Lösung entsteht. Des Weiteren wirkt Schwefeldioxid als Reduktionsmittel. ⓘ
Das Schwefeldioxid-Molekül kann durch zwei mesomere Grenzstrukturen beschrieben werden:

Hierbei werden die beiden σ-Bindungen (zwei S–O-Bindungen) und das freie Elektronenpaar am S-Atom von dem s- und den zwei p-Orbitalen des S-Atoms gebildet. Die π-Bindung ist über das gesamte Molekül delokalisiert (Mehrzentren-π-Bindung). ⓘ
Die Schwefel-Sauerstoff-Bindung hat eine Bindungsordnung von 1,5. Dieser einfache Ansatz, der keine Beteiligung von d-Orbitalen vorsieht, wird unterstützt. Im Sinne des Elektronenzählungsformalismus hat das Schwefelatom eine Oxidationsstufe von +4 und eine formale Ladung von +1. ⓘ
Vorkommen

Schwefeldioxid kommt auf der Erde in sehr geringen Konzentrationen vor und liegt in der Atmosphäre bei etwa 1 ppm. ⓘ
Auf anderen Planeten kommt Schwefeldioxid in unterschiedlichen Konzentrationen vor, wobei die Venusatmosphäre mit 150 ppm das dritthäufigste atmosphärische Gas ist. Dort reagiert es mit Wasser zu Schwefelsäurewolken und ist eine Schlüsselkomponente des globalen atmosphärischen Schwefelkreislaufs auf dem Planeten und trägt zur globalen Erwärmung bei. Es wird als Hauptfaktor für die Erwärmung des frühen Mars angesehen, wobei die Konzentrationen in der unteren Atmosphäre auf bis zu 100 ppm geschätzt werden, obwohl es nur in Spuren vorhanden ist. Wie auf der Erde wird auch auf der Venus und dem Mars vermutet, dass seine Hauptquelle vulkanisch ist. Die Atmosphäre von Io, einem natürlichen Satelliten des Jupiters, besteht zu 90 % aus Schwefeldioxid, und man nimmt an, dass auch in der Atmosphäre des Jupiters Spuren von Schwefeldioxid vorhanden sind. ⓘ
Als Eis kommt es auf den galileischen Monden in großer Menge vor - als sublimierendes Eis oder Frost auf der hinteren Hemisphäre von Io und in der Kruste und dem Mantel von Europa, Ganymed und Kallisto, möglicherweise auch in flüssiger Form und in leichter Reaktion mit Wasser. ⓘ
Produktion
Schwefeldioxid wird hauptsächlich für die Herstellung von Schwefelsäure produziert (siehe Kontaktverfahren). In den Vereinigten Staaten wurden 1979 23,6 Millionen Tonnen (26.014.547 US-Kurztonnen) Schwefeldioxid auf diese Weise verwendet, während 150 Tausend Tonnen (165.347 US-Kurztonnen) für andere Zwecke eingesetzt wurden. Der größte Teil des Schwefeldioxids wird durch die Verbrennung von elementarem Schwefel erzeugt. Ein Teil des Schwefeldioxids wird auch durch das Rösten von Pyrit und anderen sulfidischen Erzen an der Luft erzeugt. ⓘ
Verbrennungswege
Schwefeldioxid entsteht bei der Verbrennung von Schwefel oder von schwefelhaltigen Materialien:
- S + O2 → SO2, ΔH = -297 kJ/mol ⓘ
Zur Unterstützung der Verbrennung wird verflüssigter Schwefel (140-150 °C, 284-302 °F) durch eine Zerstäubungsdüse gesprüht, um feine Schwefeltröpfchen mit einer großen Oberfläche zu erzeugen. Die Reaktion ist exotherm, und die Verbrennung erzeugt Temperaturen von 1000-1600 °C (1832-2912 °F). Die große Menge an erzeugter Wärme wird durch Dampferzeugung zurückgewonnen, die anschließend in Strom umgewandelt werden kann. ⓘ
Die Verbrennung von Schwefelwasserstoff und schwefelorganischen Verbindungen läuft ähnlich ab. Zum Beispiel:
- 2 H2S + 3 O2 → 2 H2O + 2 SO2 ⓘ
Beim Rösten von Sulfiderzen wie Pyrit, Sphalerit und Zinnober (Quecksilbersulfid) wird ebenfalls SO2 freigesetzt:
- 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
- 2 ZnS + 3 O2 → 2 ZnO + 2 SO2
- HgS + O2 → Hg + SO2
- 4 FeS + 7O2 → 2 Fe2O3 + 4 SO2 ⓘ
Eine Kombination dieser Reaktionen ist für die größte Quelle von Schwefeldioxid verantwortlich: Vulkanausbrüche. Diese Ereignisse können Millionen von Tonnen SO2 freisetzen. ⓘ
Reduktion von höheren Oxiden
Schwefeldioxid kann auch ein Nebenprodukt bei der Herstellung von Kalziumsilikatzement sein; bei diesem Verfahren wird CaSO4 mit Koks und Sand erhitzt:
- 2 CaSO4 + 2 SiO2 + C → 2 CaSiO3 + 2 SO2 + CO2 ⓘ
Bis in die 1970er Jahre wurden mit diesem Verfahren in Whitehaven, England, kommerzielle Mengen an Schwefelsäure und Zement hergestellt. Das mit Schiefer oder Mergel vermischte und geröstete Sulfat setzte Schwefeldioxidgas frei, das bei der Schwefelsäureherstellung verwendet wird, und bei der Reaktion entstand auch Calciumsilikat, ein Vorprodukt für die Zementherstellung. ⓘ
Im Labormaßstab entsteht bei der Einwirkung von heißer konzentrierter Schwefelsäure auf Kupferdrehspäne Schwefeldioxid. ⓘ
- Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O ⓘ
Aus Sulfiten
Sulfite entstehen durch die Einwirkung von wässriger Base auf Schwefeldioxid:
- SO2 + 2 NaOH → Na2SO3 + H2O ⓘ
Beim Ansäuern tritt die umgekehrte Reaktion auf:
- H+ + HSO3- → SO2 + H2O ⓘ
Reaktionen
Da Schwefel die Oxidationsstufe +4 hat, ist Schwefeldioxid ein Reduktionsmittel. Es wird durch Halogene zu Sulfurylhalogeniden, wie z. B. Sulfurylchlorid, oxidiert:
- SO2 + Cl2 → SO2Cl2 ⓘ
Schwefeldioxid ist das Oxidationsmittel im Claus-Prozess, der in Ölraffinerien in großem Maßstab durchgeführt wird. Dabei wird Schwefeldioxid durch Schwefelwasserstoff zu elementarem Schwefel reduziert:
- SO2 + 2 H2S → 3 S + 2 H2O ⓘ
Die sequentielle Oxidation von Schwefeldioxid mit anschließender Hydratation wird zur Herstellung von Schwefelsäure verwendet.
- 2 SO2 + 2 H2O + O2 → 2 H2SO4 ⓘ
Reaktionen im Labor
Schwefeldioxid ist eines der wenigen gebräuchlichen sauren und zugleich reduzierenden Gase. Es färbt feuchten Lackmus rosa (weil es sauer ist) und dann weiß (wegen seiner bleichenden Wirkung). Man kann es nachweisen, indem man es durch eine Dichromatlösung sprudeln lässt, wobei sich die Lösung von orange nach grün färbt (Cr3+ (aq)). Es kann auch Eisen(III)-Ionen zu Eisen(II)-Ionen reduzieren. ⓘ
Schwefeldioxid kann mit bestimmten 1,3-Dienen in einer cheletropen Reaktion reagieren und dabei cyclische Sulfone bilden. Diese Reaktion wird in industriellem Maßstab für die Synthese von Sulfolan genutzt, das ein wichtiges Lösungsmittel in der petrochemischen Industrie ist. ⓘ
Schwefeldioxid kann sich als Ligand an Metallionen binden, um Metall-Schwefeldioxid-Komplexe zu bilden, bei denen das Übergangsmetall in der Regel die Oxidationsstufe 0 oder +1 aufweist. Es sind viele verschiedene Bindungsarten (Geometrien) bekannt, aber in den meisten Fällen ist der Ligand einzähnig und über den Schwefel an das Metall gebunden, der entweder planar oder pyramidal η1 sein kann. Als η1-SO2 (S-gebundener planarer) Ligand fungiert Schwefeldioxid als Lewis-Base, indem es das einsame Paar an S nutzt. SO2 fungiert als Lewis-Säure in seinem η1-SO2 (S-gebundene pyramidale) Bindungsmodus mit Metallen und in seinen 1:1-Addukten mit Lewis-Basen wie Dimethylacetamid und Trimethylamin. Bei der Bindung an Lewis-Basen sind die Säureparameter von SO2 EA = 0,51 und EA = 1,56. ⓘ
Verwendungen
Die übergreifende, dominierende Verwendung von Schwefeldioxid ist die Herstellung von Schwefelsäure. ⓘ
Vorläufer von Schwefelsäure
Schwefeldioxid ist ein Zwischenprodukt bei der Herstellung von Schwefelsäure, das in Schwefeltrioxid und dann in Oleum umgewandelt wird, das wiederum zu Schwefelsäure verarbeitet wird. Schwefeldioxid für diesen Zweck entsteht, wenn sich Schwefel mit Sauerstoff verbindet. Das Verfahren zur Umwandlung von Schwefeldioxid in Schwefelsäure wird als Kontaktverfahren bezeichnet. Jährlich werden mehrere Milliarden Kilogramm für diesen Zweck hergestellt. ⓘ
Konservierungsmittel für Lebensmittel
Schwefeldioxid wird aufgrund seiner antimikrobiellen Eigenschaften und seiner Fähigkeit, Oxidation zu verhindern, manchmal als Konservierungsmittel für getrocknete Aprikosen, getrocknete Feigen und andere Trockenfrüchte verwendet und wird in Europa als E220 bezeichnet. Als Konservierungsmittel bewahrt es das farbenfrohe Aussehen der Früchte und verhindert die Fäulnis. Es wird auch der geschwefelten Melasse zugesetzt. Sublimiertes Sulfit wird in einem geschlossenen Raum mit den Früchten entzündet und verbrannt. Dies geschieht in der Regel im Freien. Die Früchte können durch Eintauchen in Natriumbisulfit, Natriumsulfit oder Natriummetabisulfit geschwefelt werden. ⓘ
Weinherstellung
Schwefeldioxid wurde erstmals von den Römern in der Weinherstellung verwendet, als sie entdeckten, dass das Abbrennen von Schwefelkerzen in leeren Weinbehältern diese frisch und frei von Essiggeruch hält. ⓘ
Es ist nach wie vor eine wichtige Verbindung bei der Weinherstellung und wird in Teilen pro Million (ppm) im Wein gemessen. Selbst in so genanntem ungeschwefeltem Wein ist er in Konzentrationen von bis zu 10 mg/l enthalten. Es dient als Antibiotikum und Antioxidationsmittel und schützt den Wein vor dem Verderben durch Bakterien und vor Oxidation - ein Phänomen, das zur Bräunung des Weins und zum Verlust der kulturspezifischen Aromen führt. Seine antimikrobielle Wirkung trägt auch dazu bei, den Gehalt an flüchtiger Säure zu minimieren. Weine, die Schwefeldioxid enthalten, werden in der Regel mit dem Hinweis "sulfithaltig" gekennzeichnet. ⓘ
Schwefeldioxid kommt im Wein in freier und gebundener Form vor, und die Kombinationen werden als Gesamt-SO2 bezeichnet. Die Bindung, z. B. an die Carbonylgruppe des Acetaldehyds, ist je nach Wein unterschiedlich. Die freie Form existiert im Gleichgewicht zwischen molekularem SO2 (als gelöstes Gas) und Bisulfit-Ionen, die wiederum im Gleichgewicht mit Sulfit-Ionen stehen. Diese Gleichgewichte hängen vom pH-Wert des Weins ab. Bei einem niedrigeren pH-Wert verschiebt sich das Gleichgewicht in Richtung des molekularen (gasförmigen) SO2, das die aktive Form ist, während bei einem höheren pH-Wert mehr SO2 in den inaktiven Formen Sulfit und Bisulfit vorliegt. Das molekulare SO2 wirkt als antimikrobielles und antioxidatives Mittel, und dies ist auch die Form, die bei hohen Konzentrationen als stechender Geruch wahrgenommen werden kann. Bei Weinen mit einer SO2-Gesamtkonzentration von weniger als 10 ppm ist der Hinweis "enthält Sulfite" auf dem Etikett nach US- und EU-Recht nicht erforderlich. Die Obergrenze für den Gesamt-SO2-Gehalt in Wein liegt in den USA bei 350 ppm, in der EU bei 160 ppm für Rotweine und 210 ppm für Weiß- und Roséweine. In niedrigen Konzentrationen ist SO2 im Wein meist nicht nachweisbar, aber bei freien SO2-Konzentrationen über 50 ppm macht sich SO2 im Geruch und Geschmack des Weins bemerkbar. ⓘ
SO2 ist auch eine sehr wichtige Verbindung für die Hygiene im Weinkeller. Weinkellereien und Geräte müssen sauber gehalten werden, und da Bleichmittel in einer Weinkellerei wegen des Risikos von Korkverfärbungen nicht verwendet werden können, wird üblicherweise eine Mischung aus SO2, Wasser und Zitronensäure zur Reinigung und Desinfektion der Geräte eingesetzt. Ozon (O3) wird aufgrund seiner Wirksamkeit und der Tatsache, dass es weder den Wein noch die meisten Geräte angreift, heute in großem Umfang zur Desinfektion in Weinkellereien eingesetzt. ⓘ
Als Reduktionsmittel
Schwefeldioxid ist auch ein gutes Reduktionsmittel. In Anwesenheit von Wasser ist Schwefeldioxid in der Lage, Stoffe zu entfärben. Insbesondere ist es ein nützliches Reduktionsbleichmittel für Papier und empfindliche Materialien wie Kleidung. Dieser Bleicheffekt hält normalerweise nicht sehr lange an. Der Sauerstoff in der Atmosphäre reoxidiert die reduzierten Farbstoffe, wodurch die Farbe wiederhergestellt wird. In der kommunalen Abwasserbehandlung wird Schwefeldioxid verwendet, um chlorierte Abwässer vor der Freigabe zu behandeln. Schwefeldioxid reduziert freies und gebundenes Chlor zu Chlorid. ⓘ
Schwefeldioxid ist in Wasser recht gut löslich, und sowohl in der IR- als auch in der Raman-Spektroskopie ist die hypothetische schweflige Säure H2SO3 nicht in nennenswertem Umfang vorhanden. Solche Lösungen zeigen jedoch Spektren des Hydrogensulfit-Ions, HSO3-, bei der Reaktion mit Wasser, und es ist tatsächlich das vorhandene Reduktionsmittel:
- SO2 + H2O ⇌ HSO3- + H+ ⓘ
Als Begasungsmittel
Zu Beginn des 20. Jahrhunderts wurde Schwefeldioxid in Buenos Aires als Begasungsmittel eingesetzt, um Ratten zu töten, die das Bakterium Yersinia pestis, das die Beulenpest verursacht, in sich trugen. Der Einsatz war erfolgreich, und die Anwendung dieser Methode wurde auf andere Gebiete in Südamerika ausgedehnt. In Buenos Aires, wo diese Geräte unter dem Namen Sulfurozador bekannt waren, aber später auch in Rio de Janeiro, New Orleans und San Francisco wurden die Schwefeldioxid-Behandlungsmaschinen in die Straßen gebracht, um umfangreiche Desinfektionskampagnen mit wirksamen Ergebnissen zu ermöglichen. ⓘ
Biochemische und biomedizinische Aufgaben
Schwefeldioxid oder seine konjugierte Base Bisulfit wird biologisch als Zwischenprodukt sowohl in sulfatreduzierenden Organismen als auch in schwefeloxidierenden Bakterien gebildet. Die Rolle von Schwefeldioxid in der Biologie von Säugetieren ist noch nicht gut verstanden. Schwefeldioxid blockiert die Nervensignale der pulmonalen Dehnungsrezeptoren und hebt den Hering-Breuer-Aufblasreflex auf. ⓘ
Es wird davon ausgegangen, dass endogenes Schwefeldioxid eine bedeutende physiologische Rolle bei der Regulierung der Herz- und Blutgefäßfunktion spielt, und ein abnormaler oder mangelhafter Schwefeldioxid-Stoffwechsel kann zu verschiedenen kardiovaskulären Erkrankungen wie arterielle Hypertonie, Atherosklerose, pulmonale arterielle Hypertonie und Stenokardie beitragen. ⓘ
Es wurde gezeigt, dass bei Kindern mit pulmonaler arterieller Hypertonie aufgrund angeborener Herzkrankheiten der Homocysteinspiegel höher und der Gehalt an endogenem Schwefeldioxid niedriger ist als bei normalen Kontrollkindern. Außerdem korrelierten diese biochemischen Parameter stark mit dem Schweregrad der pulmonalen arteriellen Hypertonie. Die Autoren betrachteten Homocystein als einen nützlichen biochemischen Marker für den Schweregrad der Erkrankung und den Schwefeldioxid-Stoffwechsel als eines der möglichen therapeutischen Ziele bei diesen Patienten. ⓘ
Endogenes Schwefeldioxid senkt nachweislich auch die Proliferationsrate endothelialer glatter Muskelzellen in den Blutgefäßen, indem es die MAPK-Aktivität senkt und die Adenylylzyklase und die Proteinkinase A aktiviert. Die Proliferation glatter Muskelzellen ist einer der wichtigsten Mechanismen des hypertensiven Umbaus von Blutgefäßen und ihrer Verengung und somit ein wichtiger pathogenetischer Mechanismus bei arterieller Hypertonie und Atherosklerose. ⓘ
Endogenes Schwefeldioxid bewirkt in niedrigen Konzentrationen eine endothelabhängige Gefäßerweiterung. In höheren Konzentrationen bewirkt es eine endothelunabhängige Vasodilatation und hat eine negativ inotrope Wirkung auf die Herzleistung, wodurch der Blutdruck und der Sauerstoffverbrauch des Herzmuskels wirksam gesenkt werden. Die gefäßerweiternden und bronchienerweiternden Wirkungen von Schwefeldioxid werden über ATP-abhängige Kalziumkanäle und Kalziumkanäle vom L-Typ ("Dihydropyridin") vermittelt. Endogenes Schwefeldioxid ist auch ein starkes entzündungshemmendes, antioxidatives und zytoprotektives Mittel. Es senkt den Blutdruck und verlangsamt den hypertensiven Umbau der Blutgefäße, insbesondere die Verdickung der Intima. Außerdem reguliert es den Lipidstoffwechsel. ⓘ
Endogenes Schwefeldioxid vermindert auch die durch die adrenerge Überstimulation mit Isoproterenol verursachten Herzmuskelschäden und stärkt die antioxidativen Abwehrreserven des Herzmuskels. ⓘ
Als Reagenz und Lösungsmittel im Labor
Schwefeldioxid ist ein vielseitiges inertes Lösungsmittel, das häufig zum Lösen stark oxidierender Salze verwendet wird. Gelegentlich wird es auch als Quelle für die Sulfonylgruppe in der organischen Synthese verwendet. Die Behandlung von Aryldiazoniumsalzen mit Schwefeldioxid und Kupferchlorid ergibt beispielsweise das entsprechende Arylsulfonylchlorid:
Aufgrund seiner sehr geringen Lewis-Basizität wird es häufig als Niedrigtemperatur-Lösungsmittel/Verdünnungsmittel für Supersäuren wie z. B. die magische Säure (FSO3H/SbF5) verwendet, so dass hochreaktive Spezies wie das tert.-Butylkation bei niedrigen Temperaturen spektroskopisch beobachtet werden können (allerdings reagieren tertiäre Carbokationen oberhalb von etwa -30 °C mit SO2, und bei diesen höheren Temperaturen müssen sogar weniger reaktive Lösungsmittel wie SO2ClF verwendet werden). ⓘ
Angestrebte Anwendungen
Als Kältemittel
Da Schwefeldioxid leicht kondensiert und eine hohe Verdampfungswärme besitzt, ist es ein Kandidat für Kältemittel. Vor der Entwicklung von Fluorchlorkohlenwasserstoffen wurde Schwefeldioxid als Kältemittel in Haushaltskühlschränken verwendet. ⓘ
Klimatechnik
In der Klimatechnik wurde vorgeschlagen, Schwefeldioxid in die Stratosphäre einzubringen. Der Abkühlungseffekt wäre vergleichbar mit dem, der nach dem großen explosiven Ausbruch des Mount Pinatubo 1991 beobachtet wurde. Diese Form des Geo-Engineering hätte jedoch ungewisse regionale Auswirkungen auf die Niederschlagsmuster, z. B. in Monsunregionen. ⓘ
Als Luftschadstoff

Schwefeldioxid ist eine auffällige Komponente in der Atmosphäre, insbesondere nach Vulkanausbrüchen. Nach Angaben der United States Environmental Protection Agency (EPA) wurde in den USA pro Jahr die folgende Menge an Schwefeldioxid freigesetzt:
| Jahr | SO2 ⓘ |
|---|---|
| 1970 | 31.161.000 kurze Tonnen (28,3 Mt) |
| 1980 | 25.905.000 kurze Tonnen (23,5 Mt) |
| 1990 | 23.678.000 kurze Tonnen (21,5 Mt) |
| 1996 | 18.859.000 kurze Tonnen (17,1 Mt) |
| 1997 | 19.363.000 kurze Tonnen (17,6 Mt) |
| 1998 | 19.491.000 kurze Tonnen (17,7 Mt) |
| 1999 | 18.867.000 kurze Tonnen (17,1 Mt) |
Schwefeldioxid ist ein wichtiger Luftschadstoff und hat erhebliche Auswirkungen auf die menschliche Gesundheit. Darüber hinaus kann die Schwefeldioxidkonzentration in der Atmosphäre die Eignung von Lebensräumen für Pflanzengemeinschaften und Tiere beeinflussen. Schwefeldioxidemissionen sind ein Vorläufer des sauren Regens und der atmosphärischen Partikel. Vor allem dank des Programms für sauren Regen der US-Umweltbehörde EPA sind die Emissionen in den USA zwischen 1983 und 2002 um 33 % zurückgegangen. Diese Verbesserung ist zum Teil auf die Rauchgasentschwefelung zurückzuführen, eine Technologie, mit der SO2 in Kraftwerken, die schwefelhaltige Kohle oder Öl verbrennen, chemisch gebunden werden kann. Insbesondere reagiert Calciumoxid (Kalk) mit Schwefeldioxid zu Calciumsulfit:
- CaO + SO2 → CaSO3 ⓘ
Durch aerobe Oxidation von CaSO3 entsteht CaSO4, Anhydrit. Der größte Teil des in Europa verkauften Gipses stammt aus der Rauchgasentschwefelung. ⓘ
Zur Kontrolle der Schwefelemissionen wurden Dutzende von Verfahren mit relativ hohem Wirkungsgrad für die Ausrüstung von Kohlekraftwerken entwickelt. ⓘ
Schwefel kann während der Verbrennung aus der Kohle entfernt werden, indem Kalkstein als Bettmaterial in der Wirbelschichtfeuerung verwendet wird. ⓘ
Schwefel kann auch vor der Verbrennung aus Brennstoffen entfernt werden, um die Bildung von SO2 bei der Verbrennung des Brennstoffs zu verhindern. Das Claus-Verfahren wird in Raffinerien eingesetzt, um Schwefel als Nebenprodukt zu gewinnen. Das Stretford-Verfahren wurde ebenfalls zur Entfernung von Schwefel aus Brennstoffen eingesetzt. Auch Redox-Verfahren, die Eisenoxide verwenden, können eingesetzt werden, z. B. Lo-Cat oder Sulferox. ⓘ
Eine Analyse ergab, dass 18 Kohlekraftwerke in den westlichen Balkanländern zweieinhalb Mal mehr Schwefeldioxid ausstoßen als alle 221 Kohlekraftwerke in der EU zusammen. ⓘ
Kraftstoffadditive wie Kalziumadditive und Magnesiumcarboxylat können in Schiffsmotoren verwendet werden, um die Emission von Schwefeldioxid in die Atmosphäre zu verringern. ⓘ
Im Jahr 2006 war China mit geschätzten Emissionen von 25.490.000 Tonnen (23,1 Mio. t) im Jahr 2005 der weltweit größte Verursacher von Schwefeldioxid. Diese Menge entspricht einem Anstieg von 27 % seit dem Jahr 2000 und ist in etwa mit den Emissionen der USA im Jahr 1980 vergleichbar. ⓘ
Interessanterweise produzieren große Mengen von unerwünschtem Sargassum, das seit 2015 zunehmend an Mexikos Touristenstränden angeschwemmt wird, Schwefelwasserstoff, wenn es verrottet, und werden schließlich (mit einer Halbwertszeit von 18 Stunden) zu einer nicht-vulkanischen, nicht-fossilen Quelle für atmosphärisches Schwefeldioxid. ⓘ
Schwefeldioxid in der Welt am 15. April 2017. Beachten Sie, dass sich Schwefeldioxid mit den vorherrschenden Winden durch die Atmosphäre bewegt und daher die lokale Schwefeldioxid-Verteilung je nach Wetterlage und Jahreszeit von Tag zu Tag variiert. ⓘ
Sicherheit

Sicherheitshinweise
Eine Schwefeldioxidkonzentration, die über dem MAK-Wert liegt, kann beim Menschen zu Kopfschmerzen, Übelkeit und Benommenheit führen. In höheren Konzentrationen schädigt das Gas stark die Bronchien und Lungen. ⓘ
Eine Exposition gegenüber hohen Schwefeldioxidkonzentrationen über einen längeren Zeitraum kann durch die Zerstörung des für die Blutbildung wichtigen B12-Vitamins zu Anämie führen. ⓘ
2021 hat die Weltgesundheitsorganisation ihre Luftgüte-Richtlinie nach unten hin angepasst. Die neue Empfehlung bei Schwefeldioxid liegt bei 40 µg/m3 im 24-Stunden-Mittel. ⓘ
Die zufällige Exposition gegenüber Schwefeldioxid ist Routine, z. B. durch den Rauch von Streichhölzern, Kohle und schwefelhaltigen Brennstoffen. ⓘ
Schwefeldioxid ist leicht giftig und kann in hohen Konzentrationen gefährlich sein. Auch die langfristige Exposition gegenüber niedrigen Konzentrationen ist problematisch. Eine systematische Übersichtsarbeit aus dem Jahr 2011 kam zu dem Schluss, dass die Exposition gegenüber Schwefeldioxid mit Frühgeburten verbunden ist. ⓘ
U.S.-Vorschriften
Im Jahr 2008 senkte die American Conference of Governmental Industrial Hygienists den Grenzwert für die Kurzzeitexposition auf 0,25 Teile pro Million (ppm). In den USA hat die OSHA den PEL auf 5 ppm (13 mg/m3) zeitlich gewichtetes Mittel festgelegt. Ebenfalls in den USA hat NIOSH den IDLH-Wert auf 100 ppm festgelegt. Im Jahr 2010 überarbeitete die EPA die primäre SO2-NAAQS, indem sie eine neue einstündige Norm mit einem Wert von 75 Teilen pro Milliarde (ppb) festlegte. Die EPA hob die beiden bestehenden primären Standards auf, weil sie angesichts eines einstündigen Standards von 75 ppb keinen zusätzlichen Schutz der öffentlichen Gesundheit bieten würden. ⓘ
Verschlucken
In den Vereinigten Staaten listet das Center for Science in the Public Interest die beiden Lebensmittelkonservierungsstoffe Schwefeldioxid und Natriumbisulfit als für den menschlichen Verzehr unbedenklich auf, mit Ausnahme bestimmter asthmatischer Personen, die darauf empfindlich reagieren können, insbesondere in großen Mengen. Die Symptome einer Überempfindlichkeit gegen Sulfite, einschließlich Schwefeldioxid, äußern sich in potenziell lebensbedrohlichen Atemproblemen innerhalb von Minuten nach der Einnahme. Sulfite können auch bei Nicht-Asthmatikern Symptome wie Dermatitis, Urtikaria, Flush, Hypotonie, Bauchschmerzen und Durchfall bis hin zu lebensbedrohlicher Anaphylaxie hervorrufen. ⓘ
Eigenschaften
Physikalische Eigenschaften
Schwefeldioxid hat eine relative Gasdichte von 2,26 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine Dichte der flüssigen Phase am Siedepunkt von 1,458 kg/l. Die Gasdichte unter Normalbedingungen (0 °C, 1013 mbar) beträgt 2,9285 kg·m−3, bei einer Temperatur von 15 °C und einem Druck von 1 bar hingegen 2,728 kg·m−3. Die kritische Temperatur liegt bei 157,5 °C, der kritische Druck bei 78,8 bar und die kritische Dichte erhält den Wert 0,525 g·cm−3. Am Tripelpunkt liegt eine Temperatur von −75,5 °C und ein Druck von 16,7 mbar (12,56 Torr) vor. ⓘ
Aufbewahrung
Schwefeldioxid wird in der Industrie meist aus Druckgasflaschen bezogen und wird häufig zur Temperierung in der Produktionsumgebung, also in Innenräumen aufbewahrt, oft auch direkt neben Thermoprozessanlagen. Im Rahmen der Gefährdungsbeurteilung ist für die Aufbewahrung von Schwefeldioxid gemäß § 5 Arbeitsschutzgesetz und § 6 GefStoffV zu ermitteln, ob sich durch die Lagerung von Gefahrstoffen Gefährdungen für die Beschäftigten oder andere Personen ergeben können. ⓘ
Für die Aufbewahrung von Schwefeldioxid gelten (in Deutschland) insbesondere folgende Vorschriften:
- TRGS 510 Lagerung von Gefahrstoffen in ortsbeweglichen Behältern
- TRBS 3145 / TRGS 745 Ortsbewegliche Druckgasbehälter – Füllen, Bereitstellen, innerbetriebliche Beförderung, Entleeren
- TRBS 3146 / TRGS 726 Ortsfeste Druckanlagen für Gase
Zum Gesundheitsschutz der Mitarbeiter und um den Anforderungen des Arbeitsschutzgesetzes zu entsprechen, sind Schwefeldioxid -Flaschen daher in einer geeigneten Aufbewahrungseinrichtung aufzubewahren. Geeignet dafür ist der entsprechend ausgestattete Sicherheitsgasflaschenschrank, dessen besondere Ausstattung für die Schwefeldioxid-Aufbewahrung aus folgenden wesentlichen Komponenten besteht:
- Der Sicherheitsschrank an sich, für eine oder mehrere Schwefeldioxid-Flasche(n) und eine Stickstoffgas-Flasche. Dabei sind oft zwei Flaschen Schwefeldioxid für den Betrieb und die automatische Umschaltung vorgesehen. Eine Flasche steht im Schrank zum Vortemperieren, aus der zweiten Flasche wird das Gas zur Verwendung entnommen. Die Stickstoffgas-Flasche dient der Versorgung der Spüleinrichtung für den sicheren Flaschenwechsel. Der Sicherheitsschrank wird als feuerhemmender Schrank ausgeführt, da das unter Druck stehende Gas bei Erwärmung explodieren kann und dann schwere Verätzungen der Haut und schwere Augenschäden verursacht. Der Schrank sollte abschließbar sein, da das Sicherheitsdatenblatt für Schwefeldioxid „P405 - Unter Verschluss aufbewahren“ vorgibt.
- Schwefeldioxid -Druckregelstation aus Edelstahl mit automatischer Umschaltung, zur unterbrechungsfreien Medienversorgung. Die Schwefeldioxid -Gasflaschen werden mit Edelstahlwellschlauch angeschlossen. Die verwendeten Armaturen müssen aus Edelstahl sein, da Schwefeldioxid mit Luftfeuchtigkeit zu Schwefelsäure (H2SO4) umgesetzt wird.
- Ein automatisches Absperrmagnetventil ermöglicht die Absperrung der Schwefeldioxid -Prozessleitung zur Verwendungsstelle bei Not-Aus-Betätigung oder bei Gas-Alarm.
- Der Gaswarnsensor im Sicherheitsschrank, ggfs. mit zusätzlichen weiteren Gaswarnsensoren in der Nähe der Verwendungsstellen, erzeugt den Gas-Alarm mit optischem und akustischem Signal.
- Fremdbelüftung mit Ventilator zur manuellen Betätigung durch den Benutzer und automatischen Auslösung bei Ansprache der Gaswarneinrichtung. Meist ist der Lüftungsauslass an ein Lüftungssystem angebunden, damit die Gase nicht in die Produktionsumgebung entweichen.
Mit dieser speziellen Ausstattung des Schwefeldioxid-Schranks werden Beschäftigte sicher vor der Gefahr zu hoher Schwefeldioxid-Konzentration in Atemluft sowie vor Verätzungen bei Unfällen geschützt. ⓘ
Einsatz in Konzentrationslagern
Bei Experimenten mit Giftgasen, die im kroatischen KZ Stara Gradiška durchgeführt wurden, wurde neben Zyklon B auch Schwefeldioxid an serbischen, jüdischen und Roma-Frauen sowie Kindern eingesetzt. ⓘ
Umweltverschmutzung
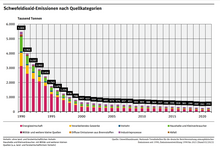
Schwefeldioxid schädigt in hohen Konzentrationen Mensch, Tiere und Pflanzen. Die Oxidationsprodukte führen zu „saurem Regen“, der empfindliche Ökosysteme wie Wald und Seen gefährdet sowie Gebäude und Materialien angreift. Dazu zählt auch die Schwächung von Forstpflanzen, die nach außerordentlichen Wintern stärkere Frostschäden erleiden als vergleichbare Pflanzen in weniger belasteten Gebieten. Die SO2-Emissionen der entwickelten Industriestaaten konnten jedoch in den letzten zwei Jahrzehnten durch die Nutzung schwefelarmer bzw. schwefelfreier Brenn- und Kraftstoffe und mittels Rauchgasentschwefelung stark reduziert werden. ⓘ
Von allen Verkehrsträgern leistet der internationale Schifffahrtsverkehr den höchsten Emissionsbeitrag. Dort liegt der von der IMO festgelegte maximal zulässige Schwefelgehalt im Brennstoff für Schiffe seit dem 1. Januar 2020 bei 0,5 Prozent. Dabei kann der Grenzwert jedoch auch durch den Einsatz von Scrubbern zur Abgasnachbehandlung eingehalten werden. Diese Grenze gilt auch für kalifornische Küstengewässer. In der Ost- und Nordsee gibt es Schwefelemissions-Überwachungsgebiete (engl. SECA), in denen der Grenzwert seit dem 1. Januar 2015 0,1 Prozent beträgt. Außerhalb dieser Gebiete muss ein Grenzwert von 0,5 Prozent eingehalten werden, wobei auch hier der Einsatz von Scrubbern zulässig ist, um die Emissionen entsprechend zu verringern. ⓘ
2019 wurde eine Studie von Transport and Environment veröffentlicht, welche zeigt, dass allein die Kreuzfahrtschiffe von Carnival im Jahr 2017 fast so viele Schwefeloxide entlang Europas Küsten ausgestoßen haben wie alle Personenkraftwagen (über 260 Millionen) in Europa zusammen. Das Max-Planck-Institut für Meteorologie konnte im Rahmen einer Studie zeigen, dass in der Umgebung der stark frequentierten Seehäfen Rotterdam, Antwerpen und Milford Haven eine erheblich dichtere Wolkendecke herrscht als im Umland. Schwefeldioxid und Stickoxide wirken als Kondensationskeime und regen die Wolkenbildung an. Die durch diese Wolkendecke verstärkte Albedo führte zu einer Verringerung der Sonneneinstrahlung in den darunterliegenden Gebieten. ⓘ
Auch global kann Schwefeldioxid durch Erhöhung des Aerosolgehalts zur Trübung der Atmosphäre beitragen, etwa nach starken Vulkanausbrüchen. ⓘ








