Schwefelwasserstoff

| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Systematische IUPAC-Bezeichnung
Schwefelwasserstoff | |||
Andere Namen
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
Beilstein-Referenz
|
3535004 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
303 | ||
| KEGG | |||
| MeSH | Wasserstoff+Sulfid | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1053 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
H2S | ||
| Molekulare Masse | 34,08 g-mol-1 | ||
| Erscheinungsbild | Farbloses Gas | ||
| Geruch | Stechend, wie verfaulte Eier | ||
| Dichte | 1,363 g dm-3 | ||
| Schmelzpunkt | -82 °C (-116 °F; 191 K) | ||
| Siedepunkt | -60 °C (-76 °F; 213 K) | ||
Löslichkeit in Wasser
|
4 g dm-3 (bei 20 °C) | ||
| Dampfdruck | 1740 kPa (bei 21 °C) | ||
| Acidität (pKa) | 7.0 | ||
| Konjugierte Säure | Sulfonium | ||
| Konjugierte Base | Bisulfid | ||
Magnetische Suszeptibilität (χ)
|
-25,5-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1.000644 (0 °C) | ||
| Struktur | |||
Punktgruppe
|
C2v | ||
Molekulare Form
|
Gebogen | ||
Dipolmoment
|
0.97 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
1.003 J K-1 g-1 | ||
Std. molare
Entropie (S |
206 J mol-1 K-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-21 kJ mol-1 | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
Entzündlich und sehr giftig | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
  
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H220, H330, H400 | ||
Sicherheitshinweise
|
P210, P260, P271, P273, P284, P304+P340, P310, P320, P377, P381, P391, P403, P403+P233, P405, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | -82,4 °C (-116,3 °F; 190,8 K) | ||
Selbstentzündung
temperatur |
232 °C (450 °F; 505 K) | ||
| Explosionsgrenzen | 4.3–46% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LC50 (mittlere Konzentration)
|
| ||
LCLo (niedrigste veröffentlichte)
|
| ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
C 20 ppm; 50 ppm [10-minütiger maximaler Spitzenwert] | ||
REL (Empfohlen)
|
C 10 ppm (15 mg/m3) [10-minütig] | ||
IDLH (Unmittelbare Gefahr)
|
100 ppm | ||
| Verwandte Verbindungen | |||
Verwandte Wasserstoff-Chalkogenide
|
| ||
Verwandte Verbindungen
|
Phosphin | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Schwefelwasserstoff ist eine chemische Verbindung mit der Formel H
2S. Es handelt sich um ein farbloses Chalkogen-Hydrid-Gas, das giftig, ätzend und brennbar ist und in Spuren in der Umgebungsatmosphäre einen charakteristischen Geruch nach faulen Eiern hat. Die Grubengasbezeichnung für übel riechende schwefelwasserstoffreiche Gasgemische lautet Stinkdampf. Dem schwedischen Chemiker Carl Wilhelm Scheele wird die Entdeckung der chemischen Zusammensetzung von gereinigtem Schwefelwasserstoff im Jahr 1777 zugeschrieben. Die britisch-englische Schreibweise dieser Verbindung ist Hydrogensulfid, eine Schreibweise, die von der Royal Society of Chemistry oder der International Union of Pure and Applied Chemistry nicht mehr empfohlen wird. ⓘ
Schwefelwasserstoff ist für Menschen und die meisten anderen Tiere giftig, da er die Zellatmung ähnlich wie Blausäure hemmt. Wenn es eingeatmet oder es oder seine Salze in großen Mengen aufgenommen werden, kommt es schnell zu Organschäden mit Symptomen, die von Atembeschwerden bis zu Krämpfen und Tod reichen. Trotzdem produziert der menschliche Körper kleine Mengen dieses Sulfids und seiner Mineralsalze und verwendet es als Signalmolekül. ⓘ
Schwefelwasserstoff entsteht häufig durch den mikrobiellen Abbau organischer Stoffe in Abwesenheit von Sauerstoff, wie z. B. in Sümpfen und Abwasserkanälen; dieser Prozess ist allgemein als anaerobe Verdauung bekannt und wird von sulfatreduzierenden Mikroorganismen durchgeführt. Schwefelwasserstoff kommt auch in vulkanischen Gasen, Erdgasvorkommen und manchmal in gut entnommenem Wasser vor. ⓘ
Schwefelwasserstoff (auch Wasserstoffsulfid, Dihydrogensulfid, nicht zu verwechseln mit dem Hydrogensulfid-Anion HS−) ist eine chemische Verbindung aus Schwefel und Wasserstoff mit der Formel H2S. Schwefelwasserstoff ist ein übelriechendes, farbloses, hochgiftiges Gas. Es ist korrosiv, brennbar, leicht entzündlich und geringfügig schwerer als Luft. Es ist in Wasser wenig, in Ethanol etwas besser löslich. H2S ist eine sehr schwache Säure, deren Salze die Sulfide und Hydrogensulfide sind. ⓘ
Schon in sehr geringen Konzentrationen ist Schwefelwasserstoff durch seinen typischen Geruch nach faulen Eiern zu erkennen. Er entsteht u. a. bei der Zersetzung von schwefelhaltigen Aminosäuren in den Proteinen von Eiklar und Dotter. ⓘ
Eigenschaften
Schwefelwasserstoff ist etwas dichter als Luft. Ein Gemisch aus H
2S und Luft kann explosiv sein. Schwefelwasserstoff verbrennt in Sauerstoff mit einer blauen Flamme zu Schwefeldioxid (SO
2) und Wasser. Im Allgemeinen wirkt Schwefelwasserstoff als Reduktionsmittel, in Gegenwart einer Base kann er jedoch auch als Säure wirken, indem er ein Proton abgibt und SH- bildet. ⓘ
Bei hohen Temperaturen oder in Gegenwart von Katalysatoren reagiert Schwefeldioxid mit Schwefelwasserstoff und bildet elementaren Schwefel und Wasser. Diese Reaktion wird im Claus-Verfahren ausgenutzt, einer wichtigen industriellen Methode zur Beseitigung von Schwefelwasserstoff. ⓘ
Schwefelwasserstoff ist in Wasser schwer löslich und wirkt als schwache Säure (pKa = 6,9 in 0,01-0,1 mol/Liter Lösungen bei 18 °C), wobei das Schwefelwasserstoff-Ion HS-
(auch geschrieben SH-
). Schwefelwasserstoff und seine Lösungen sind farblos. An der Luft oxidiert er langsam zu elementarem Schwefel, der in Wasser nicht löslich ist. Das Sulfidanion S2-
wird in wässriger Lösung nicht gebildet. ⓘ
Schwefelwasserstoff reagiert mit Metallionen und bildet Metallsulfide, die unlösliche, oft dunkel gefärbte Feststoffe sind. Blei(II)-acetatpapier wird zum Nachweis von Schwefelwasserstoff verwendet, da es sich leicht in Blei(II)-sulfid umwandelt, das schwarz ist. Bei der Behandlung von Metallsulfiden mit starker Säure oder durch Elektrolyse wird häufig Schwefelwasserstoff freigesetzt. Schwefelwasserstoff ist auch für das Anlaufen verschiedener Metalle, darunter Kupfer und Silber, verantwortlich; die Chemikalie, die für die schwarze Färbung von Silbermünzen verantwortlich ist, ist Silbersulfid (Ag2S), das entsteht, wenn das Silber auf der Oberfläche der Münze mit atmosphärischem Schwefelwasserstoff reagiert. ⓘ
Bei einem Druck von über 90 GPa (Gigapascal) wird Schwefelwasserstoff zu einem metallischen Stromleiter. Wenn diese Hochdruckphase unter eine kritische Temperatur abgekühlt wird, tritt Supraleitfähigkeit auf. Die kritische Temperatur nimmt mit dem Druck zu und reicht von 23 K bei 100 GPa bis 150 K bei 200 GPa. Wenn Schwefelwasserstoff bei höheren Temperaturen unter Druck gesetzt und dann abgekühlt wird, erreicht die kritische Temperatur 203 K (-70 °C), die höchste anerkannte kritische Temperatur für Supraleitung (Stand 2015). Wenn man einen kleinen Teil des Schwefels durch Phosphor ersetzt und noch höhere Drücke anwendet, könnte es möglich sein, die kritische Temperatur auf über 0 °C (273 K) zu erhöhen und Supraleitung bei Raumtemperatur zu erreichen. ⓘ
Thermodynamik: ΔfH0g : −20,5 kJ/mol ⓘ
S0g, 1 bar: 205,77 J/(mol·K) ⓘ
In 1 l Wasser lösen sich bei Raumtemperatur bis zu 2,582 l Schwefelwasserstoffgas. ⓘ
Schwefelwasserstoff ist geringfügig schwerer als Luft, unter Normalbedingungen beträgt der Dichteunterschied etwa 19 %. ⓘ
Das H2S-Molekül ist gewinkelt gebaut. Der Bindungswinkel beträgt 92,1° und der Kernabstand 133,6 pm. Wegen der geringen Elektronegativitätsdifferenz der Bindungspartner und somit geringen Bindungspolarität spielen Wasserstoffbrückenbindungen im Schwefelwasserstoff keine wesentliche Rolle, was sich im relativ niedrigen Schmelz- und Siedepunkt ausdrückt. ⓘ

Sicherheitstechnische Kenngrößen
Schwefelwasserstoff bildet leicht entzündliche Gas-Luft-Gemische. Der Explosionsbereich liegt zwischen 4,3 Vol-% (60 g/m3) als untere Explosionsgrenze (UEG) und 45,5 Vol-% (650 g/m3) als obere Explosionsgrenze (OEG). Der maximale Explosionsdruck beträgt 5,9 bar. Die Grenzspaltweite wurde mit 0,83 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 270 °C. Der Stoff fällt somit in die Temperaturklasse T3. ⓘ
Herstellung
Schwefelwasserstoff wird in der Regel durch Abtrennung aus Sauergas, d. h. Erdgas mit einem hohen Gehalt an H
2S. Es kann auch durch Behandlung von Wasserstoff mit geschmolzenem elementarem Schwefel bei etwa 450 °C hergestellt werden. Kohlenwasserstoffe können bei diesem Verfahren als Wasserstoffquelle dienen. ⓘ
Sulfatreduzierende (bzw. schwefelreduzierende) Bakterien erzeugen unter sauerstoffarmen Bedingungen nutzbare Energie, indem sie Sulfate (bzw. elementaren Schwefel) zur Oxidation von organischen Verbindungen oder Wasserstoff verwenden; dabei entsteht Schwefelwasserstoff als Abfallprodukt. ⓘ
Ein Standard-Laborpräparat ist die Behandlung von Eisen(II)-Sulfid mit einer starken Säure in einem Kipp-Generator:
- FeS + 2 HCl → FeCl2 + H2S
Für die qualitative anorganische Analyse wird Thioacetamid verwendet, um H
2S:
- CH3C(S)NH2 + H2O → CH3C(O)NH2 + H2S ⓘ
Viele Metall- und Nichtmetallsulfide, z. B. Aluminiumsulfid, Phosphorpentasulfid, Siliciumdisulfid, setzen bei Kontakt mit Wasser Schwefelwasserstoff frei:
- 6 H2O + Al2S3 → 3 H2S + 2 Al(OH)3 ⓘ
Dieses Gas entsteht auch beim Erhitzen von Schwefel mit festen organischen Verbindungen und bei der Reduktion sulfurierter organischer Verbindungen mit Wasserstoff. ⓘ
Warmwasserbereiter können die Umwandlung von Sulfat in Wasser in Schwefelwasserstoffgas unterstützen. Dies ist darauf zurückzuführen, dass sie ein warmes, für Schwefelbakterien nachhaltiges Milieu bieten und die Reaktion zwischen dem Sulfat im Wasser und der Anode des Wassererhitzers, die normalerweise aus Magnesiummetall besteht, aufrechterhalten. ⓘ
Biosynthese im Körper
Schwefelwasserstoff kann in den Zellen auf enzymatischem oder nicht enzymatischem Weg gebildet werden. H
2S wirkt im Körper als gasförmiges Signalmolekül, von dem bekannt ist, dass es den Komplex IV der mitochondrialen Elektronentransportkette hemmt, wodurch die ATP-Erzeugung und die biochemische Aktivität in den Zellen effektiv reduziert werden. Drei Enzyme sind für die Synthese von H
2S synthetisieren: Cystathionin-γ-Lyase (CSE), Cystathionin-β-Synthetase (CBS) und 3-Mercaptopyruvat-Sulfurtransferase (3-MST). Diese Enzyme wurden in einer Vielzahl von biologischen Zellen und Geweben identifiziert, und es wurde beobachtet, dass ihre Aktivität durch eine Reihe von Krankheitszuständen induziert wird. Es wird immer deutlicher, dass H
2S ein wichtiger Vermittler für eine Vielzahl von Zellfunktionen in Gesundheit und Krankheit ist. CBS und CSE sind die Hauptverantwortlichen für die H
2S-Biogenese, die auf dem Weg der Trans-Sulfurierung erfolgt. Diese Enzyme zeichnen sich durch die Übertragung eines Schwefelatoms von Methionin auf Serin aus, wodurch ein Cysteinmolekül entsteht. 3-MST trägt auch zur Produktion von Schwefelwasserstoff über den Cystein-Katabolismusweg bei. Mit der Nahrung aufgenommene Aminosäuren wie Methionin und Cystein dienen als primäre Substrate für den Transulfurierungsweg und für die Produktion von Schwefelwasserstoff. Schwefelwasserstoff kann auch auf nicht-enzymatischem Weg aus Proteinen wie Ferredoxinen und Rieske-Proteinen synthetisiert werden. Es besteht ein anhaltendes Interesse daran, dieses Wissen über die Rolle von Schwefelwasserstoff bei der Signalübertragung durch die Entwicklung von mechanistisch verwandten therapeutischen Wirkstoffen zu nutzen. ⓘ
Es hat sich gezeigt, dass Schwefelwasserstoff an physiologischen Prozessen wie der Gefäßerweiterung bei Tieren sowie an der Steigerung der Keimung von Samen und Stressreaktionen bei Pflanzen beteiligt ist. Die Schwefelwasserstoff-Signalübertragung ist auch eng mit physiologischen Prozessen verflochten, die bekanntermaßen durch reaktive Sauerstoffspezies (ROS) und reaktive Stickstoffspezies (RNS) moderiert werden. H
2S interagiert nachweislich mit NO, was zu verschiedenen zellulären Wirkungen sowie zur Bildung eines neuen Signals namens Nitrosothiol führt. Es ist auch bekannt, dass Schwefelwasserstoff den Gehalt an Glutathion erhöht, das den ROS-Gehalt in den Zellen reduziert oder unterbricht. Das Gebiet der H2S-Biologie hat sich von der Umwelttoxikologie zur Untersuchung der Rolle von endogen produziertem H2S unter physiologischen Bedingungen und in verschiedenen pathophysiologischen Zuständen entwickelt. Nach einer aktuellen Klassifizierung lassen sich pathophysiologische Zustände mit H2S-Überproduktion (wie Krebs und Down-Syndrom) und pathophysiologische Zustände mit H2S-Mangel (z. B. Gefäßerkrankungen) unterscheiden. Obwohl sich das Verständnis der H2S-Biologie in den letzten zehn Jahren erheblich weiterentwickelt hat, bleiben viele Fragen offen, z. B. im Zusammenhang mit der Quantifizierung des endogenen H2S-Spiegels. ⓘ
Verwendungen
Schwefelwasserstoff lässt sich labormaßstabmäßig herstellen, indem man im Kippschen Apparat Salzsäure auf Eisen(II)-sulfid tropfen lässt:
- Aus Eisen(II)-sulfid und Salzsäure entsteht Eisen(II)-chlorid und Schwefelwasserstoff. ⓘ
Das so entstehende Produkt ist in der Regel durch Gase wie Wasserstoff und Luft verunreinigt. Bei Verwendung von natürlichem Eisensulfid (z. B. Pyrrhotin) kann das Produkt zusätzlich auch noch mit Spuren von Arsenwasserstoff, Monophosphan, Selenwasserstoff, Tellurwasserstoff und ähnlichem verunreinigt sein. Reiner Schwefelwasserstoff kann durch Erhitzen einer konzentrierten Magnesiumhydrogensulfid-Lösung oder aus den Elementen, aber auch aus Natriumsulfid und Phosphorsäure erhalten werden. ⓘ
In der Petrochemie (Raffinerien) fällt Schwefelwasserstoff in großen Mengen bei der Hydrodesulfurierung von Erdöl an. ⓘ
Herstellung von Schwefel, thioorganischen Verbindungen und Alkalimetallsulfiden
Die Hauptverwendung von Schwefelwasserstoff ist die Herstellung von elementarem Schwefel. Unter Verwendung von Schwefelwasserstoff werden mehrere schwefelorganische Verbindungen hergestellt. Dazu gehören Methanthiol, Ethanthiol und Thioglykolsäure. ⓘ
In Verbindung mit Alkalimetallbasen verwandelt sich Schwefelwasserstoff in Alkalihydrogensulfide wie Natriumhydrogensulfid und Natriumsulfid:
- H2S + NaOH → NaSH + H2O
- NaSH + NaOH → Na2S + H2O ⓘ
Diese Verbindungen werden in der Papierindustrie verwendet. Insbesondere brechen SH-Salze die Bindungen zwischen den Lignin- und Zellulosebestandteilen des Zellstoffs im Kraftverfahren auf. ⓘ
Reversibel verwandelt sich Natriumsulfid in Gegenwart von Säuren in Schwefelwasserstoff und Hydrosulfide; dies liefert Hydrosulfide in organischen Lösungen und wird bei der Herstellung von Thiophenol verwendet. ⓘ
Analytische Chemie
Weit über ein Jahrhundert lang war Schwefelwasserstoff in der analytischen Chemie für die qualitative anorganische Analyse von Metallionen von Bedeutung. Bei diesen Analysen werden Schwermetall- (und Nichtmetall-) Ionen (z. B. Pb(II), Cu(II), Hg(II), As(III)) aus der Lösung ausgefällt, wenn sie H
2S). Die Bestandteile des entstehenden Niederschlags lösen sich mit einer gewissen Selektivität wieder auf und werden so identifiziert. ⓘ
Vorläufer der Metallsulfide
Wie bereits erwähnt, reagieren viele Metallionen mit Schwefelwasserstoff und bilden die entsprechenden Metallsulfide. Diese Umwandlung wird vielfach genutzt. So können beispielsweise mit Schwefelwasserstoff verunreinigte Gase oder Wässer mit Metallen gereinigt werden, indem Metallsulfide gebildet werden. Bei der Reinigung von Metallerzen durch Flotation werden Mineralpulver häufig mit Schwefelwasserstoff behandelt, um die Trennung zu verbessern. Metallteile werden manchmal mit Schwefelwasserstoff passiviert. Katalysatoren, die bei der Hydrodesulfurierung verwendet werden, werden routinemäßig mit Schwefelwasserstoff aktiviert, und auch das Verhalten von Metallkatalysatoren, die in anderen Bereichen einer Raffinerie eingesetzt werden, wird durch Schwefelwasserstoff verändert. ⓘ
Verschiedene Anwendungen
Schwefelwasserstoff wird zur Abtrennung von Deuteriumoxid oder schwerem Wasser aus normalem Wasser nach dem Girdler-Sulfid-Verfahren verwendet. ⓘ
Wissenschaftler der Universität Exeter entdeckten, dass die Exposition von Zellen gegenüber geringen Mengen von Schwefelwasserstoffgas die Schädigung von Mitochondrien verhindern kann. Wenn die Zelle durch eine Krankheit gestresst ist, werden Enzyme in die Zelle gezogen, die kleine Mengen von Schwefelwasserstoff produzieren. Diese Studie könnte weitere Auswirkungen auf die Prävention von Schlaganfällen, Herzerkrankungen und Arthritis haben. ⓘ
Je nach Grad der Tonung können Münzen, die durch Schwefelwasserstoff und andere schwefelhaltige Verbindungen getönt wurden, aufgrund der Ästhetik der Tonung einen höheren numismatischen Wert haben. Münzen können auch absichtlich mit Schwefelwasserstoff behandelt werden, um eine Tonung herbeizuführen, wobei die künstliche Tonung von der natürlichen Tonung unterschieden werden kann und unter Sammlern allgemein kritisiert wird. ⓘ
Bei Nagetieren wurde mit Schwefelwasserstoff ein schlafähnlicher Zustand herbeigeführt, der zu einer Unterkühlung und einer gleichzeitigen Verringerung der Stoffwechselrate führte. Auch der Sauerstoffbedarf wurde reduziert, was vor Hypoxie schützt. Darüber hinaus hat sich gezeigt, dass Schwefelwasserstoff in verschiedenen Situationen entzündungshemmend wirkt. ⓘ
Vorkommen

Vulkane und einige heiße Quellen (wie auch kalte Quellen) emittieren etwas H
2S, das wahrscheinlich durch die Hydrolyse von Sulfidmineralen entsteht, d. h. MS + H
2O → MO + H
2S. Schwefelwasserstoff kann auf natürliche Weise in Brunnenwasser vorkommen, oft als Ergebnis der Tätigkeit von sulfatreduzierenden Bakterien. Schwefelwasserstoff wird vom menschlichen Körper in geringen Mengen durch den bakteriellen Abbau von schwefelhaltigen Proteinen im Verdauungstrakt produziert und trägt daher zu dem charakteristischen Geruch von Blähungen bei. Es wird auch im Mund produziert (Halitosis). ⓘ
Ein Teil der weltweiten H
2S-Emissionen ist auf menschliche Aktivitäten zurückzuführen. Die bei weitem größte industrielle Quelle von H
2S sind die Erdölraffinerien: Bei der Hydrodesulfurierung wird der Schwefel durch die Einwirkung von Wasserstoff aus dem Erdöl freigesetzt. Das dabei entstehende H
2S wird durch partielle Verbrennung nach dem Claus-Verfahren in elementaren Schwefel umgewandelt, der eine wichtige Quelle für elementaren Schwefel darstellt. Weitere anthropogene Quellen für Schwefelwasserstoff sind Koksöfen, Papierfabriken (nach dem Kraftverfahren), Gerbereien und die Kanalisation. H
2S entsteht praktisch überall dort, wo elementarer Schwefel mit organischem Material in Berührung kommt, insbesondere bei hohen Temperaturen. Je nach Umgebungsbedingungen ist es für die Verschlechterung von Materialien durch die Wirkung einiger schwefeloxidierender Mikroorganismen verantwortlich. Dieser Vorgang wird als biogene Sulfidkorrosion bezeichnet. ⓘ
Im Jahr 2011 wurde berichtet, dass erhöhte Konzentrationen von H
2S im Rohöl der Bakken-Formation beobachtet wurden, was möglicherweise auf die Praktiken der Ölfelder zurückzuführen ist und Herausforderungen wie "Gesundheits- und Umweltrisiken, Korrosion des Bohrlochs, zusätzliche Kosten für Materialhandhabung und Pipeline-Ausrüstung sowie zusätzliche Raffinierungsanforderungen" mit sich bringt. ⓘ
Neben dem Wohnen in der Nähe von Gas- und Ölbohrungen können auch normale Bürger in der Nähe von Abwasseraufbereitungsanlagen, Mülldeponien und landwirtschaftlichen Betrieben mit Dunglagerung Schwefelwasserstoff ausgesetzt sein. Die Exposition erfolgt durch Einatmen verunreinigter Luft oder Trinken von verunreinigtem Wasser. ⓘ
Auf Siedlungsabfalldeponien führt das Vergraben von organischem Material schnell zu einer anaeroben Gärung innerhalb der Abfallmasse, und aufgrund der feuchten Atmosphäre und der relativ hohen Temperatur, die mit dem biologischen Abbau einhergehen, entsteht Biogas, sobald die Luft innerhalb der Abfallmasse reduziert wurde. Gibt es eine Quelle für sulfathaltiges Material wie Gipskartonplatten oder Naturgips (Calciumsulfat-Dihydrat), wird dieses unter anaeroben Bedingungen von sulfatreduzierenden Bakterien in Schwefelwasserstoff umgewandelt. Diese Bakterien können an der Luft nicht überleben, aber die feuchten, warmen, anaeroben Bedingungen von vergrabenen Abfällen, die viel Kohlenstoff enthalten - in inerten Deponien können Papier und Leim, die bei der Herstellung von Produkten wie Gipskartonplatten verwendet werden, eine reichhaltige Kohlenstoffquelle darstellen - sind eine hervorragende Umgebung für die Bildung von Schwefelwasserstoff. ⓘ
In industriellen anaeroben Vergärungsprozessen, wie der Abwasserbehandlung oder der Vergärung organischer Abfälle aus der Landwirtschaft, kann Schwefelwasserstoff durch die Reduktion von Sulfat und den Abbau von Aminosäuren und Proteinen in organischen Verbindungen gebildet werden. Sulfate sind für methanbildende Bakterien relativ unbedenklich, können aber von sulfatreduzierenden Bakterien, von denen es mehrere Gattungen gibt, zu H2S reduziert werden. ⓘ
Beseitigung aus dem Wasser
Es gibt eine Reihe von Verfahren zur Entfernung von Schwefelwasserstoff aus Trinkwasser. ⓘ
- Kontinuierliche Chlorung
- Bei einem Gehalt von bis zu 75 mg/L wird Chlor im Reinigungsprozess als Oxidationschemikalie verwendet, die mit Schwefelwasserstoff reagiert. Bei dieser Reaktion entsteht unlöslicher fester Schwefel. Normalerweise wird das Chlor in Form von Natriumhypochlorit verwendet. ⓘ
- Belüftung
- Bei Schwefelwasserstoffkonzentrationen von weniger als 2 mg/l ist die Belüftung ein ideales Behandlungsverfahren. Dem Wasser wird Sauerstoff zugeführt, und durch eine Reaktion zwischen Sauerstoff und Schwefelwasserstoff entsteht geruchloses Sulfat. ⓘ
- Zugabe von Nitrat
- Kalziumnitrat kann verwendet werden, um die Bildung von Schwefelwasserstoff in Abwasserströmen zu verhindern. ⓘ
Entfernung aus Brenngasen
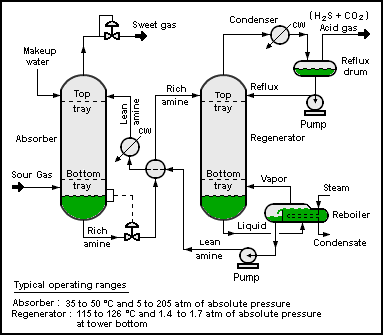
Schwefelwasserstoff ist häufig in Roh-Erdgas und Biogas enthalten. Er wird in der Regel durch Amin-Gasbehandlungstechnologien entfernt. Bei diesen Verfahren wird der Schwefelwasserstoff zunächst in ein Ammoniumsalz umgewandelt, während das Erdgas davon unbeeinflusst bleibt.
- RNH2 + H2S ⇌ RNH+
3 + SH-
Das Bisulfid-Anion wird anschließend durch Erhitzen der Amin-Sulfid-Lösung regeneriert. Der dabei entstehende Schwefelwasserstoff wird in der Regel nach dem Claus-Verfahren in elementaren Schwefel umgewandelt. ⓘ
Sicherheit
Schwefelwasserstoff ist ein hochgiftiges und entflammbares Gas (Entflammbarkeitsbereich: 4,3-46 %). Da es schwerer als Luft ist, neigt es dazu, sich in schlecht belüfteten Räumen am Boden anzusammeln. Obwohl es zunächst sehr stechend ist (es riecht wie faule Eier), tötet es schnell den Geruchssinn und führt zu einer vorübergehenden Anosmie, so dass die Opfer die Anwesenheit des Gases nicht bemerken können, bis es zu spät ist. Das Sicherheitsdatenblatt (SDS) gibt Auskunft über die sichere Handhabung. ⓘ
Toxizität
Schwefelwasserstoff ist ein Breitbandgift, d. h. es kann verschiedene Systeme im Körper vergiften, wobei das Nervensystem am stärksten betroffen ist. Die Toxizität von H
2S ist vergleichbar mit der des Kohlenmonoxids. Es bindet sich mit dem Eisen in den mitochondrialen Cytochrom-Enzymen und verhindert so die Zellatmung. Seine toxischen Eigenschaften wurden 1843 von Justus von Liebig detailliert beschrieben. ⓘ
Schwache Exposition
Da Schwefelwasserstoff natürlich im Körper, in der Umwelt und im Darm vorkommt, gibt es Enzyme, die ihn entgiften. Ab einem bestimmten Schwellenwert, von dem man annimmt, dass er im Durchschnitt bei 300-350 ppm liegt, werden die oxidativen Enzyme überwältigt. Viele Gaswarngeräte für die persönliche Sicherheit, wie z. B. diejenigen, die von Arbeitern in Versorgungsbetrieben, in der Abwasserwirtschaft und in der Petrochemie verwendet werden, sind so eingestellt, dass sie bereits bei 5 bis 10 ppm einen Alarm auslösen und bei 15 ppm auf Hochalarm schalten. Die Entgiftung erfolgt durch Oxidation zu Sulfat, das unschädlich ist. Daher können niedrige Schwefelwasserstoffkonzentrationen auf unbestimmte Zeit toleriert werden. ⓘ
Bei niedrigeren Konzentrationen kann es zu Augenreizungen, Halsschmerzen und Husten, Übelkeit, Kurzatmigkeit und Flüssigkeitsansammlung in der Lunge (Lungenödem) kommen. Man geht davon aus, dass diese Wirkungen darauf zurückzuführen sind, dass sich Schwefelwasserstoff mit dem in feuchtem Oberflächengewebe vorhandenen Alkali zu Natriumsulfid, einem ätzenden Stoff, verbindet. Diese Symptome klingen in der Regel nach ein paar Wochen ab. ⓘ
Langfristige, schwache Exposition kann zu Müdigkeit, Appetitlosigkeit, Kopfschmerzen, Reizbarkeit, Gedächtnisschwäche und Schwindelgefühl führen. Chronische Exposition gegenüber geringen Mengen H
2S (ca. 2 ppm) wurde bei russischen und finnischen Zellstoffarbeitern mit vermehrten Fehlgeburten und reproduktiven Gesundheitsproblemen in Verbindung gebracht, aber diese Berichte konnten (bis 1995) nicht bestätigt werden. ⓘ
Hochgradige Exposition
Eine kurzzeitige hohe Exposition kann zu einem sofortigen Kollaps mit Atemstillstand und einer hohen Wahrscheinlichkeit des Todes führen. Tritt der Tod nicht ein, kann eine hohe Exposition gegenüber Schwefelwasserstoff zu einer pseudolaminären Nekrose der Rinde, einer Degeneration der Basalganglien und einem Hirnödem führen. Die Atemlähmung kann sofort eintreten, sie kann aber auch bis zu 72 Stunden verzögert werden. Diagnostisch für extreme Vergiftungen durch H
2S ist die Verfärbung von Kupfermünzen in den Taschen des Opfers. ⓘ
Das Einatmen von H2S führte in den USA zu etwa 7 Todesfällen am Arbeitsplatz pro Jahr (Daten für 2011-2017), was nach Kohlenmonoxid (17 Todesfälle pro Jahr) die zweithäufigste Todesursache bei der Inhalation von Chemikalien am Arbeitsplatz ist. ⓘ
Expositionsgrenzwerte
- Von der Regierung der Vereinigten Staaten festgelegte Expositionsgrenzwerte:
- 10 ppm REL-Ceiling (NIOSH): empfohlener zulässiger Expositionsgrenzwert (der empfohlene Wert, der nicht überschritten werden darf, außer einmal für 10 Minuten in einer 8-Stunden-Schicht, wenn keine andere messbare Exposition auftritt)
- 20 ppm PEL-Ceiling (OSHA): zulässige Expositionsgrenze (der Wert, der nicht überschritten werden darf, außer einmal für 10 Minuten in einer 8-Stunden-Schicht, wenn keine andere messbare Exposition auftritt)
- 50 ppm PEL-Peak (OSHA): zulässige Spitzenbelastung (der Wert, der niemals überschritten werden darf)
- 100 ppm IDLH (NIOSH): unmittelbar lebens- und gesundheitsgefährdend (der Wert, der die Fluchtfähigkeit beeinträchtigt)
- 0,00047 ppm oder 0,47 ppb ist die Geruchsschwelle, d. h. der Punkt, an dem 50 % eines menschlichen Gremiums das Vorhandensein eines Geruchs feststellen können, ohne ihn identifizieren zu können.
- 10-20 ppm ist die Grenzkonzentration für Augenreizungen.
- 50-100 ppm führen zu Augenschäden.
- Bei 100-150 ppm wird der Geruchsnerv nach wenigen Inhalationen gelähmt, und der Geruchssinn verschwindet, oft zusammen mit dem Bewusstsein für Gefahren.
- 320-530 ppm führen zu einem Lungenödem mit der Möglichkeit des Todes.
- 530-1000 ppm bewirken eine starke Stimulation des zentralen Nervensystems und eine schnelle Atmung, die zum Atemstillstand führt.
- 800 ppm ist die tödliche Konzentration für 50 % der Menschen bei 5-minütiger Exposition (LC50).
- Konzentrationen von mehr als 1000 ppm führen zum sofortigen Kollaps mit Atemstillstand, selbst nach dem Einatmen eines einzigen Atemzuges. ⓘ
Behandlung
Die Behandlung umfasst die sofortige Inhalation von Amylnitrit, Injektionen von Natriumnitrit oder die Verabreichung von 4-Dimethylaminophenol in Kombination mit der Inhalation von reinem Sauerstoff, die Verabreichung von Bronchodilatatoren zur Überwindung eines eventuellen Bronchospasmus und in einigen Fällen die hyperbare Sauerstofftherapie (HBOT). Für die HBOT gibt es klinische und anekdotische Belege. ⓘ
Vorfälle
Schwefelwasserstoff wurde von der britischen Armee während des Ersten Weltkriegs als chemische Waffe eingesetzt. Es galt nicht als ideales Kriegsgas, wurde aber 1916, als andere Gase knapp waren, zweimal verwendet. ⓘ
Im Jahr 1975 starben neun Menschen bei der Freisetzung von Schwefelwasserstoff bei einer Ölbohrung in Denver City, Texas, was den Gesetzgeber dazu veranlasste, sich mit den tödlichen Gefahren des Gases zu befassen. Der Repräsentant des Bundesstaates, E. L. Short, war federführend bei der Befürwortung einer Untersuchung durch die texanische Eisenbahnkommission und drängte darauf, die Anwohner "notfalls durch Anklopfen an die Türen" vor der drohenden Gefahr zu warnen, die von diesem Gas ausgeht. Eine dem Gas ausgesetzte Person kann bei einem zweiten Kontakt mit dem Gas sterben, und selbst eine Warnung kann zu spät sein. ⓘ
Am 2. September 2005 führte ein Leck im Propellerraum eines in Los Angeles ankernden Kreuzfahrtschiffs der Royal Caribbean zum Tod von drei Besatzungsmitgliedern, weil eine Abwasserleitung undicht war. Infolgedessen müssen nun alle diese Räume mit einem Belüftungssystem ausgestattet sein. ⓘ
Eine Deponie mit schwefelwasserstoffhaltigem Giftmüll soll 2006 in Abidjan an der westafrikanischen Küste 17 Todesfälle und Tausende von Erkrankungen verursacht haben (Giftmülldeponie Côte d'Ivoire). ⓘ
Im September 2008 wurden in einem Pilzzuchtbetrieb in Langley, British Columbia, drei Arbeiter getötet und zwei schwer verletzt, einschließlich langfristiger Hirnschäden. Ein Ventil an einem Rohr, das Hühnermist, Stroh und Gips zum Kompostbrennstoff für die Pilzzucht transportierte, war verstopft, und als die Arbeiter das Ventil in einem engen Raum ohne ausreichende Belüftung öffneten, wurde Schwefelwasserstoff freigesetzt, der sich durch die anaerobe Zersetzung des Materials gebildet hatte, und vergiftete die Arbeiter in der Umgebung. Der Ermittler sagte, dass es mehr Todesopfer hätte geben können, wenn das Rohr vollständig geräumt worden wäre und/oder wenn der Wind seine Richtung geändert hätte. ⓘ
Im Jahr 2014 wurden in einem erst kürzlich errichteten Einkaufszentrum in Thailand, dem Siam Square One im Bereich des Siam Square, Schwefelwasserstoffwerte von bis zu 83 ppm festgestellt. Die Mieter des Einkaufszentrums berichteten über gesundheitliche Komplikationen wie Entzündungen der Nasennebenhöhlen, Atembeschwerden und Augenreizungen. Nach einer Untersuchung wurde festgestellt, dass die große Gasmenge von einer unzureichenden Abwasserbehandlung und -entsorgung in dem Gebäude herrührte. ⓘ
Im November 2014 wurde der zentrale, östliche und südöstliche Teil Moskaus von einer erheblichen Menge Schwefelwasserstoffgas eingehüllt. Die Anwohner wurden vom Katastrophenschutzministerium aufgefordert, in den Häusern zu bleiben. Obwohl die genaue Quelle des Gases nicht bekannt war, wurde eine Moskauer Ölraffinerie dafür verantwortlich gemacht. ⓘ
Im Juni 2016 wurden eine Mutter und ihre Tochter in ihrem noch fahrenden Porsche Cayenne Geländewagen aus dem Jahr 2006 an einer Leitplanke auf dem Florida Turnpike tot aufgefunden; zunächst wurde angenommen, dass sie Opfer einer Kohlenmonoxidvergiftung geworden waren. Ihr Tod blieb ungeklärt, da der Gerichtsmediziner auf die Ergebnisse der toxikologischen Untersuchungen der Opfer wartete, bis Urintests ergaben, dass Schwefelwasserstoff die Todesursache war. Ein Bericht des Orange-Osceola Medical Examiner's Office wies darauf hin, dass die giftigen Dämpfe aus der Starterbatterie des Porsche kamen, die sich unter dem Beifahrersitz befand. ⓘ
Im Januar 2017 starben drei Arbeiter eines Versorgungsunternehmens in Key Largo, Florida, einer nach dem anderen innerhalb von Sekunden, nachdem sie in einen engen Raum unter einem Gullydeckel hinabgestiegen waren, um einen Abschnitt einer gepflasterten Straße zu überprüfen. Bei dem Versuch, die Männer zu retten, brach ein Feuerwehrmann, der ohne seine Atemluftflasche in das Loch einstieg (weil er mit dieser nicht durch das Loch passte), innerhalb von Sekunden zusammen und musste von einem Kollegen gerettet werden. Der Feuerwehrmann wurde mit dem Flugzeug ins Jackson Memorial Hospital geflogen und erholte sich später. Ein Beamter des Sheriffs von Monroe County stellte zunächst fest, dass der Raum Schwefelwasserstoff und Methangas enthielt, die durch die Zersetzung der Vegetation entstanden waren. ⓘ
Am 24. Mai 2018 wurden in einer Papierfabrik von Norske Skog in Albury, New South Wales, zwei Arbeiter getötet, ein weiterer schwer verletzt und 14 weitere durch Einatmen von Schwefelwasserstoff ins Krankenhaus eingeliefert. Eine Untersuchung von SafeWork NSW ergab, dass das Gas aus einem Tank freigesetzt wurde, der zur Aufbewahrung von Prozesswasser diente. Die Arbeiter waren dem Gas am Ende einer dreitägigen Wartungsphase ausgesetzt. Schwefelwasserstoff hatte sich in einem vorgelagerten Tank angesammelt, der während der Wartungsarbeiten stagnierte und nicht mit Biozid behandelt worden war. Unter diesen Bedingungen konnten sich in dem vorgelagerten Tank sulfatreduzierende Bakterien ansiedeln, da das Wasser geringe Mengen an Zellstoff und Holzfasern enthielt. Die hohe Pumprate aus diesem Tank in den Tank, in dem sich der Vorfall ereignete, führte dazu, dass Schwefelwasserstoffgas aus verschiedenen Öffnungen im oberen Bereich des Tanks austrat, als der Pumpbetrieb am Ende der Wartungsperiode wieder aufgenommen wurde. Der Bereich darüber war ausreichend umschlossen, so dass sich das Gas dort ansammeln konnte, obwohl er von Norske Skog nicht als geschlossener Raum ausgewiesen war. Einer der getöteten Arbeiter war bei der Untersuchung eines offensichtlichen Flüssigkeitslecks in dem Tank exponiert, während der andere getötete und der schwer verletzte Arbeiter versuchten, den ersten zu retten, nachdem er auf dem Tank zusammengebrochen war. In einem daraufhin eingeleiteten Strafverfahren wurde Norske Skog vorgeworfen, die Gesundheit und Sicherheit seiner Mitarbeiter in der Anlage nicht in einem angemessenen Umfang gewährleistet zu haben. Das Unternehmen bekannte sich schuldig und wurde zu einer Geldstrafe in Höhe von AU$ 1.012.500 verurteilt und angewiesen, die Produktion eines anonymisierten Lehrvideos über den Vorfall zu finanzieren. ⓘ
Im Oktober 2019 kamen ein Angestellter der Aghorn Operating Inc. in Odessa, Texas, und seine Frau durch einen Ausfall einer Wasserpumpe ums Leben. Aus der Pumpe trat Förderwasser mit einer hohen Konzentration von Schwefelwasserstoff aus. Der Arbeiter starb, als er auf einen automatischen Telefonanruf reagierte, mit dem er auf ein mechanisches Versagen der Pumpe aufmerksam gemacht worden war, während seine Frau starb, nachdem sie zur Anlage gefahren war, um nach ihm zu sehen. In einer Untersuchung des CSB wurden laxe Sicherheitspraktiken in der Anlage festgestellt, wie etwa ein inoffizielles Lockout-Tagout-Verfahren und ein nicht funktionierendes Schwefelwasserstoff-Warnsystem. ⓘ
Selbstmorde
Das Gas, das durch Mischen bestimmter Haushaltszutaten hergestellt wird, wurde 2008 in Japan bei einer Selbstmordwelle verwendet. Die Welle veranlasste die Mitarbeiter des Tokioter Zentrums für Suizidprävention dazu, während der "Goldenen Woche" eine spezielle Hotline einzurichten, da die Zahl der Anrufe von Menschen, die sich während des jährlichen Maifeiertags umbringen wollten, zunahm. ⓘ
Seit 2010 ist dieses Phänomen in einer Reihe von US-Städten aufgetreten und hat dazu geführt, dass diejenigen gewarnt wurden, die am Ort des Selbstmordes eintrafen. Diese Ersthelfer, wie z. B. Mitarbeiter von Rettungsdiensten oder Familienangehörige, laufen Gefahr, durch das Einatmen des Gases oder durch Feuer getötet oder verletzt zu werden. Auch die lokalen Behörden haben Kampagnen zur Verhinderung solcher Selbstmorde gestartet. ⓘ
Im Jahr 2020 wurde das Einatmen von H2S von der japanischen Profi-Ringerin Hana Kimura als Selbstmordmethode eingesetzt. ⓘ
Schwefelwasserstoff in der natürlichen Umwelt
Mikrobiell: Der Schwefelkreislauf

Schwefelwasserstoff ist ein zentraler Teilnehmer am Schwefelkreislauf, dem biogeochemischen Kreislauf des Schwefels auf der Erde. ⓘ
In Abwesenheit von Sauerstoff gewinnen schwefelreduzierende und sulfatreduzierende Bakterien ihre Energie aus der Oxidation von Wasserstoff oder organischen Molekülen, indem sie elementaren Schwefel oder Sulfat zu Schwefelwasserstoff reduzieren. Andere Bakterien setzen Schwefelwasserstoff aus schwefelhaltigen Aminosäuren frei; dies führt zu dem Geruch von faulen Eiern und trägt zum Geruch von Blähungen bei. ⓘ
Wenn organisches Material unter sauerstoffarmen (oder hypoxischen) Bedingungen zerfällt (wie in Sümpfen, eutrophen Seen oder toten Zonen der Ozeane), nutzen sulfatreduzierende Bakterien die im Wasser vorhandenen Sulfate, um das organische Material zu oxidieren, wobei Schwefelwasserstoff als Abfallprodukt entsteht. Ein Teil des Schwefelwasserstoffs reagiert mit Metallionen im Wasser und bildet Metallsulfide, die nicht wasserlöslich sind. Diese Metallsulfide, wie z. B. das Eisen(II)-sulfid FeS, sind oft schwarz oder braun, was zu der dunklen Farbe des Schlamms führt. ⓘ
Mehrere Bakteriengruppen können Schwefelwasserstoff als Brennstoff verwenden und ihn zu elementarem Schwefel oder zu Sulfat oxidieren, indem sie gelösten Sauerstoff, Metalloxide (z. B. Eisenoxydhydroxide und Manganoxide) oder Nitrat als Elektronenakzeptoren verwenden. ⓘ
Die Purpurschwefelbakterien und die grünen Schwefelbakterien verwenden Schwefelwasserstoff als Elektronendonator in der Photosynthese und produzieren so elementaren Schwefel. Diese Art der Photosynthese ist älter als die von Cyanobakterien, Algen und Pflanzen, die Wasser als Elektronendonator verwenden und Sauerstoff freisetzen. ⓘ
Die Biochemie des Schwefelwasserstoffs ist ein wichtiger Bestandteil der Chemie der Eisen-Schwefel-Welt. In diesem Modell der Entstehung des Lebens auf der Erde wird geologisch erzeugter Schwefelwasserstoff als Elektronendonor postuliert, der die Reduktion von Kohlendioxid antreibt. ⓘ
Tiere
Schwefelwasserstoff ist für die meisten Tiere tödlich, aber einige hochspezialisierte Arten (Extremophile) gedeihen in Lebensräumen, die reich an dieser Verbindung sind. ⓘ
In der Tiefsee beherbergen hydrothermale Schlote und kalte Quellen mit hohem Schwefelwasserstoffgehalt eine Reihe hochspezialisierter Lebensformen, die von Bakterien bis zu Fischen reichen. Da in diesen Tiefen kein Sonnenlicht vorhanden ist, beruhen diese Ökosysteme auf Chemosynthese und nicht auf Photosynthese. ⓘ
Schwefelwasserstoffreiche Süßwasserquellen beherbergen vor allem wirbellose Tiere, aber auch eine kleine Anzahl von Fischen: Cyprinodon bobmilleri (ein Puppenfisch aus Mexiko), Limia sulphurophila (ein Pökelfisch aus der Dominikanischen Republik), Gambusia eurystoma (ein Pökelfisch aus Mexiko) und einige Poecilia (Pökelfische aus Mexiko). Wirbellose Tiere und Mikroorganismen in einigen Höhlensystemen, wie z. B. der Movile-Höhle, sind an hohe Schwefelwasserstoffkonzentrationen angepasst. ⓘ
Interstellares und planetarisches Vorkommen
Schwefelwasserstoff ist häufig im interstellaren Medium nachgewiesen worden. Er kommt auch in den Wolken der Planeten unseres Sonnensystems vor. ⓘ
Massenaussterben

Schwefelwasserstoff wird mit mehreren Massenaussterben in der Erdgeschichte in Verbindung gebracht. Insbesondere könnte eine Anhäufung von Schwefelwasserstoff in der Atmosphäre das permischtriassische Massenaussterben vor 252 Millionen Jahren verursacht oder zumindest dazu beigetragen haben. ⓘ
Organische Rückstände von diesen Aussterbegrenzen deuten darauf hin, dass die Ozeane anoxisch (sauerstoffarm) waren und Arten von oberflächennahem Plankton aufwiesen, die H
2S. Die Bildung von H
2S könnte durch massive Vulkanausbrüche ausgelöst worden sein, bei denen Kohlendioxid und Methan in die Atmosphäre gelangten, was die Ozeane erwärmte und ihre Fähigkeit zur Aufnahme von Sauerstoff verringerte, der ansonsten H
2S. Der erhöhte Schwefelwasserstoffgehalt könnte sauerstoffproduzierende Pflanzen abgetötet und die Ozonschicht abgebaut haben, was eine weitere Belastung darstellt. Kleine H
2S-Blüten wurden in der Neuzeit im Toten Meer und im Atlantik vor der Küste Namibias festgestellt. ⓘ
Siehe auch
- Chalkogenid-Wasserstoff
- Chemosynthese von Schwefelwasserstoff
- Jenkem
- Klärgas
- Gezieltes Temperaturmanagement, auch bekannt als induzierte Hypothermie
- Sumpfgas ⓘ
Zusätzliche Ressourcen
- Ausschuss für medizinische und biologische Auswirkungen von Umweltschadstoffen (1979). Hydrogen Sulfide (Schwefelwasserstoff). Baltimore: University Park Press. ISBN 978-0-8391-0127-7.
- Siefers, Andrea (2010). Eine neuartige und kosteneffiziente Technologie zur Beseitigung von Schwefelwasserstoff unter Verwendung von Gummipartikeln aus Reifen (MS-Arbeit). Iowa State University. Abgerufen am 8. Februar 2013. ⓘ
Vorkommen
In der Natur kommt Schwefelwasserstoff als sehr variabler Bestandteil (von Spuren bis zu 80 Vol-%) in Erdgas, als vulkanisches Gas und in Quellwasser gelöst vor. Er entsteht außerdem beim Abbau von Biomasse durch Fäulnis bzw. Verwesung (z. B. Tierkadaver, Leichen, Zersetzung der Laubstreu, Faulschlammbildung am Grund eutropher Seen usw.) oder bei Verdauungsvorgängen im Darm, den er mit dem Flatus verlässt. Der bei solchem Biomasseabbau entstehende Schwefelwasserstoff in Mülldeponien, Güllegruben, Abwasserhochdruckleitungen oder anderen technischen Einrichtungen verursacht in der Folge Schäden in Milliardenhöhe an Betonbauwerken (biogene Schwefelsäurekorrosion). Ein Verursacher des unangenehmen Mundgeruchs beim Menschen ist – neben anderen flüchtigen schwefelhaltigen organischen Verbindungen (Methanthiol, Dimethylsulfid) – Schwefelwasserstoff. ⓘ
Verwendung
Großchemie
Schwefelwasserstoff ist die Hauptquelle für elementaren Schwefel, welcher wiederum zu über 80 Prozent zu Schwefelsäure umgesetzt wird. Dazu wird zunächst ein Teil des Schwefelwasserstoffs zu Schwefeldioxid verbrannt:
Ein Teil des übrigen Schwefelwasserstoffs reagiert mit dem entstandenen Schwefeldioxid unter Komproportionierung zu elementarem Schwefel:
Chemische Analytik
Im klassischen Kationentrennungsgang wird H2S zum Ausfällen einer ganzen Gruppe benutzt (Schwefelwasserstoffgruppe). Durch Einleiten von H2S-Gas in schwach saure Lösungen fallen aus: As2S3, SnS2, Sb2S3, HgS, SnS, PbS, Bi2S3, CuS und bei Verdünnen mit Wasser auch CdS. Diese Kationen sind dann weiter aufzutrennen und mithilfe von Nachweisreaktionen zu identifizieren. ⓘ
Wegen seiner Giftigkeit wird im Kationen-Trennungsgang zunehmend auf Schwefelwasserstoff verzichtet. Stattdessen werden die benötigten Hydrogensulfid-Anionen in situ erzeugt, zum Beispiel durch Hydrolyse von Thioacetamid, in kleineren Mengen auch durch Erhitzen von Schwefel mit Kerzenwachs. ⓘ
H2S-Gang: Dieses Verfahren baut auf dem klassischen Trennungsgang auf. Durch spezifische Reagenzien werden chemisch ähnliche Kationen gruppenweise zur Fällung gebracht. Der Niederschlag wird in weiterer Folge aufgetrennt und analysiert, mit dem Überstand (der Lösung) wird weitergearbeitet und daraus die nächste Gruppe zur Fällung gebracht. ⓘ
Toxikologie
Langzeitwirkung
Tierversuche zeigen, dass Schweine, die mit schwefelwasserstoffhaltigen Nahrungsmitteln gefüttert wurden, nach einigen Tagen an Diarrhoe leiden und einen Gewichtsverlust nach etwa 105 Tagen zeigen. ⓘ
Physiologie
Metabolismus


Schwefelwasserstoff entsteht im Körper kurzfristig beim Abbau eines Überschusses von Cystein mittels der Cystathionin-γ-Lyase (EC 4.4.1.1), die normalerweise Cystathionin zu Cystein abbaut, jedoch auch Cystein weiter abbauen kann:
In Ratten wurde eine weitere Reaktion desselben Enzyms nachgewiesen, die von Cystin ausgeht, beim Menschen aber keine Rolle spielt:
Das Gas verbindet sich schnell mit Thiolresten von in der Umgebung befindlichen Proteinen (-Cys wird zu -CySSH) und verändert dadurch deren biologische Aktivität. Insbesondere das Enzym Cytochrom-c-Oxidase wird dadurch deaktiviert. Der Großteil wird jedoch in den Mitochondrien über Thiosulfat und Sulfit zu Sulfat oxidiert, oder über Cysteinsulfinat zu Sulfit/Sulfat oder Taurin prozessiert. ⓘ
Oxidation zu Sulfat
Mitochondrien schützen sich vor H2S beziehungsweise HS− durch dessen Oxidation zu Sulfat, die in drei Schritten stattfindet:
Zunächst wird H2S durch einen Enzymkomplex zu Thiosulfat oxidiert. Im Detail finden drei Einzelreaktionen statt, die durch die Enzyme Sulfid:Chinon-Oxidoreduktase (EC 1.8.5.-), Schwefeldioxygenase (EC 1.13.11.18) und Rhodanase katalysiert werden. ⓘ
Ein Teil der Oxidation von Thiosulfat zu Sulfit geschieht mithilfe von Glutathion und dem Enzym Thiosulfatreduktase (EC 2.8.1.3), ein anderer Teil nutzt die Thiosulfat-Schwefeltransferase. ⓘ
Zuletzt oxidiert die Sulfitoxidase Sulfit zu Sulfat. Eine Bestätigung des Abbauwegs ergab sich durch die Identifikation der mitochondrialen Schwefeldioxygenase mit dem ETHE1-Gen, das bei einer seltenen Mutation zu einer Erbkrankheit mit Schädigungen durch erhöhte H2S-Konzentrationen führt. ⓘ
Funktion

Schwefelwasserstoff wirkt im Körper ähnlich wie Stickstoffmonoxid als Botenstoff (siehe Gasotransmitter) und erweitert Blutgefäße (vasodilatativ). Es wird in Endothelzellen der Blutgefäße als auch in glatten Muskelzellen aus der Aminosäure L-Cystein gebildet. Wird Gefäßendothel über Muskarinische Acetylcholinrezeptoren stimuliert, wird H2S freigesetzt. Dies aktiviert in glatten Muskelzellen der Gefäßmuskulatur spannungsaktivierte und kalziumaktivierte Kaliumkanäle. Dadurch kommt es zur Hyperpolarisation glatter Muskelzellen und letztlich zur Erweiterung der Blutgefäße (Vasodilatation). ⓘ
Anwendung
Schwefelwasserstoff könnte möglicherweise als Mittel gegen Erektionsstörungen Anwendung finden. Es wird natürlich in den Schwellkörpern des Penis und der glatten Muskulatur der Penis-Arterie gebildet. Versuche zeigten, dass sowohl L-Cystein als auch Schwefelwasserstoff(-Salz) extern zugeführt eine konzentrationsabhängige Erektion in den Penisschwellkörpern (Corpora cavernosa penis) verursachen. ⓘ
In niedriger Konzentrationen bremst Schwefelwasserstoff bei Mäusen Stoffwechselvorgänge und senkt die Körpertemperatur ab. Der winterschlafähnliche Zustand ist voll reversibel und für die Tiere unschädlich. Untersucht wird daher, ob man damit bei Transplantationen die Qualität und Überlebenszeit von zur Transplantation vorgesehenen Organen steigern kann. Auch wird in Humanstudien geprüft, ob Schwefelwasserstoff die Überlebenswahrscheinlichkeit von Notfallpatienten verbessern, um durch Inhalation bzw. Injektion von H2S den Stoffwechsel zu verlangsamen und den Sauerstoffbedarf zu reduzieren. Im Idealfall könnte dies der Rettungsdienst präklinisch vornehmen. ⓘ
Gemäß einer Studie von 2007 an der University of Alabama at Birmingham, die im Fachblatt Proceedings of the National Academy of Sciences erschien, verursacht Schwefelwasserstoff sehr gering dosiert vermutlich die gesundheitliche Wirkung von Knoblauch, da Knoblauch Risiken für Herzerkrankungen durch Bluthochdruck, erhöhte Blutfette und andere Faktoren senkt. In Bevölkerungsgruppen, die viel Knoblauch verzehren, gebe es weniger Probleme mit zu hohem Blutdruck. ⓘ
Analytik
Sowohl die Toxizität als auch seine biologische Relevanz stellen hohe Anforderungen an die Analytik von Schwefelwasserstoff. Im Gegensatz zur oben erwähnten Verwendung von H2S im anorganischen Trennungsgang werden hier instrumentelle, quantitative Nachweisverfahren für H2S vorgestellt. ⓘ
Instrumentelle Analytik
Optische Bestimmung
Die am häufigsten verwendete chromogene Reaktion für den photometrischen Nachweis von H2S und Sulfiden ist die Reaktion mit N',N-Dimethyl-p-phenylendiamin zum Methylenblau. Dabei werden Eisen(III)-Salze als Katalysator verwendet. Das Reaktionsprodukt weist ein Absorptionsmaximum bei 670 Nanometer auf und kann photometrisch bestimmt werden. ⓘ
Elektroanalytik
Amperometrie ⓘ
Weit verbreitet sind amperometrische H2S-Sensoren. Bei der Amperometrie wird an eine Arbeitselektrode ein Potential angelegt und der resultierende Strom gemessen; dieser ist proportional zur Konzentration des H2S. Schwefelwasserstoff wird dabei zum Sulfat oxidiert. Mit Kohlenstoffnanoröhren modifizierte Elektroden erzielten bei einem Oxidationspotential von 100 mV eine Nachweisgrenze von 0,3 µmol/l. Die Bauart der verwendeten Elektroden ist eng verwandt mit der der Clark-Elektrode zur Sauerstoffbestimmung. ⓘ
Potentiometrie ⓘ
Für die Sensorik von gasförmigem H2S wurden auch potentiometrische Sonden entwickelt. Als Beispiel können Feststoffelektrolyt-basierte, galvanische Halbzellen genannt werden, die zusammen mit H2S eine elektromotorische Kraft liefern, die gemessen wird. Mit Yttriumoxid-stabilisierten Zirkoniumröhren als Sensor konnten H2S-Konzentrationen in Luft bis 0,2 ppm mit zuverlässiger Reproduzierbarkeit gemessen werden. Unter Verwendung von Hexacyanoferrat als Redoxpartner konnten sogar 30 ppb H2S nachgewiesen werden. ⓘ
Gaschromatographie
Für die Analytik von gasförmigen Substanzen ist häufig die Gaschromatographie die erste Wahl. Nach erfolgter Trennung können Schwefelverbindungen wie H2S flammenphotometrisch bei einer Emissionswellenlänge von 397 Nanometer detektiert werden. Ein Verfahren zum schnellen Spurennachweis von Schwefelwasserstoff in Kohlegas erzielte eine Nachweisgrenze von 10 ppb. ⓘ