Schwefelhexafluorid
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Schwefelhexafluorid
| |||
| Systematische IUPAC-Bezeichnung
Hexafluor-λ6-sulfan | |||
| Andere Bezeichnungen
Elagas
Esaflon | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
2752 | ||
| KEGG | |||
| MeSH | Schwefel+Hexafluorid | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1080 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
SF6 | ||
| Molekulare Masse | 146,06 g/mol | ||
| Erscheinungsbild | Farbloses Gas | ||
| Geruch | geruchlos | ||
| Dichte | 6,17 g/L | ||
| Schmelzpunkt | -64 °C; -83 °F; 209 K | ||
| Siedepunkt | -50,8 °C (-59,4 °F; 222,3 K) | ||
| Kritischer Punkt (T, P) | 45,51±0,1 °C, 3,749±0,01 MPa | ||
Löslichkeit in Wasser
|
0.003% (25 °C) | ||
| Löslichkeit | schwer löslich in Wasser, gut löslich in Ethanol, Hexan, Benzol | ||
| Dampfdruck | 2,9 MPa (bei 21,1 °C) | ||
Magnetische Suszeptibilität (χ)
|
-44,0×10-6 cm3/mol | ||
| Wärmeleitfähigkeit |
| ||
| Viskosität | 15,23 μPa-s | ||
| Struktur | |||
Kristallstruktur
|
Orthorhombisch, oP28 | ||
Raumgruppe
|
Oh | ||
Koordinationsgeometrie
|
Orthogonal hexagonal | ||
Molekulare Form
|
Oktaedrisch | ||
Dipolmoment
|
0 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
0,097 kJ/(mol-K) (konstanter Druck) | ||
Std. molare
Entropie (S |
292 J-mol-1-K-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-1209 kJ-mol-1 | ||
| Pharmakologie | |||
ATC-Code
|
V08DA05 (WHO) | ||
| Zulassungsdaten |
| ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|

| ||
Signalwort
|
Warnhinweis | ||
Gefahrenhinweise
|
H280 | ||
Sicherheitshinweise
|
P403 | ||
| NFPA 704 (Feuerdiamant) | |||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 1000 ppm (6000 mg/m3) | ||
REL (Empfohlen)
|
TWA 1000 ppm (6000 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
N.B.. | ||
| Sicherheitsdatenblatt (SDS) | Externes SDB | ||
| Verwandte Verbindungen | |||
Verwandte Schwefelfluoride
|
Disulfur-Decafluorid Schwefeltetrafluorid | ||
Verwandte Verbindungen
|
Selenhexafluorid Sulfurylfluorid | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Schwefelhexafluorid (SF6) oder Schwefelhexafluorid (britische Schreibweise) ist ein extrem starkes und langlebiges Treibhausgas, das hauptsächlich als elektrischer Isolator und Lichtbogenunterdrücker verwendet wird. Es ist anorganisch, farblos, geruchlos, nicht entflammbar und ungiftig. SF
6 hat eine oktaedrische Geometrie, bestehend aus sechs Fluoratomen, die an ein zentrales Schwefelatom gebunden sind. Es ist ein hypervalentes Molekül. ⓘ
Typisch für ein unpolares Gas, ist SF
6 schlecht in Wasser, aber gut in unpolaren organischen Lösungsmitteln löslich. Es hat eine Dichte von 6,12 g/L auf Meereshöhe und liegt damit deutlich über der Dichte von Luft (1,225 g/L). Es wird im Allgemeinen als verflüssigtes Druckgas transportiert. ⓘ
Die Konzentration von SF
6 in der Troposphäre der Erde erreichte im Jahr 2021 10,63 Teile pro Billion (ppt) und stieg um 0,36 ppt/Jahr an. Der Anstieg in den letzten 40 Jahren wurde größtenteils durch den expandierenden Elektrizitätssektor verursacht, einschließlich der flüchtigen Emissionen von SF
6-Gas, das in den Mittel- und Hochspannungsschaltanlagen enthalten ist. Die Verwendung in der Magnesium-, Aluminium- und Elektronikindustrie beschleunigte ebenfalls das Wachstum der Atmosphäre. ⓘ
Schwefelhexafluorid ist eine anorganische chemische Verbindung aus den Elementen Schwefel und Fluor mit der Summenformel SF6. Es ist unter Normalbedingungen ein farb- und geruchloses, ungiftiges und nicht brennbares Gas, das sich, ähnlich wie Stickstoff, äußerst reaktionsträge verhält. Bei Normaldruck und einer Temperatur von −63,8 °C geht Schwefelhexafluorid durch Sublimation direkt vom festen in den gasförmigen Zustand über. ⓘ
Synthese und Reaktionen
Schwefelhexafluorid kommt auf der Erde in erster Linie als vom Menschen erzeugtes Industriegas vor, wurde aber auch in der Natur gefunden. ⓘ
SF
6 kann aus den Elementen hergestellt werden, indem man S
8 mit F
2. Diese Methode wurde auch von den Entdeckern Henri Moissan und Paul Lebeau im Jahr 1901 angewandt. Es entstehen auch einige andere Schwefelfluoride, die jedoch durch Erhitzen des Gemischs entfernt werden, um die S
2F
10 (das hochgiftig ist) zu disproportionieren und dann das Produkt mit NaOH zu waschen, um die restlichen SF
4. ⓘ
Alternativ kann Schwefelhexafluorid unter Verwendung von Brom aus SF4 und CoF3 bei niedrigeren Temperaturen (z. B. 100 °C) wie folgt synthetisiert werden:
Es gibt praktisch keine chemische Reaktion für SF
6. Ein Hauptgrund für die Inertheit von SF6 ist die sterische Hinderung des Schwefelatoms, wohingegen seine schwereren Pendants der Gruppe 16, wie z. B. SeF6, aufgrund der geringeren sterischen Hinderung reaktiver sind als SF6 (siehe Hydrolysebeispiel). Es reagiert nicht mit geschmolzenem Natrium unterhalb seines Siedepunktes, reagiert jedoch exotherm mit Lithium. ⓘ
Anwendungen
Etwa 80 % des im Jahr 2000 produzierten Schwefelhexafluorids wurde in der Elektroenergieindustrie verwendet, hauptsächlich als gasförmiges Dielektrikum. Weitere wichtige Verwendungszwecke waren 2015 ein Silizium-Ätzmittel für die Halbleiterherstellung und ein Inertgas für das Gießen von Magnesium. ⓘ
Dielektrisches Medium
SF
6 wird in der Elektroindustrie als gasförmiges Dielektrikum für Hochspannungs-Leistungsschalter, Schaltanlagen und andere elektrische Geräte verwendet und ersetzt häufig ölgefüllte Leistungsschalter, die schädliche polychlorierte Biphenyle (PCB) enthalten können. SF
6-Gas unter Druck wird als Isolator in gasisolierten Schaltanlagen (GIS) verwendet, da es eine viel höhere Durchschlagsfestigkeit als Luft oder trockener Stickstoff aufweist. Die hohe Durchschlagfestigkeit ist das Ergebnis der hohen Elektronegativität und Dichte des Gases. Diese Eigenschaft ermöglicht es, die Größe elektrischer Geräte erheblich zu reduzieren. Dadurch eignet sich GIS besser für bestimmte Zwecke, z. B. für die Aufstellung in Innenräumen, im Gegensatz zu luftisolierten elektrischen Anlagen, die wesentlich mehr Platz beanspruchen. ⓘ
Gasisolierte elektrische Anlagen sind außerdem widerstandsfähiger gegen Umweltverschmutzung und Klimaeinflüsse und aufgrund ihrer kontrollierten Betriebsumgebung langfristig zuverlässiger im Betrieb. Die Einwirkung eines Lichtbogens führt zu einer chemischen Zersetzung von SF
6 chemisch auf, obwohl die meisten der Zersetzungsprodukte dazu neigen, sich schnell wieder zu SF
6 zu bilden, ein Prozess, der als "Selbstheilung" bezeichnet wird. Ein Lichtbogen oder eine Korona kann Disulfurdekafluorid (S
2F
10), ein hochgiftiges Gas, dessen Toxizität mit der von Phosgen vergleichbar ist. S
2F
10 wurde im Zweiten Weltkrieg als potenzieller chemischer Kampfstoff betrachtet, da es weder Tränenfluss noch Hautreizungen hervorruft und somit kaum eine Warnung vor einer Exposition auslöst. ⓘ
SF
6 wird auch häufig als Hochspannungsdielektrikum in den Hochspannungsversorgungen von Teilchenbeschleunigern, wie Van-de-Graaff-Generatoren und Pelletrons, sowie in Hochspannungs-Transmissionselektronenmikroskopen verwendet. ⓘ
Alternativen zu SF
6 als dielektrisches Gas sind mehrere Fluoroketone. Die kompakte GIS-Technologie, die Vakuumschaltung mit Reinluftisolierung kombiniert, wurde für eine Teilmenge von Anwendungen bis 420 kV eingeführt. ⓘ
Medizinische Anwendung
SF
6 wird zur Tamponade oder zum Stopfen eines Netzhautlochs bei der Reparatur von Netzhautablösungen in Form einer Gasblase verwendet. Es ist im Glaskörperraum inert und verdoppelt zunächst sein Volumen innerhalb von 36 Stunden, bevor es innerhalb von 10-14 Tagen vom Blut absorbiert wird. ⓘ
SF
6 wird als Kontrastmittel für die Ultraschalluntersuchung verwendet. Schwefelhexafluorid-Mikrobläschen werden in Lösung durch Injektion in eine periphere Vene verabreicht. Diese Mikrobläschen verbessern die Sichtbarkeit der Blutgefäße im Ultraschall. Diese Anwendung wurde zur Untersuchung der Gefäßstruktur von Tumoren eingesetzt. Die Mikrobläschen bleiben 3 bis 8 Minuten lang im Blut sichtbar und werden dann über die Lunge ausgeatmet. ⓘ
Tracer-Verbindung
Schwefelhexafluorid war das Tracergas, das bei der ersten Kalibrierung eines Luftausbreitungsmodells für Straßen verwendet wurde. Dieses Forschungsprogramm wurde von der US-Umweltschutzbehörde gesponsert und in Sunnyvale, Kalifornien, am US Highway 101 durchgeführt. Gasförmiges SF
6 wird als Tracergas in Kurzzeitexperimenten zur Untersuchung der Belüftungseffizienz in Gebäuden und Innenräumen sowie zur Bestimmung von Infiltrationsraten verwendet. Zwei wichtige Faktoren sprechen für seine Verwendung: Seine Konzentration kann mit zufriedenstellender Genauigkeit bei sehr niedrigen Konzentrationen gemessen werden, und die Erdatmosphäre hat eine vernachlässigbare Konzentration von SF
6. ⓘ
Schwefelhexafluorid wurde am 25. März 2007 in einem Experiment in der Londoner U-Bahn-Station St. John's Wood im Vereinigten Königreich als ungiftiges Testgas verwendet. Das Gas wurde in der gesamten U-Bahn-Station freigesetzt und bei seiner Ausbreitung überwacht. Zweck des Experiments, das Anfang März vom Verkehrsminister Douglas Alexander angekündigt worden war, war es, zu untersuchen, wie sich giftiges Gas bei einem Terroranschlag in den Stationen und Gebäuden der Londoner U-Bahn verbreiten könnte. ⓘ
Schwefelhexafluorid wird auch routinemäßig als Tracergas in Laborabzugstests verwendet. Das Gas wird in der letzten Phase der Qualifizierung von Laborabzügen nach ASHRAE 110 verwendet. Innerhalb des Abzugs wird eine Gasfahne erzeugt und eine Reihe von Tests durchgeführt, während ein außerhalb des Abzugs angeordneter Gasanalysator Proben von SF6 nimmt, um die Einschlusseigenschaften des Abzugs zu überprüfen. ⓘ
Es wurde erfolgreich als Tracer in der Ozeanographie eingesetzt, um die diapyknische Durchmischung und den Gasaustausch zwischen Luft und Meer zu untersuchen. ⓘ
Andere Verwendungen
- Die Magnesiumindustrie verwendet SF
6 als inertes "Schutzgas", um die Oxidation beim Gießen zu verhindern. Einst der größte Verbraucher, ist der Verbrauch durch Auffangen und Recycling stark zurückgegangen. - In Isolierglasfenstern wird es als Füllstoff verwendet, um die Wärme- und Schalldämmung zu verbessern.
- SF
6 Plasma wird in der Halbleiterindustrie als Ätzmittel in Verfahren wie dem reaktiven Ionen-Tiefenätzen verwendet. Ein kleiner Teil des SF
6 zerfällt im Plasma in Schwefel und Fluor, wobei die Fluor-Ionen eine chemische Reaktion mit Silizium eingehen. - Die Fluor-Ionen führen eine chemische Reaktion mit Silizium durch. Bei Reifen, die damit gefüllt sind, dauert es aufgrund der größeren Molekülgröße länger, bis die Luft durch Diffusion durch den Gummi entweicht.
- Nike verwendete es ebenfalls zur Erlangung eines Patents und zur Füllung der Kissen in allen Schuhen der Marke "Air" von 1992 bis 2006. Auf dem Höhepunkt im Jahr 1997 wurden 277 Tonnen verwendet.
- Das geschlossene Rankine-Kreislauf-Antriebssystem des Torpedos Mark 50 der US-Marine wird durch Schwefelhexafluorid in einer exothermen Reaktion mit festem Lithium angetrieben.
- Wellenleiter in Hochleistungs-Mikrowellensystemen werden mit diesem Gas unter Druck gesetzt. Das Gas isoliert den Hohlleiter elektrisch und verhindert so interne Lichtbögen.
- In elektrostatischen Lautsprechern wird es wegen seiner hohen Durchschlagsfestigkeit und seines hohen Molekulargewichts verwendet.
- Zur Herstellung der chemischen Waffe Disulfurdekafluorid wird es als Ausgangsstoff verwendet.
- Zu Unterhaltungszwecken bewirkt das Einatmen von SF
6 beim Einatmen eine deutlich tiefere Stimme, da seine Dichte viel höher ist als die von Luft, wie in diesem Video zu sehen ist. Dies ist verwandt mit dem bekannteren Effekt des Einatmens von Helium mit geringer Dichte, das die Stimme einer Person viel höher werden lässt. Beide Effekte sollten nur mit Vorsicht ausprobiert werden, da diese Gase den Sauerstoff verdrängen, den die Lunge aus der Luft zu gewinnen versucht. Schwefelhexafluorid hat auch eine leicht betäubende Wirkung. - Für wissenschaftliche Demonstrationen / Magie als "unsichtbares Wasser", da ein leichtes Folienboot in einem Tank schwimmen kann, ebenso wie ein luftgefüllter Ballon.
- Es wird für Benchmark- und Kalibrierungsmessungen in Experimenten zur assoziativen und dissoziativen Elektronenanlagerung (DEA) verwendet. ⓘ
Treibhausgas
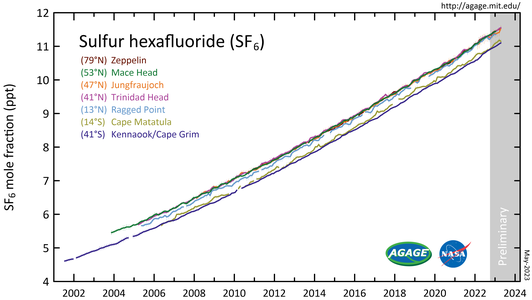
Schwefelhexafluorid (SF6), das im Rahmen des Advanced Global Atmospheric Gases Experiment (AGAGE) in der unteren Atmosphäre (Troposphäre) an Stationen auf der ganzen Welt gemessen wird. Die Häufigkeiten werden als unverschmutzte monatliche mittlere Molenbrüche in Teilen pro Billion angegeben.
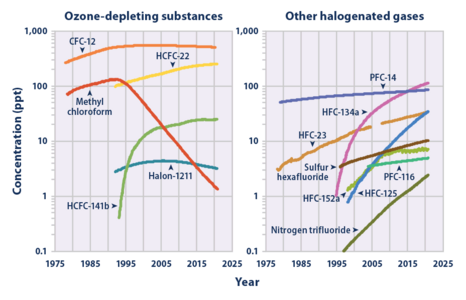
Atmosphärische Konzentration von SF6 im Vergleich zu ähnlichen anthropogenen Gasen (rechtes Diagramm). Beachten Sie die logarithmische Skala. ⓘ
Nach Angaben des Zwischenstaatlichen Ausschusses für Klimaänderungen ist SF
6 das stärkste bisher untersuchte Treibhausgas mit einem Erderwärmungspotenzial, das 23.900 Mal höher ist als das von CO
2 im Vergleich über einen Zeitraum von 100 Jahren. Schwefelhexafluorid ist in der Troposphäre und Stratosphäre inert und mit einer geschätzten atmosphärischen Lebensdauer von 800-3.200 Jahren extrem langlebig. ⓘ
Messungen von SF6 zeigen, dass sein globales durchschnittliches Mischungsverhältnis von einem konstanten Ausgangswert von etwa 54 Teilen pro Billion vor der Industrialisierung auf über 10 Teile pro Billion (ppt) im April 2020 angestiegen ist und um etwa 0,35 ppt (3,5 Prozent) pro Jahr zunimmt. Die durchschnittliche weltweite SF6-Konzentration stieg in den 1980er und 1990er Jahren um etwa sieben Prozent pro Jahr an, was vor allem auf die Verwendung von SF6 in der Magnesiumproduktion sowie bei Stromversorgern und Elektronikherstellern zurückzuführen ist. Da SF6 im Vergleich zu Kohlendioxid nur in geringen Mengen freigesetzt wird, wird sein individueller Beitrag zur globalen Erwärmung auf weniger als 0,2 Prozent geschätzt. Der kollektive Beitrag von SF6 und ähnlichen künstlich hergestellten halogenierten Gasen erreicht jedoch bis 2020 etwa 10 Prozent. Es werden Alternativen getestet. ⓘ
In Europa fällt SF
6 unter die F-Gas-Richtlinie, die seine Verwendung für verschiedene Anwendungen verbietet oder kontrolliert. Seit dem 1. Januar 2006 ist SF
6 als Tracergas und in allen Anwendungen außer in Hochspannungsschaltanlagen verboten. Im Jahr 2013 wurde berichtet, dass eine dreijährige Anstrengung des Energieministeriums der Vereinigten Staaten zur Identifizierung und Behebung von Leckagen in seinen Labors in den Vereinigten Staaten wie dem Princeton Plasma Physics Laboratory, wo das Gas als Hochspannungsisolator verwendet wird, produktiv war und die jährlichen Leckagen um 1.030 Kilogramm (2.280 Pfund) reduziert hat. Dies wurde erreicht, indem man die Einkäufe mit dem Bestand verglich, die Differenz als Leckage annahm und dann die Leckagen lokalisierte und reparierte. ⓘ

Die Emission durch elektrotechnische Anlagen in Deutschland betrug 1997 10 % von 238 t der Gesamtemission. Der relative Anteil der Elektrischen Industrie am Ausstoß schwankt stark zwischen verschiedenen Ländern und variiert, nach von der Industrie gemeldeten Daten, im Zeitraum 1990–2012 zwischen 20–30 % (EU) und 70–80 % (US). ⓘ
Der Anstieg der SF6-Konzentration in den letzten Jahren beträgt an der Station Bukit Kototabang in Indonesien von 5,3 ppt Anfang 2004 auf 6,3 ppt Ende 2008, was einem Anstieg um ca. 19 % in fünf Jahren entspricht. ⓘ
Im Jahr 2016 wurden in Deutschland 1142 Tonnen Schwefelhexafluorid an Verwender abgegeben, das sind ungefähr 2 % oder 23 t mehr als 2015. Die Klimawirksamkeit der Menge im Jahre 2016 beträgt 26 Mio. t CO2-Äquivalente, wobei Teile dieser Menge auch in geschlossene Systeme gefüllt wurden. Für diese Berechnung wurde der Treibhauseffekt-Faktor 22.800 gegenüber CO2 für einen verminderten Zeithorizont von 100 Jahren genutzt, obwohl die o. g. atmosphärische Lebensdauer objektiv längere Zeiträume der Hochrechnung erfordert, um Summationseffekte verantwortlich einzuschätzen. Die Hauptmenge gelangte in den Wirtschaftsbereich Elektroindustrie und Apparatebau mit 21,9 Millionen Tonnen CO2-Äquivalenten für 2016, gefolgt von der Halbleiterindustrie mit 1,2 Millionen Tonnen CO2-Äquivalenten. ⓘ
Physiologische Auswirkungen und Vorsichtsmaßnahmen
Schwefelhexafluorid ist ein ungiftiges Gas, aber da es den Sauerstoff in der Lunge verdrängt, besteht die Gefahr der Erstickung, wenn zu viel davon eingeatmet wird. Da es eine höhere Dichte als Luft hat, setzt sich eine erhebliche Menge des Gases, wenn es freigesetzt wird, in niedrig gelegenen Gebieten ab und birgt ein erhebliches Erstickungsrisiko, wenn das Gebiet betreten wird. Dies ist besonders wichtig für die Verwendung als Isolator in elektrischen Geräten, da sich die Arbeiter in Gräben oder Gruben unterhalb von SF-haltigen Geräten aufhalten können.
6. ⓘ
Wie bei allen Gasen beeinflusst die Dichte von SF
6 wie bei allen Gasen die Resonanzfrequenzen des Vokaltrakts und verändert damit drastisch die Klangqualität oder das Timbre der Stimme derjenigen, die es einatmen. Die Schwingungen der Stimmlippen werden davon nicht beeinflusst. Die Dichte von Schwefelhexafluorid ist bei Raumtemperatur und -druck aufgrund der großen molaren Masse des Gases relativ hoch. Im Gegensatz zu Helium, das eine molare Masse von etwa 4 g/mol hat und die Stimme anhebt, hat SF
6 eine Molmasse von etwa 146 g/mol, und die Schallgeschwindigkeit durch das Gas beträgt bei Raumtemperatur etwa 134 m/s, wodurch die Stimme leiser wird. Zum Vergleich: Die molare Masse von Luft, die zu etwa 80 % aus Stickstoff und 20 % aus Sauerstoff besteht, beträgt etwa 30 g/mol, was zu einer Schallgeschwindigkeit von 343 m/s führt. ⓘ
Schwefelhexafluorid hat eine etwas geringere Narkosewirkung als Distickstoffoxid und wird als mildes Narkosemittel eingestuft. ⓘ
Gewinnung und Darstellung
Schwefelhexafluorid kann direkt aus den Elementen durch Umsetzung elementaren Schwefels (S8) im Fluorgasstrom (F2) synthetisiert werden. Die Reaktion verläuft stark exotherm. ⓘ
Neben SF6 bilden sich bei diesem Syntheseweg auch weitere Schwefelfluoride, wie Dischwefeldecafluorid (S2F10). Daher wird bei der technischen Herstellung das Gas auf 400 °C erhitzt, wodurch eine Disproportionierung von Dischwefeldecafluorid in Schwefelhexafluorid und Schwefeltetrafluorid (SF4) erfolgt. ⓘ
Durch Waschen des Gasgemisches in Lauge wird das Schwefeltetrafluorid zerstört, während SF6 durch die Lauge nicht angegriffen wird. ⓘ
Durch anschließende Druckdestillation wird das reine SF6 abgetrennt. ⓘ
Eigenschaften
Physikalische Eigenschaften
Schwefelhexafluorid ist unter Normalbedingungen gasförmig. Es hat eine etwa fünfmal so hohe Dichte wie Luft. Sein Sublimationspunkt liegt bei −63,8 °C. ⓘ
Der Tripelpunkt liegt bei einer Temperatur von −50,8 °C und bei einem Druck von 2,26 bar. Erst oberhalb dieses Drucks ist auch eine flüssige Phase möglich. ⓘ
Der kritische Punkt liegt bei einer Temperatur von 45,6 °C, einem kritischen Druck von 3,76 MPa und einer kritischen Dichte von 0,735 g·cm−3. ⓘ
Die Verdampfungsenthalpie von Schwefelhexafluorid beträgt bei einem Druck von 1013 hPa 115 kJ/kg. ⓘ
Kristall- und Molekülstruktur
Bei tiefen Temperaturen kristallisiert es im monoklinen Kristallsystem. ⓘ
Im gasförmigen Zustand ist das SF6-Molekül oktaedrisch (Oh); die S–F-Bindungslänge beträgt 156,1(2) pm. ⓘ
Bindungslänge und -winkel beim gasförmigen Schwefelhexafluorid ⓘ
Chemische Eigenschaften
Aufgrund seiner Struktur ist es praktisch chemisch inert und verhält sich daher ähnlich wie molekularer Stickstoff oder die Edelgase. Es ist nahezu unlöslich in Wasser und nicht entflammbar. ⓘ
Auf Grund seiner Inertheit sind Reaktionen in der Regel nur unter drastischeren als der Normalbedingung durchführbar. So setzen sich Alkalimetalle mit SF6 in flüssigem Ammoniak zu den korrespondierenden Sulfiden und Fluoriden um:
- . ⓘ
In Gegenwart von Schwefelwasserstoff ist die Komproportionierung zu elementarem Schwefel und Fluorwasserstoff (HF) bekannt:
- . ⓘ
SF6 ist isoelektronisch zu den Anionen Hexafluorophosphat (PF6−), Hexafluorosilicat (SiF62−) und Hexafluoroaluminat (AlF63−). ⓘ
Verwendung

Schwefelhexafluorid (SF6) wird als Isoliergas in der Mittel- und Hochspannungstechnik eingesetzt, beispielsweise in gasisolierten Schaltanlagen (GIS) mit Hochspannungsschaltern und bei gasisolierten Rohrleitern (GIL) in komplett gekapselten Anlagen mit Betriebsspannungen von 6 kV bis 800 kV. Gegenüber Freiluftschaltanlagen wird deutlich Platz eingespart und die Einflüsse von Witterung und Vögeln oder Nagetieren werden vermieden. SF6 dient dabei auch als Löschgas, um den Schaltlichtbogen in Leistungsschaltern zu unterbrechen. ⓘ
Die Durchschlagsfestigkeit ist bei Normaldruck fast dreimal so hoch wie in Luft oder Stickstoff. Diese Eigenschaften sowie die geringen dielektrischen Verluste prädestinieren es zur Verwendung als Isoliergas in Koaxialkabeln und gasisolierten Hochfrequenz-Leistungskondensatoren, die damit kleiner gebaut werden können. Als Isolationsgas in elektrischen Schaltanlagen wird es unter einem Druck von 5 bar bis 10 bar gehalten, um die nötige hohe Isolationsfähigkeit sicherzustellen. Je höher der Gasdruck, desto kürzer ist gemäß dem Paschen-Gesetz die mittlere Weglänge der freien Elektronen im Gas. Elektronen können nicht so stark beschleunigt werden wie bei Normaldruck, denn sie stoßen früher mit den SF6-Molekülen zusammen. ⓘ
In Schaltanlagen mit dem prinzipiell ungiftigen SF6-Gas entstehen im Laufe des Betriebes durch die Lichtbögen in Kombination mit Verunreinigungen wie einem geringen Wasseranteil neben dem ungiftigen Tetrafluormethan giftige Fluorid-Verbindungen wie Fluorwasserstoff und Thionylfluorid sowie das hochgiftige Dischwefeldecafluorid (S2F10). Aus diesen Gründen müssen in gasdichten SF6-Schaltanlagen vor Wartungsarbeiten Sicherheitsrichtlinien zur Entlüftung beachtet werden. SF6 muss laut EU-Verordnung 517/2014 und laut der nationalen Chemikalien-Klimaschutzverordnung von zertifiziertem Personal wiedergewonnen werden, um dessen Recycling, Aufarbeitung oder Zerstörung sicherzustellen. SF6 muss gemäß den Vorschriften der DIN EN 60480 behandelt werden. Außerdem gilt die freiwillige Selbstverpflichtung der Hersteller und Betreiber von elektrischen Betriebsmitteln > 1000 Volt. ⓘ
Es wird als Isoliergas für Routinetests (Prüfung) mikroelektronischer Schaltkreise im Rahmen der Qualitätssicherung verwendet. ⓘ
Bei der Herstellung von Halbleiter-Bauteilen dient es als Ätzgas: SF6 ist das reaktive Gas beim reaktiven Ionenätzen (RIE) und DRIE (von engl. Deep Reactive Ion Etching). Außerdem wird es auf ähnliche Weise zum Reinigungsätzen unter anderem in der Display-Fertigung eingesetzt. ⓘ
SF6 verwendet man auch als Schutzgas bei der Gewinnung von Magnesium. Das SF6, spezifisch schwerer als Luft, verhindert hier den Kontakt der heißen Metallschmelze mit der Umgebungsluft. Prozessbedingt werden bei dieser Anwendung sehr große SF6-Mengen in die Atmosphäre abgegeben. ⓘ
SF6 wurde früher als Isoliergas zwischen Isolierglasscheiben benutzt sowie als Füllgas in Sohlen von Sportschuhen. Außerdem wurde Schwefelhexafluorid bis etwa zum Jahr 2000 auch zur Befüllung von Autoreifen eingesetzt, obwohl das pro Reifensatz bis zu 100 DM (ca. 50 Euro) kostete (siehe auch Reifengas). Alle drei vorgenannten Anwendungen sind inzwischen aus Gründen des Umweltschutzes verboten. ⓘ
Aufgrund seiner physikalischen Eigenschaften, der geringen Hintergrundkonzentration in der Atmosphäre und der sehr guten Nachweisbarkeit in Gasanalysatoren wird SF6 aktuell noch als Tracergas für Lüftungseffizienz-Messungen in sehr geringen Mengen verwendet. Für viele Anwendungen werden mittlerweile aber weniger klimaschädliche Gase eingesetzt. ⓘ
In der Augenheilkunde wird ein Gemisch aus Schwefelhexafluorid und Luft gegen Netzhautablösung eingesetzt, um ein Wiederanlegen der Netzhaut zu erreichen. Dazu wird während der operativen Glaskörperentfernung (Vitrektomie) das Gasgemisch in den Glaskörperraum (Camera vitrea bulbi) zu dem Zweck eingebracht, die Netzhaut auf ihre Unterlage zu drücken (Endotamponade). ⓘ
SF6 wird seit 2001 als Ultraschallkontrastmittel in der Medizin eingesetzt. Hier dient es insbesondere dem Nachweis von Lebermetastasen maligner Tumoren. Vorteile sind eine sehr hohe zeitliche und örtliche Kontrastauflösung. Schilddrüsenerkrankungen und Niereninsuffizienz sind keine Kontraindikation zur Durchführung dieser Untersuchung. Mit Hilfe von SF6 können Leberherde zu ca. 90 % korrekt nachgewiesen werden. ⓘ
Emissionen
| Emissionsquelle | 1990 | 1995 | 2000 | 2002 | 2004 | 2006 | 2007 | 2007 potenzielle Emissionen* |
|---|---|---|---|---|---|---|---|---|
| Alu-Guss/Spurengas | 1 | 1 | 14,5 | 35,5 | 46 | 85,5 | 84 | - |
| Schallschutzscheiben | 69 | 108 | 52 | 46 | 54 | 61 | 67 | 1950 |
| Solartechnik/Opt. Fasern | 0 | 0 | 0 | 0,4 | 1,5 | 4,7 | 20,3 | - |
| Elektr. Schaltanlagen | 23 | 27,3 | 16,9 | 15,7 | 16,3 | 14,4 | 15,8 | 1770 |
| Magnesiumgießereien | 7,4 | 7,7 | 13,4 | 16,1 | 24,9 | 24,1 | 15,2 | - |
| T&D-Bauteile | k. A. | 16,7 | 26,6 | 23,3 | 16,0 | 12,4 | 9,9 | k. A. |
| Teilchenbeschleuniger | 5,2 | 4,5 | 5,0 | 4,9 | 4,9 | 4,9 | 4,9 | 74 |
| Autoreifen | 65 | 110 | 50 | 9 | 4 | 2,5 | 2 | 6 |
| Halbleiterproduktion | 3,7 | 2 | 2,4 | 2,4 | 3,4 | 1,3 | 1,2 | - |
| Sonstiges | 11 | 26 | 32 | 24 | 21 | 20 | 13 | k. A. |
| Insgesamt | 200 | 300 | 210 | 180 | 190 | 230 | 230 | - |
| *durchschnittlicher Jahresbestand | ||||||||