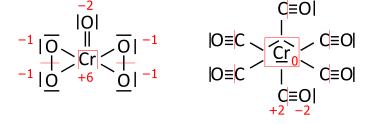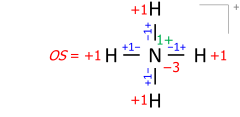Oxidationszahl
In der Chemie ist der Oxidationszustand oder die Oxidationszahl die hypothetische Ladung eines Atoms, wenn alle seine Bindungen zu anderen Atomen vollständig ionisch wären. Sie beschreibt den Grad der Oxidation (Verlust von Elektronen) eines Atoms in einer chemischen Verbindung. Vom Konzept her kann die Oxidationsstufe positiv, negativ oder null sein. Obwohl vollständig ionische Bindungen in der Natur nicht vorkommen, weisen viele Bindungen eine starke Ionizität auf, so dass die Oxidationsstufe ein nützlicher Indikator für die Ladung ist. ⓘ
Die Oxidationsstufe eines Atoms stellt nicht die "echte" formale Ladung dieses Atoms oder eine andere tatsächliche Atomeigenschaft dar. Dies gilt insbesondere für hohe Oxidationsstufen, bei denen die Ionisierungsenergie, die zur Erzeugung eines mehrfach positiven Ions erforderlich ist, weit über den in chemischen Reaktionen verfügbaren Energien liegt. Darüber hinaus können die Oxidationsstufen der Atome in einer bestimmten Verbindung je nach Wahl der für ihre Berechnung verwendeten Elektronegativitätsskala variieren. Daher ist die Oxidationsstufe eines Atoms in einer Verbindung ein reiner Formalismus. Sie ist jedoch wichtig für das Verständnis der Nomenklaturkonventionen für anorganische Verbindungen. Außerdem lassen sich mehrere Beobachtungen bei chemischen Reaktionen auf einer grundlegenden Ebene mit Hilfe von Oxidationsstufen erklären. ⓘ
Oxidationsstufen werden normalerweise durch ganze Zahlen dargestellt, die positiv, null oder negativ sein können. In einigen Fällen ist die durchschnittliche Oxidationsstufe eines Elements ein Bruchteil, wie z. B. 8/3 für Eisen im Magnetit Fe3O4 (siehe unten). Die höchste bekannte Oxidationsstufe wird mit +9 für das Tetroxoiridium(IX)-Kation (IrO+4) angegeben. Es wird vorhergesagt, dass Uran in dem ungewöhnlichen Hexoxid UO6 sogar eine Oxidationsstufe von +12 erreichen kann. Die niedrigste Oxidationsstufe ist -5, wie bei Bor in Al3BC. ⓘ
In der anorganischen Nomenklatur wird die Oxidationsstufe durch eine römische Ziffer hinter dem Elementnamen in Klammern oder als hochgestellte Zahl hinter dem Elementsymbol dargestellt, z. B. Eisen(III)-oxid. ⓘ
Der Begriff Oxidation wurde erstmals von Antoine Lavoisier verwendet, um die Reaktion eines Stoffes mit Sauerstoff zu bezeichnen. Viel später erkannte man, dass die Substanz bei der Oxidation Elektronen verliert, und die Bedeutung wurde auf andere Reaktionen ausgedehnt, bei denen Elektronen verloren gehen, unabhängig davon, ob Sauerstoff beteiligt war. Die Erhöhung der Oxidationsstufe eines Atoms durch eine chemische Reaktion wird als Oxidation bezeichnet; eine Verringerung der Oxidationsstufe wird als Reduktion bezeichnet. Bei solchen Reaktionen kommt es zu einer formalen Übertragung von Elektronen: ein Nettogewinn an Elektronen ist eine Reduktion, ein Nettoverlust von Elektronen eine Oxidation. Bei reinen Elementen ist die Oxidationsstufe Null. ⓘ
Die einfach zu ermittelnden Oxidationszahlen sind in der anorganischen und organischen Chemie zum Verständnis von Redoxreaktionen wichtig und bei der Formulierung von Redoxgleichungen sehr hilfreich. Die höchst mögliche bzw. die niedrigst mögliche Oxidationszahl hat ein Atom in einer Verbindung oder in einem Ion dann erreicht, wenn es so viele Elektronen abgegeben bzw. aufgenommen hat, dass es die nächsthöhere bzw. nächstniedrigere Edelgaskonfiguration erreicht. Eine Übersicht der möglichen Oxidationszahlen von chemischen Elementen findet sich in der Liste der Oxidationsstufen der chemischen Elemente. Die Ermittlung der Oxidationszahlen von Atomen in Verbindungen und Ionen, folgt einigen einfachen Regeln. ⓘ
IUPAC-Definition
Die IUPAC hat eine "Umfassende Definition des Begriffs Oxidationszustand (IUPAC Recommendations 2016)" veröffentlicht. Es handelt sich um eine Destillation eines technischen Berichts der IUPAC "Toward a comprehensive definition of oxidation state" aus dem Jahr 2014. Die aktuelle IUPAC Gold Book Definition der Oxidationsstufe lautet:
Die Oxidationsstufe eines Atoms ist die Ladung dieses Atoms nach ionischer Annäherung seiner heteronuklearen Bindungen...
- IUPAC ⓘ
und der Begriff Oxidationszahl sind nahezu synonym. ⓘ
Das zugrunde liegende Prinzip ist, dass die ionische Ladung "der Oxidationszustand eines Atoms nach ionischer Annäherung seiner Bindungen" ist, wobei ionische Annäherung bedeutet, dass alle Bindungen ionisch sind. Für die ionische Annäherung wurden mehrere Kriterien berücksichtigt:
- Extrapolation der Polarität der Bindung;
- aus dem Elektronegativitätsunterschied,
- aus dem Dipolmoment, und
- aus quantenchemischen Berechnungen von Ladungen.
- Zuordnung der Elektronen entsprechend dem Beitrag des Atoms zur Bindung Molekülorbital (MO) / die Zugehörigkeit des Elektrons in einem LCAO-MO-Modell. ⓘ
Bei einer Bindung zwischen zwei verschiedenen Elementen werden die Elektronen der Bindung dem Atom mit dem größten Beitrag/höherer Elektronegativität zugeordnet; bei einer Bindung zwischen zwei Atomen desselben Elements werden die Elektronen gleichmäßig aufgeteilt. Dies liegt daran, dass die meisten Elektronegativitätsskalen vom Bindungszustand des Atoms abhängen, was die Zuordnung der Oxidationsstufe zu einem etwas zirkulären Argument macht. Einige Skalen können zum Beispiel ungewöhnliche Oxidationsstufen ergeben, wie -6 für Platin in PtH2-4, für Pauling- und Mulliken-Skalen. Die Dipolmomente würden manchmal auch ungewöhnliche Oxidationszahlen ergeben, wie bei CO und NO, die mit ihrem positiven Ende zum Sauerstoff hin orientiert sind. Somit bleibt der Beitrag des Atoms zur Bindungs-MO, die Atom-Orbital-Energie und die quantenchemischen Berechnungen der Ladungen als einzig brauchbare Kriterien mit aussagekräftigen Werten für die ionische Näherung. Für eine einfache Schätzung der ionischen Annäherung können wir jedoch die Elektronegativitäten von Allen verwenden, da nur diese Elektronegativitätsskala wirklich unabhängig von der Oxidationsstufe ist, da sie sich auf die durchschnittliche Valenz-Elektronenenergie des freien Atoms bezieht:
| Gruppe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Zeitraum | ||||||||||||||||||
| 1 | H 2.300 |
He 4.160 | ||||||||||||||||
| 2 | Li 0.912 |
Be 1.576 |
B 2.051 |
C 2.544 |
N 3.066 |
O 3.610 |
F 4.193 |
Ne 4.787 | ||||||||||
| 3 | Na 0.869 |
Mg 1.293 |
Al 1.613 |
Si 1.916 |
P 2.253 |
S 2.589 |
Cl 2.869 |
Ar 3.242 | ||||||||||
| 4 | K 0.734 |
Ca 1.034 |
Sc 1.19 |
Ti 1.38 |
V 1.53 |
Cr 1.65 |
Mn 1.75 |
Fe 1.80 |
Co 1.84 |
Ni 1.88 |
Cu 1.85 |
Zn 1.588 |
Ga 1.756 |
Ge 1.994 |
As 2.211 |
Se 2.424 |
Br 2.685 |
Kr 2.966 |
| 5 | Rb 0.706 |
Sr 0.963 |
Y 1.12 |
Zr 1.32 |
Nb 1.41 |
Mo 1.47 |
Tc 1.51 |
Ru 1.54 |
Rh 1.56 |
Pd 1.58 |
Ag 1.87 |
Cd 1.521 |
In 1.656 |
Sn 1.824 |
Sb 1.984 |
Te 2.158 |
I 2.359 |
Xe 2.582 |
| 6 | Cs 0.659 |
Ba 0.881 |
Lu 1.09 |
Hf 1.16 |
Ta 1.34 |
W 1.47 |
Re 1.60 |
Os 1.65 |
Ir 1.68 |
Pt 1.72 |
Au 1.92 |
Hg 1.765 |
Tl 1.789 |
Pb 1.854 |
Bi 2.01 |
Po 2.19 |
At 2.39 |
Rn 2.60 |
| 7 | Fr 0.67 |
Ra 0.89 | ||||||||||||||||
| Siehe auch: Elektronegativitäten der Elemente (Datenseite) | ||||||||||||||||||
Bestimmung
Während in den einführenden Stufen des Chemieunterrichts postulierte Oxidationsstufen verwendet werden, sind in der IUPAC-Empfehlung und im Eintrag im Gold Book zwei ganz allgemeine Algorithmen zur Berechnung der Oxidationsstufen von Elementen in chemischen Verbindungen aufgeführt. ⓘ
Einfacher Ansatz ohne Berücksichtigung von Bindungen
In der Einführung in die Chemie werden Postulate verwendet: Die Oxidationsstufe eines Elements in einer chemischen Formel wird anhand der Gesamtladung und der postulierten Oxidationsstufen aller anderen Atome berechnet. ⓘ
Ein einfaches Beispiel basiert auf zwei Postulaten, ⓘ
- OS = +1 für Wasserstoff
- OS = -2 für Sauerstoff ⓘ
wobei OS für die Oxidationsstufe steht. Dieser Ansatz führt zu korrekten Oxidationsstufen in Oxiden und Hydroxiden jedes einzelnen Elements und in Säuren wie H2SO4 oder H2Cr2O7. Der Geltungsbereich kann entweder durch eine Liste von Ausnahmen oder durch die Zuweisung von Prioritäten zu den Postulaten erweitert werden. Letzteres funktioniert bei H2O2, wo die Priorität von Regel 1 beide Sauerstoffatome in der Oxidationsstufe -1 belässt. ⓘ
Zusätzliche Postulate und ihre Rangfolge können das Spektrum der Verbindungen erweitern, um dem Umfang eines Lehrbuchs zu entsprechen. Als Beispiel ein Postulat-Algorithmus von vielen möglichen; in einer Reihenfolge mit abnehmender Priorität:
- Ein Element in einer freien Form hat OS = 0.
- In einer Verbindung oder einem Ion ist die Summe der Oxidationsstufen gleich der Gesamtladung der Verbindung oder des Ions.
- Fluor in Verbindungen hat OS = -1; dies gilt für Chlor und Brom nur, wenn sie nicht an ein leichteres Halogen, Sauerstoff oder Stickstoff gebunden sind.
- Metalle der Gruppe 1 und Gruppe 2 in Verbindungen haben OS = +1 bzw. +2.
- Wasserstoff hat OS = +1, nimmt aber den Wert -1 an, wenn er als Hydrid an Metalle oder Metalloide gebunden ist.
- Sauerstoff in Verbindungen hat OS = -2, aber nur, wenn er nicht an Sauerstoff (z. B. in Peroxiden) oder Fluor gebunden ist. ⓘ
Dieser Satz von Postulaten gilt für die Oxidationsstufen von Fluoriden, Chloriden, Bromiden, Oxiden, Hydroxiden und Hydriden jedes einzelnen Elements. Er umfasst alle Oxosäuren eines beliebigen Zentralatoms (und alle ihre Fluor-, Chlor- und Bromverwandten) sowie die Salze solcher Säuren mit Metallen der Gruppe 1 und 2. Sie umfasst auch Jodide, Sulfide und ähnliche einfache Salze dieser Metalle. ⓘ
Algorithmus für die Zuweisung von Bindungen
Dieser Algorithmus wird anhand einer Lewis-Struktur (ein Diagramm, das alle Valenzelektronen zeigt) durchgeführt. Der Oxidationszustand entspricht der Ladung eines Atoms, nachdem jede seiner heteronuklearen Bindungen dem elektronegativeren Partner der Bindung zugeordnet wurde (außer wenn dieser Partner ein reversibel gebundener Lewis-Säure-Ligand ist) und die homonuklearen Bindungen gleichmäßig aufgeteilt wurden:
Dabei steht jedes "-" für ein Elektronenpaar (entweder zwischen zwei Atomen oder nur an einem Atom), und "OS" ist die Oxidationsstufe als numerische Variable. ⓘ
Nachdem die Elektronen gemäß den vertikalen roten Linien auf der Formel zugeordnet wurden, wird die Gesamtzahl der Valenzelektronen, die nun zu jedem Atom "gehören", von der Anzahl N der Valenzelektronen des neutralen Atoms (z. B. 5 für Stickstoff in Gruppe 15) abgezogen, um die Oxidationsstufe dieses Atoms zu erhalten. ⓘ
Dieses Beispiel zeigt, wie wichtig es ist, die Bindungen zu beschreiben. Die Kurzformel HNO3 entspricht zwei Strukturisomeren: der peroxynitrosen Säure in der obigen Abbildung und der stabileren Salpetersäure. Bei der Formel HNO3 ergibt der einfache Ansatz ohne Berücksichtigung der Bindungen -2 für alle drei Sauerstoffatome und +5 für den Stickstoff, was für Salpetersäure korrekt ist. Bei der peroxynitrosen Säure jedoch haben die beiden Sauerstoffatome in der O-O-Bindung jeweils OS = -1 und der Stickstoff hat OS = +3, was eine Struktur zum Verständnis erfordert. ⓘ
Organische Verbindungen werden auf ähnliche Weise behandelt; hier am Beispiel der funktionellen Gruppen, die zwischen CH4 und CO2 auftreten:
Analog für Übergangsmetallverbindungen; CrO(O2)2 auf der linken Seite hat insgesamt 36 Valenzelektronen (18 zu verteilende Paare), und Cr(CO)6 auf der rechten Seite hat 66 Valenzelektronen (33 Paare):
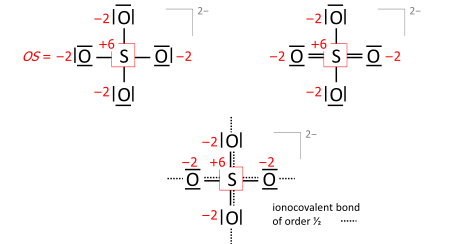
Ein wichtiger Schritt ist das Zeichnen der Lewis-Struktur des Moleküls (neutral, kationisch, anionisch): Die Atomsymbole werden so angeordnet, dass Atompaare durch einfache Zwei-Elektronen-Bindungen wie im Molekül verbunden werden können (eine Art "Skelettstruktur"), und die verbleibenden Valenzelektronen werden so verteilt, dass sp-Atome ein Oktett (Duett für Wasserstoff) mit einer Priorität erhalten, die proportional zur Elektronegativität zunimmt. In einigen Fällen führt dies zu alternativen Formeln, die sich in der Reihenfolge der Bindungen unterscheiden (die Gesamtheit dieser Formeln wird als Resonanzformeln bezeichnet). Nehmen wir das Sulfatanion (SO2-
4 mit 32 Valenzelektronen; 24 von den Sauerstoffatomen, 6 vom Schwefel, 2 der Anionenladung stammen vom impliziten Kation). Die Bindungsordnungen zu den endständigen Sauerstoffatomen haben keinen Einfluss auf die Oxidationsstufe, solange die Sauerstoffatome Oktette haben. Bereits die Skelettstruktur, oben links, ergibt die richtigen Oxidationsstufen, ebenso wie die Lewis-Struktur, oben rechts (eine der Resonanzformeln):
Die Formel für die Bindungsordnung unten kommt der Realität am nächsten, wenn vier äquivalente Sauerstoffatome mit einer Gesamtbindungsordnung von 2 vorhanden sind. Diese Gesamtbindungsordnung schließt die Bindung der Ordnung 1/2 an das angedeutete Kation ein und folgt der 8-N-Regel, die besagt, dass die Bindungsordnung des Hauptgruppenatoms gleich 8 minus N Valenzelektronen des neutralen Atoms ist, und zwar mit einer Priorität, die proportional zur Elektronegativität zunimmt. ⓘ
Dieser Algorithmus funktioniert auch für molekulare Kationen, die aus mehreren Atomen bestehen. Ein Beispiel ist das Ammoniumkation mit 8 Valenzelektronen (5 vom Stickstoff, 4 vom Wasserstoff, minus 1 Elektron für die positive Ladung des Kations):
Das Zeichnen von Lewis-Strukturen mit gestrichelten Elektronenpaaren unterstreicht die wesentliche Gleichwertigkeit von Bindungspaaren und einsamen Paaren beim Zählen der Elektronen und beim Verschieben von Bindungen auf Atome. Strukturen, die mit Elektronenpunktpaaren gezeichnet werden, sind natürlich in jeder Hinsicht identisch:
Der Vorbehalt des Algorithmus
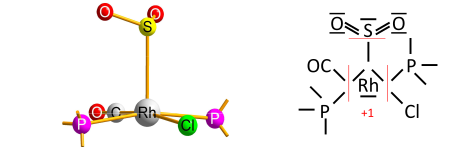
Der Algorithmus enthält einen Vorbehalt, der die seltenen Fälle von Übergangsmetallkomplexen mit einem Ligandentyp betrifft, der reversibel als Lewis-Säure gebunden ist (als Akzeptor des Elektronenpaares vom Übergangsmetall); in der Green'schen Methode zur Klassifizierung kovalenter Bindungen wird dieser Ligand als "Z-Typ" bezeichnet. Der Vorbehalt ergibt sich aus der vereinfachenden Verwendung der Elektronegativität anstelle der MO-basierten Elektronenzugehörigkeit zur Bestimmung des ionischen Vorzeichens. Ein frühes Beispiel ist der Komplex O2S-RhCl(CO)(PPh3)2 mit SO2 als reversibel gebundenem Akzeptorliganden (der beim Erhitzen freigesetzt wird). Die Rh-S-Bindung wird daher ionisch gegen die Elektronegativität von Rhodium und Schwefel extrapoliert, wodurch sich für Rhodium die Oxidationsstufe +1 ergibt:
Algorithmus zur Summierung von Bindungsordnungen
Dieser Algorithmus funktioniert mit Lewis-Strukturen und Bindungsgraphen von erweiterten (nichtmolekularen) Festkörpern:
Die Oxidationsstufe ergibt sich durch Summierung der heteronuklearen Bindungsordnungen am Atom als positiv, wenn das Atom der elektropositive Partner in einer bestimmten Bindung ist, und als negativ, wenn dies nicht der Fall ist, und die formale Ladung des Atoms (falls vorhanden) wird zu dieser Summe hinzugefügt. ⓘ
Angewandt auf eine Lewis-Struktur
Ein Beispiel für eine Lewis-Struktur ohne formale Ladung,
verdeutlicht, dass bei diesem Algorithmus homonukleare Bindungen einfach ignoriert werden (die Bindungsordnungen sind blau). ⓘ
Kohlenmonoxid ist ein Beispiel für eine Lewis-Struktur mit formalen Ladungen:
Um die Oxidationsstufen zu erhalten, werden die formalen Ladungen summiert, wobei der Wert der Bindungsordnung am Kohlenstoff positiv und am Sauerstoff negativ angenommen wird. ⓘ
Auf Molekülionen angewandt, berücksichtigt dieser Algorithmus die tatsächliche Lage der formalen (ionischen) Ladung, wie sie in der Lewis-Struktur eingezeichnet ist. Als Beispiel ergibt die Summe der Bindungsordnungen im Ammoniumkation -4 am Stickstoff mit der formalen Ladung +1, wobei die beiden Zahlen die Oxidationsstufe -3 ergeben:
Die Summe der Oxidationsstufen des Ions ist gleich seiner Ladung (wie sie bei einem neutralen Molekül gleich Null ist). ⓘ
Auch bei Anionen müssen die formalen (ionischen) Ladungen berücksichtigt werden, wenn sie nicht Null sind. Für Sulfat wird dies anhand der Skelett- oder Lewis-Strukturen (oben) veranschaulicht, die mit der Formel der Bindungsordnung aller Sauerstoffäquivalente verglichen werden und die Oktett- und 8-N-Regeln erfüllen (unten):
Angewandt auf das Bindungsdiagramm
Ein Bindungsdiagramm in der Festkörperchemie ist eine chemische Formel einer erweiterten Struktur, in der direkte Bindungsbeziehungen dargestellt sind. Ein Beispiel ist der Perowskit AuORb3, dessen Einheitszelle links und das Bindungsdiagramm (mit hinzugefügten numerischen Werten) rechts eingezeichnet ist:
Man sieht, dass das Sauerstoffatom an die sechs nächstgelegenen Rubidiumkationen bindet, von denen jedes 4 Bindungen zum Auridanion hat. Das Bindungsdiagramm fasst diese Bindungen zusammen. Die Bindungsordnungen (auch Bindungsvalenzen genannt) summieren sich zu Oxidationsstufen entsprechend dem angehängten Zeichen der ionischen Näherung der Bindung (es gibt keine formalen Ladungen in Bindungsgraphen). ⓘ
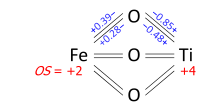
Die Bestimmung der Oxidationsstufen anhand eines Bindungsdiagramms lässt sich am Beispiel von Ilmenit, FeTiO3, veranschaulichen. Wir können uns fragen, ob das Mineral Fe2+ und Ti4+ oder Fe3+ und Ti3+ enthält. In seiner Kristallstruktur ist jedes Metallatom an sechs Sauerstoffatome und jedes der äquivalenten Sauerstoffatome an zwei Eisen- und zwei Titanatome gebunden, wie im nachstehenden Bindungsdiagramm dargestellt. Experimentelle Daten zeigen, dass drei Metall-Sauerstoff-Bindungen im Oktaeder kurz und drei lang sind (die Metalle sind nicht zentriert). Die Bindungsordnungen (Valenzen), die sich aus den Bindungslängen nach der Bindungsvalenzmethode ergeben, summieren sich bei Fe auf 2,01 und bei Ti auf 3,99, die auf die Oxidationsstufen +2 bzw. +4 abgerundet werden können:
Redoxbilanzierung
Die Oxidationsstufen können für das Gleichgewicht chemischer Gleichungen für Oxidations-Reduktions- (oder Redox-) Reaktionen nützlich sein, da die Veränderungen der oxidierten Atome durch die Veränderungen der reduzierten Atome ausgeglichen werden müssen. Bei der Reaktion von Acetaldehyd mit dem Tollens'schen Reagenz zur Bildung von Essigsäure (siehe unten) ändert beispielsweise das Carbonylkohlenstoffatom seine Oxidationsstufe von +1 auf +3 (es verliert zwei Elektronen). Diese Oxidation wird durch die Reduktion von zwei Ag+-Kationen zu Ag0 ausgeglichen (wobei insgesamt zwei Elektronen gewonnen werden). ⓘ
Ein anorganisches Beispiel ist die Bettendorf-Reaktion mit SnCl2 zum Nachweis von Arsenit-Ionen in einem konzentrierten HCl-Extrakt. Bei Vorhandensein von Arsen(III) tritt eine Braunfärbung auf, die einen dunklen Arsen-Niederschlag bildet, entsprechend der folgenden vereinfachten Reaktion:
- 2 As3+ + 3 Sn2+ → 2 As0 + 3 Sn4+
Hier werden drei Zinnatome von der Oxidationsstufe +2 auf +4 oxidiert, wobei sechs Elektronen entstehen, die zwei Arsenatome von der Oxidationsstufe +3 auf 0 reduzieren. Die einfache Einzeilenbilanzierung sieht folgendermaßen aus: Die beiden Redoxpaare werden so notiert, wie sie reagieren;
- As3+ + Sn2+ ⇌ As0 + Sn4+.
Ein Zinn wird von der Oxidationsstufe +2 zu +4 oxidiert, ein Schritt mit zwei Elektronen, daher wird vor den beiden Arsenpartnern 2 geschrieben. Ein Arsen wird von +3 zu 0 reduziert, ein Schritt mit drei Elektronen, daher steht 3 vor den beiden Zinnpartnern. Ein alternatives Drei-Zeilen-Verfahren besteht darin, die Halbreaktionen für die Oxidation und die Reduktion, die jeweils mit Elektronen bilanziert werden, getrennt aufzuschreiben und sie dann so zu summieren, dass sich die Elektronen kreuzen. Im Allgemeinen müssen diese Redox-Bilanzen (die Ein-Zeilen-Bilanz oder jede Halbreaktion) daraufhin überprüft werden, ob die Ionen- und Elektronenladungssummen auf beiden Seiten der Gleichung tatsächlich gleich sind. Wenn sie nicht gleich sind, werden geeignete Ionen hinzugefügt, um die Ladungen und die Nicht-Redox-Elementbilanz auszugleichen. ⓘ
Erscheinungen
Nominale Oxidationsstufen
Die nominelle Oxidationsstufe ist ein allgemeiner Begriff mit zwei verschiedenen Definitionen:
- Die elektrochemische Oxidationsstufe stellt ein Molekül oder ein Ion im Latimer-Diagramm oder Frost-Diagramm für sein redoxaktives Element dar. Ein Beispiel ist das Latimer-Diagramm für Schwefel bei pH 0, wo die elektrochemische Oxidationsstufe +2 für Schwefel HS
2O-
3 zwischen S und H2SO3 liegt:
- Die systematische Oxidationsstufe wird aus naheliegenden Alternativen als pädagogische Beschreibung ausgewählt. Ein Beispiel ist die Oxidationsstufe von Phosphor in H3PO3 (strukturell diprotisches HPO(OH)2), die nominell mit +3 angegeben wird, während die Elektronegativitäten von Phosphor und Wasserstoff mit einer geringen Marge, die die beiden Alternativen fast gleichwertig macht, auf +5 hindeuten:
- Beide alternativen Oxidationszahlen für Phosphor sind chemisch sinnvoll, je nachdem, welche chemische Eigenschaft oder Reaktion im Vordergrund steht. Im Gegensatz dazu ist eine berechnete Alternative wie der Durchschnitt (+4) nicht sinnvoll. ⓘ
Zweideutige Oxidationsstufen
Lewis-Formeln sind regelbasierte Annäherungen an die chemische Realität, ebenso wie die Elektronegativitäten von Allen. Dennoch können Oxidationsstufen zweideutig erscheinen, wenn ihre Bestimmung nicht einfach ist. Wenn die Oxidationsstufe nur durch ein Experiment bestimmt werden kann, ist die regelbasierte Bestimmung mehrdeutig (unzureichend). Es gibt auch wirklich dichotome Werte, die willkürlich bestimmt werden. ⓘ
Oxidationszustandsbestimmung aus Resonanzformeln
Scheinbar mehrdeutige Oxidationsstufen werden aus einer Reihe von gleichgewichtigen Resonanzformeln für ein Molekül mit heteronuklearen Bindungen abgeleitet, bei denen die Atomkonnektivität nicht der durch die 8-N-Regel vorgegebenen Anzahl von Zwei-Elektronen-Bindungen entspricht. Ein Beispiel ist S2N2, bei dem vier Resonanzformeln mit einer S=N-Doppelbindung die Oxidationsstufen +2 und +4 für die beiden Schwefelatome aufweisen, die im Durchschnitt +3 ergeben, weil die beiden Schwefelatome in diesem quadratischen Molekül gleichwertig sind. ⓘ
Um die Oxidationsstufe zu bestimmen, ist eine physikalische Messung erforderlich
- wenn ein nicht unschuldiger Ligand vorhanden ist, der versteckte oder unerwartete Redox-Eigenschaften aufweist, die sonst dem Zentralatom zugeordnet werden könnten. Ein Beispiel ist der Nickeldithiolatkomplex Ni(S
2C
2H
2)2−
2. - Wenn die Redox-Zweideutigkeit eines Zentralatoms und eines Liganden zu dichotomen Oxidationszuständen von geringer Stabilität führt, kann es zu thermisch induziertem Tautomerismus kommen, wie z. B. bei Mangancatecholat, Mn(C6H4O2)3. Die Zuordnung solcher Oxidationsstufen erfordert spektroskopische, magnetische oder strukturelle Daten.
- wenn die Bindungsordnung zusammen mit einem isolierten Tandem aus einer heteronuklearen und einer homonuklearen Bindung ermittelt werden muss. Ein Beispiel ist Thiosulfat S
2O2-
3 mit zwei möglichen Oxidationsstufen (Bindungsordnungen sind blau und formale Ladungen grün dargestellt):
- Die Messung des S-S-Abstandes in Thiosulfat ist erforderlich, um zu zeigen, dass diese Bindungsordnung sehr nahe bei 1 liegt, wie in der Formel links. ⓘ
Mehrdeutige/willkürliche Oxidationsstufen
- wenn der Elektronegativitätsunterschied zwischen zwei gebundenen Atomen sehr gering ist (wie in H3PO3). Für diese Atome erhält man zwei nahezu äquivalente Paare von Oxidationsstufen, die willkürlich gewählt werden.
- wenn ein elektronegatives p-Block-Atom ausschließlich homonukleare Bindungen bildet, deren Anzahl von der Anzahl der durch die Regeln vorgeschlagenen Zwei-Elektronen-Bindungen abweicht. Beispiele hierfür sind homonukleare endliche Ketten wie N-
3 (der zentrale Stickstoff verbindet zwei Atome mit vier Zwei-Elektronen-Bindungen, während nach der 8-N-Regel nur drei Zwei-Elektronen-Bindungen erforderlich sind) oder I-
3 (das zentrale Jod verbindet zwei Atome mit zwei Zwei-Elektronen-Bindungen, während nur eine Zwei-Elektronen-Bindung die 8 - N-Regel erfüllt). Ein sinnvoller Ansatz besteht darin, die ionische Ladung auf die beiden äußeren Atome zu verteilen. Eine solche Anordnung der Ladungen in einem Polysulfid S2-
n (bei dem alle inneren Schwefelatome zwei Bindungen bilden, die die 8-N-Regel erfüllen) ergibt sich bereits aus der Lewis-Struktur. - wenn das isolierte Tandem aus einer heteronuklearen und einer homonuklearen Bindung zu einem Bindungskompromiss zwischen zwei Lewis-Strukturen mit limitierenden Bindungsordnungen führt. Ein Beispiel ist N2O:
- Die typische Oxidationsstufe des Stickstoffs in N2O ist +1, die sich auch für beide Stickstoffe durch einen Molekülorbitalansatz ergibt. Die formalen Ladungen auf der rechten Seite entsprechen den Elektronegativitäten, was einen zusätzlichen Beitrag der Ionenbindung impliziert. Die geschätzten N-N- und N-O-Bindungsordnungen betragen 2,76 bzw. 1,9 und nähern sich damit der Formel für ganzzahlige Bindungsordnungen, die den ionischen Beitrag explizit als Bindung einschließen würde (in grün):
- Umgekehrt verringern formale Ladungen gegen Elektronegativitäten in einer Lewis-Struktur die Bindungsordnung der entsprechenden Bindung. Ein Beispiel ist Kohlenmonoxid mit einer geschätzten Bindungsordnung von 2,6. ⓘ
Fraktionierte Oxidationsstufen
Die fraktionierten Oxidationsstufen werden häufig verwendet, um die durchschnittliche Oxidationsstufe mehrerer Atome desselben Elements in einer Struktur darzustellen. Die Formel von Magnetit lautet zum Beispiel Fe
3O
4, was eine durchschnittliche Oxidationsstufe für Eisen von +8/3 bedeutet. Dieser Durchschnittswert ist jedoch möglicherweise nicht repräsentativ, wenn die Atome nicht gleichwertig sind. In einem Fe
3O
4-Kristall unter 120 K (-153 °C) sind zwei Drittel der Kationen Fe3+
und ein Drittel sind Fe2+
und die Formel lässt sich besser als FeO-Fe
2O
3. ⓘ
Ähnlich verhält es sich mit Propan, C
3H
8, mit einer Kohlenstoffoxidationsstufe von -8/3 beschrieben. Auch hier handelt es sich um einen Durchschnittswert, da die Struktur des Moleküls H
3C-CH
2-CH
3, wobei das erste und das dritte Kohlenstoffatom jeweils eine Oxidationsstufe von -3 und das mittlere von -2 aufweisen. ⓘ
Ein Beispiel mit echten fraktionierten Oxidationsstufen für äquivalente Atome ist Kaliumsuperoxid, KO
2. Das zweiatomige Superoxid-Ion O-
2 hat eine Gesamtladung von -1, so dass jedes seiner beiden äquivalenten Sauerstoffatome eine Oxidationsstufe von -1/2 hat. Dieses Ion kann als Resonanzhybrid zweier Lewis-Strukturen beschrieben werden, wobei jeder Sauerstoff in der einen Struktur die Oxidationsstufe 0 und in der anderen die Oxidationsstufe -1 hat. ⓘ
Für das Cyclopentadienyl-Anion C
5H-
5 ist die Oxidationsstufe von C -1 + -1/5 = -6/5. Die -1 ergibt sich, weil jeder Kohlenstoff an ein Wasserstoffatom (ein weniger elektronegatives Element) gebunden ist, und die -1/5, weil die gesamte ionische Ladung von -1 auf fünf äquivalente Kohlenstoffe verteilt ist. Auch dies kann als Resonanzhybrid aus fünf äquivalenten Strukturen beschrieben werden, die jeweils vier Kohlenstoffatome mit der Oxidationsstufe -1 und ein Kohlenstoffatom mit -2 aufweisen. ⓘ
ⓘBeispiele für fraktionierte Oxidationsstufen für Kohlenstoff Oxidationsstufe Beispielspezies -6/5 C
5H-
5-6/7 C
7H+
7+3/2 C
4O2-
4
Schließlich werden bei der Beschreibung von Mennige keine fraktionierten Oxidationszahlen verwendet. Pb
3O
4 wird als Blei(II,IV)-oxid dargestellt, wobei die Oxidationsstufen der beiden nicht-äquivalenten Bleiatome angegeben werden. ⓘ
Elemente mit mehreren Oxidationsstufen
Die meisten Elemente haben mehr als eine mögliche Oxidationsstufe. Zum Beispiel hat Kohlenstoff neun mögliche ganzzahlige Oxidationsstufen von -4 bis +4:
ⓘGanzzahlige Oxidationsstufen von Kohlenstoff Oxidationsstufe Beispielverbindung -4 CH
4-3 C
2H
6-2 C
2H
4, CH
3Cl-1 C
2H
2, C
6H
6, (CH
2OH)
2HCHO, CH
2Cl
2+1 OCHCHO, CHCl
2CHCl
2+2 HCOOH, CHCl
3+3 HCOOH, C
2Cl
6+4 CCl
4, CO
2
Oxidationszustand bei Metallen
Viele Verbindungen mit Glanz und elektrischer Leitfähigkeit haben eine einfache stöchiometrische Formel, wie das goldene TiO, das blauschwarze RuO2 oder das kupferfarbene ReO3, die alle eine eindeutige Oxidationsstufe aufweisen. Letztlich ist die Zuordnung der freien Metallelektronen zu einem der gebundenen Atome nicht umfassend und kann zu ungewöhnlichen Oxidationsstufen führen. Beispiele hierfür sind die LiPb- und Cu
3Au-Legierungen, deren Zusammensetzung und Struktur weitgehend durch die Größe der Atome und die Packungsfaktoren bestimmt werden. Sollte die Oxidationsstufe für die Redoxbilanzierung benötigt werden, wird sie am besten für alle Atome einer solchen Legierung auf 0 gesetzt. ⓘ
Liste der Oxidationsstufen der Elemente
Dies ist eine Liste der bekannten Oxidationsstufen der chemischen Elemente, mit Ausnahme der nicht ganzzahligen Werte. Die häufigsten Zustände sind fett gedruckt. Die Tabelle basiert auf derjenigen von Greenwood und Earnshaw, wobei Ergänzungen vermerkt sind. Jedes Element liegt in der Oxidationsstufe 0 vor, wenn es als reines, nicht ionisiertes Element in einer beliebigen Phase vorliegt, unabhängig davon, ob es sich um einatomige oder mehratomige Allotrope handelt. In der Spalte für die Oxidationsstufe 0 sind nur Elemente aufgeführt, von denen bekannt ist, dass sie in Verbindungen in der Oxidationsstufe 0 vorliegen.
- Vorlage:Liste der Oxidationsstufen der Elemente ⓘ
Frühe Formen (Oktettregel)
Eine Abbildung mit einem ähnlichen Format wurde 1919 von Irving Langmuir in einer der frühen Abhandlungen über die Oktettregel verwendet. Die Periodizität der Oxidationsstufen war eines der Indizien, die Langmuir zur Annahme der Regel veranlassten. ⓘ
Verwendung in der Nomenklatur
Die Oxidationsstufe wird bei der Benennung von Verbindungen von Übergangsmetallen, Lanthaniden und Actiniden entweder als hochgestellte Zahl neben dem Elementsymbol in einer chemischen Formel (z. B. FeIII) oder in Klammern nach dem Namen des Elements in chemischen Bezeichnungen (z. B. Eisen(III)) angegeben. Zum Beispiel heißt :Vorlage:Chem Eisen(III)-sulfat und seine Formel kann als Fe:Vorlage:Su:Vorlage:Chem dargestellt werden. Das liegt daran, dass ein Sulfat-Ion eine Ladung von -2 hat, so dass jedes Eisenatom eine Ladung von +3 erhält. ⓘ
Geschichte des Oxidationsstufenkonzepts
Die Anfänge
Die Oxidation selbst wurde erstmals von Antoine Lavoisier untersucht, der sie als das Ergebnis von Reaktionen mit Sauerstoff definierte (daher der Name). Seitdem wurde der Begriff so verallgemeinert, dass er einen formalen Verlust von Elektronen bedeutet. Oxidationszustände, die Friedrich Wöhler 1835 als Oxidationsstufen bezeichnete, waren einer der geistigen Bausteine, die Dmitri Mendelejew zur Ableitung des Periodensystems nutzte. William B. Jensen gibt einen Überblick über die Geschichte bis zum Jahr 1938. ⓘ
Verwendung in der Nomenklatur
Als man erkannte, dass einige Metalle zwei verschiedene binäre Verbindungen mit demselben Nichtmetall bilden, wurden die beiden Verbindungen oft durch die Endung -ic für die höhere Oxidationsstufe des Metalls und die Endung -ous für die niedrigere unterschieden. Zum Beispiel ist FeCl3 Eisenchlorid und FeCl2 Eisenchlorid. Dieses System ist nicht sehr zufriedenstellend (obwohl es manchmal noch verwendet wird), weil verschiedene Metalle unterschiedliche Oxidationsstufen haben, die gelernt werden müssen: Eisen und Eisen(II) sind +3 bzw. +2, aber Kupfer und Kupfer(II) sind +2 und +1, und Zinn(II) und Zinn(II) sind +4 und +2. Außerdem wurden Metalle mit mehr als zwei Oxidationsstufen nicht berücksichtigt, wie z. B. Vanadium mit den Oxidationsstufen +2, +3, +4 und +5.:Vorlage:Rp ⓘ
Dieses System wurde weitgehend durch das von Alfred Stock 1919 vorgeschlagene und von der IUPAC 1940 übernommene System ersetzt. So wurde FeCl2 als Eisen(II)-chlorid und nicht als Eisen(II)-chlorid geschrieben. Die römische Ziffer II am Zentralatom wurde "Stock-Zahl" genannt (ein inzwischen veralteter Begriff), und ihr Wert wurde als Ladung am Zentralatom nach Entfernung der Liganden und der mit ihnen geteilten Elektronenpaare ermittelt.:Vorlage:Rp ⓘ
Entwicklung zum heutigen Konzept
Der Begriff "Oxidationszustand" wurde in der englischsprachigen chemischen Literatur von Wendell Mitchell Latimer in seinem 1938 erschienenen Buch über elektrochemische Potentiale popularisiert. Er verwendete ihn für den Wert (synonym mit dem deutschen Begriff Wertigkeit), der im Englischen zuvor als "valence", "polar valence" oder "polar number" bezeichnet wurde, oder auch als "oxidation stage" oder "state of oxidation". Seit 1938 wird der Begriff "Oxidationsstufe" mit elektrochemischen Potentialen und dem Elektronenaustausch in Redoxpaaren in Verbindung gebracht, die an Redoxreaktionen beteiligt sind. Bis 1948 verwendete die IUPAC die Nomenklaturregeln von 1940 mit dem Begriff "Oxidationszustand" anstelle der ursprünglichen Wertigkeit. 1948 schlug Linus Pauling vor, dass die Oxidationszahl durch Extrapolation der Bindungen in Richtung der Elektronegativität auf vollständig ionisch bestimmt werden könnte. Eine vollständige Akzeptanz dieses Vorschlags wurde durch die Tatsache erschwert, dass die Pauling-Elektronegativitäten als solche von der Oxidationsstufe abhängen und dass sie bei einigen Übergangsmetallen zu ungewöhnlichen Werten für die Oxidationsstufen führen können. Im Jahr 1990 griff die IUPAC auf eine postulative (regelbasierte) Methode zur Bestimmung der Oxidationsstufe zurück. Diese wurde durch den synonymen Begriff Oxidationszahl ergänzt, der auf die 1940 in die Nomenklatur eingeführte Stockzahl zurückgeht. Die Terminologie mit "Liganden":Vorlage:Rp erweckte jedoch den Eindruck, dass die Oxidationszahl etwas Spezifisches für Koordinationskomplexe sein könnte. Diese Situation und das Fehlen einer wirklich einheitlichen Definition führten zu zahlreichen Debatten über die Bedeutung der Oxidationsstufe, zu Vorschlägen für Methoden zu ihrer Bestimmung und zu Definitionen der Oxidationsstufe. Um dieses Problem zu lösen, wurde 2008 ein IUPAC-Projekt (2008-040-1-200) zur "Umfassenden Definition des Oxidationszustandes" gestartet, das mit zwei Berichten und den überarbeiteten Einträgen "Oxidationszustand" und "Oxidationszahl" im IUPAC Gold Book abgeschlossen wurde. Die Ergebnisse waren eine einheitliche Definition der Oxidationsstufe und zwei Algorithmen zur Berechnung der Oxidationsstufe in molekularen und ausgedehnten festen Verbindungen, die sich an Allen Elektronegativitäten orientieren, die unabhängig von der Oxidationsstufe sind. ⓘ
Bedeutung und Nutzen
Die Oxidationszahl eines Atoms kann der formalen Beschreibung der Elektronendichte bei einem Atom dienen, wobei eine positive Oxidationszahl eine verringerte Elektronendichte (gegenüber dem Zustand im Element) und eine negative Oxidationszahl eine erhöhte Elektronendichte anzeigt. Als rein formale Größe korreliert die Oxidationszahl jedoch nur schlecht mit der tatsächlichen Elektronendichte- beziehungsweise Ladungsverteilung. ⓘ
Oxidationszahlen haben eine große Bedeutung bei der sachgerechten Formulierung und Bestimmung der Stöchiometrie von Redoxreaktionen. Sie dienen dazu, die unterschiedlichen Oxidationsstufen und ihre Veränderungen bei Redoxreaktionen darzustellen und die Anzahl der ausgetauschten Elektronen zu ermitteln. Eine Erniedrigung der Oxidationszahl einer Atomsorte bei einer Redoxreaktion bedeutet, dass diese Atomsorte reduziert wurde; analog bedeutet eine Erhöhung der Oxidationszahl einer Atomsorte, dass diese Atomsorte oxidiert wurde. ⓘ
Nach IUPAC können die Bezeichnungen oxidation state und oxidation number verwendet werden. Die Bezeichnung oxidation state (Oxidationszustand) entspricht in ihrer Bedeutung der Oxidationszahl und wird in der organischen Chemie häufig benutzt, um verschiedene Substanzklassen hinsichtlich ihres Oxidationszustandes zu vergleichen, z. B. mit den folgenden Aussagen: Carbonsäuren sind im gleichen Oxidationszustand wie Carbonsäureester und andere strukturell vergleichbare Derivate von Carbonsäuren wie z. B. auch Carbonsäurechloride. Carbonsäuren und ihre Derivate sind aber in einem höheren Oxidationszustand als Aldehyde und Alkohole und in einem niedrigeren Oxidationszustand als das Kohlendioxid. ⓘ
- Durch den Vergleich von Oxidationszahlen lässt sich schnell erkennen, dass die Umsetzung eines primären Alkohols zu einem Aldehyd und auch die Umsetzung eines Aldehyds zu einer Carbonsäure beides Oxidationen sind. ⓘ
Ethanol Acetaldehyd Essigsäure
- Bei verschiedenen Kohlenwasserstoffen werden die unterschiedlichen Oxidationszustände der C-Atome deutlich.