Serotonin-Wiederaufnahmehemmer
| Selektiver Serotonin-Wiederaufnahme-Hemmer ⓘ | |
|---|---|
| Wirkstoffklasse | |
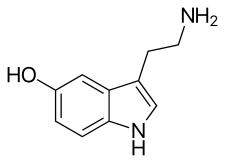 Serotonin, der Neurotransmitter, der am Wirkmechanismus der SSRIs beteiligt ist. | |
| Identifikatoren der Klasse | |
| Synonyme | Serotonin-spezifische Wiederaufnahmeinhibitoren, serotonerge Antidepressiva |
| Verwendung | Major depressive Störung, Angststörungen |
| ATC-Code | N06AB |
| Biologisches Ziel | Serotonin-Transporter |
| Klinische Daten | |
| Drogen.com | Medikamenten-Klassen |
| Verbraucher-Berichte | Best Buy Medikamente |
| Externe Links | |
| MeSH | D017367 |
Selektive Serotonin-Wiederaufnahmehemmer (SSRI) sind eine Klasse von Arzneimitteln, die in der Regel als Antidepressiva bei der Behandlung von schweren Depressionen, Angststörungen und anderen psychischen Erkrankungen eingesetzt werden. ⓘ
SSRI erhöhen den extrazellulären Spiegel des Neurotransmitters Serotonin, indem sie dessen Wiederaufnahme (Reuptake) in die präsynaptische Zelle einschränken. Sie sind unterschiedlich selektiv für die anderen Monoamintransporter, wobei reine SSRI eine starke Affinität für den Serotonintransporter und nur eine schwache Affinität für die Noradrenalin- und Dopamintransporter aufweisen. ⓘ
SSRIs sind in vielen Ländern die am häufigsten verschriebenen Antidepressiva. Die Wirksamkeit von SSRI bei leichten oder mittelschweren Depressionen ist umstritten und wird möglicherweise durch die Nebenwirkungen, insbesondere bei Jugendlichen, aufgewogen oder nicht. ⓘ
Serotonin-Wiederaufnahmehemmer (englisch Serotonin Reuptake Inhibitors, SRI) sind eine Klasse von Antidepressiva. Gemeinsam ist diesen Substanzen, dass sie Serotonintransporter blockieren und dadurch die Konzentration von Serotonin in der Gewebsflüssigkeit des Gehirns erhöhen. ⓘ
Sie werden auch Selektive Serotonin-Wiederaufnahmehemmer (Selective Serotonin Reuptake Inhibitor, SSRI) genannt, da sie an andere Monoamintransporter nicht oder nur sehr schwach binden. Diese Selektivität unterscheidet die SSRI von den älteren trizyklischen Antidepressiva. ⓘ
Medizinische Anwendungen
Viele verschiedene (pharmako)therapeutische Ansätze zur Behandlung von Depressionen sind möglich. Einen dieser Ansätze nutzen die SSRI. Ein Hauptanwendungsgebiet für alle SSRI außer Dapoxetin ist die Depression von klinisch bedeutsamem Schweregrad (depressive Episode, major depression). In den letzten Jahren haben die SSRI eine umfangreiche Erweiterung der Indikationen erfahren, insbesondere im Bereich der Angst- und Zwangsstörungen. Neben den oben genannten Anwendungsgebieten gibt es Hinweise auf eine Wirksamkeit der SSRI bei verschiedenen Syndromen, z. B. dem prämenstruell-dysphorischen Syndrom und klimakterischen Beschwerden, Ejaculatio praecox, verschiedenen Essstörungen und dem Fibromyalgiesyndrom (teils Off-label-Indikationen). ⓘ
Die Hauptindikation für SSRI ist die schwere depressive Störung; sie werden jedoch auch häufig bei Angststörungen wie sozialer Angststörung, generalisierter Angststörung, Panikstörung, Zwangsstörung, Essstörungen, chronischen Schmerzen und in einigen Fällen bei posttraumatischer Belastungsstörung (PTSD) verschrieben. Sie werden auch häufig zur Behandlung der Depersonalisationsstörung eingesetzt, allerdings mit unterschiedlichen Ergebnissen. ⓘ
Depressionen
Antidepressiva werden vom britischen National Institute for Health and Care Excellence (NICE) als Erstbehandlung schwerer Depressionen und zur Behandlung leichter bis mittelschwerer Depressionen empfohlen, die nach konservativen Maßnahmen wie kognitiver Therapie fortbestehen. Von einer routinemäßigen Anwendung bei Personen mit chronischen Gesundheitsproblemen und leichten Depressionen wird abgeraten. ⓘ
Die Wirksamkeit von SSRI bei der Behandlung von Depressionen in Abhängigkeit von deren Schwere und Dauer ist umstritten.
- Zwei 2008 (Kirsch) und 2010 (Fournier) veröffentlichte Meta-Analysen kamen zu dem Ergebnis, dass SSRI bei leichten und mittelschweren Depressionen im Vergleich zu Placebo nur eine geringe oder gar keine Wirkung haben, während bei sehr schweren Depressionen die Wirkung von SSRI zwischen "relativ gering" und "erheblich" liegt. Die Meta-Analyse aus dem Jahr 2008 fasste 35 klinische Studien zusammen, die der Food and Drug Administration (FDA) vor der Zulassung von vier neueren Antidepressiva vorgelegt wurden (darunter die SSRI Paroxetin und Fluoxetin, das Nicht-SSRI-Antidepressivum Nefazodon und der Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SNRI) Venlafaxin). Die Autoren führten den Zusammenhang zwischen Schweregrad und Wirksamkeit auf eine Verringerung des Placebo-Effekts bei schwer depressiven Patienten zurück und nicht auf eine Verstärkung der Wirkung des Medikaments. Einige Forscher haben die statistische Grundlage dieser Studie in Frage gestellt, weil sie die Wirkung von Antidepressiva unterschätzt.
- Eine Metaanalyse von Fluoxetin und Venlafaxin aus dem Jahr 2012 kam zu dem Schluss, dass für jedes Medikament im Vergleich zu Placebo statistisch und klinisch signifikante Behandlungseffekte beobachtet wurden, und zwar unabhängig von der Ausgangsschwere der Depression; einige der Autoren legten jedoch erhebliche Beziehungen zur Pharmaindustrie offen.
- In einer systematischen Übersichtsarbeit aus dem Jahr 2017 heißt es: "SSRIs scheinen im Vergleich zu Placebo statistisch signifikante Auswirkungen auf depressive Symptome zu haben, aber die klinische Signifikanz dieser Auswirkungen scheint fraglich zu sein, und alle Studien waren mit einem hohen Risiko für Verzerrungen behaftet. Darüber hinaus erhöhen SSRI im Vergleich zu Placebo signifikant das Risiko für schwerwiegende und nicht schwerwiegende unerwünschte Ereignisse. Unsere Ergebnisse zeigen, dass die schädlichen Wirkungen von SSRI im Vergleich zu Placebo bei schweren depressiven Störungen die möglicherweise geringen positiven Wirkungen zu überwiegen scheinen". Fredrik Hieronymus et al. kritisierten die Übersichtsarbeit als ungenau und irreführend, legten aber auch mehrfache Verbindungen zur Pharmaindustrie und den Erhalt von Sprecherhonoraren offen. ⓘ
Im Jahr 2018 zeigte eine systematische Überprüfung und Netzwerk-Metaanalyse, die die Wirksamkeit und Akzeptanz von 21 Antidepressiva verglich, dass Escitalopram eines der wirksamsten ist. ⓘ
Bei Kindern gibt es Bedenken hinsichtlich der Qualität der Belege für die Aussagekraft der beobachteten Vorteile. Wenn ein Medikament eingesetzt wird, scheint Fluoxetin die erste Wahl zu sein. ⓘ
Soziale Angststörung
Einige SSRI sind bei sozialen Angststörungen wirksam, auch wenn ihre Wirkung auf die Symptome nicht immer überzeugend ist und ihr Einsatz manchmal zugunsten von psychologischen Therapien abgelehnt wird. Paroxetin war das erste für soziale Angststörungen zugelassene Medikament und gilt als wirksam für diese Störung, Sertralin und Fluvoxamin wurden später ebenfalls für diese Störung zugelassen, Escitalopram und Citalopram werden off-label mit akzeptabler Wirksamkeit eingesetzt, während Fluoxetin als nicht wirksam für diese Störung gilt. ⓘ
Posttraumatische Belastungsstörung
PTBS ist relativ schwer zu behandeln, und die Behandlung ist im Allgemeinen nicht sehr wirksam; SSRI bilden hier keine Ausnahme. Sie sind bei dieser Störung nicht sehr wirksam und nur zwei SSRI sind von der FDA für diese Erkrankung zugelassen, Paroxetin und Sertralin. Paroxetin hat etwas höhere Ansprech- und Remissionsraten bei PTBS als Sertralin, aber beide sind bei vielen Patienten nicht voll wirksam. Fluoxetin wird off-label eingesetzt, allerdings mit gemischten Ergebnissen; Venlafaxin, ein SNRI, gilt als einigermaßen wirksam, wird aber ebenfalls off-label eingesetzt. Fluvoxamin, Escitalopram und Citalopram sind bei dieser Störung nicht gut erprobt. Paroxetin ist nach wie vor das am besten geeignete Medikament für PTBS, allerdings mit begrenztem Nutzen. ⓘ
Generalisierte Angststörung
SSRI werden vom National Institute for Health and Care Excellence (NICE) für die Behandlung der generalisierten Angststörung (GAD) empfohlen, die auf konservative Maßnahmen wie Aufklärung und Selbsthilfeaktivitäten nicht anspricht. GAD ist eine weit verbreitete Störung, deren zentrales Merkmal die übermäßige Sorge um eine Reihe verschiedener Ereignisse ist. Zu den Hauptsymptomen gehören übermäßige Ängste vor verschiedenen Ereignissen und Problemen sowie Schwierigkeiten bei der Kontrolle beunruhigender Gedanken, die mindestens sechs Monate lang anhalten. ⓘ
Antidepressiva bewirken bei GAD eine mäßige bis leichte Verringerung der Ängste und sind bei der Behandlung von GAD einem Placebo überlegen. Die Wirksamkeit der verschiedenen Antidepressiva ist ähnlich. ⓘ
Zwangsneurosen
In Kanada gehören SSRI zur Erstbehandlung von Zwangsstörungen (OCD) bei Erwachsenen. Im Vereinigten Königreich werden sie nur bei mittelschwerer bis schwerer funktioneller Beeinträchtigung als Erstlinientherapie und bei leichter Beeinträchtigung als Zweitlinientherapie eingesetzt, obwohl diese Empfehlung Anfang 2019 überprüft wird. Bei Kindern können SSRI bei mittelschwerer bis schwerer Beeinträchtigung als Zweitlinientherapie in Betracht gezogen werden, wobei sie engmaschig auf psychiatrische Nebenwirkungen überwacht werden. SSRI, insbesondere Fluvoxamin, das als erstes Medikament von der FDA für die Behandlung von Zwangsstörungen zugelassen wurde, sind wirksam; bei Patienten, die mit SSRI behandelt werden, ist die Wahrscheinlichkeit, dass sie auf die Behandlung ansprechen, etwa doppelt so hoch wie bei Patienten, die mit Placebo behandelt werden. Die Wirksamkeit wurde sowohl in Kurzzeitbehandlungsstudien von 6 bis 24 Wochen als auch in Absetzstudien von 28 bis 52 Wochen Dauer nachgewiesen. ⓘ
Panikstörung
Paroxetin CR war Placebo bei der primären Ergebnismessung überlegen. In einer randomisierten, kontrollierten 10-Wochen-Doppelblindstudie war Escitalopram wirksamer als Placebo. Fluvoxamin, ein weiterer SSRI, hat positive Ergebnisse gezeigt. Die Nachweise für ihre Wirksamkeit und Akzeptanz sind jedoch unklar. ⓘ
Essstörungen
Antidepressiva werden bei der Behandlung von Bulimia nervosa als Alternative oder zusätzlicher erster Schritt zu Selbsthilfeprogrammen empfohlen. SSRIs (insbesondere Fluoxetin) werden aufgrund ihrer Akzeptanz, Verträglichkeit und der besseren Symptomlinderung in Kurzzeitstudien anderen Antidepressiva vorgezogen. Die langfristige Wirksamkeit ist noch unzureichend beschrieben. ⓘ
Ähnliche Empfehlungen gelten für die Binge-Eating-Störung. SSRI bewirken zwar eine kurzfristige Verringerung des Essverhaltens, wurden aber nicht mit einer signifikanten Gewichtsabnahme in Verbindung gebracht. ⓘ
Klinische Studien haben überwiegend negative Ergebnisse für den Einsatz von SSRI bei der Behandlung von Anorexia nervosa erbracht. Die Behandlungsrichtlinien des National Institute of Health and Clinical Excellence raten von der Verwendung von SSRI bei dieser Störung ab. In den Leitlinien der American Psychiatric Association wird darauf hingewiesen, dass SSRI keinen Vorteil in Bezug auf die Gewichtszunahme bieten, dass sie aber zur Behandlung von gleichzeitig bestehenden Depressionen, Angstzuständen oder Zwangsstörungen eingesetzt werden können. ⓘ
Erholung nach Schlaganfall
SSRI wurden in der Off-Label-Behandlung von Schlaganfallpatienten eingesetzt, auch bei Patienten mit und ohne depressive Symptome. Eine Metaanalyse randomisierter, kontrollierter klinischer Studien aus dem Jahr 2019 ergab eine statistisch signifikante Wirkung von SSRI auf Abhängigkeit, neurologische Defizite, Depressionen und Angstzustände, doch die Studien wiesen ein hohes Risiko der Verzerrung auf. Es gibt keine verlässlichen Hinweise darauf, dass sie routinemäßig zur Förderung der Genesung nach einem Schlaganfall eingesetzt werden. Das Thromboserisiko wird verringert, weil SSRI die Verfügbarkeit von Serotonin für die Blutplättchen einschränken, so dass die Vorteile einer verringerten Gerinnungsneigung, wie z. B. die Erholung nach einem Schlaganfall, mit SSRI zunehmen. ⓘ
Vorzeitige Ejakulation
Ein Vorteil für die Anwendung der SSRI ist, dass die meisten Präparate nur einmal täglich gegeben werden müssen, was die Therapietreue (Compliance) der Patienten erhöht. Allerdings tritt die antidepressive Wirkung bei SSRIs erst mit Verzögerung ein, was zu Beginn einer Behandlung Disziplin der Patienten voraussetzt und eine entsprechende Beratung notwendig macht. Diese zeitliche Verzögerung der Wirkung gilt ähnlich auch für die meisten anderen Indikationen und ist einer der Gründe, warum SSRI sich nicht zur schnellen Behandlung aus direktem Anlass, z. B. bei einer akuten Panikattacke, eignen, sondern eine regelmäßige Einnahme über einen längeren Zeitraum erfordern. ⓘ
SSRI sind bei korrekter Anwendung relativ nebenwirkungsarm und sicher. Die beschriebenen Nebenwirkungen treten dabei, im Unterschied zur gewünschten Wirkung, überwiegend nur in den ersten Tagen auf. ⓘ
Andere Verwendungen
SSRI wie Sertralin haben sich als wirksam bei der Verringerung der Wut erwiesen. ⓘ
Nebenwirkungen
Bei langfristiger Einnahme von SSRI-Antidepressiva erhöht sich das Risiko, Karies zu erleiden. Die Mundtrockenheit, die durch SSRI und eine Reihe weiterer Antidepressiva hervorgerufen wird, und die damit verbundenen nachteiligen Folgen auf die Mundflora werden als ausschlaggebende Ursachen angenommen. Die Mundtrockenheit ist ein typisches anticholinerges Symptom, welches bei den stärker anticholinerg wirkenden trizyklischen Antidepressiva häufiger und stärker auftritt als bei SSRIs. ⓘ
Die Nebenwirkungen sind bei den einzelnen Arzneimitteln dieser Klasse unterschiedlich und können Folgendes umfassen:
- erhöhtes Risiko von Knochenbrüchen
- Akathisie
- Suizidgedanken (Selbstmordgedanken) und andere Risiken (siehe unten) ⓘ
Sexuelle Dysfunktion
SSRI können verschiedene Arten sexueller Funktionsstörungen wie Anorgasmie, erektile Dysfunktion, verminderte Libido, Taubheit im Genitalbereich und sexuelle Anhedonie (lustloser Orgasmus) verursachen. Sexuelle Probleme sind bei SSRIs weit verbreitet. Während die ersten Studien Nebenwirkungen bei 5-15 % der Anwender zeigten (basierend auf spontanen Berichten der Anwender), haben spätere Studien (basierend auf direkter Befragung der Patienten) Nebenwirkungsraten von 36 % bis 98 % ergeben. Eine schlechte sexuelle Funktion ist auch einer der häufigsten Gründe für das Absetzen des Medikaments. ⓘ
In einigen Fällen können die Symptome einer sexuellen Funktionsstörung auch nach dem Absetzen von SSRIs fortbestehen. Diese Kombination von Symptomen wird manchmal als Post-SSRI Sexual Dysfunction (PSSD) bezeichnet. Am 11. Juni 2019 kam der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz der Europäischen Arzneimittel-Agentur zu dem Schluss, dass ein möglicher Zusammenhang zwischen der Einnahme von SSRI und anhaltenden sexuellen Funktionsstörungen nach Beendigung der Einnahme besteht. Der Ausschuss kam zu dem Schluss, dass auf dem Etikett von SSRI und SNRI ein Warnhinweis zu diesem möglichen Risiko hinzugefügt werden sollte. ⓘ
Der Mechanismus, durch den SSRI sexuelle Nebenwirkungen hervorrufen können, ist bis 2021 noch nicht genau bekannt. Das Spektrum möglicher Mechanismen umfasst (1) unspezifische neurologische Wirkungen (z. B. Sedierung), die das Verhalten einschließlich der Sexualfunktion global beeinträchtigen; (2) spezifische Wirkungen auf Gehirnsysteme, die die Sexualfunktion vermitteln; (3) spezifische Wirkungen auf periphere Gewebe und Organe, wie den Penis, die die Sexualfunktion vermitteln; und (4) direkte oder indirekte Wirkungen auf Hormone, die die Sexualfunktion vermitteln. Zu den Behandlungsstrategien gehören: bei Erektionsstörungen die Zugabe eines PDE5-Hemmers wie Sildenafil; bei verminderter Libido möglicherweise die Zugabe von oder die Umstellung auf Bupropion; und bei allgemeiner sexueller Dysfunktion die Umstellung auf Nefazodon. ⓘ
Eine Reihe von Nicht-SSRI-Medikamenten wird nicht mit sexuellen Nebenwirkungen in Verbindung gebracht (z. B. Bupropion, Mirtazapin, Tianeptin, Agomelatin und Moclobemid). ⓘ
Mehrere Studien deuten darauf hin, dass SSRI die Qualität des Spermas beeinträchtigen können. ⓘ
Trazodon (ein Antidepressivum mit alpha-adrenerger Rezeptorblockade) ist ein berüchtigter Auslöser von Priapismus, aber auch bei bestimmten SSRI (z. B. Fluoxetin, Citalopram) wurden Fälle von Priapismus berichtet. ⓘ
Emotionale Abstumpfung
Bestimmte Antidepressiva können zu einer emotionalen Abstumpfung führen, die durch eine verringerte Intensität sowohl positiver als auch negativer Emotionen sowie durch Symptome von Apathie, Gleichgültigkeit und Amotivation gekennzeichnet ist. Dies kann je nach Situation als vorteilhaft oder nachteilig empfunden werden. Diese Nebenwirkung wird vor allem mit serotonergen Antidepressiva wie SSRI und SNRI in Verbindung gebracht, kann aber bei atypischen Antidepressiva wie Bupropion, Agomelatin und Vortioxetin geringer ausfallen. Höhere Dosen von Antidepressiva scheinen eher zu emotionalem Abstumpfen zu führen als niedrigere Dosen. Sie kann verringert werden, indem die Dosis reduziert, das Medikament abgesetzt oder auf ein anderes Antidepressivum umgestellt wird, das weniger zu dieser Nebenwirkung neigt. ⓘ
Gewalt
Der Forscher David Healy und andere haben die verfügbaren Daten geprüft und sind zu dem Schluss gekommen, dass SSRI bei Erwachsenen und Kindern sowohl während der Therapie als auch während des Entzugs zu mehr Gewalttätigkeit führen. Diese Ansicht wird auch von einigen Patientenaktivistengruppen geteilt. ⓘ
Sehkraft
Das akute Engwinkelglaukom ist die häufigste und wichtigste okuläre Nebenwirkung von SSRI und wird häufig fehldiagnostiziert. ⓘ
Herz
SSRI scheinen das Risiko einer koronaren Herzkrankheit (KHK) bei Personen, bei denen noch keine KHK diagnostiziert wurde, nicht zu beeinflussen. Eine große Kohortenstudie deutet darauf hin, dass die Einnahme von SSRI während des ersten Trimesters der Schwangerschaft das Risiko für Herzfehlbildungen nicht wesentlich erhöht. In einer Reihe von großen Studien mit Personen ohne bekannte vorbestehende Herzerkrankung wurden keine EKG-Veränderungen im Zusammenhang mit der Einnahme von SSRI festgestellt. Die empfohlene Tageshöchstdosis von Citalopram und Escitalopram wurde aufgrund von Bedenken hinsichtlich einer QT-Verlängerung reduziert. Bei Überdosierung wurde berichtet, dass Fluoxetin Sinustachykardie, Myokardinfarkt, junktionale Rhythmen und Trigeminus hervorrufen kann. Einige Autoren haben eine elektrokardiografische Überwachung bei Patienten mit schweren vorbestehenden kardiovaskulären Erkrankungen, die SSRI einnehmen, empfohlen. ⓘ
Blutungen
Unter der Einnahme von SSRI kann es zu einer Beeinträchtigung der Thrombozytenfunktion und damit der Blutgerinnung kommen. Die Freisetzung von Serotonin aus den Thrombozyten spielt eine wichtige Rolle bei der Regulierung der hämostatischen Antwort auf die vaskuläre Verletzung. Serotonin wir dabei nicht in den Thrombozyten gebildet, sondern aus dem Blutkreislauf durch Serotonintransporter in die Blutplättchen aufgenommen. In therapeutischer Dosis blockieren Fluoxetin und andere SSRI die Aufnahme von Serotonin in die Thrombozyten. Das führt nach einigen Wochen zu einer Verarmung an Serotonin. Hierdurch wird das Blutungsrisiko erhöht. Klinische Symptome sind z. B. das spontane Auftreten von blauen Flecken (Hämatome), Nasenbluten oder bei Frauen eine verstärkte Menstruationsblutung. Auch wenn diese Blutungen aus medizinischer Sicht als „harmlos“ eingeordnet werden, können sie für den Betroffenen ein Grund zur Besorgnis sein, besonders wenn er deren Ursache nicht kennt. Die Kombination eines SSRI mit Medikamenten, die direkt oder indirekt das Blutungsrisiko steigern, erhöht die Wahrscheinlichkeit von gastrointestinale Blutungen um 43 % (Chancenverhältnis: 1,43; 95 % Konfidenzintervall: 1,09–1,89). Die gleichzeitige Therapie mit Protonenpumpenhemmer senkte das Risiko deutlich. ⓘ
Bei Risikopatienten wird ausdrücklich vor der unbedachten Kombination eines SSRI mit z. B. Aspirin (Acetylsalicylsäure) oder anderen nicht-steroidalen Entzündungshemmern wie Indomethacin, Phenylbutazon, Naproxen, Ibuprofen oder Fenoprofen gewarnt. Als besonders gefährdet gelten Patienten über 65 Jahre, die in ihrer Vorgeschichte schon einmal ein Magengeschwür bzw. eine Magendarmblutung hatten. Hier ist zu bedenken, dass gerade bei älteren Menschen Ärzte unterschiedlicher Fachrichtungen aus ihrer jeweiligen Sicht oft Medikamente verordnen, ohne einen Gesamtüberblick über die schon verordnete Medikation zu haben, sodass sie das Risiko eventuell auftretender Wechselwirkungen nicht immer gebührend einschätzen. ⓘ
Frakturrisiko
Belege aus Längsschnitt-, Querschnitt- und prospektiven Kohortenstudien deuten auf einen Zusammenhang zwischen der Einnahme von SSRI in therapeutischen Dosen und einer Abnahme der Knochenmineraldichte sowie einem erhöhten Frakturrisiko hin, ein Zusammenhang, der auch bei einer adjuvanten Bisphosphonattherapie bestehen zu bleiben scheint. Da der Zusammenhang zwischen SSRI und Frakturen jedoch auf Beobachtungsdaten und nicht auf prospektiven Studien beruht, ist das Phänomen nicht definitiv kausal. Außerdem scheint es bei der Einnahme von SSRI vermehrt zu frakturbedingten Stürzen zu kommen, was darauf hindeutet, dass bei älteren Patienten, die diese Medikamente einnehmen, verstärkt auf das Sturzrisiko geachtet werden muss. Der Verlust der Knochendichte scheint bei jüngeren Patienten, die SSRI einnehmen, nicht aufzutreten. ⓘ
Bruxismus
SSRI- und SNRI-Antidepressiva können ein reversibles Syndrom aus Kieferschmerzen und Kieferkrämpfen verursachen (obwohl dies nicht häufig vorkommt). Buspiron scheint bei der Behandlung von Bruxismus bei SSRI/SNRI-induziertem Kieferknirschen erfolgreich zu sein. ⓘ
Absetzsyndrom
Serotonin-Wiederaufnahmehemmer sollten nach einer längeren Therapie nicht abrupt abgesetzt werden, sondern, wann immer möglich, über mehrere Wochen reduziert werden, um absetzbedingte Symptome wie Übelkeit, Kopfschmerzen, Schwindel, Schüttelfrost, Körperschmerzen, Parästhesien, Schlaflosigkeit und Hirnströme zu minimieren. Paroxetin kann häufiger als andere SSRIs absetzungsbedingte Symptome hervorrufen, obwohl für alle SSRIs qualitativ ähnliche Wirkungen berichtet wurden. Bei Fluoxetin scheinen die Absetzerscheinungen geringer zu sein, was möglicherweise auf seine lange Halbwertszeit und den natürlichen Verjüngungseffekt zurückzuführen ist, der mit seiner langsamen Ausscheidung aus dem Körper einhergeht. Eine Strategie zur Minimierung von SSRI-Absetzsymptomen besteht darin, den Patienten auf Fluoxetin umzustellen und dann das Fluoxetin auszuschleichen und abzusetzen. ⓘ
Serotonin-Syndrom
Das Serotonin-Syndrom wird in der Regel durch die Einnahme von zwei oder mehr serotonergen Arzneimitteln, einschließlich SSRI, verursacht. Das Serotonin-Syndrom ist ein Zustand, der von leicht (am häufigsten) bis tödlich reichen kann. Leichte Symptome können aus erhöhter Herzfrequenz, Fieber, Schüttelfrost, Schwitzen, erweiterten Pupillen, Myoklonus (intermittierendes Zucken oder Zucken) sowie Hyperreflexie bestehen. Die gleichzeitige Einnahme von SSRIs oder SNRIs zur Behandlung von Depressionen mit einem Triptan zur Behandlung von Migräne scheint das Risiko eines Serotonin-Syndroms nicht zu erhöhen. Die Einnahme von Monoaminoxidase-Hemmern (MAOI) in Kombination mit SSRI kann tödlich sein, da MAOI die Monoaminoxidase stören, ein Enzym, das für den Abbau von Serotonin und anderen Neurotransmittern benötigt wird. Ohne Monoaminoxidase ist der Körper nicht in der Lage, überschüssige Neurotransmitter auszuscheiden, so dass sie sich in gefährlichen Mengen anreichern können. Wenn das Serotonin-Syndrom richtig erkannt wird, sind die Aussichten auf eine Genesung in einem Krankenhaus im Allgemeinen gut. Die Behandlung besteht aus dem Absetzen aller serotonergen Medikamente und einer unterstützenden Pflege zur Behandlung von Unruhe und Hyperthermie, in der Regel mit Benzodiazepinen. ⓘ
Suizidrisiko
Kinder und Heranwachsende
Meta-Analysen von randomisierten klinischen Kurzzeitstudien haben ergeben, dass die Einnahme von SSRI mit einem höheren Risiko für suizidales Verhalten bei Kindern und Jugendlichen verbunden ist. So ergab eine Analyse klinischer Studien der US-amerikanischen Food and Drug Administration (FDA) aus dem Jahr 2004 bei Kindern mit schweren depressiven Störungen einen statistisch signifikanten Anstieg des Risikos "möglicher Suizidgedanken und suizidalen Verhaltens" um etwa 80 % und von Unruhe und Feindseligkeit um etwa 130 %. Nach Angaben der FDA besteht das erhöhte Suizidrisiko innerhalb der ersten ein bis zwei Monate der Behandlung. Das National Institute for Health and Care Excellence (NICE) sieht das erhöhte Risiko in den "frühen Phasen der Behandlung". Die European Psychiatric Association sieht das übermäßige Risiko in den ersten zwei Wochen der Behandlung und kommt auf der Grundlage einer Kombination aus epidemiologischen Daten, Daten aus prospektiven Kohorten, Daten zu medizinischen Leistungen und Daten aus randomisierten klinischen Studien zu dem Schluss, dass nach diesem frühen Zeitraum ein Schutzeffekt überwiegt. Ein Cochrane-Review aus dem Jahr 2014 ergab, dass bei Kindern, die mit Antidepressiva behandelt wurden, auch nach sechs bis neun Monaten noch häufiger Suizidgedanken auftraten als bei Kindern, die eine psychologische Therapie erhielten. ⓘ
Ein kürzlich durchgeführter Vergleich von Aggression und Feindseligkeit, die während der Behandlung mit Fluoxetin auftraten, mit Placebo bei Kindern und Jugendlichen ergab keinen signifikanten Unterschied zwischen der Fluoxetin-Gruppe und einer Placebo-Gruppe. Es gibt auch Hinweise darauf, dass eine höhere Verschreibungsrate von SSRI mit einer niedrigeren Selbstmordrate bei Kindern in Verbindung steht, da es sich jedoch um Korrelationen handelt, ist die tatsächliche Art der Beziehung unklar. ⓘ
Im Jahr 2004 beurteilte die britische Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) Fluoxetin (Prozac) als einziges Antidepressivum, das bei Kindern mit Depressionen ein günstiges Nutzen-Risiko-Verhältnis aufwies, obwohl es auch mit einem leicht erhöhten Risiko für Selbstverletzungen und Suizidgedanken verbunden war. Im Vereinigten Königreich sind nur zwei SSRI für die Behandlung von Kindern zugelassen: Sertralin (Zoloft) und Fluvoxamin (Luvox), und auch nur für die Behandlung von Zwangsstörungen. Fluoxetin ist für diese Anwendung nicht zugelassen. ⓘ
Bereits 2004 wurde die Anwendung von Paroxetin als Antidepressivum bei unter 18-Jährigen als kontraindiziert eingestuft. Unter Berücksichtigung des Suizidrisikos bei Nichtbehandlung und der Datenlage zur Wirksamkeit gilt Fluoxetin als Mittel der Wahl, wenn eine medikamentöse Therapie dennoch erwogen wird. Eine retrospektive Studie von über 36.000 Kindern und Jugendlichen unter SSRI- oder SNRI-Behandlung in den USA zeigte 2013, dass Sertralin, Paroxetin, Citalopram, Escitalopram und Venlafaxin ein mit Fluoxetin vergleichbares Suizidrisiko in dieser Altersgruppe besitzen. ⓘ
Erwachsene
Es ist unklar, ob SSRI das Risiko von Suizidalität bei Erwachsenen beeinflussen.
- Eine Meta-Analyse der Daten von Arzneimittelherstellern aus dem Jahr 2005 ergab keine Hinweise darauf, dass SSRI das Suizidrisiko erhöhen; wichtige schützende oder gefährliche Effekte konnten jedoch nicht ausgeschlossen werden.
- In einer Übersichtsarbeit aus dem Jahr 2005 wurde festgestellt, dass Selbstmordversuche bei Personen, die SSRI einnehmen, im Vergleich zu Placebo und im Vergleich zu anderen therapeutischen Maßnahmen als trizyklischen Antidepressiva erhöht sind. Zwischen SSRI und trizyklischen Antidepressiva wurde kein Unterschied im Risiko von Selbstmordversuchen festgestellt.
- Andererseits deutet eine Übersichtsarbeit aus dem Jahr 2006 darauf hin, dass der weit verbreitete Einsatz von Antidepressiva in der neuen "SSRI-Ära" in den meisten Ländern mit traditionell hohen Selbstmordraten zu einem hochsignifikanten Rückgang der Selbstmordraten geführt zu haben scheint. Besonders auffällig ist der Rückgang bei Frauen, die im Vergleich zu Männern häufiger Hilfe wegen Depressionen in Anspruch nehmen. Jüngste klinische Daten zu großen Stichproben in den USA haben ebenfalls eine schützende Wirkung von Antidepressiva gegen Selbstmord gezeigt.
- Eine Meta-Analyse von randomisierten kontrollierten Studien aus dem Jahr 2006 deutet darauf hin, dass SSRIs im Vergleich zu Placebo die Suizidgedanken verstärken. Die Beobachtungsstudien legen jedoch nahe, dass SSRI das Suizidrisiko nicht stärker erhöhen als ältere Antidepressiva. Die Forscher erklärten, dass, wenn SSRI bei einigen Patienten das Selbstmordrisiko erhöhen, die Zahl der zusätzlichen Todesfälle sehr gering ist, da ökologische Studien im Allgemeinen ergeben haben, dass die Selbstmordsterblichkeit mit zunehmendem Einsatz von SSRI zurückgegangen (oder zumindest nicht gestiegen) ist.
- Eine weitere Meta-Analyse der FDA aus dem Jahr 2006 ergab eine altersabhängige Wirkung von SSRIs. Die Ergebnisse zeigten, dass bei Erwachsenen unter 25 Jahren ein höheres Risiko für suizidales Verhalten besteht. Bei Erwachsenen zwischen 25 und 64 Jahren scheint die Wirkung auf die Suizidalität neutral zu sein, während sie bei Erwachsenen zwischen 25 und 64 Jahren möglicherweise schützend auf die Suizidalität wirkt. Bei Erwachsenen, die älter als 64 Jahre sind, scheinen SSRI das Risiko von Suizidalität und Suizidalität zu verringern.
- Im Jahr 2016 kritisierte eine Studie die Auswirkungen der FDA-Black-Box-Suizidwarnung in der Verschreibung. Die Autoren erörterten, dass die Suizidrate auch als Folge der Warnung steigen könnte. ⓘ
Risiko des Todes
Eine Metaanalyse aus dem Jahr 2017 ergab, dass Antidepressiva einschließlich SSRI in der Allgemeinbevölkerung mit einem signifikant erhöhten Risiko für Tod (+33 %) und neue kardiovaskuläre Komplikationen (+14 %) verbunden waren. Bei Menschen mit bestehenden Herz-Kreislauf-Erkrankungen war das Risiko dagegen nicht erhöht. ⓘ
Schwangerschaft und Stillen
Die Einnahme von SSRI in der Schwangerschaft wurde mit einer Vielzahl von Risiken in Verbindung gebracht, wobei der Nachweis der Kausalität in unterschiedlichem Maße erbracht wurde. Da Depressionen unabhängig voneinander mit negativen Schwangerschaftsergebnissen in Verbindung gebracht werden, ist es in einigen Fällen schwierig, festzustellen, inwieweit die beobachteten Zusammenhänge zwischen der Einnahme von Antidepressiva und bestimmten unerwünschten Ergebnissen auf einen ursächlichen Zusammenhang zurückzuführen sind. In anderen Fällen scheint die Zuordnung der negativen Folgen zur Antidepressiva-Exposition ziemlich eindeutig zu sein. ⓘ
Die Einnahme von SSRI in der Schwangerschaft ist mit einem etwa 1,7-fach erhöhten Risiko eines Spontanaborts verbunden. Die Einnahme wird auch mit Frühgeburten in Verbindung gebracht. ⓘ
Eine systematische Überprüfung des Risikos schwerer Geburtsfehler bei Schwangerschaften unter Antidepressiva-Exposition ergab einen geringen Anstieg (3 % bis 24 %) des Risikos schwerer Missbildungen und ein Risiko für kardiovaskuläre Geburtsfehler, das sich nicht von dem nicht-exponierter Schwangerschaften unterschied. In anderen Studien wurde ein erhöhtes Risiko für kardiovaskuläre Geburtsfehler bei depressiven Müttern festgestellt, die sich keiner SSRI-Behandlung unterzogen, was auf die Möglichkeit eines Erfassungsfehlers hindeutet, z. B. dass besorgte Mütter aggressivere Tests bei ihren Kindern durchführen lassen. In einer anderen Studie wurde kein Anstieg von kardiovaskulären Geburtsfehlern und ein um 27 % erhöhtes Risiko für schwerwiegende Fehlbildungen bei Schwangerschaften unter SSRI-Exposition festgestellt. ⓘ
Die FDA gab am 19. Juli 2006 eine Erklärung ab, wonach stillende Mütter, die SSRI einnehmen, die Behandlung mit ihren Ärzten besprechen müssen. Die medizinische Fachliteratur über die Sicherheit von SSRIs hat jedoch ergeben, dass einige SSRIs wie Sertralin und Paroxetin als sicher für das Stillen gelten. ⓘ
Eine Publikation im American Journal of Obstetrics and Gynecology vom April 2006 warnte vor einem erhöhten Risiko von Früh- und Totgeburten, niedrigem Geburtsgewicht und Krampfanfällen bei Neugeborenen nach SSRI-Einnahme der Mutter. Das erhöhte Risiko für Neugeborene wurde in einer im August 2006 publizierten Studie nochmals für alle SSRI bestätigt. ⓘ
Neonatales Abstinenzsyndrom
Mehrere Studien haben das neonatale Abstinenzsyndrom dokumentiert, ein Syndrom mit neurologischen, gastrointestinalen, autonomen, endokrinen und/oder respiratorischen Symptomen bei einer großen Minderheit von Säuglingen mit intrauteriner Exposition. Diese Syndrome sind kurzlebig, aber es liegen nicht genügend Langzeitdaten vor, um festzustellen, ob es langfristige Auswirkungen gibt. ⓘ
Persistierende pulmonale Hypertonie
Persistierende pulmonale Hypertonie (PPHN) ist eine ernste und lebensbedrohliche, aber sehr seltene Lungenerkrankung, die kurz nach der Geburt des Neugeborenen auftritt. Neugeborene mit PPHN haben einen hohen Druck in ihren Lungenblutgefäßen und können nicht genügend Sauerstoff in ihren Blutkreislauf bekommen. Etwa 1 bis 2 von 1000 Babys, die in den USA geboren werden, entwickeln kurz nach der Geburt eine PPHN, und oft brauchen sie intensive medizinische Betreuung. Sie ist mit einem Risiko von etwa 25 % für erhebliche langfristige neurologische Defizite verbunden. Eine Meta-Analyse aus dem Jahr 2014 ergab kein erhöhtes Risiko für eine persistierende pulmonale Hypertonie im Zusammenhang mit einer Exposition gegenüber SSRI in der Frühschwangerschaft und einen leichten Anstieg des Risikos bei einer Exposition in der Spätschwangerschaft; "schätzungsweise 286 bis 351 Frauen müssten in der Spätschwangerschaft mit einem SSRI behandelt werden, um durchschnittlich einen zusätzlichen Fall von persistierender pulmonaler Hypertonie des Neugeborenen zu verursachen". Eine im Jahr 2012 veröffentlichte Übersichtsarbeit kam zu sehr ähnlichen Schlussfolgerungen wie die Studie von 2014. ⓘ
Eine seltenere, aber weitaus gefährlichere Schädigung durch mütterliche SSRI-Einnahme ist die pulmonale Hypertonie (Bluthochdruck im Lungenkreislauf). Der Zusammenhang wurde durch eine Fall-Kontroll-Studie aufgedeckt, die zur Prüfung des Verdachts aus einer Kohortenstudie mit Fluoxetin dienen sollte. Die Pathophysiologie beruht vermutlich auf der Erhöhung des Serotoninspiegels im kindlichen Organismus – eine auffällige Parallele zu anderen bekannten Auslösemechanismen pulmonaler Hypertonie. ⓘ
Das Risiko ist dosisabhängig (Dosisreduktion vermindert die Gefährdung) und besteht vor allem ab der 20. Schwangerschaftswoche. Neugeborene mit dieser Form der dauerhaften pulmonalen Hypertonie haben eine verringerte Lebenserwartung. In knapp zehn Prozent der Fälle ist die Schädigung tödlich. Die Gefährdung wird mit etwa einem Prozent beziffert, d. h. eins von 100 Neugeborenen kommt nach SSRI-Einnahme der Mutter geschädigt zur Welt. ⓘ
Neuropsychiatrische Auswirkungen bei den Nachkommen
Einer 2015 veröffentlichten Übersichtsarbeit zufolge deuten die verfügbaren Daten darauf hin, dass eine vorgeburtliche Exposition gegenüber SSRI das Risiko von Autismus-Spektrum-Störungen (ASD) erhöhen könnte, auch wenn eine 2013 veröffentlichte große Kohortenstudie und eine 2016 veröffentlichte Kohortenstudie, die Daten aus dem nationalen Register Finnlands aus den Jahren 1996 bis 2010 verwendet, keinen signifikanten Zusammenhang zwischen SSRI-Einnahme und Autismus bei den Nachkommen feststellen konnten. In der finnischen Studie von 2016 wurde ebenfalls kein Zusammenhang mit ADHS festgestellt, wohl aber ein Zusammenhang mit erhöhten Raten von Depressionsdiagnosen im frühen Jugendalter. ⓘ
Überdosierung
Im Vergleich zu herkömmlichen Antidepressiva wie den trizyklischen Antidepressiva scheinen SSRI bei Überdosierung sicherer zu sein. Diese relative Sicherheit wird sowohl durch Fallserien als auch durch Studien über Todesfälle im Verhältnis zur Zahl der Verschreibungen belegt. Aus Fallberichten über SSRI-Vergiftungen geht jedoch hervor, dass schwere Vergiftungen auftreten können, und es wurde von Todesfällen nach massiver einmaliger Einnahme berichtet, obwohl dies im Vergleich zu den trizyklischen Antidepressiva äußerst selten ist. ⓘ
Aufgrund des breiten therapeutischen Index der SSRI haben die meisten Patienten nach einer moderaten Überdosierung leichte oder keine Symptome. Die am häufigsten gemeldete schwerwiegende Wirkung nach einer SSRI-Überdosierung ist das Serotonin-Syndrom; die Serotonin-Toxizität tritt in der Regel im Zusammenhang mit sehr hohen Überdosierungen oder der Einnahme mehrerer Medikamente auf. Andere gemeldete schwerwiegende Wirkungen sind Koma, Krampfanfälle und kardiale Toxizität. ⓘ
Bei Überdosierung von SSRI besteht die Gefahr, dass sich ein Serotoninsyndrom entwickelt, insbesondere wenn sie mit anderen Antidepressiva vom MAO-Hemmer-Typ kombiniert werden. SSRI sind meistens erst bei einer 50–100-fachen Überdosis tödlich. Bei einer Überdosierung kommt es oft zu psychoseartigen Zuständen. ⓘ
Bipolarer Wechsel
Bei Erwachsenen und Kindern mit bipolarer Störung können SSRIs einen bipolaren Wechsel von Depression zu Hypomanie/Manie verursachen. Wenn sie zusammen mit Stimmungsstabilisatoren eingenommen werden, ist das Risiko eines Wechsels nicht erhöht, bei der Einnahme von SSRI als Monotherapie kann das Risiko eines Wechsels jedoch doppelt oder dreimal so hoch sein wie im Durchschnitt. Die Veränderungen sind oft nicht leicht zu erkennen und erfordern eine Überwachung durch die Familie und psychosoziale Fachkräfte. Dieser Wechsel kann auch ohne vorangegangene (hypo)manische Episoden erfolgen und wird daher vom Psychiater möglicherweise nicht vorhergesehen. ⓘ
Wechselwirkungen
Die folgenden Arzneimittel können bei Patienten, die SSRI einnehmen, ein Serotonin-Syndrom auslösen:
- Linezolid
- Monoaminoxidase-Hemmer (MAOIs) einschließlich Moclobemid, Phenelzin, Tranylcypromin, Selegilin und Methylenblau
- Lithium
- Sibutramin
- MDMA (Ecstasy)
- Dextromethorphan
- Tramadol
- 5-HTP
- Pethidin/Meperidin
- Johanniskraut
- Yohimbe
- Trizyklische Antidepressiva (TCAs)
- Serotonin-Norepinephrin-Wiederaufnahmehemmer (SNRIs)
- Buspiron
- Triptan
- Mirtazapin ⓘ
Schmerzmittel aus der Familie der NSAIDs können die Wirksamkeit von SSRIs beeinträchtigen und verringern und das erhöhte Risiko von Magen-Darm-Blutungen bei der Einnahme von SSRIs verstärken. Zu den NSAIDs gehören:
Es gibt eine Reihe potenzieller pharmakokinetischer Wechselwirkungen zwischen den einzelnen SSRI und anderen Medikamenten. Die meisten dieser Wechselwirkungen ergeben sich aus der Tatsache, dass jeder SSRI die Fähigkeit besitzt, bestimmte P450-Cytochrome zu hemmen. ⓘ
| Name des Medikaments | CYP1A2 | CYP2C9 | CYP2C19 | CYP2D6 | CYP3A4 | CYP2B6 ⓘ |
|---|---|---|---|---|---|---|
| Citalopram | + | 0 | 0 | + | 0 | 0 |
| Escitalopram | 0 | 0 | 0 | + | 0 | 0 |
| Fluoxetin | + | ++ | +/++ | +++ | + | + |
| Fluvoxamin | +++ | ++ | +++ | + | + | + |
| Paroxetin | + | + | + | +++ | + | +++ |
| Sertralin | + | + | +/++ | + | + | + |
Legende:
0 - keine Hemmung
+ - leichte Hemmung
++ - mäßige Hemmung
+++ - starke Hemmung ⓘ
Das CYP2D6-Enzym ist vollständig für den Metabolismus von Hydrocodon, Codein und Dihydrocodein zu ihren aktiven Metaboliten (Hydromorphon, Morphin bzw. Dihydromorphin) verantwortlich, die ihrerseits einer Phase-2-Glucuronidierung unterzogen werden. Diese Opioide (und in geringerem Maße auch Oxycodon, Tramadol und Methadon) haben ein Interaktionspotenzial mit selektiven Serotonin-Wiederaufnahmehemmern. Die gleichzeitige Anwendung einiger SSRI (Paroxetin und Fluoxetin) mit Codein kann die Plasmakonzentration des aktiven Metaboliten Morphin verringern, was zu einer verminderten analgetischen Wirksamkeit führen kann. ⓘ
Eine weitere wichtige Wechselwirkung bestimmter SSRI betrifft Paroxetin, einen starken Inhibitor von CYP2D6, und Tamoxifen, einen Wirkstoff, der häufig bei der Behandlung und Prävention von Brustkrebs eingesetzt wird. Tamoxifen ist ein Prodrug, das durch das hepatische Cytochrom-P450-Enzymsystem, insbesondere CYP2D6, zu seinen aktiven Metaboliten metabolisiert wird. Die gleichzeitige Einnahme von Paroxetin und Tamoxifen bei Frauen mit Brustkrebs ist mit einem höheren Sterberisiko verbunden, das bei den Frauen, die es am längsten eingenommen haben, bis zu 91 % beträgt. ⓘ
Alle SSRIs sind starke Inhibitoren der Cytochrom P450-Isoenzyme (insbesondere Paroxetin und Fluoxetin) und hemmen so z. B. die Aktivierung von Codein und den Abbau von Benzodiazepinen. Die Kombination mit dem Hustenblocker Dextromethorphan, der häufig in rezeptfreien Grippemitteln enthalten ist, kann zu psychotischem Verhalten führen. ⓘ
Liste der SSRIs
Im Handel erhältlich
Antidepressiva
- Citalopram (Celexa)
- Escitalopram (Lexapro)
- Fluoxetin (Prozac)
- Fluvoxamin (Luvox)
- Paroxetin (Paxil)
- Sertralin (Zoloft) ⓘ
| ⓘ | ||||||
|---|---|---|---|---|---|---|
 Citalopram Citalopram
|
 Escitalopram Escitalopram
|
 Fluoxetin Fluoxetin
|
 Fluvoxamin Fluvoxamin
|
 Paroxetin Paroxetin
|
 Sertralin Sertralin
| |
Andere
- Dapoxetin (Priligy) ⓘ
| ⓘ |
|---|
 Dapoxetin Dapoxetin
|
Abgekündigt
Antidepressiva
- Indalpin (Upstène)
- Zimelidin (Zelmid) ⓘ
| ⓘ | |
|---|---|
 Indalpin Indalpin
|
 Zimelidin Zimelidin
|
Nie vermarktet
Antidepressiva
- Alaproclat (GEA-654)
- Centpropazin
- Cericlamin (JO-1017)
- Femoxetin (Malexil; FG-4963)
- Ifoxetin (CGP-15210)
- Omiloxetin
- Panuramin (WY-26002)
- Pirandamin (AY-23713)
- Seproxetin ((S)-Norfluoxetin) ⓘ
| ⓘ | |||||||
|---|---|---|---|---|---|---|---|
 Alaproclat Alaproclat
|
 Cericlamin Cericlamin
|
 Femoxetin Femoxetin
|
 Ifoxetin Ifoxetin
|
 Omiloxetin Omiloxetin
|
 Pirandamin Pirandamin
|
 Seproxetin Seproxetin
| |
Verwandte Medikamente
Obwohl sie als SNRIs bezeichnet werden, sind Duloxetin (Cymbalta), Venlafaxin (Effexor) und Desvenlafaxin (Pristiq) als Serotonin-Wiederaufnahmehemmer (SRIs) tatsächlich relativ selektiv. Sie sind mindestens 10-fach selektiv für die Hemmung der Serotonin-Wiederaufnahme gegenüber der Noradrenalin-Wiederaufnahme. Das Selektivitätsverhältnis beträgt etwa 1:30 für Venlafaxin, 1:10 für Duloxetin und 1:14 für Desvenlafaxin. Bei niedrigen Dosen wirken diese SNRI hauptsächlich als SSRI; erst bei höheren Dosen hemmen sie auch die Wiederaufnahme von Noradrenalin. Milnacipran (Ixel, Savella) und sein Stereoisomer Levomilnacipran (Fetzima) sind die einzigen weit verbreiteten SNRI, die Serotonin und Noradrenalin in ähnlichem Maße hemmen, beide mit einem Verhältnis von nahezu 1:1. ⓘ
Vilazodon (Viibryd) und Vortioxetin (Trintellix) sind SRI, die ebenfalls als Modulatoren von Serotoninrezeptoren wirken und als Serotonin-Modulatoren und -Stimulatoren (SMS) bezeichnet werden. Vilazodon ist ein partieller 5-HT1A-Rezeptor-Agonist, während Vortioxetin ein 5-HT1A-Rezeptor-Agonist und 5-HT3- und 5-HT7-Rezeptor-Antagonist ist. Litoxetin (SL 81-0385) und Lubazodon (YM-992, YM-35995) sind ähnliche Arzneimittel, die nie auf den Markt gebracht wurden. Sie sind SRIs und Litoxetin ist ebenfalls ein 5-HT3-Rezeptor-Antagonist, während Lubazodon auch ein 5-HT2A-Rezeptor-Antagonist ist. ⓘ
Mechanismus der Wirkung
Hemmung der Serotonin-Wiederaufnahme
Im Gehirn werden Nachrichten von einer Nervenzelle zu einer anderen über eine chemische Synapse, einen kleinen Spalt zwischen den Zellen, weitergeleitet. Die präsynaptische Zelle, die die Informationen sendet, gibt Neurotransmitter, darunter Serotonin, in diesen Spalt ab. Die Neurotransmitter werden dann von Rezeptoren auf der Oberfläche der empfangenden postsynaptischen Zelle erkannt, die auf diese Stimulation hin das Signal weiterleitet. Etwa 10 % der Neurotransmitter gehen bei diesem Vorgang verloren; die anderen 90 % werden von den Rezeptoren freigesetzt und von Monoamintransportern wieder in die sendende präsynaptische Zelle aufgenommen, ein Vorgang, der als Reuptake bezeichnet wird. ⓘ
SSRIs hemmen die Wiederaufnahme von Serotonin. Dadurch verbleibt das Serotonin länger im synaptischen Spalt als es normalerweise der Fall wäre, und kann die Rezeptoren der Empfängerzelle wiederholt stimulieren. Kurzfristig führt dies zu einer verstärkten Signalübertragung über Synapsen, in denen Serotonin als primärer Neurotransmitter dient. Bei chronischer Einnahme signalisiert die erhöhte Besetzung der postsynaptischen Serotoninrezeptoren dem präsynaptischen Neuron, weniger Serotonin zu synthetisieren und freizusetzen. Der Serotoninspiegel in der Synapse sinkt, steigt dann wieder an und führt schließlich zu einer Herunterregulierung der postsynaptischen Serotoninrezeptoren. Weitere indirekte Wirkungen können eine erhöhte Noradrenalinausschüttung, ein erhöhter neuronaler zyklischer AMP-Spiegel und ein erhöhter Spiegel von Regulierungsfaktoren wie BDNF und CREB sein. Da es keine allgemein akzeptierte umfassende Theorie der Biologie von Stimmungsstörungen gibt, gibt es auch keine allgemein akzeptierte Theorie darüber, wie diese Veränderungen zu den stimmungsaufhellenden und angstlösenden Wirkungen von SSRIs führen. Ihre Wirkung auf den Serotoninspiegel im Blut, die erst nach Wochen einsetzt, scheint weitgehend für die nur langsam eintretende psychiatrische Wirkung verantwortlich zu sein. ⓘ
Sigma-Rezeptor-Liganden
| Medikation | SERT | σ1 | σ2 | σ1 / SERT | |
|---|---|---|---|---|---|
| Citalopram | 1.16 | 292–404 | Agonist | 5,410 | 252–348 |
| Escitalopram | 2.5 | 288 | Agonist | ND | ND |
| Fluoxetin | 0.81 | 191–240 | Agonist | 16,100 | 296–365 |
| Fluvoxamin | 2.2 | 17–36 | Agonist | 8,439 | 7.7–16.4 |
| Paroxetin | 0.13 | ≥1,893 | ND | 22,870 | ≥14,562 |
| Sertralin | 0.29 | 32–57 | Antagonist | 5,297 | 110–197 |
| Die Werte sind Ki (nM). Je kleiner der Wert, desto stärker bindet der Medikament an die Stelle bindet. | |||||
Einige SSRI wirken nicht nur als Wiederaufnahmehemmer von Serotonin, sondern sind zufällig auch Liganden der Sigma-Rezeptoren. Fluvoxamin ist ein Agonist des σ1-Rezeptors, während Sertralin ein Antagonist des σ1-Rezeptors ist und Paroxetin keine signifikanten Wechselwirkungen mit dem σ1-Rezeptor aufweist. Keiner der SSRIs hat eine signifikante Affinität zum σ2-Rezeptor, und die SNRIs interagieren im Gegensatz zu den SSRIs nicht mit einem der Sigma-Rezeptoren. Fluvoxamin hat bei weitem die stärkste Aktivität der SSRI am σ1-Rezeptor. In der Positronen-Emissions-Tomographie (PET) wurde im menschlichen Gehirn eine hohe Belegung des σ1-Rezeptors durch klinische Dosierungen von Fluvoxamin beobachtet. Es wird vermutet, dass der Agonismus des σ1-Rezeptors durch Fluvoxamin positive Auswirkungen auf die Kognition haben könnte. Im Gegensatz zu Fluvoxamin ist die Bedeutung des σ1-Rezeptors für die Wirkung der anderen SSRI ungewiss und aufgrund ihrer im Vergleich zum SERT sehr geringen Affinität für den Rezeptor fragwürdig. ⓘ
Entzündungshemmende Wirkungen
Die Rolle von Entzündungen und des Immunsystems bei Depressionen wurde eingehend untersucht. Die Beweise für diesen Zusammenhang wurden in den letzten zehn Jahren in zahlreichen Studien erbracht. Landesweite Studien und Meta-Analysen kleinerer Kohortenstudien haben einen Zusammenhang zwischen vorbestehenden entzündlichen Erkrankungen wie Typ-1-Diabetes, rheumatoider Arthritis (RA) oder Hepatitis und einem erhöhten Depressionsrisiko aufgedeckt. Die Daten zeigen auch, dass der Einsatz entzündungsfördernder Mittel bei der Behandlung von Krankheiten wie Melanomen zu Depressionen führen kann. In mehreren meta-analytischen Studien wurden bei depressiven Patienten erhöhte Werte proinflammatorischer Zytokine und Chemokine festgestellt. Dieser Zusammenhang hat Wissenschaftler dazu veranlasst, die Auswirkungen von Antidepressiva auf das Immunsystem zu untersuchen. ⓘ
SSRI wurden ursprünglich mit dem Ziel entwickelt, den Gehalt an verfügbarem Serotonin in den extrazellulären Räumen zu erhöhen. Die verzögerte Reaktion zwischen dem Beginn der SSRI-Behandlung und dem Eintreten der Wirkung hat die Wissenschaftler jedoch zu der Annahme veranlasst, dass andere Moleküle an der Wirksamkeit dieser Medikamente beteiligt sind. Um die offensichtlichen entzündungshemmenden Wirkungen von SSRI zu untersuchen, führten sowohl Kohler et al. als auch Więdłocha et al. Metaanalysen durch, die zeigten, dass nach einer Behandlung mit Antidepressiva die mit Entzündungen verbundenen Zytokinspiegel sinken. In einer großen Kohortenstudie, die von Forschern in den Niederlanden durchgeführt wurde, wurde der Zusammenhang zwischen depressiven Störungen, Symptomen und Antidepressiva mit Entzündungen untersucht. Die Studie zeigte, dass die Werte von Interleukin (IL)-6, einem Zytokin mit entzündungsfördernden Wirkungen, bei Patienten, die SSRI einnahmen, im Vergleich zu Patienten, die keine Medikamente einnahmen, abnahmen. ⓘ
Bei der Behandlung mit SSRI wurde eine verringerte Produktion von Entzündungszytokinen wie IL-1β, Tumornekrosefaktor (TNF)-α, IL-6 und Interferon (IFN)-γ festgestellt, was zu einer Verringerung der Entzündungswerte und in der Folge zu einer Verringerung des Aktivierungsniveaus der Immunreaktion führt. Diese entzündlichen Zytokine aktivieren nachweislich Mikroglia, spezialisierte Makrophagen, die sich im Gehirn befinden. Makrophagen sind eine Untergruppe von Immunzellen, die im Rahmen des angeborenen Immunsystems für die Wirtsabwehr verantwortlich sind. Makrophagen können Zytokine und andere Chemikalien freisetzen, um eine Entzündungsreaktion auszulösen. Eine periphere Entzündung kann eine Entzündungsreaktion in den Mikroglia auslösen und eine Neuroinflammation verursachen. SSRI hemmen die Produktion proinflammatorischer Zytokine, was zu einer geringeren Aktivierung von Mikroglia und peripheren Makrophagen führt. SSRIs hemmen nicht nur die Produktion dieser proinflammatorischen Zytokine, sondern es wurde auch gezeigt, dass sie entzündungshemmende Zytokine wie IL-10 hochregulieren. Insgesamt wird dadurch die gesamte entzündliche Immunreaktion reduziert. ⓘ
Neben der Beeinflussung der Zytokinproduktion gibt es Hinweise darauf, dass die Behandlung mit SSRI Auswirkungen auf die Vermehrung und Lebensfähigkeit von Zellen des Immunsystems hat, die sowohl an der angeborenen als auch an der adaptiven Immunität beteiligt sind. Es ist erwiesen, dass SSRI die Proliferation von T-Zellen hemmen können, die für die adaptive Immunität wichtig sind und Entzündungen auslösen können. SSRI können auch die Apoptose, den programmierten Zelltod, in T-Zellen auslösen. Der vollständige Wirkmechanismus der entzündungshemmenden Wirkung von SSRI ist noch nicht vollständig bekannt. Es gibt jedoch Hinweise darauf, dass verschiedene Wege an dem Mechanismus beteiligt sind. Ein solcher möglicher Mechanismus ist die Erhöhung des Spiegels von zyklischem Adenosinmonophosphat (cAMP) als Ergebnis einer Beeinflussung der Aktivierung der Proteinkinase A (PKA), einem cAMP-abhängigen Protein. Andere mögliche Wege sind die Beeinflussung von Kalzium-Ionenkanälen oder die Auslösung von Zelltodwegen wie MAPK und Notch-Signalweg. ⓘ
Die entzündungshemmenden Wirkungen von SSRI haben zu Studien über die Wirksamkeit von SSRI bei der Behandlung von Autoimmunerkrankungen wie Multipler Sklerose, RA, entzündlichen Darmerkrankungen und septischem Schock geführt. Diese Studien wurden an Tiermodellen durchgeführt, haben jedoch konsistente immunregulierende Wirkungen gezeigt. Fluoxetin, ein SSRI, hat sich auch in Tiermodellen der Transplantat-gegen-Wirt-Krankheit als wirksam erwiesen. SSRIs wurden auch erfolgreich als Schmerzmittel bei Patienten eingesetzt, die sich einer onkologischen Behandlung unterziehen. Man nimmt an, dass die Wirksamkeit zumindest teilweise auf die entzündungshemmenden Wirkungen von SSRI zurückzuführen ist. ⓘ
Pharmakogenetik
Umfangreiche Forschungsarbeiten befassen sich mit der Verwendung genetischer Marker zur Vorhersage, ob Patienten auf SSRI ansprechen oder Nebenwirkungen haben, die zum Absetzen der Medikamente führen, obwohl diese Tests noch nicht für den breiten klinischen Einsatz bereit sind. ⓘ
Im Vergleich zu TCAs
SSRI werden als 'selektiv' bezeichnet, weil sie nur die für Serotonin verantwortlichen Wiederaufnahmepumpen beeinflussen, im Gegensatz zu früheren Antidepressiva, die auch andere Monoamin-Neurotransmitter beeinflussen, weshalb SSRI weniger Nebenwirkungen haben. ⓘ
Es scheint keinen signifikanten Unterschied in der Wirksamkeit zwischen SSRI und trizyklischen Antidepressiva zu geben, die vor der Entwicklung der SSRI die am häufigsten verwendete Klasse von Antidepressiva waren. SSRIs haben jedoch den wichtigen Vorteil, dass ihre toxische Dosis hoch ist und sie daher viel schwieriger als Mittel zum Selbstmord eingesetzt werden können. Außerdem haben sie weniger und mildere Nebenwirkungen. Trizyklische Antidepressiva bergen außerdem ein höheres Risiko für schwerwiegende kardiovaskuläre Nebenwirkungen, was bei SSRI nicht der Fall ist. ⓘ
SSRI wirken auf Signalwege wie z.B. zyklisches Adenosinmonophosphat (cAMP) an der postsynaptischen Nervenzelle, was zur Freisetzung des neurotrophen Faktors des Gehirns (BDNF) führt. BDNF fördert das Wachstum und das Überleben von kortikalen Neuronen und Synapsen. ⓘ
Geschichte
Fluoxetin wurde 1987 auf den Markt gebracht und war der erste große SSRI, der auf den Markt kam. ⓘ
Kontroverse Diskussion
Eine Studie, die die Veröffentlichung der Ergebnisse von durch die FDA bewerteten Antidepressiva untersuchte, kam zu dem Schluss, dass die Ergebnisse mit positiven Resultaten viel häufiger veröffentlicht wurden als die mit negativen Ergebnissen. Darüber hinaus ergab eine Untersuchung von 185 Meta-Analysen zu Antidepressiva, dass 79 % der Autoren in irgendeiner Weise mit Pharmaunternehmen verbunden waren und dass sie nur ungern über Vorbehalte gegenüber Antidepressiva berichteten. ⓘ
David Healy hat argumentiert, dass es viele Jahre lang Warnhinweise gab, bevor sich die Zulassungsbehörden dazu entschlossen, auf dem Etikett von Antidepressiva zu warnen, dass sie Selbstmordgedanken auslösen könnten. Zu der Zeit, als diese Warnhinweise hinzugefügt wurden, argumentierten andere, dass die Beweise für die Schädlichkeit nicht überzeugend seien, und andere taten dies auch nach der Aufnahme der Warnhinweise. ⓘ
Überblick
- Hinsichtlich Wechselwirkungen mit anderen Medikamenten gelten Citalopram, Escitalopram und Sertralin gegenüber anderen SSRI als vorteilhaft.
- Citalopram, Escitalopram und Sertralin werden in Deutschland manchmal als SSRI der zweiten oder neuen Generation bezeichnet.
- In Deutschland wird Citalopram mit deutlichem Abstand am häufigsten verordnet, gefolgt von Sertralin und Escitalopram, dann Fluoxetin und Paroxetin; deutlich seltener Fluvoxamin.
- Von den Hauptsubstanzen war in Deutschland bis 2014 einzig Escitalopram nicht generisch erhältlich. Eine definierte Tagesdosis Escitalopram kostete im Jahr 2011 etwa das Drei- bis Vierfache im Vergleich zu Citalopram. Die Aussage des Herstellers, das Enantiomer wirke stärker und schneller als das Racemat, ließ sich in Studien nicht belegen.
- Im Gegensatz zu Citalopram hat Escitalopram frühzeitig nach Markteinführung eine breite Indikationszulassung erhalten. Auch Sertralin hat im Sommer 2009 in Deutschland eine Indikationserweiterung in ähnlicher Breite erfahren. Letzteres wird in neuester Literatur zur Psychopharmakotherapie oft nicht berücksichtigt. ⓘ
Unerwünschte Wirkungen
Suizidrisiko
Bei Erwachsenen
Ein Zusammenhang mit dem Suizidrisiko bei Erwachsenen unter SSRI-Behandlung ist unklar. Eine Übersichtsarbeit aus dem Jahr 2005 ist zu dem Ergebnis gekommen, dass, insbesondere zu Beginn der Behandlung, die Suizidgefahr ansteige. Eine placebokontrollierte US-amerikanische Metaanalyse, aus dem Jahr 2012, mit 9185 Patienten, konnte hingegen keinen Zusammenhang zwischen der Gabe von SSRI, hier Fluoxetin und Venlafaxin (welches ein SSNRI ist), und einem erhöhten Suizidrisiko finden. Die Studie kommt zu dem Ergebnis, dass die Annahmen der amerikanischen Gesundheitsbehörde FDA, die zu Warnhinweisen geführt hatten, falsch sind. ⓘ
Gleichwohl wird in Beipackzetteln von SSRI-Medikamenten auf die anfangs erhöhte Suizidgefahr hingewiesen, die auch in deren typischer Wirkungskurve begründet sei. Die ARD strahlte zu dem Thema erstmals am 21. Februar 2014 eine Dokumentation „Gefährliche Glückspillen“ aus. In der Diskussion steht, ob es einen Zusammenhang zwischen den Einnahmen von SSRI und aggressiven Handlungen, wie etwa Amokläufen, gibt. Eine Webseite sammelt Fälle von Suiziden und Gewalttaten, bei denen SSRI eine Rolle spielten. Einige Forscher empfehlen weitere Studien, um einen möglichen Kausalzusammenhang zu untersuchen. ⓘ
SSRI bei älteren Patienten
Schon länger wird diskutiert, dass es unter der Therapie mit SSRI bei älteren Patienten vermehrt zu einem Apathiesyndrom kommen kann. Aktuelle Studienergebnisse scheinen dies zu bestätigen. Auch das Risiko für das Auftreten von Blutungen scheint vor allem bei älteren Menschen unter einer Therapie mit SSRI erhöht zu sein (siehe unter Wechselwirkungen) ⓘ
In einer Studie mit 248 Pflegeheimbewohnern mit Demenz erhöhten SSRIs das Risiko für einen schweren Sturz auf das bis zu Zweifache. Dabei konnte eine Dosisabhängigkeit gezeigt werden. Ein noch höheres Risiko ergab sich unter Komedikation mit Sedativa. Substanzen mit geringerem Interaktionsrisiko wie Citalopram, Escitalopram und Sertralin sind zu bevorzugen. ⓘ
SSRI und Schwangerschaft
Absetzsyndrom
Bei bis zu jedem 3. Kind kann nach mütterlicher SSRI-Einnahme während der Spätschwangerschaft ein Absetzsyndrom (vgl. oben) auftreten. Als Auslöser wurden die SSRI Fluoxetin, Paroxetin, Sertralin und Citalopram/Escitalopram sowie der SNRI Venlafaxin benannt. Symptome sind Rigor bzw. erhöhter Muskeltonus, vermehrtes Schreien, verschiedene Magen-Darm-Probleme und andere. ⓘ
Diese Entzugserscheinungen erreichen i. d. R. nicht die Schwere eines Opiatentzuges (Finnegan-Score ab 10), sind aber mit Finnegan-Punktwerten von 3–8 eine Belastung für das Neugeborene. ⓘ
Missbildungen
Ende 2005 warnte die amerikanische Gesundheitsbehörde FDA vor erhöhten Missbildungsraten nach Einnahme von Paroxetin. Nach epidemiologischen Daten vom Oktober 2006 geht die Einnahme aller SSRI mit erhöhten Missbildungsraten einher. ⓘ
Kombinationstherapie
Die Wechselwirkungen von SSRI untereinander können auch zu Gunsten der Therapie genutzt werden. So kann z. B. manchmal die fehlende Wirkung von Citalopram bei Citalopram-Non-Respondern durch gleichzeitige Gabe einer geringen Dosis Paroxetin oder Fluoxetin beseitigt werden. Da sowohl Paroxetin als auch Fluoxetin ein Enzym hemmen, welches Citalopram abbaut, kann durch gleichzeitige Gabe die Plasma-Konzentration und damit die Wirkstärke von Citalopram erhöht werden. ⓘ
SSRI und Pharmakogenetik
Es existiert eine ständig wachsende Fülle an wissenschaftlichen Publikationen zum Einfluss bestimmter Genvarianten bzw. -marker auf die Wirksamkeit oder Verträglichkeit von SSRI. Diese Resultate haben bisher nicht zu einer Verbesserung der Therapie geführt, da sie entweder nicht in weiteren Studien bestätigt werden konnten, sich Gentests als unpraktikabel erwiesen oder noch nicht weit genug entwickelt sind: ⓘ
Ansprechraten
Das im Zusammenhang mit der SSRI-Wirkung am häufigsten untersuchte Gen ist das des Serotonin-Transporters (SERTPR oder 5-HTTLPR), das direkten Einfluss auf die Serotonin(rück)aufnahme hat. Die Studienlage ist uneinheitlich und eine praktische Anwendbarkeit dieser Befunde ist derzeit unwahrscheinlich. ⓘ
Ein weiteres speziell mit der unzureichenden Wirkung von SSRI bei manchen Patienten in Verbindung gebrachtes Gen ist das der Tryptophan-Hydroxylase (TPH-1 und TPH-2). Einer Studie zufolge soll dieses Gen bei depressiven Patienten zehnmal häufiger mutiert sein als bei gesunden Kontrollpersonen. Patienten mit dieser Mutation könnten schlechter auf SSRI reagieren. Dieses Gen wird weiterhin intensiv untersucht, auch bei Patienten mit bipolarer Störung, bislang jedoch ohne klinische Konsequenzen. ⓘ
Verstoffwechselung
Die Verstoffwechselung von SSRI über die CYP-450-Isoenzyme war ein Ansatz der genetischen Forschung, der sich bisher als unpraktikabel erwiesen hat. Gentests zur Identifikation der „poor metabolizer“ haben nicht zur Verbesserung der Verträglichkeit von SSRI geführt, und „Schnellmetabolisierer“ profitieren nicht von einer Dosiserhöhung. ⓘ