Calciumcarbonat
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Kalziumkarbonat
| |||
| Andere Namen
Aragonit; Calcit; Kreide; Kalk; Kalkstein; Marmor; Auster; Perle
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
CaCO3 | ||
| Molekulare Masse | 100,0869 g/mol | ||
| Erscheinungsbild | Feines weißes Pulver; kreidiger Geschmack | ||
| Geruch | geruchlos | ||
| Dichte | 2,711 g/cm3 (Calcit) 2,83 g/cm3 (Aragonit) | ||
| Schmelzpunkt | 1.339 °C (2.442 °F; 1.612 K) (Calcit) 825 °C (1.517 °F; 1.098 K) (Aragonit) | ||
| Siedepunkt | zersetzt sich | ||
Löslichkeit in Wasser
|
0,013 g/L (25 °C) | ||
Löslichkeitsprodukt (Ksp)
|
3.3×10−9 | ||
| Löslichkeit in verdünnten Säuren | löslich | ||
| Azidität (pKa) | 9.0 | ||
Magnetische Suszeptibilität (χ)
|
-3,82×10-5 cm3/mol | ||
Brechungsindex (nD)
|
1.59 | ||
| Struktur | |||
Kristallstruktur
|
Trigonal | ||
Raumgruppe
|
32/m | ||
| Thermochemie | |||
Std. molare
Entropie (S |
93 J-mol-1-K-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-1207 kJ-mol-1 | ||
| Pharmakologie | |||
ATC-Code
|
A02AC01 (WHO) A12AA04 (WHO) | ||
| Gefahren | |||
| NFPA 704 (Feuerdiamant) | |||
| Letale Dosis oder Konzentration (LD, LC): | |||
LD50 (mittlere Dosis)
|
6450 mg/kg (oral, Ratte) | ||
| NIOSH (US-Grenzwerte für Gesundheitsgefährdung): | |||
PEL (Zulässig)
|
TWA 15 mg/m3 (gesamt) TWA 5 mg/m3 (resp) | ||
| Sicherheitsdatenblatt (SDS) | ICSC 1193 | ||
| Verwandte Verbindungen | |||
Andere Anionen
|
Kalziumbikarbonat | ||
Sonstige Kationen
|
Berylliumkarbonat Magnesiumkarbonat Strontiumkarbonat Bariumkarbonat Radiumkarbonat | ||
Verwandte Verbindungen
|
Kalziumsulfat | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||

Calciumcarbonat ist eine chemische Verbindung mit der Formel CaCO3. Es ist eine häufige Substanz, die in Gesteinen in Form der Minerale Calcit und Aragonit vorkommt (vor allem in Form von Kalkstein, einer Art Sedimentgestein, das hauptsächlich aus Calcit besteht), und ist der Hauptbestandteil von Eierschalen, Schneckenschalen, Schalentierskeletten und Perlen. Kalziumkarbonat ist der aktive Bestandteil von Kalk in der Landwirtschaft und entsteht, wenn Kalziumionen in hartem Wasser mit Karbonat-Ionen reagieren und Kalk bilden. Es wird in der Medizin als Kalziumzusatz oder als Antazidum verwendet, aber ein übermäßiger Verzehr kann gefährlich sein und zu Hyperkalzämie und Verdauungsproblemen führen. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
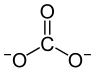
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumcarbonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CaCO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner und geruchloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
| ||||||||||||||||||
| Schmelzpunkt |
>825 °C (Zersetzung) | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (14 mg·l−1 bei 20 °C) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub) | ||||||||||||||||||
| Toxikologische Daten |
6450 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Calciumcarbonat (fachsprachlich), Kalziumkarbonat oder in deutscher Trivialbezeichnung kohlensaurer Kalk, ist eine chemische Verbindung der Elemente Calcium, Kohlenstoff und Sauerstoff mit der chemischen Formel CaCO3. Als ein Calcium-Salz der Kohlensäure gehört es zur Stoffgruppe der Carbonate. Es ist ein farbloser, kristalliner Feststoff, dessen Kristallstruktur aus den Ionen Ca2+ und CO32− im Verhältnis 1:1 besteht. ⓘ
Chemie
Calciumcarbonat weist die typischen Eigenschaften anderer Carbonate auf. Vor allem reagiert es
- reagiert mit Säuren unter Freisetzung von Kohlendioxid (technisch gesehen Kohlensäure, die sich jedoch schnell in CO2 und H2O auflöst):
- CaCO3(s) + 2 H+(aq) → Ca2+(aq) + CO2(g) + H2O(l)
- setzt beim Erhitzen Kohlendioxid frei, was als thermische Zersetzungsreaktion oder Kalzinierung (im Falle von CaCO3 auf über 840 °C) bezeichnet wird, und bildet Calciumoxid, CaO, das gemeinhin als Branntkalk bezeichnet wird, mit einer Reaktionsenthalpie von 178 kJ/mol:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CaCO3(s)->[\Delta]CaO(s){+}CO2\uparrow <span title="Aus: Englische Wikipedia, Abschnitt "Chemistry"" class="plainlinks">[https://en.wikipedia.org/wiki/Calcium_carbonate#Chemistry <span style="color:#dddddd">ⓘ</span>]</span>}}
Calciumcarbonat reagiert mit Wasser, das mit Kohlendioxid gesättigt ist, zu dem löslichen Calciumbicarbonat.
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CaCO3(s){+}CO2(g){+}H2O(l)-> Ca(HCO3)2(aq) <span title="Aus: Englische Wikipedia, Abschnitt "Chemistry"" class="plainlinks">[https://en.wikipedia.org/wiki/Calcium_carbonate#Chemistry <span style="color:#dddddd">ⓘ</span>]</span>}}
Diese Reaktion ist wichtig für die Erosion von Karbonatgestein und die Bildung von Kavernen und führt in vielen Regionen zu hartem Wasser. ⓘ
Eine ungewöhnliche Form von Calciumcarbonat ist das Hexahydrat Ikait, CaCO3-6H2O. Ikait ist nur unter 8 °C stabil. ⓘ
Herstellung
Der überwiegende Teil des in der Industrie verwendeten Calciumcarbonats wird im Bergbau oder in Steinbrüchen gewonnen. Reines Kalziumkarbonat (z. B. für Lebensmittel oder pharmazeutische Zwecke) kann aus einer reinen Steinbruchquelle (in der Regel Marmor) gewonnen werden. ⓘ
Alternativ wird Calciumcarbonat aus Calciumoxid hergestellt. Durch Zugabe von Wasser erhält man Calciumhydroxid. Anschließend wird Kohlendioxid durch diese Lösung geleitet, um das gewünschte Calciumcarbonat auszufällen, das in der Industrie als gefälltes Calciumcarbonat (PCC) bezeichnet wird:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{Ca(OH)2{+}CO2->CaCO3{+}H_2O <span title="Aus: Englische Wikipedia, Abschnitt "Preparation"" class="plainlinks">[https://en.wikipedia.org/wiki/Calcium_carbonate#Preparation <span style="color:#dddddd">ⓘ</span>]</span>}}
Struktur
Die thermodynamisch stabile Form von CaCO3 unter normalen Bedingungen ist hexagonales β-CaCO3 (das Mineral Calcit). Es können auch andere Formen hergestellt werden, das dichtere (2,83 g/cm3) orthorhombische λ-CaCO3 (das Mineral Aragonit) und das hexagonale μ-CaCO3, das als Mineral Vaterit vorkommt. Die Aragonitform kann durch Ausfällung bei Temperaturen über 85 °C hergestellt werden; die Vateritform kann durch Ausfällung bei 60 °C hergestellt werden. Calcit enthält Calciumatome, die von sechs Sauerstoffatomen koordiniert werden; im Aragonit werden sie von neun Sauerstoffatomen koordiniert. Die Struktur von Vaterit ist nicht vollständig geklärt. Magnesiumcarbonat (MgCO3) hat die Calcitstruktur, während Strontiumcarbonat (SrCO3) und Bariumcarbonat (BaCO3) die Aragonitstruktur aufweisen, was auf ihre größeren Ionenradien zurückzuführen ist. ⓘ
Vorkommen

Modifikationen in der Natur
Calciumcarbonat fand früher auch als Tafelkreide Verwendung, insbesondere in Frankreich als sogenannte Champagnerkreide, die aus Kreidegestein besteht, einem chemisch sehr reinen Calciumcarbonat. Etwa 55 Prozent der in Deutschland verkauften Kreide besteht heute aus Gips (Calciumsulfat). ⓘ
Für einige Anwendungen sind natürliche Calciumcarbonate nicht optimal, so dass hier synthetische Calciumcarbonate verwendet werden. Mit der Bezeichnung Hydro-Calcit wird synthetisches Calciumcarbonat in der Wassertechnik zur Entsäuerung von Wässern mit „aggressiver Kohlensäure“ verwendet. Dieses Verfahren gilt als eines der ältesten Entsäurerungsverfahren. ⓘ
Zusammen mit Magnesiumcarbonat wird Calciumcarbonat in Medikamenten zur Magensäureregulation (Antazida) eingesetzt. ⓘ

In der Natur bildet Calciumcarbonat verschiedene Gesteine, die zwar chemisch identisch sind, sich jedoch in mancherlei Hinsicht unterscheiden. Calcit ist eines der wenigen Minerale, das in reiner Form als Gesteinsbildner in allen drei Hauptgruppen vertreten ist. Denn neben den Sedimenten Kreide und Kalkstein sowie dem Metamorphit Marmor gibt es auch magmatische Calciumcarbonat-Gesteine – die Carbonatite. ⓘ
Calcit, Aragonit und Vaterit sind reine Calciumcarbonatminerale. Zu den industriell wichtigen Ausgangsgesteinen, die überwiegend aus Calciumcarbonat bestehen, gehören Kalkstein, Kreide, Marmor und Travertin. ⓘ
Kreide

Kreide ist ein feines, mikrokristallines Sedimentgestein, das durch Ablagerung von durch photosynthetischen Kohlensäureentzug gefälltem Calcit sowie der aragonitischen Schalen von fossilen Kleinlebewesen, wie Coccolithen der Coccolithophoriden und Schalen der Foraminiferen, entstanden ist. Kreide tritt an zahlreichen Standorten entlang des europäischen Kreidegürtels zutage, von Großbritannien über Frankreich bis hin zur Insel Rügen in Norddeutschland, und wird stellenweise abgebaut. Seekreide am Grund von Seen oder in verlandeten Seebecken besteht fast vollständig aus gefälltem Calcit. Die in der Schule verwendete Tafelkreide wird inzwischen allerdings meist nicht mehr aus echter Kreide, sondern vor allem aus Gips (Calciumsulfat) hergestellt. ⓘ
Kalkstein
Kalkstein wird ebenfalls überwiegend von Lebewesen gebildet und ist stärker verfestigt als Kreide. Die Kalkablagerung geschieht entweder direkt oder indirekt aus den Überresten der Lebewesen, wie zum Beispiel von Schnecken, Muscheln, gesteinsbildenden Steinkorallen und Schwämmen, die Calciumcarbonat zum Aufbau von Außen- oder Innenskeletten abscheiden. Indirekt wird er dadurch gebildet, dass Lebewesen, vor allem phototrophe, CO2 assimilieren und so das Milieu alkalisieren, was zur Ausfällung von Calciumcarbonat führt. Die Größe der Carbonatkristalle liegt zwischen derjenigen von Kreide und Marmor. Große Kalkstein-Vorkommen befinden sich zum Beispiel auf der Schwäbischen und Fränkischen Alb, im Jura, in den Kalkalpen und den Westalpen, im Himalaya und in vielen anderen Gebieten. ⓘ
Marmor
Marmor ist ein grobkristallines, metamorphes Gestein, das entsteht, wenn Kreide, Kalkstein oder Dolomit unter dem Einfluss hoher Temperaturen und/oder hoher Drücke (über 1000 bar) umkristallisiert werden. Große Marmor-Vorkommen finden sich in Europa beispielsweise in Südtirol (Laas), Österreich (Gummern), Norwegen (Molde) oder im italienischen Carrara, der Heimat des reinweißen Statuario, aus dem Michelangelo seine Skulpturen schuf, sowie auch in Nordamerika. ⓘ
Biologische Quellen

Eierschalen, Schneckenhäuser und die meisten Muscheln bestehen überwiegend aus Kalziumkarbonat und können als industrielle Quellen für diese Chemikalie verwendet werden. Austernschalen sind in letzter Zeit als Kalziumquelle für die Ernährung anerkannt worden, sind aber auch eine praktische industrielle Quelle. Dunkelgrüne Gemüsesorten wie Brokkoli und Grünkohl enthalten erhebliche Mengen an Kalziumkarbonat in der Nahrung, sind aber als industrielle Quelle nicht geeignet. ⓘ
Extraterrestrisches
Außerhalb der Erde gibt es deutliche Hinweise auf das Vorhandensein von Kalziumkarbonat auf dem Mars. Anzeichen von Kalziumkarbonat wurden an mehr als einer Stelle entdeckt (vor allem in den Kratern Gusev und Huygens). Dies ist ein Hinweis darauf, dass in der Vergangenheit flüssiges Wasser vorhanden war. ⓘ
Geologie
Karbonat kommt in geologischen Umgebungen häufig vor und stellt ein enormes Kohlenstoffreservoir dar. Calciumcarbonat kommt in Form von Aragonit, Calcit und Dolomit vor und ist ein wichtiger Bestandteil des Calciumkreislaufs. Die Karbonatminerale bilden die Gesteinsarten: Kalkstein, Kreide, Marmor, Travertin, Tuffstein und andere. ⓘ
In warmen, klaren tropischen Gewässern sind Korallen häufiger anzutreffen als an den Polen, wo das Wasser kalt ist. Kalkbildner wie Plankton (z. B. Coccolithen und planktische Foraminiferen), Korallenalgen, Schwämme, Brachiopoden, Stachelhäuter, Moostierchen und Mollusken sind in der Regel in flachen Gewässern zu finden, wo Sonnenlicht und filtrierbare Nahrung im Überfluss vorhanden sind. Kaltwasserkarbonate kommen auch in höheren Breitengraden vor, wachsen aber nur sehr langsam. Die Kalkbildungsprozesse werden durch die Versauerung der Ozeane verändert. ⓘ
Dort, wo die ozeanische Kruste unter eine kontinentale Platte subduziert wird, werden Sedimente in wärmere Zonen in der Asthenosphäre und Lithosphäre hinuntergetragen. Unter diesen Bedingungen zersetzt sich Kalziumkarbonat und erzeugt Kohlendioxid, das zusammen mit anderen Gasen zu explosiven Vulkanausbrüchen führt. ⓘ
Karbonat-Kompensationstiefe
Die Karbonatkompensationstiefe (CCD) ist der Punkt im Ozean, an dem die Ausscheidungsrate von Kalziumkarbonat durch die Auflösungsrate aufgrund der herrschenden Bedingungen ausgeglichen ist. Tief im Ozean sinkt die Temperatur und der Druck steigt. Kalziumkarbonat ist insofern ungewöhnlich, als seine Löslichkeit mit abnehmender Temperatur zunimmt. Mit steigendem Druck nimmt auch die Löslichkeit von Kalziumkarbonat zu. Die Kompensationstiefe des Karbonats kann zwischen 4.000 und 6.000 Metern unter dem Meeresspiegel liegen. ⓘ
Rolle in der Taphonomie
Kalziumkarbonat kann Fossilien durch Permineralisierung konservieren. Die meisten Wirbeltierfossilien der Two Medicine Formation - einer geologischen Formation, die für ihre Dinosauriereier mit Entenschnabel bekannt ist - sind durch CaCO3-Permineralisierung erhalten. Bei dieser Art der Konservierung bleiben viele Details erhalten, sogar bis hinunter zur mikroskopischen Ebene. Sie macht die Exemplare jedoch auch anfällig für Verwitterung, wenn sie an der Oberfläche liegen. ⓘ
Man ging einst davon aus, dass Trilobiten im Kambrium den Großteil des aquatischen Lebens ausmachten, da ihre kalkhaltigen Schalen leichter zu erhalten waren als die anderer Arten, die nur Chitinpanzer hatten. ⓘ
Verwendungen
Bauwesen
Kalziumkarbonat wird hauptsächlich im Baugewerbe verwendet, entweder als Baumaterial oder als Kalksteinzuschlag für den Straßenbau, als Bestandteil von Zement oder als Ausgangsmaterial für die Herstellung von Baukalk durch Brennen im Brennofen. Aufgrund der Verwitterung, die vor allem durch sauren Regen verursacht wird, wird Kalziumkarbonat (in Form von Kalkstein) jedoch nicht mehr als solches für Bauzwecke verwendet, sondern nur noch als Ausgangsstoff für Baumaterialien. ⓘ
Kalziumkarbonat wird auch bei der Reinigung von Eisen aus Eisenerz in einem Hochofen verwendet. Das Karbonat wird an Ort und Stelle kalziniert, um Kalziumoxid zu erhalten, das eine Schlacke mit verschiedenen Verunreinigungen bildet und sich vom gereinigten Eisen trennt. ⓘ
In der Erdölindustrie wird Kalziumkarbonat den Bohrspülungen als formationsüberbrückendes und filterkuchenabdichtendes Mittel zugesetzt; es ist auch ein Beschwerungsmaterial, das die Dichte der Bohrspülungen erhöht, um den Druck im Bohrloch zu kontrollieren. Calciumcarbonat wird Schwimmbädern als pH-Korrekturmittel zugesetzt, um die Alkalität zu erhalten und die sauren Eigenschaften des Desinfektionsmittels auszugleichen. ⓘ
Es wird auch als Rohstoff bei der Raffination von Zucker aus Zuckerrüben verwendet; es wird in einem Ofen mit Anthrazit gebrannt, wobei Calciumoxid und Kohlendioxid entstehen. Dieser gebrannte Kalk wird dann in frischem Wasser gelöscht, um eine Calciumhydroxid-Suspension für die Ausfällung von Verunreinigungen im Rohsaft während der Karbonatisierung zu erzeugen. ⓘ
Calciumcarbonat in Form von Kreide ist traditionell ein Hauptbestandteil von Tafelkreide. Moderne Kreide besteht jedoch hauptsächlich aus Gips, hydratisiertem Calciumsulfat CaSO4-2H2O. Kalziumkarbonat ist eine der Hauptquellen für den Anbau von Biorock. Gefälltes Kalziumkarbonat (PCC), das in Form einer Aufschlämmung vordispergiert wird, ist ein gängiges Füllmaterial für Latexhandschuhe, mit dem Ziel, maximale Einsparungen bei den Material- und Produktionskosten zu erzielen. ⓘ
Fein gemahlenes Kalziumkarbonat (GCC) ist ein wesentlicher Bestandteil der mikroporösen Folie, die in Windeln und einigen Baufolien verwendet wird, da die Poren um die Kalziumkarbonatpartikel während der Herstellung der Folie durch biaxiales Recken gebildet werden. GCC und PCC werden als Füllstoff in Papier verwendet, da sie billiger sind als Holzfasern. Bezogen auf das Marktvolumen sind GCC die wichtigsten derzeit verwendeten Füllstoffarten. Druck- und Schreibpapier kann 10-20% Calciumcarbonat enthalten. In Nordamerika hat Kalziumkarbonat begonnen, Kaolin bei der Herstellung von glänzendem Papier zu ersetzen. In Europa wird dies seit einigen Jahrzehnten als alkalische Papierherstellung oder säurefreie Papierherstellung praktiziert. PCC, das für Papierfüllungen und -beschichtungen verwendet wird, wird in einer Vielzahl von Formen und Größen mit einer charakteristischen engen Partikelgrößenverteilung und äquivalenten Kugeldurchmessern von 0,4 bis 3 Mikrometern ausgefällt und hergestellt. ⓘ
Kalziumkarbonat wird häufig als Füllstoff in Farben verwendet, insbesondere in matten Dispersionsfarben, die in der Regel zu 30 Gewichtsprozent aus Kreide oder Marmor bestehen. Es ist auch ein beliebter Füllstoff in Kunststoffen. Typische Beispiele sind etwa 15 bis 20 % Kreideanteil in Abflussrohren aus weichmacherfreiem Polyvinylchlorid (PVC) und 5 bis 15 % stearatbeschichtete Kreide oder Marmor in PVC-Fensterprofilen. In PVC-Kabeln kann Kalziumkarbonat in einer Konzentration von bis zu 70 phr (Teile pro hundert Teile Harz) verwendet werden, um die mechanischen Eigenschaften (Zugfestigkeit und Dehnung) und die elektrischen Eigenschaften (Durchgangswiderstand) zu verbessern. Polypropylenmischungen werden häufig mit Kalziumkarbonat gefüllt, um die Steifigkeit zu erhöhen, eine Anforderung, die bei hohen Einsatztemperaturen wichtig wird. Hier liegt der Anteil oft bei 20-40 %. Calciumcarbonat wird auch routinemäßig als Füllstoff in wärmehärtenden Harzen (Platten- und Schüttgutformmassen) verwendet und wurde auch mit ABS und anderen Bestandteilen gemischt, um einige Arten von formgepressten "Ton"-Pokerchips herzustellen. Ausgefälltes Kalziumkarbonat, das durch Eintröpfeln von Kalziumoxid in Wasser hergestellt wird, wird allein oder mit Zusätzen als weiße Farbe verwendet, die auch als Tünche bekannt ist. ⓘ
Kalziumkarbonat wird einer Vielzahl von handelsüblichen und selbst hergestellten Klebstoffen, Dichtungsmitteln und Spachtelmassen für die Dekoration zugesetzt. Keramikfliesenkleber enthalten in der Regel 70 bis 80 % Kalkstein. Rissfüller für Dekorationszwecke enthalten ähnliche Mengen an Marmor oder Dolomit. Er wird auch mit Kitt zum Einsetzen von Glasfenstern gemischt und als Resist verwendet, um zu verhindern, dass das Glas beim Brennen von Glasuren und Farben bei hohen Temperaturen an den Ofenböden klebt. ⓘ
In keramischen Glasuren wird Kalziumkarbonat als Kreide bezeichnet und ist in seiner weißen, pulverförmigen Form ein häufiger Bestandteil vieler Glasuren. Wenn eine Glasur, die dieses Material enthält, in einem Brennofen gebrannt wird, wirkt die Kreide als Flussmittel in der Glasur. Gemahlenes Kalziumkarbonat ist ein Schleifmittel (sowohl als Scheuerpulver als auch als Bestandteil von Scheuercremes für den Haushalt), insbesondere in seiner Kalzitform, die den relativ niedrigen Härtegrad 3 auf der Mohs-Skala aufweist und daher Glas und die meisten anderen Keramiken, Emaille, Bronze, Eisen und Stahl nicht zerkratzt und eine mäßige Wirkung auf weichere Metalle wie Aluminium und Kupfer hat. Eine Paste aus Kalziumkarbonat und entionisiertem Wasser kann verwendet werden, um Silber anzulaufen. ⓘ
Gesundheit und Ernährung

Kalziumkarbonat wird in der Medizin häufig als preiswertes Kalziumpräparat für Magensäuremittel (wie Tums und Eno) verwendet. Es kann als Phosphatbinder für die Behandlung von Hyperphosphatämie (vor allem bei Patienten mit chronischem Nierenversagen) verwendet werden. In der pharmazeutischen Industrie wird es als inerter Füllstoff für Tabletten und andere Arzneimittel verwendet. ⓘ
Kalziumkarbonat wird bei der Herstellung von Kalziumoxid und Zahnpasta verwendet und hat als Lebensmittelkonservierungsmittel und Farberhaltungsstoff in oder mit Produkten wie Bio-Äpfeln einen neuen Aufschwung erlebt. ⓘ
Kalziumkarbonat wird therapeutisch als Phosphatbinder bei Patienten in der Erhaltungshämodialyse eingesetzt. Es ist die am häufigsten verordnete Form des Phosphatbinders, insbesondere bei chronischen Nierenerkrankungen, die nicht auf Dialyse beruhen. Kalziumkarbonat ist der am häufigsten verwendete Phosphatbinder, doch verschreiben Kliniker zunehmend die teureren, nicht auf Kalzium basierenden Phosphatbinder, insbesondere Sevelamer. ⓘ
Überschüssiges Kalzium aus Nahrungsergänzungsmitteln, angereicherten Lebensmitteln und kalziumreicher Ernährung kann das Milch-Alkali-Syndrom verursachen, das eine schwere Toxizität aufweist und tödlich sein kann. 1915 führte Bertram Sippy die "Sippy-Kur" ein, bei der er 10 Tage lang stündlich Milch und Sahne zu sich nahm und nach und nach Eier und gekochtes Getreide hinzufügte, kombiniert mit alkalischen Pulvern, die eine symptomatische Linderung der Magengeschwüre bewirkten. In den folgenden Jahrzehnten führte die Sippy-Kur zu Nierenversagen, Alkalose und Hyperkalzämie, vor allem bei Männern mit Magengeschwüren. Diese unerwünschten Wirkungen bildeten sich zurück, wenn die Kur abgesetzt wurde, aber bei einigen Patienten mit langwierigem Erbrechen war sie tödlich. Das Milch-Alkali-Syndrom ging bei Männern zurück, nachdem wirksame Behandlungen für Magengeschwüre aufkamen. Seit den 1990er Jahren wird es am häufigsten bei Frauen beobachtet, die zur Vorbeugung und Behandlung von Osteoporose Kalziumpräparate einnehmen, die über den empfohlenen Bereich von 1,2 bis 1,5 Gramm täglich hinausgehen, und es wird durch Dehydrierung verschlimmert. Freiverkäuflichen Produkten wurde Kalzium zugesetzt, was zu einer unbeabsichtigten übermäßigen Einnahme beiträgt. Eine übermäßige Kalziumzufuhr kann zu einer Hyperkalzämie führen, zu deren Komplikationen Erbrechen, Bauchschmerzen und ein veränderter Geisteszustand gehören. ⓘ
Als Lebensmittelzusatzstoff wird es als E170 bezeichnet und hat eine INS-Nummer von 170. Es wird als Säureregulator, Antibackmittel, Stabilisator oder Farbstoff verwendet und ist in der EU, den USA, Australien und Neuseeland zugelassen. Es wird "per Gesetz allen im Vereinigten Königreich gemahlenen Brotmehlen außer Vollkornmehl zugesetzt". Es wird in einigen Sojamilch- und Mandelmilchprodukten als Kalziumquelle für die Ernährung verwendet; mindestens eine Studie deutet darauf hin, dass Kalziumkarbonat genauso bioverfügbar sein könnte wie das Kalzium in Kuhmilch. Kalziumkarbonat wird auch als Festigungsmittel in vielen pflanzlichen Produkten in Dosen und Flaschen verwendet. ⓘ
Mehrere Kalziumergänzungsmittel enthalten nachweislich das chemische Element Blei, was ein Problem für die öffentliche Gesundheit darstellt. Blei findet sich häufig in natürlichen Kalziumquellen. ⓘ
Landwirtschaft und Aquakultur
Landwirtschaftlicher Kalk, Kreide- oder Kalksteinpulver, wird als billige Methode zur Neutralisierung saurer Böden verwendet, um sie für die Bepflanzung geeignet zu machen, und wird auch in der Aquakultur zur Regulierung des pH-Werts von Teichböden vor Beginn der Zucht verwendet. ⓘ
Reinigung von Haushalten
Kalziumkarbonat ist ein Hauptbestandteil vieler Haushaltsreinigungsmittel wie Comet und wird als Scheuermittel verwendet. ⓘ
Verringerung der Umweltverschmutzung
1989 brachte ein Forscher, Ken Simmons, CaCO3 in den Whetstone Brook in Massachusetts ein. Er hoffte, dass das Kalziumkarbonat die durch den sauren Regen verursachte Säure im Bach bekämpfen und die Forellen, die nicht mehr laichen, retten würde. Obwohl sein Experiment ein Erfolg war, stieg die Menge an Aluminiumionen in dem Teil des Baches, der nicht mit dem Kalkstein behandelt wurde. Dies zeigt, dass CaCO3 zugesetzt werden kann, um die Auswirkungen des sauren Regens in Flussökosystemen zu neutralisieren. Derzeit wird Kalziumkarbonat verwendet, um saure Bedingungen im Boden und im Wasser zu neutralisieren. Seit den 1970er Jahren wird eine solche Kalkung in Schweden in großem Umfang praktiziert, um die Versauerung einzudämmen, und mehrere tausend Seen und Bäche werden wiederholt gekalkt. ⓘ
Kalziumkarbonat wird auch in der Rauchgasentschwefelung eingesetzt, um schädliche SO2- und NO2-Emissionen aus Kohle und anderen fossilen Brennstoffen zu beseitigen, die in großen Kraftwerken mit fossilen Brennstoffen verbrannt werden. ⓘ
Gleichgewicht bei der Kalzinierung
Die Kalzinierung von Kalkstein mit Hilfe von Holzkohlefeuern zur Herstellung von Branntkalk wird seit dem Altertum von Kulturen auf der ganzen Welt praktiziert. Die Temperatur, bei der aus Kalkstein Kalziumoxid entsteht, wird gewöhnlich mit 825 °C angegeben, aber die Angabe eines absoluten Grenzwerts ist irreführend. Calciumcarbonat befindet sich bei jeder Temperatur im Gleichgewicht mit Calciumoxid und Kohlendioxid. Bei jeder Temperatur gibt es einen Partialdruck von Kohlendioxid, der im Gleichgewicht mit Calciumcarbonat steht. Bei Raumtemperatur überwiegt das Gleichgewicht zugunsten von Kalziumkarbonat, da der CO2-Gleichgewichtsdruck nur einen winzigen Bruchteil des CO2-Partialdrucks in Luft ausmacht, der etwa 0,035 kPa beträgt. ⓘ
Bei Temperaturen über 550 °C beginnt der Gleichgewichts-CO2-Druck den CO2-Druck in der Luft zu übersteigen. Oberhalb von 550 °C beginnt Kalziumkarbonat also, CO2 in die Luft auszugasen. In einem mit Holzkohle befeuerten Ofen ist die CO2-Konzentration jedoch viel höher als in der Luft. Wenn nämlich der gesamte Sauerstoff im Ofen durch das Feuer verbraucht wird, kann der CO2-Partialdruck im Ofen bis zu 20 kPa betragen. ⓘ
Die Tabelle zeigt, dass dieser Partialdruck erst bei einer Temperatur von fast 800 °C erreicht wird. Damit die Ausgasung von CO2 aus Kalziumkarbonat wirtschaftlich sinnvoll ist, muss der Gleichgewichtsdruck deutlich über dem Umgebungsdruck von CO2 liegen. Und damit dies schnell geschieht, muss der Gleichgewichtsdruck den atmosphärischen Gesamtdruck von 101 kPa übersteigen, was bei 898 °C der Fall ist. ⓘ
ⓘGleichgewichtsdruck von CO2 über CaCO3 (P) in Abhängigkeit von der Temperatur (T). P (kPa) 0.055 0.13 0.31 1.80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 T (°C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Löslichkeit
Bei unterschiedlichem CO2-Druck
Calciumcarbonat ist in reinem Wasser schwer löslich (47 mg/L bei normalem atmosphärischem CO2-Partialdruck, wie unten dargestellt). ⓘ
Das Gleichgewicht seiner Lösung ist durch die Gleichung gegeben (mit gelöstem Calciumcarbonat auf der rechten Seite):
ⓘCaCO3 ⇌ Ca2+ + CO2-3 Ksp = 3,7×10-9 bis 8,7×10-9 bei 25 °C
wobei das Löslichkeitsprodukt für [Ca2+][CO2-3] je nach Datenquelle mit Ksp = 3,7×10-9 bis Ksp = 8,7×10-9 bei 25 °C angegeben wird. Die Gleichung besagt, dass das Produkt aus der molaren Konzentration der Calciumionen (Mol gelöstes Ca2+ pro Liter Lösung) und der molaren Konzentration des gelösten CO2-3 den Wert von Ksp nicht überschreiten darf. Diese scheinbar einfache Löslichkeitsgleichung muss jedoch zusammen mit dem komplizierteren Gleichgewicht von Kohlendioxid mit Wasser betrachtet werden (siehe Kohlensäure). Ein Teil des CO2-3 verbindet sich mit H+ in der Lösung gemäß ⓘ
ⓘHCO-3 ⇌ H+ + CO2-3 Ka2 = 5,61×10-11 bei 25 °C
HCO-3 wird als Bicarbonat-Ion bezeichnet. Kalziumbikarbonat ist in Wasser um ein Vielfaches löslicher als Kalziumkarbonat - es existiert sogar nur in Lösung. ⓘ
Ein Teil des HCO-3 verbindet sich in Lösung mit H+ gemäß ⓘ
ⓘH2CO3 ⇌ H+ + HCO-3 Ka1 = 2,5×10-4 bei 25 °C
Ein Teil des H2CO3 zerfällt in Wasser und gelöstes Kohlendioxid gemäß ⓘ
ⓘH2O + CO2(aq) ⇌ H2CO3 Kh = 1,70×10-3 bei 25 °C
Und das gelöste Kohlendioxid befindet sich im Gleichgewicht mit dem atmosphärischen Kohlendioxid gemäß ⓘ
ⓘPCO2/[CO2] = kH wobei kH = 29,76 atm/(mol/L) bei 25 °C (Henry-Konstante) und PCO2 der CO2-Partialdruck ist.
Für Umgebungsluft beträgt PCO2 etwa 3,5×10-4 Atmosphären (oder äquivalent 35 Pa). Die letzte Gleichung oben legt die Konzentration des gelösten CO2 als Funktion des PCO2 fest, unabhängig von der Konzentration des gelösten CaCO3. Bei atmosphärischem Partialdruck von CO2 beträgt die Konzentration von gelöstem CO2 1,2×10-5 Mol pro Liter. Die vorstehende Gleichung legt die Konzentration von H2CO3 in Abhängigkeit von der CO2-Konzentration fest. Für [CO2] = 1,2×10-5 ergibt sie [H2CO3] = 2,0×10-8 Mol pro Liter. Wenn [H2CO3] bekannt ist, können die übrigen drei Gleichungen zusammen mit ⓘ
| PCO2 (atm) | pH-Wert | [Ca2+] (mol/L) |
|---|---|---|
| 10−12 | 12.0 | 5.19×10−3 |
| 10−10 | 11.3 | 1.12×10−3 |
| 10−8 | 10.7 | 2.55×10−4 |
| 10−6 | 9.83 | 1.20×10−4 |
| 10−4 | 8.62 | 3.16×10−4 |
| 3.5×10−4 | 8.27 | 4.70×10−4 |
| 10−3 | 7.96 | 6.62×10−4 |
| 10−2 | 7.30 | 1.42×10−3 |
| 10−1 | 6.63 | 3.05×10−3 |
| 1 | 5.96 | 6.58×10−3 |
| 10 | 5.30 | 1.42×10−2 |
ⓘH2O ⇌ H+ + OH- K = 10-14 bei 25 °C
(was für alle wässrigen Lösungen gilt), und die Tatsache, dass die Lösung elektrisch neutral sein muss, d.h., die Gesamtladung der gelösten positiven Ionen [Ca2+] + 2 [H+] muss durch die Gesamtladung der gelösten negativen Ionen [HCO-3] + [CO2-3] + [OH-] aufgehoben werden, ermöglichen die gleichzeitige Lösung der verbleibenden fünf unbekannten Konzentrationen (man beachte, dass die zuvor erwähnte Form der Neutralität nur gilt, wenn Calciumcarbonat mit reinem Wasser oder einer pH-neutralen Lösung in Kontakt gebracht wurde; in dem Fall, in dem der anfängliche pH-Wert des Lösungsmittels Wasser nicht neutral ist, ist die Bilanz nicht neutral). ⓘ
Die nebenstehende Tabelle zeigt das Ergebnis für [Ca2+] und [H+] (in Form von pH) in Abhängigkeit vom CO2-Partialdruck der Umgebung (für die Berechnung wurde Ksp = 4,47×10-9 angenommen).
- Die Tabelle zeigt, dass die Lösung bei atmosphärischem CO2-Partialdruck leicht alkalisch ist und die maximale CaCO3-Löslichkeit 47 mg/L beträgt.
- Wenn der CO2-Partialdruck der Umgebung unter atmosphärische Werte sinkt, wird die Lösung immer alkalischer. Bei extrem niedrigem PCO2 verdampfen gelöstes CO2, Bicarbonat- und Carbonationen weitgehend aus der Lösung und hinterlassen eine stark alkalische Lösung aus Calciumhydroxid, das besser löslich ist als CaCO3. Man beachte, dass bei PCO2 = 10-12 atm das Produkt [Ca2+][OH-]2 noch unter dem Löslichkeitsprodukt von Ca(OH)2 (8×10-6) liegt. Bei noch niedrigerem CO2-Druck erfolgt die Ca(OH)2-Ausfällung vor der CaCO3-Ausfällung.
- Wenn der CO2-Partialdruck in der Umgebung auf Werte über dem atmosphärischen Druck ansteigt, sinkt der pH-Wert, und ein Großteil der Carbonat-Ionen wird in Bicarbonat-Ionen umgewandelt, was zu einer höheren Löslichkeit von Ca2+ führt. ⓘ
Die Auswirkung des letztgenannten Phänomens ist im täglichen Leben von Menschen mit hartem Wasser besonders deutlich. Wasser in unterirdischen Grundwasserleitern kann einem CO2-Gehalt ausgesetzt sein, der weit über dem atmosphärischen liegt. Wenn dieses Wasser durch kalkhaltiges Gestein sickert, löst sich das CaCO3 entsprechend dem zweiten Trend auf. Wenn dasselbe Wasser dann aus dem Wasserhahn kommt, stellt es mit der Zeit ein Gleichgewicht mit dem CO2-Gehalt in der Luft her, indem es das überschüssige CO2 ausgast. Das Kalziumkarbonat wird dadurch weniger löslich, und der Überschuss fällt als Kalk aus. Dieser Prozess ist auch für die Bildung von Stalaktiten und Stalagmiten in Kalksteinhöhlen verantwortlich. ⓘ
Zwei hydratisierte Phasen von Kalziumkarbonat, Monohydrokalzit CaCO3-H2O und Ikait CaCO3-6H2O, können bei Umgebungsbedingungen aus dem Wasser ausfallen und als metastabile Phasen bestehen bleiben. ⓘ
Bei schwankendem pH-Wert, Temperatur und Salzgehalt: CaCO3-Ablagerungen in Schwimmbädern
Im Gegensatz zum obigen Szenario des offenen Gleichgewichts werden viele Schwimmbäder durch Zugabe von Natriumbicarbonat (NaHCO3) auf etwa 2 mM als Puffer und anschließende Kontrolle des pH-Werts durch Verwendung von HCl, NaHSO4, Na2CO3, NaOH oder Chlorformulierungen, die sauer oder basisch sind, betrieben. In dieser Situation ist der gelöste anorganische Kohlenstoff (gesamter anorganischer Kohlenstoff) weit vom Gleichgewicht mit dem atmosphärischen CO2 entfernt. Die Annäherung an das Gleichgewicht durch Ausgasen von CO2 wird verlangsamt durch
- die langsame Reaktion
- H2CO3 ⇌ CO2(aq) + H2O;
- begrenzte Belüftung in einer tiefen Wassersäule; und
- regelmäßiges Nachfüllen von Bikarbonat zur Aufrechterhaltung der Pufferkapazität (oft durch Messung der Gesamtalkalität geschätzt). ⓘ
In dieser Situation sind die Dissoziationskonstanten für die viel schnelleren Reaktionen
- H2CO3 ⇌ H+ + HCO-3 ⇌ 2 H+ + CO2-3
ermöglichen die Vorhersage der Konzentrationen der einzelnen gelösten anorganischen Kohlenstoffarten in Lösung anhand der zugesetzten Konzentration von HCO-3 (das mehr als 90 % der Bjerrum-Plot-Arten von pH 7 bis pH 8 bei 25 °C in Süßwasser ausmacht). Die Zugabe von HCO-3 erhöht die CO2-3-Konzentration bei jedem pH-Wert. Wenn man die obigen Gleichungen umstellt, ergibt sich, dass [Ca2+] = Ksp/[CO2-3] und [CO2-3] = Ka2 [HCO-3]/[H+]. Wenn also die HCO-3-Konzentration bekannt ist, kann die maximale Konzentration von Ca2+-Ionen vor der Skalierung durch CaCO3-Ausfällung anhand der Formel vorhergesagt werden:
- [Ca2+]max = Ksp/Ka2 × [H+]/[HCO-3] ⓘ
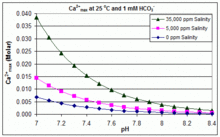
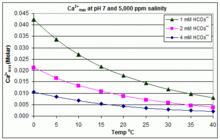
Das Löslichkeitsprodukt für CaCO3 (Ksp) und die Dissoziationskonstanten für die gelösten anorganischen Kohlenstoffspezies (einschließlich Ka2) werden alle wesentlich von der Temperatur und dem Salzgehalt beeinflusst, mit dem Gesamteffekt, dass [Ca2+]max von Süßwasser zu Salzwasser ansteigt und mit steigender Temperatur, steigendem pH-Wert oder zugesetztem Bikarbonatgehalt abnimmt, wie in den nebenstehenden Diagrammen dargestellt. ⓘ
Die Tendenzen sind für das Poolmanagement anschaulich, aber ob Scaling auftritt, hängt auch von anderen Faktoren ab, darunter Wechselwirkungen mit Mg2+, [B(OH)4]- und anderen Ionen im Pool sowie Übersättigungseffekte. Scaling wird häufig in elektrolytischen Chlorgeneratoren beobachtet, wo ein hoher pH-Wert in der Nähe der Kathodenoberfläche herrscht und die Ablagerung von Kesselstein die Temperatur weiter erhöht. Dies ist ein Grund dafür, dass einige Schwimmbadbetreiber Borat gegenüber Bikarbonat als primären pH-Puffer bevorzugen und die Verwendung von calciumhaltigen Schwimmbadchemikalien vermeiden. ⓘ
Löslichkeit in einer stark oder schwach sauren Lösung
Lösungen von starken (HCl), mäßig starken (Sulfamat) oder schwachen (Essig-, Zitronen-, Sorbin-, Milch-, Phosphorsäure) Säuren sind im Handel erhältlich. Sie werden üblicherweise als Entkalkungsmittel zur Entfernung von Kalkablagerungen verwendet. Die maximale Menge an CaCO3, die von einem Liter einer Säurelösung "aufgelöst" werden kann, lässt sich anhand der oben genannten Gleichgewichtsgleichungen berechnen.
- Im Falle einer starken Monosäure mit abnehmender Säurekonzentration [A] = [A-] ergibt sich (mit der molaren Masse von CaCO3 = 100 g/mol):
ⓘ[A] (mol/L) 1 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-10 Initial pH 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6.79 7.00 Endgültiger pH-Wert 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Gelöstes CaCO3
(g/L der Säure)50.0 5.00 0.514 0.0849 0.0504 0.0474 0.0471 0.0470 0.0470
- wobei der Anfangszustand die saure Lösung ohne Ca2+ (ohne Berücksichtigung einer möglichen CO2-Auflösung) und der Endzustand die Lösung mit gesättigtem Ca2+ ist. Bei starken Säurekonzentrationen haben alle Spezies im Endzustand eine vernachlässigbare Konzentration in Bezug auf Ca2+ und A-, so dass sich die Neutralitätsgleichung ungefähr auf 2[Ca2+] = [A-] reduziert, was [Ca2+] ≈ 0,5 [A-] ergibt. Wenn die Konzentration abnimmt, wird [HCO-3] nicht mehr vernachlässigbar, so dass der vorhergehende Ausdruck nicht mehr gültig ist. Für verschwindende Säurekonzentrationen kann man den endgültigen pH-Wert und die Löslichkeit von CaCO3 in reinem Wasser ermitteln.
- Im Fall einer schwachen Monosäure (hier nehmen wir Essigsäure mit pKa = 4,76) mit abnehmender Gesamtsäurekonzentration [A] = [A-] + [AH], erhalten wir:
[A] (mol/L) [Ca2+] ≈ 0.5 [A-] 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-10 Initial pH 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6.79 7.00 Endgültiger pH-Wert 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Gelöstes CaCO3
(g/L der Säure)49.5 4.99 0.513 0.0848 0.0504 0.0474 0.0471 0.0470 0.0470
- Bei gleicher Gesamtsäurekonzentration ist der anfängliche pH-Wert der schwachen Säure weniger sauer als der der starken Säure; die maximal auflösbare CaCO3-Menge ist jedoch ungefähr gleich groß. Dies liegt daran, dass im Endzustand der pH-Wert größer ist als der pKa-Wert, so dass die schwache Säure fast vollständig dissoziiert und am Ende genauso viele H+-Ionen wie die starke Säure liefert, um das Calciumcarbonat zu "lösen".
- Die Berechnung im Falle der Phosphorsäure (die für Haushaltszwecke am häufigsten verwendet wird) ist komplizierter, da die Konzentrationen der vier Dissoziationszustände dieser Säure zusammen mit [HCO-3], [CO2-3], [Ca2+], [H+] und [OH-] berechnet werden müssen. Das System kann auf eine Gleichung siebten Grades für [H+] reduziert werden, deren numerische Lösung folgendes ergibt ⓘ
ⓘ[A] (mol/L) 1 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-10 Initial pH 1.08 1.62 2.25 3.05 4.01 5.00 5.97 6.74 7.00 Endgültiger pH-Wert 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 Gelöstes CaCO3
(g/L der Säure)62.0 7.39 0.874 0.123 0.0536 0.0477 0.0471 0.0471 0.0470
- wobei [A] = [H3PO4] + [H2PO-4] + [HPO2-4] + [PO3-4] die gesamte Säurekonzentration ist. Somit ist Phosphorsäure effizienter als eine Monosäure, da bei dem endgültigen, fast neutralen pH-Wert die Konzentration des zweiten dissoziierten Zustands [HPO2-4] nicht vernachlässigbar ist (siehe Phosphorsäure). ⓘ
Verwendung
Natürliches Calciumcarbonat (Kalkstein) wird in großen Mengen als Rohstoff für die Baustoff-Industrie, als Zuschlagstoff in der Stahlindustrie, als mineralischer Dünger, als Futterkalk und als mineralischer Füllstoff in diversen industriellen Anwendungen verwendet (z. B. in Papieren, Farben, Lacken, Putzen, Kunststoffen und Rückseitenbeschichtungen von Teppichen). Insgesamt werden jährlich über fünf Milliarden Tonnen Kalkgestein abgebaut. ⓘ
Baustoff
Das Haupteinsatzgebiet ist die Herstellung von Zement (Calciumsilicat, Calciumaluminat) und Branntkalk. ⓘ
Durch Brennen von Kalk entsteht Branntkalk. Aus diesem wird durch Löschen mit Wasser Kalkhydrat (Calciumhydroxid Ca(OH)2, gelöschter Kalk) hergestellt. Mit dem Kohlenstoffdioxid der Luft reagiert er wiederum zu Kalk und schließt den technischen Kalkkreislauf. Kalkhydrat und Kalk eignen sich als Putz oder Wandbeschichtungen wie dem Tadelakt. Die ersten Entdecker dieses Phänomens waren die Römer, die im großen Stile Kalkbrennanlagen betrieben. ⓘ
Füllstoff
Nach dem weltweit verkauften Volumen ist Calciumcarbonat der wichtigste Füllstoff. Obgleich mehr als fünf Prozent der Erdkruste aus Calciumcarbonat-Gesteinen besteht, sind nur wenige Lagerstätten für die Gewinnung von Füllstoffen geeignet, die möglichst weiß sein sollen. Der größte industrielle Anwender von weißen Calciumcarbonaten ist mit einer Menge von über 10 Millionen Tonnen (weltweit) pro Jahr die Papierindustrie, danach folgen die Kunststoff- und die Baustoff-Industrie (Putze und Farben) mit insgesamt nochmals 15 Millionen Tonnen pro Jahr. Für den Einsatz in der Papierindustrie, vor allem als Streichfarbe, werden in Europa insbesondere Lagerstätten in Frankreich, Italien, Deutschland, Norwegen und Österreich abgebaut, wobei das Mineral durch Nassmahlung zerkleinert und als Slurry (teilweise per Tankschiff) in den Handel kommt. ⓘ
Landwirtschaft
Beim Bodengefüge werden über den Calciummagnesiumcarbonat-Gehalt der pH-Wert und dadurch die strukturellen Eigenschaften, die biotische Aktivität sowie die Speicherfähigkeit und Umsetzung der Nährstoffe im Boden beeinflusst. Das macht den pH-Wert zur wichtigsten Kenngröße für die Bewirtschaftung aller Bodentypen. Dabei spielt eine ausreichende Kalkversorgung mit „freiem“, nicht an Bodenpartikel gebundenem Calciumcarbonat eine bedeutende Rolle. Durch Kalkung wird versucht, einer Bodenversauerung entgegenzuwirken und die Bodenfruchtbarkeit zu erhalten oder zu verbessern. Calciumcarbonat dient so seit Jahrhunderten zur Verbesserung der Bodenfruchtbarkeit in der Landwirtschaft. Die Bestimmung des Calciumcarbonatgehaltes im Boden erfolgt durch Zusetzung von 10%iger Salzsäure und Bewertung der auftretenden Reaktion, wie einer Schaumbildung. ⓘ
Lebensmittelzusatzstoff
In Deutschland wurde Calciumcarbonat durch die Farbstoff-Verordnung ab 1959 als Lebensmittelfarbstoff für die Verwendung in Lebensmitteln zugelassen. Zur Übernahme der Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in nationales Recht wurde die Farbstoff-Verordnung 1966 angepasst und für Calciumcarbonat die E-Nummer E 170 aufgenommen. Ab 1978 wurde die Verwendung in Deutschland durch die Zusatzstoff-Zulassungsverordnung geregelt. Durch die Verordnung (EG) Nr. 1333/2008, die am 20. Januar 2009 in Kraft trat, ist die Verwendung von Calciumcarbonat als Lebensmittelzusatzstoff im ganzen EWR einheitlich geregelt. E 170 ist in Gruppe I und zusammen mit anderen Farbstoffen, wie Riboflavine, Zuckercouleur oder Carotin in Gruppe II: Lebensmittelfarbstoffe ohne Höchstmengenbeschränkung einsortiert und kann somit ohne Mengenbegrenzung (quantum satis) verwendet werden. Calciumcarbonat wird in Lebensmitteln neben der Verwendung als Farbstoff auch als Füllstoff, Säureregulator, Trennmittel oder Rieselhilfe eingesetzt. Im Speisesalz ist es als Rieselhilfe enthalten. Calciumcarbonat wird gebrochen und/oder gemahlen und kommt stückig oder als Mehl in den Handel. ⓘ