Nuklearmedizin
| Nuklearmedizin ⓘ | |
|---|---|
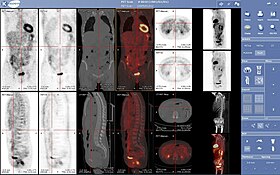 Eine nuklearmedizinische PET-Untersuchung | |
| ICD-10-PCS | C |
| ICD-9 | 92 |
| MeSH | D009683 |
| OPS-301-Kode | 3-70-3-72, 8-53 |
Die Nuklearmedizin oder Nukleologie ist ein medizinisches Fachgebiet, das sich mit der Anwendung radioaktiver Substanzen bei der Diagnose und Behandlung von Krankheiten befasst. Die nuklearmedizinische Bildgebung ist in gewissem Sinne "Radiologie von innen nach außen", da sie Strahlung aufzeichnet, die aus dem Körperinneren austritt, und nicht Strahlung, die von externen Quellen wie Röntgenstrahlen erzeugt wird. Außerdem unterscheiden sich nuklearmedizinische Untersuchungen von der Radiologie, da der Schwerpunkt nicht auf der Darstellung der Anatomie, sondern auf der Funktion liegt. Aus diesem Grund wird sie auch als physiologische Bildgebungsmethode bezeichnet. Die Einzelphotonen-Emissions-Computertomographie (SPECT) und die Positronen-Emissions-Tomographie (PET) sind die beiden häufigsten bildgebenden Verfahren in der Nuklearmedizin. ⓘ
Nuklearmedizin ist die Anwendung von offenen Radionukliden zu diagnostischen und therapeutischen Zwecken. Sie umfasst zudem die Anwendung weiterer radioaktiver Substanzen und kernphysikalischer Verfahren zur Funktions- und Lokalisationsdiagnostik und den Strahlenschutz mit seinen physikalischen, biologischen und medizinischen Grundlagen. ⓘ
Diagnostische medizinische Bildgebung
Diagnostische
Bei der nuklearmedizinischen Bildgebung werden Radiopharmaka innerlich eingenommen, z. B. durch Inhalation, intravenös oder oral. Anschließend wird die von den Radiopharmazeutika abgegebene Strahlung mit externen Detektoren (Gammakameras) aufgenommen und zu Bildern verarbeitet. Dieses Verfahren unterscheidet sich vom diagnostischen Röntgen, bei dem externe Strahlung durch den Körper geleitet wird, um ein Bild zu erzeugen. ⓘ
Es gibt verschiedene Techniken der diagnostischen Nuklearmedizin.
- 2D: Die Szintigraphie ("scint") ist die Verwendung interner Radionuklide zur Erzeugung zweidimensionaler Bilder. ⓘ
Ein nuklearmedizinischer Ganzkörper-Knochenscan. Die nuklearmedizinische Ganzkörper-Knochenszintigraphie wird im Allgemeinen zur Beurteilung verschiedener knochenbezogener Pathologien eingesetzt, z. B. bei Knochenschmerzen, Stressfrakturen, nicht bösartigen Knochenläsionen, Knocheninfektionen oder der Ausbreitung von Krebs auf den Knochen.
- File:nl mpi2.jpg
Nuklearmedizinische Myokardperfusionsuntersuchung mit Thallium-201 für die Ruhebilder (untere Reihen) und Tc-Sestamibi für die Belastungsbilder (obere Reihen). Die nuklearmedizinische Myokardperfusionsuntersuchung spielt eine zentrale Rolle bei der nichtinvasiven Beurteilung der koronaren Herzkrankheit. Die Untersuchung dient nicht nur der Identifizierung von Patienten mit koronarer Herzkrankheit, sondern liefert auch Informationen zur Gesamtprognose oder zum Gesamtrisiko kardialer Ereignisse für den Patienten.
- File:parathyroid subtraction.jpg
Eine nuklearmedizinische Untersuchung der Nebenschilddrüse zeigt ein Nebenschilddrüsenadenom neben dem linken Unterpol der Schilddrüse. Die obige Untersuchung wurde mit Technetium-Sestamibi (1. Spalte) und Jod-123 (2. Spalte) Simultanbildgebung und der Subtraktionstechnik (3. Spalte) durchgeführt.
- File:HIDA.jpg
Normale hepatobiliäre Untersuchung (HIDA-Scan). Die nuklearmedizinische Hepatobiliäruntersuchung ist klinisch nützlich für den Nachweis von Gallenblasenerkrankungen.
- File:ventperf.jpg
Normale Lungenventilation und -perfusion (V/Q-Scan). Die nuklearmedizinische V/Q-Untersuchung ist für die Beurteilung einer Lungenembolie nützlich.
- File:thyroid scan.jpg
Schilddrüsenszintigraphie mit Jod-123 zur Feststellung einer Schilddrüsenüberfunktion. ⓘ
- 3D: SPECT ist ein 3D-Tomographieverfahren, das Gammakameradaten aus vielen Projektionen verwendet und in verschiedenen Ebenen rekonstruiert werden kann. Die Positronen-Emissions-Tomographie (PET) nutzt die Koinzidenzdetektion zur Darstellung funktioneller Prozesse. ⓘ
- File:PET-MIPS-anim.gif
Maximalintensitätsprojektion (MIP) einer Ganzkörper-Positronenemissionstomographie (PET) einer 79 kg schweren Frau nach intravenöser Injektion von 371 MBq 18F-FDG (eine Stunde vor der Messung). ⓘ
Nuklearmedizinische Untersuchungen unterscheiden sich von den meisten anderen bildgebenden Verfahren dadurch, dass diagnostische Tests in erster Linie die physiologische Funktion des untersuchten Systems zeigen, im Gegensatz zur traditionellen anatomischen Bildgebung wie CT oder MRT. Nuklearmedizinische Bildgebungsuntersuchungen sind in der Regel organ-, gewebe- oder krankheitsspezifischer (z. B. Lungen-, Herz-, Knochen-, Hirn-, Tumor-, Infektions-, Parkinsonuntersuchungen usw.) als die Untersuchungen in der konventionellen radiologischen Bildgebung, die sich auf einen bestimmten Körperbereich konzentrieren (z. B. Röntgenaufnahmen des Brustkorbs, CT des Abdomens/Beckens, CT des Kopfes usw.). Darüber hinaus gibt es nuklearmedizinische Untersuchungen, die eine Bildgebung des gesamten Körpers auf der Grundlage bestimmter zellulärer Rezeptoren oder Funktionen ermöglichen. Beispiele hierfür sind Ganzkörper-PET-Scans oder PET/CT-Scans, Gallium-Scans, Indium-Scans der weißen Blutkörperchen, MIBG- und Octreotid-Scans. ⓘ
Die Fähigkeit des Kernstoffwechsels, Krankheitsprozesse anhand von Unterschieden im Stoffwechsel abzubilden, ist zwar unübertroffen, aber nicht einzigartig. Bestimmte Techniken wie die fMRI bilden Gewebe (insbesondere Hirngewebe) anhand des Blutflusses ab und zeigen so den Stoffwechsel. Auch Kontrastverstärkungstechniken sowohl in der CT als auch in der MRT zeigen Geweberegionen, die aufgrund eines Entzündungsprozesses unterschiedlich mit Arzneimitteln umgehen. ⓘ
Diagnostische Tests in der Nuklearmedizin machen sich die Art und Weise zunutze, wie der Körper mit Substanzen umgeht, wenn eine Krankheit oder Pathologie vorliegt. Das in den Körper eingebrachte Radionuklid ist häufig chemisch an einen Komplex gebunden, der sich im Körper charakteristisch verhält; dies wird allgemein als Tracer bezeichnet. Liegt eine Krankheit vor, wird ein Tracer oft im Körper verteilt und/oder anders verarbeitet. Beispielsweise kann der Ligand Methylendiphosphonat (MDP) bevorzugt von den Knochen aufgenommen werden. Durch die chemische Bindung von Technetium-99m an MDP kann die Radioaktivität über das Hydroxylapatit transportiert und für die Bildgebung an den Knochen gebunden werden. Jede gesteigerte physiologische Funktion, z. B. aufgrund eines Knochenbruchs, führt in der Regel zu einer erhöhten Konzentration des Tracers. Dies führt häufig zum Auftreten eines "Hot Spot", d. h. einer fokalen Zunahme der Radioakkumulation oder einer allgemeinen Zunahme der Radioakkumulation im gesamten physiologischen System. Einige Krankheitsprozesse führen zum Ausschluss eines Tracers, was das Auftreten eines "kalten Flecks" zur Folge hat. Es wurden viele Tracerkomplexe entwickelt, um viele verschiedene Organe, Drüsen und physiologische Prozesse abzubilden oder zu behandeln. ⓘ
Die bildgebenden Verfahren Szintigrafie, Positronen-Emissions-Tomographie (PET) und SPECT (single photon emission computed tomography) bilden nach dem Tracer-Prinzip vorwiegend die Funktion eines Organs oder Organsystems ab, im Gegensatz zu den morphologischen bildgebenden Verfahren, die hauptsächlich die Struktur zeigen. Zum Beispiel verwendet man in der Skelettszintigrafie ein Radiopharmakon (99mTechnetium-Methylendiphosphonat), das bevorzugt von knochenbildenden Zellen (Osteoblasten) aufgenommen wird. Normales Knochengewebe zeigt im resultierenden Szintigramm niedrige Aktivität, die von physiologischen Umbauprozessen herrührt. Zonen erhöhter Aktivität lassen dagegen auf verstärkten Knochenumbau und damit auf krankhafte Vorgänge schließen, die an den entsprechenden Stellen im Skelett ablaufen. Dabei kann es sich um Kontusionen, heilende Frakturen, Krebs, gutartige Knochentumore, Arthrosen oder Knochenentzündungen handeln. ⓘ
Dynamische Untersuchungen sind ein weiteres Beispiel für den funktionellen Charakter der Nuklearmedizin. Etwa wird bei der Nierenfunktionsszintigrafie eine Reihe von Bildern in Intervallen zwischen einer und 60 Sekunden über einen Zeitraum von 20 bis 40 Minuten aufgezeichnet. So lässt sich die Anreicherung und Ausscheidung des Radiopharmakons in verschiedenen Organen als Kurven aufzeichnen. Dies ermöglicht zum Beispiel die Beurteilung der Ausscheidungsleistung einer Niere im Verhältnis zur anderen. ⓘ
Ebenfalls zum Gebiet der Nuklearmedizin gehören Nachweis und medizinische Beurteilung von Radioaktivität, die bei Strahlenunfällen in den Körper gelangt ist oder des natürlichen Kalium-40, das der Muskelmasse proportional ist. Dafür stehen nicht-bildgebende Messmethoden (Szintillationsdetektor, Halbleiterdetektor, Ganzkörperzähler und Ausscheidungsmessungen) zur Verfügung. ⓘ
Die häufigsten nuklearmedizinischen Untersuchungsverfahren sind die Schilddrüsenszintigrafie, Skelettszintigrafie, Myokardszintigrafie, Nierenfunktionsszintigrafie und Lungenszintigrafie sowie die Positronen-Emissions-Tomografie. Für viele weitere physiologische Vorgänge existieren nuklearmedizinische Untersuchungen. ⓘ
Als von ionisierenden Strahlen unabhängige Untersuchungsmethoden, die kernphysikalische Effekte ausnutzen, um Bilder vom Inneren des Körpers zu erzeugen und die Zusammensetzung von Geweben zu analysieren, stehen die Magnetresonanztomographie (auch Kernspintomographie genannt) und die Magnetresonanzspektroskopie zur Verfügung. Deren Aussagemöglichkeiten liegen aber nicht so ausgeprägt auf funktionellem Gebiet wie die der klassischen Nuklearmedizin, sondern mehr auf anatomischem, wobei vornehmlich der Wasserstoffgehalt von Geweben zusätzliche, eben funktionelle, Aufschlüsse gibt. Diese Methode wird von dazu berechtigten Radiologen und seltener auch Nuklearmedizinern ausgeübt. ⓘ
Da nuklearmedizinische Untersuchungen oft zu anatomisch nicht eindeutigen Befunden führen (d. h., der Untersucher sieht zwar eine Abweichung von der Norm, kann sie aber nicht genau einer speziellen Körperstruktur, etwa einer Lymphknotengruppe, zuordnen) werden seit etwa dem Jahr 2000 mehr und mehr Kombinationsgeräte angeboten und aufgestellt, bei denen eine nuklearmedizinische Gammakamera oder ein PET-Scanner mit einem mechanisch fest verbundenen Computertomographen kombiniert wird. Dabei können in einem Gang ohne Umlagerung sowohl funktionelle, als auch anatomische Daten erhoben werden und in einem Bildersatz fusioniert werden. Dies verbessert die Anschaulichkeit und in verschiedenen kritischen Fällen auch die Richtigkeit der Diagnose. Solche Geräte nennt man SPECT-CT beziehungsweise PET-CT; an vollintegrierten Lösungen wird gearbeitet, auch gibt es heute (2012) erste – noch überwiegend in der Forschung eingesetzte – PET-MRT-Geräte. Der klinische Wert der PET-MRT ist noch nicht zu beurteilen. ⓘ
Hybride Untersuchungstechniken
In einigen Zentren können die nuklearmedizinischen Aufnahmen mit Hilfe von Software oder Hybridkameras mit Bildern von Modalitäten wie CT oder MRT überlagert werden, um den Teil des Körpers hervorzuheben, in dem das Radiopharmakon konzentriert ist. Dieses Verfahren wird oft als Bildfusion oder Koregistrierung bezeichnet, zum Beispiel SPECT/CT und PET/CT. Die Bildfusionstechnik in der Nuklearmedizin liefert Informationen über die Anatomie und Funktion, die sonst nicht verfügbar wären oder ein invasiveres Verfahren oder eine Operation erfordern würden. ⓘ
- File:abnl petct.jpg
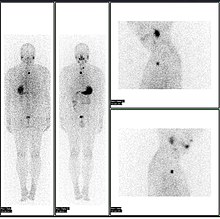
Abnormaler Ganzkörper-PET/CT-Scan mit multiplen Metastasen einer Krebserkrankung. Die Ganzkörper-PET/CT-Untersuchung hat sich zu einem wichtigen Instrument bei der Bewertung von Krebserkrankungen entwickelt. ⓘ
Praktische Bedenken bei der nuklearen Bildgebung
Obwohl die Risiken niedriger Strahlenbelastungen nicht gut erforscht sind, hat sich allgemein der vorsichtige Ansatz durchgesetzt, dass alle Strahlenbelastungen des Menschen so niedrig wie vernünftigerweise praktikabel (ALARP") gehalten werden sollten. (Ursprünglich war dies als "As Low As Reasonably Achievable" (ALARA) bekannt, aber dies wurde in modernen Entwürfen der Gesetzgebung geändert, um mehr Gewicht auf das "Reasonably" und weniger auf das "Achievable" zu legen). ⓘ
Auf der Grundlage des ALARP-Prinzips muss vor der Exposition eines Patienten für eine nuklearmedizinische Untersuchung der Nutzen der Untersuchung ermittelt werden. Dabei müssen gegebenenfalls die besonderen Umstände des betreffenden Patienten berücksichtigt werden. Wenn es beispielsweise unwahrscheinlich ist, dass ein Patient in der Lage ist, eine ausreichende Menge des Verfahrens zu tolerieren, um eine Diagnose zu erhalten, dann wäre es unangemessen, dem Patienten den radioaktiven Tracer zu injizieren. ⓘ
Wenn der Nutzen das Verfahren rechtfertigt, sollte auch die Strahlenbelastung (die Menge der dem Patienten verabreichten Strahlung) so gering wie möglich gehalten werden. Das bedeutet, dass die in der Nuklearmedizin erzeugten Bilder nie besser sein sollten als für eine sichere Diagnose erforderlich. Größere Strahlenbelastungen können das Rauschen in einem Bild reduzieren und es fotografisch ansprechender machen, aber wenn die klinische Frage auch ohne diese Detailgenauigkeit beantwortet werden kann, ist dies unangemessen. ⓘ
Die Strahlendosis der nuklearmedizinischen Bildgebung ist daher je nach Art der Untersuchung sehr unterschiedlich. Die effektive Strahlendosis kann niedriger oder vergleichbar sein als die allgemeine tägliche jährliche Hintergrunddosis in der Umwelt oder sie kann diese bei weitem übersteigen. Ebenso kann sie geringer, im Bereich der Strahlendosis einer CT-Untersuchung des Abdomens/Beckens liegen oder höher sein als diese. ⓘ
Einige nuklearmedizinische Verfahren erfordern eine spezielle Vorbereitung des Patienten vor der Untersuchung, um ein möglichst genaues Ergebnis zu erzielen. Zu den Vorbereitungen vor der Untersuchung kann eine spezielle Diät oder das Absetzen bestimmter Medikamente gehören. Die Patienten werden gebeten, sich vor der Untersuchung mit der nuklearmedizinischen Abteilung zu beraten. ⓘ
Analyse
Das Ergebnis der nuklearmedizinischen Bildgebung ist ein Datensatz mit einem oder mehreren Bildern. Bei Mehrbilddatensätzen kann es sich um eine zeitliche Sequenz (z. B. Cine oder Film) handeln, die oft als "dynamischer" Datensatz bezeichnet wird, eine kardiale Zeitsequenz oder eine räumliche Sequenz, bei der die Gamma-Kamera relativ zum Patienten bewegt wird. SPECT (Single Photon Emission Computed Tomography) ist ein Verfahren, bei dem die von einer rotierenden Gammakamera aufgenommenen Bilder rekonstruiert werden, um ein Bild eines "Schnitts" durch den Patienten an einer bestimmten Position zu erzeugen. Eine Sammlung paralleler Schichten bildet einen Schichtstapel, eine dreidimensionale Darstellung der Verteilung des Radionuklids im Patienten. ⓘ
Der nuklearmedizinische Computer kann Millionen von Quellcodezeilen erfordern, um quantitative Analysepakete für jedes der spezifischen Bildgebungsverfahren in der Nuklearmedizin bereitzustellen. ⓘ
Zeitliche Abläufe können mit Hilfe von kinetischen Modellen wie Multikompartiment-Modellen oder einem Patlak-Plot weiter analysiert werden. ⓘ
Interventionelle Nuklearmedizin
Die Radionuklidtherapie kann zur Behandlung von Erkrankungen wie Schilddrüsenüberfunktion, Schilddrüsenkrebs, Hautkrebs und Blutkrankheiten eingesetzt werden. ⓘ
Bei der nuklearmedizinischen Therapie wird die Strahlendosis innerlich (z. B. intravenös oder oral) oder äußerlich direkt über dem zu behandelnden Gebiet in Form eines Präparats (z. B. bei Hautkrebs) verabreicht. ⓘ
Die in der nuklearmedizinischen Therapie verwendeten Radiopharmaka emittieren ionisierende Strahlung, die sich nur über eine kurze Strecke ausbreitet, wodurch unerwünschte Nebenwirkungen und Schäden an unbeteiligten Organen oder benachbarten Strukturen minimiert werden. Die meisten nuklearmedizinischen Therapien können ambulant durchgeführt werden, da die Behandlung kaum Nebenwirkungen hat und die Strahlenbelastung für die Allgemeinheit in einem sicheren Rahmen gehalten werden kann. ⓘ
Gängige nuklearmedizinische Therapien (unverschlossene Quelle) ⓘ
| Substanz | Zustand ⓘ |
|---|---|
| Jod-131-Natriumjodid | Hyperthyreose und Schilddrüsenkrebs |
| Yttrium-90-Ibritumomab-Tiuxetan (Zevalin) und Jod-131-Tositumomab (Bexxar) | refraktäres Lymphom |
| 131I-MIBG (Metaiodobenzylguanidin) | neuroendokrine Tumore |
| Samarium-153 oder Strontium-89 | palliative Behandlung von Knochenschmerzen |
| Rhenium-188 | Plattenepithelkarzinom oder Basalzellkarzinom der Haut |
In einigen Zentren kann die nuklearmedizinische Abteilung auch implantierte Isotopenkapseln (Brachytherapie) zur Krebsbehandlung einsetzen. ⓘ
Häufig verwendete Strahlenquellen (Radionuklide) für die Brachytherapie ⓘ
| Radionuklid | Typ | Halbwertszeit | Energie ⓘ |
|---|---|---|---|
| Cäsium-137 (137Cs) | γ-Strahlung | 30,17 Jahre | 0,662 MeV |
| Kobalt-60 (60Co) | γ-Strahlung | 5,26 Jahre | 1,17, 1,33 MeV |
| Iridium-192 (192Ir) | β-Teilchen | 73,8 Tage | 0,38 MeV (Mittelwert) |
| Jod-125 (125I) | γ-Strahlen | 59,6 Tage | 27,4, 31,4 und 35,5 keV |
| Palladium-103 (103Pd) | γ-Strahlung | 17,0 Tage | 21 keV (Mittelwert) |
| Ruthenium-106 (106Ru) | β-Teilchen | 1,02 Jahre | 3,54 MeV |
Geschichte
Die Geschichte der Nuklearmedizin enthält Beiträge von Wissenschaftlern aus verschiedenen Disziplinen der Physik, Chemie, Technik und Medizin. Der multidisziplinäre Charakter der Nuklearmedizin macht es Medizinhistorikern schwer, das Geburtsdatum der Nuklearmedizin zu bestimmen. Am ehesten lässt sie sich wohl zwischen der Entdeckung der künstlichen Radioaktivität im Jahr 1934 und der Herstellung von Radionukliden durch das Oak Ridge National Laboratory für medizinische Zwecke im Jahr 1946 einordnen. ⓘ
Die Ursprünge dieser medizinischen Idee reichen bis in die Mitte der 1920er Jahre in Freiburg zurück, als George de Hevesy Experimente mit Ratten verabreichten Radionukliden durchführte und so die Stoffwechselwege dieser Substanzen aufzeigte und das Tracer-Prinzip etablierte. Die Geburtsstunde der Nuklearmedizin schlug 1936, als John Lawrence, der als "Vater der Nuklearmedizin" bekannt ist, sich von seinem Lehrauftrag an der Yale Medical School beurlauben ließ, um seinen Bruder Ernest Lawrence in dessen neuem Strahlungslabor (dem heutigen Lawrence Berkeley National Laboratory) in Berkeley, Kalifornien, zu besuchen. Später führte John Lawrence die erste Anwendung eines künstlichen Radionuklids bei Patienten durch, als er Phosphor-32 zur Behandlung von Leukämie einsetzte. ⓘ
Viele Historiker betrachten die Entdeckung künstlich hergestellter Radionuklide durch Frédéric Joliot-Curie und Irène Joliot-Curie im Jahr 1934 als den wichtigsten Meilenstein der Nuklearmedizin. Im Februar 1934 berichteten sie in der Zeitschrift Nature über die erste künstliche Herstellung von radioaktivem Material, nachdem sie Radioaktivität in Aluminiumfolie entdeckt hatten, die mit einem Poloniumpräparat bestrahlt worden war. Ihre Arbeit baute auf früheren Entdeckungen von Wilhelm Konrad Roentgen (Röntgenstrahlen), Henri Becquerel (radioaktive Uransalze) und Marie Curie (Mutter von Irène Curie) (radioaktives Thorium und Polonium) auf und prägte den Begriff "Radioaktivität". Taro Takemi untersuchte in den 1930er Jahren die Anwendung der Kernphysik in der Medizin. Die Geschichte der Nuklearmedizin ist nicht vollständig, ohne diese frühen Pioniere zu erwähnen. ⓘ
Die Nuklearmedizin erlangte öffentliche Anerkennung als potenzielles Fachgebiet, als am 11. Mai 1946 im Journal of the American Medical Association (JAMA) ein Artikel von Dr. Saul Hertz vom Massachusetts General Hospital und Dr. Arthur Roberts vom Massachusetts Institute of Technology veröffentlicht wurde, in dem die erfolgreiche Behandlung der Basedow-Krankheit mit radioaktivem Jod (RAI) beschrieben wurde. Darüber hinaus brachte Sam Seidlin eine weitere Entwicklung auf diesem Gebiet, indem er eine erfolgreiche Behandlung eines Patienten mit Schilddrüsenkrebsmetastasen mit Radiojod (I-131) beschrieb. Diese Artikel werden von vielen Historikern als die wichtigsten Artikel angesehen, die jemals in der Nuklearmedizin veröffentlicht wurden. Obwohl der früheste Einsatz von I-131 der Therapie von Schilddrüsenkrebs gewidmet war, wurde seine Verwendung später auf die Bildgebung der Schilddrüse, die Quantifizierung der Schilddrüsenfunktion und die Therapie der Schilddrüsenüberfunktion ausgeweitet. Unter den vielen Radionukliden, die für medizinische Zwecke entdeckt wurden, war keines so wichtig wie die Entdeckung und Entwicklung von Technetium-99m. Es wurde erstmals 1937 von C. Perrier und E. Segre als künstliches Element entdeckt, um den Platz 43 im Periodensystem zu füllen. Die Entwicklung eines Generatorsystems zur Herstellung von Technetium-99m in den 1960er Jahren wurde zu einer praktischen Methode für den medizinischen Einsatz. Heute ist Technetium-99m das am häufigsten verwendete Element in der Nuklearmedizin und wird bei einer Vielzahl von nuklearmedizinischen Bildgebungsstudien eingesetzt. ⓘ
Die breite klinische Anwendung der Nuklearmedizin begann in den frühen 1950er Jahren, als sich das Wissen über Radionuklide, den Nachweis von Radioaktivität und die Verwendung bestimmter Radionuklide zur Verfolgung biochemischer Prozesse erweiterte. Die Pionierarbeit von Benedict Cassen bei der Entwicklung des ersten geradlinigen Scanners und die Szintillationskamera von Hal O. Anger (Anger-Kamera) erweiterten die junge Disziplin der Nuklearmedizin zu einem vollwertigen Fachgebiet der medizinischen Bildgebung. ⓘ
Anfang der 1960er Jahre entwickelten Niels A. Lassen, David H. Ingvar und Erik Skinhøj in Südskandinavien Techniken, mit denen die ersten Blutflusskarten des Gehirns erstellt werden konnten. Dazu wurde zunächst Xenon-133 inhaliert; bald darauf wurde ein intraarterielles Äquivalent entwickelt, das die Messung der lokalen Verteilung der Hirnaktivität bei Patienten mit neuropsychiatrischen Störungen wie Schizophrenie ermöglichte. Spätere Versionen hatten 254 Szintillatoren, so dass ein zweidimensionales Bild auf einem Farbmonitor erzeugt werden konnte. Damit konnten sie Bilder erstellen, die die Hirnaktivierung beim Sprechen, Lesen, bei der visuellen oder auditiven Wahrnehmung und bei willkürlichen Bewegungen widerspiegeln. Die Technik wurde auch eingesetzt, um z. B. imaginäre sequentielle Bewegungen, mentales Rechnen und mentale räumliche Navigation zu untersuchen. ⓘ
In den 1970er Jahren konnten die meisten Organe des Körpers mit nuklearmedizinischen Verfahren sichtbar gemacht werden. Im Jahr 1971 erkannte die American Medical Association die Nuklearmedizin offiziell als medizinisches Fachgebiet an. 1972 wurde das American Board of Nuclear Medicine und 1974 das American Osteopathic Board of Nuclear Medicine gegründet, womit sich die Nuklearmedizin als eigenständiges medizinisches Fachgebiet etablierte. ⓘ
In den 1980er Jahren wurden Radiopharmaka für die Diagnose von Herzkrankheiten entwickelt. Die Entwicklung der Einzelphotonen-Emissions-Computertomographie (SPECT) führte etwa zur gleichen Zeit zur dreidimensionalen Rekonstruktion des Herzens und zur Etablierung des Fachgebiets der Nuklearkardiologie. ⓘ
Zu den neueren Entwicklungen in der Nuklearmedizin gehört die Erfindung des ersten Positronen-Emissions-Tomographen (PET). Das Konzept der Emissions- und Transmissions-Tomographie, das später zur Einzelphotonen-Emissions-Computertomographie (SPECT) weiterentwickelt wurde, wurde von David E. Kuhl und Roy Edwards in den späten 1950er Jahren eingeführt. Ihre Arbeit führte zur Entwicklung und zum Bau mehrerer Tomographiegeräte an der Universität von Pennsylvania. Tomographische Bildgebungsverfahren wurden an der Washington University School of Medicine weiterentwickelt. Diese Innovationen führten zur Fusionsbildgebung mit SPECT und CT durch Bruce Hasegawa von der University of California San Francisco (UCSF) und zum ersten PET/CT-Prototyp von D. W. Townsend von der University of Pittsburgh im Jahr 1998. ⓘ
Die PET- und PET/CT-Bildgebung verzeichnete in den ersten Jahren ein langsameres Wachstum, was auf die Kosten der Modalität und die Notwendigkeit eines Zyklotrons vor Ort oder in der Nähe zurückzuführen war. Eine Verwaltungsentscheidung zur Genehmigung der Kostenerstattung für begrenzte PET- und PET/CT-Anwendungen in der Onkologie hat jedoch in den letzten Jahren zu einem phänomenalen Wachstum und einer breiten Akzeptanz geführt, die auch durch die Einführung von 18F-markierten Tracern für Standardverfahren begünstigt wurde, die die Arbeit an Standorten ohne Zyklotron ermöglichen. Die PET/CT-Bildgebung ist heute ein fester Bestandteil der Onkologie zur Diagnose, Stadieneinteilung und Behandlungsüberwachung. Ein vollständig integrierter MRT/PET-Scanner ist seit Anfang 2011 auf dem Markt. ⓘ
Quellen für Radionuklide
99mTc wird den Krankenhäusern in der Regel über einen Radionuklidgenerator geliefert, der das Ausgangsradionuklid Molybdän-99 enthält. 99Mo wird in der Regel als Spaltprodukt von 235U in Kernreaktoren gewonnen, doch haben weltweite Versorgungsengpässe dazu geführt, dass andere Produktionsmethoden erforscht werden. Etwa ein Drittel des weltweiten und der größte Teil des europäischen Angebots an medizinischen Isotopen wird im Kernreaktor Petten in den Niederlanden hergestellt. Ein weiteres Drittel des Weltangebots und der größte Teil des nordamerikanischen Angebots wurde bis zu seiner endgültigen Stilllegung im Jahr 2018 in den Chalk River Laboratories in Chalk River, Ontario, Kanada, hergestellt. ⓘ
Das am häufigsten verwendete Radioisotop in PET, 18F, wird nicht in einem Kernreaktor, sondern in einem Kreisbeschleuniger, einem Zyklotron, hergestellt. Das Zyklotron wird verwendet, um Protonen zu beschleunigen, die das stabile schwere Sauerstoffisotop 18O beschießen. Das 18O macht etwa 0,20 % des gewöhnlichen Sauerstoffs (meist Sauerstoff-16) aus, aus dem es extrahiert wird. Das 18F wird dann normalerweise zur Herstellung von FDG verwendet. ⓘ
| Isotop | Symbol | Z | T1/2 | Zerfall | Gamma (keV) | Beta-Energie (keV) ⓘ |
|---|---|---|---|---|---|---|
| Bildgebung: | ||||||
| Fluor-18 | 18F | 9 | 109.77 m | β+ | 511 (193%) | 249.8 (97%) |
| Gallium-67 | 67Ga | 31 | 3.26 d | ec | 93 (39%), 185 (21%), 300 (17%) |
- |
| Krypton-81m | 81mKr | 36 | 13.1 s | IT | 190 (68%) | - |
| Rubidium-82 | 82Rb | 37 | 1.27 m | β+ | 511 (191%) | 3.379 (95%) |
| Stickstoff-13 | 13N | 7 | 9.97 m | β+ | 511 (200%) | 1190 (100%) |
| Technetium-99m | 99mTc | 43 | 6.01 h | IT | 140 (89%) | - |
| Indium-111 | 111In | 49 | 2.80 d | ec | 171 (90%), 245 (94%) |
- |
| Jod-123 | 123I | 53 | 13.3 h | ec | 159 (83%) | - |
| Xenon-133 | 133Xe | 54 | 5.24 d | β− | 81 (31%) | 0.364 (99%) |
| Thallium-201 | 201Tl | 81 | 3.04 d | ec | 69–83* (94%), 167 (10%) |
- |
| Therapie: | ||||||
| Yttrium-90 | 90Y | 39 | 2.67 d | β− | - | 2.280 (100%) |
| Jod-131 | 131I | 53 | 8.02 d | β− | 364 (81%) | 0.807 (100%) |
| Lutetium-177 | 177Lu | 71 | 6.65 d | β− | 113 (6.6%),
208 (11%) |
497 (78.6%),
384 (9.1%), 176 (12.2%) |
|
Z = Ordnungszahl, die Anzahl der Protonen; T1/2 = Halbwertszeit; Zerfall = Art des Zerfalls | ||||||
Eine typische nuklearmedizinische Studie beinhaltet die Verabreichung eines Radionuklids in den Körper durch intravenöse Injektion in flüssiger oder aggregierter Form, durch Einnahme in Verbindung mit der Nahrung, durch Inhalation als Gas oder Aerosol oder, seltener, durch Injektion eines Radionuklids, das mikroverkapselt wurde. Einige Untersuchungen erfordern die Markierung der eigenen Blutzellen des Patienten mit einem Radionuklid (Leukozytenszintigraphie und Erythrozytenszintigraphie). Die meisten diagnostischen Radionuklide emittieren Gammastrahlen entweder direkt durch ihren Zerfall oder indirekt durch Elektron-Positron-Annihilation, während die zellschädigenden Eigenschaften von Betateilchen für therapeutische Anwendungen genutzt werden. Raffinierte Radionuklide für den Einsatz in der Nuklearmedizin stammen aus Spaltungs- oder Fusionsprozessen in Kernreaktoren, die Radionuklide mit längeren Halbwertszeiten erzeugen, oder aus Zyklotrons, die Radionuklide mit kürzeren Halbwertszeiten produzieren, oder sie nutzen natürliche Zerfallsprozesse in speziellen Generatoren, z. B. Molybdän/Technetium oder Strontium/Rubidium. ⓘ
Die am häufigsten verwendeten intravenös verabreichten Radionuklide sind Technetium-99m, Jod-123, Jod-131, Thallium-201, Gallium-67, Fluor-18-Fluordesoxyglucose und Indium-111-markierte Leukozyten. Die am häufigsten verwendeten gasförmigen/aerosolen Radionuklide sind Xenon-133, Krypton-81m und (aerosolisiertes) Technetium-99m. ⓘ
Richtlinien und Verfahren
Strahlendosis
Ein Patient, der sich einem nuklearmedizinischen Verfahren unterzieht, erhält eine Strahlendosis. Nach den derzeitigen internationalen Leitlinien wird davon ausgegangen, dass jede Strahlendosis, wie gering sie auch sein mag, ein Risiko darstellt. Die Strahlendosis, die einem Patienten bei einer nuklearmedizinischen Untersuchung verabreicht wird, ist zwar nicht bewiesen, aber es wird allgemein davon ausgegangen, dass sie ein sehr geringes Risiko für die Entstehung von Krebs darstellt. In dieser Hinsicht ähnelt sie dem Risiko von Röntgenuntersuchungen, mit dem Unterschied, dass die Dosis von innen abgegeben wird und nicht von einer externen Quelle wie einem Röntgengerät, und dass die Dosis in der Regel deutlich höher ist als bei Röntgenstrahlen. ⓘ
Die Strahlendosis einer nuklearmedizinischen Untersuchung wird als effektive Dosis in der Einheit Sievert (üblicherweise in Millisievert, mSv) angegeben. Die effektive Dosis einer Untersuchung wird durch die Menge der verabreichten Radioaktivität in Megabcquerel (MBq), die physikalischen Eigenschaften des verwendeten Radiopharmakons, seine Verteilung im Körper und seine Ausscheidungsrate aus dem Körper beeinflusst. ⓘ
Die effektiven Dosen können von 6 μSv (0,006 mSv) für eine 3 MBq Chrom-51-EDTA-Messung der glomerulären Filtrationsrate bis zu 11,2 mSv (11.200 μSv) für eine 80 MBq Thallium-201-Myokarduntersuchung reichen. Die übliche Knochenszintigraphie mit 600 MBq Technetium-99m MDP hat eine effektive Dosis von etwa 2,9 mSv (2.900 μSv). ⓘ
Frühere Maßeinheiten waren das Curie (Ci), das 3,7E10 Bq entspricht, und auch 1,0 Gramm Radium (Ra-226); das Rad (Strahlungs-Energiedosis), das jetzt durch das Gray ersetzt wurde, und das Rem (Röntgen-Äquivalentmann), das jetzt durch das Sievert ersetzt wurde. Rad und Rem sind bei fast allen nuklearmedizinischen Verfahren im Wesentlichen gleichwertig, und nur Alphastrahlung erzeugt aufgrund ihrer viel höheren relativen biologischen Wirksamkeit (RBW) einen höheren Rem- oder Sv-Wert. Alphastrahler werden heute nur noch selten in der Nuklearmedizin verwendet, wurden aber vor dem Aufkommen der in Kernreaktoren und Beschleunigern erzeugten Radionuklide in großem Umfang eingesetzt. Die Konzepte im Zusammenhang mit der Strahlenexposition des Menschen fallen in den Bereich der Gesundheitsphysik; die Entwicklung und Anwendung sicherer und wirksamer nuklearmedizinischer Verfahren ist ein Schwerpunkt der Medizinphysik. ⓘ
Rechtliche Rahmenbedingungen und Leitlinien
In verschiedenen Ländern der Welt gibt es Regelwerke, die für den Umgang mit und die Verwendung von Radionukliden in verschiedenen medizinischen Bereichen zuständig sind. In den USA beispielsweise haben die Nuclear Regulatory Commission (NRC) und die Food and Drug Administration (FDA) Richtlinien erlassen, die von Krankenhäusern zu befolgen sind. Wenn es sich nicht um radioaktive Materialien handelt, wie z. B. Röntgenstrahlen, werden sie nicht von der NRC, sondern von den einzelnen Bundesstaaten geregelt. Internationale Organisationen wie die Internationale Atomenergie-Organisation (IAEO) haben regelmäßig verschiedene Artikel und Richtlinien für bewährte Verfahren in der Nuklearmedizin veröffentlicht und berichten über neue Technologien in der Nuklearmedizin. Zu den weiteren Faktoren, die in der Nuklearmedizin berücksichtigt werden, gehören die Krankengeschichte des Patienten und die Behandlung nach der Bestrahlung. Gruppen wie die Internationale Strahlenschutzkommission haben Informationen darüber veröffentlicht, wie die Entlassung von Patienten aus einem Krankenhaus mit nicht versiegelten Radionukliden zu handhaben ist. ⓘ
„In-vivo“-Verfahren
In-vivo-Verfahren sind Messverfahren, bei denen ein Radiopharmakon („Tracer“) in den Körper eingebracht wird, dessen Gammastrahlung oder Vernichtungsstrahlung von außerhalb des Körpers sehr genau gemessen werden kann. (Zusätzliche Information über Organfunktionen liefern fallweise auch Radioaktivitätsmessungen von Blutproben oder Ausscheidungen.) ⓘ
Ein Radiopharmakon ist ein Radionuklid oder die chemische Verbindung eines Radionuklids mit anderen Stoffen. Wie ein Radiopharmakon in der Nuklearmedizin verwendet wird, hängt wesentlich von zwei Eigenschaften ab:
- Radioaktivität (Zerfallsverhalten und entstehende Strahlung)
- Pharmakokinetik (Verteilung im Organismus, Teilnahme an Körperfunktionen, Eliminierung). ⓘ
Therapie
In der nuklearmedizinischen Therapie werden Radiopharmaka eingesetzt, die Beta- oder seltener Alphastrahlung abgeben. Diese Strahlungsarten zeichnen sich durch eine geringe Durchdringungstiefe (wenige Millimeter bei Betastrahlung, einige µm bei Alphastrahlung) aus. Dadurch entfalten sie ihre Wirkung am Ort der Anreicherung im Organismus. Die Kinetik des Radiopharmakons bestimmt, wo diese Anreicherung stattfindet. So zielt beispielsweise die Radiojodtherapie auf die Schilddrüse. Das Radiopharmakon wird vorzugsweise von hormonproduzierenden Follikelzellen aufgenommen und zerstört lokal überschüssiges oder bösartiges Gewebe (siehe auch Hyperthyreose, Schilddrüsenkarzinom). Radiojod wird gewöhnlich in Form einer Therapiekapsel oral verabreicht. ⓘ
Eine weitere Möglichkeit besteht in der Verabreichung künstlich hergestellter, mit einem geeigneten Radionuklid versehener monoklonaler Antikörper oder Peptide (kleine Eiweißmoleküle). Ein solches Radiopharmakon kann intravenös injiziert werden und findet „von selbst“ sein Zielorgan. ⓘ
Wenn das Zielorgan räumlich gut abgegrenzt und zugänglich ist, bietet sich die direkte Einbringung des therapeutischen Radionuklids an (Endoradiotherapie). Ein solches Verfahren ist die Radiosynoviorthese, die zunehmend bei der chronischen Polyarthritis, aktivierten Arthrose oder anderen Gelenkerkrankungen durchgeführt wird. Dabei wird Yttrium-90 oder ein anderer Betastrahler in den Gelenkspalt injiziert, um die Gelenkinnenhaut zu veröden. Als nicht invasive Anwendung gilt die epidermale Radioisotopentherapie, welche bei der Behandlung von Basaliomen oder Spinaliomen der Haut zum Einsatz kommt. Dabei wird Rhenium-188, ein Betastrahler, direkt auf einer Folie über der zu behandelnden Läsion aufgebracht. ⓘ
Die Anwendung der Gammastrahlung aus umschlossenen radioaktiven Substanzen, die Brachytherapie, wird nicht zu den nuklearmedizinischen Verfahren gezählt. ⓘ
„In-vitro“-Verfahren
Als In-vitro-Verfahren werden Labormethoden wie der Radioimmunoassay (RIA) bezeichnet. Bei diesen Verfahren können Substanzkonzentration in aus dem Körper gewonnenem Probenmaterial mittels immunologischer Reaktionen besonders genau bestimmt werden, da ein Reaktionspartner zuvor radioaktiv markiert wurde. ⓘ
Der Facharzt für Nuklearmedizin
Um nach einem absolvierten Medizinstudium in Deutschland als Facharzt für Nuklearmedizin tätig zu werden, bedarf es einer fünfjährigen Weiterbildung,
- davon ein Jahr in der stationären Patientenversorgung,
- wovon 6 Monate in einem anderen Gebiet abgeleistet werden können
- ein Jahr in der Radiologie kann angerechnet werden.
Die Weiterbildungsordnung schreibt bestimmte Mindestzahlen für Untersuchungen und Therapien vor. Vor der Facharztprüfung müssen außerdem noch spezielle Kurse im Strahlenschutz absolviert werden. ⓘ



