Nervengift

Neurotoxine sind Toxine, die das Nervengewebe zerstören (Neurotoxizität verursachen). Neurotoxine sind eine umfangreiche Klasse exogener chemischer neurologischer Insulte, die die Funktion sowohl des sich entwickelnden als auch des reifen Nervengewebes beeinträchtigen können. Der Begriff kann auch zur Klassifizierung endogener Verbindungen verwendet werden, die sich bei abnormem Kontakt als neurologisch toxisch erweisen können. Obwohl Neurotoxine oft neurologisch destruktiv sind, ist ihre Fähigkeit, spezifisch auf neurale Komponenten einzuwirken, für die Untersuchung von Nervensystemen wichtig. Gängige Beispiele für Neurotoxine sind Blei, Ethanol (Trinkalkohol), Glutamat, Stickstoffoxid, Botulinumtoxin (z. B. Botox), Tetanustoxin und Tetrodotoxin. Einige Stoffe wie Stickstoffmonoxid und Glutamat sind in der Tat für die ordnungsgemäße Funktion des Körpers unerlässlich und üben nur bei übermäßigen Konzentrationen neurotoxische Wirkungen aus. ⓘ
Neurotoxine hemmen die Kontrolle der Neuronen über die Ionenkonzentrationen in der Zellmembran oder die Kommunikation zwischen Neuronen über eine Synapse. Die lokale Pathologie der Neurotoxinexposition umfasst häufig Exzitotoxizität oder Apoptose der Neuronen, kann aber auch Gliazellenschäden umfassen. Zu den makroskopischen Manifestationen einer Neurotoxinexposition können weit verbreitete Schädigungen des Zentralnervensystems wie geistige Behinderung, anhaltende Gedächtnisstörungen, Epilepsie und Demenz gehören. Darüber hinaus sind neurotoxinvermittelte Schädigungen des peripheren Nervensystems wie Neuropathie oder Myopathie häufig. Eine Reihe von Behandlungen, die darauf abzielen, neurotoxinvermittelte Schäden abzuschwächen, wie z. B. die Verabreichung von Antioxidantien und Antitoxinen, wurden bereits unterstützt. ⓘ
Nervengifte oder Neurotoxine sind Stoffe, die bereits in einer geringen Dosis eine schädigende Wirkung auf Nervenzellen bzw. Nervengewebe erzielen. Nervengifte sind eine heterogene Gruppe von Stoffen mit einer Vielzahl an Wirkmechanismen. Die Mehrheit der Nervengifte sind exogene, natürlich vorkommende Toxine, die von Organismen stammen. Einige chemische Elemente sind Nervengifte, darunter Schwermetalle wie Blei, Cadmium, Quecksilber und Thallium. Die Bezeichnung „Nervengas“ – insbesondere für Nervenkampfstoffe – ist irreführend, da alle hier aufgeführten Nervenkampfstoffe teilweise hochviskose Flüssigkeiten sind und nur wenige Gase zu den Nervengiften zählen. Der Begriff stammt daher, dass die ersten chemischen Kampfstoffe – wie etwa Chlor – Gase waren und zum Schutz dagegen Gasmasken eingesetzt wurden, welche auch einen geringen Schutz gegen Nervenkampfstoffe bieten. Eine endogene Vergiftung von Nervenzellen kann durch Reizüberflutung und darauf folgende übermäßige Ausschüttung von Neurotransmittern auftreten (Excitotoxizität). ⓘ
Hintergrund

Die Exposition gegenüber Neurotoxinen in der Gesellschaft ist nicht neu, da die Zivilisationen schon seit Tausenden von Jahren neurologisch zerstörerischen Verbindungen ausgesetzt sind. Ein bemerkenswertes Beispiel ist die möglicherweise erhebliche Bleiexposition während des Römischen Reiches, die auf die Entwicklung ausgedehnter Rohrleitungsnetze und die Angewohnheit zurückzuführen ist, mit Blei versetzten Wein in Bleipfannen zu kochen, um ihn zu süßen, wobei Bleiacetat entsteht, das als "Bleizucker" bekannt ist. Neurotoxine sind Teil der menschlichen Geschichte, weil das Nervensystem so zerbrechlich und anfällig für Störungen ist. ⓘ
Das Nervengewebe im Gehirn, im Rückenmark und in der Peripherie stellt ein außerordentlich komplexes biologisches System dar, das viele der einzigartigen Eigenschaften des Menschen weitgehend bestimmt. Wie bei jedem hochkomplexen System können jedoch selbst kleine Störungen in seiner Umgebung zu erheblichen Funktionsstörungen führen. Zu den Eigenschaften, die zur Anfälligkeit des Nervengewebes führen, gehören eine große Oberfläche der Neuronen, ein hoher Lipidgehalt, der lipophile Toxine zurückhält, eine hohe Durchblutung des Gehirns, die zu einer erhöhten effektiven Toxinexposition führt, und die Persistenz der Neuronen während des gesamten Lebens eines Menschen, was zu einer Verstärkung der Schäden führt. Daher verfügt das Nervensystem über eine Reihe von Mechanismen, die es vor internen und externen Angriffen schützen sollen, darunter die Blut-Hirn-Schranke. ⓘ
Die Blut-Hirn-Schranke (BHS) ist ein wichtiges Beispiel für diesen Schutz, der verhindert, dass Giftstoffe und andere schädliche Verbindungen in das Gehirn gelangen. Da das Gehirn mit Nährstoffen versorgt und Abfallstoffe abtransportiert werden müssen, wird es vom Blutstrom durchströmt. Das Blut kann jedoch eine Reihe von aufgenommenen Toxinen transportieren, die zum Absterben von Nervenzellen führen würden, wenn sie das Nervengewebe erreichen. Daher umgeben schützende Zellen, die so genannten Astrozyten, die Kapillaren im Gehirn und nehmen Nährstoffe aus dem Blut auf, um sie anschließend zu den Neuronen zu transportieren, wodurch das Gehirn wirksam vor einer Reihe potenzieller chemischer Einflüsse geschützt wird. ⓘ
Diese Schranke bildet eine dichte hydrophobe Schicht um die Kapillaren im Gehirn, die den Transport von großen oder hydrophilen Verbindungen verhindert. Zusätzlich zur Blut-Hirn-Schranke bietet der Plexus choroideus eine Schutzschicht gegen die Absorption von Toxinen im Gehirn. Die Plexus choroideus sind vaskularisierte Gewebeschichten, die sich im dritten, vierten und seitlichen Ventrikel des Gehirns befinden und durch die Funktion ihrer Ependymzellen für die Synthese der Liquorflüssigkeit (CSF) verantwortlich sind. Durch die selektive Passage von Ionen und Nährstoffen und das Auffangen von Schwermetallen wie Blei sorgen die Aderhautgeflechte für eine streng regulierte Umgebung, in der sich das Gehirn und das Rückenmark befinden. ⓘ

Da sie hydrophob und klein sind oder die Funktion der Astrozyten hemmen, können einige Verbindungen, darunter bestimmte Neurotoxine, in das Gehirn eindringen und erhebliche Schäden verursachen. In der heutigen Zeit stehen Wissenschaftler und Ärzte vor der Herausforderung, Neurotoxine zu identifizieren und zu behandeln, was zu einem wachsenden Interesse sowohl an der neurotoxikologischen Forschung als auch an klinischen Studien geführt hat. Obwohl die klinische Neurotoxikologie ein noch weitgehend junges Gebiet ist, wurden bei der Identifizierung zahlreicher Umweltneurotoxine große Fortschritte erzielt, was zur Klassifizierung von 750 bis 1000 bekannten potenziell neurotoxischen Verbindungen geführt hat. Da es von entscheidender Bedeutung ist, Neurotoxine in der Umwelt zu finden, hat die US-Umweltschutzbehörde (EPA) spezielle Protokolle für die Prüfung und Bestimmung neurotoxischer Wirkungen von Verbindungen entwickelt (USEPA 1998). Darüber hinaus werden zunehmend In-vitro-Systeme eingesetzt, da sie erhebliche Verbesserungen gegenüber den früher üblichen In-vivo-Systemen bieten. Beispiele für diese Verbesserungen sind vertretbare, einheitliche Umgebungen und die Eliminierung von kontaminierenden Effekten des systemischen Metabolismus. In-vitro-Systeme sind jedoch mit Problemen behaftet, da es schwierig ist, die Komplexität des Nervensystems, wie z. B. die Interaktionen zwischen den unterstützenden Astrozyten und Neuronen bei der Bildung der BHS, richtig nachzubilden. Um die Bestimmung von Neurotoxinen bei In-vitro-Tests noch weiter zu erschweren, kann es schwierig sein, zwischen Neurotoxizität und Zytotoxizität zu unterscheiden, da es in-vivo nicht möglich ist, Neuronen direkt den Substanzen auszusetzen, wie es in-vitro der Fall ist. Darüber hinaus lässt die Reaktion der Zellen auf Chemikalien möglicherweise keine genaue Unterscheidung zwischen Neurotoxinen und Zytotoxinen zu, da Symptome wie oxidativer Stress oder Veränderungen des Skeletts als Reaktion auf beide auftreten können. ⓘ
In dem Bemühen, diese Komplikation zu beheben, wurden kürzlich Neuritenauswüchse (entweder axonal oder dendritisch) als Reaktion auf angewandte Verbindungen als genauere Unterscheidung zwischen echten Neurotoxinen und Zytotoxinen in einer In-vitro-Testumgebung vorgeschlagen. Aufgrund der erheblichen Ungenauigkeiten, die mit diesem Verfahren verbunden sind, hat es jedoch nur langsam eine breite Unterstützung gefunden. Darüber hinaus werden biochemische Mechanismen bei Neurotoxin-Tests immer häufiger eingesetzt, so dass Verbindungen daraufhin überprüft werden können, ob sie ausreichen, um eine Störung der Zellmechanismen hervorzurufen, wie z. B. die Hemmung der Acetylcholinesterase-Kapazität von Organophosphaten (einschließlich DDT und Sarin-Gas). Obwohl die Methoden zur Bestimmung der Neurotoxizität noch erheblich weiterentwickelt werden müssen, hat sich die Identifizierung schädlicher Verbindungen und der Symptome einer Toxinexposition deutlich verbessert. ⓘ
Anwendungen in der Neurowissenschaft
Trotz ihrer unterschiedlichen chemischen Eigenschaften und Funktionen haben Neurotoxine die gemeinsame Eigenschaft, dass sie durch einen Mechanismus wirken, der entweder zur Störung oder Zerstörung notwendiger Komponenten des Nervensystems führt. Neurotoxine können jedoch aufgrund ihres Aufbaus im Bereich der Neurowissenschaften sehr nützlich sein. Da das Nervensystem der meisten Organismen sowohl hochkomplex als auch überlebensnotwendig ist, ist es ein natürliches Angriffsziel sowohl für Raubtiere als auch für Beutetiere geworden. Da giftige Organismen ihre Neurotoxine häufig einsetzen, um ein Raubtier oder eine Beute sehr schnell zu überwältigen, haben sich die Toxine so entwickelt, dass sie für ihre Zielkanäle sehr spezifisch sind, so dass das Toxin nicht ohne weiteres an andere Ziele binden kann (siehe Ionenkanal-Toxine). Neurotoxine stellen somit ein wirksames Mittel dar, mit dem bestimmte Elemente des Nervensystems genau und effizient angegriffen werden können. Ein frühes Beispiel für ein auf Neurotoxinen basierendes Targeting war die Verwendung von radioaktiv markiertem Tetrodotoxin, um Natriumkanäle zu untersuchen und präzise Messungen ihrer Konzentration entlang der Nervenmembranen zu erhalten. Durch die Isolierung bestimmter Kanalaktivitäten haben Neurotoxine das ursprüngliche Hodgkin-Huxley-Modell des Neurons verbessert, in dem die Theorie aufgestellt wurde, dass einzelne generische Natrium- und Kaliumkanäle für die meisten Funktionen des Nervengewebes verantwortlich sein könnten. Ausgehend von diesem grundlegenden Verständnis hat die Verwendung gängiger Verbindungen wie Tetrodotoxin, Tetraethylammonium und Bungarotoxine zu einem viel tieferen Verständnis der unterschiedlichen Verhaltensweisen einzelner Neuronen geführt. ⓘ
Mechanismen der Aktivität
Da es sich bei Neurotoxinen um Verbindungen handelt, die sich negativ auf das Nervensystem auswirken, besteht eine Reihe von Mechanismen, über die sie wirken, in der Hemmung der zellulären Prozesse von Neuronen. Diese gehemmten Prozesse können von Membrandepolarisationsmechanismen bis zur Kommunikation zwischen Neuronen reichen. Durch die Hemmung der Fähigkeit von Neuronen, ihre erwarteten intrazellulären Funktionen auszuführen oder ein Signal an eine benachbarte Zelle weiterzuleiten, können Neurotoxine einen Stillstand des Nervensystems (wie im Falle von Botulinumtoxin) oder sogar den Tod von Nervengewebe herbeiführen. Die Zeit, die für das Auftreten von Symptomen nach einer Neurotoxinexposition erforderlich ist, kann zwischen den verschiedenen Toxinen variieren und in der Größenordnung von Stunden für Botulinumtoxin und Jahren für Blei liegen. ⓘ
| Klassifizierung der Neurotoxine | Neurotoxine ⓘ |
|---|---|
| Na-Kanal-Inhibitoren | Tetrodotoxin |
| K-Kanal-Hemmer | Tetraethylammonium |
| Cl-Kanal-Hemmer | Chlorotoxin, |
| Ca-Kanal-Hemmer | Conotoxin |
| Inhibitoren der synaptischen Vesikelfreisetzung | Botulinumtoxin, Tetanustoxin |
| Rezeptor-Hemmer | Bungarotoxin |
| Rezeptor-Agonisten | Caramboxin
25I-NBOMe JWH-018 5-MEO-DiPT |
| Blut-Hirn-Schranken-Inhibitoren | Quecksilber |
| Störung des Zytoskeletts | Arsen, Ammoniak |
| Ca-vermittelte Zytotoxizität | Blei |
| Mehrere Wirkungen | Ethanol und Methanol |
| Endogene Neurotoxinquellen | Stickstoffmonoxid, Glutamat, Dopamin |
Hemmstoffe
Natriumkanal
Tetrodotoxin

Tetrodotoxin (TTX) ist ein Gift, das von Organismen produziert wird, die zur Ordnung der Tetraodontiformes gehören, zu denen der Kugelfisch, der Sonnenbarsch und der Igelfisch gehören. Bei den Kugelfischen findet sich TTX in der Leber, den Keimdrüsen, den Därmen und der Haut. TTX kann bei Verzehr tödlich sein und ist in vielen Ländern zu einer häufigen Vergiftung geworden. Zu den häufigen Symptomen des TTX-Konsums gehören Parästhesien (oft auf den Mund und die Gliedmaßen beschränkt), Muskelschwäche, Übelkeit und Erbrechen, die oft innerhalb von 30 Minuten nach der Einnahme auftreten. Der primäre Mechanismus, über den TTX toxisch wirkt, ist die Hemmung der Natriumkanalfunktion, wodurch die Funktionsfähigkeit der neuronalen Kommunikation verringert wird. Diese Hemmung betrifft vor allem eine anfällige Untergruppe von Natriumkanälen, die als TTX-empfindlich (TTX-s) bekannt sind und die auch weitgehend für den Natriumstrom verantwortlich sind, der die Depolarisationsphase der neuronalen Aktionspotenziale antreibt.
TTX-resistent (TTX-r) ist eine weitere Form des Natriumkanals, der nur begrenzt empfindlich auf TTX reagiert und hauptsächlich in Axonen mit kleinem Durchmesser vorkommt, wie z. B. in Neuronen der Nozizeption. Wird eine signifikante Menge TTX eingenommen, bindet es Natriumkanäle in Neuronen und verringert deren Membrandurchlässigkeit für Natrium. Dies führt zu einer erhöhten effektiven Schwelle der erforderlichen Erregungssignale, um ein Aktionspotenzial in einem postsynaptischen Neuron auszulösen. Diese erhöhte Signalschwelle führt zu einer verringerten Erregbarkeit der postsynaptischen Neuronen und in der Folge zum Verlust der motorischen und sensorischen Funktionen, was zu Lähmungen und zum Tod führen kann. Obwohl die assistierte Beatmung die Überlebenschancen nach einer TTX-Exposition erhöhen kann, gibt es derzeit kein Gegengift. Die Verwendung des Acetylcholinesterase-Hemmers Neostigmin oder des muskarinischen Acetylcholin-Antagonisten Atropin (der die parasympathische Aktivität hemmt) kann jedoch die Aktivität des Sympathikus so weit erhöhen, dass sich die Überlebenschancen nach einer TTX-Exposition verbessern. ⓘ
Kaliumkanal
Tetraethylammonium
Tetraethylammonium (TEA) ist eine Verbindung, die, wie eine Reihe von Neurotoxinen, zunächst durch ihre schädigende Wirkung auf das Nervensystem identifiziert wurde und nachweislich in der Lage ist, die Funktion der motorischen Nerven und damit die Kontraktion der Muskulatur auf ähnliche Weise wie Curare zu hemmen. Außerdem würde durch die chronische Verabreichung von TEA eine Muskelatrophie hervorgerufen. Später wurde festgestellt, dass TEA in vivo in erster Linie durch seine Fähigkeit funktioniert, sowohl die Kaliumkanäle, die für die verzögerte Gleichrichtung in einem Aktionspotenzial verantwortlich sind, als auch eine bestimmte Population von Kalzium-abhängigen Kaliumkanälen zu hemmen. Diese Fähigkeit, den Kaliumfluss in Neuronen zu hemmen, hat TEA zu einem der wichtigsten Werkzeuge in den Neurowissenschaften gemacht. Es wurde die Hypothese aufgestellt, dass die Fähigkeit von TEA, Kaliumkanäle zu hemmen, auf seine ähnliche raumfüllende Struktur wie Kaliumionen zurückzuführen ist. Was TEA für Neurowissenschaftler sehr nützlich macht, ist seine spezifische Fähigkeit, die Aktivität von Kaliumkanälen auszuschalten, was die Untersuchung der neuronalen Reaktionsbeiträge anderer Ionenkanäle wie spannungsgesteuerter Natriumkanäle ermöglicht. Neben seiner vielfältigen Verwendung in der neurowissenschaftlichen Forschung hat sich TEA auch als wirksames Mittel zur Behandlung der Parkinson-Krankheit erwiesen, da es das Fortschreiten der Krankheit bremsen kann. ⓘ
Chloridkanal
Chlorotoxin
Chlorotoxin (Cltx) ist der Wirkstoff im Skorpiongift und wirkt vor allem aufgrund seiner Fähigkeit, die Leitfähigkeit von Chloridkanälen zu hemmen, toxisch. Die Aufnahme tödlicher Mengen von Cltx führt zu einer Lähmung durch die Unterbrechung dieser Ionenkanäle. Ähnlich wie Botulinumtoxin besitzt Cltx nachweislich einen erheblichen therapeutischen Wert. Es hat sich gezeigt, dass Cltx die Fähigkeit von Gliomen, gesundes Nervengewebe im Gehirn zu infiltrieren, hemmen kann, wodurch die potenziellen invasiven Schäden, die von Tumoren verursacht werden, erheblich reduziert werden. ⓘ
Kalziumkanal
Conotoxin
Conotoxine sind eine Kategorie von Giften, die von der marinen Kegelschnecke produziert werden und in der Lage sind, die Aktivität einer Reihe von Ionenkanälen wie Kalzium-, Natrium- oder Kaliumkanälen zu hemmen. In vielen Fällen enthalten die von den verschiedenen Arten von Kegelschnecken freigesetzten Gifte eine Reihe verschiedener Arten von Conotoxinen, die für verschiedene Ionenkanäle spezifisch sein können, wodurch ein Gift entsteht, das in der Lage ist, weit verbreitete Nervenfunktionen zu unterbrechen. Eine der einzigartigen Formen von Conotoxinen, das ω-Conotoxin (ω-CgTx), ist hochspezifisch für Ca-Kanäle und hat sich als nützlich erwiesen, um diese aus einem System zu isolieren. Da der Kalziumfluss für die ordnungsgemäße Erregbarkeit einer Zelle notwendig ist, könnte jede signifikante Hemmung einen großen Teil der Funktionalität verhindern. Bezeichnenderweise ist ω-CgTx in der Lage, sich langfristig an spannungsabhängige Kalziumkanäle zu binden und diese zu hemmen, die sich in den Membranen von Neuronen, nicht aber in denen von Muskelzellen befinden. ⓘ
Synaptische Vesikelfreisetzung
Botulinumtoxin
Botulinumtoxin (BTX) ist eine Gruppe von Neurotoxinen, die aus acht verschiedenen Verbindungen besteht, die als BTX-A,B,C,D,E,F,G,H bezeichnet werden und von dem Bakterium Clostridium botulinum produziert werden und zu Muskellähmungen führen. Ein besonderes Merkmal von BTX ist seine relativ häufige therapeutische Verwendung bei der Behandlung von Dystonie und Spastik sowie bei der Auslösung von Muskelschwund, obwohl es die giftigste bekannte Substanz ist. BTX wirkt peripher und hemmt die Freisetzung von Acetylcholin (ACh) an der neuromuskulären Verbindung durch Abbau der SNARE-Proteine, die für die ACh-Vesikel-Membran-Fusion erforderlich sind. Da das Toxin biologisch sehr aktiv ist, reicht eine geschätzte Dosis von 1 μg/kg Körpergewicht aus, um ein unzureichendes Atemzugvolumen und damit den Erstickungstod herbeizuführen. Aufgrund seiner hohen Toxizität sind BTX-Antitoxine ein aktives Forschungsgebiet. Es hat sich gezeigt, dass Capsaicin (der für die Schärfe in Chilischoten verantwortliche Wirkstoff) den TRPV1-Rezeptor auf cholinergen Neuronen binden und die toxischen Wirkungen von BTX hemmen kann. ⓘ
Tetanus-Toxin
Tetanus-Neurotoxin (TeNT) ist eine Verbindung, die funktionell die hemmenden Übertragungen im Nervensystem reduziert, was zu Muskeltetanie führt. TeNT ähnelt BTX und ist in der Tat in Struktur und Ursprung sehr ähnlich; beide gehören zur gleichen Kategorie der Clostridien-Neurotoxine. Wie BTX hemmt TeNT die Kommunikation zwischen den Neuronen durch die Freisetzung von vesikulären Neurotransmittern (NT). Ein bemerkenswerter Unterschied zwischen den beiden Verbindungen besteht darin, dass BTX Muskelkontraktionen hemmt, während TeNT sie auslöst. Obwohl beide Toxine die Vesikelfreisetzung an den Synapsen der Neuronen hemmen, liegt der Grund für diese unterschiedliche Erscheinung darin, dass BTX hauptsächlich im peripheren Nervensystem (PNS) wirkt, während TeNT hauptsächlich im zentralen Nervensystem (ZNS) aktiv ist. Dies ist darauf zurückzuführen, dass TeNT durch motorische Neuronen zu den hemmenden Neuronen des Rückenmarks wandert, nachdem es durch Endozytose in diese gelangt ist. Dies führt zu einem Funktionsverlust der hemmenden Neuronen im ZNS, was zu systemischen Muskelkontraktionen führt. Ähnlich wie bei einer tödlichen Dosis von BTX führt TeNT zu Lähmungen und anschließendem Ersticken. ⓘ
Blut-Hirn-Schranke
Aluminium
Es ist bekannt, dass Aluminium neurotoxisch wirkt, sobald es in den Blutkreislauf gelangt, wo es ins Gehirn wandern und einige der entscheidenden Funktionen der Blut-Hirn-Schranke (BHS) hemmen kann. Ein Funktionsverlust der Blut-Hirn-Schranke kann zu einer erheblichen Schädigung der Neuronen im ZNS führen, da die Barriere, die das Gehirn vor anderen im Blut befindlichen Toxinen schützt, nicht mehr in der Lage ist, eine solche Wirkung zu entfalten. Obwohl bekannt ist, dass das Metall neurotoxisch ist, sind die Auswirkungen in der Regel auf Patienten beschränkt, die nicht in der Lage sind, überschüssige Ionen aus dem Blut zu entfernen, wie z. B. Patienten mit Nierenversagen. Patienten, die an Aluminiumtoxizität leiden, können Symptome wie Lernschwierigkeiten und eine verminderte motorische Koordination aufweisen. Darüber hinaus ist bekannt, dass der systemische Aluminiumspiegel mit dem Alter ansteigt und nachweislich mit der Alzheimer-Krankheit korreliert, was darauf hindeutet, dass Aluminium eine neurotoxische Ursache für diese Krankheit ist. Trotz seiner bekannten Toxizität in seiner ionischen Form sind die Studien über die potenzielle Toxizität von Aluminium in Verpackungen und Kochgeräten geteilt. ⓘ
Quecksilber
Quecksilber ist in der Lage, ZNS-Schäden zu verursachen, indem es über die BHS ins Gehirn gelangt. Quecksilber kommt in einer Reihe verschiedener Verbindungen vor, wobei Methylquecksilber (MeHg+), Dimethylquecksilber und Diethylquecksilber die einzigen signifikant neurotoxischen Formen sind. Diethylquecksilber und Dimethylquecksilber gelten als einige der stärksten jemals entdeckten Neurotoxine. MeHg+ wird in der Regel durch den Verzehr von Meeresfrüchten aufgenommen, da es sich in der Regel in Organismen konzentriert, die in der Nahrungskette weit oben stehen. Es ist bekannt, dass das Quecksilberion den Transport von Aminosäuren (AA) und Glutamat (Glu) hemmt, was zu exzitotoxischen Wirkungen führen kann. ⓘ
Rezeptor-Agonisten und -Antagonisten
Anatoxin-a
| Externes Video ⓘ | |
|---|---|
Universität von Nottingham |

Die Untersuchungen zu Anatoxin-a, auch bekannt als "Very Fast Death Factor", begannen 1961 nach dem Tod von Kühen, die aus einem See mit einer Algenblüte in Saskatchewan, Kanada, getrunken hatten. Es handelt sich um ein Cyanotoxin, das von mindestens vier verschiedenen Gattungen von Cyanobakterien produziert wird, und über das in Nordamerika, Europa, Afrika, Asien und Neuseeland berichtet wurde. ⓘ
Die toxischen Wirkungen von Anatoxin-a schreiten sehr schnell voran, da es direkt auf die Nervenzellen (Neuronen) wirkt. Die fortschreitenden Symptome einer Anatoxin-a-Exposition sind Koordinationsverlust, Zuckungen, Krämpfe und schneller Tod durch Atemlähmung. Die Nervengewebe, die mit den Muskeln kommunizieren, enthalten einen Rezeptor, den so genannten nikotinischen Acetylcholinrezeptor. Die Stimulation dieser Rezeptoren bewirkt eine Muskelkontraktion. Das Anatoxin-a-Molekül ist so geformt, dass es zu diesem Rezeptor passt, und ahmt auf diese Weise den natürlichen Neurotransmitter nach, der normalerweise von diesem Rezeptor verwendet wird, nämlich Acetylcholin. Sobald es eine Kontraktion ausgelöst hat, lässt Anatoxin-a die Neuronen nicht mehr in den Ruhezustand zurückkehren, da es von der Cholinesterase, die normalerweise diese Funktion übernimmt, nicht abgebaut wird. Infolgedessen kontrahieren die Muskelzellen dauerhaft, die Kommunikation zwischen Gehirn und Muskeln ist gestört und die Atmung setzt aus. ⓘ
Bei seiner Entdeckung wurde das Toxin "Very Fast Death Factor" (VFDF) genannt, weil es bei der Injektion in die Körperhöhle von Mäusen innerhalb weniger Minuten Zittern, Lähmung und Tod auslöste. Im Jahr 1977 wurde die Struktur von VFDF als sekundäres, bizyklisches Aminalkaloid bestimmt und es wurde in Anatoxin-a umbenannt. Strukturell ist es dem Kokain ähnlich. Das Interesse an Anatoxin-a ist ungebrochen, da es eine Gefahr für Freizeit- und Trinkwasser darstellt und ein besonders nützliches Molekül für die Untersuchung von Acetylcholinrezeptoren im Nervensystem ist. Die Tödlichkeit des Toxins bedeutet, dass es ein hohes militärisches Potenzial als Toxinwaffe besitzt. ⓘ
Bungarotoxin
Bungarotoxin ist eine Verbindung, von der bekannt ist, dass sie mit nikotinischen Acetylcholinrezeptoren (nAChRs) interagiert, einer Familie von Ionenkanälen, deren Aktivität durch die Bindung von Neurotransmittern ausgelöst wird. Bungarotoxin wird in verschiedenen Formen hergestellt, wobei eine der am häufigsten verwendeten Formen die langkettige Alpha-Form, α-Bungarotoxin, ist, die aus der gebänderten Krait-Schlange isoliert wird. Obwohl α-Bungarotoxin bei Einnahme extrem giftig ist, hat es sich in der Neurowissenschaft als äußerst nützlich erwiesen, da es aufgrund seiner hohen Affinität zu den Rezeptoren besonders gut zur Isolierung von nAChRs geeignet ist. Da es mehrere Formen von Bungarotoxin gibt, gibt es auch verschiedene Formen von nAChRs, an die es bindet, und α-Bungarotoxin ist besonders spezifisch für α7-nAChR. Dieser α7-nAChR hat die Funktion, den Einstrom von Kalziumionen in die Zellen zu ermöglichen, und wenn er durch eingenommenes Bungarotoxin blockiert wird, hat dies schädliche Auswirkungen, da die ACh-Signalübertragung gehemmt wird. Ebenso kann die Verwendung von α-Bungarotoxin in der Neurowissenschaft sehr nützlich sein, wenn es wünschenswert ist, den Kalziumfluss zu blockieren, um die Auswirkungen anderer Kanäle zu isolieren. Darüber hinaus können verschiedene Formen von Bungarotoxin nützlich sein, um gehemmte nAChRs und den daraus resultierenden Kalzium-Ionenfluss in verschiedenen Systemen des Körpers zu untersuchen. So ist beispielsweise α-Bungarotoxin spezifisch für nAChRs in der Muskulatur und κ-Bungarotoxin für nAChRs in Neuronen. ⓘ
Caramboxin

Caramboxin (CBX) ist ein Toxin, das in der Sternfrucht (Averrhoa carambola) vorkommt. Bei Menschen mit bestimmten Nierenerkrankungen kann es nach dem Verzehr von Sternfrüchten oder dem Trinken von Saft aus diesen Früchten zu neurologischen Nebenwirkungen wie Vergiftungen, Krampfanfällen und sogar zum Tod kommen. Caramboxin ist ein neues nicht-peptidisches Aminosäuretoxin, das die Glutamatrezeptoren in Neuronen stimuliert. Caramboxin ist ein Agonist sowohl der NMDA- als auch der AMPA-glutamatergen ionotropen Rezeptoren mit starken erregenden, krampfartigen und neurodegenerativen Eigenschaften. ⓘ
Curare
Der Begriff "Curare" ist mehrdeutig, da er zur Beschreibung einer Reihe von Giften verwendet wurde, die zum Zeitpunkt der Namensgebung anders verstanden wurden als heute. In der Vergangenheit bezeichnete der Begriff Gifte, die von südamerikanischen Stämmen für Pfeile oder Pfeile verwendet wurden, er hat sich jedoch zu einer spezifischen Kategorisierung von Giften weiterentwickelt, die auf die neuromuskuläre Verbindung einwirken, um die Signalübertragung zu hemmen und so eine Muskelentspannung zu bewirken. Die Kategorie der Neurotoxine umfasst eine Reihe verschiedener Gifte, die jedoch alle ursprünglich aus Pflanzen aus Südamerika gereinigt wurden. Die Wirkung, mit der das injizierte Curare-Gift in der Regel in Verbindung gebracht wird, ist die Muskellähmung und der daraus resultierende Tod. Curare hemmt vor allem die nikotinischen Acetylcholinrezeptoren an der neuromuskulären Verbindungsstelle. Normalerweise lassen diese Rezeptorkanäle Natriumionen in die Muskelzellen eindringen, um ein Aktionspotenzial auszulösen, das zur Muskelkontraktion führt. Durch die Blockade der Rezeptoren ist das Neurotoxin in der Lage, die Signalübertragung an der neuromuskulären Verbindung erheblich zu reduzieren, eine Wirkung, die dazu geführt hat, dass es von Anästhesisten zur Muskelentspannung eingesetzt wird. ⓘ
Störung des Zytoskeletts
Arsen
Arsen ist ein Neurotoxin, das in Gebieten, die landwirtschaftlichen Abwässern, Bergbau- und Schmelzanlagen ausgesetzt sind, häufig konzentriert vorkommt (Martinez-Finley 2011). Eine der Auswirkungen der Arsenaufnahme während der Entwicklung des Nervensystems ist die Hemmung des Neuritenwachstums, die sowohl im PNS als auch im ZNS auftreten kann. Diese Hemmung des Neuritenwachstums kann häufig zu Defekten bei der neuronalen Migration und zu erheblichen morphologischen Veränderungen der Neuronen während der Entwicklung führen, was bei Neugeborenen häufig zu Neuralrohrdefekten führt. Als Metabolit von Arsen wird Arsenit nach der Aufnahme von Arsen gebildet und hat innerhalb von etwa 24 Stunden nach der Exposition eine erhebliche Toxizität für Neuronen gezeigt. Der Mechanismus dieser Zytotoxizität beruht auf einem durch Arsenit ausgelösten Anstieg des intrazellulären Kalziumionenspiegels in den Neuronen, der in der Folge das Transmembranpotenzial der Mitochondrien verringern kann, wodurch die Caspasen aktiviert werden und der Zelltod ausgelöst wird. Eine weitere bekannte Funktion von Arsenit ist seine zerstörerische Wirkung auf das Zytoskelett durch Hemmung des Neurofilamenttransports. Dies ist besonders zerstörerisch, da Neurofilamente für die grundlegende Zellstruktur und -unterstützung verwendet werden. Die Verabreichung von Lithium hat sich jedoch als vielversprechend erwiesen, um einen Teil der verlorenen Neurofilament-Beweglichkeit wiederherzustellen. Ähnlich wie bei der Behandlung anderer Neurotoxine hat sich auch die Verabreichung bestimmter Antioxidantien als vielversprechend erwiesen, um die Neurotoxizität von aufgenommenem Arsen zu verringern. ⓘ
Ammoniak

Die Toxizität von Ammoniak wird häufig auf zwei Wegen zugeführt: entweder durch Verzehr oder durch endogene Erkrankungen wie Leberversagen. Ein bemerkenswerter Fall, in dem die Ammoniak-Toxizität häufig auftritt, ist die Leberzirrhose, die zu einer hepatischen Enzephalopathie führt und ein Hirnödem verursachen kann (Haussinger 2006). Dieses Hirnödem kann das Ergebnis eines Umbaus der Nervenzellen sein. Als Folge erhöhter Konzentrationen hat sich gezeigt, dass die Ammoniakaktivität in vivo eine Schwellung der Astrozyten im Gehirn durch eine erhöhte Produktion von cGMP (zyklisches Guanosinmonophosphat) innerhalb der Zellen auslöst, was zu Protein-Kinase G-vermittelten (PKG) Zytoskelettveränderungen führt. Die Folge dieser Toxizität kann eine Verringerung des Energiestoffwechsels und der Funktion des Gehirns sein. Wichtig ist, dass die toxischen Auswirkungen von Ammoniak auf den Astrozytenumbau durch die Verabreichung von L-Carnitin verringert werden können. Dieser Astrozyten-Umbau scheint durch den Ammoniak-induzierten mitochondrialen Permeabilitätsübergang vermittelt zu werden. Dieser mitochondriale Übergang ist eine direkte Folge der Glutaminaktivität, einer Verbindung, die sich in vivo aus Ammoniak bildet. Die Verabreichung von Antioxidantien oder Glutaminasehemmern kann diesen mitochondrialen Übergang und möglicherweise auch den Umbau von Astrozyten verringern. ⓘ
Kalzium-vermittelte Zytotoxizität

Blei
Blei ist ein starkes Neurotoxin, dessen Toxizität seit mindestens Tausenden von Jahren bekannt ist. Obwohl neurotoxische Wirkungen von Blei sowohl bei Erwachsenen als auch bei Kleinkindern festgestellt werden, ist das sich entwickelnde Gehirn besonders anfällig für bleiinduzierte Schäden, die Apoptose und Exzitotoxizität umfassen können. Ein zugrundeliegender Mechanismus, durch den Blei Schaden anrichten kann, ist seine Fähigkeit, durch Kalzium-ATPase-Pumpen über die BHS transportiert zu werden, was einen direkten Kontakt mit den empfindlichen Zellen im zentralen Nervensystem ermöglicht. Die Neurotoxizität resultiert aus der Fähigkeit von Blei, ähnlich wie Kalziumionen zu wirken, da konzentriertes Blei zu einer zellulären Aufnahme von Kalzium führt, die die zelluläre Homöostase stört und Apoptose auslöst. Dieser intrazelluläre Kalziumanstieg aktiviert die Proteinkinase C (PKC), die sich bei Kindern als Folge einer frühen Bleiexposition in Form von Lerndefiziten manifestiert. Blei löst nicht nur Apoptose aus, sondern hemmt auch die Interneuronen-Signalübertragung durch die Unterbrechung der kalziumvermittelten Neurotransmitter-Freisetzung. ⓘ
Neurotoxine mit Mehrfachwirkung
Ethanol

Als Neurotoxin führt Ethanol nachweislich zu einer Schädigung des Nervensystems und beeinträchtigt den Körper auf vielfältige Weise. Zu den bekannten Auswirkungen der Ethanolexposition gehören sowohl vorübergehende als auch dauerhafte Folgen. Zu den dauerhaften Auswirkungen gehören eine langfristig verringerte Neurogenese im Hippocampus, eine weit verbreitete Hirnatrophie und eine induzierte Entzündung des Gehirns. Darüber hinaus hat sich gezeigt, dass chronischer Ethanolkonsum zu einer Umstrukturierung der Zellmembranbestandteile führt, was sich in einer Lipiddoppelschicht mit erhöhten Cholesterin- und gesättigten Fettkonzentrationen in der Membran niederschlägt. Dies ist wichtig, da der Neurotransmittertransport durch die Hemmung des vesikulären Transports beeinträchtigt werden kann, was zu einer verminderten Funktion des neuronalen Netzes führt. Ein signifikantes Beispiel für eine verringerte Kommunikation zwischen den Neuronen ist die Fähigkeit von Ethanol, NMDA-Rezeptoren im Hippocampus zu hemmen, was zu einer verringerten Langzeitpotenzierung (LTP) und Gedächtniserwerb führt. Es hat sich gezeigt, dass NMDA eine wichtige Rolle bei der LTP und folglich bei der Gedächtnisbildung spielt. Bei chronischem Ethanolkonsum steigt jedoch die Anfälligkeit dieser NMDA-Rezeptoren für die Induktion von LTP in den mesolimbischen Dopamin-Neuronen in Abhängigkeit von Inositol-1,4,5-Triphosphat (IP3). Diese Reorganisation kann zu neuronaler Zytotoxizität führen, sowohl durch Hyperaktivierung postsynaptischer Neuronen als auch durch induzierte Abhängigkeit bei kontinuierlichem Ethanolkonsum. Darüber hinaus hat sich gezeigt, dass Ethanol die intrazelluläre Kalziumionenakkumulation durch eine gehemmte NMDA-Rezeptoraktivität direkt reduziert und damit die Fähigkeit zur LTP verringert. ⓘ
Zusätzlich zu den neurotoxischen Wirkungen von Ethanol in reifen Organismen kann die chronische Aufnahme von Ethanol zu schweren Entwicklungsstörungen führen. 1973 wurde erstmals ein Zusammenhang zwischen chronischem Ethanolkonsum von Müttern und Fehlbildungen bei ihren Nachkommen nachgewiesen. Diese Arbeit war verantwortlich für die Klassifizierung des fetalen Alkoholsyndroms, einer Krankheit, die durch allgemeine Morphogenesefehler wie Defekte in der Schädel- und Gliedmaßenentwicklung sowie in der Ausbildung des Herz-Kreislauf-Systems gekennzeichnet ist. Das Ausmaß der Neurotoxizität von Ethanol bei Föten, die zum fetalen Alkoholsyndrom führt, hängt nachweislich vom Gehalt an Antioxidantien im Gehirn, wie z. B. Vitamin E, ab. Da das fetale Gehirn relativ zerbrechlich und anfällig für induzierte Belastungen ist, können schwere schädliche Auswirkungen der Alkoholexposition in wichtigen Bereichen wie dem Hippocampus und dem Kleinhirn beobachtet werden. Der Schweregrad dieser Auswirkungen hängt direkt von der Menge und Häufigkeit des Ethanolkonsums der Mutter und dem Entwicklungsstadium des Fötus ab. Es ist bekannt, dass eine Ethanolexposition zu einem verringerten Gehalt an Antioxidantien, einer mitochondrialen Dysfunktion (Chu 2007) und dem anschließenden Absterben von Neuronen führt, was offenbar auf die vermehrte Bildung reaktiver oxidativer Spezies (ROS) zurückzuführen ist. Dies ist ein plausibler Mechanismus, da im fötalen Gehirn weniger antioxidative Enzyme wie Katalase und Peroxidase vorhanden sind. Zur Unterstützung dieses Mechanismus führt die Verabreichung von hohen Mengen an Vitamin E in der Nahrung zu einer Verringerung oder Beseitigung der durch Ethanol verursachten neurotoxischen Wirkungen bei Föten. ⓘ
n-Hexan
n-Hexan ist ein Neurotoxin, das in den letzten Jahren für die Vergiftung von mehreren Arbeitern in chinesischen Elektronikfabriken verantwortlich war. ⓘ
Rezeptorselektive Neurotoxine
MPP+
MPP+, der toxische Metabolit von MPTP, ist ein selektives Neurotoxin, das die oxidative Phosphorylierung in den Mitochondrien beeinträchtigt, indem es den Komplex I hemmt, was zur Erschöpfung von ATP und zum anschließenden Zelltod führt. Dies geschieht fast ausschließlich in dopaminergen Neuronen der Substantia nigra, was bei exponierten Personen 2-3 Tage nach der Verabreichung zu permanentem Parkinsonismus führt. ⓘ
Endogene Neurotoxinquellen
Im Gegensatz zu den meisten gängigen Quellen von Neurotoxinen, die vom Körper durch Verschlucken aufgenommen werden, haben endogene Neurotoxine ihren Ursprung und ihre Wirkung in vivo. Während die meisten Gifte und exogenen Neurotoxine nur selten nützliche in-vivo-Fähigkeiten besitzen, werden endogene Neurotoxine vom Körper häufig auf nützliche und gesunde Weise verwendet, wie z. B. Stickstoffmonoxid, das in der Zellkommunikation eingesetzt wird. Erst wenn diese körpereigenen Verbindungen in hoher Konzentration auftreten, führen sie oft zu gefährlichen Wirkungen. ⓘ
Stickstoffmonoxid
Obwohl Stickstoffmonoxid (NO) vom Nervensystem häufig für die Kommunikation zwischen den Neuronen und die Signalübertragung verwendet wird, kann es auch bei Mechanismen aktiv sein, die zu Ischämie im Großhirn führen (Iadecola 1998). Die Neurotoxizität von NO beruht auf seiner Bedeutung für die Glutamatexzitotoxizität, da NO in Reaktion auf die glutamatvermittelte NMDA-Aktivierung, die bei Glutamatexzitotoxizität in erhöhtem Maße auftritt, calciumabhängig gebildet wird. NO fördert zwar die Durchblutung potenziell ischämischer Hirnregionen, kann aber auch den oxidativen Stress erhöhen und damit DNA-Schäden und Apoptose auslösen. Somit kann ein erhöhtes Vorkommen von NO in einem ischämischen Bereich des ZNS erhebliche toxische Auswirkungen haben. ⓘ
Glutamat
Glutamat ist wie Stickstoffmonoxid eine körpereigene Verbindung, die von den Neuronen für ihre normale Funktion verwendet wird und in geringen Konzentrationen in der gesamten grauen Substanz des ZNS vorhanden ist. Eine der bemerkenswertesten Verwendungen von endogenem Glutamat ist seine Funktion als erregender Neurotransmitter. In konzentrierter Form wird Glutamat jedoch für die umliegenden Neuronen toxisch. Diese Toxizität kann sowohl auf die direkte tödliche Wirkung von Glutamat auf Neuronen als auch auf den induzierten Kalziumfluss in Neuronen zurückzuführen sein, der zu Schwellungen und Nekrosen führt. Es wurde nachgewiesen, dass diese Mechanismen bei Krankheiten und Komplikationen wie der Huntington-Krankheit, Epilepsie und Schlaganfall eine wichtige Rolle spielen. ⓘ
Dopamin
Dopamin ist eine körpereigene Verbindung, die als Neurotransmitter zur Steuerung von Belohnungserwartungen eingesetzt wird. Dopamin tötet dopaminproduzierende Neuronen, indem es in die Elektronentransportkette der Neuronen eingreift. Diese Störung führt zu einer Hemmung der Zellatmung und damit zum Tod der Neuronen. ⓘ
Neurotoxine
Die meisten Nervengifte sind Toxine, das heißt, von Lebewesen synthetisierte Nervengifte, und andere organische Stoffe. Sie werden im Tierreich häufig zur Verteidigung oder als Beutegift zur Jagd anderer Tiere oder von Pflanzen und Pilzen als Fraßschutz eingesetzt. Die Wirkung dieser Stoffe beruht meist auf der Interaktion der Stoffe mit bestimmten Rezeptoren der Nervenzellen, indem sie als Agonisten (z. B. Nicotin an nicotinischen Acetylcholinrezeptoren) diese auslösen oder als Antagonisten (z. B. Atropin an muskarinischen Acetylcholinrezeptoren) diese blockieren, wodurch die Erregungsweiterleitung und damit die Funktion von Organen gestört wird. Ein weiterer, häufiger Wirkmechanismus beruht auf der Öffnung oder dem Blockieren von Ionenkanälen, wie der Öffnung von Calciumkanälen durch Alpha-Latrotoxin, dem Gift der Europäischen Schwarzen Witwe oder der Blockade von Natriumkanälen durch Saxitoxin, welches vorwiegend von Dinoflagellaten produziert wird. Die Herkunft solcher Toxine sind beispielsweise ⓘ
- Spinnentiere
- Skorpione
- Echte Witwen
- Schlangen
- Giftnattern
- Vipern
- Pilze
- Mutterkornalkaloide aus Mutterkorn
- Ibotensäureverbindungen aus Wulstlingen
- Psilocybin aus Psilocybe-Arten
- Pflanzen
- Tropan-Alkaloide aus Nachtschattengewächsen
- Coniin des Gefleckten Schierlings
- Bakterien
- Botulinumtoxin aus Clostridium botulinum
- Tetanospasmin aus Clostridium tetani, dem Erreger von Tetanus
- Sonstige Lebewesen
- Saxitoxin aus Dinoflagellaten
- Conotoxine aus der Kegelschnecken-Gattung Conus ⓘ
Nervenkampfstoffe
Als Nervenkampfstoffe wird eine Klasse von chemischen Waffen bezeichnet, welche auf die Weiterleitung von Signalen in den Nerven und zwischen den Nerven einwirken. Diese Nervengifte können über die Haut, Atmung und über Körperöffnungen in den Körper eindringen und führen zu schweren, systemischen Symptomen, welche schließlich zum Tod führen können. Solche Symptome können starke Muskelkrämpfe und Krampfanfälle, Zittern, Zucken der Muskulatur, Kopfschmerzen, Augenschmerzen, Müdigkeit, Verwirrtheit, Angstzustände, Spannungen, Übelkeit mit Erbrechen und Durchfällen, unkontrollierter Harn- und Stuhlabgang, Appetitlosigkeit, Atemnot, Bewusstlosigkeit und Atemlähmung sein. ⓘ
Reihen
Nervenkampfstoffe werden nach dem Ursprung ihrer Entwicklung in Gruppen eingeteilt, die als Reihe bezeichnet werden. Man unterscheidet dabei die G-Reihe, V-Reihe und die Nowitschok-Reihe. Zur analytischen Charakterisierung der Stoffe und ihrer Abbauprodukte finden Methoden der Kopplung der HPLC mit der Massenspektrometrie Verwendung. ⓘ
G-Reihe


Die G-Reihe wurde während des Zweiten Weltkrieges vom deutschen Chemiker Gerhard Schrader synthetisiert, das G steht hierbei für Germany. ⓘ
Es handelt sich um nicht persistente phosphororganische Verbindungen, welche als Phosphorsäureester angesehen werden können und einen ähnlichen Aufbau, wie in der nebenstehenden Abbildung zu entnehmen ist, aufweisen. So enthalten alle bis auf Tabun anstatt einer OH-Gruppe der Phosphorsäure ein Fluoratom; Tabun enthält stattdessen eine Nitril-Gruppe. Zu dieser Stoffreihe zählen Tabun (GA, 1936), Sarin (GB, 1939), Soman (GD, 1944), Cyclosarin (GF, 1949) und GV (in Klammern jeweils G-Reihen-Bezeichnung und das Jahr der Erstherstellung). ⓘ
Die Wirkung dieser Nervenkampfstoffe beruht auf der Hemmung der Acetylcholinesterase. Die Gifte besetzen das aktive Zentrum des Enzyms und reagieren dort mit einem nukleophilen Serin-Rest unter Bildung einer kovalenten Bindung. Der durch die Enzymblockade gehemmte Abbau des Acetylcholins führt zu einem drastischen Konzentrationsanstieg dieses Neurotransmitters im cholinergen System und äußert sich im sogenannten akuten cholinergen Toxidrom mit Übererregung der Nerven und schließlich Blockade der Erregungsübertragung. Es kommt je nach Stärke der Vergiftung zu folgenden Symptomen: Kopfschmerzen, Übelkeit mit Erbrechen und Durchfällen, Augenschmerzen, Müdigkeit, Krampfanfälle, Zittern, Zucken der Muskulatur, unkontrollierter Harn- und Stuhlabgang, Atemnot, Appetitlosigkeit, Angstzustände, Spannungen, Verwirrtheit, Bewusstlosigkeit. Der Tod tritt schließlich durch Atemlähmung ein. Die Antidote der medizinischen Notfallausrüstung von NATO-Soldaten enthalten als Anticholinergikum Atropin und Enzymreaktivatoren wie Trimedoximbromid und Obidoximchlorid. Letztere gehören zur Stoffgruppe der Oxime. ⓘ
Im Gegensatz zu den Vertretern der V-Reihe sind die Vertreter der G-Reihe und DFP durch eine Phosphotriesterase in Tieren und manchen Mikroorganismen spaltbar, ebenso durch die Organophosphorsäure-Hydrolase aus Flavobakterien und Pseudomonas diminuta und durch das Calamari-Enzym. ⓘ
V-Reihe

Diese Reihe hatte ihren Ursprung bei dem Chemiker Ranajit Ghosh, welcher für das britische Unternehmen Imperial Chemical Industries Pflanzenschutzmittel erforscht hatte. ICI brachte 1954 unter dem Namen Amiton das waffenfähige VG auf den Markt. Es galt jedoch als zu gefährlich für den Einsatz als Pflanzenschutzmittel, fand aber schnell Verwendung bei den Streitkräften des Vereinigten Königreiches und der USA, auch wenn es aufgrund von erheblichen Problemen bei der Produktion, Lagerung und Munitionierung nie großtechnisch hergestellt oder gelagert wurde. ⓘ
Der Name leitet sich je nach Quelle von „Victory“ („Sieg“), „Venomous“ („giftig“) oder „Viscous“ („viskos“) ab. Die Stoffe dieser Reihe werden gelegentlich auch „Tammelin’s esters“ genannt. Lars-Erik Tammelin hatte sich für das schwedische Forschungsinstitut der Verteidigung mit den chemischen Kampfstoffen des Ersten Weltkrieges und Zweiten Weltkrieges beschäftigt und war seit 1952 ebenfalls an der Erforschung der V-Reihe beteiligt. ⓘ
Es handelt sich ebenfalls um phosphororganische, den Phosphorsäurestern ähnliche Kampfstoffe, welche im Gegensatz zur G-Reihe stabiler und etwa 5-mal so giftig sind (vgl. LD50 7 µg·kg−1 für VX (Ratte, i.v.) und 39 μg·kg−1 für Sarin (Ratte i.v.)). Sie verbleiben länger auf dem Schlachtfeld, in der Kleidung sowie anderen Gegenständen und können auch länger gelagert und beispielsweise in Granaten, Raketen und auch Landminen eingesetzt werden. Die Konsistenz ist zähflüssig und ölartig, weshalb die häufige Bezeichnung Nervengas irreführend ist. Neben den bekannten hier abgebildeten Beispielen, von denen jedoch nur VX und VR militärisch verwendet wurden, gibt es noch weitere Derivate mit ähnlichen Eigenschaften. Die Wirkung und entsprechenden Gegenmaßnahmen sind denen der G-Reihe gleich. Zu dieser Reihe zählen die Stoffe VE, VG, VM, VP, VR, VS und VX, sowie EA-2192 und EA-3148, wobei VX als der bekannteste und am besten erforschte Kampfstoff dieser Reihe gilt. ⓘ
Der Kontakt mit Giften aus der V-Reihe kann, nach adäquater Probenvorbereitung, durch Identifizieren des Stoffwechselprodukts Methylphosphonsäure mit Hilfe der Kopplung der Massenspektrometrie mit der Ionenchromatographie nachgewiesen werden. Eine relativ schnelle Nachweismethode für Gifte, auch der VR-Klasse, verwendet die Kopplung der HPLC mit der Tandem-Massenspektrometrie. Die Nachweisgrenze für die Gifte in Urinproben wird hierbei mit 5 μg/ml angegeben. ⓘ
Nowitschok-Reihe
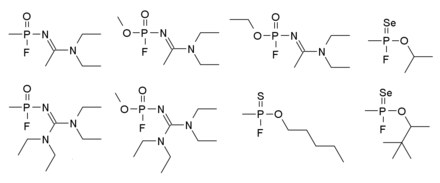
Nowitschok (russisch новичок, so viel wie Neuling oder Anfänger) bezeichnet eine Reihe neuartiger sowjetischer Nervenkampfstoffe, welche etwa zwischen 1970 und 1990 entwickelt wurden. Sie zählen zu den tödlichsten Nervenkampfstoffen, die jemals hergestellt worden sind, von denen einige etwa 5- bis 8-mal so stark wie VX sein sollen. Es gibt über hundert Varianten in dieser Serie, von denen einige in der Darstellung rechts gezeigt werden. Die Wirkung und entsprechende Gegenmaßnahmen sind denen der G-Reihe gleich. ⓘ
Sonstige Nervenkampfstoffe
Diisopropylfluorphosphat, kurz DFP, wurde erstmals im Zweiten Weltkrieg von englischer Seite entwickelt und produziert. Es war gedacht, DFP als taktisches Gemisch mit Senfgas einzusetzen. So wäre es zu einem Kontaktgift geworden. Die tatsächliche Verwendung von DFP als Kampfstoff ist nicht bekannt geworden. ⓘ
Antidote
In vitro konnte gezeigt werden, dass 1,1’-(Propan-1,3-diyl)bis(4-tert-butylpyridinium)diiodid in der Lage ist, durch allosterische Modulation von nikotinischer Acetylcholinrezeptoren der Wirkung von Soman entgegenzuwirken. ⓘ
Sonstige Nervengifte
Auch einige Medikamente und Alkaloide wirken schädigend auf Nervenzellen und zählen damit zu den Nervengiften. Edelgase zählen nicht zu den Giften und sind gegenüber Biomolekülen chemisch inert. Jedoch über induzierte Dipole können Atome des Gases mit biologischen Systemen wechselwirken. So wirkt Xenon beispielsweise durch einen noch nicht vollständig geklärten Mechanismus unter Beteiligung von Glutamat-Rezeptoren narkotisierend. ⓘ

