Aluminiumoxid

| |

| |
| Bezeichner | |
|---|---|
3D-Modell (JSmol)
|
|
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
| EC-Nummer |
|
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
Al2O3 |
| Molekulare Masse | 101,960 g-mol-1 |
| Erscheinungsbild | weißer Feststoff |
| Geruch | geruchlos |
| Dichte | 3.987g/cm3 |
| Schmelzpunkt | 2.072 °C (3.762 °F; 2.345 K) |
| Siedepunkt | 2,977 °C (5,391 °F; 3,250 K) |
Löslichkeit in Wasser
|
unlöslich |
| Löslichkeit | unlöslich in allen Lösungsmitteln |
| log P | 0.31860 |
Magnetische Suszeptibilität (χ)
|
-37,0×10-6 cm3/mol |
| Thermische Leitfähigkeit | 30 W-m-1-K-1 |
Brechungsindex (nD)
|
nω=1,768-1,772 nε=1,760-1,763 Doppelbrechung 0,008 |
| Struktur | |
Kristallstruktur
|
Trigonal, hR30 |
Raumgruppe
|
R3c (Nr. 167) |
Gitterkonstante
|
a = 478,5 pm, c = 1299,1 pm
|
Koordinationsgeometrie
|
oktaedrisch |
| Thermochemie | |
Std. molare
Entropie (S |
50,92 J-mol-1-K-1 |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-1675,7 kJ/mol |
| Pharmakologie | |
ATC-Code
|
D10AX04 (WHO) |
| Gefahren | |
| GHS-Kennzeichnung: | |
Piktogramme
|

|
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | Nicht brennbar |
| NIOSH (US-Grenzwerte für Gesundheitsgefährdung): | |
PEL (Zulässig)
|
OSHA 15 mg/m3 (Gesamtstaub) OSHA 5 mg/m3 (lungengängige Fraktion) ACGIH/TLV 10 mg/m3 |
REL (Empfohlen)
|
keine |
IDLH (Unmittelbare Gefahr)
|
N.D. |
| Verwandte Verbindungen | |
Andere Anionen
|
Aluminiumhydroxid Aluminiumsulfid Aluminiumselenid |
Andere Kationen
|
Bortrioxid Galliumoxid Indiumoxid Thallium(III)-oxid |
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Aluminiumoxid ist eine chemische Verbindung aus Aluminium und Sauerstoff mit der chemischen Formel Al2O3. Es ist das am häufigsten vorkommende von mehreren Aluminiumoxiden und wird speziell als Aluminium(III)-oxid bezeichnet. Es wird allgemein als Tonerde bezeichnet und kann je nach Form oder Anwendung auch als Aloxid, Aloxit oder Alundum bezeichnet werden. In der Natur kommt es in seiner kristallinen polymorphen Phase α-Al2O3 als Mineral Korund vor, von dem die kostbaren Edelsteine Rubin und Saphir gebildet werden. Al2O3 ist von Bedeutung für die Herstellung von Aluminiummetall, wegen seiner Härte als Schleifmittel und wegen seines hohen Schmelzpunkts als feuerfester Werkstoff. ⓘ
| Kristallstruktur ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
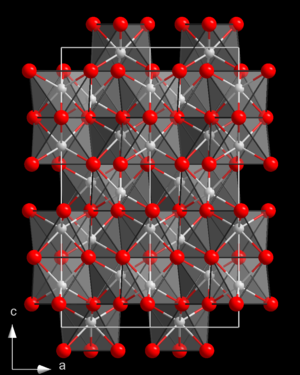
| |||||||||||||||||||
| Korund-Struktur _ Al3+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aluminiumoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | Al2O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 101,96 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,94 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
2054 °C | ||||||||||||||||||
| Siedepunkt |
2980 ± 60 °C | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, schwer löslich in Säuren und Basen | ||||||||||||||||||
| Brechungsindex |
1,77 (Saphir @500 nm) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten |
> 5000 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1676 kJ·mol−1 | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||

Natürliches Vorkommen
Korund ist die in der Natur am häufigsten vorkommende kristalline Form von Aluminiumoxid. Rubine und Saphire sind Edelsteinformen des Korunds, die ihre charakteristische Farbe Spuren von Verunreinigungen verdanken. Rubine erhalten ihre charakteristische tiefrote Farbe und ihre Lasereigenschaften durch Spuren von Chrom. Saphire gibt es in verschiedenen Farben, die durch verschiedene andere Verunreinigungen, wie Eisen und Titan, entstehen. Eine äußerst seltene δ-Form kommt als Mineral Deltalumit vor. ⓘ
Eigenschaften

Al2O3 ist ein elektrischer Isolator, hat aber eine relativ hohe Wärmeleitfähigkeit (30 Wm-1K-1) für ein keramisches Material. Aluminiumoxid ist unlöslich in Wasser. In seiner am häufigsten vorkommenden kristallinen Form, Korund oder α-Aluminiumoxid genannt, eignet es sich aufgrund seiner Härte als Schleifmittel und als Bestandteil von Schneidwerkzeugen. ⓘ
Aluminiumoxid ist für die Witterungsbeständigkeit von metallischem Aluminium verantwortlich. Metallisches Aluminium ist sehr reaktionsfreudig gegenüber Luftsauerstoff, und auf jeder freiliegenden Aluminiumoberfläche bildet sich innerhalb von Hunderten von Pikosekunden eine dünne Passivierungsschicht aus Aluminiumoxid (4 nm Dicke). Diese Schicht schützt das Metall vor weiterer Oxidation. Die Dicke und die Eigenschaften dieser Oxidschicht können durch ein Verfahren namens Eloxieren verbessert werden. Eine Reihe von Legierungen, wie z. B. Aluminiumbronzen, machen sich diese Eigenschaft zunutze, indem sie einen Anteil an Aluminium in der Legierung enthalten, um die Korrosionsbeständigkeit zu erhöhen. Das durch Eloxieren erzeugte Aluminiumoxid ist in der Regel amorph, aber entladungsunterstützte Oxidationsverfahren wie die plasmaelektrolytische Oxidation führen zu einem beträchtlichen Anteil an kristallinem Aluminiumoxid in der Beschichtung, was ihre Härte erhöht. ⓘ
Aluminiumoxid wurde 1988 von der Chemikalienliste der US-Umweltschutzbehörde EPA gestrichen. In faserförmiger Form steht Aluminiumoxid auf der Liste des Toxics Release Inventory der EPA. ⓘ
Eigenschaften
Aluminiumoxid ist eine amphotere Substanz, d. h. es kann sowohl mit Säuren als auch mit Basen reagieren, z. B. mit Flusssäure und Natriumhydroxid, wobei es als Säure mit einer Base und als Base mit einer Säure reagiert, die jeweils andere neutralisiert und ein Salz bildet.
- Al2O3 + 6 HF → 2 AlF3 + 3 H2O
- Al2O3 + 2 NaOH + 3 H2O → 2 NaAl(OH)4 (Natriumaluminat) ⓘ
Modifikationen
Die wichtigsten Modifikationen des Aluminiumoxides sind:
- das kubische γ-Al2O3 (Tonerde, Ausgangsstoff zur Keramik- und Aluminiumherstellung)
- das rhomboedrische (trigonale) α-Al2O3 (bekannt als Mineral Korund, Saphir oder – bei Chromdotierung – Rubin, als Schleifmittel und Aluminiumoxid-Keramik)
- Ebenso ist noch die β-Tonerde (β-Al2O3) bekannt, hierbei handelt es sich um einen historischen Irrtum. Dabei handelt es sich um die Verbindung von Na2O und Al2O3 zu Na2Al22O34 (Na2O·11Al2O3), bekannt auch unter dem Mineralnamen Diaoyudaoit ⓘ
Elektrische Eigenschaften
Al2O3 ist ein sehr guter Isolator und besitzt eine sehr hohe Durchschlagsfestigkeit von 35 kV/mm. Der spezifische Widerstand beträgt bei 20 °C 1012 Ω m, bei 1000 °C sinkt er auf 107 Ω·m. Die relative Permittivität beträgt 9–10 bei 100 MHz, der Verlustfaktor etwa 10−4. ⓘ
Thermische Eigenschaften
Unter Standardbedingungen liegt die Wärmeleitfähigkeit aufgrund der Phononenresonanz bei einem für Keramikmaterialien vergleichsweise sehr hohen Wert von 35,6–39 W·m−1·K−1 (einkristalliner Korund: 40 W·m−1·K−1, dichte Keramik mit 96 % Al2O3 ca. 25 W·m−1·K−1), der mit sinkender Temperatur stark ansteigt und mit steigender Temperatur bei 1000 °C auf etwa 5 W·m−1·K−1 absinkt. ⓘ
Der Ausdehnungskoeffizient liegt im Bereich 6,5–8,9·10−6 K−1. ⓘ
Die Schmelztemperatur beträgt 2054 °C, daher sollte die Anwendungstemperatur hochreiner Aluminiumoxidkeramik unter 1900 °C liegen. ⓘ
Chemische Eigenschaften
Al2O3 ist ein amphoteres Salz, das heißt, es kann als Säure (in Verbindung mit einer Base) oder als Base (in Verbindung mit einer Säure) reagieren. ⓘ
Das γ-Al2O3 ist ein hygroskopisches, weißes, lockeres Pulver, das nicht in Wasser, dafür in starken Säuren und Basen löslich ist. Bereits ab 800 °C geht das γ-Al2O3 in das in Säuren wie Basen im Allgemeinen unlösliche α-Al2O3 über. ⓘ
γ-Al2O3 ist ein poröses Material, dessen Oberflächenstruktur stark von dem Herstellungsprozess, beziehungsweise dessen Temperatur, beeinflusst werden kann. In der Chromatographie wird es als stationäre Phase verwendet. ⓘ
Mit verschiedenen Metalloxiden bildet Aluminiumoxid Aluminate. ⓘ
Mechanische Eigenschaften
Die mechanischen Eigenschaften der Aluminiumoxidkeramik hängen von der Reinheit und dem Gefüge der hergestellten Keramik ab. Je reiner die Sorte ist, desto bessere Eigenschaften werden erzielt, desto aufwendiger wird aber auch der gesamte Herstellungsprozess. Neben den in der Tabelle unten aufgeführten Eigenschaften zeichnet sich Aluminiumoxidkeramik auch durch sehr gute tribologische Eigenschaften bzw. ein sehr gutes Reibungs- und Verschleißverhalten aus:
| Eigenschaft | 96 % | 99,8 % |
|---|---|---|
| Dichte | 3,75 g/cm³ | 3,96 g/cm³ |
| Biegefestigkeit | 310 MPa | 630 MPa |
| Weibullmodul | 13 | 15 |
| Druckfestigkeit | 2500 MPa | 4000 MPa |
| Bruchzähigkeit | 4,0 MPam½ | 4,3 MPam½ |
| E-Modul | 350 GPa | 406 GPa |
| Vickershärte HV1 | 1620 MPa | 2000 MPa |
Struktur

Die am häufigsten vorkommende Form von kristallinem Aluminiumoxid ist als Korund bekannt und ist die thermodynamisch stabilste Form. Die Sauerstoffionen bilden eine nahezu hexagonale, dicht gepackte Struktur, wobei die Aluminiumionen zwei Drittel der oktaedrischen Zwischenräume ausfüllen. Jedes Al3+-Zentrum ist oktaedrisch. Kristallographisch gesehen weist Korund ein trigonales Bravais-Gitter mit der Raumgruppe R3c (Nummer 167 in den Internationalen Tabellen) auf. Die Urzelle enthält zwei Formeleinheiten aus Aluminiumoxid. ⓘ
Aluminiumoxid existiert auch in anderen metastabilen Phasen, darunter die kubischen γ- und η-Phasen, die monokline θ-Phase, die hexagonale χ-Phase, die orthorhombische κ-Phase und die δ-Phase, die tetragonal oder orthorhombisch sein kann. Jede dieser Phasen hat eine eigene Kristallstruktur und eigene Eigenschaften. Kubisches γ-Al2O3 hat wichtige technische Anwendungen. Das so genannte β-Al2O3 hat sich als NaAl11O17 erwiesen. ⓘ
Geschmolzenes Aluminiumoxid nahe der Schmelztemperatur ist zu etwa 2/3 tetraedrisch (d. h. 2/3 der Al-Atome sind von 4 benachbarten Sauerstoffatomen umgeben) und zu 1/3 5-koordiniert, wobei nur sehr wenig (<5 %) oktaedrisches Al-O vorhanden ist. Etwa 80 % der Sauerstoffatome werden von drei oder mehr Al-O-Polyedern gemeinsam genutzt, und die meisten interpolyedrischen Verbindungen sind Eckverbindungen, während die restlichen 10-20 % Kantenverbindungen sind. Der Zerfall von Oktaedern beim Schmelzen geht mit einer relativ großen Volumenzunahme (~33 %) einher, die Dichte der Flüssigkeit nahe dem Schmelzpunkt beträgt 2,93 g/cm3. Die Struktur des geschmolzenen Aluminiumoxids ist temperaturabhängig, und der Anteil des 5- und 6-fachen Aluminiums nimmt während des Abkühlens (und der Unterkühlung) auf Kosten der tetraedrischen AlO4-Einheiten zu und nähert sich damit den lokalen Strukturanordnungen des amorphen Aluminiumoxids an. ⓘ
Herstellung
Aluminiumhydroxidminerale sind der Hauptbestandteil von Bauxit, dem wichtigsten Aluminiumerz. Bauxiterz besteht aus einer Mischung von Mineralien, darunter Gibbsit (Al(OH)3), Böhmit (γ-AlO(OH)) und Diaspore (α-AlO(OH)), sowie Verunreinigungen aus Eisenoxiden und -hydroxiden, Quarz und Tonmineralien. Bauxite kommen in Lateriten vor. Bauxit wird in der Regel nach dem Bayer-Verfahren gereinigt:
- Al2O3 + H2O + NaOH → NaAl(OH)4
- Al(OH)3 + NaOH → NaAl(OH)4 ⓘ
Mit Ausnahme von SiO2 lösen sich die anderen Bestandteile des Bauxits nicht in der Base. Beim Filtrieren der Basenmischung wird Fe2O3 entfernt. Beim Abkühlen der Bayer-Flüssigkeit fällt Al(OH)3 aus, wobei die Silikate in Lösung bleiben. ⓘ
- NaAl(OH)4 → NaOH + Al(OH)3 ⓘ
Der feste Al(OH)3-Gibbsit wird dann kalziniert (auf über 1100 °C erhitzt), wobei Aluminiumoxid entsteht:
- 2 Al(OH)3 → Al2O3 + 3 H2O ⓘ
Das Produkt Aluminiumoxid ist in der Regel mehrphasig, d. h. es besteht aus mehreren Phasen von Aluminiumoxid und nicht nur aus Korund. Der Produktionsprozess kann daher optimiert werden, um ein maßgeschneidertes Produkt herzustellen. Die Art der vorhandenen Phasen wirkt sich beispielsweise auf die Löslichkeit und die Porenstruktur des Aluminiumoxidprodukts aus, was sich wiederum auf die Kosten der Aluminiumproduktion und den Umweltschutz auswirkt. ⓘ
Anwendungen
Aluminiumoxid ist in den Materialwissenschaften als Alpha-Aluminiumoxid, im Bergbau und in der Keramikindustrie als Alundum (in geschmolzener Form) oder Aloxit bekannt und findet breite Anwendung. Die weltweite Jahresproduktion von Aluminiumoxid betrug 2015 etwa 115 Millionen Tonnen, wovon über 90 % für die Herstellung von Aluminiummetall verwendet werden. Die wichtigsten Verwendungszwecke für spezielle Aluminiumoxide sind feuerfeste Materialien, Keramik, Polier- und Schleifmittel. Große Mengen an Aluminiumhydroxid, aus dem Aluminiumoxid gewonnen wird, werden zur Herstellung von Zeolithen, Beschichtungspigmenten aus Titandioxid und als Feuerschutzmittel/Rauchschutzmittel verwendet. ⓘ
Über 90 % des produzierten Aluminiumoxids, das normalerweise als Smelter Grade Alumina (SGA) bezeichnet wird, wird für die Herstellung von Aluminium verbraucht, üblicherweise nach dem Hall-Héroult-Verfahren. Das restliche Aluminiumoxid, das normalerweise als Spezialtonerde bezeichnet wird, wird in einer Vielzahl von Anwendungen eingesetzt, die seine Inertheit, Temperaturbeständigkeit und seinen elektrischen Widerstand widerspiegeln. ⓘ
Füllstoffe
Da Aluminiumoxid chemisch relativ inert und weiß ist, ist es ein beliebter Füllstoff für Kunststoffe. Aluminiumoxid ist ein häufiger Bestandteil von Sonnenschutzmitteln und manchmal auch in Kosmetika wie Rouge, Lippenstift und Nagellack enthalten. ⓘ
Glas
Viele Glasformulierungen enthalten Aluminiumoxid als Bestandteil. Aluminosilikatglas ist eine häufig verwendete Glasart, die oft 5 bis 10 % Aluminiumoxid enthält. ⓘ
Katalyse
Aluminiumoxid katalysiert eine Vielzahl von Reaktionen, die in der Industrie nützlich sind. In seiner größten Anwendung ist Aluminiumoxid der Katalysator im Claus-Prozess zur Umwandlung von Schwefelwasserstoff-Abgasen in elementaren Schwefel in Raffinerien. Es ist auch für die Dehydratisierung von Alkoholen zu Alkenen nützlich. ⓘ
Aluminiumoxid dient als Katalysatorträger für viele industrielle Katalysatoren, z. B. für die Hydrodesulfurierung und einige Ziegler-Natta-Polymerisationen. ⓘ
Gasreinigung
Aluminiumoxid wird häufig zur Entfernung von Wasser aus Gasströmen verwendet. ⓘ
Schleifmittel
Aluminiumoxid wird wegen seiner Härte und Festigkeit verwendet. Seine natürlich vorkommende Form, Korund, hat die Härte 9 auf der Mohsschen Härteskala (knapp unterhalb von Diamant). Es wird in großem Umfang als Schleifmittel verwendet, unter anderem als weitaus preiswerterer Ersatz für Industriediamanten. Viele Arten von Schleifpapier verwenden Aluminiumoxidkristalle. Aufgrund der geringen Wärmespeicherung und der niedrigen spezifischen Wärme wird es außerdem häufig für Schleifarbeiten verwendet, insbesondere für Trennwerkzeuge. Als pulverförmiges Schleifmineral Aloxit ist es neben Siliziumdioxid ein Hauptbestandteil der beim Billard verwendeten "Kreide" für die Queuespitzen. Aluminiumoxidpulver wird in einigen CD/DVD-Polier- und Kratzer-Reparatursets verwendet. Seine polierenden Eigenschaften sind auch der Grund für seine Verwendung in Zahnpasta. Es wird auch in der Mikrodermabrasion verwendet, sowohl in dem maschinellen Verfahren, das bei Dermatologen und Kosmetikerinnen erhältlich ist, als auch als manuelles Hautabschleifmittel, das gemäß den Anweisungen des Herstellers verwendet wird. ⓘ
Farbe
Aluminiumoxidflocken werden in Farben für reflektierende dekorative Effekte verwendet, z. B. in der Automobil- oder Kosmetikindustrie. ⓘ
Faserverbundwerkstoffe
Aluminiumoxid wurde in einigen experimentellen und kommerziellen Fasermaterialien für Hochleistungsanwendungen verwendet (z. B. Fiber FP, Nextel 610, Nextel 720). Insbesondere Aluminiumoxid-Nanofasern sind ein interessantes Forschungsgebiet geworden. ⓘ
Körperpanzer
Einige Körperpanzer verwenden Aluminiumoxid-Keramikplatten, in der Regel in Kombination mit einer Aramid- oder UHMWPE-Verstärkung, um gegen die meisten Bedrohungen durch Gewehre wirksam zu sein. Aluminiumoxid-Keramikpanzerungen sind für die meisten Zivilisten in Ländern, in denen sie legal sind, leicht erhältlich, gelten aber nicht als militärisch geeignet. ⓘ
Abrasionsschutz
Aluminiumoxid kann durch Eloxieren oder plasmaelektrolytische Oxidation als Beschichtung auf Aluminium aufgebracht werden (siehe oben unter "Eigenschaften"). Sowohl die Härte als auch die Abriebfestigkeit der Beschichtung beruhen auf der hohen Festigkeit des Aluminiumoxids, doch liegt die mit herkömmlichen Gleichstrom-Eloxalverfahren erzeugte poröse Schicht in einem Härtebereich von 60-70 Rockwell C, der nur mit gehärteten Kohlenstoffstahllegierungen vergleichbar ist, aber deutlich unter der Härte von natürlichem und synthetischem Korund liegt. Bei der plasmaelektrolytischen Oxidation hingegen ist die Beschichtung nur in der obersten Oxidschicht porös, während die unteren Oxidschichten viel kompakter sind als bei den üblichen Gleichstrom-Eloxalverfahren und eine höhere Kristallinität aufweisen, da die Oxidschichten umgeschmolzen und verdichtet werden, so dass α-Al2O3-Cluster mit einer viel höheren Schichthärte von etwa 2000 Vickers entstehen. ⓘ
Aluminiumoxid wird zur Herstellung von Fliesen verwendet, die in den Leitungen für pulverisierte Brennstoffe und Rauchgaskanälen von Kohlekraftwerken angebracht werden, um Bereiche mit hohem Verschleiß zu schützen. Sie eignen sich nicht für Bereiche mit hohen Stoßkräften, da diese Platten spröde und bruchgefährdet sind. ⓘ
Elektrische Isolierung
Aluminiumoxid ist ein elektrischer Isolator, der als Substrat (Silizium auf Saphir) für integrierte Schaltkreise, aber auch als Tunnelbarriere für die Herstellung von supraleitenden Bauelementen wie Einzelelektronentransistoren und supraleitenden Quanteninterferenzbauelementen (SQUIDs) verwendet wird. ⓘ
Für seine Anwendung als elektrischer Isolator in integrierten Schaltkreisen, bei der das konforme Wachstum einer dünnen Schicht eine Voraussetzung ist und die bevorzugte Wachstumsmethode die Atomlagenabscheidung ist, können Al2O3-Schichten durch den chemischen Austausch zwischen Trimethylaluminium (Al(CH3)3) und H2O hergestellt werden:
- 2 Al(CH3)3 + 3 H2O → Al2O3 + 6 CH4 ⓘ
H2O kann in der obigen Reaktion durch Ozon (O3) als aktives Oxidationsmittel ersetzt werden, und die folgende Reaktion läuft dann ab:
- 2 Al(CH3)3 + O3 → Al2O3 + 3 C2H6 ⓘ
Die mit O3 hergestellten Al2O3-Schichten weisen im Vergleich zu den mit H2O hergestellten Schichten eine 10- bis 100-mal geringere Leckstromdichte auf. ⓘ
Da Aluminiumoxid ein Dielektrikum mit relativ großer Bandlücke ist, wird es als isolierende Barriere in Kondensatoren verwendet. ⓘ
Andere
In der Beleuchtungstechnik wird lichtdurchlässiges Aluminiumoxid in einigen Natriumdampflampen verwendet. Aluminiumoxid wird auch bei der Herstellung von Beschichtungssuspensionen in Kompaktleuchtstofflampen verwendet. ⓘ
In Chemielabors ist Aluminiumoxid ein Medium für die Chromatographie, das in basischen (pH 9,5), sauren (pH 4,5 in Wasser) und neutralen Formulierungen erhältlich ist. ⓘ
Im Gesundheitswesen und in der Medizin wird es unter anderem als Material für Hüftprothesen und Antibabypillen verwendet. ⓘ
Es wird als Szintillator und Dosimeter für Strahlenschutz- und Therapieanwendungen aufgrund seiner optisch stimulierten Lumineszenzeigenschaften verwendet. ⓘ
Isolierungen für Hochtemperaturöfen werden häufig aus Aluminiumoxid hergestellt. Manchmal enthält die Isolierung je nach Temperaturbereich des Materials unterschiedliche Anteile an Siliziumdioxid. Die Isolierung kann in Form von Matten, Platten, Ziegeln und losen Fasern für verschiedene Anwendungsanforderungen hergestellt werden. ⓘ
Kleine Stücke von Aluminiumoxid werden oft als Siedechips in der Chemie verwendet. ⓘ
Es wird auch zur Herstellung von Zündkerzenisolatoren verwendet. ⓘ
Mit Hilfe eines Plasmaspritzverfahrens und in Mischung mit Titandioxid wird es auf die Bremsfläche einiger Fahrradfelgen aufgetragen, um Abrieb- und Verschleißfestigkeit zu gewährleisten. ⓘ
Die meisten keramischen Augen an Angelruten sind runde Ringe aus Aluminiumoxid. ⓘ
In seiner feinsten pulverförmigen (weißen) Form, Diamantine genannt, wird Aluminiumoxid als hervorragendes Poliermittel in der Uhrenindustrie verwendet. ⓘ
Aluminiumoxid wird auch für die Beschichtung von Stützen in der Motorcross- und Mountainbike-Industrie verwendet. Diese Beschichtung wird mit Molybdändisulfat kombiniert, um eine langfristige Schmierung der Oberfläche zu gewährleisten. ⓘ
Gewinnung und Darstellung
Aus Bauxit wird Aluminiumhydroxid durch Aufschließen in Natronlauge gewonnen (Bayer-Verfahren). Durch Entziehen des Wassers, zum Beispiel durch Brennen, Sintern oder Kalzinieren erhält man Aluminiumoxid. ⓘ
Die Darstellung von Aluminiumoxid kann auch durch vorsichtiges Dehydrieren von Gibbsit (Hydrargillit) oder Böhmit erfolgen. ⓘ
Aluminiumoxid entsteht zudem bei der Verbrennung von Aluminiumpulver mit Ammoniumperchlorat in Feststoffraketen. ⓘ
Das reine Metall Aluminium weist nach Lagerung an Luft eine dünne spontane Aluminiumoxidschicht (Selbstpassivierung) auf, die es vor Korrosion schützt. Mittels einer elektrolytisch aufgebrachten Aluminiumoxidschicht werden durch Eloxieren die Aluminiumoberflächen von Gebrauchsgegenständen mit einer extrem harten (etwa Mohs-Härte 9) und korrosionsbeständigen Schutzschicht versehen. Zur Fertigung von Elektrolytkondensatoren verwendet man diese eloxierten Aluminiumsorten. ⓘ
Die weltweite Produktion von Aluminiumoxid stieg von 108 Mio. t im Jahre 2014 auf geschätzte 118 Mio. t im Jahre 2015. Die drei größten Produzenten von Aluminiumoxid waren 2014 China (47,8 Mio. t), Australien (20,5 Mio. t) und Brasilien (10,6 Mio. t). Der USGS gibt als durchschnittliche US-Importpreise für Aluminiumoxid 410 USD je Tonne im Jahre 2015 an, während die Importpreise für Bauxit im selben Jahr bei 28 USD je Tonne lagen. ⓘ
Als Abfallprodukt bei der Gewinnung von Aluminiumoxid entsteht Rotschlamm, der ätzende Natronlauge und giftige Schwermetalle enthält und weltweit teilweise in offenen Deponien gelagert oder in Flüsse abgeleitet wird. ⓘ
Weitere Aluminiumoxide
Neben dem dreiwertigen Aluminiumoxid sind noch zwei weitere Aluminiumoxide in niedrigeren Oxidationsstufen, Aluminium(I)-oxid und Aluminium(II)-oxid bekannt. Diese sind jedoch nur bei hohen Temperaturen in der Gasphase stabil. ⓘ


