Aceton
|
| |||
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Aceton
| |||
| Bevorzugter IUPAC-Name
Propan-2-one | |||
Andere Bezeichnungen
| |||
| Bezeichnungen | |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
Beilstein-Referenz
|
635680 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
1466 | ||
| KEGG | |||
| MeSH | Aceton | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1090 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C3H6O | ||
| Molekulare Masse | 58,080 g-mol-1 | ||
| Erscheinungsbild | Farblose Flüssigkeit | ||
| Geruch | Stechend, reizend, blumig, gurkenartig | ||
| Dichte | 0,7845 g/cm3 (25 °C) | ||
| Schmelzpunkt | -94,7 °C (-138,5 °F; 178,5 K) | ||
| Siedepunkt | 56,05 °C (132,89 °F; 329,20 K) | ||
Löslichkeit in Wasser
|
mischbar | ||
| Löslichkeit | mischbar in Benzol, Diethylether, Methanol, Chloroform, Ethanol | ||
| log P | −0.16 | ||
| Dampfdruck |
| ||
| Säuregehalt (pKa) |
| ||
Magnetische Suszeptibilität (χ)
|
-33,78-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1,3588 (VD = 54,46) | ||
| Viskosität | 0,295 mPa-s (25 °C) | ||
| Struktur | |||
Koordinationsgeometrie
|
Trigonal planar bei C2 | ||
Molekulare Form
|
Zweiflächig an C2 | ||
Dipolmoment
|
2.91 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
125,45 J/(mol-K) | ||
Std. molare
Entropie (S |
200,4 J/(mol-K) | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
(-250,03) - (-248,77) kJ/mol | ||
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
-1,772 MJ/mol | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H225, H319, H336, H373 | ||
Sicherheitshinweise
|
P210, P235, P260, P305+P351+P338 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | -20 °C (-4 °F; 253 K) | ||
Selbstentzündung
temperatur |
465 °C (869 °F; 738 K) | ||
| Explosionsgrenzen | 2.6–12.8% | ||
Schwellengrenzwert (TLV)
|
1185 mg/m3 (TWA), 2375 mg/m3 (STEL) | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (Mittlere Dosis)
|
| ||
LC50 (mittlere Konzentration)
|
20.702 ppm (Ratte, 8 h) | ||
LCLo (niedrigste veröffentlichte)
|
45.455 ppm (Maus, 1 h) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
1000 ppm (2400 mg/m3) | ||
REL (Empfohlen)
|
TWA 250 ppm (590 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
2500 ppm | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
| ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
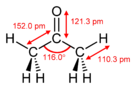
Aceton, Propanon oder Dimethylketon, ist eine organische Verbindung mit der Formel (CH3)2CO. Es ist das einfachste und kleinste Keton. Es ist eine farblose, leicht flüchtige und brennbare Flüssigkeit mit einem charakteristischen, stechenden Geruch. ⓘ
Aceton ist mit Wasser mischbar und dient als wichtiges organisches Lösungsmittel in der Industrie, im Haushalt und im Labor. Im Jahr 2010 wurden weltweit etwa 6,7 Millionen Tonnen produziert, hauptsächlich zur Verwendung als Lösungsmittel und zur Herstellung von Methylmethacrylat (und daraus PMMA) sowie Bisphenol A. Es ist ein häufiger Baustein in der organischen Chemie. Im Haushalt wird Aceton häufig als Wirkstoff in Nagellackentfernern und als Farbverdünner verwendet. In den Vereinigten Staaten ist Aceton als flüchtige organische Verbindung (VOC) freigestellt. ⓘ
Aceton wird im menschlichen Körper durch normale Stoffwechselprozesse produziert und entsorgt. Es ist normalerweise in Blut und Urin vorhanden. Menschen mit diabetischer Ketoazidose produzieren es in größeren Mengen. Reproduktionstoxizitätstests zeigen, dass es nur ein geringes Potenzial hat, Fortpflanzungsprobleme zu verursachen. Ketogene Diäten, die den Gehalt an Ketonkörpern (Aceton, β-Hydroxybuttersäure und Acetessigsäure) im Blut erhöhen, werden eingesetzt, um epileptische Anfälle bei Säuglingen und Kindern zu bekämpfen, die an refraktärer Epilepsie leiden. ⓘ
Geschichte
Aceton wurde erstmals von Andreas Libavius im Jahr 1606 durch Destillation von Blei(II)-acetat hergestellt. ⓘ
Im Jahr 1832 bestimmten der französische Chemiker Jean-Baptiste Dumas und der deutsche Chemiker Justus von Liebig die empirische Formel für Aceton. 1833 benannte der französische Chemiker Antoine Bussy Aceton, indem er dem Stamm der entsprechenden Säure (Essigsäure) die Endung -one hinzufügte. 1852 erkannte der englische Chemiker Alexander William Williamson, dass es sich bei Aceton um Methylacetyl handelte; ein Jahr später stimmte der französische Chemiker Charles Frédéric Gerhardt zu. Im Jahr 1865 veröffentlichte der deutsche Chemiker August Kekulé die moderne Strukturformel für Aceton. Johann Josef Loschmidt hatte bereits 1861 die Struktur von Aceton vorgestellt, doch seine privat veröffentlichte Broschüre fand kaum Beachtung. Während des Ersten Weltkriegs entwickelte Chaim Weizmann das Verfahren zur industriellen Herstellung von Aceton (Weizmann-Prozess). ⓘ
Produktion
Im Jahr 2010 wurde die weltweite Produktionskapazität für Aceton auf 6,7 Millionen Tonnen pro Jahr geschätzt. Mit 1,56 Millionen Tonnen pro Jahr hatten die Vereinigten Staaten die höchste Produktionskapazität, gefolgt von Taiwan und dem chinesischen Festland. Der größte Acetonhersteller ist INEOS Phenol mit einem Anteil von 17 % an der weltweiten Kapazität, wobei Mitsui, Sunoco und Shell im Jahr 2010 ebenfalls erhebliche Kapazitäten (7-8 %) besaßen. INEOS Phenol besitzt auch die weltweit größte Produktionsstätte (420.000 Tonnen/Jahr) in Beveren (Belgien). Der Spotpreis für Aceton lag im Sommer 2011 in den Vereinigten Staaten bei 1100-1250 USD/Tonne. ⓘ
Derzeitige Methode
Aceton wird direkt oder indirekt aus Propylen hergestellt. Etwa 83 % des Acetons werden nach dem Cumolverfahren hergestellt, so dass die Acetonproduktion an die Phenolproduktion gebunden ist. Beim Cumol-Verfahren wird Benzol mit Propylen alkyliert, um Cumol zu erzeugen, das an der Luft oxidiert wird, um Phenol und Aceton zu erzeugen:
Andere Verfahren beinhalten die direkte Oxidation von Propylen (Wacker-Hoechst-Verfahren) oder die Hydratisierung von Propylen zu 2-Propanol, das zu Aceton oxidiert (dehydriert) wird. ⓘ
Ältere Methoden
Früher wurde Aceton durch die trockene Destillation von Acetaten, z. B. Calciumacetat in ketonischer Decarboxylierung, hergestellt.
- Ca(CH3COO)2 → CaO(s) + CO2(g) + (CH3)2CO (v)
Danach, während des Ersten Weltkriegs, wurde Aceton durch Aceton-Butanol-Ethanol-Fermentation mit Clostridium acetobutylicum-Bakterien hergestellt, die von Chaim Weizmann (dem späteren ersten Präsidenten Israels) entwickelt wurde, um die britischen Kriegsanstrengungen bei der Herstellung von Cordit zu unterstützen. Diese Aceton-Butanol-Ethanol-Fermentation wurde schließlich aufgegeben, als neuere Methoden mit besseren Erträgen gefunden wurden. ⓘ
Chemische Eigenschaften
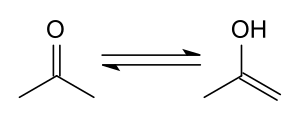
Keto/Enol-Tautomerie
Wie die meisten Ketone weist Aceton die Keto-Enol-Tautomerie auf, bei der die nominelle Ketostruktur (CH
3)
2C=O des Acetons selbst im Gleichgewicht mit dem Enol-Isomer (CH
3)C(OH)=(CH
2) (Prop-1-en-2-ol). In Acetondampf bei Umgebungstemperatur liegen nur 2,4×10-7 % der Moleküle in der Enolform vor. Dennoch ist die Enolform bei einigen chemischen Reaktionen von Bedeutung. ⓘ
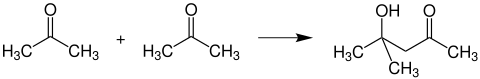
Aldol-Kondensation
In Anwesenheit geeigneter Katalysatoren verbinden sich zwei Acetonmoleküle auch zu der Verbindung Diacetonalkohol (CH
3)C=O(CH
2)C(OH)(CH
3)
2, die nach Dehydratisierung Mesityloxid (CH
3)C=O(CH)=C(CH3)
2. Dieses Produkt kann sich weiter mit einem anderen Acetonmolekül verbinden, wobei ein weiteres Wassermolekül verloren geht und Phoron und andere Verbindungen entstehen. ⓘ
Polymerisation
Man kann davon ausgehen, dass Aceton auch Polymere und (möglicherweise zyklische) Oligomere zweier Arten bilden kann. Bei der einen Art könnten die Einheiten Acetonmoleküle sein, die durch Etherbrücken -O- verbunden sind, die sich aus der Öffnung der Doppelbindung ergeben, um eine polyketalartige (PKA) Kette [-O-C(CH
3)
2-]n. Der andere Typ könnte durch wiederholte Aldolkondensation erhalten werden, wobei bei jedem Schritt ein Wassermolekül entfernt wird, was eine Poly(methylacetylen)-Kette (PMA) [-CH=C(CH
3)-]n. ⓘ
PKA-Typ
Die Umwandlung von Aceton in ein Polyketal (PKA) würde analog zur Bildung von Paraformaldehyd aus Formol und von Trithioaceton aus Thioaceton verlaufen. 1960 stellten Kargin, Kabanov und andere fest, dass die Thermodynamik dieses Prozesses für flüssiges Aceton ungünstig ist, so dass es (im Gegensatz zu Thioaceton und Formol) auch mit Katalysatoren nicht spontan polymerisieren dürfte. Sie beobachteten jedoch, dass die Thermodynamik für kristallines festes Aceton am Schmelzpunkt (-96 °C) günstig wurde. Sie behaupteten, ein solches Polymer (ein weißer, elastischer, in Aceton löslicher Feststoff, der mehrere Stunden lang bei Raumtemperatur stabil ist) durch Ablagerung von Acetondampf mit etwas Magnesium als Katalysator auf einer sehr kalten Oberfläche erhalten zu haben. ⓘ
1962 berichtete Wasaburo Kawai über die Synthese eines ähnlichen Produkts aus flüssigem, auf -70 bis -78 °C abgekühltem Aceton unter Verwendung von n-Butyllithium oder Triethylaluminium als Katalysatoren. Er behauptete, das Infrarot-Absorptionsspektrum zeige das Vorhandensein von -O- Bindungen, aber keine C=O-Gruppen. Andere Forscher kamen jedoch später zu widersprüchlichen Ergebnissen. ⓘ

PMA-Typ
Die Acetonpolymere vom Typ PMA entsprechen dem Polymerisationsprodukt von Propin, mit Ausnahme einer Keto-Endgruppe. ⓘ
Biochemie
Aceton ist ein in der Leber gebildeter Ketonkörper, der nicht in nennenswertem Umfang verstoffwechselt werden kann. Er wird deshalb über die Lunge oder im Ausnahmefall über den Harn abgegeben (Acetonurie, ein Symptom des Diabetes mellitus). Andere Ketonkörper sind Acetessigsäure und 3-Hydroxybutansäure. Diese können im Stoffwechsel verarbeitet werden und sind beteiligt an der Energiebereitstellung für die Muskeln. ⓘ
Biosynthese
Geringe Mengen von Aceton werden im Körper durch die Decarboxylierung von Ketonkörpern gebildet. Bestimmte Ernährungsgewohnheiten, wie langes Fasten und fettreiche, kohlenhydratarme Diäten, können zu einer Ketose führen, bei der Aceton im Körpergewebe gebildet wird. Bestimmte Gesundheitszustände wie Alkoholismus und Diabetes können eine Ketoazidose hervorrufen, eine unkontrollierbare Ketose, die zu einem starken und möglicherweise tödlichen Anstieg des Säuregehalts im Blut führt. Da es ein Nebenprodukt der Gärung ist, ist Aceton ein Nebenprodukt der Brennereiindustrie. ⓘ
Aceton kann durch die Oxidation von eingenommenem Isopropanol oder durch den spontanen/enzymatischen Abbau von Acetoacetat (einem Ketonkörper) bei ketotischen Personen entstehen. ⓘ
Stoffwechsel
Obwohl einige Biochemielehrbücher und aktuelle Forschungspublikationen darauf hinweisen, dass Aceton nicht verstoffwechselt werden kann, gibt es Beweise für das Gegenteil. Es kann entweder durch CYP2E1 über Methylglyoxal zu D-Laktat und Pyruvat und schließlich zu Glukose/Energie verstoffwechselt werden oder auf einem anderen Weg über Propylenglykol zu Pyruvat, Laktat, Acetat (für Energie nutzbar) und Propionaldehyd. ⓘ
Verwendungen
Industriell
Etwa ein Drittel der weltweiten Acetonproduktion wird als Lösungsmittel verwendet, und ein Viertel wird als Acetoncyanhydrin, einem Vorprodukt von Methylmethacrylat, verbraucht. ⓘ
Lösungsmittel
Aceton ist ein gutes Lösungsmittel für viele Kunststoffe und einige Kunstfasern. Es wird zum Verdünnen von Polyesterharz, zum Reinigen von Werkzeugen und zum Auflösen von Zweikomponenten-Epoxidharz und Sekundenkleber vor dem Aushärten verwendet. Es wird als eine der flüchtigen Komponenten einiger Farben und Lacke verwendet. Als Hochleistungsentfetter ist es nützlich bei der Vorbereitung von Metall vor dem Lackieren oder Löten und zur Entfernung von Kolophoniumflussmittel nach dem Löten (um das Anhaften von Schmutz und elektrischen Leckagen und möglicherweise Korrosion zu verhindern oder aus kosmetischen Gründen), obwohl es viele elektronische Bauteile (z. B. Polystyrolkondensatoren) angreift, so dass es für die Reinigung vieler Leiterplatten ungeeignet ist. ⓘ
Acetylenträger
Obwohl Aceton selbst brennbar ist, wird es in großem Umfang als Lösungsmittel für den sicheren Transport und die Lagerung von Acetylen verwendet, das als reine Verbindung nicht sicher unter Druck gesetzt werden kann. Gefäße, die ein poröses Material enthalten, werden zunächst mit Aceton und dann mit Acetylen gefüllt, das sich im Aceton auflöst. Ein Liter Aceton kann bei einem Druck von 10 bar (1,0 MPa) etwa 250 Liter Acetylen auflösen. ⓘ
Chemisches Zwischenprodukt
Aceton wird für die Synthese von Methylmethacrylat verwendet. Es beginnt mit der anfänglichen Umwandlung von Aceton in Acetoncyanohydrin:
- (CH3)2CO + HCN → (CH3)2C(OH)CN
In einem weiteren Schritt wird das Nitril zu dem ungesättigten Amid hydrolysiert, das verestert wird:
- (CH3)2C(OH)CN + CH3OH → CH2=C(CH3)CO2CH3 + NH3
Die dritte wichtige Verwendung von Aceton (etwa 20 %) ist die Synthese von Bisphenol A. Bisphenol A ist Bestandteil vieler Polymere wie Polycarbonate, Polyurethane und Epoxidharze. Die Synthese erfolgt durch die Kondensation von Aceton mit Phenol:
- (CH3)2CO + 2 C6H5OH → (CH3)2C(C6H4OH)2 + H2O
Viele Millionen Kilogramm Aceton werden für die Herstellung der Lösungsmittel Methylisobutylalkohol und Methylisobutylketon verbraucht. Diese Produkte entstehen zunächst durch eine Aldolkondensation zu Diacetonalkohol.
- 2 (CH3)2CO → (CH3)2C(OH)CH2C(O)CH3
Durch Kondensation mit Acetylen entsteht 2-Methylbut-3-yn-2-ol, eine Vorstufe synthetischer Terpene und Terpenoide. ⓘ
Laboratorium
Chromatographie

Spektroskopietechniken sind nützlich, wenn es sich bei der zu untersuchenden Probe um ein reines Gemisch oder um eine sehr häufige Mischung handelt. Wenn ein unbekanntes Gemisch analysiert wird, muss es in seine Einzelteile zerlegt werden. Mit Hilfe der Chromatographie lassen sich Gemische in ihre Bestandteile zerlegen, so dass jeder Teil separat analysiert werden kann. ⓘ
Die Dünnschichtchromatographie (TLC) ist eine schnelle Alternative zu komplexeren Chromatographieverfahren. Mit der TLC lassen sich Tinten und Farbstoffe durch Extraktion der einzelnen Bestandteile analysieren. Dies kann zur Untersuchung von am Tatort hinterlassenen Notizen oder Fasern verwendet werden, da die Produkte der einzelnen Unternehmen leicht unterschiedlich sind und diese Unterschiede mit TLC sichtbar gemacht werden können. Der einzige einschränkende Faktor bei der TLC-Analyse ist die Notwendigkeit, dass die Komponenten in der Lösung löslich sein müssen, die für den Transport der Komponenten auf die Analyseplatte verwendet wird. Diese Lösung wird als mobile Phase bezeichnet. Der forensische Chemiker kann unbekannte Komponenten mit bekannten Standards vergleichen, indem er den Weg betrachtet, den jede Komponente zurückgelegt hat. Dieser Abstand wird im Vergleich zum Ausgangspunkt als Retentionsfaktor (Rf) für jede extrahierte Komponente bezeichnet. Wenn jeder Rf-Wert mit einer bekannten Probe übereinstimmt, ist dies ein Hinweis auf die Identität der unbekannten Komponente. ⓘ
Mit Hilfe der Hochleistungsflüssigkeitschromatographie können einzelne Bestandteile aus einem in einer Lösung gelösten Gemisch extrahiert werden. HPLC wird für nicht flüchtige Gemische verwendet, die für die Gaschromatographie nicht geeignet sind. Dies ist bei der Analyse von Arzneimitteln nützlich, bei denen es sich um Kombinationspräparate handelt, da sich die Bestandteile zu unterschiedlichen Zeiten trennen bzw. eluieren, was die Überprüfung der einzelnen Bestandteile ermöglicht. Die Eluate aus der HPLC-Säule werden dann in verschiedene Detektoren geleitet, die einen Peak in einem Diagramm im Verhältnis zu seiner Konzentration beim Eluieren aus der Säule erzeugen. Der gebräuchlichste Detektortyp ist ein ultraviolett-sichtbares Spektrometer, da die am häufigsten mit HPLC untersuchten Arzneimittel eine UV-Absorption aufweisen. ⓘ
Die Gaschromatographie (GC) erfüllt dieselbe Funktion wie die Flüssigchromatographie, wird aber für flüchtige Gemische verwendet. In der forensischen Chemie verwenden die gebräuchlichsten GC-Geräte die Massenspektrometrie als Detektor. GC-MS kann bei Untersuchungen von Brandstiftung, Vergiftungen und Explosionen eingesetzt werden, um genau festzustellen, was verwendet wurde. Theoretisch können GC-MS-Geräte Substanzen nachweisen, deren Konzentrationen im Femtogramm-Bereich (10-15) liegen. In der Praxis jedoch liegt die praktische Nachweisgrenze für GC-MS aufgrund des Signal-Rausch-Verhältnisses und anderer einschränkender Faktoren, wie dem Alter der einzelnen Geräteteile, im Pikogramm-Bereich (10-12). Die GC-MS ist auch in der Lage, die von ihr nachgewiesenen Substanzen zu quantifizieren; Chemiker können diese Informationen nutzen, um die Wirkung der Substanz auf eine Person zu bestimmen. GC-MS-Geräte benötigen etwa 1.000-mal mehr von der Substanz, um die Menge zu quantifizieren, als sie für den bloßen Nachweis benötigen; die Quantifizierungsgrenze liegt typischerweise im Nanogrammbereich (10-9). ⓘ
Chemische Forschung
Im Labor wird Aceton als polares, aprotisches Lösungsmittel bei einer Vielzahl von organischen Reaktionen, wie z. B. SN2-Reaktionen, verwendet. Die Verwendung von Aceton als Lösungsmittel ist für die Jones-Oxidation entscheidend. Es bildet kein Azeotrop mit Wasser (siehe Azeotroptabellen). Aufgrund seiner geringen Kosten und seiner Flüchtigkeit ist es ein gängiges Lösungsmittel zum Spülen von Laborglasgeräten. Obwohl es häufig als vermeintliches Trocknungsmittel verwendet wird, ist es nur durch Massenverdrängung und Verdünnung wirksam. Aceton kann mit Trockeneis auf -78 °C gekühlt werden, ohne zu gefrieren; Aceton/Trockeneis-Bäder werden häufig zur Durchführung von Reaktionen bei niedrigen Temperaturen verwendet. Aceton ist unter ultraviolettem Licht fluoreszierend, und sein Dampf kann als fluoreszierender Tracer in Strömungsexperimenten verwendet werden. ⓘ
Aceton wird zur Ausfällung von Proteinen verwendet. Alternativen für die Proteinausfällung sind Trichloressigsäure oder Ethanol. ⓘ
Reinigung
Geringwertiges Aceton wird in akademischen Laboratorien auch häufig als Spülmittel für Glasgeräte verwendet, um Rückstände und Feststoffe vor der Endreinigung zu entfernen. Aceton hinterlässt beim Trocknen eine geringe Menge an Rückständen auf der Oberfläche, die für Oberflächenproben schädlich sind. ⓘ
Niedertemperaturbad
Eine Mischung aus Aceton und Trockeneis ist ein beliebtes Kühlbad, das eine Temperatur von -78 °C aufrechterhält, solange noch etwas Trockeneis vorhanden ist. ⓘ
Histologie
Aceton wird in der Pathologie verwendet, um Lymphknoten im Fettgewebe für das Tumor-Staging zu finden (z. B. bei der Suche nach Lymphknoten im Fett, das den Darm umgibt). Dies trägt dazu bei, das Fett aufzulösen, und härtet die Knoten aus, so dass sie leichter zu finden sind. ⓘ
Aceton wird auch zum Entfärben von Objektträgern mit bestimmten Färbungen verwendet. ⓘ
Eigenschaften als Lewis-Base
Aceton ist eine schwache Lewis-Base, die Addukte mit weichen Säuren wie I2 und harten Säuren wie Phenol bildet. Aceton bildet auch Komplexe mit zweiwertigen Metallen. ⓘ
Medizinische
Lösungsmittel und Hilfsstoff für Arzneimittel
Aceton wird in der pharmazeutischen Industrie als Lösungsmittel und als Vergällungsmittel in vergälltem Alkohol verwendet. Aceton ist auch als Hilfsstoff in einigen Arzneimitteln enthalten. ⓘ
Entfettung der Haut
Dermatologen verwenden Aceton zusammen mit Alkohol bei Aknebehandlungen, um trockene Haut chemisch zu schälen. Übliche Mittel für das chemische Peeling sind Salicylsäure, Glykolsäure, Azelainsäure, 30%ige Salicylsäure in Ethanol und Trichloressigsäure (TCA). Vor der chemischen Peelingbehandlung wird die Haut gereinigt und überschüssiges Fett in einem so genannten Entfettungsprozess entfernt. Dabei werden in der Regel Aceton, Septisol oder eine Kombination aus diesen Mitteln verwendet. ⓘ
Antikonvulsivum
Aceton hat sich in Tiermodellen der Epilepsie als krampflösend erwiesen, ohne toxisch zu wirken, wenn es in millimolaren Konzentrationen verabreicht wird. Es wurde die Hypothese aufgestellt, dass die fettreiche, kohlenhydratarme ketogene Diät, die klinisch zur Kontrolle der arzneimittelresistenten Epilepsie bei Kindern eingesetzt wird, durch einen Anstieg des Acetons im Gehirn wirkt. Aufgrund ihres höheren Energiebedarfs haben Kinder eine höhere Acetonproduktion als die meisten Erwachsenen - und je jünger das Kind ist, desto höher ist die erwartete Produktion. Dies deutet darauf hin, dass Kinder nicht in besonderem Maße für eine Aceton-Exposition empfänglich sind. Die externe Exposition ist im Vergleich zu der mit der ketogenen Diät verbundenen Exposition gering. ⓘ
Häusliche und andere Nischenverwendungen
Aceton ist häufig der Hauptbestandteil von Reinigungsmitteln wie Nagellack- und Sekundenkleberentfernern. Es greift jedoch auch einige Kunststoffe an. ⓘ
Maskenbildner verwenden Aceton, um Hautkleber aus dem Netz von Perücken und Schnurrbärten zu entfernen, indem sie den Gegenstand in ein Acetonbad tauchen und dann die aufgeweichten Klebstoffreste mit einer steifen Bürste entfernen. ⓘ
Aceton wird häufig für die Dampfpolitur von Druckartefakten auf 3D-gedruckten Modellen aus ABS-Kunststoff verwendet. Bei dieser Technik, die Aceton-Dampfbad-Glättung genannt wird, wird das gedruckte Teil in eine abgedichtete Kammer mit einer kleinen Menge Aceton gelegt und 10 Minuten lang auf etwa 80 Grad Celsius erhitzt. Dadurch entsteht in dem Behälter ein Acetondampf. Das Aceton kondensiert gleichmäßig auf dem gesamten Teil, wodurch die Oberfläche erweicht und verflüssigt wird. Die Oberflächenspannung glättet dann den halbflüssigen Kunststoff. Wenn das Teil aus der Kammer entnommen wird, verdampft die Acetonkomponente und hinterlässt ein glasig-glattes Teil ohne Rillen, Muster und sichtbare Schichtkanten, wie sie bei unbehandelten 3D-Druckteilen häufig vorkommen. ⓘ
Aceton entfernt effizient Filzstiftmarkierungen von Glas und Metallen. ⓘ
Sicherheit
Entflammbarkeit
Die gefährlichste Eigenschaft von Aceton ist seine extreme Entflammbarkeit. In kleinen Mengen brennt Aceton mit einer stumpfen blauen Flamme, in größeren Mengen führt die Verdampfung des Brennstoffs zu einer unvollständigen Verbrennung und einer hellen gelben Flamme. Bei Temperaturen oberhalb des Flammpunkts von Aceton (-20 °C) können Luftgemische mit 2,5 bis 12,8 Volumenprozent Aceton explodieren oder eine Stichflamme verursachen. Dämpfe können entlang von Oberflächen zu entfernten Zündquellen fließen und zurückschlagen. Auch statische Entladungen können Acetondämpfe entzünden, obwohl Aceton einen sehr hohen Energiepunkt für die Zündung hat und daher eine versehentliche Entzündung selten ist. Selbst wenn Aceton über rotglühende Kohle gegossen oder gesprüht wird, entzündet sich diese aufgrund der hohen Dampfkonzentration und der kühlenden Wirkung der Verdampfung der Flüssigkeit nicht. Es entzündet sich selbst bei 465 °C (869 °F). Die Selbstentzündungstemperatur hängt auch von der Einwirkungszeit ab, daher wird sie bei einigen Tests mit 525 °C angegeben. Außerdem enthält industrielles Aceton wahrscheinlich eine geringe Menge Wasser, das die Entzündung ebenfalls hemmt. ⓘ
Acetonperoxyd
Bei der Oxidation von Aceton entsteht als Nebenprodukt Acetonperoxid, eine höchst instabile, primär hochexplosive Verbindung. Es kann versehentlich gebildet werden, z. B. wenn Wasserstoffperoxidabfälle in acetonhaltige Lösungsmittelabfälle geschüttet werden. Aufgrund seiner Instabilität wird es trotz seiner einfachen chemischen Synthese nur selten verwendet. ⓘ
Toxizität
Aceton wurde eingehend untersucht, und es wird angenommen, dass es bei normalem Gebrauch nur eine geringe Toxizität aufweist. Es gibt keine eindeutigen Hinweise auf chronische gesundheitliche Auswirkungen, wenn grundlegende Vorsichtsmaßnahmen befolgt werden. Es ist allgemein anerkannt, dass es eine geringe akute und chronische Toxizität aufweist, wenn es verschluckt und/oder eingeatmet wird. Aceton gilt derzeit weder als krebserregend noch als erbgutverändernde Chemikalie und ist auch nicht wegen chronischer neurotoxischer Wirkungen bedenklich. ⓘ
Aceton ist als Inhaltsstoff in einer Vielzahl von Konsumgütern enthalten, von Kosmetika bis hin zu verarbeiteten und unverarbeiteten Lebensmitteln. Aceton wurde als allgemein als sicher anerkannte Substanz (GRAS) eingestuft, wenn es in Getränken, Backwaren, Desserts und Konserven in Konzentrationen von 5 bis 8 mg/l enthalten ist. ⓘ
Aceton ist jedoch ein Reizstoff, der leichte Hautreizungen und mäßige bis schwere Augenreizungen verursacht. Bei hohen Dampfkonzentrationen kann es, wie viele andere Lösungsmittel, das zentrale Nervensystem beeinträchtigen. Die akute Toxizität für Mäuse bei Verschlucken (LD50) liegt bei 3 g/kg, und bei Einatmen (LC50) bei 44 g/m3 über 4 Stunden. ⓘ
EPA-Einstufung
1995 strich die United States Environmental Protection Agency (EPA) Aceton aus der Liste der "giftigen Chemikalien", die unter Abschnitt 313 des Emergency Planning and Community Right to Know Act (EPCRA) geführt wird. Bei dieser Entscheidung führte die EPA eine umfassende Prüfung der verfügbaren Toxizitätsdaten über Aceton durch und kam zu dem Schluss, dass Aceton "akute Toxizität nur in Konzentrationen aufweist, die die Freisetzungen und die daraus resultierenden Expositionen bei weitem übersteigen", und dass Aceton "in chronischen Studien eine geringe Toxizität aufweist".
- Genotoxizität. Aceton wurde in mehr als zwei Dutzend In-vitro- und In-vivo-Untersuchungen getestet. Diese Studien zeigen, dass Aceton nicht genotoxisch ist.
- Karzinogenität. Die EPA kam 1995 zu dem Schluss, dass es derzeit keine Anhaltspunkte für eine Besorgnis hinsichtlich der Karzinogenität gibt". (EPCRA-Überprüfung, beschrieben in Abschnitt 3.3). NTP-Wissenschaftler haben von chronischen Toxizitäts-/Karzinogenitätstests für Aceton abgeraten, weil "die prächronischen Studien nur eine sehr milde toxische Reaktion bei sehr hohen Dosen bei Nagetieren zeigten".
- Neurotoxizität und entwicklungsbedingte Neurotoxizität. Das neurotoxische Potenzial sowohl von Aceton als auch von Isopropanol, dem metabolischen Vorläufer von Aceton, wurde eingehend untersucht. Diese Studien zeigen, dass Aceton, obwohl die Exposition gegenüber hohen Acetondosen vorübergehende Auswirkungen auf das zentrale Nervensystem haben kann, nicht neurotoxisch ist. Eine Studie zur Entwicklungsneurotoxizität wurde mit Isopropanol durchgeführt, und selbst bei der höchsten getesteten Dosis wurden keine entwicklungsneurotoxischen Wirkungen festgestellt. (SIAR, S. 1, 25, 31).
- Umwelt. Als die EPA 1995 Aceton von der Regulierung als flüchtige organische Verbindung (VOC) befreite, erklärte sie, dass diese Befreiung "zur Erreichung mehrerer wichtiger Umweltziele beitragen und die Bemühungen der EPA zur Vermeidung von Umweltverschmutzung unterstützen würde". 60 Fed. Reg. 31.634 (16. Juni 1995). 60 Fed. Reg. 31,634 (16. Juni 1995). Die EPA wies darauf hin, dass Aceton als Ersatz für mehrere Verbindungen verwendet werden könnte, die in Abschnitt 112 des Clean Air Act als gefährliche Luftschadstoffe (HAP) aufgeführt sind. ⓘ
Auswirkungen auf die Umwelt
Obwohl Aceton in der Umwelt in Pflanzen, Bäumen, vulkanischen Gasen, Waldbränden und als Abbauprodukt von Körperfett vorkommt, ist der größte Teil des in die Umwelt freigesetzten Acetons industriellen Ursprungs. Aceton verdunstet schnell, auch aus Wasser und Boden. In der Atmosphäre hat es eine Halbwertszeit von 22 Tagen und wird durch UV-Licht durch Photolyse abgebaut (hauptsächlich in Methan und Ethan). ⓘ
Die LD50 von Aceton für Fische beträgt 8,3 g/L Wasser (oder etwa 1 %) über 96 Stunden, und seine Halbwertszeit in der Umwelt beträgt etwa 1 bis 10 Tage. Aceton kann in aquatischen Systemen aufgrund des mikrobiellen Verbrauchs ein erhebliches Risiko der Sauerstoffverarmung darstellen. ⓘ
Extraterrestrisches Vorkommen
Am 30. Juli 2015 berichteten Wissenschaftler, dass bei der ersten Landung der Landefähre Philae auf der Oberfläche des Kometen 67P bei Messungen mit den Instrumenten COSAC und Ptolemy sechzehn organische Verbindungen festgestellt wurden, von denen vier zum ersten Mal auf einem Kometen beobachtet wurden, darunter Acetamid, Aceton, Methylisocyanat und Propionaldehyd. ⓘ
Eigenschaften
Chemische Eigenschaften
Aceton besitzt aufgrund der elektronenziehenden Ketogruppe eine relativ starke CH-Acidität an den Methylgruppen. Folglich kann es durch starke Basen (hier als B– dargestellt) deprotoniert werden, wobei ein resonanzstabilisiertes Carbanion gebildet wird:
Es ist eine farblose, niedrigviskose Flüssigkeit mit charakteristischem, leicht süßlichem Geruch, leicht entzündlich und bildet mit Luft ein explosives Gemisch. Der Siedepunkt bei Normaldruck beträgt 56 °C. Es ist in jedem Verhältnis mit Wasser und den meisten organischen Lösungsmitteln mischbar. Das Acetonmolekül zeigt Keto-Enol-Tautomerie. Aceton kann aufgrund seiner polaren Carbonylgruppe mit Kationen auch Komplexverbindungen bilden. ⓘ
Die Verbindung bildet mit einer Reihe anderer Lösungsmittel azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Wasser, Ethanol, 1-Propanol, 2-Propanol, n-Butanol, Benzol, Toluol, Ethylbenzol, Diethylether, Ethylacetat und Acetonitril gebildet. ⓘ
| Azeotrope mit verschiedenen Lösungsmitteln ⓘ | ||||||||||||
| Lösungsmittel | n-Pentan | n-Hexan | n-Heptan | Cyclohexan | Methanol | Chloroform | Tetrachlormethan | Diisopropylether | Methylacetat | |||
| Gehalt Aceton | in Ma% | 21 | 59 | 90 | 67 | 88 | 22 | 89 | 61 | 50 | ||
| Siedepunkt | in °C | 32 | 50 | 56 | 53 | 55 | 64 | 56 | 54 | 55 | ||
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,42448, B = 1312,253 und C = −32,445 im Temperaturbereich von 259,2 bis 507,6 K. ⓘ
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−249,4 kJ·mol−1 −218,5 kJ·mol−1 |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0gas | −1821,4 kJ·mol−1 | |
| Wärmekapazität | cp | 125,45 J·mol−1·K−1 (25 °C) 2,16 J·g−1·K−1 (25 °C) 75,02 J·mol−1·K−1 (25 °C) 1,29 J·g−1·K−1 (25 °C) |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 508,15 K | |
| Kritischer Druck | pc | 47,582 bar | |
| Kritische Dichte | ρc | 4,63 mol·l−1 | |
| Azentrischer Faktor | ωc | 0,30653 | |
| Schmelzenthalpie | ΔfH | 5,72 kJ·mol−1 | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 29,1 kJ·mol−1 | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 46,95 kJ/mol, β = 0,2826 und Tc = 508,2 K im Temperaturbereich zwischen 298 K und 363 K beschreiben. Die spezifische Wärmekapazität kann im Temperaturbereich zwischen 5 °C und 50 °C über eine lineare Funktion mit cp = 1,337 + 2,7752·10−3 ·T (mit cp in kJ·kg−1·K−1 und T in K) abgeschätzt werden. ⓘ
Dampfdruckfunktion von Aceton
Spezifische Wärmekapazität von Aceton ⓘ
Sicherheitstechnische Kenngrößen
Aceton bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −20 °C. Der Explosionsbereich liegt zwischen 2,5 Vol.‑% (60 g/m³) als untere Explosionsgrenze (UEG) und 14,3 Vol.‑% (345 g/m³) als obere Explosionsgrenze (OEG). Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −23 °C sowie einen oberen Explosionspunkt von 8 °C. Die Explosionsgrenzen sind druckabhängig. Eine Verringerung des Drucks führt zu einer Verkleinerung des Explosionsbereiches. Die untere Explosionsgrenze ändert sich bis zu einem Druck von 100 mbar nur wenig und steigt erst bei Drücken kleiner als 100 mbar an. Die obere Explosionsgrenze verringert sich mit sinkendem Druck analog. ⓘ
| Explosionsgrenzen unter reduziertem Druck (gemessen bei 100 °C) ⓘ | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 2,2 | 2,2 | 2,3 | 2,3 | 2,4 | 2,4 | 2,5 | 2,6 | 2,7 | 3,6 | 5,0 |
| in g·m−3 | 53 | 53 | 53 | 55 | 57 | 58 | 59 | 61 | 63 | 86 | 119 | |
| Obere Explosionsgrenze (OEG) | in Vol.‑% | 14,3 | 14,0 | 13,7 | 13,4 | 13,2 | 13,1 | 13,1 | 13,1 | 12,5 | 10,3 | 9,0 |
| in g·m−3 | 345 | 338 | 331 | 324 | 319 | 316 | 316 | 316 | 302 | 249 | 217 | |
| Maximaler Explosionsdruck unter reduziertem Druck ⓘ | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 200 | 100 | ||||
| Maximaler Explosionsdruck (in bar) | bei 20 °C | 9,3 | 7,5 | 5,5 | 3,6 | 2,7 | 1,8 | 0,8 | ||||
| bei 100 °C | 7,4 | 4,5 | ||||||||||
Der maximale Explosionsdruck beträgt 9,7 bar. Mit steigender Temperatur und sinkendem Ausgangsdruck sinkt der maximale Explosionsdruck. Die Grenzspaltweite wurde mit 1,04 mm (50 °C) bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Mit einer Mindestzündenergie von 1,15 mJ sind Dampf-Luft-Gemische extrem zündfähig. Die Zündtemperatur beträgt 535 °C. Der Stoff fällt somit in die Temperaturklasse T1. Unter erhöhtem Druck wird ein starkes Absinken der Zündtemperatur beobachtet. Die elektrische Leitfähigkeit ist mit 4,9·10−7 S·m−1 eher gering. ⓘ
| Zündtemperaturen unter erhöhtem Druck ⓘ | ||||||||||||
| Druck | in bar | 1 | 2 | 4 | 6,8 | 16,5 | ||||||
| Zündtemperatur | in °C | 535 | 345 | 290 | 265 | 250 | ||||||
Reaktionen (Auswahl)
Iodierung von Aceton
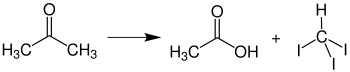
Als besondere Reaktion sei hier die Iodierung von Aceton als klassisches Beispiel für eine Reaktionskinetik pseudo-nullter Ordnung genannt. Da sich nur die Enolform iodieren lässt, Aceton aber nahezu zu 100 % als Keton vorliegt, kann man bei der Reaktion die Konzentration an 2-Propenol als konstant ansehen. Dessen C=C-Doppelbindung reagiert mit Iod unter Abspaltung eines Iodidions zu einem mesomeren Kation, das anschließend ein Proton auf ein Iodidion überträgt. ⓘ
Die Einstellung des Keto-Enol-Gleichgewichts ist säure- (und auch basen-) -katalysiert. Durch den entstehenden Iodwasserstoff wird die Iodierung daher stark beschleunigt (Autokatalyse). ⓘ
Iodoformreaktion
Bei Zugabe von Base läuft hingegen die Iodoformreaktion ab:
Bildung von Dibenzalaceton
Aceton reagiert in Gegenwart von Benzaldehyd in alkalischer Lösung zum Dibenzalaceton. Die Reaktion findet nach dem allgemeinen Mechanismus der Aldol-Kondensation statt. ⓘ
Auch Benzalanilin ist synthetisierbar – dabei reagiert das Anilin mit dem sich in alkalischer Lösung befindenden Aceton unter Wasserabspaltung zur Schiffschen Base (Azomethin). Sowohl Dibenzalaceton als auch Benzalanilin sind wertvolle Substanzen, da sie sehr reaktive Doppelbindungen besitzen, die von Nucleophilen angegriffen werden können. ⓘ
Bildung von Diacetonalkohol
Lässt man je zwei Acetonmoleküle unter dem Einfluss basischer Reagenzien aldolartig dimerisieren, so entsteht Diacetonalkohol:
Bildung von Acetonperoxid
Aceton reagiert mit Wasserstoffperoxid zum detonationsneigenden Acetonperoxid:
Reaktion mit Chloroform
Aceton und Chloroform dürfen nicht in höheren Konzentrationen gemischt werden, weil es in Gegenwart von Spuren von basisch reagierenden Stoffen zu einer sehr heftigen Reaktion kommt, bei der 1,1,1-Trichlor-2-methyl-2-propanol entsteht. Auch aus diesem Grund sollen im Labor chlorierte und nicht chlorierte Lösemittelabfälle getrennt gesammelt werden. ⓘ
Verwendung
Aceton ist in der chemischen Industrie Ausgangsstoff für zahlreiche Synthesen. Hauptsächlich dient es zur Herstellung von Polymethylmethacrylat (PMMA), umgangssprachlich als Acrylglas oder Plexiglas bezeichnet. Dazu wird das Aceton zunächst durch Addition von Blausäure in das Acetoncyanhydrin überführt, das im sauren Milieu leicht Wasser abspaltet (Mesomeriestabilisierung der Doppelbindung aufgrund der Konjugation zur Dreifachbindung der Nitrilgruppe). Das dabei entstehende 2-Methylpropennitril wird durch Zugabe eines Gemisches aus konzentrierter Schwefelsäure und Methanol zu Methylmethacrylat umgesetzt, das in einem weiteren Schritt zum Acrylglas polymerisiert wird. ⓘ
Aceton dient industriell als Vorstufe zur Herstellung von Diacetonalkohol durch Aldoladdition und damit indirekt als Vorstufe für Mesityloxid und Methylisobutylketon. ⓘ

Ferner wird Aceton in Kleinmengen als nützliches Lösungsmittel für Harze, Fette und Öle, Kolophonium, Celluloseacetat sowie als Nagellackentferner und Plastikkleber eingesetzt. Des Weiteren wird es zum Entfernen von durch Bauschaum entstandenen Verunreinigungen zum Beispiel der Reinigung von PU-Schaum-Pistolen eingesetzt. Es löst ein Vielfaches seines Volumens an Ethin (Acetylen). ⓘ
In einigen Ländern wird Aceton in kleinen Anteilen (1:2000 – 1:5000) Benzin oder Diesel zugesetzt, um eine effektivere Verbrennung des Treibstoffs zu erreichen. ⓘ
In der photochemischen Leiterplattenherstellung wird Aceton zur abschließenden Entfettung der Leiterplatte vor dem Löten eingesetzt. ⓘ
Acetonhaltige Lösungen finden in der Zahnmedizin Verwendung zur Reinigung präparierter Dentinflächen und Wurzelkanäle. ⓘ
Toxikologie
Auf der Haut verursacht Aceton Trockenheit, da es die Haut entfettet. Deshalb sollte man betroffene Stellen nach Kontakt einfetten. Inhalation größerer Dosen erzeugt Bronchialreizung, Müdigkeit und Kopfschmerz. Sehr hohe Dosen wirken narkotisch. ⓘ
Hexadeuteroaceton

Deuteriertes Aceton (Summenformel: C3D6O), auch Aceton-d6 genannt, findet in der Kernresonanzspektroskopie (NMR) als Lösungsmittel Verwendung. ⓘ
Die physikalischen Eigenschaften unterscheiden sich geringfügig von der nichtdeuterierten Verbindung:
- Schmelzpunkt: −93,8 °C
- Siedepunkt: 55,5 °C
- Dichte: 0,872 g/ml (25 °C)
- Brechungsindex: 1,355 (20 °C) ⓘ