Ethylenoxid
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
Oxiran | |||
| Systematische IUPAC-Bezeichnung
Epoxyethan Oxacyclopropan | |||
| Andere Bezeichnungen
Ethylenoxid
Dimethylenoxid 1,2-Epoxyethan [3]-Krone-1 Epoxid | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| Abkürzungen | EO, EtO | ||
Beilstein-Referenz
|
102378 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
676 | ||
| KEGG | |||
| MeSH | Ethylen+Oxid | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1040 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C2H4O | ||
| Molare Masse | 44,052 g-mol-1 | ||
| Erscheinungsbild | Farbloses Gas | ||
| Geruch | Wie Diethylether | ||
| Dichte | 0,8821 g-cm-3 | ||
| Schmelzpunkt | -112,46 °C (-170,43 °F; 160,69 K) | ||
| Siedepunkt | 10,4 °C (50,7 °F; 283,5 K) | ||
Löslichkeit in Wasser
|
mischbar | ||
| Dampfdruck | 1,46 atm (20 °C) | ||
Magnetische Suszeptibilität (χ)
|
-30,5-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1,3597 (589 nm) | ||
Dipolmoment
|
1.94 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
47,9 J-mol-1-K-1 | ||
Std. molare
Entropie (S |
242,5 J-mol-1-K-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-52,6 kJ-mol-1 | ||
Gibbssche freie Energie (ΔfG˚)
|
-13,0 kJ-mol-1 | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
Krebserregend Hochentzündlich | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
   
| ||
Gefahrenhinweise
|
H220, H230, H280, H301, H314, H331, H335, H336, H340, H350, H360FD, H372 | ||
Sicherheitshinweise
|
P202, P210, P260, P280, P301+P310+P330, P303+P361+P353, P305+P351+P338+P310, P410+P403 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | -20 °C (-4 °F; 253 K) | ||
Selbstentzündung
temperatur |
429 °C (804 °F; 702 K) | ||
| Explosionsgrenzen | 3 bis 100% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LC50 (mittlere Konzentration)
|
836 ppm (Maus, 4 Std.) 4000 ppm (Ratte, 4 Std.) 800 ppm (Ratte, 4 Std.) 819 ppm (Meerschweinchen, 4 Std.) 1460 ppm (Ratte, 4 Std.) 835 ppm (Maus, 4 Std.) 960 ppm (Hund, 4 Std.) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 1 ppm 5 ppm [15-minütiger Ausflug] | ||
REL (Empfohlen)
|
Ca TWA <0,1 ppm (0,18 mg/m3) C 5 ppm (9 mg/m3) [10-min/Tag] | ||
IDLH (Unmittelbare Gefahr)
|
Ca [800 ppm] | ||
| Sicherheitsdatenblatt (SDS) | ICSC 0155 | ||
| Verwandte Verbindungen | |||
Verwandte Heterocyclen
|
Aziridin, Thiiran, Boriran | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Ethylenoxid ist eine organische Verbindung mit der Formel C
2H
4O. Es ist ein cyclischer Ether und das einfachste Epoxid: ein dreigliedriger Ring, der aus einem Sauerstoffatom und zwei Kohlenstoffatomen besteht. Ethylenoxid ist ein farbloses und brennbares Gas mit einem leicht süßlichen Geruch. Da es sich um einen gespannten Ring handelt, nimmt Ethylenoxid leicht an einer Reihe von Additionsreaktionen teil, die zu einer Ringöffnung führen. Ethylenoxid ist isomer mit Acetaldehyd und mit Vinylalkohol. Ethylenoxid wird industriell durch Oxidation von Ethylen in Gegenwart eines Silberkatalysators hergestellt. ⓘ
Die Reaktivität, die für viele der Gefahren von Ethylenoxid verantwortlich ist, macht es auch nützlich. Obwohl es für den direkten Gebrauch im Haushalt zu gefährlich und den Verbrauchern im Allgemeinen nicht bekannt ist, wird Ethylenoxid für die Herstellung zahlreicher Konsumgüter sowie von Chemikalien und Zwischenprodukten verwendet, die nicht für den Konsum bestimmt sind. Zu diesen Produkten gehören Reinigungsmittel, Verdickungsmittel, Lösungsmittel, Kunststoffe und verschiedene organische Chemikalien wie Ethylenglykol, Ethanolamine, einfache und komplexe Glykole, Polyglykolether und andere Verbindungen. Obwohl Ethylenoxid ein lebenswichtiger Rohstoff mit vielfältigen Anwendungsmöglichkeiten ist, einschließlich der Herstellung von Produkten wie Polysorbat 20 und Polyethylenglykol (PEG), die oft wirksamer und weniger toxisch sind als alternative Materialien, ist Ethylenoxid selbst ein sehr gefährlicher Stoff. Bei Raumtemperatur ist es ein entflammbares, krebserregendes, mutagenes, reizendes und betäubendes Gas. ⓘ
Ethylenoxid ist ein Flächendesinfektionsmittel, das in Krankenhäusern und in der medizinischen Geräteindustrie häufig als Ersatz für Dampf bei der Sterilisation von hitzeempfindlichen Instrumenten und Geräten, wie z. B. Einwegspritzen aus Kunststoff, verwendet wird. Es ist so brennbar und extrem explosiv, dass es als Hauptbestandteil thermobarischer Waffen verwendet wird; daher wird es in der Regel als gekühlte Flüssigkeit gehandhabt und versandt, um seine Gefährlichkeit zu kontrollieren. ⓘ
| Strukturformel ⓘ | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Keile zur Verdeutlichung der Geometrie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ethylenoxid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C2H4O | ||||||||||||
| Kurzbeschreibung |
farbloses Gas mit süßlich-etherischem Geruch | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 44,05 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Dichte |
1,965 kg·m−3 (0 °C, 1013 hPa) | ||||||||||||
| Schmelzpunkt |
−112,55 °C | ||||||||||||
| Siedepunkt |
10,5 °C | ||||||||||||
| Dampfdruck |
| ||||||||||||
| Löslichkeit |
leicht löslich in Wasser | ||||||||||||
| Brechungsindex |
1,3597 (7 °C) | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK |
| ||||||||||||
| Toxikologische Daten |
| ||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−78,0 kJ/mol (l) | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Ethylenoxid (kurz EO) ist ein farbloses, hochentzündliches Gas mit süßlichem Geruch und das einfachste Epoxid. Es ist ein wichtiges Zwischenprodukt bei der Herstellung von Ethylenglycol und anderen Chemikalien. Ethylenoxid wird als Desinfektionsmittel für Nahrungsmittel, organische Dämmstoffe (Wolle, Pflanzenfasern), Textilfasern und medizinische Geräte verwendet. ⓘ
Als mutagenes Klastogen ist Ethylenoxid ein Gift, welches Chromosomenaberrationen hervorrufen kann. Ihm ist die UN-Nummer 1040 zugewiesen. ⓘ
Nach IUPAC-Nomenklatur wird Ethylenoxid als Oxiran bezeichnet, dessen Name sich aus dem Hantzsch-Widman-System ableitet. ⓘ
Geschichte
Ethylenoxid wurde erstmals 1859 von dem französischen Chemiker Charles-Adolphe Wurtz beschrieben, der es durch Behandlung von 2-Chlorethanol mit Kaliumhydroxid herstellte:
- Cl-CH2CH2-OH + KOH → (CH2CH2)O + KCl + H2O ⓘ
Wurtz maß den Siedepunkt von Ethylenoxid mit 13,5 °C (56,3 °F), etwas höher als der heutige Wert, und entdeckte die Fähigkeit von Ethylenoxid, mit Säuren und Metallsalzen zu reagieren. Wurtz nahm fälschlicherweise an, dass Ethylenoxid die Eigenschaften einer organischen Base besitzt. Dieser Irrglaube hielt sich bis 1896, als Georg Bredig feststellte, dass Ethylenoxid kein Elektrolyt ist. Dass es sich von anderen Ethern vor allem durch seine Neigung zu den für ungesättigte Verbindungen typischen Additionsreaktionen unterscheidet, war lange Zeit umstritten. Die heterocyclische Dreiecksstruktur von Ethylenoxid wurde bereits 1868 oder früher vorgeschlagen. ⓘ
Die Synthese von Wurtz aus dem Jahr 1859 blieb lange Zeit die einzige Methode zur Herstellung von Ethylenoxid, trotz zahlreicher Versuche, auch von Wurtz selbst, Ethylenoxid direkt aus Ethylen herzustellen. Erst 1931 entwickelte der französische Chemiker Theodore Lefort ein Verfahren zur direkten Oxidation von Ethylen in Gegenwart eines Silberkatalysators. Seit 1940 stützt sich fast die gesamte industrielle Produktion von Ethylenoxid auf dieses Verfahren. Die Sterilisation durch Ethylenoxid zur Konservierung von Gewürzen wurde 1938 von dem amerikanischen Chemiker Lloyd Hall patentiert. Industrielle Bedeutung erlangte Ethylenoxid während des Ersten Weltkriegs als Vorläufer des Kühlmittels Ethylenglykol und der chemischen Waffe Senfgas. ⓘ
Molekulare Struktur und Eigenschaften

Der Epoxid-Zyklus von Ethylenoxid ist ein fast regelmäßiges Dreieck mit Bindungswinkeln von etwa 60° und einer erheblichen Winkelspannung, die einer Energie von 105 kJ/mol entspricht. Zum Vergleich: In Alkoholen beträgt der C-O-H-Winkel etwa 110°, in Ethern beträgt der C-O-C-Winkel 120°. Die Trägheitsmomente um jede der Hauptachsen sind IA = 32,921×10-40 g-cm2, IB = 37,926×10-40 g-cm2 und IC = 59,510×10-40 g-cm2. ⓘ
Die relative Instabilität der Kohlenstoff-Sauerstoff-Bindungen im Molekül wird durch den Vergleich der Energie deutlich, die erforderlich ist, um zwei C-O-Bindungen im Ethylenoxid oder eine C-O-Bindung in Ethanol und Dimethylether zu brechen:
| Reaktion | ΔH°298, kJ/mol | Verfahren ⓘ |
|---|---|---|
| (C2H4)O → C2H4 + O (Spaltung von zwei Bindungen) | 354.38 | Berechnet, aus Atomenthalpien |
| C2H5OH → C2H5 + OH (Spaltung einer Bindung) | 405.85 | Elektronenstoß |
| CH3OCH3 → CH3O + CH3 (Spaltung einer Bindung) | 334.72 | Berechnet anhand der Enthalpien der Radikalbildung |
Diese Instabilität korreliert mit seiner hohen Reaktivität, was die Leichtigkeit seiner Ringöffnungsreaktionen erklärt (siehe Chemische Eigenschaften). ⓘ
Physikalische Eigenschaften
Ethylenoxid ist bei 25 °C ein farbloses Gas und bei 0 °C eine bewegliche Flüssigkeit - die Viskosität von flüssigem Ethylenoxid bei 0 °C ist etwa 5,5 mal geringer als die von Wasser. Das Gas hat einen charakteristischen süßlichen Geruch nach Ether, der bei einer Konzentration von über 500 ppm in der Luft wahrnehmbar ist. Ethylenoxid ist leicht löslich in Wasser, Ethanol, Diethylether und vielen organischen Lösungsmitteln. ⓘ
Die wichtigsten thermodynamischen Konstanten sind:
- Die Oberflächenspannung von flüssigem Ethylenoxid an der Grenzfläche zu seinem eigenen Dampf beträgt 35,8 mJ/m2 (0,00079 cal/sq ft) bei -50,1 °C (-58,2 °F) und 27,6 mJ/m2 (0,00061 cal/sq ft) bei -0,1 °C (31,8 °F).
- Der Siedepunkt steigt mit dem Dampfdruck wie folgt an: 57,7 °C (135,9 °F) (2 atm (200 kPa; 29 psi)), 83,6 °C (182,5 °F) (5 atm (510 kPa; 73 psi)), und 114,0 °C (237,2 °F) (10 atm (1.000 kPa; 150 psi)).
- Die Viskosität nimmt mit der Temperatur ab, mit Werten von 0,577 kPa-s bei -49,8 °C (-57,6 °F), 0,488 kPa-s bei -38,2 °C (-36,8 °F), 0,394 kPa-s bei -21,0 °C (-5,8 °F) und 0,320 kPa-s bei 0 °C (32 °F). ⓘ
Zwischen -91 und 10,5 °C (-131,8 und 50,9 °F) variiert der Dampfdruck p (in mmHg) mit der Temperatur (T in °C) als
- . ⓘ
| Temperatur, °C | Dampfdruck, kPa | Enthalpie der Flüssigkeit, J/g | Enthalpie der Verdampfung, J/g | Dichte, kg/L | Wärmekapazität, J/(kg-K) | Wärmeleitfähigkeit, W/(m-K) |
|---|---|---|---|---|---|---|
| −40 | 8.35 | 0 | 628.6 | 0.9488 | 1878 | 0.20 |
| −20 | 25.73 | 38.8 | 605.4 | 0.9232 | 1912 | 0.18 |
| 0 | 65.82 | 77.3 | 581.7 | 0.8969 | 1954 | 0.16 |
| 20 | 145.8 | 115.3 | 557.3 | 0.8697 | 2008 | 0.15 |
| 40 | 288.4 | 153.2 | 532.1 | 0.8413 | 2092 | 0.14 |
| 60 | 521.2 | 191.8 | 505.7 | 0.8108 | 2247 | 0.14 |
| 80 | 875.4 | 232.6 | 477.4 | 0.7794 | 2426 | 0.14 |
| 100 | 1385.4 | 277.8 | 445.5 | 0.7443 | 2782 | 0.13 |
| 120 | 2088 | 330.4 | 407.5 | 0.7052 | 3293 | N/A* |
| 140 | 3020 | 393.5 | 359.4 | 0.6609 | 4225 | N/A |
| 160 | 4224 | 469.2 | 297.1 | 0.608 | N/A | N/A |
| 180 | 5741 | 551.2 | 222.5 | 0.533 | N/A | N/A |
| 195.8 | 7191 | N/A | N/A | N/A | N/A | N/A |
*N/A - Daten nicht verfügbar. ⓘ
| Temperatur, K | Entropie, J/(mol-K) | Bildungswärme, kJ/mol | Freie Bildungsenergie, kJ/mol | Viskosität, μPa-s | Wärmeleitfähigkeit, W/(m-K) | Wärmekapazität, J/(mol-K) |
|---|---|---|---|---|---|---|
| 298 | 242.4 | −52.63 | −13.10 | N/A | N/A | 48.28 |
| 300 | 242.8 | −52.72 | −12.84 | 9.0 | 0.012 | 48.53 |
| 400 | 258.7 | −56.53 | 1.05 | 13.5 | 0.025 | 61.71 |
| 500 | 274.0 | −59.62 | 15.82 | 15.4 | 0.038 | 75.44 |
| 600 | 288.8 | −62.13 | 31.13 | 18.2 | 0.056 | 86.27 |
| 700 | 302.8 | −64.10 | 46.86 | 20.9 | 0.075 | 95.31 |
| 800 | 316.0 | −65.61 | 62.80 | N/A | 0.090 | 102.9 |
*N/A - Daten nicht verfügbar. ⓘ
Chemische Eigenschaften
Ethylenoxid reagiert leicht mit verschiedenen Verbindungen unter Öffnung des Rings. Typisch sind Reaktionen mit Nucleophilen, die über den SN2-Mechanismus sowohl in sauren (schwache Nucleophile: Wasser, Alkohole) als auch in alkalischen Medien (starke Nucleophile: OH-, RO-, NH3, RNH2, RR'NH usw.) ablaufen. Das allgemeine Reaktionsschema lautet ⓘ
und spezifischere Reaktionen werden im Folgenden beschrieben. ⓘ
Zugabe von Wasser und Alkoholen
Wässrige Lösungen von Ethylenoxid sind recht stabil und können lange Zeit ohne nennenswerte chemische Reaktion bestehen, aber die Zugabe einer kleinen Menge Säure, z. B. stark verdünnte Schwefelsäure, führt sofort zur Bildung von Ethylenglykol, selbst bei Raumtemperatur:
- (CH2CH2)O + H2O → HO-CH2CH2-OH ⓘ
Die Reaktion findet auch in der Gasphase statt, in Gegenwart eines Phosphorsäuresalzes als Katalysator. ⓘ
Die Reaktion wird in der Regel bei etwa 60 °C (140 °F) mit einem großen Wasserüberschuss durchgeführt, um die Reaktion des gebildeten Ethylenglykols mit Ethylenoxid zu verhindern, die Di- und Triethylenglykol bilden würde:
- 2 (CH2CH2)O + H2O → HO-CH2CH2-O-CH2CH2-OH ⓘ
- 3 (CH2CH2)O + H2O → HO-CH2CH2-O-CH2CH2-O-CH2CH2-OH ⓘ
Die Verwendung von alkalischen Katalysatoren kann zur Bildung von Polyethylenglykol führen:
- n (CH2CH2)O + H2O → HO-(-CH2CH2-O-)n-H ⓘ
Reaktionen mit Alkoholen verlaufen ähnlich und führen zu Ethylenglykolethern:
- (CH2CH2)O + C2H5OH → HO-CH2CH2-OC2H5 ⓘ
- 2 (CH2CH2)O + C2H5OH → HO-CH2CH2-O-CH2CH2-OC2H5 ⓘ
Reaktionen mit niederen Alkoholen verlaufen weniger aktiv als mit Wasser und erfordern strengere Bedingungen, z. B. Erhitzen auf 160 °C (320 °F) und Erhöhen des Drucks auf 3 MPa (440 psi) sowie Hinzufügen eines sauren oder alkalischen Katalysators. ⓘ
Reaktionen von Ethylenoxid mit Fettalkoholen laufen in Gegenwart von Natriummetall, Natriumhydroxid oder Bortrifluorid ab und werden für die Synthese von Tensiden verwendet. ⓘ
Addition von Carbonsäuren und deren Derivaten
Die Reaktion von Ethylenoxid mit Carbonsäuren in Gegenwart eines Katalysators führt zu Glykolmono- und -diestern:
- (CH2CH2)O + CH3CO2H → HOCH2CH2-O2CCH3 ⓘ
- (CH2CH2)O + (CH3CO)2O → CH3CO2CH2CH2O2CCH3 ⓘ
Die Addition von Säureamiden verläuft in ähnlicher Weise:
- (CH2CH2)O + CH3CONH2 → HOCH2CH2NHC(O)CH3 ⓘ
Die Addition von Ethylenoxid an höhere Carbonsäuren erfolgt bei erhöhter Temperatur (typischerweise 140-180 °C) und Druck (0,3-0,5 MPa) in einer inerten Atmosphäre in Gegenwart eines alkalischen Katalysators (Konzentration 0,01-2 %), wie Natrium- oder Kaliumhydroxid oder -carbonat. Das Carboxylat-Ion wirkt bei der Reaktion als Nukleophil:
- (CH2CH2)O + RCO2- → RCO2CH2CH2O- ⓘ
- RCO2CH2CH2O- + RCO2H → RCO2CH2CH2OH + RCO2- ⓘ
Zugabe von Ammoniak und Aminen
Ethylenoxid reagiert mit Ammoniak und bildet eine Mischung aus Mono-, Di- und Tri-Ethanolaminen. Die Reaktion wird durch Zugabe einer kleinen Menge Wasser angeregt. ⓘ
- (CH2CH2)O + NH3 → HO-CH2CH2-NH2 ⓘ
- 2 (CH2CH2)O + NH3 → (HO-CH2CH2)2NH ⓘ
- 3 (CH2CH2)O + NH3 → (HO-CH2CH2)3N ⓘ
Ähnlich verlaufen die Reaktionen mit primären und sekundären Aminen:
- (CH2CH2)O + RNH2 → HO-CH2CH2-NHR ⓘ
Dialkylaminoethanole können weiter mit Ethylenoxid reagieren und Aminopolyethylenglykole bilden:
- n (CH2CH2)O + R2NCH2CH2OH → R2NCH2CH2O-(-CH2CH2O-)n-H ⓘ
Trimethylamin reagiert mit Ethylenoxid in Gegenwart von Wasser und bildet Cholin:
- (CH2CH2)O + (CH3)3N + H2O → [HOCH2CH2N (CH3)3]+OH- ⓘ
Auch aromatische primäre und sekundäre Amine reagieren mit Ethylenoxid und bilden die entsprechenden Arylaminoalkohole. ⓘ
Halogenid-Addition
Ethylenoxid reagiert leicht mit wässrigen Lösungen von Salzsäure, Bromwasserstoffsäure und Iodwasserstoffsäure unter Bildung von Halohydrinen. Mit den beiden letztgenannten Säuren verläuft die Reaktion leichter:
- (CH2CH2)O + HCl → HO-CH2CH2-Cl ⓘ
Die Reaktion mit diesen Säuren konkurriert mit der säurekatalysierten Hydratation von Ethylenoxid; daher entsteht immer ein Nebenprodukt aus Ethylenglykol mit einer Beimischung von Diethylenglykol. Um ein saubereres Produkt zu erhalten, wird die Reaktion in der Gasphase oder in einem organischen Lösungsmittel durchgeführt. ⓘ
Ethylenfluorhydrin wird auf andere Weise gewonnen: durch Kochen von Fluorwasserstoff mit einer 5-6%igen Lösung von Ethylenoxid in Diethylether. Der Ether hat normalerweise einen Wassergehalt von 1,5-2 %; in Abwesenheit von Wasser polymerisiert das Ethylenoxid. ⓘ
Halohydrine können auch gewonnen werden, indem Ethylenoxid durch wässrige Lösungen von Metallhalogeniden geleitet wird:
- 2 (CH2CH2)O + CuCl2 + 2 H2O → 2 HO-CH2CH2-Cl + Cu(OH)2↓ ⓘ
Metallorganische Addition
Die Wechselwirkung von Ethylenoxid mit magnesiumorganischen Verbindungen, bei denen es sich um Grignard-Reagenzien handelt, kann als nukleophile Substitution unter dem Einfluss von carbanionischen metallorganischen Verbindungen betrachtet werden. Das Endprodukt der Reaktion ist ein primärer Alkohol:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + RMgBr -> R-CH2CH2-OMgBr ->[\ce{H2O}] \overset{primärer~Alkohol}{R-CH2CH2-OH} <span title="Aus: Englische Wikipedia, Abschnitt "Metalorganic addition"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Metalorganic_addition <span style="color:#dddddd">ⓘ</span>]</span>}}
Ein ähnlicher Mechanismus gilt auch für andere metallorganische Verbindungen, wie z. B. Alkyllithium:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + \overset{alkyl~lithium}{RLi} -> R-CH2CH2-OLi ->[\ce{H2O}] R-CH2CH2-OH <span title="Aus: Englische Wikipedia, Abschnitt "Metalorganic addition"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Metalorganic_addition <span style="color:#dddddd">ⓘ</span>]</span>}}
Andere Additionsreaktionen
Addition von Cyanwasserstoff
Ethylenoxid reagiert leicht mit Cyanwasserstoff unter Bildung von Ethylencyanhydrin:
- (CH2CH2)O + HCN → HO-CH2CH2-CN ⓘ
Anstelle von HCN kann auch eine leicht gekühlte (10-20 °C) wässrige Lösung von Calciumcyanid verwendet werden:
- 2 (CH2CH2)O + Ca(CN)2 + 2 H2O → 2 HO-CH2CH2-CN + Ca(OH)2 ⓘ
Ethylencyanohydrin verliert leicht Wasser, wobei Acrylnitril entsteht:
- HO-CH2CH2-CN → CH2=CH-CN + H2O ⓘ
Zugabe von Schwefelwasserstoff und Mercaptanen
Bei der Reaktion mit Schwefelwasserstoff bildet Ethylenoxid 2-Mercaptoethanol und Thiodiglykol, und mit Alkylmercaptanen entsteht 2-Alkylmercaptoetanol:
- (CH2CH2)O + H2S → HO-CH2CH2-HS ⓘ
- 2 (CH2CH2)O + H2S → (HO-CH2CH2)2S ⓘ
- (CH2CH2)O + RHS → HO-CH2CH2-SR ⓘ
Der Überschuss an Ethylenoxid mit einer wässrigen Lösung von Schwefelwasserstoff führt zum Tris-(hydroxyethyl)sulfonylhydroxid:
- 3 (CH2CH2)O + H2S → [(HO-CH2CH2)3S+]OH- ⓘ
Addition von salpetriger Säure und Salpetersäure
Die Reaktion von Ethylenoxid mit wässrigen Lösungen von Bariumnitrit, Calciumnitrit, Magnesiumnitrit, Zinknitrit oder Natriumnitrit führt zur Bildung von 2-Nitroethanol:
- 2 (CH2CH2)O + Ca(NO2)2 + 2 H2O → 2 HO-CH2CH2-NO2 + Ca(OH)2 ⓘ
Mit Salpetersäure bildet Ethylenoxid Mono- und Dinitroglykole:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + \overset{Stickstoffsäure}{HNO3} -> HO-CH2CH2-ONO2 ->[\ce{+HNO3}] [\ce{-H2O}] O2NO-CH2CH2-ONO_2 <span title="Aus: Englische Wikipedia, Abschnitt "Addition of nitrous and nitric acids"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Addition_of_nitrous_and_nitric_acids <span style="color:#dddddd">ⓘ</span>]</span>}}
Reaktion mit Verbindungen, die aktive Methylengruppen enthalten
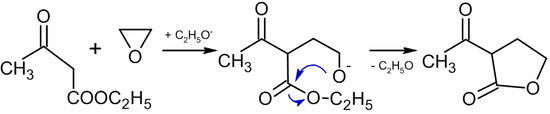
In Gegenwart von Alkoxiden führt die Reaktion von Ethylenoxid mit Verbindungen, die aktive Methylengruppen enthalten, zur Bildung von Butyrolactonen:
Alkylierung von aromatischen Verbindungen
Ethylenoxid geht mit Benzol die Friedel-Crafts-Reaktion ein, bei der Phenethylalkohol entsteht:
Styrol kann in einem Schritt gewonnen werden, wenn diese Reaktion bei erhöhten Temperaturen (315-440 °C) und Drücken (0,35-0,7 MPa) in Gegenwart eines Aluminosilikatkatalysators durchgeführt wird. ⓘ
Synthese von Kronenethern
Eine Reihe von polynomialen heterocyclischen Verbindungen, die als Kronenether bezeichnet werden, können mit Ethylenoxid synthetisiert werden. Eine Methode ist die kationische Zyklopolymerisation von Ethylenoxid, wobei die Größe des gebildeten Zyklus begrenzt wird:
- n (CH2CH2)O → (-CH2CH2-O-)n ⓘ
Um die Bildung anderer linearer Polymere zu unterdrücken, wird die Reaktion in einer stark verdünnten Lösung durchgeführt. ⓘ
Die Reaktion von Ethylenoxid mit Schwefeldioxid in Gegenwart von Cäsiumsalzen führt zur Bildung einer 11-gliedrigen heterocyclischen Verbindung, die die komplexbildenden Eigenschaften von Kronenethern aufweist:
Isomerisierung
Beim Erhitzen auf etwa 400 °C (750 °F) oder auf 150-300 °C (300-570 °F) in Gegenwart eines Katalysators (Al2O3, H3PO4 usw.) isomerisiert Ethylenoxid zu Acetaldehyd:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O ->[\ce{200^\circ C}] [\ce{Al2O3}] \overset{Acetaldehyd}{CH3CHO} <span title="Aus: Englische Wikipedia, Abschnitt "Isomerization"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Isomerization <span style="color:#dddddd">ⓘ</span>]</span>}}
Zur Erklärung dieser Reaktion in der Gasphase wurde der radikalische Mechanismus vorgeschlagen, der die folgenden Schritte umfasst:
-
(CH2CH2)O ↔ -CH2CH2O- → CH3CHO*
(1) ⓘ
-
CH3CHO* → CH3- + CHO-
(2) ⓘ
-
CH3CHO* + M → CH3CHO + M*
(3) ⓘ
In Reaktion (3) bezieht sich M auf die Wand des Reaktionsgefäßes oder auf einen heterogenen Katalysator. Die Einheit CH3CHO* stellt ein kurzlebiges (Lebensdauer 10-8,5 Sekunden), aktiviertes Acetaldehydmolekül dar. Seine Überschussenergie beträgt etwa 355,6 kJ/mol, was die Bindungsenergie der C-C-Bindung in Acetaldehyd um 29,3 kJ/mol übersteigt. ⓘ
In Abwesenheit eines Katalysators ist die thermische Isomerisierung von Ethylenoxid niemals selektiv und führt neben Acetaldehyd zu erheblichen Mengen an Nebenprodukten (siehe Abschnitt Thermische Zersetzung). ⓘ
Reduktionsreaktion
Ethylenoxid kann in Gegenwart eines Katalysators wie Nickel, Platin, Palladium, Borane, Lithiumaluminiumhydrid und einiger anderer Hydride zu Ethanol hydriert werden. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + H2 -> [{}\atop\ce{Ni, Pt, Pd, BH3, LiAlH4}\text{ oder andere Hydride}] [\ce{80^\circ C}] \underset{ethanol}{C2H5OH} <span title="Aus: Englische Wikipedia, Abschnitt "Reduction reaction"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Reduction_reaction <span style="color:#dddddd">ⓘ</span>]</span>}}
Umgekehrt kann Ethylenoxid mit einigen anderen Katalysatoren durch Wasserstoff zu Ethylen mit einer Ausbeute von bis zu 70 % reduziert werden. Zu den Reduktionskatalysatoren gehören Gemische aus Zinkstaub und Essigsäure, aus Lithiumaluminiumhydrid mit Titantrichlorid (das Reduktionsmittel ist eigentlich Titandichlorid, das durch die Reaktion zwischen LiAlH4 und TiCl3 entsteht) und aus Eisen(III)-chlorid mit Butyllithium in Tetrahydrofuran. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + H2 ->[{}\atop\ce{{Zn} + CH3COOH}] \underset{ethylen}{CH2=CH2} + H2O <span title="Aus: Englische Wikipedia, Abschnitt "Reduction reaction"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Reduction_reaction <span style="color:#dddddd">ⓘ</span>]</span>}}
Oxidation
Ethylenoxid kann je nach den Bedingungen zu Glykolsäure oder Kohlendioxid weiter oxidiert werden:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + O2 ->[\ce{AgNO3}] \overset{Glykolsäure}{HOCH2CO2H} <span title="Aus: Englische Wikipedia, Abschnitt "Oxidation"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Oxidation <span style="color:#dddddd">ⓘ</span>]</span>}}
Die tiefe Oxidation von Ethylenoxid in einem Gasphasenreaktor bei 800-1.000 K (527-727 °C; 980-1.340 °F) und einem Druck von 0,1-1 MPa (15-145 psi) ergibt ein komplexes Gemisch von Produkten, das O2, H2, CO, CO2, CH4, C2H2, C2H4, C2H6, C3H6, C3H8 und CH3CHO enthält. ⓘ
Dimerisierung
In Anwesenheit von sauren Katalysatoren dimerisiert Ethylenoxid zu Dioxan:
Der Reaktionsmechanismus ist wie folgt:
Die Dimerisierungsreaktion ist unselektiv. Als Nebenprodukt entsteht Acetaldehyd (aufgrund der Isomerisierung). Die Selektivität und Geschwindigkeit der Dimerisierung kann durch Zugabe eines Katalysators, wie Platin, Platin-Palladium oder Jod mit Sulfolan, erhöht werden. Im letzteren Fall entsteht als Nebenprodukt 2-Methyl-1,3-dioxolan. ⓘ
Polymerisation
Flüssiges Ethylenoxid kann Polyethylenglykole bilden. Die Polymerisation kann über radikalische und ionische Mechanismen ablaufen, aber nur der letztere hat eine breite praktische Anwendung. Die kationische Polymerisation von Ethylenoxid wird durch protische Säuren (HClO4, HCl), Lewis-Säuren (SnCl4, BF3 usw.), metallorganische Verbindungen oder komplexere Reagenzien unterstützt:
Der Reaktionsmechanismus sieht wie folgt aus. In der ersten Stufe wird der Katalysator (MXm) durch Alkyl- oder Acylhalogen oder durch Verbindungen mit aktiven Wasserstoffatomen, in der Regel Wasser, Alkohol oder Glykol, initiiert:
- MXm + ROH → MXmRO-H+ ⓘ
Der resultierende aktive Komplex reagiert mit Ethylenoxid über den SN2-Mechanismus:
- (CH2CH2)O + MXmRO-H+ → (CH2CH2)O---H+O-RMXm ⓘ
- (CH2CH2)O---H+ O-RMXm → HO-CH2CH2+ + MXmRO-2 ⓘ
- HO-CH2CH2+ + n (CH2CH2)O → HO-CH2CH2-(O-CH2CH2)n+ ⓘ
Die Kette bricht als ⓘ
- HO-CH2CH2-(O-CH2CH2)n+ + MXmRO- → HO-CH2CH2-(O-CH2CH2)n-OR + MXm ⓘ
- H(O-CH2CH2)n-O-CH2-CH2+ + MXmRO- → H(O-CH2CH2)n-O-CH=CH2 + MXm + ROH ⓘ
Die anionische Polymerisation von Ethylenoxid wird durch Basen, wie Alkoxide, Hydroxide, Carbonate oder andere Verbindungen von Alkali- oder Erdalkalimetallen, unterstützt. Der Reaktionsmechanismus sieht wie folgt aus:
- (CH2CH2)O + RONa → RO-CH2CH2-O-Na+ ⓘ
- RO-CH2CH2-O-Na+ + n (CH2CH2)O → RO-(CH2CH2-O)n-CH2CH2-O-Na+ ⓘ
- RO-(CH2CH2-O)n-CH2CH2-O-Na+ → RO-(CH2CH2-O)n-CH=CH2 + NaOH ⓘ
- RO-(CH2CH2-O)n-CH2CH2-O-Na+ + H2O → RO-(CH2CH2-O)(n+1)OH + NaOH ⓘ
Thermische Zersetzung
Ethylenoxid ist beim Erhitzen relativ stabil - in Abwesenheit eines Katalysators dissoziiert es bis zu 300 °C nicht, und erst oberhalb von 570 °C kommt es zu einer größeren exothermen Zersetzung, die nach dem Radikalmechanismus abläuft. In der ersten Stufe findet eine Isomerisierung statt, aber hohe Temperaturen beschleunigen die radikalischen Prozesse. Sie führen zu einem Gasgemisch, das Acetaldehyd, Ethan, Ethyl, Methan, Wasserstoff, Kohlendioxid, Keten und Formaldehyd enthält. Die Hochtemperaturpyrolyse (830-1.200 K (557-927 °C; 1.034-1.700 °F)) bei erhöhtem Druck in einer inerten Atmosphäre führt zu einer komplexeren Zusammensetzung des Gasgemisches, das auch Acetylen und Propan enthält. Im Gegensatz zur Isomerisierung läuft die Kettenbildung hauptsächlich wie folgt ab:
- (CH2CH2)O → -CH2CH2O- → CH2O + CH2:
Wenn man die thermische Zersetzung von Ethylenoxid in Gegenwart von Übergangsmetallverbindungen als Katalysatoren durchführt, kann man nicht nur die Temperatur senken, sondern auch Ethyl als Hauptprodukt erhalten, d. h. die Ethylenoxid-Synthesereaktion umkehren. ⓘ
Andere Reaktionen
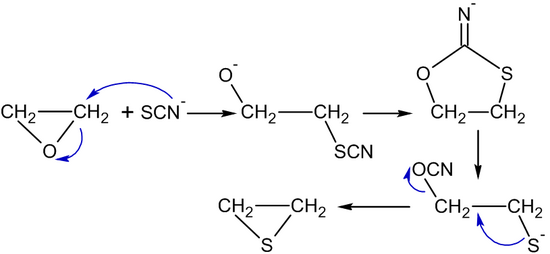
Thiocyanat-Ionen oder Thioharnstoff verwandeln Ethylenoxid in Thiiran (Ethylensulfid):
- (CH2CH2)O + (NH2)2C=S → (CH2CH2)S + (NH2)2C=O ⓘ
Bei der Reaktion von Phosphorpentachlorid mit Ethylenoxid entsteht Ethylendichlorid:
- (CH2CH2)O + PCl5 → Cl-CH2CH2-Cl + POCl3 ⓘ
Andere Dichlorderivate von Ethylenoxid können durch die kombinierte Wirkung von Sulfurylchlorid (SOCl2) und Pyridin sowie von Triphenylphosphin und Tetrachlorkohlenstoff erhalten werden. ⓘ
Phosphortrichlorid reagiert mit Ethylenoxid und bildet Chlorethylester der phosphorigen Säure:
- (CH2CH2)O + PCl3 → Cl-CH2CH2-OPCl2 ⓘ
- 2 (CH2CH2)O + PCl3 → (Cl-CH2CH2-O)2PCl ⓘ
- 3 (CH2CH2)O + PCl3 → Cl-CH2CH2-O)3P ⓘ
Das Reaktionsprodukt von Ethylenoxid mit Acylchloriden in Gegenwart von Natriumiodid ist ein komplexer Iodoethylester:
- (CH2CH2)O + RCOCl + NaI → RC(O)-OCH2CH2-I + NaCl ⓘ
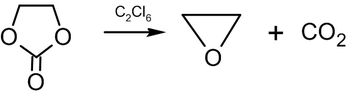
Durch Erhitzen von Ethylenoxid auf 100 °C mit Kohlendioxid in einem unpolaren Lösungsmittel in Gegenwart von Bis-(Triphenylphosphin)-Nickel(0) entsteht Ethylencarbonat:
In der Industrie wird eine ähnliche Reaktion bei hohem Druck und hoher Temperatur in Anwesenheit von quaternären Ammonium- oder Phosphoniumsalzen als Katalysator durchgeführt. ⓘ
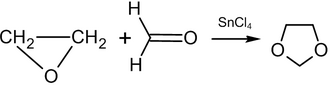
Die Reaktion von Ethylenoxid mit Formaldehyd bei 80-150 °C in Anwesenheit eines Katalysators führt zur Bildung von 1,3-Dioxolan:
Die Substitution von Formaldehyd durch andere Aldehyde oder Ketone führt zu einem 2-substituierten 1,3-Dioxolan (Ausbeute: 70-85 %, Katalysator: Tetraethylammoniumbromid). ⓘ
Durch katalytische Hydroformylierung von Ethylenoxid erhält man Hydroxypropanal, das zu Propan-1,3-diol hydriert werden kann:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O + CO + H2 -> CHO-CH2CH2-OH ->[\ce{+H2}] HO-CH2CH2CH2-OH <span title="Aus: Englische Wikipedia, Abschnitt "Other reactions"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Other_reactions <span style="color:#dddddd">ⓘ</span>]</span>}}
Synthese im Labor
Dehydrochlorierung von Ethylen und seinen Derivaten
Die Dehydrochlorierung von 2-Chlorethanol, die von Wurtz 1859 entwickelt wurde, ist nach wie vor ein gängiger Laborweg zu Ethylenoxid:
- Cl-CH2CH2-OH + NaOH → (CH2CH2)O + NaCl + H2O ⓘ
Die Reaktion wird bei erhöhter Temperatur durchgeführt, und neben Natrium- oder Kaliumhydroxid können auch Calciumhydroxid, Bariumhydroxid, Magnesiumhydroxid oder Carbonate von Alkali- oder Erdalkalimetallen verwendet werden. ⓘ
Mit hoher Ausbeute (90 %) lässt sich Ethylenoxid durch Behandlung von Calciumoxid mit Ethylhypochlorit herstellen; wird Calcium durch andere Erdalkalimetalle ersetzt, verringert sich die Reaktionsausbeute:
- 2 CH3CH2-OCl + CaO → 2 (CH2CH2)O + CaCl2 + H2O ⓘ
Direkte Oxidation von Ethylen durch Peroxysäuren
Ethylen kann mit Peroxysäuren, z. B. Peroxybenzoesäure oder meta-Chlor-peroxybenzoesäure, direkt zu Ethylenoxid oxidiert werden:
Die Oxidation durch Peroxysäuren ist bei höheren Alkenen effizient, nicht aber bei Ethylen. Die obige Reaktion ist langsam und hat eine geringe Ausbeute, weshalb sie in der Industrie nicht verwendet wird. ⓘ
Andere präparative Methoden
Andere Synthesemethoden sind die Reaktion von Diiodethan mit Silberoxid:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{I-CH2CH2-I + Ag2O -> (CH2CH2)O + 2AgI <span title="Aus: Englische Wikipedia, Abschnitt "Other preparative methods"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Other_preparative_methods <span style="color:#dddddd">ⓘ</span>]</span>}}
und die Zersetzung von Ethylencarbonat bei 200-210 °C (392-410 °F) in Gegenwart von Hexachlorethan:
Industrielle Synthese
Geschichte
Die kommerzielle Herstellung von Ethylenoxid geht auf das Jahr 1914 zurück, als die BASF die erste Fabrik baute, die das Chlorhydrinverfahren (Reaktion von Ethylenchlorhydrin mit Calciumhydroxid) anwandte. Das Chlorhydrin-Verfahren war aus mehreren Gründen unattraktiv, u. a. wegen der geringen Effizienz und des Verlusts von wertvollem Chlor in Calciumchlorid. Die effizientere direkte Oxidation von Ethylen durch Luft wurde 1931 von Lefort erfunden, und 1937 eröffnete Union Carbide die erste Anlage, die dieses Verfahren verwendete. Das Verfahren wurde 1958 von Shell Oil Co. weiter verbessert, indem Luft durch Sauerstoff ersetzt und eine höhere Temperatur von 200-300 °C (390-570 °F) und ein höherer Druck (1-3 MPa (150-440 psi)) verwendet wurden. Dieses effizientere Verfahren machte in den 1950er Jahren etwa die Hälfte der Ethylenoxid-Produktion in den USA aus und ersetzte nach 1975 die früheren Methoden vollständig. Die Produktion von Ethylenoxid macht etwa 11 % des weltweiten Ethylenbedarfs aus. ⓘ
Chlorhydrin-Verfahren zur Herstellung von Ethylenoxid
Obwohl das Chlorhydrin-Verfahren in der Industrie fast vollständig durch die direkte Oxidation von Ethylen verdrängt wurde, ist die Kenntnis dieses Verfahrens aus pädagogischen Gründen und wegen der Tatsache, dass es immer noch bei der Herstellung von Propylenoxid eingesetzt wird, nach wie vor wichtig. Das Verfahren besteht aus drei Hauptschritten: Synthese von Ethylenchlorhydrin, Dehydrochlorierung von Ethylenchlorhydrin zu Ethylenoxid und Reinigung von Ethylenoxid. Diese Schritte werden kontinuierlich durchgeführt. In der ersten Säule wird die Hypochlorierung von Ethylen wie folgt durchgeführt:
- Cl2 + H2O → HOCl + HCl ⓘ
- CH2=CH2 + HOCl → HO-CH2CH2-Cl ⓘ
- CH2=CH2 + Cl2 → Cl-CH2CH2-Cl ⓘ
Um die Umwandlung von Ethylen in Ethylendichlorid (die letzte Reaktion) zu unterdrücken, wird die Ethylenkonzentration bei etwa 4-6 % gehalten und die Lösung mit Dampf bis zum Siedepunkt erhitzt. ⓘ
Anschließend gelangt die wässrige Lösung des Ethylenchlorhydrins in die zweite Kolonne, wo sie mit einer 30 %igen Lösung von Calciumhydroxid bei 100 °C (212 °F) reagiert:
- 2 OH-CH2CH2-Cl + Ca(OH)2 → 2 (CH2CH2)O + CaCl2 + 2H2O ⓘ
Das hergestellte Ethylenoxid wird durch Rektifikation gereinigt. Mit dem Chlorhydrinverfahren kann eine 95%ige Umwandlung von Ethylenchlorhydrin erreicht werden. Die Ausbeute an Ethylenoxid beträgt etwa 80 % des theoretischen Wertes; für 1 Tonne (0,98 long tons; 1,1 short tons) Ethylenoxid werden etwa 200 kg Ethylendichlorid hergestellt. Der größte Nachteil dieses Verfahrens ist jedoch der hohe Chlorverbrauch und die Abwasserbelastung. Dieses Verfahren ist inzwischen überholt. ⓘ
Direkte Oxidation von Ethylen
Verwendung in der Industrie weltweit
Die direkte Oxidation von Ethylen wurde 1931 von Lefort patentiert. Diese Methode wurde wiederholt für die industrielle Nutzung modifiziert, und es sind mindestens vier Hauptvarianten bekannt. Sie alle nutzen die Oxidation durch Sauerstoff oder Luft und einen Katalysator auf Silberbasis, unterscheiden sich aber in den technischen Details und der Hardware. ⓘ
Union Carbide (heute eine Abteilung der Dow Chemical Company) war das erste Unternehmen, das das direkte Oxidationsverfahren entwickelte. ⓘ
Ein ähnliches Produktionsverfahren wurde von Scientific Design Co. entwickelt, fand aber aufgrund des Lizenzsystems breitere Anwendung - es macht 25 % der Weltproduktion und 75 % der lizenzierten Weltproduktion von Ethylenoxid aus. Eine geschützte Variante dieses Verfahrens wird von der Japan Catalytic Chemical Co. verwendet, die die Synthese von Ethylenoxid und Ethylenglykol in einem einzigen Industriekomplex angepasst hat. ⓘ
Eine andere Modifikation wurde von Shell International Chemicals BV entwickelt. Ihre Methode ist recht flexibel im Hinblick auf die spezifischen Anforderungen bestimmter Industrien; sie zeichnet sich durch eine hohe Selektivität in Bezug auf das Produkt Ethylenoxid und eine lange Lebensdauer des Katalysators (3 Jahre) aus. Auf sie entfallen etwa 40 % der weltweiten Produktion. ⓘ
Ältere Fabriken verwenden in der Regel Luft für die Oxidation, während neuere Anlagen und Verfahren, wie METEOR und Japan Catalytic, Sauerstoff bevorzugen. ⓘ
Chemie und Kinetik des direkten Oxidationsprozesses
Formal wird der direkte Oxidationsprozess durch die folgende Gleichung beschrieben:
- ΔH = -105 kJ/mol ⓘ
In der Praxis wird jedoch eine beträchtliche Ausbeute an Kohlendioxid und Wasser beobachtet, was durch die vollständige Oxidation von Ethylen oder Ethylenoxid erklärt werden kann:
- CH2=CH2 + 3 O2 → 2 CO2 + 2 H2O, ΔH = -1327 kJ/mol
- (CH2CH2)O + 2,5 O2 → 2 CO2 + 2 H2O, ΔH = -1223 kJ/mol ⓘ
Nach einer kinetischen Analyse von Kilty und Sachtler beschreiben die folgenden Reaktionen den Weg, der zu EO führt. Im ersten Schritt wird eine Superoxid-(O2-)Spezies gebildet:
- O2 + Ag → Ag+O2-
Diese Spezies reagiert mit Ethylen
- Ag+O2- + H2C=CH2 → (CH2CH2)O + AgO
Das entstehende Silberoxid oxidiert dann Ethylen oder Ethylenoxid zu CO2 und Wasser. Durch diese Reaktion wird der Silberkatalysator wieder aufgefüllt. Die Gesamtreaktion wird also wie folgt ausgedrückt ⓘ
- 7 CH2=CH2 + 6 O2 → 6 (CH2CH2)O + 2 CO2 + 2 H2O ⓘ
und der maximale Grad der Umwandlung von Ethylen in Ethylenoxid wird theoretisch auf 6/7 oder 85,7 % vorhergesagt, obwohl in der Praxis höhere Ausbeuten erzielt werden. ⓘ
Der Katalysator für die Reaktion ist metallisches Silber, das auf verschiedenen Matrizen abgeschieden ist, darunter Bimsstein, Kieselgel, verschiedene Silikate und Aluminosilikate, Aluminiumoxid und Siliziumkarbid, und durch bestimmte Zusätze (Antimon, Wismut, Bariumperoxid usw.) aktiviert wird. Die Prozesstemperatur wurde auf 220-280 °C (430-540 °F) optimiert. Niedrigere Temperaturen verringern die Aktivität des Katalysators, und höhere Temperaturen fördern die vollständige Oxidation des Ethylens, wodurch die Ausbeute an Ethylenoxid verringert wird. Ein erhöhter Druck von 1-3 MPa (150-440 psi) steigert die Produktivität des Katalysators und erleichtert die Aufnahme von Ethylenoxid aus den Reaktionsgasen. ⓘ
Während die Oxidation mit Luft immer noch verwendet wird, wird Sauerstoff (> 95 % Reinheit) aus mehreren Gründen bevorzugt, z. B. wegen der höheren molaren Ausbeute an Ethylenoxid (75-82 % bei Sauerstoff im Vergleich zu 63-75 % bei Luft), der höheren Reaktionsgeschwindigkeit (keine Gasverdünnung) und der fehlenden Notwendigkeit, Stickstoff in den Reaktionsprodukten abzutrennen. ⓘ
Überblick über den Prozess
Die Herstellung von Ethylenoxid im kommerziellen Maßstab wird durch die Vereinigung der folgenden Prozesseinheiten erreicht:
- Hauptreaktor
- Ethylenoxid-Wäscher
- Ethylenoxid-Ent-Sorber
- Stripper und Destillationskolonne
- CO2-Wäscher und CO2-Entwäscher ⓘ
Hauptreaktor: Der Hauptreaktor besteht aus Tausenden von Katalysatorrohren in Bündeln. Diese Rohre sind in der Regel 6 bis 15 m (20 bis 50 ft) lang und haben einen Innendurchmesser von 20 bis 50 mm (0,8 bis 2,0 in). Der in diesen Rohren verpackte Katalysator hat die Form von Kugeln oder Ringen mit einem Durchmesser von 3 bis 10 mm (0,12 bis 0,39 in). Im Reaktor herrschen Betriebsbedingungen von 200-300 °C (390-570 °F) mit einem Druck von 1-3 MPa (150-440 psi). Um diese Temperatur zu halten, spielt das Kühlsystem des Reaktors eine entscheidende Rolle. Mit zunehmender Alterung des Katalysators nimmt seine Selektivität ab und es entstehen mehr exotherme CO2-Nebenprodukte. ⓘ
Ethylenoxid-Wäscher: Nachdem der Gasstrom aus dem Hauptreaktor, der Ethylenoxid (1-2 %) und CO2 (5 %) enthält, abgekühlt ist, wird er in den Ethylenoxid-Wäscher geleitet. Hier wird Wasser als Waschmedium verwendet, das den größten Teil des Ethylenoxids zusammen mit einigen Mengen an CO2, N2, CH2=CH2, CH4 und Aldehyden (die durch den Rücklaufstrom eingebracht werden) abwäscht. Außerdem wird ein kleiner Teil des Gases, das den Ethylenoxid-Wäscher verlässt (0,1-0,2 %), kontinuierlich entfernt (verbrannt), um den Aufbau inerter Verbindungen (N2, Ar und C2H6) zu verhindern, die als Verunreinigungen mit den Reaktanten eingeführt werden. ⓘ
Ethylenoxid-Desorber: Der wässrige Strom, der aus dem oben beschriebenen Waschverfahren resultiert, wird anschließend in den Ethylenoxid-Desorber geleitet. Hier wird Ethylenoxid als Kopfprodukt gewonnen, während das erhaltene Bodenprodukt als Glykolabzug bezeichnet wird. Wenn Ethylenoxid mit einer wässrigen Lösung aus dem Kreislaufgas gewaschen wird, entstehen unvermeidlich Ethylenglykole (nämlich Monoethylenglykol, Diethylenglykol und andere Polyethylenglykole). Um zu verhindern, dass sie sich im System ansammeln, werden sie daher kontinuierlich abgeleitet. ⓘ
Stripp- und Destillationskolonne: Hier wird der Ethylenoxidstrom von seinen niedrig siedenden Bestandteilen befreit und anschließend destilliert, um ihn in Wasser und Ethylenoxid zu trennen. ⓘ
CO2-Wäscher: Der aus dem Ethylenoxid-Wäscher gewonnene Rücklaufstrom wird verdichtet und ein Nebenstrom dem CO2-Wäscher zugeführt. Hier wird das CO2 in der heißen wässrigen Kaliumkarbonatlösung (d.h. dem Waschmedium) aufgelöst. Die Auflösung von CO2 ist nicht nur ein physikalisches, sondern auch ein chemisches Phänomen, denn das CO2 reagiert mit Kaliumcarbonat zu Kaliumhydrogencarbonat. ⓘ
- K2CO3 + CO2 + H2O → 2 KHCO3 ⓘ
CO2-Wäscher: Die oben genannte (mit CO2 angereicherte) Kaliumcarbonatlösung wird dann in den CO2-Wäscher geleitet, wo das CO2 durch stufenweises (in der Regel zweistufiges) Flashen ausgewaschen wird. In der ersten Stufe werden die Kohlenwasserstoffgase entfernt, in der zweiten Stufe wird das CO2 abgestreift. ⓘ
Weltproduktion von Ethylenoxid
Die Weltproduktion von Ethylenoxid lag 2009 bei 20 Mio. Tonnen (22 Mio. short tons), 2008 bei 19 Mio. Tonnen (21 Mio. short tons) und 2007 bei 18 Mio. Tonnen (20 Mio. short tons). Damit ist Ethylenoxid die 14. meistproduzierte organische Chemikalie, während Ethylen mit 113 Mio. t (125 Mio. short tons) die meistproduzierte Chemikalie war. SRI Consulting prognostizierte ein Wachstum des Ethylenoxidverbrauchs von 4,4 % pro Jahr im Zeitraum 2008-2013 und 3 % von 2013 bis 2018. ⓘ
Im Jahr 2004 stellte sich die weltweite Produktion von Ethylenoxid nach Regionen wie folgt dar:
| Region | Anzahl der wichtigsten Hersteller | Produktion, tausend Tonnen ⓘ |
|---|---|---|
| Nord-Amerika Vereinigte Staaten Kanada Mexiko |
10 3 3 |
4009 1084 350 |
| Südamerika Brasilien Venezuela |
2 1 |
312 82 |
| Europa Belgien Frankreich Deutschland Niederlande Spanien Türkei Vereinigtes Königreich Ost-Europa |
2 1 4 2 1 1 1 Keine Daten |
770 215 995 460 100 115 300 950 |
| Mittlerer Osten Iran Kuwait Saudi-Arabien |
2 1 2 |
201 350 1781 |
| Asien China Taiwan Indien Indonesien Japan Malaysia Südkorea Singapur |
Keine Daten 4 2 1 4 1 3 1 |
1354 820 488 175 949 385 740 80 |
Die weltweit größten Hersteller von Ethylenoxid sind Dow Chemical Company (3-3,5 Mio. Tonnen (3,3-3,9 Mio. Kurztonnen) im Jahr 2006), Saudi Basic Industries (2.000-2.500 Tonnen (2.200-2.800 Kurztonnen) im Jahr 2006), Royal Dutch Shell (1,328 Mio. Tonnen (1,464 Mio. Kurztonnen) im Zeitraum 2008-2009), BASF (1. 175 Mt (1,295 Millionen kurze Tonnen) in 2008-2009), China Petrochemical Corporation (~1 Mt (1,1 Millionen kurze Tonnen) in 2006), Formosa Plastics (~1 Mt (1,1 Millionen kurze Tonnen) in 2006) und Ineos (0,92 Mt (1,01 Millionen kurze Tonnen) in 2008-2009). ⓘ
Anwendungen

Ethylenoxid ist einer der wichtigsten Rohstoffe für die großtechnische chemische Produktion. Der größte Teil des Ethylenoxids wird für die Synthese von Ethylenglykolen, einschließlich Diethylenglykol und Triethylenglykol, verwendet, auf die bis zu 75 % des weltweiten Verbrauchs entfallen. Weitere wichtige Produkte sind Ethylenglykolether, Ethanolamine und Ethoxylate. Unter den Glykolen wird Ethylenglykol als Frostschutzmittel, bei der Herstellung von Polyester und Polyethylenterephthalat (PET - Rohstoff für Kunststoffflaschen), flüssigen Kühlmitteln und Lösungsmitteln verwendet. ⓘ
| Sektor | Anteil an der Nachfrage (%) ⓘ |
|---|---|
| Agrochemikalien | 7 |
| Ölfeldchemikalien | 10 |
| Detergenzien | 25 |
| Textilien | 35 |
| Körperpflege | 10 |
| Pharmazeutika | 8 |
| Sonstige | 5 |
| Insgesamt [2009] | 5,2 Mt |
Polyethylenglykole werden in Parfüms, Kosmetika, Arzneimitteln, Schmiermitteln, Farbverdünnern und Weichmachern verwendet. Ethylenglykolether sind Bestandteil von Bremsflüssigkeiten, Reinigungsmitteln, Lösungsmitteln, Lacken und Farben. Ethanolamine werden bei der Herstellung von Seife und Waschmitteln sowie bei der Reinigung von Erdgas verwendet. Ethoxylate sind Reaktionsprodukte von Ethylenoxid mit höheren Alkoholen, Säuren oder Aminen. Sie werden bei der Herstellung von Waschmitteln, Tensiden, Emulgatoren und Dispergiermitteln verwendet. ⓘ
Während die Synthese von Ethylenglykolen die wichtigste Anwendung von Ethylenoxid ist, variiert ihr Anteil je nach Region stark: von 44 % in Westeuropa, 63 % in Japan und 73 % in Nordamerika bis zu 90 % im übrigen Asien und 99 % in Afrika. ⓘ
Der größte Anteil des produzierten Ethylenoxids dient als Zwischenprodukt bei der Herstellung anderer Chemikalien. Ein Großteil des Ethylenoxids wird für die Produktion von Ethylenglycol eingesetzt, heute durch den OMEGA-Prozess. Weiter wird es für die Herstellung von Polyestern (beispielsweise PET) oder Hydroxyethylcellulose (HEC) benötigt. Ethylenoxid kann zu – ungiftigem und gut wasserlöslichem – Polyethylenglycol (auch Polyethylenoxid) polymerisieren. Es ist ebenfalls wichtig für die Herstellung von Tensiden (siehe Nichtionische Tenside), z. B. Polyalkylenglycolether. Eine Kategorie von Ethylenoxidderivaten, die große wissenschaftliche Aufmerksamkeit erregt hat, sind die Kronenether, die als zyklische Oligomere des Ethylenoxids angesehen werden können. Diese Verbindungen haben die Fähigkeit, ionische Substanzen in unpolaren Lösungsmitteln löslich zu machen, in denen sie sonst unlöslich sind. Aufgrund hoher Kosten bleibt die Verwendung dieser Substanzen auf Laboranwendungen begrenzt. ⓘ
Herstellung von Ethylenglykol
Ethylenglykol wird industriell durch nicht katalytische Hydratation von Ethylenoxid bei einer Temperatur von 200 °C (392 °F) und einem Druck von 1,5-2 MPa (220-290 psi) hergestellt:
- (CH2CH2)O + H2O → HOCH2CH2OH ⓘ
Als Nebenprodukte der Reaktion entstehen Diethylenglykol, Triethylenglykol und Polyglykole mit einem Gesamtanteil von etwa 10 %, die durch Destillation bei vermindertem Druck vom Ethylenglykol getrennt werden. ⓘ
Eine weitere Synthesemethode ist die Reaktion von Ethylenoxid und CO2 (Temperatur 80-120 °C und Druck von 5,2 MPa), wobei Ethylenkarbonat und dessen anschließende Hydrolyse mit Decarboxylierung entsteht:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O{} + CO2 -> \overset{Ethylen}carbonat}{(O-CH2CH_2-O)C=O} ->[\ce{+H2O}] [\ce{-CO2}] HOCH2CH2OH <span title="Aus: Englische Wikipedia, Abschnitt "Production of ethylene glycol"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Production_of_ethylene_glycol <span style="color:#dddddd">ⓘ</span>]</span>}}
Zu den modernen Technologien zur Herstellung von Ethylenglykol gehören die folgenden. Die Shell OMEGA-Technologie (Only Mono-Ethylene Glycol Advantage) ist eine zweistufige Synthese von Ethylencarbonat unter Verwendung eines Phosphoniumhalogenids als Katalysator. Die Glykolausbeute beträgt 99-99,5 %, wobei andere Glykole praktisch nicht vorkommen. Der Hauptvorteil des Verfahrens ist die Herstellung von reinem Ethylenglykol ohne weitere Reinigung. Die erste kommerzielle Anlage, die dieses Verfahren anwendet, wurde 2008 in Südkorea eröffnet. Dow METEOR (Most Effective Technology for Ethylene Oxide Reactions) ist eine integrierte Technologie zur Herstellung von Ethylenoxid und dessen anschließender Hydrolyse zu Ethylenglykol. Die Glykolausbeute liegt bei 90-93%. Der Hauptvorteil des Verfahrens liegt in der relativen Einfachheit, da weniger Stufen und weniger Ausrüstung benötigt werden. ⓘ
Die Umwandlung in Ethylenglykol ist auch das Mittel, mit dem Ethylenoxidabfälle gereinigt werden, bevor sie in die Umwelt entlassen werden. In der Regel wird das EtO über eine Matrix geleitet, die entweder Schwefelsäure oder Kaliumpermanganat enthält. ⓘ
Herstellung von Glykolethern
Die wichtigsten industriellen Ester von Mono-, Di- und Triethylenglykolen sind Methyl-, Ethyl- und Normalbutylether sowie ihre Acetate und Phthalate. Die Synthese erfolgt durch Reaktion des entsprechenden Alkohols mit Ethylenoxid:
- (CH2CH2)O + ROH → HOCH2CH2ODER
- (CH2CH2)O + HOCH2CH2OR → HOCH2CH2OCH2CH2OR
- (CH2CH2)O + HOCH2CH2CH2CH2OR → HOCH2CH2CH2CH2CH2CH2CH2OR ⓘ
Die Reaktion von Monoestern mit einer Säure oder ihrem Anhydrid führt zur Bildung der Ester:
- CH3CO2H + HOCH2CH2OR → ROCH2CH2OCOCH3 + H2O ⓘ
Herstellung von Ethanolaminen
In der Industrie werden Ethanolamine (Mono-, Di- und Triethanolamine) durch Reaktion von Ammoniak und Ethylenoxid in wasserfreiem Medium bei einer Temperatur von 40-70 °C (100-160 °F) und einem Druck von 1,5-3,5 MPa (220-510 psi) MPa hergestellt:
- (CH2CH2)O + NH3 → HOCH2CH2NH2
- 2 (CH2CH2)O + NH3 → (HOCH2CH2)2NH
- 3 (CH2CH2)O + NH3 → (HOCH2CH2)3N ⓘ
Bei diesem Verfahren werden alle drei Ethanolamine hergestellt, während Ammoniak und ein Teil des Methylamins zurückgeführt werden. Die Endprodukte werden durch Vakuumdestillation abgetrennt. Hydroxyalkylamine werden nach einem ähnlichen Verfahren hergestellt:
- (CH2CH2)O + RNH2 → HOCH2CH2NHR
- 2 (CH2CH2)O + RNH2 → (HOCH2CH2)2NR ⓘ
Monosubstituierte Produkte entstehen durch Reaktion eines großen Überschusses an Amin mit Ethylenoxid in Gegenwart von Wasser und bei einer Temperatur unter 100 °C (212 °F). Disubstituierte Produkte werden mit einem geringen Überschuss an Ethylenoxid, bei einer Temperatur von 120-140 °C (250-280 °F) und einem Druck von 0,3-0,5 MPa (45-75 psi) erhalten. ⓘ
Herstellung von Ethoxylaten
Die industrielle Herstellung von Ethoxylaten erfolgt durch eine direkte Reaktion höherer Alkohole, Säuren oder Amine mit Ethylenoxid in Gegenwart eines alkalischen Katalysators bei einer Temperatur von 120-180 °C (250-360 °F). Moderne Anlagen zur Herstellung von Ethoxylaten basieren in der Regel auf der BUSS LOOP-Reaktortechnologie, die auf einem dreistufigen kontinuierlichen Verfahren beruht. In der ersten Stufe werden der Initiator oder Katalysator für die Reaktion und das Ausgangsmaterial in den Behälter gegeben, wo sie gemischt, erhitzt und im Vakuum getrocknet werden. Dann wird die Reaktion in einem speziellen isolierten Reaktor in einer inerten Atmosphäre (Stickstoff) durchgeführt, um eine mögliche Explosion von Ethylenoxid zu verhindern. Schließlich wird das Reaktionsgemisch neutralisiert, entgast und gereinigt. ⓘ
Herstellung von Acrylnitril
Derzeit wird der größte Teil des Acrylnitrils (90 % im Jahr 2008) nach dem SOHIO-Verfahren hergestellt, das auf der katalytischen Oxidation von Propylen in Gegenwart von Ammoniak und Wismutphosphomolybdat basiert. Bis 1960 war jedoch die Zugabe von Cyanwasserstoff zu Ethylenoxid und die anschließende Dehydratisierung des entstehenden Cyanohydrins ein wichtiges Herstellungsverfahren:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(CH2CH2)O + HCN -> HOCH2CH2CN ->[][\ce{-H2O}] CH2=CH-CN <span title="Aus: Englische Wikipedia, Abschnitt "Production of acrylonitrile"" class="plainlinks">[https://en.wikipedia.org/wiki/Ethylene_oxide#Production_of_acrylonitrile <span style="color:#dddddd">ⓘ</span>]</span>}}
Die Zugabe von Blausäure zu Ethylenoxid erfolgt in Gegenwart eines Katalysators (Natriumhydroxid und Diethylamin), und die Dehydratisierung des Cyanohydrins erfolgt in der Gasphase durch die katalytische Wirkung von Aluminiumoxid. ⓘ
Nicht-industrielle Verwendungen
Die direkte Verwendung von Ethylenoxid macht nur 0,05 % (Daten von 2004) seiner weltweiten Produktion aus. Ethylenoxid wird als Sterilisiermittel, Desinfektionsmittel und Begasungsmittel in einem Gemisch mit Kohlendioxid (8,5-80 % Ethylenoxid), Stickstoff oder Dichlordifluormethan (12 % Ethylenoxid) verwendet. Es wird für die Gasphasensterilisation von medizinischen Geräten und Instrumenten, Verpackungsmaterialien und Kleidung, chirurgischen und wissenschaftlichen Geräten sowie für die Behandlung von Lagereinrichtungen (Tabak, Getreidepakete, Reissäcke usw.), Kleidung, Pelzen und wertvollen Dokumenten verwendet. ⓘ
Sterilisiermittel für das Gesundheitswesen
Ethylenoxid ist eine der am häufigsten verwendeten Sterilisationsmethoden im Gesundheitswesen, da es empfindliche Instrumente und Geräte, die sterilisiert werden müssen, nicht beschädigt und eine breite Palette von Materialien verträgt. Es wird für Instrumente verwendet, die Hitze, Feuchtigkeit oder abrasive Chemikalien nicht vertragen, wie z. B. Elektronik, optische Geräte, Papier, Gummi und Kunststoffe. Es wurde in den 1940er Jahren vom US-Militär als Sterilisationsmittel entwickelt, und seine Verwendung als medizinisches Sterilisationsmittel geht auf die späten 1950er Jahre zurück, als das McDonald-Verfahren für medizinische Geräte patentiert wurde. Das Anprolene-System wurde in den 1960er Jahren von Andersen Products patentiert und ist nach wie vor das am häufigsten verwendete System in verschiedenen Nischenmärkten, insbesondere in der Tiermedizin und auf einigen internationalen Märkten. Es beruht auf der Verwendung einer flexiblen Sterilisationskammer und einer EtO-Kartusche für die Sterilisation kleiner Mengen und für Fälle, in denen aus Gründen des Umweltschutzes und/oder der Tragbarkeit eine niedrige Dosis erforderlich ist. Sie wird daher als "flexible Kammersterilisationsmethode" oder als "Gasdiffusionssterilisationsmethode" bezeichnet. ⓘ
In den Vereinigten Staaten wird der Betrieb der EtO-Sterilisation von der EPA durch die Nationalen Emissionsstandards für gefährliche Luftschadstoffe (NESHAP) beaufsichtigt. ⓘ
Nischenanwendungen
Ethylenoxid wird als Fungizid und als Beschleuniger der Reifung von Tabakblättern verwendet. Ethylenoxid wird auch als Hauptbestandteil von thermobarischen Waffen (Brennstoff-Luft-Sprengstoffe) verwendet. ⓘ
Ethylen wird für die Synthese von 2-Butoxyethanol verwendet, das als Lösungsmittel in vielen Produkten eingesetzt wird. ⓘ
Identifizierung von Ethylenoxid
Die Gaschromatographie ist die wichtigste Methode zur Analyse und zum Nachweis von Ethylenoxid. ⓘ
Ein kostengünstiger Test für Ethylenoxid nutzt die Ausfällung von festen Metallhydroxiden, wenn es durch wässrige Lösungen ihrer Salze geleitet wird:
- 2 (CH2CH2)O + MnCl2 + 2 H2O → 2 HO-CH2CH2-Cl + Mn(OH)2↓ ⓘ
In ähnlicher Weise wird Ethylenoxid durch die leuchtend rosa Farbe des Indikators nachgewiesen, wenn Luft durch wässrige Lösungen einiger Natrium- oder Kaliumsalze (Chloride, Jodide, Thiosulfate usw.) mit Zusatz von Phenolphthalein geleitet wird:
- (CH2CH2)O + NaCl + H2O → HO-CH2CH2-Cl + NaOH ⓘ
Andere Methoden zum Nachweis von Ethylenoxid sind Farbreaktionen mit Pyridin-Derivaten und die Hydrolyse von Ethylenglykol mit Perjodsäure. Die entstehende Jodsäure wird mit Silbernitrat nachgewiesen. ⓘ
Unfälle
Ethylenoxid ist hochentzündlich, und seine Gemische mit Luft sind explosiv. Bei Erhitzung kann es sich schnell ausdehnen und Feuer und Explosionen verursachen. Mehrere Industrieunfälle wurden auf die Explosion von Ethylenoxid zurückgeführt. ⓘ
Die Selbstentzündungstemperatur liegt bei 429 °C (804 °F), die Zersetzungstemperatur bei 571 °C (1.060 °F) bei 101,3 kPa (14,69 psi), der Mindestgehalt an brennbaren Stoffen in der Luft beträgt 2,7 % und die Höchstgrenze liegt bei 100 %. Die NFPA-Einstufung ist NFPA 704. Ethylenoxid kann in Gegenwart von Wasser zu Ethylenglykol hydrolysieren und Polyethylenoxid bilden, das dann schließlich durch Luft oxidiert wird und zu Hotspots führt, die eine explosive Zersetzung auslösen können. ⓘ
Durch Ethylenoxid verursachte Brände werden mit herkömmlichen Mitteln wie Schaum, Kohlendioxid oder Wasser gelöscht. Die Unterdrückung dieser Aktivität kann durch Überlagerung mit einem Inertgas erfolgen, bis der Gesamtdruck den nicht-explosiven Bereich erreicht. Das Löschen von brennendem Ethylenoxid wird durch seine Fähigkeit erschwert, in einer inerten Atmosphäre und in Wasserlösungen weiterzubrennen. Das Feuer wird erst bei einer Verdünnung mit Wasser von mehr als 22:1 unterdrückt. ⓘ
Unfall in La Canonja, Spanien
Am 14. Januar 2020 kam es in einem Industriegebiet in der Nähe von Tarragona zu einer Explosion in einem Ethoxylierungsreaktor des Chemieunternehmens Industrias Quimicas de Oxido de Etileno (IQOXE, Teil der CL Industrial Group). Bei dem Unfall wurden in einem Umkreis von etwa zweieinhalb Kilometern erhebliche Trümmerteile freigesetzt, von denen ein Teil in ein entferntes Haus eindrang und einen Bewohner tötete. Berichten zufolge wurden bei der Explosion mindestens drei Menschen getötet und sieben verletzt. ⓘ
Das Unternehmen war bis zum Zeitpunkt der Explosion der einzige Hersteller von Ethylenoxid in Spanien mit einer installierten Kapazität von 140.000 Tonnen/Jahr. Die Hälfte dieser Produktion wurde zur Herstellung von Ethylenglykol für die PET-Produktion verwendet. Der Unfall wird gemäß den EU-Vorschriften im Rahmen der Europäischen Agentur für Sicherheit und Gesundheitsschutz am Arbeitsplatz untersucht. ⓘ
Kontamination von Sesamsamen 2020
Im September 2020 wurden in 268 Tonnen Sesamsamen aus Indien hohe Mengen an Pestiziden gefunden. Die Kontamination betrug das 1000- bis 3500-fache des in Europa zulässigen Grenzwerts von 0,05 Milligramm pro Kilogramm für Ethylenoxid. Dieses Pestizid ist in Europa verboten, da es als krebserregend und erbgutverändernd bekannt ist. Ein Produktrückruf wurde durchgeführt, die Hälfte der Produkte hatte eine Bio-Zertifizierung. ⓘ
Im September wurde in Belgien von der RASFF Alarm geschlagen, aber das Produkt wurde auch in anderen EU-Binnenmarktländern wie Frankreich und Irland verkauft. ⓘ
Physiologische Auswirkungen
Wirkung auf Mikroorganismen
Die Exposition gegenüber Ethylenoxidgas verursacht eine Alkylierung von Mikroorganismen auf nuklearer Ebene. Die desinfizierende Wirkung von Ethylenoxid ähnelt derjenigen der Sterilisation durch Hitze, wirkt aber aufgrund der begrenzten Penetration nur auf die Oberfläche. Die ETO-Sterilisation kann aufgrund der langsamen Wirkung auf Mikroorganismen und der langen Verarbeitungs- und Belüftungszeit bis zu 12 Stunden dauern. ⓘ
Auswirkungen auf Menschen und Tiere
Ethylenoxid ist ein Alkylierungsmittel; es hat reizende, sensibilisierende und narkotisierende Wirkungen. Chronische Exposition gegenüber Ethylenoxid ist auch mutagen. Die Internationale Agentur für Krebsforschung stuft Ethylenoxid in die Gruppe 1 ein, was bedeutet, dass es ein nachgewiesenes Karzinogen ist. Die deutsche MAK-Kommission stuft Ethylenoxid als Karzinogen der Klasse 2 ein, die ACGIH als Karzinogen der Klasse A2. Eine 2003 durchgeführte Studie mit 7.576 Frauen, die bei ihrer Arbeit in kommerziellen Sterilisationsanlagen in den USA Ethylenoxid ausgesetzt waren, deutet darauf hin, dass ein Zusammenhang zwischen Ethylenoxid und dem Auftreten von Brustkrebs besteht. Eine Folgestudie aus dem Jahr 2004, in der 18 235 Männer und Frauen untersucht wurden, die zwischen 1987 und 1998 Ethylenoxid ausgesetzt waren, kam zu dem Schluss: "Es gab kaum Hinweise auf eine übermäßige Krebssterblichkeit für die gesamte Kohorte, mit Ausnahme von Knochenkrebs, der auf einer kleinen Zahl von Personen beruht. Positive Expositions-Wirkungs-Trends für lymphoide Tumore wurden nur für Männer gefunden. Die Gründe für die Geschlechtsspezifität dieses Effekts sind nicht bekannt. Es gab auch einige Hinweise auf eine positive Expositions-Wirkungsbeziehung für die Sterblichkeit an Brustkrebs. Eine erhöhte Inzidenz von Hirntumoren und mononukleärer Zellleukämie wurde bei Ratten festgestellt, die über einen Zeitraum von zwei Jahren Ethylenoxid in Konzentrationen von 10, 33 oder 100 mL/m3 (0,0100, 0,0329 oder 0,0997 imp fl oz/cu ft) eingeatmet hatten. Bei den Tieren, die Konzentrationen von 33 und 100 mL/m3 (0,0329 und 0,0997 imp fl oz/cu ft) ausgesetzt waren, wurde auch eine erhöhte Inzidenz von Mesotheliomen des Bauchfells beobachtet. Die Ergebnisse epidemiologischer Humanstudien über Arbeitnehmer, die Ethylenoxid ausgesetzt waren, sind unterschiedlich. Sowohl Human- als auch Tierstudien weisen darauf hin, dass die Inhalationsexposition gegenüber Ethylenoxid zu einem breiten Spektrum an karzinogenen Wirkungen führen kann. ⓘ
Ethylenoxid ist giftig beim Einatmen, wobei der zulässige US OSHA-Grenzwert für die Exposition als TWA (zeitlich gewichteter Durchschnitt) über 8 Stunden bei 1 ppm und der Grenzwert für die kurzfristige Exposition (Exkursionsgrenze) als TWA über 15 Minuten bei 5 ppm liegt. Bei Konzentrationen in der Luft von etwa 200 Teilen pro Million reizt Ethylenoxid die Nasen- und Rachenschleimhäute; höhere Gehalte führen zu einer Schädigung der Luftröhre und der Bronchien bis hin zum teilweisen Kollaps der Lunge. Hohe Konzentrationen können ein Lungenödem verursachen und das Herz-Kreislauf-System schädigen; die schädigende Wirkung von Ethylenoxid kann erst nach 72 Stunden nach der Exposition auftreten. Der Höchstgehalt von Ethylenoxid in der Luft beträgt nach den US-Normen (ACGIH) 1,8 mg/m3 (0,00079 gr/cu ft). NIOSH hat festgelegt, dass der IDLH-Wert (Immediately Dangerous to Life and Health) 800 ppm beträgt. ⓘ
Da die Geruchsschwelle für Ethylenoxid zwischen 250 und 700 ppm liegt, erreicht das Gas bereits toxische Konzentrationen, wenn es gerochen werden kann. Selbst dann ist der Geruch von Ethylenoxid süßlich und aromatisch und kann leicht mit dem Aroma von Diethylether verwechselt werden, einem gebräuchlichen Laborlösungsmittel mit sehr geringer Toxizität. In Anbetracht dieser heimtückischen Eigenschaften ist eine kontinuierliche elektrochemische Überwachung gängige Praxis, und die Verwendung von Ethylenoxid zur Begasung von Gebäudeinnenräumen ist in der EU und einigen anderen Ländern verboten. ⓘ
Ethylenoxid verursacht akute Vergiftungen, die mit einer Vielzahl von Symptomen einhergehen. Auswirkungen auf das zentrale Nervensystem werden häufig mit der Exposition des Menschen gegenüber Ethylenoxid am Arbeitsplatz in Verbindung gebracht. Es wurde über Kopfschmerzen, Übelkeit und Erbrechen berichtet. Periphere Neuropathie, gestörte Hand-Augen-Koordination und Gedächtnisverlust wurden in neueren Fallstudien von chronisch exponierten Arbeitnehmern bei geschätzten durchschnittlichen Expositionswerten von nur 3 ppm (mit möglichen kurzfristigen Spitzenwerten von bis zu 700 ppm) berichtet. Der Metabolismus von Ethylenoxid ist nicht vollständig bekannt. Daten aus Tierstudien deuten auf zwei mögliche Wege für den Metabolismus von Ethylenoxid hin: Hydrolyse zu Ethylenglykol und Glutathionkonjugation zur Bildung von Mercaptursäure und Meththio-Metaboliten. ⓘ
Ethylenoxid dringt leicht durch gewöhnliche Kleidung und Schuhe hindurch und verursacht Hautreizungen und Dermatitis mit Blasenbildung, Fieber und Leukozytose. ⓘ
Die Toxizitätsdaten für Ethylenoxid lauten wie folgt:
- Augenexposition: 18 mg (0,28 gr)/6 Stunden (Kaninchen)
- Oral: 72 mg/kg (0,00115 oz/lb) (Ratte, LD50), 1.186 mg/kg (0,01898 oz/lb) (Ratte, TDLo), 5.112 mg/kg (0,08179 oz/lb) (Ratte, TD)
- Einatmen: 12.500 ppm (Mensch, TCLo), 960 ppm/4 Stunden (Hund, LC50) 33-50 ppm (Ratte oder Maus, TC), 800 ppm/4 Stunden (Ratte oder Maus, LC50)
- Subkutane Injektion: 100 mg/kg (0,0016 oz/lb) (Katze, LDLo), 292 mg/kg (0,00467 oz/lb) (Maus, TDLo) 900-2.600 mg/kg (0,014-0,042 oz/lb) (Maus, TD), 187 mg/kg (0,00299 oz/lb) (Ratte, LD50).
- Intraperitoneale Injektion: 750 mg/kg (0,0120 oz/lb) (Maus, TDLo), 175 mg/kg (0,00280 oz/lb) (Maus, LD50)
- Intravenöse Injektion: 175 mg/kg (0,00280 oz/lb) (Kaninchen, LD50), 290 mg/kg (0,0046 oz/lb) (Maus, LD50)
- Die US-Umweltschutzbehörde (USEPA) schätzte 2016, dass die lebenslange Inhalation von Ethylenoxid bei niedrigen Dosen das lebenslange Krebsrisiko einer Person um bis zu 3,0 × 10-3 pro μg/m3 erhöhen könnte (ohne zu berücksichtigen, dass die Exposition in frühen Lebensjahren wahrscheinlich stärker ist). Die USEPA schätzte die Steigung der Dosis-Wirkungsbeziehung bei höheren Dosen ab, und es wurden zusätzliche Krebsrisikoschätzungen für verschiedene Szenarien der beruflichen Exposition berechnet. ⓘ
Weltweite Nachfrage
Die weltweite Nachfrage nach EO ist von 16,6 Mio. Tonnen (18,3 Mio. kurze Tonnen) im Jahr 2004 auf 20 Mio. Tonnen (22 Mio. kurze Tonnen) im Jahr 2009 gestiegen, während die Nachfrage nach raffiniertem EO von 4,64 Mio. Tonnen (5,11 Mio. kurze Tonnen) im Jahr 2004 auf 5,6 Mio. Tonnen (6,2 Mio. kurze Tonnen) im Jahr 2008 gestiegen ist. Im Jahr 2009 dürfte die Nachfrage auf etwa 5,2 Mio. Tonnen (5,7 Mio. Kurztonnen) zurückgegangen sein. Die Gesamtnachfrage nach EO verzeichnete im Zeitraum 2005 bis 2009 eine jährliche Wachstumsrate von 5,6 % und wird den Prognosen zufolge im Zeitraum 2009 bis 2013 um 5,7 % pro Jahr steigen. ⓘ
Gesundheits- und Sicherheitsvorschriften
Laut dem Sicherheitsdatenblatt 2020 von Merck Life Science UK, das der Europäischen Agentur für chemische Stoffe zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) - einer Verordnung der Europäischen Union aus dem Jahr 2006 - vorgelegt wurde, wird davon ausgegangen, dass Ethylenoxid ein krebserregendes Potenzial für den Menschen hat". ⓘ
Gewinnung und Darstellung
Industrielle Synthese
Die großtechnische Herstellung von Ethylenoxid erfolgt heute ausschließlich durch die katalytische Oxidation von Ethen mit Sauerstoff bei Temperaturen von 230–270 °C und Drücken von 10–20 bar. Als Katalysator wird fein verteiltes Silberpulver, welches auf einem anorganischen, oxidhaltigen Träger (bevorzugt Aluminiumoxid) aufgebracht ist, eingesetzt. ⓘ
Die komplette Reaktion wird dabei in einem Rohrbündelreaktor, bei dem die beträchtliche Reaktionswärme (ΔHR= −119,7 kJ·mol−1 der Haupt- und ΔHR= −1324 kJ·mol−1 der Nebenreaktion) mithilfe von Salzschmelzen abgeführt und zur Erzeugung von überhitztem Hochdruckdampf genutzt wird, durchgeführt. Der Katalysator ist bei diesem Verfahren als Festbett angeordnet. Die Ausbeute an reinem Ethylenoxid liegt bei 85 %. Als Nebenreaktion tritt die vollständige Oxidation des Ethens zu Kohlenstoffdioxid und Wasser auf. ⓘ
Im Jahr 2010 wurden weltweit etwa 21 Millionen Tonnen an Ethylenoxid verbraucht. ⓘ
Verwendung
Sterilisation
Die Sterilisation mit Ethylenoxid ist heute ein weit verbreitetes Verfahren in der industriellen Herstellung von Medizinprodukten, insbesondere von Einmalprodukten wie Verbandstoffen, Nahtmaterial oder Spritzen und Kathetern, aber auch von chirurgischen Instrumenten und empfindlichen Medizinprodukten (z. B. Cochleaimplantaten). Das Verfahren ist hochgradig standardisiert (u. a. ISO 11135, ISO 10993-7, EN 1422). Die Behandlung von Wattestäbchen mit Ethylenoxidgas kann DNS-Spuren so zersetzen, dass sie mit forensischen Methoden nicht mehr nachweisbar sind. Lediglich etwa 2 % der Weltproduktion wird für die Sterilisation mit gasförmigem EO verwendet. ⓘ
Als Brennstoff
Im militärischen Bereich wird Ethylenoxid als Brennstoff in Aerosol-Kleinbomben, die z. B. in Streubomben des Typs CBU-55 enthalten sind, verwendet. ⓘ
Als Pestizid, Biozid und im Vorratsschutz
Ethylenoxidgas tötet Bakterien, Viren und Pilze ab, daher kann es zur Begasung von hitzeempfindlichen Substanzen verwendet werden. Die Sterilisation von Gewürzen mit EO wurde 1938 durch den amerikanischen Chemiker Lloyd Hall patentiert und wird auch heute noch in einigen Ländern praktiziert. Ethylenoxid wurde zusammen mit einem höheren Anteil Kohlendioxid (um die Brennbarkeit herabzusetzen) unter den Handelsnamen Cartox und T-Gas als Begasungsmittel von z. B. Silos, Lagerräumen und Containern verwendet. ⓘ
Sicherheitshinweise
Ethylenoxid ist giftig und krebserregend. Symptome einer Vergiftung sind Kopfschmerzen, Schwindel und Übelkeit/Erbrechen. Mit zunehmender Dosis kommt es zu Zuckungen, Krämpfen und schlussendlich zum Koma. Es ist für die Haut und die Atemwege reizend. Die Lunge kann sich Stunden nach dem Einatmen mit Flüssigkeit füllen (Lungenödem). ⓘ
Ethylenoxid wird normalerweise druckverflüssigt in Kombination mit 10 % Kohlenstoffdioxid gelagert. Bei Normaldruck und Zimmertemperatur verdunstet es sehr schnell und verursacht Frostverbrennungen auf der Haut. ⓘ
Bei Tieren hat es zahlreiche Fortpflanzungsdefekte wie Mutationen oder Fehlgeburten ausgelöst. Der Einfluss auf die menschliche Fortpflanzung ist noch nicht genau untersucht, es ist aber wahrscheinlich, dass die gleichen Effekte wie im Tierversuch auftreten. ⓘ
Gesetzliche Regelungen
In Deutschland ist der Einsatz von Ethylenoxid als Pflanzenschutzmittel durch die Pflanzenschutz-Anwendungsverordnung seit 1981 verboten, da hierbei giftiges 2-Chlorethanol entstehen kann. In der gesamten EU ist die Verwendung von Ethylenoxid als Pflanzenschutzmittel durch Inkrafttreten der Verordnung (EWG) Nr. 414/91 seit 1991 nicht mehr erlaubt. In der EU wurde Ethylenoxid als Biozid, zur Verwendung als Schutz von Lebens- und Futtermitteln, 2011 verboten. Die Verwendung von Ethylenoxid in Kosmetik ist in der EU bereits seit 1976 verboten. ⓘ
In der EU liegen die Höchstwerte für Ethylenoxidrückstände in Lebensmitteln je nach Produkt zwischen 0,02 und 0,1 mg/kg was der jeweiligen unteren analytischen Nachweisgrenze entspricht. Durch die Verordnung (EU) Nr. 231/2012, welche die Spezifikationen für die in der EU zugelassen Lebensmittelzusatzstoffe enthält, wird festgelegt, dass Ethylenoxid nicht zur Sterilisierung von Lebensmittelzusatzstoffen verwendet werden darf und dass in polyoxyetheylenhaltigen synthetischen Zusatzstoffen ein Ethylenoxidgehalt von 0,2 mg/kg nicht überschreiten werden darf. 2020 und 2021 gab es in der EU und der Schweiz zahlreiche Meldungen und Rückrufe für verschiedene importierte Produkte, wie etwa Bio-Sesamsaat und -produkte, den Verdickungsmitteln Guarkernmehl (E412) und Johannisbrotkernmehl (E410), Nahrungsergänzungsmitteln oder (Bio-)Ingwerpulver bei denen der zulässige Höchstwert um ein Vielfaches überschritten wurde. Dabei ist der Rückruf bei Johannisbrotkernmehlprodukten (z. B. Speiseeis) in Ländern wie Frankreich deutlich zahlreicher als in Deutschland. ⓘ
Ethylenoxid wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Ethylenoxid waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, hoher (aggregierter) Tonnage. Die Neubewertung fand ab 2012 statt und wurde von Österreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht. Im Rahmen der CLP-Verordnung wurde mit der Verordnung (EU) 2020/217, der 14. Anpassungen an den technischen und wissenschaftlichen Fortschritt (14. ATP) eine harmonisierte Einstufung für die EU festgelegt, die zum 1. Oktober 2021 in Kraft trat. ⓘ

















![{\displaystyle n{\ce {(CH2CH2)O ->[{\ce {SnCl4}}]}}\ \overbrace {{\ce {(CH2CH2-O-)}}_{n}} ^{{\ce {polyethyleneglycol}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8bba2c593a453d067fd3451b740268bbdcfade3)
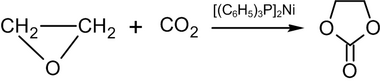

![{\displaystyle {\ce {2CH_2=CH2 + O2 ->[{\ce {Ag}}] 2(CH2CH2)O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fde14a6cc111cfdc46c6324e44a305aae14f8ce)
