Herzinfarkt
| Myokardinfarkt ⓘ | |
|---|---|
| Andere Bezeichnungen | Akuter Myokardinfarkt (AMI), Herzinfarkt |
 | |
| Ein Myokardinfarkt tritt auf, wenn sich eine atherosklerotische Plaque langsam in der inneren Auskleidung einer Koronararterie ansammelt und dann plötzlich reißt, was eine katastrophale Thrombusbildung verursacht, die Arterie vollständig verschließt und den Blutfluss stromabwärts verhindert. | |
| Fachgebiet | Kardiologie, Notfallmedizin |
| Symptome | Brustschmerzen, Kurzatmigkeit, Übelkeit, Ohnmachtsgefühl, kalter Schweiß, Müdigkeit; Arm-, Nacken-, Rücken-, Kiefer- oder Magenschmerzen |
| Komplikationen | Herzversagen, unregelmäßiger Herzschlag, kardiogener Schock, Herzstillstand |
| Ursachen | In der Regel koronare Herzkrankheit |
| Risikofaktoren | Bluthochdruck, Rauchen, Diabetes, Bewegungsmangel, Fettleibigkeit, hoher Cholesterinspiegel im Blut |
| Diagnostische Methode | Elektrokardiogramme (EKG), Blutuntersuchungen, Koronarangiographie |
| Behandlung | Perkutane Koronarintervention, Thrombolyse |
| Medikation | Aspirin, Nitroglyzerin, Heparin |
| Prognose | STEMI 10% Sterberisiko (Industrieländer) |
| Häufigkeit | 15,9 Millionen (2015) |
Ein Myokardinfarkt (MI), auch bekannt als Herzinfarkt, tritt auf, wenn der Blutfluss in der Koronararterie des Herzens abnimmt oder stoppt, wodurch der Herzmuskel geschädigt wird. Das häufigste Symptom sind Schmerzen oder Beschwerden in der Brust, die in die Schulter, den Arm, den Rücken, den Nacken oder den Kiefer ausstrahlen können. Häufig treten sie in der Mitte oder auf der linken Seite der Brust auf und dauern länger als ein paar Minuten an. Die Beschwerden können sich gelegentlich wie Sodbrennen anfühlen. Weitere Symptome können Kurzatmigkeit, Übelkeit, Schwächegefühl, kalter Schweiß oder Müdigkeit sein. Etwa 30 % der Betroffenen haben atypische Symptome. Frauen haben häufiger keine Schmerzen in der Brust und leiden stattdessen unter Nacken- oder Armschmerzen oder fühlen sich müde. Von den über 75-Jährigen haben etwa 5 % einen Herzinfarkt ohne oder mit nur geringen Symptomen erlitten. Ein Herzinfarkt kann zu Herzversagen, unregelmäßigem Herzschlag, kardiogenem Schock oder Herzstillstand führen. ⓘ
Die meisten Herzinfarkte sind auf eine koronare Herzkrankheit zurückzuführen. Zu den Risikofaktoren gehören Bluthochdruck, Rauchen, Diabetes, Bewegungsmangel, Fettleibigkeit, hoher Cholesterinspiegel, schlechte Ernährung und übermäßiger Alkoholkonsum. Die vollständige Verstopfung einer Koronararterie durch die Ruptur einer atherosklerotischen Plaque ist in der Regel der zugrunde liegende Mechanismus für einen Herzinfarkt. Seltener werden Herzinfarkte durch Spasmen der Koronararterien verursacht, die unter anderem durch Kokain, erheblichen emotionalen Stress (allgemein als Takotsubo-Syndrom oder Syndrom des gebrochenen Herzens bekannt) und extreme Kälte verursacht werden können. Eine Reihe von Untersuchungen ist für die Diagnose hilfreich, darunter Elektrokardiogramme (EKG), Bluttests und Koronarangiographie. Ein EKG, bei dem es sich um eine Aufzeichnung der elektrischen Aktivität des Herzens handelt, kann einen ST-Hebungsinfarkt (STEMI) bestätigen, wenn eine ST-Hebung vorhanden ist. Zu den häufig verwendeten Bluttests gehören Troponin und seltener Kreatinkinase MB. ⓘ
Die Behandlung eines MI ist zeitkritisch. Aspirin ist eine geeignete Sofortbehandlung für einen vermuteten MI. Nitroglyzerin oder Opioide können zur Linderung der Brustschmerzen eingesetzt werden; sie verbessern jedoch nicht die Gesamtergebnisse. Bei niedrigem Sauerstoffgehalt oder Kurzatmigkeit wird zusätzlicher Sauerstoff empfohlen. Bei einem STEMI wird versucht, den Blutfluss zum Herzen wiederherzustellen. Dazu gehören die perkutane Koronarintervention (PCI), bei der die Arterien aufgedrückt und gegebenenfalls mit Stents versehen werden, oder die Thrombolyse, bei der die Verstopfung mit Medikamenten beseitigt wird. Menschen, die einen Myokardinfarkt ohne ST-Hebungen (NSTEMI) haben, werden häufig mit dem Blutverdünner Heparin behandelt, wobei bei hohem Risiko zusätzlich eine PCI durchgeführt wird. Bei Menschen mit Verstopfungen mehrerer Koronararterien und Diabetes kann anstelle einer Angioplastie eine koronare Bypassoperation (CABG) empfohlen werden. Nach einem Myokardinfarkt wird in der Regel eine Änderung des Lebensstils zusammen mit einer Langzeitbehandlung mit Aspirin, Betablockern und Statinen empfohlen. ⓘ
Im Jahr 2015 traten weltweit etwa 15,9 Millionen Herzinfarkte auf. Mehr als 3 Millionen Menschen hatten einen ST-Hebungsinfarkt, und mehr als 4 Millionen hatten einen NSTEMI. STEMI treten bei Männern etwa doppelt so häufig auf wie bei Frauen. In den Vereinigten Staaten erleiden jedes Jahr etwa eine Million Menschen einen Herzinfarkt. In den Industrieländern liegt das Sterberisiko derjenigen, die einen STEMI erlitten haben, bei etwa 10 %. Die MI-Raten in einem bestimmten Alter sind zwischen 1990 und 2010 weltweit zurückgegangen. Im Jahr 2011 gehörte ein Herzinfarkt zu den fünf teuersten Erkrankungen bei stationären Krankenhausaufenthalten in den USA, mit Kosten in Höhe von 11,5 Milliarden US-Dollar für 612.000 Krankenhausaufenthalte. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| I21 | Akuter Myokardinfarkt |
| I22 | Rezidivierender Myokardinfarkt |
| ICD-10 online (WHO-Version 2019) | |

Der Herzinfarkt oder (genauer) Myokardinfarkt, auch Koronarinfarkt genannt, ist ein akutes und lebensbedrohliches Ereignis infolge einer Erkrankung des Herzens, bei der eine Koronararterie oder einer ihrer Äste verlegt oder stärker eingeengt wird. In der Humanmedizin gebräuchliche Abkürzungen sind HI, MI (myocardial infarction) oder AMI (acute myocardial infarction). ⓘ
Der Artikel behandelt den Myokardinfarkt im Wesentlichen beim Menschen; Myokardinfarkte bei Tieren sind gesondert am Schluss beschrieben. ⓘ
Terminologie
Ein Myokardinfarkt (MI) ist ein Gewebetod (Infarkt) des Herzmuskels (Myokard), der durch eine Ischämie, d. h. eine mangelnde Sauerstoffversorgung des Herzmuskelgewebes, verursacht wird. Sie ist eine Form des akuten Koronarsyndroms, das eine plötzliche oder kurzfristige Veränderung der Symptome im Zusammenhang mit der Durchblutung des Herzens beschreibt. Im Gegensatz zur anderen Art des akuten Koronarsyndroms, der instabilen Angina pectoris, tritt ein Herzinfarkt auf, wenn ein Zelltod eintritt, der durch die Messung von Biomarkern (das Herzprotein Troponin) im Blut festgestellt werden kann. Wenn es Anzeichen für einen Herzinfarkt gibt, kann er auf der Grundlage der Ergebnisse eines EKGs als ST-Hebungsinfarkt (STEMI) oder Nicht-ST-Hebungsinfarkt (NSTEMI) klassifiziert werden. ⓘ
Der Begriff "Herzinfarkt" wird oft unspezifisch verwendet, um auf einen Myokardinfarkt hinzuweisen. Ein Herzinfarkt unterscheidet sich von einem Herzstillstand, bei dem das Herz überhaupt nicht oder nur so schwach kontrahiert, dass alle lebenswichtigen Organe nicht mehr funktionieren, was zum Tod führen kann, kann aber auch dazu führen. Er unterscheidet sich auch von einer Herzinsuffizienz, bei der die Pumpleistung des Herzens beeinträchtigt ist. Ein Herzinfarkt kann jedoch zu einer Herzinsuffizienz führen. ⓘ
Anzeichen und Symptome
Schmerzen in der Brust, die auf andere Körperteile ausstrahlen können oder auch nicht, sind das typischste und wichtigste Symptom eines Myokardinfarkts. Sie können von anderen Symptomen wie Schweißausbrüchen begleitet sein. ⓘ
Schmerzen
Schmerzen in der Brust gehören zu den häufigsten Symptomen eines akuten Myokardinfarkts und werden häufig als Enge-, Druck- oder Quetschungsgefühl beschrieben. Der Schmerz strahlt am häufigsten in den linken Arm aus, kann aber auch in den Unterkiefer, den Hals, den rechten Arm, den Rücken und den Oberbauch ausstrahlen. Die Schmerzen, die am ehesten auf einen akuten Herzinfarkt hindeuten und die höchste Wahrscheinlichkeit aufweisen, sind Schmerzen, die in den rechten Arm und die rechte Schulter ausstrahlen. Auch Schmerzen in der Brust, die an einen früheren Herzinfarkt erinnern, sind sehr wahrscheinlich. Die mit einem Herzinfarkt verbundenen Schmerzen sind in der Regel diffus, lageunabhängig und dauern länger als 20 Minuten an. Er kann als Druck, Engegefühl, messerartiges, reißendes oder brennendes Gefühl beschrieben werden (all dies tritt auch bei anderen Erkrankungen auf). Es kann als eine unerklärliche Angst empfunden werden, und der Schmerz kann ganz fehlen. Das Levine-Zeichen, bei dem eine Person den Brustschmerz lokalisiert, indem sie eine oder beide Fäuste über dem Brustbein ballt, galt bisher als Vorhersage für kardiale Brustschmerzen, obwohl eine prospektive Beobachtungsstudie zeigte, dass es einen geringen positiven Vorhersagewert hatte. ⓘ
Typischerweise lassen Brustschmerzen aufgrund einer Ischämie, sei es eine instabile Angina pectoris oder ein Myokardinfarkt, durch die Einnahme von Nitroglyzerin nach. Nitroglyzerin kann aber auch Brustschmerzen lindern, die nicht auf Herzerkrankungen zurückzuführen sind. ⓘ
Andere
Brustschmerzen können von Schweißausbrüchen, Übelkeit oder Erbrechen und Ohnmacht begleitet sein, und diese Symptome können auch ganz ohne Schmerzen auftreten. Bei Frauen gehören Kurzatmigkeit, Schwäche und Müdigkeit zu den häufigsten Symptomen eines Myokardinfarkts. Ungewöhnliche oder unerklärliche Müdigkeit sowie Übelkeit oder Erbrechen treten bei Frauen häufiger als Symptome auf. Frauen, die einen Herzinfarkt erleiden, haben häufiger Herzklopfen, Rückenschmerzen, Atemnot, Erbrechen und Schmerzen im linken Arm als Männer, obwohl die Studien, die diese Unterschiede zeigen, sehr unterschiedlich ausfallen. Frauen berichten seltener über Schmerzen in der Brust während eines Herzinfarkts und häufiger über Übelkeit, Kieferschmerzen, Nackenschmerzen, Husten und Müdigkeit, obwohl diese Ergebnisse in den verschiedenen Studien uneinheitlich sind. Frauen mit Herzinfarkten hatten auch häufiger Verdauungsstörungen, Schwindel, Appetitlosigkeit und Bewusstlosigkeit. Kurzatmigkeit ist ein häufiges und manchmal das einzige Symptom, das auftritt, wenn die Schädigung des Herzens die Leistung der linken Herzkammer einschränkt, wobei die Kurzatmigkeit entweder durch Sauerstoffmangel im Blut oder durch ein Lungenödem verursacht wird. Andere, weniger häufige Symptome sind Schwäche, Benommenheit, Herzklopfen und Anomalien der Herzfrequenz oder des Blutdrucks. Diese Symptome werden wahrscheinlich durch einen massiven Anstieg der Katecholamine des sympathischen Nervensystems ausgelöst, der als Reaktion auf Schmerzen und, falls vorhanden, niedrigen Blutdruck auftritt. Bei einem Herzinfarkt kann es zu Bewusstseinsstörungen aufgrund einer unzureichenden Durchblutung des Gehirns und eines kardiogenen Schocks sowie zu einem plötzlichen Tod kommen, der häufig auf ein Kammerflimmern zurückzuführen ist. Herzstillstand und atypische Symptome wie Herzklopfen treten häufiger bei Frauen, älteren Menschen, Diabetikern, frisch Operierten und kritisch Kranken auf. ⓘ
Abwesenheit
"Stille" Herzinfarkte können ohne jegliche Symptome auftreten. Diese Fälle können später auf Elektrokardiogrammen, durch Blutenzymtests oder bei der Autopsie nach dem Tod einer Person entdeckt werden. Solche stummen Myokardinfarkte machen zwischen 22 und 64 % aller Infarkte aus und treten häufiger bei älteren Menschen, bei Menschen mit Diabetes mellitus und nach Herztransplantationen auf. Bei Menschen mit Diabetes werden Unterschiede in der Schmerzschwelle, autonome Neuropathie und psychologische Faktoren als mögliche Erklärungen für das Fehlen von Symptomen angeführt. Bei einer Herztransplantation wird das Spenderherz nicht vollständig durch das Nervensystem des Empfängers innerviert. ⓘ
Risikofaktoren
Die wichtigsten Risikofaktoren für einen Myokardinfarkt sind höheres Alter, aktives Rauchen, Bluthochdruck, Diabetes mellitus sowie Gesamtcholesterin- und High-Density-Lipoproteinwerte. Viele Risikofaktoren für einen Myokardinfarkt sind mit der koronaren Herzkrankheit, der Hauptursache für einen Myokardinfarkt, identisch. Weitere Risikofaktoren sind männliches Geschlecht, geringe körperliche Aktivität, eine familiäre Vorbelastung, Übergewicht und Alkoholkonsum. Die Risikofaktoren für eine Herzmuskelerkrankung werden häufig in Risikofaktor-Stratifizierungs-Scores wie dem Framingham Risk Score berücksichtigt. In jedem Alter haben Männer ein höheres Risiko für die Entwicklung von Herz-Kreislauf-Erkrankungen als Frauen. Ein bekannter Risikofaktor sind hohe Cholesterinwerte im Blut, insbesondere hohe Low-Density-Lipoproteine, niedrige High-Density-Lipoproteine und hohe Triglyceride. ⓘ
Viele Risikofaktoren für einen Herzinfarkt sind potenziell veränderbar, wobei der wichtigste das Tabakrauchen (einschließlich Passivrauchen) ist. Rauchen scheint die Ursache von etwa 36 % und Fettleibigkeit die Ursache von 20 % der koronaren Herzkrankheiten zu sein. Bewegungsmangel wird mit 7-12 % der Fälle in Verbindung gebracht. Zu den weniger häufigen Ursachen gehören stressbedingte Ursachen wie beruflicher Stress, der in etwa 3 % der Fälle auftritt, und chronisch hoher Stress. ⓘ
Ernährung
Die Bedeutung von gesättigten Fettsäuren für die Entstehung von Herzinfarkten ist nicht eindeutig belegt. Studien haben gezeigt, dass der Verzehr von mehrfach ungesättigten Fetten anstelle von gesättigten Fetten mit einem geringeren Herzinfarktrisiko verbunden ist, während andere Studien kaum Beweise dafür finden, dass eine Verringerung des Verzehrs von gesättigten Fetten oder eine Erhöhung der Aufnahme von mehrfach ungesättigten Fetten das Herzinfarktrisiko beeinflusst. Cholesterin in der Nahrung scheint keine signifikante Auswirkung auf den Cholesterinspiegel im Blut zu haben, so dass Empfehlungen zum Cholesterinverzehr möglicherweise nicht erforderlich sind. Transfette scheinen das Risiko zu erhöhen. Akuter und längerer Konsum großer Mengen alkoholischer Getränke (3-4 oder mehr pro Tag) erhöht das Risiko eines Herzinfarkts. ⓘ
Genetik
Eine familiäre Vorbelastung mit ischämischen Herzkrankheiten oder Herzinfarkten, insbesondere wenn ein männlicher Verwandter ersten Grades (Vater, Bruder) vor dem Alter von 55 Jahren einen Herzinfarkt erlitten hat, oder ein weiblicher Verwandter ersten Grades (Mutter, Schwester) unter 65 Jahren, erhöht das Risiko eines Herzinfarkts. ⓘ
In genomweiten Assoziationsstudien wurden 27 genetische Varianten gefunden, die mit einem erhöhten Risiko für einen Herzinfarkt in Verbindung gebracht werden. Die stärkste Assoziation mit einem Herzinfarkt wurde auf Chromosom 9 auf dem kurzen Arm p an Locus 21 festgestellt, der die Gene CDKN2A und 2B enthält, obwohl die beteiligten Einzelnukleotid-Polymorphismen in einer nicht codierenden Region liegen. Die meisten dieser Varianten befinden sich in Regionen, die bisher nicht mit der koronaren Herzkrankheit in Verbindung gebracht wurden. Die folgenden Gene werden mit MI in Verbindung gebracht: PCSK9, SORT1, MIA3, WDR12, MRAS, PHACTR1, LPA, TCF21, MTHFDSL, ZC3HC1, CDKN2A, 2B, ABO, PDGF0, APOA5, MNF1ASM283, COL4A1, HHIPC1, SMAD3, ADAMTS7, RAS1, SMG6, SNF8, LDLR, SLC5A3, MRPS6, KCNE2. ⓘ
Andere
Das Risiko, einen Herzinfarkt zu erleiden, steigt mit zunehmendem Alter, geringer körperlicher Aktivität und niedrigem sozioökonomischen Status. Herzinfarkte scheinen häufiger in den Morgenstunden aufzutreten, insbesondere zwischen 6 Uhr morgens und Mittag. Es gibt Hinweise darauf, dass die Wahrscheinlichkeit eines Herzinfarkts am Morgen mindestens dreimal so hoch ist wie am späten Abend. Auch Schichtarbeit wird mit einem höheren Risiko für einen Herzinfarkt in Verbindung gebracht. Und eine Analyse hat einen Anstieg der Herzinfarkte unmittelbar nach Beginn der Sommerzeit festgestellt. ⓘ
Frauen, die kombinierte orale Kontrazeptiva verwenden, haben ein geringfügig erhöhtes Herzinfarktrisiko, insbesondere bei Vorliegen anderer Risikofaktoren. Die Einnahme von nicht-steroidalen Antirheumatika (NSAIDs), auch wenn sie nur eine Woche dauert, erhöht das Risiko. ⓘ
Endometriose bei Frauen unter 40 Jahren ist ein bekannter Risikofaktor. ⓘ
Auch die Luftverschmutzung stellt ein wichtiges veränderbares Risiko dar. Die kurzfristige Exposition gegenüber Luftschadstoffen wie Kohlenmonoxid, Stickstoffdioxid und Schwefeldioxid (nicht aber Ozon) wurde mit Herzinfarkt und anderen akuten kardiovaskulären Ereignissen in Verbindung gebracht. Bei plötzlichen Herztodesfällen korrelierte jeder Anstieg des Schadstoffnormenindex um 30 Einheiten mit einem um 8 % erhöhten Risiko eines Herzstillstands außerhalb des Krankenhauses am Tag der Exposition. Auch extreme Temperaturen werden damit in Verbindung gebracht. ⓘ
Eine Reihe von akuten und chronischen Infektionen, darunter Chlamydophila pneumoniae, Influenza, Helicobacter pylori und Porphyromonas gingivalis, wurden mit Atherosklerose und Herzinfarkt in Verbindung gebracht. Seit 2013 gibt es jedoch keine Belege mehr für einen Nutzen von Antibiotika oder Impfungen, so dass dieser Zusammenhang in Frage gestellt wird. Ein Myokardinfarkt kann auch als Spätfolge der Kawasaki-Krankheit auftreten. ⓘ
Kalziumablagerungen in den Herzkranzgefäßen können mit CT-Scans nachgewiesen werden. Das in den Koronararterien nachgewiesene Kalzium kann über die klassischen Risikofaktoren hinausgehende Informationen zur Vorhersage liefern. Hohe Blutwerte der Aminosäure Homocystein werden mit vorzeitiger Atherosklerose in Verbindung gebracht; ob ein erhöhter Homocysteinspiegel im Normalbereich kausal ist, ist umstritten. ⓘ
Bei Menschen ohne offensichtliche koronare Herzkrankheit kommen als mögliche Ursachen für den Herzinfarkt ein Koronarspasmus oder eine Koronararteriendissektion in Frage. ⓘ
Mechanismus
Atherosklerose
Die häufigste Ursache für einen Herzinfarkt ist der Riss einer atherosklerotischen Plaque in einer Arterie, die den Herzmuskel versorgt. Plaques können instabil werden, reißen und zusätzlich die Bildung eines Blutgerinnsels fördern, das die Arterie verstopft; dies kann innerhalb von Minuten geschehen. Die Verstopfung einer Arterie kann zum Absterben von Gewebe führen, das von dieser Arterie versorgt wird. Atherosklerotische Plaques sind oft über Jahrzehnte vorhanden, bevor sie zu Symptomen führen. ⓘ
Die allmähliche Ansammlung von Cholesterin und faserigem Gewebe in Plaques in der Wand der Koronararterien oder anderer Arterien, typischerweise über Jahrzehnte, wird als Atherosklerose bezeichnet. Die Atherosklerose ist durch eine fortschreitende Entzündung der Arterienwände gekennzeichnet. Entzündungszellen, insbesondere Makrophagen, wandern in die betroffenen Arterienwände ein. Mit der Zeit werden sie mit Cholesterinprodukten, insbesondere LDL, beladen und zu Schaumzellen. Beim Absterben der Schaumzellen bildet sich ein Cholesterinkern. Als Reaktion auf Wachstumsfaktoren, die von den Makrophagen abgesondert werden, wandern glatte Muskel- und andere Zellen in die Plaque ein und stabilisieren sie. Eine stabile Plaque kann eine dicke faserige Kappe mit Verkalkung aufweisen. Bei einer anhaltenden Entzündung kann die Kappe dünn sein oder ulzerieren. Unter dem Druck, der mit dem Blutfluss einhergeht, können Plaques, insbesondere solche mit dünner Auskleidung, reißen und die Bildung eines Blutgerinnsels (Thrombus) auslösen. Die Cholesterinkristalle werden mit der Ruptur der Plaques durch mechanische Verletzungen und Entzündungen in Verbindung gebracht. ⓘ
Andere Ursachen
Eine atherosklerotische Erkrankung ist nicht die einzige Ursache für einen Herzinfarkt, sie kann jedoch andere Ursachen verschlimmern oder zu ihnen beitragen. Ein Myokardinfarkt kann die Folge eines Herzens sein, dessen Blutversorgung eingeschränkt ist und das einem erhöhten Sauerstoffbedarf ausgesetzt ist, z. B. bei Fieber, hoher Herzfrequenz, Schilddrüsenüberfunktion, zu wenig roten Blutkörperchen im Blutkreislauf oder niedrigem Blutdruck. Beschädigung oder Versagen von Verfahren wie perkutane Koronarintervention oder Koronararterien-Bypass-Transplantationen können einen Herzinfarkt verursachen. Spasmen der Koronararterien, wie die Prinzmetal-Angina, können zu Verstopfungen führen. ⓘ
Absterben des Gewebes

Wenn die Durchblutungsstörung des Herzens lange genug anhält, wird ein Prozess ausgelöst, der als ischämische Kaskade bezeichnet wird: Die Herzzellen im Gebiet der blockierten Koronararterie sterben ab (Infarkt), vor allem durch Nekrose, und wachsen nicht nach. An ihrer Stelle bildet sich eine Kollagennarbe. Wenn eine Arterie blockiert ist, fehlt den Zellen der Sauerstoff, der für die Produktion von ATP in den Mitochondrien benötigt wird. ATP wird für die Aufrechterhaltung des Elektrolytgleichgewichts benötigt, insbesondere durch die Na/K-ATPase. Dies führt zu einer ischämischen Kaskade von intrazellulären Veränderungen, Nekrose und Apoptose der betroffenen Zellen. ⓘ
Die Zellen in dem am schlechtesten durchbluteten Bereich, direkt unter der inneren Oberfläche des Herzens (Endokard), sind am anfälligsten für Schäden. Die Ischämie betrifft zuerst diese Region, den subendokardialen Bereich, und das Gewebe beginnt innerhalb von 15-30 Minuten nach dem Verlust der Blutversorgung abzusterben. Das abgestorbene Gewebe ist von einer Zone mit potenziell reversibler Ischämie umgeben, die sich zu einem transmuralen Infarkt mit voller Dicke ausweitet. Die anfängliche Infarktwelle" kann sich über 3-4 Stunden hinziehen. Diese Veränderungen sind in der groben Pathologie sichtbar und können nicht durch das Vorhandensein oder Fehlen von Q-Wellen auf einem EKG vorhergesagt werden. Lage, Größe und Ausmaß eines Infarkts hängen von der betroffenen Arterie, der Gesamtheit der Verstopfung, der Dauer der Verstopfung, dem Vorhandensein von Kollateralgefäßen, dem Sauerstoffbedarf und dem Erfolg der interventionellen Verfahren ab. ⓘ
Das Absterben des Gewebes und die Vernarbung des Herzmuskels verändern die normalen Erregungsleitungsbahnen des Herzens und schwächen die betroffenen Bereiche. Aufgrund ihrer Größe und Lage besteht die Gefahr von Herzrhythmusstörungen (Arrhythmien) oder Herzblockaden, Aneurysmen der Herzkammern, Entzündungen der Herzwand nach einem Infarkt und Rupturen der Herzwand, die katastrophale Folgen haben können. ⓘ
Auch bei der Reperfusion kommt es zu einer Schädigung des Herzmuskels. Dies kann sich als ventrikuläre Arrhythmie äußern. Die Reperfusionsverletzung ist eine Folge der Kalzium- und Natriumaufnahme aus den Herzzellen und der Freisetzung von Sauerstoffradikalen während der Reperfusion. Das No-Reflow-Phänomen - wenn das Blut trotz Aufhebung des Verschlusses nicht in das betroffene Myokard gelangen kann - trägt ebenfalls zur Schädigung des Myokards bei. Die lokale Endothelschwellung ist einer von vielen Faktoren, die zu diesem Phänomen beitragen. ⓘ
Diagnose

Herzinfarkte ereignen sich in unterschiedlichen Bereichen des Herzmuskels, abhängig davon, welches Gefäß betroffen ist und welcher Abschnitt des Herzmuskels von dem jeweiligen Gefäß mit Blut versorgt wird. Da es eine große Variabilität der Herzarterien gibt, kann man keine strengen Regeln für die Infarktlokalisation aufstellen. Häufig führen Verschlüsse der rechten Koronararterie (RCA – Right Coronary Artery) zu sogenannten Hinterwandinfarkten und krankhafte Veränderungen der linken Herzarterie (LCA – Left Coronary Artery) zu Vorderwandinfarkten. Der übliche Ausdruck Hinterwandinfarkt ist dabei insofern irreführend, als es sich zumeist um einen inferioren Infarkt handelt, also in einem dem Zwerchfell (Diaphragma) zugewandten unteren Areal (zum streng posterioren Infarkt siehe unten). Je näher der Verschluss zum Abgang der jeweiligen Arterie von der Aorta liegt (man sagt proximal), desto größer ist das Infarktareal; je weiter entfernt (man sagt distal), desto kleiner ist das minderversorgte Muskelgebiet. ⓘ
Im Einzelnen unterscheidet man so proximale Verschlüsse der RCA, die zu einem rechtsventrikulären Infarkt oder einem inferioren (zur Herzspitze gelegenen) Hinterwandinfarkt führen, und Prozesse in einem Ast der RCA, dem Ramus posterolateralis dexter, die zu einem Hinterseitenwandinfarkt führen. Die Einteilung ist komplizierter, wenn die linke Herzarterie (LCA) betroffen ist, da diese mehr Äste besitzt. Der sogenannte Hauptstamm der LCA ist sehr kurz und teilt sich gleich in den Ramus circumflexus (RCX) und den Ramus interventricularis anterior (RIVA). Der RIVA wird im englischsprachigen Raum als LAD (Left Anterior Descending) bezeichnet; doch auch im deutschsprachigen Raum (zum Beispiel in der Herzchirurgie) wird anstelle von RIVA oft der Begriff LAD verwendet. Verschlüsse der RCX führen oft zu einem posterioren (zum Rücken) gelegenen Hinterwandinfarkt. Der posteriore Hinterwandinfarkt heißt in der Nomenklatur der Pathologen Seitenwand- oder Kanteninfarkt. Proximale Verschlüsse der RIVA führen zu einem großen Vorderwandinfarkt, distale RIVA-Verschlüsse führen zu einem anteroseptalen Infarkt; dabei ist die Herzscheidewand betroffen. Ein Verschluss des Diagonalastes der RIVA führt zu einem Lateralinfarkt. Die verschiedenen Infarkttypen verursachen charakteristische EKG-Veränderungen. Sieht man zum Beispiel direkte Infarktzeichen (ST-Hebungen) in allen Brustwandableitungen (V1-V6), handelt es sich (bezogen auf das Gefäßversorgungsgebiet) um einen großen Vorderwandinfarkt. Dann findet sich meistens ein proximaler Verschluss der RIVA. Die entsprechende Zuordnung aufgrund des EKGs ist aber vorläufig und kann nur durch eine Coronarangiographie bewiesen werden. Da die Muskelmasse und damit auch das Versorgungsgebiet des rechten Ventrikels kleiner als des linken ist und zu dessen Durchblutung folglich auch eine längere Gefäßstrecke notwendig ist, die erkranken kann, ist bei den Herzinfarkten auch statistisch überwiegend die linke Koronararterie betroffen. ⓘ

Kriterien
Ein Myokardinfarkt ist nach aktuellem Konsens definiert durch erhöhte kardiale Biomarker mit steigender oder fallender Tendenz und mindestens einem der folgenden Punkte:
- Symptome, die auf eine Ischämie hinweisen
- Veränderungen im Elektrokardiogramm (EKG), wie ST-Segmentveränderungen, neuer Linksschenkelblock oder pathologische Q-Wellen
- Veränderungen in der Bewegung der Herzwand in der Bildgebung
- Nachweis eines Thrombus im Angiogramm oder bei der Autopsie. ⓘ
Arten
Ein Myokardinfarkt wird in der Regel klinisch als ST-Hebungsinfarkt (STEMI) oder als Nicht-ST-Hebungsinfarkt (NSTEMI) klassifiziert. Die Einteilung basiert auf der ST-Hebung, einem Teil des Herzschlags, der auf einem EKG grafisch aufgezeichnet wird. STEMI machen etwa 25-40 % der Myokardinfarkte aus. Es gibt auch ein eindeutigeres Klassifizierungssystem, das auf einem internationalen Konsens aus dem Jahr 2012 beruht. Darin werden Myokardinfarkte in fünf Typen eingeteilt:
- Spontaner Infarkt aufgrund von Plaque-Erosion und/oder Rupturspaltung oder Dissektion
- Ischämiebedingter Infarkt, z. B. aufgrund von erhöhtem Sauerstoffbedarf oder verminderter Sauerstoffzufuhr, z. B. Koronararterienspasmus, Koronarembolie, Anämie, Herzrhythmusstörungen, Bluthochdruck oder niedriger Blutdruck
- Plötzlicher unerwarteter Herztod, einschließlich Herzstillstand, wenn die Symptome auf einen Herzinfarkt hindeuten, ein EKG mit auffälligen Veränderungen vorliegt oder ein Blutgerinnsel in einer Koronararterie durch Angiographie und/oder bei der Autopsie gefunden wird, aber keine Blutproben entnommen werden konnten, oder zu einem Zeitpunkt vor dem Auftreten von kardialen Biomarkern im Blut
- In Verbindung mit Koronarangioplastie oder Stents
- In Verbindung mit einer perkutanen Koronarintervention (PCI)
- In Verbindung mit einer Stentthrombose, die durch Angiographie oder bei der Autopsie dokumentiert wurde
- Assoziiert mit CABG
- Im Zusammenhang mit einer spontanen Koronararteriendissektion bei jungen, fitten Frauen ⓘ
Kardiale Biomarker
Es gibt viele verschiedene Biomarker, mit denen sich das Vorhandensein einer Herzmuskelschädigung feststellen lässt. Troponine, die durch einen Bluttest gemessen werden, gelten als die besten und werden bevorzugt, da sie eine höhere Empfindlichkeit und Spezifität für die Messung von Herzmuskelschäden aufweisen als andere Tests. Der Troponinwert steigt innerhalb von 2 bis 3 Stunden nach der Schädigung des Herzmuskels an und erreicht innerhalb von 1 bis 2 Tagen seinen Höchststand. Der Troponinwert und seine zeitliche Entwicklung sind nützlich, um Herzinfarkte zu messen und zu diagnostizieren oder auszuschließen, und die diagnostische Genauigkeit der Troponin-Tests verbessert sich mit der Zeit. Ein hochempfindliches kardiales Troponin kann einen Herzinfarkt ausschließen, solange das EKG normal ist. ⓘ
Von anderen Tests, wie z. B. CK-MB oder Myoglobin, wird abgeraten. CK-MB ist nicht so spezifisch wie Troponine für akute Myokardverletzungen und kann bei früheren Herzoperationen, Entzündungen oder elektrischer Kardioversion erhöht sein; es steigt innerhalb von 4-8 Stunden an und kehrt innerhalb von 2-3 Tagen auf den Normalwert zurück. Copeptin kann zusammen mit Troponin zum raschen Ausschluss eines Herzinfarkts nützlich sein. ⓘ
Elektrokardiogramm

Elektrokardiogramme (EKG) sind eine Reihe von Ableitungen auf der Brust einer Person, die die mit der Kontraktion des Herzmuskels verbundene elektrische Aktivität messen. Die Erstellung eines EKGs ist ein wichtiger Teil der Untersuchung eines AMI, und EKGs werden oft nicht nur einmal erstellt, sondern können im Laufe von Minuten bis Stunden oder als Reaktion auf Veränderungen der Anzeichen oder Symptome wiederholt werden. ⓘ
Das EKG zeigt eine Kurvenform mit verschiedenen Merkmalen an. Neben einem Anstieg der Biomarker können auch ein Anstieg des ST-Segments, Veränderungen in der Form oder ein Flipping der T-Wellen, neue Q-Wellen oder ein neuer Linksschenkelblock zur Diagnose eines AMI herangezogen werden. Darüber hinaus kann eine ST-Hebung zur Diagnose eines ST-Segment-Myokardinfarkts (STEMI) herangezogen werden. Es muss ein neuer Anstieg in V2 und V3 ≥2 mm (0,2 mV) bei Männern oder ≥1,5 mm (0,15 mV) bei Frauen oder ≥1 mm (0,1 mV) in zwei anderen benachbarten Brust- oder Extremitätenableitungen vorliegen. Eine ST-Hebung wird mit einem Infarkt in Verbindung gebracht und kann Veränderungen vorausgehen, die auf eine Ischämie hinweisen, wie z. B. eine ST-Senkung oder eine Inversion der T-Wellen. Anhand der Ableitungen, die von den Veränderungen betroffen sind, können Anomalien helfen, den Ort eines Infarkts zu bestimmen. Frühe STEMIs können mit spitzen T-Wellen einhergehen. Andere EKG-Anomalien, die mit den Komplikationen eines akuten Myokardinfarkts zusammenhängen, wie z. B. Vorhofflimmern oder Kammerflimmern, können ebenfalls auftreten. ⓘ
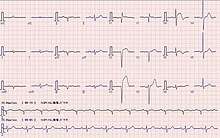
Auch für die Erkennung und Beurteilung von Herzrhythmusstörungen als häufige Komplikationen eines Infarktes ist das EKG von entscheidender Bedeutung. Um Extrasystolen, Kammerflimmern und AV-Blockierungen in der Akutphase so rasch wie möglich erkennen und ggf. behandeln zu können, wird in der Akutphase eine kontinuierliche EKG-Überwachung (EKG-Monitoring) durchgeführt. ⓘ
Im Anschluss an die Akutphase dient ein Belastungs-EKG der Beurteilung der Belastbarkeit und Erkennung fortbestehender Durchblutungsstörungen des Herzmuskels, ein Langzeit-EKG der Aufdeckung anderweitig unbemerkter Herzrhythmusstörungen. ⓘ
Bildgebung
Die nichtinvasive Bildgebung spielt eine wichtige Rolle bei der Diagnose und Charakterisierung des Myokardinfarkts. Tests wie Röntgenaufnahmen des Brustkorbs können eingesetzt werden, um andere Ursachen für die Symptome einer Person zu untersuchen und auszuschließen. Tests wie die Stressechokardiographie und die Myokardperfusionsbildgebung können die Diagnose bestätigen, wenn die Krankengeschichte, die körperliche Untersuchung (einschließlich der Herzuntersuchung), das EKG und die kardialen Biomarker auf ein Problem hindeuten. ⓘ
Die Echokardiographie, eine Ultraschalluntersuchung des Herzens, kann das Herz, seine Größe und Form sowie abnorme Bewegungen der Herzwände beim Schlagen darstellen, die auf einen Herzinfarkt hindeuten können. Der Blutfluss kann abgebildet werden, und zur Verbesserung des Bildes können Kontrastmittel verabreicht werden. Andere Untersuchungen mit radioaktivem Kontrastmittel sind SPECT-CT-Scans mit Thallium, Sestamibi (MIBI-Scans) oder Tetrofosmin oder ein PET-Scan mit Fludeoxyglucose oder Rubidium-82. Mit diesen nuklearmedizinischen Untersuchungen kann die Durchblutung des Herzmuskels sichtbar gemacht werden. SPECT kann auch zur Bestimmung der Lebensfähigkeit des Gewebes und zur Feststellung, ob Ischämiebereiche induzierbar sind, eingesetzt werden. ⓘ
Medizinische Fachgesellschaften und Berufsrichtlinien empfehlen, dass sich der Arzt vergewissert, dass eine Person ein hohes Risiko für einen Myokardinfarkt hat, bevor er bildgebende Tests zur Diagnosestellung durchführt, da solche Tests die Behandlung wahrscheinlich nicht ändern und zu höheren Kosten führen. Bei Patienten, die ein normales EKG haben und in der Lage sind, Sport zu treiben, ist beispielsweise eine routinemäßige Bildgebung nicht erforderlich. ⓘ
Schlechte Bewegung des Herzens aufgrund eines Herzinfarkts, wie im Ultraschall zu sehen
Lungenödem aufgrund eines MI im Ultraschall ⓘ
Differentialdiagnose
Es gibt viele Ursachen für Schmerzen in der Brust, die vom Herzen, der Lunge, dem Magen-Darm-Trakt, der Aorta und anderen Muskeln, Knochen und Nerven in der Umgebung des Brustkorbs ausgehen können. Neben einem Myokardinfarkt können auch Angina pectoris, eine unzureichende Durchblutung (Ischämie) der Herzmuskulatur ohne Anzeichen eines Zelltods, eine gastroösophageale Refluxkrankheit, eine Lungenembolie, ein Lungentumor, eine Lungenentzündung, eine Rippenfraktur, eine Costochondritis, eine Herzinsuffizienz und andere Verletzungen des Bewegungsapparats die Ursache sein. Zu den selteneren schweren Differentialdiagnosen gehören Aortendissektion, Speiseröhrenruptur, Spannungspneumothorax und Perikarderguss, der eine Herztamponade verursacht. Der Brustschmerz bei einem MI kann Sodbrennen imitieren. Die Ursachen für plötzlich auftretende Atemnot betreffen in der Regel die Lunge oder das Herz - einschließlich Lungenödem, Lungenentzündung, allergische Reaktionen und Asthma sowie Lungenembolie, akutes Atemnotsyndrom und metabolische Azidose. Es gibt viele verschiedene Ursachen für Müdigkeit, und ein Herzinfarkt ist keine häufige Ursache. ⓘ
Prävention
Es gibt eine große Schnittmenge zwischen den Lebensstil- und Aktivitätsempfehlungen zur Vorbeugung eines Myokardinfarkts und den Empfehlungen zur Sekundärprävention nach einem ersten Myokardinfarkt, da es gemeinsame Risikofaktoren gibt und die Arteriosklerose an den Herzgefäßen verringert werden soll. Auch die Grippeimpfung scheint mit einem Nutzen von 15 bis 45 % vor einem Myokardinfarkt zu schützen. ⓘ
Primäre Prävention
Lebensstil
Körperliche Aktivität kann das Risiko von Herz-Kreislauf-Erkrankungen verringern, und Risikopersonen wird empfohlen, sich wöchentlich 150 Minuten lang mäßig oder 75 Minuten lang intensiv zu bewegen. Ein gesundes Gewicht, Alkoholkonsum innerhalb der empfohlenen Grenzen und der Verzicht auf das Rauchen verringern das Risiko von Herz-Kreislauf-Erkrankungen. ⓘ
Der Ersatz von gesättigten Fetten durch mehrfach ungesättigte Fette wie Oliven- und Rapsöl kann das Risiko eines Herzinfarkts verringern, auch wenn es darüber keine allgemeine Übereinstimmung gibt. Einige nationale Behörden empfehlen, die Ernährung zu ändern, u. a. den Verzehr von Vollkornstärke zu erhöhen, den Zuckerkonsum (insbesondere von raffiniertem Zucker) zu reduzieren, täglich fünf Portionen Obst und Gemüse zu verzehren, zwei oder mehr Portionen Fisch pro Woche zu essen und vier bis fünf Portionen ungesalzene Nüsse, Samen oder Hülsenfrüchte pro Woche zu verzehren. Das Ernährungsmuster mit der größten Unterstützung ist die Mittelmeerdiät. Die Einnahme von Vitaminen und Mineralstoffen hat keinen nachgewiesenen Nutzen, ebenso wenig wie die Einnahme von Pflanzenstanolen oder -sterolen. ⓘ
Maßnahmen des öffentlichen Gesundheitswesens können auch auf Bevölkerungsebene zur Verringerung des Herzinfarktrisikos beitragen, z. B. durch die Verringerung ungesunder Ernährung (zu viel Salz, gesättigte Fettsäuren und Transfettsäuren), einschließlich Vorschriften für die Lebensmittelkennzeichnung und -vermarktung sowie für Catering und Restaurants, und durch die Förderung der körperlichen Bewegung. Dies kann im Rahmen regionaler Programme zur Prävention von Herz-Kreislauf-Erkrankungen oder durch die Bewertung der gesundheitlichen Auswirkungen regionaler und lokaler Pläne und Maßnahmen erfolgen. ⓘ
Die meisten Leitlinien empfehlen eine Kombination verschiedener Präventionsstrategien. Ein Cochrane-Review aus dem Jahr 2015 fand einige Hinweise darauf, dass ein solcher Ansatz bei Blutdruck, Body-Mass-Index und Taillenumfang helfen könnte. Es gab jedoch keine ausreichenden Belege für eine Wirkung auf die Sterblichkeit oder tatsächliche kardiovaskuläre Ereignisse. ⓘ
Medikation
Statine, Medikamente zur Senkung des Cholesterinspiegels im Blut, verringern die Häufigkeit und die Sterblichkeitsrate von Herzinfarkten. Sie werden häufig bei Personen mit einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen empfohlen. ⓘ
Aspirin wurde bei Personen mit erhöhtem Myokardinfarktrisiko eingehend untersucht. Auf der Grundlage zahlreicher Studien an verschiedenen Gruppen (z. B. Menschen mit oder ohne Diabetes) scheint der Nutzen nicht groß genug zu sein, um das Risiko übermäßiger Blutungen aufzuwiegen. Dennoch wird in vielen klinischen Praxisleitlinien weiterhin Aspirin zur Primärprävention empfohlen, und einige Forscher sind der Ansicht, dass Personen mit sehr hohem kardiovaskulärem Risiko, aber geringem Blutungsrisiko, weiterhin Aspirin erhalten sollten. ⓘ
Sekundärprävention
Es gibt eine große Schnittmenge zwischen den Lebensstil- und Aktivitätsempfehlungen zur Vorbeugung eines Myokardinfarkts und den Empfehlungen, die als Sekundärprävention nach einem ersten Myokardinfarkt angenommen werden können. Zu den Empfehlungen gehören der Verzicht auf das Rauchen, die allmähliche Wiederaufnahme der sportlichen Betätigung, eine gesunde Ernährung mit wenig gesättigten Fettsäuren und wenig Cholesterin, ein Alkoholkonsum innerhalb der empfohlenen Grenzen, körperliche Betätigung und der Versuch, ein gesundes Gewicht zu erreichen. Bewegung ist sicher und wirksam, auch wenn die Betroffenen Stents oder eine Herzinsuffizienz hatten, und es wird empfohlen, nach 1-2 Wochen schrittweise damit zu beginnen. Es sollte eine Beratung zu den eingenommenen Medikamenten und zu den Warnsignalen einer Depression angeboten werden. Frühere Studien deuten auf einen Nutzen der Einnahme von Omega-3-Fettsäuren hin, was sich jedoch nicht bestätigt hat. ⓘ
Medikamente
Nach einem Herzinfarkt verringern Nitrate, wenn sie zwei Tage lang eingenommen werden, und ACE-Hemmer das Sterberisiko. Zu den weiteren Medikamenten gehören: Aspirin wird auf unbestimmte Zeit fortgesetzt, ebenso wie ein weiterer Thrombozytenaggregationshemmer wie Clopidogrel oder Ticagrelor ("duale Thrombozytenaggregationshemmer" oder DAPT) für bis zu zwölf Monate. Wenn jemand eine andere Erkrankung hat, die eine Antikoagulation erfordert (z. B. mit Warfarin), muss diese möglicherweise an das Risiko weiterer kardialer Ereignisse sowie an das Blutungsrisiko angepasst werden. Bei Personen, die einen Stent erhalten haben, hat eine mehr als 12-monatige Einnahme von Clopidogrel plus Aspirin keinen Einfluss auf das Sterberisiko. ⓘ
Es wird empfohlen, innerhalb von 24 Stunden mit einer Betablockertherapie wie Metoprolol oder Carvedilol zu beginnen, sofern keine akute Herzinsuffizienz oder ein Herzblock vorliegt. Die Dosis sollte auf die höchste verträgliche Dosis erhöht werden. Anders als lange Zeit angenommen, scheint der Einsatz von Betablockern das Sterberisiko nicht zu erhöhen, möglicherweise weil sich andere Behandlungsmethoden für MI verbessert haben. Wenn Betablocker innerhalb der ersten 24-72 Stunden nach einem STEMI verabreicht werden, werden keine Leben gerettet. Allerdings wurde bei 1 von 200 Personen ein erneuter Herzinfarkt und bei weiteren 1 von 200 ein abnormaler Herzrhythmus verhindert. Außerdem bewirkt das Medikament bei 1 von 91 Personen eine vorübergehende Verringerung der Pumpfähigkeit des Herzens. ⓘ
Eine ACE-Hemmer-Therapie sollte innerhalb von 24 Stunden begonnen und mit der höchsten verträglichen Dosis auf unbestimmte Zeit fortgesetzt werden. Voraussetzung ist, dass es keine Anzeichen für eine Verschlechterung des Nierenversagens, hohen Kaliumspiegel, niedrigen Blutdruck oder eine bekannte Verengung der Nierenarterien gibt. Personen, die ACE-Hemmer nicht vertragen, können mit einem Angiotensin-II-Rezeptor-Antagonisten behandelt werden. ⓘ
Eine Statintherapie senkt nachweislich die Sterblichkeit und nachfolgende kardiale Ereignisse und sollte zur Senkung des LDL-Cholesterinspiegels eingeleitet werden. Andere Medikamente, wie Ezetimib, können ebenfalls mit diesem Ziel eingesetzt werden. ⓘ
Aldosteronantagonisten (Spironolacton oder Eplerenon) können eingesetzt werden, wenn nach einem Herzinfarkt Anzeichen einer linksventrikulären Dysfunktion vorliegen, idealerweise nach Beginn der Behandlung mit einem ACE-Hemmer. ⓘ
Andere
Ein Defibrillator, ein elektrisches Gerät, das an das Herz angeschlossen und chirurgisch unter die Haut eingeführt wird, kann empfohlen werden. Dies gilt insbesondere dann, wenn anhaltende Anzeichen einer Herzinsuffizienz mit einer niedrigen linksventrikulären Auswurffraktion und einem New York Heart Association Grad II oder III 40 Tage nach dem Infarkt bestehen. Defibrillatoren erkennen potenziell tödliche Herzrhythmusstörungen und versetzen der betroffenen Person einen elektrischen Schock, um eine kritische Masse des Herzmuskels zu depolarisieren. ⓘ
Behandlung

Vordringliches Therapieziel beim ST-Hebungsinfarkt ist die möglichst rasche Eröffnung des betroffenen und in dieser Situation meist verschlossenen Herzkranzgefäßes. Diese Wiederherstellung der Durchblutung im Infarktgebiet wird Reperfusionstherapie genannt. Je früher diese erfolgt, umso besser kann eine Infarktausdehnung verhindert werden („time is muscle“). Gelingt es, die Reperfusionstherapie bereits in der ersten Stunde nach Infarkteintritt anzuwenden, so können viele dieser Infarkte sogar verhindert werden. ⓘ
Als Reperfusionstherapie sind zwei Behandlungsverfahren etabliert:
- Primär-Perkutane Koronarintervention (auch Direkt-PTCA oder Primär-PTCA): mechanische Öffnung (Rekanalisation) des Gefäßes mit anschließender Ballondilatation und Stentimplantation mittels Herzkatheter. Zeigt sich ein mittels PTCA nicht angehbarer Befund, kann in Einzelfällen eine akute operative Myokardrevaskularisation indiziert sein.
- Lysetherapie oder Thrombolyse: intravenöse Gabe eines gerinnselauflösenden Medikamentes. Dieses Thrombolytikum kann vom Notarzt bereits am Einsatzort verabreicht werden (prästationäre Lyse) und führt durch frühen Behandlungsbeginn zu besseren Ergebnissen als eine Therapieeinleitung im Krankenhaus. ⓘ
Bei gleichzeitiger Verfügbarkeit ist die Primär-PCI in einem erfahrenen Zentrum die bevorzugte Strategie. Da aber weniger als 20 % der deutschen Krankenhäuser über die Möglichkeit zur Primär-PCI verfügen, muss die Entscheidung zur optimalen Therapie im Einzelfall getroffen werden. Viele Notärzte sind mit Zwölf-Kanal-EKG-Geräten und Medikamenten für eine Lysetherapie ausgerüstet, so dass sie heute sofort nach Diagnosestellung in Abhängigkeit von der Infarktdauer, dem Patientenzustand, der Verfügbarkeit eines erfahrenen Herzkatheterteams und der Transportentfernung die bestmögliche Reperfusionstherapie auswählen können. ⓘ
Bei Nicht-ST-Hebungsinfarkten (NSTEMI) ist ein Nutzen der unverzüglichen Reperfusionstherapie nicht belegt, eine Lysetherapie ist kontraindiziert. Ob und zu welchem Zeitpunkt eine Herzkatheteruntersuchung erforderlich ist, ist trotz vieler Studien zu diesem Thema strittig. Die vorherrschende und auch in den Leitlinien der kardiologischen Fachgesellschaften verankerte Empfehlung sieht eine „frühe Intervention“ innerhalb von 48 Stunden vor. Erneute Diskussionen sind durch eine weitere im Herbst 2005 veröffentlichte Studie entstanden, die bei 1200 Patienten mit NSTEMI kein höheres Risiko fand, wenn die Intervention nur bei Patienten mit anhaltenden Beschwerden erfolgte. ⓘ
Ein Myokardinfarkt erfordert sofortige medizinische Hilfe. Ziel der Behandlung ist es, so viel Herzmuskel wie möglich zu erhalten und weitere Komplikationen zu verhindern. Die Behandlung hängt davon ab, ob es sich bei dem Myokardinfarkt um einen STEMI oder NSTEMI handelt. Die Behandlung zielt im Allgemeinen darauf ab, die Blutgefäße zu entlasten, die Vergrößerung von Blutgerinnseln zu verringern, die Ischämie zu reduzieren und die Risikofaktoren zu verändern, um künftige Infarkte zu verhindern. Darüber hinaus umfasst die Hauptbehandlung von Myokardinfarkten mit ST-Hebungen im EKG (STEMI) die Thrombolyse oder die perkutane Koronarintervention, obwohl die PCI auch bei NSTEMI idealerweise innerhalb von 1-3 Tagen durchgeführt wird. Neben der klinischen Beurteilung kann auch eine Risikostratifizierung die Behandlung leiten, z. B. mit den TIMI- und GRACE-Scoring-Systemen. ⓘ
Schmerzen
Die mit einem Myokardinfarkt verbundenen Schmerzen werden häufig mit Nitroglyzerin, einem Vasodilatator, oder Opioiden wie Morphin behandelt. Nitroglyzerin (das unter die Zunge oder in eine Vene gespritzt wird) kann die Blutzufuhr zum Herzen verbessern. Es ist ein wichtiger Bestandteil der Therapie, weil es schmerzlindernd wirkt, obwohl kein Nutzen für die Sterblichkeit nachgewiesen ist. Morphin oder andere opioide Medikamente können ebenfalls eingesetzt werden und sind bei Schmerzen im Zusammenhang mit einem STEMI wirksam. Es gibt kaum Belege dafür, dass Morphin einen Nutzen für das Gesamtergebnis hat, und es gibt einige Hinweise auf mögliche Schäden. ⓘ
Antithrombotika
Aspirin, ein Thrombozytenaggregationshemmer, wird in Form einer Ladedosis verabreicht, um die Größe des Gerinnsels zu verringern und eine weitere Gerinnung in der betroffenen Arterie zu verhindern. Es ist bekannt, dass es die Sterblichkeitsrate bei akutem Myokardinfarkt um mindestens 50 % senken kann. P2Y12-Inhibitoren wie Clopidogrel, Prasugrel und Ticagrelor werden gleichzeitig verabreicht, ebenfalls als Ladedosis, wobei die Dosis davon abhängt, ob eine weitere chirurgische Behandlung oder eine Fibrinolyse geplant ist. Prasugrel und Ticagrelor werden in europäischen und amerikanischen Leitlinien empfohlen, da sie schneller und konsequenter wirken als Clopidogrel. P2Y12-Inhibitoren werden sowohl bei NSTEMI als auch bei STEMI empfohlen, auch bei PCI, wobei es auch Hinweise auf eine verbesserte Mortalität gibt. Heparine, insbesondere in der unfraktionierten Form, wirken an mehreren Stellen der Gerinnungskaskade, verhindern die Vergrößerung eines Gerinnsels und werden auch bei Myokardinfarkt verabreicht, da es Hinweise auf eine verbesserte Sterblichkeitsrate gibt. In sehr risikoreichen Fällen können Inhibitoren des Plättchen-Glykoprotein-αIIbβ3a-Rezeptors wie Eptifibatid oder Tirofiban eingesetzt werden. ⓘ
Es gibt unterschiedliche Erkenntnisse über den Nutzen für die Mortalität bei NSTEMI. Eine 2014 durchgeführte Überprüfung von P2Y12-Inhibitoren wie Clopidogrel ergab, dass sie das Sterberisiko nicht verändern, wenn sie Menschen mit Verdacht auf NSTEMI vor einer PCI verabreicht werden, und auch Heparine verändern das Sterberisiko nicht. Sie verringern jedoch das Risiko eines weiteren Myokardinfarkts. ⓘ

Angiogramm
Die primäre perkutane Koronarintervention (PCI) ist die Behandlung der Wahl bei einem STEMI, wenn sie rechtzeitig durchgeführt werden kann, idealerweise innerhalb von 90-120 Minuten nach Kontakt mit einem medizinischen Dienstleister. Einige empfehlen, dass sie auch bei einem NSTEMI innerhalb von 1 bis 3 Tagen durchgeführt wird, vor allem, wenn sie als risikoreich gilt. In einer Untersuchung aus dem Jahr 2017 wurde jedoch kein Unterschied zwischen einer frühen und einer späteren PCI bei NSTEMI festgestellt. ⓘ
Bei der PCI werden kleine Sonden durch periphere Blutgefäße wie die Arteria femoralis oder die Arteria radialis in die Blutgefäße des Herzens eingeführt. Mit diesen Sonden werden dann Verstopfungen aufgespürt und beseitigt, indem kleine Ballons durch das verstopfte Segment gezogen werden, um das Gerinnsel abzutragen, oder indem Stents eingesetzt werden. Eine koronare Bypass-Operation wird nur dann in Betracht gezogen, wenn der betroffene Herzmuskelbereich groß ist und eine PCI nicht in Frage kommt, z. B. bei schwieriger Herzanatomie. Nach einer PCI werden die Patienten in der Regel auf unbestimmte Zeit auf Aspirin und mindestens ein Jahr lang auf eine duale Thrombozytenaggregationshemmer-Therapie (in der Regel Aspirin und Clopidogrel) eingestellt. ⓘ
Fibrinolyse
Wenn bei einem STEMI eine PCI nicht innerhalb von 90 bis 120 Minuten durchgeführt werden kann, wird eine Fibrinolyse, vorzugsweise innerhalb von 30 Minuten nach Ankunft im Krankenhaus, empfohlen. Wenn die Symptome bereits seit 12 bis 24 Stunden bestehen, ist die Wirksamkeit der Thrombolyse weniger gut belegt, und wenn die Symptome bereits länger als 24 Stunden bestehen, wird sie nicht empfohlen. Bei der Thrombolyse werden Medikamente verabreicht, die die Enzyme aktivieren, die normalerweise Blutgerinnsel auflösen. Zu diesen Medikamenten gehören Gewebeplasminogenaktivator, Reteplase, Streptokinase und Tenecteplase. Die Thrombolyse wird in einer Reihe von Situationen nicht empfohlen, insbesondere dann, wenn ein hohes Blutungsrisiko oder das Potenzial für problematische Blutungen besteht, z. B. bei aktiven Blutungen, früheren Schlaganfällen oder Blutungen im Gehirn oder bei schwerem Bluthochdruck. Zu den Situationen, in denen eine Thrombolyse mit Vorsicht in Betracht gezogen werden kann, gehören kürzlich durchgeführte Operationen, die Einnahme von Gerinnungshemmern, eine Schwangerschaft und eine Neigung zu Blutungen. Die Hauptrisiken der Thrombolyse sind schwere Blutungen und intrakranielle Blutungen. Die Thrombolyse vor dem Krankenhausaufenthalt verkürzt die Zeit bis zur thrombolytischen Behandlung, wie aus Studien in Ländern mit höherem Einkommen hervorgeht; es ist jedoch unklar, ob dies Auswirkungen auf die Sterblichkeitsrate hat. ⓘ
Andere
In der Vergangenheit wurde Sauerstoff mit hohem Durchfluss für alle Patienten mit einem möglichen Herzinfarkt empfohlen. In jüngster Zeit wurden jedoch keine Belege für eine routinemäßige Anwendung bei Personen mit normalen Sauerstoffwerten gefunden, und es besteht die Gefahr, dass die Intervention Schaden anrichtet. Daher wird Sauerstoff derzeit nur empfohlen, wenn ein niedriger Sauerstoffgehalt festgestellt wird oder wenn jemand unter Atemnot leidet. ⓘ
Kommt es trotz Thrombolyse zu einem signifikanten kardiogenen Schock, anhaltenden starken Brustschmerzen oder einer weniger als 50-prozentigen Verbesserung der ST-Hebung im EKG nach 90 Minuten, dann ist eine Notfall-PCI angezeigt. ⓘ
Bei Patienten mit Herzstillstand kann ein gezieltes Temperaturmanagement mit Prüfung der Anwendung von Hypothermieprotokollen von Vorteil sein. Darüber hinaus sollte bei Personen mit Herzstillstand und ST-Hebung zu irgendeinem Zeitpunkt eine Angiographie durchgeführt werden. Aldosteronantagonisten scheinen bei Personen, die einen STEMI erlitten haben und keine Herzinsuffizienz haben, nützlich zu sein. ⓘ
Rehabilitation und Bewegung
Die kardiale Rehabilitation ist für viele Herzinfarktpatienten von Nutzen, auch wenn das Herz bereits erheblich geschädigt ist und eine Linksherzinsuffizienz vorliegt. Sie sollte bald nach der Entlassung aus dem Krankenhaus beginnen. Das Programm kann Ratschläge zur Lebensführung, Bewegung, soziale Unterstützung sowie Empfehlungen zum Autofahren, Fliegen, zur Teilnahme am Sport, zur Stressbewältigung und zum Geschlechtsverkehr umfassen. Die Rückkehr zur sexuellen Aktivität nach einem Myokardinfarkt ist für die meisten Patienten ein wichtiges Anliegen, das im Rahmen einer ganzheitlichen Betreuung besprochen werden sollte. ⓘ
Kurzfristig können trainingsbasierte kardiovaskuläre Rehabilitationsprogramme das Risiko eines Myokardinfarkts verringern, eine große Anzahl von Krankenhausaufenthalten aus allen Gründen reduzieren, die Krankenhauskosten senken, die gesundheitsbezogene Lebensqualität verbessern und einen geringen Einfluss auf die Gesamtmortalität haben. Längerfristige Studien deuten darauf hin, dass bewegungsbasierte kardiovaskuläre Rehabilitationsprogramme die kardiovaskuläre Sterblichkeit und den Myokardinfarkt verringern können. ⓘ
Prognose
Die Prognose nach einem Myokardinfarkt ist sehr unterschiedlich und hängt vom Ausmaß und der Lage des betroffenen Herzmuskels sowie von der Entwicklung und dem Umgang mit Komplikationen ab. Die Prognose ist mit zunehmendem Alter und sozialer Isolation schlechter. Vorderwandinfarkte, anhaltende ventrikuläre Tachykardie oder Kammerflimmern, die Entwicklung von Herzblockaden und linksventrikuläre Beeinträchtigungen sind mit einer schlechteren Prognose verbunden. Ohne Behandlung stirbt etwa ein Viertel der Infarktpatienten innerhalb weniger Minuten und etwa vierzig Prozent innerhalb des ersten Monats. Die Morbidität und Mortalität des Myokardinfarkts hat sich jedoch im Laufe der Jahre dank früherer und besserer Behandlung verbessert: Von denjenigen, die in den Vereinigten Staaten einen STEMI erleiden, sterben 5 bis 6 Prozent vor der Entlassung aus dem Krankenhaus und 7 bis 18 Prozent innerhalb eines Jahres. ⓘ
Es ist ungewöhnlich, dass Babys einen Herzinfarkt erleiden, aber wenn dies der Fall ist, stirbt etwa die Hälfte. Kurzfristig scheinen die überlebenden Neugeborenen eine normale Lebensqualität zu haben. ⓘ
Komplikationen
Sehr häufig sind Herzrhythmusstörungen, auch bei kleinen Infarkten vor allem in der Frühphase. Ventrikuläre Tachykardien bis hin zum Kammerflimmern sind die häufigste Todesursache beim Herzinfarkt, deshalb wird in der Akutphase eine ständige Überwachung und Defibrillationsbereitschaft auf einer Intensivstation gesichert. In Einzelfällen ist eine Behandlung mit einem Antiarrhythmikum nötig. Besonders Hinterwandinfarkte können über eine Ischämie des AV-Knotens zum AV-Block und bei Ischämie des Sinusknoten zum Sick-Sinus-Syndrom führen, was vorübergehend (oder dauerhaft) den Einsatz eines Herzschrittmachers erfordert. ⓘ
Wenn der Infarkt große Areale des Herzens (mehr als 30 % der Muskulatur) betrifft, kann es zur Ausbildung eines kardiogenen Schocks kommen, bei dem das Herz durch die Herzmuskelschädigung nicht mehr in der Lage ist, eine ausreichende Kreislauffunktion aufrechtzuerhalten. Diese Patienten haben eine deutlich schlechtere Prognose, der kardiogene Schock ist die zweithäufigste Todesursache im Rahmen eines akuten Herzinfarktes. Hier kann eine intraaortale Ballonpumpe (IABP) vorübergehend das Herz unterstützen. ⓘ
Ein Herzwandaneurysma kann sich aufgrund der Wandschwäche nach einem Herzinfarkt ausbilden. Hierbei entwickelt sich eine Auswölbung der geschädigten Herzwand. Chronisch kommt es zu einer verschlechterten Herzfunktion, der Bildung eines Thrombus durch gestörten Blutfluss mit der Möglichkeit arterieller Embolien. In der direkten Phase nach einem Infarkt kann es zu einer Ruptur (Platzen) der Auswölbung kommen mit nachfolgender Herzbeuteltamponade, welche sofort entlastet und im Allgemeinen chirurgisch versorgt werden muss. ⓘ
Durch Nekrose im Herzscheidewandbereich kann es auch hier zu einer Septumperforation kommen. Nachfolgend kommt es zum Übertritt von Blut aus dem linken in den rechten Teil des Herzens. ⓘ
Insbesondere bei Hinterwandinfarkten kann eine akute Insuffizienz der Mitralklappe durch Nekrose der Papillarmuskeln mit nachfolgendem Abriss eines Sehnenfadens auftreten. Der Rückfluss von Blut in den linken Vorhof kann zu einer akuten Herzinsuffizienz führen und eine schnelle Herzoperation notwendig machen. Ein neu auftretendes systolisches Herzgeräusch kann zu dieser Verdachtsdiagnose führen, daher sollen Patienten nach Herzinfarkt regelmäßig abgehört (auskultiert) werden. ⓘ
Im weiteren Verlauf (einige Tage bis ca. acht Wochen) kann sich im Rahmen einer Autoimmunreaktion eine Entzündung des Herzbeutels, das sogenannte Dressler-Syndrom, entwickeln. ⓘ
Als Langzeitfolge kann sich eine Herzinsuffizienz entwickeln, bei der die Pumpfähigkeit des Herzmuskels beeinträchtigt ist, Vernarbungen auftreten und der vorhandene Muskel an Größe zunimmt. Ein Aneurysma des linken Ventrikelmyokards entwickelt sich in etwa 10 % der Fälle von MI und ist selbst ein Risikofaktor für Herzinsuffizienz, Herzrhythmusstörungen und die Entwicklung von Blutgerinnseln. ⓘ
Zu den Risikofaktoren für Komplikationen und Tod gehören Alter, hämodynamische Parameter (wie Herzinsuffizienz, Herzstillstand bei der Aufnahme, systolischer Blutdruck oder Killip-Klasse von zwei oder höher), ST-Strecken-Abweichung, Diabetes, Serumkreatinin, periphere Gefäßerkrankungen und erhöhte kardiale Marker. ⓘ
Epidemiologie
Der Herzinfarkt ist eine der Haupttodesursachen in den Industrienationen. Die Inzidenz beträgt in Österreich/Deutschland etwa 300 Infarkte jährlich pro 100.000 Einwohner (in Japan < 100; Mittelmeer, Schweiz, Frankreich < 200; 300 bis 400 in Skandinavien; 400 bis 500 in England, Ungarn), in Deutschland erleiden jedes Jahr etwa 280.000 Menschen einen Herzinfarkt. Laut Todesursachenstatistik des Statistischen Bundesamtes starben in Deutschland im Jahr 2015 über 49.000 Menschen infolge eines akuten Herzinfarktes. Damit liegt der akute Herzinfarkt seit 1998 immer an zweiter Stelle der Todesursachen in Deutschland. Sowohl die absolute Anzahl der Sterbefälle infolge eines Herzinfarktes als auch die relative Häufigkeit sind in Deutschland seit Jahren stetig rückläufig (siehe Tabelle). ⓘ
| Jahr | absolute Anzahl | männlich | weiblich ⓘ |
|---|---|---|---|
| 2000 | 67.282 | 36.458 | 30.824 |
| 2001 | 65.228 | 35.473 | 29.755 |
| 2002 | 64.218 | 34.907 | 29.311 |
| 2003 | 64.229 | 34.679 | 29.550 |
| 2004 | 61.736 | 33.348 | 28.388 |
| 2005 | 61.056 | 32.973 | 28.083 |
| 2006 | 59.938 | 32.471 | 27.467 |
| 2007 | 57.788 | 31.195 | 26.593 |
| 2008 | 56.775 | 30.559 | 26.216 |
| 2009 | 56.226 | 30.934 | 25.292 |
| 2010 | 55.541 | 30.651 | 24.890 |
| 2011 | 52.113 | 28.621 | 23.492 |
| 2012 | 52.516 | 28.951 | 23.565 |
| 2013 | 52.044 | 28.991 | 23.053 |
| 2014 | 48.181 | 27.188 | 20.993 |
| 2015 | 49.210 | 27.835 | 21.375 |
| 2016 | 48.669 | 28.130 | 20.539 |
| 2017 | 46.966 | 27.130 | 19.836 |
| 2018 | 46.207 | 26.884 | 19.323 |
Herzinfarkte treten deutlich häufiger in sozial ärmeren Stadtteilen auf. Zudem sind die Patienten aus diesen Vierteln im Gegensatz zu Patienten aus sozial privilegierteren Bezirken jünger und haben ein höheres Risiko, innerhalb eines Jahres nach dem Herzinfarkt zu versterben. ⓘ
Der Myokardinfarkt ist eine häufige Form der koronaren Herzkrankheit. Die Weltgesundheitsorganisation schätzte im Jahr 2004, dass 12,2 % der weltweiten Todesfälle auf ischämische Herzkrankheiten zurückzuführen sind, wobei sie in Ländern mit hohem oder mittlerem Einkommen die häufigste Todesursache darstellen und in Ländern mit niedrigem Einkommen an zweiter Stelle nach Infektionen der unteren Atemwege stehen. Weltweit erleiden mehr als 3 Millionen Menschen pro Jahr einen STEMI und 4 Millionen einen NSTEMI. STEMIs treten bei Männern etwa doppelt so häufig auf wie bei Frauen. ⓘ
Die Todesraten aufgrund von ischämischen Herzkrankheiten (IHD) sind in den meisten Ländern mit hohem Einkommen gesunken oder haben sich verlangsamt, obwohl 2008 in den USA immer noch jeder dritte Todesfall auf Herz-Kreislauf-Erkrankungen zurückzuführen war. So ist die Zahl der Todesfälle durch Herz-Kreislauf-Erkrankungen in den Vereinigten Staaten zwischen 2001 und 2011 um fast ein Drittel zurückgegangen. ⓘ
Im Gegensatz dazu ist die Herz-Kreislauf-Erkrankung in den Entwicklungsländern eine immer häufigere Todesursache. In Indien beispielsweise war die Herz-Kreislauf-Erkrankung im Jahr 2004 mit 1,46 Millionen Todesfällen (14 % aller Todesfälle) die häufigste Todesursache, und es wird erwartet, dass sich die Zahl der Todesfälle aufgrund von Herz-Kreislauf-Erkrankungen zwischen 1985 und 2015 verdoppeln wird. Weltweit werden die durch ischämische Herzkrankheiten verlorenen behinderungsbereinigten Lebensjahre (DALYs) im Jahr 2030 voraussichtlich 5,5 % der gesamten DALYs ausmachen, was sie zur zweitwichtigsten Ursache für Behinderungen (nach unipolaren depressiven Störungen) und zur führenden Todesursache bis zu diesem Zeitpunkt macht. ⓘ
Soziale Determinanten der Gesundheit
Soziale Determinanten wie Benachteiligung in der Nachbarschaft, Einwanderungsstatus, mangelnde soziale Unterstützung, soziale Isolation und Zugang zu Gesundheitsdiensten spielen eine wichtige Rolle für das Herzinfarktrisiko und die Überlebensrate. Studien haben gezeigt, dass ein niedriger sozioökonomischer Status mit einem erhöhten Risiko für ein schlechteres Überleben verbunden ist. Es gibt gut dokumentierte Unterschiede in der Überlebensrate bei Myokardinfarkten je nach sozioökonomischem Status, Rasse, Bildung und Armut auf der Ebene des Zählbezirks. ⓘ
Rasse: In den USA sind Afroamerikaner stärker von Myokardinfarkten und anderen kardiovaskulären Ereignissen betroffen. Auf Bevölkerungsebene gibt es eine höhere Prävalenz von Risikofaktoren, die nicht erkannt und daher auch nicht behandelt werden, wodurch diese Personen eine höhere Wahrscheinlichkeit haben, nachteilige Folgen und damit eine potenziell höhere Morbidität und Mortalität zu erleiden. ⓘ
Sozioökonomischer Status: Bei Personen, die in Gebieten mit niedrigem sozioökonomischem Status (SES) leben, was etwa 25 % der US-Bevölkerung ausmacht, traten Myokardinfarkte doppelt so häufig auf wie bei Personen, die in Gebieten mit höherem SES lebten. ⓘ
Einwanderungsstatus: Im Jahr 2018 sind viele Einwanderer, die sich rechtmäßig in den USA aufhalten und Anspruch auf Versicherungsschutz haben, nach wie vor nicht versichert, da Einwandererfamilien mit einer Reihe von Hindernissen bei der Aufnahme in die Versicherung konfrontiert sind, darunter Angst, Unklarheit über die Anspruchsvoraussetzungen, Schwierigkeiten bei der Aufnahme in die Versicherung sowie Sprach- und Leseprobleme. Nicht versicherte Einwanderer ohne Papiere haben aufgrund ihres Einwanderungsstatus keinen Anspruch auf Versicherungsschutz. ⓘ
Zugang zur Gesundheitsversorgung: Fehlende Krankenversicherung und finanzielle Bedenken hinsichtlich des Zugangs zur Gesundheitsversorgung wurden mit Verzögerungen bei der Inanspruchnahme der Notfallversorgung bei akutem Myokardinfarkt in Verbindung gebracht, was erhebliche negative Auswirkungen auf die Ergebnisse der Patienten haben kann. ⓘ
Bildung: Die Forscher fanden heraus, dass Personen mit einem niedrigeren Bildungsniveau im Vergleich zu Personen mit einem Hochschulabschluss ein höheres Risiko für einen Herzinfarkt, den Tod durch ein kardiovaskuläres Ereignis und den Tod insgesamt aufwiesen. ⓘ
Gesellschaft und Kultur
In den populären Medien werden Herzinfarkte oft so dargestellt, dass die Betroffenen kollabieren oder das Bewusstsein verlieren, was keine üblichen Symptome sind. Diese Darstellungen tragen zu einem weit verbreiteten Missverständnis über die Symptome von Herzinfarkten bei, was wiederum dazu beiträgt, dass Menschen sich nicht rechtzeitig behandeln lassen. ⓘ
Rechtliche Folgen
Nach allgemeinem Recht ist ein Myokardinfarkt eine Krankheit, kann aber auch eine Verletzung sein. Dies kann bei der Verwaltung von verschuldensunabhängigen Versicherungssystemen wie der Arbeiterunfallversicherung zu Problemen bei der Deckung führen. Im Allgemeinen ist ein Herzinfarkt nicht versichert; er kann jedoch eine arbeitsbedingte Verletzung sein, wenn er z. B. auf ungewöhnlichen emotionalen Stress oder ungewöhnliche Anstrengung zurückzuführen ist. Darüber hinaus können in einigen Ländern Herzinfarkte bei Personen, die bestimmte Berufe ausüben, wie z. B. Polizeibeamte, per Gesetz oder Richtlinie als Verletzungen im Rahmen ihrer Arbeit eingestuft werden. In einigen Ländern oder Staaten darf eine Person, die einen Herzinfarkt erlitten hat, nicht an Aktivitäten teilnehmen, die das Leben anderer Menschen gefährden, z. B. am Steuer eines Autos oder eines Flugzeugs. ⓘ
Terminologie und Pathologie
Das Verständnis vom Herzinfarkt hat sich in den letzten dreißig Jahren grundlegend gewandelt. Neue Diagnose- und Therapieverfahren haben wichtige Erkenntnisse zur Pathophysiologie besonders der ersten Stunden nach Beginn der Symptome beigetragen und die Definition und Terminologie des Herzinfarktes verändert. ⓘ
Pathophysiologie
Die Mehrzahl der Herzinfarkte entsteht im Rahmen einer koronaren Herzkrankheit (KHK). Wie alle akuten Koronarsyndrome beim Menschen werden sie fast immer durch eine plötzliche Minderdurchblutung in einem Herzkranzgefäß hervorgerufen, die auf eine arteriosklerotische Gefäßveränderung mit zusätzlichen Blutgerinnseln („Koronarthrombose“) zurückzuführen ist und von einer krampfartigen Gefäßverengung (Koronarspasmus) begleitet sein kann. Das sich daraus entwickelnde Krankheitsbild hängt von der Lokalisation, der Schwere und der Dauer der Durchblutungsstörung des Herzmuskels ab. Bei ST-Hebungsinfarkten zeigt sich im akuten Stadium bei über 90 % ein durch Blutgerinnsel (Thromben) verschlossenes Herzkranzgefäß. Bei NSTEMI sind nur in etwa 50 % der Fälle Thromben in den Kranzgefäßen nachweisbar. ⓘ
65–75 % der ST-Hebungsinfarkte entstehen durch die Ruptur eines „vulnerablen“ Plaques, also den Einriss der dünnen fibrösen Kappe einer entzündlich veränderten lipidreichen Gefäßwandveränderung. Etwa 75 % der Infarkte entstehen an nur leicht oder mittelgradig veränderten Abschnitten der Herzkranzgefäße. ⓘ
Deutlich seltener ist ein Herzinfarkt die Folge einer anderen Erkrankung. In Frage kommen Verschlüsse der Herzkranzgefäße durch andere Ursachen, wie langanhaltende „Verkrampfungen“ (Spasmen) bei Prinzmetal-Angina oder im Rahmen einer allergischen Reaktion (Kounis-Syndrom) und Embolien bei einer Endokarditis oder einer disseminierten intravasalen Koagulopathie (DIC). Auch Blutungen oder Tumoren am Herzen sowie Einrisse der Gefäßinnenwand (Intima) bei einer Aortendissektion können zum Verschluss eines Kranzgefäßes und damit zum Herzinfarkt führen. ⓘ
Wenn seine Blutzufuhr komplett unterbrochen ist, beginnt der Herzmuskel nach 15–30 Minuten abzusterben. Dieser Vorgang der Infarzierung beginnt innen, in der den Herzkammern zugewandten Schicht, und setzt sich zeitabhängig nach außen, zum Herzbeutel hin, fort. ⓘ
Risikofaktoren
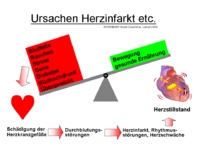
Da Herzinfarkte die Folge einer Atherosklerose der Herzkranzgefäße (Koronare Herzkrankheit) sind, sind die Hauptrisikofaktoren solche, die zur Atherosklerose führen:
- Tabakkonsum,
- Diabetes mellitus (Zuckerkrankheit),
- Bluthochdruck
- Hypercholesterinämie
- familiäre Belastung (früh auftretende Herzkreislauferkrankungen wie Infarkt oder Schlaganfall bei nahen Blutsverwandten)
- ererbte oder erworbene Störung des Fettstoffwechsels. Hierbei sind vor allem ein erhöhtes LDL, erhöhtes IDL, niedriges HDL und erhöhte Triglyceride problematisch. ⓘ
Einige der o. g. Risikofaktoren verstärken sich bei Übergewicht, Fehlernährung und Bewegungsmangel. Für die Berechnung des individuellen Risikos gibt es Software wie den Arriba-Rechner. Trotz tendenzieller Gewichtszunahme bei Rauchstopp verringert dieser das Risiko, an einer Herz-Kreislauf-Erkrankung zu erkranken. ⓘ
Stress und Wut
Auslösende Faktoren für einen Infarkt können plötzliche Belastungen und Stresssituationen mit starken Blutdruckschwankungen sein; 40 % aller Infarkte ereignen sich in den frühen Morgenstunden (zwischen 6 und 10 Uhr). Infarkte treten montags häufiger als an anderen Wochentagen auf, auch bei Rentnern nach dem 60. Lebensjahr. ⓘ
In Japan bezeichnet Karōshi den „Tod durch Überarbeiten“, der meist als Herzinfarkt oder Schlaganfall auftritt. ⓘ
Der Anteil psychosozialer Faktoren wie Depression, Angst, Persönlichkeit, Charakter, sozialer Isolation und chronischem Stress bei der Entstehung einer KHK wird seit Jahrzehnten ohne klares Ergebnis untersucht. Gesundheitsschädliches Verhalten, Stress, Rauchen, zu reichliche Ernährung etc. haben unzweifelhaft Einfluss. Diskutiert wird weiter, inwieweit beispielsweise eine Aktivierung von Blutplättchen oder des neuroendokrinen Systems mit Ausschüttung von Stresshormonen mit den Folgen einer Verengung der Blutgefäße, Verschlechterung der Fließeigenschaften des Blutes sowie Anstieg von Herzfrequenz und Blutdruck zusätzliche auslösende Qualitäten aufweist. Eine Studie aus dem Jahr 2006 zur Zeit der Fußball-Weltmeisterschaft hat gezeigt, dass die mit Fußball verbundenen Emotionen das Risiko für einen Infarkt erheblich steigern und dass dies besonders für Menschen zutrifft, die eine bekannte koronare Herzkrankheit haben. Diese Erkenntnis wird jedoch in der wissenschaftlichen Literatur kontrovers diskutiert: So konnte eine zweite Studie im gleichen Zeitintervall in der gleichen Region (Bayern) keinen Einfluss der Fußballweltmeisterschaft 2006 auf das Risiko eines Myokardinfarkts nachweisen. ⓘ
Auch andere emotionale Faktoren leisten der Krankheit Vorschub. So konnte nachgewiesen werden, dass gewohnheitsmäßige, schlecht gehandhabte Wut ein machtvoller Prädiktor für Herzinfarkte ist. Infarktpatienten, die sich einem Anti-Aggressivitäts-Training unterzogen, erlitten unter Studienbedingungen weniger häufig einen zweiten Infarkt als Personen der Vergleichsgruppe. ⓘ
Alkohol
Bei übermäßigem Alkoholkonsum ist das Risiko für einen Herzinfarkt und verschiedene andere schwere Erkrankungen erhöht. Hinsichtlich der Sterblichkeit gibt es Hinweise auf eine Korrelation zwischen einem regelmäßigen Konsum von geringen und mehr noch „mäßigen“ Mengen Alkohol und einem niedrigeren Risiko, an Herzkreislauferkrankungen zu sterben. Insgesamt betrachtet stellen dennoch selbst geringe Mengen Alkohol eine Schädigung für den Körper dar. ⓘ
Infektion
Eine akute Infektionskrankheit erhöht das Risiko eines Herzinfarktes. Bereits in den 1920er Jahren wurde erkannt, dass während einer Influenza-Epidemie die Herzinfarktrate anstieg. Die gleiche Beobachtung wurde bei Lungenentzündung, akuter Bronchitis und anderen Atemwegsinfektionen gemacht. Eine neuere Studie ergab nach einer Influenza-Infektion ein sechsfach erhöhtes Infarktrisiko, nach RSV-Infektion ein vierfach und nach anderen virusbedingten Atemwegserkrankungen ein dreifach erhöhtes Infarktrisiko. Auch für bakterielle Infektionen mit Pneumokokken und Haemophilus influenzae wurde eine Steigerung der Infarktrate nachgewiesen. Harnwegsinfektionen und Bakteriaemien erhöhen ebenfalls das Infarktrisiko. Als Erklärung wird angenommen, dass atheroskleroischer Plaques zahlreiche Entzündungszellen enthalten. Bei einer Infektion werden verschiedene Zytokine wie zum Beispiel IL1, IL6, IL8 und TNF-alpha ausgeschüttet. Diese stimulieren die Entzündungszellen im atheroskleroischen Plaque und begünstigen eine Destabilisierung mit folgender Thrombose und Verschluss. ⓘ
Weitere Risikofaktoren
Ein erhöhter Blutspiegel von Homocystein (Hyperhomocysteinämie) ist ebenfalls ein unabhängiger Risikofaktor, die verfügbaren Therapieansätze zur Senkung des Homocysteinspiegels führen allerdings nicht zu einer Senkung des kardiovaskulären Risikos. ⓘ
Auch ein niedriger Blutspiegel des Vitamin D3 (25-Hydroxy-Cholecalciferol) korreliert möglicherweise mit einem erhöhten Infarktrisiko. In einer prospektiven Fall-Kontroll-Studie konnte gezeigt werden, dass Männer mit niedrigeren Vitamin-D3-Spiegeln ein doppelt so hohes Infarktrisiko hatten wie jene mit höheren. Männer mit mittleren Spiegeln an Vitamin D3 (15,0–22,5 ng/ml) waren im Vergleich zu jenen mit höheren offenbar noch vermehrt infarktgefährdet. Ob dies in einer mangelhaften Zufuhr des Vitamin D oder einem verminderten Umbau des 7-Dehydrocholesterol bzw. 25-Hydroxy-Cholecalciferol in der Leber und Haut begründet ist, der auf einer auch für den Herzinfarkt ursächlichen Disposition beruhen könnte, wurde nicht untersucht. ⓘ
Schlechte Compliance ist ein Risikofaktor für ein Fortschreiten der Erkrankung. Eine Analyse der Einnahme fettsenkender Medikamente (Statine), Betablocker und Calciumantagonisten nach Herzinfarkt zeigte, dass eine schlechte Compliance eine Erhöhung der Mortalität innerhalb von 2,4 Jahren für Statine um 25 % und für Betablocker um 13 % hatte. Bei den Kalziumantagonisten ergab sich keine Beziehung zwischen Mortalität und Zusammenarbeit. ⓘ
Träger der Blutgruppe AB sind am stärksten herzinfarktgefährdet, diejenigen der Gruppe 0 dagegen am wenigsten. ⓘ
Ein weiterer Risikofaktor ist das Vorhandensein einer Migräne mit Aura. Dieser Risikofaktor ist laut einer Studie nach der arteriellen Hypertonie der zweitwichtigste Risikofaktor für Herzinfarkt und Schlaganfall. ⓘ
Auch eine Allergieneigung kann das Risiko für ein kardiales Ereignis erhöhen (Kounis-Syndrom). ⓘ
Epidemiologische Studien zur Wirtschaftskrise in Griechenland und zum Tropensturm Katrina in New Orleans zeigen auch, dass es nach Krisen vermehrt zu Herzinfarkten kommt. Dies könnte entweder an fehlenden Medikamenten oder posttraumatischem Stress liegen, dem die Menschen ausgesetzt sind. ⓘ
Auch der Wohnort könnte eine gewisse Rolle spielen. So zeigt eine neue europäische Kohortenstudie, dass eine Feinstaubbelastung bereits unterhalb der EU-Grenzwerte zu einem höheren Risiko für ein koronares Ereignis führt. ⓘ
An sehr kalten Tagen steigt die Zahl der Herzinfarkte. Starke Kälte belastet die Herzkranzgefäße, indem sich die Gefäße verengen und die Blutversorgung des Herzmuskels vermindern, der dadurch weniger Sauerstoff bekommt. Gleichzeitig werden auch die Widerstandsgefäße im übrigen Körper verengt – das hat einen Blutdruckanstieg zur Folge-, so dass das Herz gegen einen größeren Widerstand anpumpen muss. Darüber hinaus existieren erste Hinweise auf ähnliche Zusammenhänge zwischen der kälteren Jahreszeit und dem häufigeren Auftreten von Schlaganfällen, Lungenembolien und bestimmten Herzrhythmusstörungen. Andererseits gibt es aber auch kanadische Studien, die einen Zusammenhang zwischen zu warmen Nächten und dem Herzinfarkt belegen, besonders bei Männern. Zwei Drittel der Opfer in den besonders heißen Sommerphasen im Juni und Juli waren Männer. Mit jedem Grad wärmer in der Nacht stieg das Risiko eines tödlichen Herzinfarkts für die Männer um vier Prozent. ⓘ
Prävention
Die Empfehlungen der American Heart Association (AHA) von 2021 beinhalten folgende evidenzbasierte Richtlinien zur Ernährung:
- Energiezufuhr auf Verbrauch einstellen, um ein gesundes Körpergewicht zu erreichen und zu halten
- Viel Obst und Gemüse essen und eine bunte Vielzahl wählen
- Vollkornprodukte statt Weißmehlprodukten konsumieren
- Gesunde Formen von Eiweiß konsumieren:
- vorwiegend pflanzliches Eiweiß wählen (Hülsenfrüchte, Nüsse)
- Fisch und Meeresfrüchte
- fettarme Milchprodukte
- wenn Fleisch oder Geflügel gewünscht sind, fettarmes und unbearbeitetes Fleisch wählen
- flüssige Pflanzenöle bevorzugen gegenüber tropischen Ölen (Kokos, Palm, Palmkern), tierischen Fetten oder gehärteten Fetten
- Minimal verarbeitete Lebensmittel statt hoch verarbeitete Lebensmittel wählen
- Mahlzeiten mit keinem oder wenig Salz zubereiten
- Wer keinen Alkohol trinkt, sollte nicht damit anfangen, wer doch Alkohol trinkt, sollte den Konsum reduzieren
- Sich immer an diese Richtlinien halten, unabhängig davon, wo Lebensmittel zubereitet oder konsumiert werden ⓘ
Krankheitsbild
Klinische Zeichen
Die Befunde der körperlichen Untersuchung sind variabel, sie reichen vom Normalbefund eines unbeeinträchtigten Patienten bis hin zum bewusstlosen Patienten mit einem Herz-Kreislauf-Stillstand. Eindeutige klinische Zeichen des Herzinfarktes gibt es zwar nicht, typisch aber ist der Gesamteindruck eines schmerzgeplagten Patienten mit Blässe, ängstlich wirkendem Gesichtsausdruck, Erbrechen und Schweißneigung. ⓘ
Andere Befunde weisen bereits auf eingetretene Komplikationen hin:
- Pulsunregelmäßigkeiten auf die beim Infarkt häufigen Extrasystolen,
- Pulsbeschleunigung, beim Abhören (Auskultation) neben den zwei normalen ein dritter Herzton und Rasselgeräusche über der Lunge sowie Halsvenenstauung auf eine Pumpschwäche des Herzens (Herzinsuffizienz),
- Herzgeräusche auf eine Mitralklappeninsuffizienz, eine Herzbeutelentzündung (Perikarditis) oder eine Ventrikelruptur (Herzkammerriss) und
- Kollaps, Bewusstlosigkeit und Herz-Kreislaufstillstand auf schwerwiegende Rhythmusstörungen wie Kammerflimmern, ventrikuläre Tachykardien oder Asystolien. ⓘ
Technische Befunde
Laboruntersuchungen

Als sogenannte Biomarker werden Enzyme und andere Eiweiße bezeichnet, die von absterbenden Herzmuskelzellen freigesetzt werden. Sie sind im Blut nach einem Herzinfarkt in erhöhter Konzentration messbar. ⓘ
Die klassischen und bis Anfang der 1990er Jahre einzigen Biomarker sind die Creatin-Kinase (CK), deren Isoenzym CK-MB, die Aspartat-Aminotransferase (AST, meist noch als GOT abgekürzt) und die Lactatdehydrogenase (LDH). Hinzugekommen sind seither das Myoglobin und das Troponin (Troponin T und Troponin I, oft abgekürzt als „Trop“). Der neueste Biomarker ist die Glycogenphosphorylase BB (GPBB). Dieser Biomarker ist herzspezifisch und ein Frühmarker, findet derzeit (2013) klinisch aber keine Anwendung. ⓘ
Die Messung der Blutkonzentrationen dieser Biomarker wird meist in regelmäßigen Abständen wiederholt, da Anstieg, höchster Wert und Abfall der Konzentration Rückschlüsse auf den Zeitpunkt des Infarktbeginns, die Größe des Herzinfarktes und den Erfolg der Therapie erlauben. ⓘ
Bildgebende Verfahren
Die Ultraschalluntersuchung des Herzens (Echokardiografie) zeigt beim Herzinfarkt eine Wandbewegungsstörung im betroffenen Herzmuskelbereich. Da das Ausmaß dieser Wandbewegungsstörung für die Prognose des Patienten sehr wichtig ist, wird die Untersuchung bei fast allen Infarktpatienten durchgeführt. In der Akutphase liefert die Echokardiografie bei diagnostischen Unsicherheiten und Komplikationen wichtige Zusatzinformationen, weil sie hilft, die Pumpfunktion und evtl. Einrisse (Ruptur) des Herzmuskels, Schlussunfähigkeiten der Mitralklappe (Mitralklappeninsuffizienz) und Flüssigkeitsansammlungen im Herzbeutel (Perikarderguss) zuverlässig zu beurteilen. ⓘ
Die Gefäßdarstellung (Angiografie) der Herzkranzgefäße im Rahmen einer Herzkatheteruntersuchung erlaubt den direkten Nachweis von Verschlüssen und Verengungen. Sie wird entweder so früh wie möglich als Notfall-Untersuchung zur Vorbereitung einer PTCA (vgl. Reperfusionstherapie) oder im weiteren Verlauf bei Hinweisen auf fortbestehende Durchblutungsstörungen des Herzmuskels durchgeführt. Nachteilig kann die hohe Strahlenbelastung von bis zu 14,52 mSv sein. Das ist so viel wie bei 725 Röntgen-Thorax-Bildern. Jedes Jahr werden weltweit mehrere Milliarden Bilder mittels der Strahlentechnik angefertigt – ungefähr ein Drittel dieser Aufnahmen bei Patienten mit akutem Myokardinfarkt. Zwischen den Jahren 1980 und 2006 ist die jährliche Dosis um schätzungsweise 700 % angestiegen. ⓘ
Diagnostik
Differentialdiagnose
Wegen der möglicherweise weitreichenden Konsequenzen wurde die Verdachtsdiagnose Herzinfarkt früher oft gestellt, in der Akutsituation mussten dann die Differentialdiagnosen Pneumothorax, Lungenembolie, Aortendissektion, Lungenödem anderer Ursache, Herpes Zoster, Stress-Kardiomyopathie, Roemheld-Syndrom, Herzneurose oder auch Gallenkolik berücksichtigt werden. Nur bei etwa 32 % der Patienten mit Infarktverdacht fand sich tatsächlich ein Herzinfarkt. Heute wird der Begriff Infarkt bis zu seinem definitiven Nachweis meist vermieden und stattdessen vom akuten Koronarsyndrom gesprochen, um der häufigen diagnostischen Unsicherheit in den ersten Stunden Ausdruck zu verleihen. ⓘ
Auch die Infarktdiagnostik ist mit möglichen Fehlern behaftet: Bei einigen Patienten (in einer Untersuchung 0,8 %), vor allem bei älteren Patienten und solchen mit Diabetes mellitus, wird auch im Krankenhaus der Infarkt nicht richtig erkannt. ⓘ
Eine außergewöhnliche Verwechslung der Symptome wurden bei einem (eher seltenen) Fall des Verzehrs von Honig von der türkischen Schwarzmeerküste beobachtet (siehe dazu Honig#Giftstoffe in Honig und giftige Honigsorten). ⓘ
Therapie
Erste Hilfe
Die ersten Minuten und Stunden eines Herzinfarktes sind für den Patienten von entscheidender Bedeutung. ⓘ
Innerhalb der ersten Stunde (der sogenannten goldenen Stunde oder golden hour) bestehen gute Aussichten, den Gefäßverschluss durch eine Lysetherapie oder Herzkatheterbehandlung fast vollständig rückgängig zu machen. Daher steht die unverzügliche Alarmierung des Rettungsdienstes an erster Stelle der für Laien sinnvollen Maßnahmen. Die Deutsche Herzstiftung empfiehlt für diese Situation:
- Nicht warten.
- Rettungsdienst über die Rufnummer 112 (in Europa) oder eine andere örtliche Notrufnummer alarmieren und Verdacht auf Herzinfarkt äußern.
- Niemals selbst mit dem Auto in die Klinik fahren, wegen der Gefahr eines Zusammenbruchs während der Fahrt. ⓘ
Die Gefahr des Herzstillstandes durch Kammerflimmern ist in der ersten Stunde am größten. Nur durch eine rasch einsetzende Herz-Lungen-Wiederbelebung durch Ersthelfer und Rettungsdienst kann in diesem Fall der Tod oder schwere Schäden durch Sauerstoffunterversorgung des Gehirns verhindert werden. Durch eine Defibrillation durch medizinisches Fachpersonal oder mittels eines öffentlich zugänglichen automatisierten externen Defibrillators, der durch Laien bedient werden kann, besteht die Möglichkeit, dass das Kammerflimmern gestoppt wird und sich wieder ein stabiler Eigenrhythmus einstellt. ⓘ
Medizinische Erstversorgung
Das Rettungsfachpersonal des Rettungsdienstes konzentriert sich zunächst auf eine möglichst rasche Erkennung von Akutgefährdung und Komplikationen. Dazu gehört eine zügige klinische Untersuchung mit Blutdruckmessung und Auskultation (Abhören) von Herz und Lunge. Nur ein schnell angefertigtes Zwölf-Kanal-EKG lässt den ST-Hebungsinfarkt erkennen und erlaubt die Einleitung der dann dringlichen Lysetherapie oder Katheterbehandlung. Um Herzrhythmusstörungen sofort erkennen zu können, wird eine kontinuierliche EKG-Überwachung (Rhythmusmonitoring) begonnen und zur Medikamentengabe eine periphere Verweilkanüle angelegt. ⓘ
Die medikamentöse Therapie zielt in der Akutsituation auf eine möglichst optimale Sauerstoffversorgung des Herzens, die Schmerzbekämpfung und eine Vermeidung weiterer Blutgerinnselbildung. Verabreicht werden in der Regel Nitroglycerin-Spray oder -Kapseln sublingual und Morphinpräparate, Acetylsalicylsäure und Clopidogrel sowie Heparin intravenös. Sauerstoff (O2) wird nach den aktuellen Leitlinien der ERC nur noch bei niedriger Sauerstoffsättigung des Bluts verabreicht. Die generelle Gabe von Sauerstoff wird wegen seiner möglicherweise schädlichen Auswirkungen allerdings nicht mehr empfohlen. ⓘ
In speziellen Situationen und bei Komplikationen können weitere Medikamente erforderlich sein, zur Beruhigung (Sedierung) beispielsweise Benzodiazepine wie Diazepam oder Midazolam, bei vagaler Reaktion Atropin, bei Übelkeit oder Erbrechen Antiemetika (beispielsweise Metoclopramid), bei Tachykardie trotz Schmerzfreiheit und fehlenden Zeichen der Linksherzinsuffizienz Betablocker (beispielsweise Metoprolol) und bei kardiogenem Schock die Gabe von Katecholaminen. ⓘ
Weitere Behandlung
Im Krankenhaus werden Infarktpatienten wegen möglicher Herzrhythmusstörungen in der Akutphase auf einer Intensiv- oder Überwachungsstation behandelt, wo eine kontinuierliche EKG-Überwachung (Monitoring) möglich ist. Bei einem unkomplizierten Verlauf können sie oft bereits am Folgetag Schritt für Schritt mobilisiert und nach fünf bis acht Tagen entlassen werden. Patienten mit großen Infarkten, die zu einer Pumpschwäche (Herzinsuffizienz) des Herzmuskels geführt haben, benötigen manchmal bis zu drei Wochen, um die gewohnten Alltagsaktivitäten wiederaufnehmen zu können. ⓘ
Nach einem Herzinfarkt ist bei den meisten Patienten eine lebenslange medikamentöse Therapie sinnvoll, die Komplikationen wie Herzrhythmusstörungen und Herzmuskelschwäche sowie erneuten Herzinfarkten vorbeugt. Dazu zählt die Therapie mit Betablockern, ASS, Statinen, ACE-Hemmern und bei einigen Patienten Clopidogrel oder Prasugrel. In der Realität zeigt sich allerdings, dass die medikamentöse Therapie oft nicht leitliniengerecht umgesetzt wird und eine deutliche Unterversorgung der betroffenen Patienten besteht. ⓘ
Bei stark eingeschränkter Pumpfunktion des Herzens wird die prophylaktische Anlage eines implantierbaren Defibrillators zum Schutz vor plötzlichem Herztod empfohlen. ⓘ
Nach dem Auftreten von großen Vorderwandinfarkten kann es (< 50 %) zur Thrombenbildung in der linken Schlagkammer kommen, die die Gefahr eines Hirninfarktes nach sich ziehen können. Sollten sich echokardiografisch Thromben nachweisen lassen, wird meist eine mehrmonatige Antikoagulantientherapie mit Phenprocoumon durchgeführt. ⓘ
Besondere Aufmerksamkeit erfordern die Risikofaktoren, die die Lebenserwartung der Infarktpatienten erheblich beeinträchtigen können. Vorteilhaft sind strikter Nikotinverzicht und eine optimale Einstellung von Blutdruck, Blutzucker und Blutfettwerten. Neben der Normalisierung des Lebenswandels, dem Stressabbau und der Gewichtsnormalisierung spielen eine gesunde Ernährung und regelmäßiges körperliches Ausdauertraining nach ärztlicher Empfehlung dabei eine wesentliche Rolle. ⓘ
Im Anschluss an die Krankenhausbehandlung wird in Deutschland oft eine ambulante oder stationäre Anschlussheilbehandlung empfohlen. Diese meist drei Wochen dauernde Maßnahme soll durch Krankengymnastik (Physiotherapie), dosiertes körperliches Training, Schulungsmaßnahmen und psychosoziale Betreuung eine möglichst gute und vollständige Wiedereingliederung in den Alltag ermöglichen. Zur dauerhaften Lebensstilveränderung kann der Besuch einer Herzschule sinnvoll sein. ⓘ
Weitere Therapie der koronaren Herzerkrankung mit Koronararterien-Bypass oder PTCA
Um weiteren Infarkten vorzubeugen, ist eine definitive Versorgung der (oftmals mehreren) kritischen Stenosen mittels Stentimplantation oder Koronararterien-Bypass notwendig. Die aktuellen Leitlinien der Europäischen kardiologischen Gesellschaft zur Revaskularisierung geben für Patienten mit hohem Operationsrisiko und einer oder zwei betroffenen Koronararterien ohne Beteiligung des linkskoronaren Hauptstamms (oder einer äquivalenten proximalen Stenose des Ramus interventrikularis anterior) die Empfehlung, bevorzugt mittels PTCA zu behandeln. Für alle anderen Patienten gilt eine höhergradige Empfehlung zur operativen Versorgung mit Koronararterien-Bypässen. Es wird ein insbesondere hinsichtlich der Begleiterkrankungen (wie hämodynamisch relevantes Aneurysma, thorakale Re-Operation) ein auf den individuellen Patienten zugeschnittenes Prozedere propagiert. Die Therapieplanung und Beratung des Patienten sollte hierbei durch ein „Heart Team“ erfolgen, also eine interdisziplinäre Zusammenkunft von Kardiologen und Herzchirurgen. Dies ist in der täglichen Praxis in Deutschland erfahrungsgemäß jedoch eher die Ausnahme. ⓘ
Experimentelle Ansätze
Seit den 1990er Jahren werden Versuche unternommen, die Pumpfunktion des Herzmuskels nach einem Herzinfarkt durch Stammzellen positiv zu beeinflussen. Dabei werden verschiedene Techniken eingesetzt, unter anderem die Injektion von Stammzellen, die aus Blut oder Knochenmark gewonnen werden, in das betroffene Herzkranzgefäß (intrakoronar, mittels Herzkatheter). Auch die subkutane Injektion von granulocyte-colony stimulating factor (G-CSF), der die Stammzellproduktion fördert, wird untersucht. Mehrere in den Jahren 2004 bis 2006 veröffentlichte Studien weisen darauf hin, dass die intrakoronare Anwendung von Knochenmark-Stammzellen die Pumpfunktion tatsächlich verbessern kann, die alleinige Gabe von G-CSF hingegen keinen Vorteil bringt. Eine Studie aus dem Jahr 2012 hat jedoch keinen positiven Effekt festgestellt. Ein weiterer, in jüngerer Zeit in präklinischen Studien verfolgter Therapieansatz ist der Einsatz von Wachstumsfaktoren wie Fibroblast-like Growth Factor (FGF-1), Insuline-like Growth Factors (IGFs) und Vascular Endothelial Growth Factor (VEGF), die die Gefäßneubildung (Angiogenese) anregen. ⓘ
Krankheitsverlauf und Prognose
Die ersten beiden Stunden nach Eintritt eines Herzinfarktes sind zumindest bei einem ST-Hebungsinfarkt (STEMI) für den weiteren Verlauf und die Überlebenschance des Patienten von entscheidender Bedeutung, weil
- sich die Mehrzahl der Todesfälle, die in der Regel durch Kammerflimmern verursacht sind, in diesem kurzen Zeitraum ereignet und
- eine während dieser Zeit eingeleitete Reperfusionstherapie die Prognose maßgeblich beeinflusst. ⓘ
Die Akutsterblichkeit jener Patienten, die im Krankenhaus aufgenommen werden, beträgt heute nach verschiedenen Untersuchungen zwischen weniger als zehn und knapp zwölf Prozent. Weiterhin stirbt aber fast ein Drittel aller Patienten vor Aufnahme in eine Klinik, so dass die Einjahressterblichkeit aller Infarktpatienten in den letzten 30 Jahren nahezu unverändert bei etwa 50 % verblieben ist. ⓘ
Die Sterblichkeit im Zusammenhang mit einem Herzinfarkt wird vom Alter des Patienten stark beeinflusst. Aus dem Berliner Herzinfarktregister wurde für die Jahre 1999 bis 2003 bei über 75-Jährigen eine Krankenhaussterblichkeit von 23,9 %, bei jüngeren Patienten von 7,3 % ermittelt. Insgesamt ist die Rate an Sterbefällen nach Herzinfarkten jedoch stark abgesunken, wie eine epidemiologische Studie mit Daten der WHO zeigte. So haben sich die Herzinfarkt-Sterbefälle seit 1980 in Europa halbiert. In Deutschland lag sie 2009 bei 15–17 %, in Österreich bei 19–20 %, in Frankreich bei 6–8 %. ⓘ
Infarkte bei älteren Menschen
| ≤ 75 Jahre | > 75 Jahre | |
|---|---|---|
| Herzversagen | 3,5 % | 14,4 % |
| Niereninsuffizienz | 3,9 % | 11,5 % |
| Diabetes mellitus | 24,3 % | 37,3 % |
| Lungenstauung | 19,7 % | 45,4 % |
| Linksschenkelblock | 3,6 % | 12,7 % |
In den europäischen Ländern betreffen etwa ein Drittel (24 bis 42 %) aller Infarkte Menschen im Alter von über 74 Jahren. Dieser Anteil wird aufgrund der demografischen Entwicklung mit der Zeit zunehmen. Schätzungen zufolge soll der Anteil über 75-Jähriger im Jahr 2050 bereits zwei Drittel betragen. ⓘ
Ältere Infarktpatienten leiden häufiger an bedeutsamen Begleiterkrankungen wie Herzversagen, Niereninsuffizienz und Diabetes mellitus (Zuckerkrankheit). Bei ihnen werden öfter Zeichen eines schweren Infarktes wie Lungenstauung und Linksschenkelblock festgestellt. Die Zeit zwischen Symptombeginn und Aufnahme im Krankenhaus ist bei ihnen länger und gemessen am Einsatz der Reperfusionstherapie sowie der Anwendung von Betablockern und Statinen kommt eine leitliniengerechte Therapie seltener zur Anwendung. ⓘ
Zusätzlich erhöhen kardiale Erkrankungen, wie der Herzinfarkt, auch das Risiko für kognitive Probleme. Vor allem Frauen mit Herzerkrankungen leiden im Alter öfter an einer leichten nicht-amnestischen kognitiven Beeinträchtigung (Wortfindungsstörungen, Aufmerksamkeitsprobleme, Desorientierung usw.). ⓘ
Geschichte
Von den Anfängen bis 1950
Seit dem Beginn des 19. Jahrhunderts ist bekannt, dass eine Thrombose im Herzkranzgefäß zum Tode führen kann. Tierexperimente mit Unterbindung eines Kranzgefäßes und Sektionsbefunde legten nahe, dass die Koronarthrombose ein fatales Ereignis darstellte. Im Mai 1876 diagnostizierte Adam Hammer in Wien als Erster den Herzinfarkt an einem lebenden Menschen. 1901 wies der Deutsche Ludolf von Krehl nach, dass sie nicht immer tödlich ausging, die erste ausführliche Beschreibung nicht-tödlicher Herzinfarkte stammt von den Russen V. P. Obraztsov und N. D. Strazhesko aus dem Jahr 1910. ⓘ
1912 bezog sich der US-Amerikaner James B. Herrick auf diese Veröffentlichung und führte körperliche Ruhe als Therapieprinzip für Infarktpatienten ein. Sie blieb bis in die frühen 1950er Jahre einzige Behandlungsmöglichkeit und wurde konsequent betrieben: Die Patienten durften sich zwei Wochen nicht bewegen und sollten deshalb auch gefüttert werden. Herrick war es auch, der die 1903 vom Holländer Einthoven entwickelte Elektrokardiografie zur Diagnostik des Herzinfarktes einführte. ⓘ
1923 veröffentlichte Wearn die Beschreibung des Krankheitsverlaufes von 19 Patienten mit Herzinfarkt, denen absolute Bettruhe und eine Beschränkung der Flüssigkeitszufuhr verordnet wurden. Sie erhielten Digitalispräparate gegen eine Lungenstauung sowie Koffein und Campher zur Vorbeugung und Behandlung von erniedrigtem Blutdruck, Synkopen und Herzrhythmusstörungen. 1928 beschrieben Parkinson und Bedford ihre Erfahrungen mit der Schmerzbehandlung durch Morphin bei 100 Infarktpatienten, Nitrate hielten sie wegen der blutdrucksenkenden Wirkung für kontraindiziert. ⓘ
1929 veröffentlichte Samuel A. Levine das erste ausschließlich der Infarktbehandlung gewidmete Fachbuch, in dem unter anderem auf die Bedeutung der Herzrhythmusstörungen eingegangen und Chinidin gegen ventrikuläre Tachykardien und Adrenalin gegen Blockierungen empfohlen wurde. ⓘ
In den 1950er Jahren wurde der Herzinfarkt bereits als wichtige Todesursache in den Industrieländern angesehen. Wegen der hohen Gefährdung durch Thrombosen und Lungenembolien auf Grund der langen Bettruhe gewann das von Bernard Lown propagierte Konzept einer früheren Mobilisierung (arm chair treatment) an Bedeutung. Großzügige Flüssigkeitszufuhr und regelmäßige Sauerstoffgabe wurden empfohlen. ⓘ
Die „Thrombolyse-Ära“
Bereits 1948 wurde empfohlen, nach einem überstandenen Herzinfarkt vorbeugend Cumarine als Antikoagulanzien einzunehmen. Hauptsächlich Fletcher und Verstraete wiesen in den 1950er und 1960er Jahren experimentell nach, dass frische Koronarthrombosen medikamentös aufgelöst werden können. 1959 brachten die deutschen Behring-Werke Streptokinase auf den Markt, das unter anderem die Lysetherapie beim akuten Herzinfarkt ermöglichte. In den 1970er Jahren waren es dann zwei Arbeitsgruppen um Jewgeni Tschasow und Klaus Peter Rentrop, die den Nachweis einer erfolgreichen Lysetherapie durch intrakoronare Infusion von Streptokinase führten. Ihre Ergebnisse wurden unterstützt durch Befunde von De Wood, der bei 90 % der Patienten mit ST-Strecken-Hebung okkludierende (das Gefäßlumen verschließende) Koronarthromben nachwies. Anfang der 1980er Jahre wurde deutlich, dass eine intravenöse Infusion der intrakoronaren gleichwertig war, was die Verbreitung der Methode sehr förderte. ⓘ
1986 wurde die als GISSI-Studie bezeichnete erste randomisierte klinische Studie zur Lysetherapie veröffentlicht, die an 11.806 Patienten durchgeführt wurde und eine Senkung der 21-Tage-Sterblichkeit von 13 auf 10,7 % nachwies, was einem geretteten Menschenleben pro 43 Behandlungen entsprach. ⓘ
Weiterentwicklung der Therapie
1960 veröffentlichte die American Heart Association die Framingham-Studie, die den Zusammenhang zwischen dem Rauchen und dem Auftreten von Herzinfarkten bewies. Mitte der 1990er Jahre wurde die erst 1977 von Andreas Grüntzig eingeführte Ballondilatation der Herzkranzgefäße als Therapieoption auch beim akuten Herzinfarkt in größerem Umfang eingesetzt. Heute ist dies die Behandlung der Wahl und wird in Deutschland bei mehr als 200.000 Patienten jährlich angewandt. ⓘ
Myokardinfarkt bei Tieren
Anders als beim Menschen wird der Herzmuskelinfarkt bei Tieren nur selten beobachtet. Zudem sind bei Haussäugetieren, im Gegensatz zur meist nichtinfektiösen Genese beim Menschen, vor allem infektiös bedingte Endokarditiden der Mitralklappe mit Abschwemmung von Thromben in die Herzkranzgefäße Auslöser eines Myokardinfarkts. ⓘ
Bei Tieren, die auch in menschlicher Obhut ein hohes Alter erreichen, wie etwa Haushunden, Papageien und Zootieren (z. B. Pazifisches Walross), sind auch vereinzelt Myokardinfarkte infolge atherosklerotischer Veränderungen wie beim Menschen beschrieben. Beim Hund wird auch eine verminderte Sauerstoffversorgung des Herzmuskels infolge einer Amyloidose kleiner Herzarterien beobachtet. Diese – in der Regel kleinen – Infarkte bleiben klinisch zumeist unbemerkt und werden als Zufallsbefunde bei pathologischen Untersuchungen relativ häufig als lokale Vernarbungen des Herzmuskels gefunden. Bei Katzen scheinen Infarkte vor allem als Komplikation bereits bestehender Herzmuskelerkrankungen (Hypertrophe Kardiomyopathie) aufzutreten. ⓘ
Die erhöhte Anfälligkeit des Herzmuskels von Schweinen auf Stress ist dagegen nicht auf eine Mangeldurchblutung zurückzuführen, sondern beruht auf einer massiven und unkontrollierten Calciumfreisetzung innerhalb der Muskelzelle mit Muskeluntergang (Porcine stress syndrome). ⓘ

