Heparin
| Strukturformel ⓘ | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Darstellung eines Ausschnitts aus der Struktur von Heparin | |||||||||
| Allgemeines | |||||||||
| Name | Heparin | ||||||||
| Andere Namen |
| ||||||||
| CAS-Nummer |
| ||||||||
| Monomere/Teilstrukturen | abwechselnd D-Glucosamin und D-Glucuronsäure oder L-Iduronsäure | ||||||||
| PubChem | 772 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB01109 | ||||||||
| Kurzbeschreibung |
weißes bis graues, amorphes und hygroskopisches Pulver (Heparin-Natrium) | ||||||||
| Arzneistoffangaben | |||||||||
| Wirkstoffklasse | |||||||||
| Wirkmechanismus |
Antithrombin | ||||||||
| Eigenschaften | |||||||||
| Löslichkeit |
leicht löslich in Wasser und Salzlösung, praktisch unlöslich in Ethanol, Aceton, Benzol und Diethylether (Heparin-Natrium) | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten |
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Heparine (zu altgriechisch ἧπαρ Hepar „Leber“) sind körpereigene Vielfachzucker (Polysaccharide), die hemmend auf die Gerinnungskaskade wirken und daher auch therapeutisch zur Antikoagulation (Blutgerinnungshemmung) verwendet werden. Chemisch gesehen handelt es sich bei diesen Polyelektrolyten um Glykosaminoglykane, bestehend aus einer variablen Anzahl von Aminozuckern mit einer molaren Masse zwischen 4.000 und 40.000 (Häufigkeitsgipfel etwa 15.000). Natürliche Heparine werden am ergiebigsten aus Dünndarmmukosa vom Schwein extrahiert. Die Gewinnung aus Rinderlungen wird seit der BSE-Epidemie nicht mehr praktiziert. Heparin wird nicht über den Magen-Darm-Trakt aufgenommen und wird deshalb parenteral verabreicht, das heißt, je nach Anwendungsbereich als Spritze oder als kontinuierliche Infusion. Zur äußeren Anwendung werden Heparin-Zubereitungen als Gel oder Salbe zur unterstützenden Behandlung bei akuten Schwellungszuständen nach stumpfen Verletzungen (Blutergüssen) angeboten, obwohl Heparin aufgrund seiner physikochemischen Eigenschaften die Haut nicht nachweisbar durchdringen und daher nicht wirksam resorbiert werden kann. ⓘ
Die gerinnungshemmende Wirkung beruht darauf, dass im Blut Antithrombin III zirkuliert, ein Proteaseinhibitor, der aktivierte Gerinnungsfaktoren wie Thrombin und Faktor Xa hemmt. Heparin bindet an Antithrombin III, wodurch die Bindung an die Gerinnungsfaktoren etwa tausendfach schneller abläuft. ⓘ
Heparin wird angewandt zur Prophylaxe sowie Therapie von Thrombosen und um das Gerinnen von Blutproben zu vermeiden. ⓘ
Seine Dosis wird nicht in Gramm angegeben, sondern in Internationalen Einheiten (IE): Eine Einheit verhindert die Gerinnung von 1 ml citrathaltigem Plasma nach Zugabe von CaCl2 bei 37 °C über eine Stunde. ⓘ
 | |
| Klinische Daten | |
|---|---|
| Aussprache | /ˈhɛpərɪn/ HEP-ər-in |
| AHFS/Drugs.com | Monographie |
| Lizenz-Daten |
|
| Wege der Verabreichung | Intravenöse Therapie, subkutane Injektion |
| ATC-Code |
|
| Rechtlicher Status | |
| Rechtlicher Status |
|
| Pharmakokinetische Daten | |
| Bioverfügbarkeit | Erratisch |
| Verstoffwechselung | Leber |
| Eliminationshalbwertszeit | 1,5 Stunden |
| Ausscheidung | Urin |
| Bezeichner | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| Chemische und physikalische Daten | |
| Formel | C12H19NO20S3 |
| Molare Masse | 593,45 g-mol-1 |
InChI
| |
| | |
Heparin, auch bekannt als unfraktioniertes Heparin (UFH), ist ein Medikament und natürlich vorkommendes Glykosaminoglykan. Da Heparine von der Aktivität des Antithrombins abhängen, gelten sie als Antikoagulanzien. Insbesondere wird es auch zur Behandlung von Herzinfarkten und instabiler Angina pectoris eingesetzt. Es wird durch Injektion in eine Vene oder unter die Haut verabreicht. Außerdem wird es in Reagenzgläsern und Nierendialysegeräten verwendet. ⓘ
Zu den häufigen Nebenwirkungen gehören Blutungen, Schmerzen an der Injektionsstelle und niedrige Blutplättchen. Zu den schwerwiegenden Nebenwirkungen gehört die Heparin-induzierte Thrombozytopenie. Bei Personen mit schlechter Nierenfunktion ist erhöhte Vorsicht geboten. ⓘ
Heparin ist bei Verdacht auf impfstoffinduzierte prothrombotische Immunthrombozytopenie (VIPIT) als Folge der SARS-CoV-2-Impfung kontraindiziert, da Heparin das Blutungsrisiko durch eine Anti-PF4/Heparin-Komplex-Autoimmunerkrankung weiter erhöhen kann, so dass alternative gerinnungshemmende Medikamente (wie Argatroban oder Danaparoid) vorzuziehen sind. ⓘ
Die Anwendung von Heparin während der Schwangerschaft und Stillzeit scheint relativ sicher zu sein. Heparin wird von Basophilen und Mastzellen in allen Säugetieren produziert. ⓘ
Die Entdeckung von Heparin wurde im Jahr 1916 bekannt gegeben. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation. Eine fraktionierte Version von Heparin, bekannt als niedermolekulares Heparin, ist ebenfalls erhältlich. ⓘ
Geschichte
Heparin wurde 1916 von Jay McLean und William Henry Howell entdeckt, obwohl es erst 1935 in die klinische Erprobung kam. Ursprünglich wurde es aus Hundeleberzellen isoliert, daher sein Name (hepar oder "ήπαρ" ist griechisch für "Leber"; hepar + -in). ⓘ
McLean war Medizinstudent im zweiten Jahr an der Johns Hopkins University und untersuchte unter der Leitung von Howell gerinnungsfördernde Präparate, als er ein fettlösliches Phosphatid-Antikoagulans in Hundelebergewebe isolierte. Im Jahr 1918 prägte Howell den Begriff "Heparin" für diese Art von fettlöslichem Gerinnungshemmer. Anfang der 1920er Jahre isolierte Howell ein wasserlösliches Polysaccharid-Antikoagulans, das er ebenfalls als "Heparin" bezeichnete, obwohl es sich von den zuvor entdeckten Phosphatidpräparaten unterschied. McLeans Arbeit als Chirurg änderte wahrscheinlich den Schwerpunkt der Howell-Gruppe auf die Suche nach gerinnungshemmenden Substanzen, was schließlich zur Entdeckung der Polysaccharide führte. ⓘ
In den 1930er Jahren beschäftigten sich mehrere Forscher mit Heparin. Erik Jorpes vom Karolinska Institutet veröffentlichte 1935 seine Forschungsergebnisse über die Struktur von Heparin, die es dem schwedischen Unternehmen Vitrum AB ermöglichten, 1936 das erste Heparinprodukt zur intravenösen Anwendung auf den Markt zu bringen. Zwischen 1933 und 1936 perfektionierten die Connaught Medical Research Laboratories, die damals zur Universität von Toronto gehörten, eine Technik zur Herstellung von sicherem, ungiftigem Heparin, das den Patienten in einer Kochsalzlösung verabreicht werden konnte. Die ersten Versuche mit Heparin am Menschen begannen im Mai 1935, und 1937 war klar, dass das Heparin von Connaught sicher, leicht verfügbar und als Blutgerinnungshemmer wirksam war. Vor 1933 war Heparin nur in geringen Mengen erhältlich, extrem teuer und giftig und daher von keinerlei medizinischem Wert. ⓘ
Die Heparinproduktion erfuhr in den 1990er Jahren eine Zäsur. Bis dahin wurde Heparin hauptsächlich aus Rindergewebe gewonnen, das vor allem in Nordamerika als Nebenprodukt der Fleischindustrie anfiel. Mit der raschen Verbreitung von BSE gaben immer mehr Hersteller diese Bezugsquelle auf. Infolgedessen konzentrierte sich die weltweite Heparinproduktion zunehmend in China, wo die Substanz nun aus der expandierenden Industrie der Schweinezucht und -schlachtung bezogen wurde. Die Abhängigkeit der medizinischen Versorgung von der Fleischindustrie nahm im Zuge der COVID-19-Pandemie bedrohliche Ausmaße an. Im Jahr 2020 belegten mehrere Studien die Wirksamkeit von Heparin bei der Milderung des schweren Krankheitsverlaufs, da seine gerinnungshemmende Wirkung der Bildung von Immunthrombosen entgegenwirkte. Allerdings war die Verfügbarkeit von Heparin auf dem Weltmarkt eingeschränkt, da gleichzeitig eine erneute Schweinegrippe-Epidemie erhebliche Teile des chinesischen Schweinebestands dezimiert hatte. Die Situation wurde noch dadurch verschärft, dass Massenschlachthöfe auf der ganzen Welt selbst zu Korona-Hotspots wurden und vorübergehend geschlossen werden mussten. In weniger wohlhabenden Ländern führte der daraus resultierende Heparinmangel auch zu einer Verschlechterung der Gesundheitsversorgung über die Behandlung von Covid hinaus, z. B. durch die Absage von Herzoperationen. ⓘ
Medizinische Verwendung
Heparin wirkt als Gerinnungshemmer und verhindert die Bildung von Blutgerinnseln und die Ausdehnung bestehender Gerinnsel im Blut. Während Heparin selbst keine bereits gebildeten Gerinnsel auflöst (im Gegensatz zum Gewebeplasminogenaktivator), ermöglicht es den natürlichen Gerinnselauflösungsmechanismen des Körpers, normal zu arbeiten, um bereits gebildete Gerinnsel aufzulösen. Heparin wird im Allgemeinen zur Antikoagulation bei folgenden Erkrankungen eingesetzt:
- Akutes Koronarsyndrom, z. B. NSTEMI
- Vorhofflimmern
- Tiefe Venenthrombose und Lungenembolie
- Kardiopulmonaler Bypass für Herzoperationen
- ECMO-Kreislauf zur extrakorporalen Lebenserhaltung
- Hämofiltration
- Verweilende zentrale oder periphere Venenkatheter
Heparin und seine niedermolekularen Derivate (z. B. Enoxaparin, Dalteparin, Tinzaparin) sind wirksam bei der Vorbeugung von tiefen Venenthrombosen und Lungenembolien bei Risikopersonen, aber es gibt keine Hinweise darauf, dass eines von ihnen bei der Vorbeugung von Todesfällen wirksamer ist als ein anderes. ⓘ
Bei der Angiographie werden 2 bis 5 Einheiten/ml unfraktionierte Heparin-Kochsalzlösung verwendet, um die Gerinnung von Blut in Führungsdrähten, Schleusen und Kathetern zu verhindern und damit zu verhindern, dass sich Thromben aus diesen Geräten in den Blutkreislauf lösen. ⓘ
Unfraktioniertes Heparin wird bei der Hämodialyse verwendet. Im Vergleich zu niedermolekularem Heparin hat unfraktioniertes Heparin keine längere Antikoagulationswirkung nach der Dialyse und ist kostengünstig. Die kurze Wirkungsdauer von Heparin würde jedoch eine kontinuierliche Infusion erfordern, um die Wirkung aufrechtzuerhalten. Außerdem besteht bei unfraktioniertem Heparin ein höheres Risiko einer Heparin-induzierten Thrombozytopenie. ⓘ
Unerwünschte Wirkungen
Eine schwerwiegende Nebenwirkung von Heparin ist die heparininduzierte Thrombozytopenie (HIT), die durch eine immunologische Reaktion verursacht wird, die die Thrombozyten zum Ziel einer immunologischen Reaktion macht, was zum Abbau der Thrombozyten und damit zur Thrombozytopenie führt. Dieser Zustand kehrt sich in der Regel nach Absetzen der Medikamente um und kann im Allgemeinen durch die Verwendung synthetischer Heparine vermieden werden. Auch eine gutartige Form der Thrombozytopenie wird mit einer frühen Heparineinnahme in Verbindung gebracht, die sich ohne Absetzen des Heparins auflöst. ⓘ
Es sind zwei nicht-hämorrhagische Nebenwirkungen der Heparinbehandlung bekannt. Die erste ist eine Erhöhung der Serum-Aminotransferase-Werte, die bei bis zu 80 % der mit Heparin behandelten Patienten festgestellt wurde. Diese Anomalie ist nicht mit einer Leberfunktionsstörung verbunden und verschwindet nach Absetzen des Medikaments. Die andere Komplikation ist die Hyperkaliämie, die bei 5 bis 10 % der Heparin-Patienten auftritt und auf eine heparininduzierte Aldosteronsuppression zurückzuführen ist. Die Hyperkaliämie kann innerhalb weniger Tage nach Beginn der Heparintherapie auftreten. Seltener können bei chronischer Einnahme die Nebenwirkungen Alopezie und Osteoporose auftreten. ⓘ
Wie bei vielen Arzneimitteln kann eine Überdosierung von Heparin tödlich sein. Im September 2006 erlangte Heparin weltweite Aufmerksamkeit, als drei Frühgeborene starben, nachdem ihnen in einem Krankenhaus in Indianapolis irrtümlich eine Überdosis Heparin verabreicht worden war. ⓘ
Die Hauptnebenwirkung von Heparin sind Blutungen. Das Risiko ist dosisabhängig und steigt mit gleichzeitiger Anwendung anderer die Blutgerinnung hemmender Medikamente. Als Gegenmittel kann Protamin intravenös verabreicht werden. Heparin kann als Nebenwirkung eine Heparin-induzierte Thrombozytopenie auslösen. Dabei kann es durch Antikörper gegen Heparin sowohl zu lebensgefährlichen Blutungen als auch Blutgerinnselbildungen kommen. Eine Behandlung länger als vier Wochen kann eine messbare Verminderung der Knochendichte auslösen. Bis zu 2–3 % der Patienten unter Langzeitbehandlung mit Heparin erleiden osteoporotische Wirbelkörperfrakturen. Ebenso sind reversible Erhöhungen der Transaminasen häufig. Niedermolekulare Heparine weisen eine geringere Häufigkeit dieser Nebenwirkungen auf. Sie haben jedoch gegenüber dem längerkettigen Heparin aufgrund ihrer geringeren Wirkung auf die Deaktivierung von Thrombin einen geringeren therapeutischen Effekt. ⓘ
Kontraindikationen
Heparin ist kontraindiziert bei Personen mit Blutungsrisiko (insbesondere bei Menschen mit unkontrolliertem Blutdruck, Lebererkrankungen und Schlaganfall), schweren Lebererkrankungen oder schwerem Bluthochdruck. ⓘ
Gegengift für Heparin
Protaminsulfat wurde verabreicht, um der gerinnungshemmenden Wirkung von Heparin entgegenzuwirken (1 mg pro 100 Einheiten Heparin, die in den letzten 6 Stunden verabreicht wurden). Es kann bei Überdosierung von Heparin oder zur Umkehrung der Wirkung von Heparin eingesetzt werden, wenn es nicht mehr benötigt wird. ⓘ
Physiologische Funktion
Die normale Rolle von Heparin im Körper ist unklar. Heparin wird in der Regel in den sekretorischen Granula von Mastzellen gespeichert und nur bei Gewebeverletzungen in die Blutgefäße freigesetzt. Es wurde vorgeschlagen, dass der Hauptzweck von Heparin nicht in der Antikoagulation, sondern in der Abwehr von eindringenden Bakterien und anderen Fremdkörpern an solchen Stellen besteht. Darüber hinaus wird Heparin in einer Reihe von sehr unterschiedlichen Spezies beobachtet, einschließlich einiger wirbelloser Tiere, die kein ähnliches Blutgerinnungssystem haben. Es handelt sich um ein stark sulfatiertes Glykosaminoglykan. Es hat die höchste negative Ladungsdichte aller bekannten biologischen Moleküle. ⓘ
Evolutionäre Erhaltung
Neben dem Gewebe von Rindern und Schweinen, aus denen Heparin in pharmazeutischer Qualität üblicherweise gewonnen wird, wurde es auch aus folgenden Tieren extrahiert und charakterisiert:
- Truthahn
- Walfisch
- Dromedar-Kamel
- Maus
- Mensch
- Hummer
- Süßwassermuschel
- Venusmuschel
- Krabbe
- Mangrove-Krabbe
- Sanddollar
- Atlantischer Lachs
- Zebrafisch
Die biologische Aktivität von Heparin bei den Arten 6-11 ist unklar und untermauert den Gedanken, dass die wichtigste physiologische Funktion von Heparin nicht die Gerinnungshemmung ist. Diese Arten verfügen über kein Blutgerinnungssystem, das dem der unter 1-5 aufgeführten Arten ähnelt. Die obige Liste zeigt auch, dass Heparin in hohem Maße evolutionär konserviert ist, wobei Moleküle mit ähnlicher Struktur von einer Vielzahl von Organismen aus vielen verschiedenen Phyla produziert werden. ⓘ
Pharmakologie
In der Natur ist Heparin ein Polymer mit unterschiedlicher Kettengröße. Unfraktioniertes Heparin (UFH) als Arzneimittel ist Heparin, das nicht fraktioniert wurde, um den Anteil der Moleküle mit niedrigem Molekulargewicht abzusondern. Im Gegensatz dazu wurde niedermolekulares Heparin (LMWH) fraktioniert, um seine Pharmakodynamik besser vorhersagbar zu machen. Häufig kann entweder UFH oder LMWH verwendet werden; in manchen Situationen ist das eine oder das andere vorzuziehen. ⓘ
Wirkmechanismus
Heparin bindet an den Enzyminhibitor Antithrombin III (AT) und bewirkt eine Konformationsänderung, die zu seiner Aktivierung führt, indem die Flexibilität der Schleife der reaktiven Stelle erhöht wird. Das aktivierte AT inaktiviert dann Thrombin, Faktor Xa und andere Proteasen. Die Rate der Inaktivierung dieser Proteasen durch AT kann sich durch die Bindung von Heparin um das bis zu 1000-fache erhöhen. Heparin bindet an AT über eine spezifische Pentasaccharid-Sulfatierungssequenz, die im Heparinpolymer enthalten ist:
- GlcNAc/NS(6S)-GlcA-GlcNS(3S,6S)-IdoA(2S)-GlcNS(6S) ⓘ
Die Konformationsänderung von AT bei der Heparinbindung vermittelt seine Hemmung von Faktor Xa. Für die Thrombinhemmung muss Thrombin jedoch auch an das Heparinpolymer an einer Stelle proximal zum Pentasaccharid binden. Die hohe negative Ladungsdichte von Heparin trägt zu seiner sehr starken elektrostatischen Wechselwirkung mit Thrombin bei. Die Bildung eines ternären Komplexes zwischen AT, Thrombin und Heparin führt zur Inaktivierung von Thrombin. Aus diesem Grund ist die Aktivität von Heparin gegen Thrombin größenabhängig, wobei der ternäre Komplex mindestens 18 Saccharideinheiten für eine effiziente Bildung benötigt. Im Gegensatz dazu erfordert die Antifaktor-Xa-Aktivität über AT nur die Pentasaccharid-Bindungsstelle. ⓘ
Dieser Größenunterschied hat zur Entwicklung von niedermolekularen Heparinen (LMWHs) und Fondaparinux als Antikoagulanzien geführt. Fondaparinux zielt eher auf die Anti-Faktor-Xa-Aktivität als auf die Hemmung der Thrombinaktivität ab, um eine subtilere Regulierung der Gerinnung und einen besseren therapeutischen Index zu ermöglichen. Es handelt sich um ein synthetisches Pentasaccharid, dessen chemische Struktur nahezu identisch ist mit der AT-bindenden Pentasaccharidsequenz, die in polymerem Heparin und Heparansulfat zu finden ist. ⓘ
Mit LMWH und Fondaparinux wird das Risiko einer Osteoporose und einer Heparin-induzierten Thrombozytopenie (HIT) verringert. Die Überwachung der aktivierten partiellen Thromboplastinzeit ist ebenfalls nicht erforderlich und spiegelt nicht die gerinnungshemmende Wirkung wider, da die APTT unempfindlich gegenüber Veränderungen des Faktors Xa ist. ⓘ
Danaparoid, eine Mischung aus Heparansulfat, Dermatansulfat und Chondroitinsulfat, kann als Antikoagulans bei Patienten mit HIT eingesetzt werden. Da Danaparoid kein Heparin oder Heparinfragmente enthält, wird die Kreuzreaktivität von Danaparoid mit Heparin-induzierten Antikörpern mit weniger als 10 % angegeben. ⓘ
Die Wirkung von Heparin wird im Labor anhand der partiellen Thromboplastinzeit (aPTT) gemessen, einer der Messgrößen für die Zeit, die das Blutplasma zur Gerinnung benötigt. Die partielle Thromboplastinzeit sollte nicht mit der Prothrombinzeit (PT) verwechselt werden, die die Blutgerinnungszeit über einen anderen Weg der Gerinnungskaskade misst. ⓘ
Sowohl NMH als auch UFH binden Antithrombine, vor allem Antithrombin III (AT III). Der daraus resultierende Komplex wird Sofortinhibitor genannt und beschleunigt die Inaktivierung von aktivierten Gerinnungsfaktoren um das Tausendfache. NMH inaktiviert vornehmlich den Prothrombinasekomplex, bestehend aus aktiviertem Faktor X (Stuart-Prower-Faktor), aktiviertem Faktor V (Proakzelerin), Calciumionen und Phospholipiden. UFH inaktiviert neben dem Prothrombinasekomplex auch den aktivierten Faktor II = Thrombin. Insofern erklärt sich die schneller gerinnungshemmende Wirkung von UFH gegenüber NMH. ⓘ
Des Weiteren werden die Faktoren IX (Antihämophilie Faktor B bzw. Christmas-Faktor), XI (Rosenthal-Faktor) und XII (Hagemann-Faktor) inaktiviert. Die fibrinolytisch aktive Serinprotease Kallikrein wird außerdem aktiviert. Ein weiterer Wirkmechanismus besteht darin, dass das Polyanion Heparin Ca-Ionen bindet, die Verminderung von Ca-Ionen ist gerinnungshemmend. ⓘ
Verabreichung

Heparin wird parenteral verabreicht, da es aufgrund seiner hohen negativen Ladung und seiner Größe nicht aus dem Darm resorbiert wird. Es kann intravenös oder subkutan (unter die Haut) injiziert werden; intramuskuläre Injektionen (in den Muskel) werden wegen der Gefahr der Bildung von Hämatomen vermieden. Aufgrund seiner kurzen biologischen Halbwertszeit von etwa einer Stunde muss Heparin häufig oder als Dauerinfusion verabreicht werden. Unfraktioniertes Heparin hat eine Halbwertszeit von etwa ein bis zwei Stunden nach der Infusion, während LMWH eine Halbwertszeit von vier bis fünf Stunden hat. Dank der Verwendung von LMWH kann das Medikament einmal täglich verabreicht werden, so dass keine Dauerinfusion erforderlich ist. Wenn eine Langzeit-Antikoagulation erforderlich ist, wird Heparin häufig nur zur Einleitung einer Antikoagulationstherapie verwendet, bis ein orales Antikoagulans, z. B. Warfarin, wirksam wird. ⓘ
Das American College of Chest Physicians veröffentlicht klinische Leitlinien zur Heparin-Dosierung. ⓘ
Natürlicher Abbau oder Clearance
Unfraktioniertes Heparin hat eine Halbwertszeit von etwa ein bis zwei Stunden nach der Infusion, während die Halbwertszeit von niedermolekularem Heparin etwa viermal länger ist. Niedrigere Heparindosen haben eine viel kürzere Halbwertszeit als höhere Dosen. Heparin, das an Makrophagenzellen bindet, wird von den Makrophagen internalisiert und depolymerisiert. Es bindet sich auch schnell an Endothelzellen, wodurch die Bindung an Antithrombin, die zu einer gerinnungshemmenden Wirkung führt, verhindert wird. Bei höheren Heparindosen ist die Bindung an die Endothelzellen gesättigt, so dass die Ausscheidung von Heparin aus dem Blutkreislauf über die Nieren langsamer erfolgt. ⓘ
Chemie
Heparin-Struktur

Natives Heparin ist ein Polymer mit einem Molekulargewicht von 3 bis 30 kDa, obwohl das durchschnittliche Molekulargewicht der meisten kommerziellen Heparinpräparate im Bereich von 12 bis 15 kDa liegt. Heparin gehört zur Familie der Glykosaminoglykane (zu der auch das eng verwandte Molekül Heparansulfat gehört) und besteht aus einer variabel sulfatierten, sich wiederholenden Disaccharideinheit. Die wichtigsten Disaccharideinheiten, die in Heparin vorkommen, sind nachstehend aufgeführt. Die häufigste Disaccharideinheit* (siehe unten) besteht aus einer 2-O-sulfatierten Iduronsäure und 6-O-sulfatiertem, N-sulfatiertem Glucosamin, IdoA(2S)-GlcNS(6S). Dies macht beispielsweise 85 % der Heparine aus Rinderlunge und etwa 75 % der Heparine aus Schweinedarmschleimhaut aus. ⓘ
Unten nicht aufgeführt sind die seltenen Disaccharide, die ein 3-O-sulfatiertes Glucosamin (GlcNS(3S,6S)) oder eine freie Amingruppe (GlcNH3+) enthalten. Unter physiologischen Bedingungen sind die Ester- und Amid-Sulfatgruppen deprotoniert und ziehen positiv geladene Gegenionen an, um ein Heparinsalz zu bilden. Heparin wird normalerweise in dieser Form als Antikoagulans verabreicht. ⓘ
GlcA = β-D-Glucuronsäure, IdoA = α-L-Iduronsäure, IdoA(2S) = 2-O-Sulfo-α-L-Iduronsäure, GlcNAc = 2-Deoxy-2-acetamido-α-D-glucopyranosyl, GlcNS = 2-Deoxy-2-sulfamido-α-D-glucopyranosyl, GlcNS(6S) = 2-Deoxy-2-sulfamido-α-D-glucopyranosyl-6-O-sulfat ⓘ
Eine Einheit Heparin (die "Howell-Einheit") ist eine Menge, die ungefähr 0,002 mg reinem Heparin entspricht; dies ist die Menge, die erforderlich ist, um 1 ml Katzenblut 24 Stunden lang bei 0 °C flüssig zu halten. ⓘ
Dreidimensionale Struktur
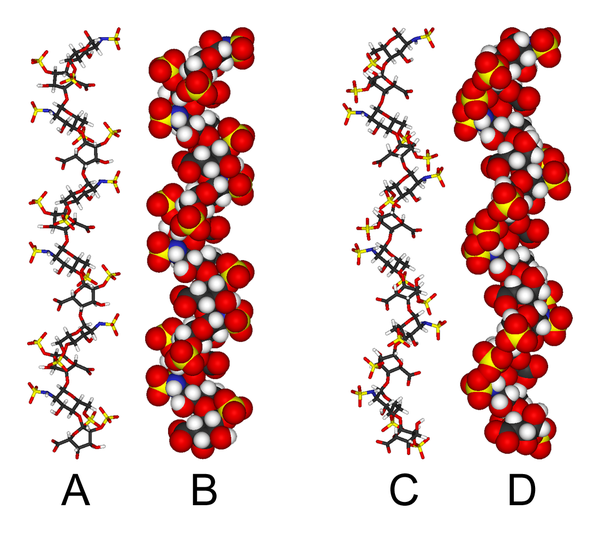
Die dreidimensionale Struktur von Heparin ist kompliziert, da die Iduronsäure in einer von zwei energiearmen Konformationen vorliegen kann, wenn sie innerhalb eines Oligosaccharids angeordnet ist. Das Konformationsgleichgewicht wird durch den Sulfatierungszustand der benachbarten Glucosamin-Zucker beeinflusst. Dennoch wurde die Lösungsstruktur eines Heparin-Dodecasaccharids, das ausschließlich aus sechs GlcNS(6S)-IdoA(2S)-Wiederholungseinheiten besteht, mit Hilfe einer Kombination aus NMR-Spektroskopie und molekularen Modellierungsverfahren bestimmt. Es wurden zwei Modelle erstellt, eines, bei dem alle IdoA(2S) in der 2S0-Konformation vorliegen (A und B unten), und eines, bei dem sie in der 1C4-Konformation vorliegen (C und D unten). Es gibt jedoch keine Anzeichen dafür, dass der Wechsel zwischen diesen Konformationen in einer konzertierten Weise erfolgt. Diese Modelle entsprechen dem Proteindatenbankcode 1HPN. ⓘ
In der obigen Abbildung:
- A = 1HPN (alle IdoA(2S)-Reste in 2S0-Konformation) Jmol-Viewer
- B = Van-der-Waals-Radius-Raumfüllungsmodell von A
- C = 1HPN (alle IdoA(2S)-Reste in 1C4-Konformation) Jmol-Viewer
- D = Van-der-Waals-Radius-Raumfüllungsmodell von C ⓘ
In diesen Modellen nimmt Heparin eine helikale Konformation an, durch deren Drehung sich Sulfatgruppen in regelmäßigen Abständen von etwa 17 Angström (1,7 nm) auf beiden Seiten der Helixachse anordnen. ⓘ
Depolymerisationstechniken
Die überwiegende Mehrheit der Analysen zur Struktur und Funktion von Heparin und Heparansulfat (HS) beruht entweder auf chemischen oder enzymatischen Depolymerisationstechniken oder einer Kombination aus beiden. ⓘ
Enzymatisch
Die Enzyme, die traditionell zum Abbau von Heparin oder HS verwendet werden, werden auf natürliche Weise von dem Bodenbakterium Pedobacter heparinus (früher Flavobacterium heparinum genannt) produziert. Dieses Bakterium ist in der Lage, entweder Heparin oder HS als einzige Kohlenstoff- und Stickstoffquelle zu nutzen. Zu diesem Zweck produziert es eine Reihe von Enzymen wie Lyasen, Glucuronidasen, Sulfesterasen und Sulfamidasen. Die Lyasen wurden hauptsächlich in Heparin/HS-Studien verwendet. Das Bakterium produziert drei Lyasen, die Heparinasen I (EC 4.2.2.7), II (keine EC-Nummer zugeordnet) und III (EC 4.2.2.8), die jeweils unterschiedliche Substratspezifitäten aufweisen (siehe unten). ⓘ
| Heparinase-Enzym | Substratspezifität ⓘ |
| Heparinase I | GlcNS(±6S)-IdoA(2S) |
| Heparinase II | GlcNS/Ac(±6S)-IdoA(±2S) GlcNS/Ac(±6S)-GlcA |
| Heparinase III | GlcNS/Ac(±6S)-GlcA/IdoA (mit einer Präferenz für GlcA) |

Die Lyasen spalten Heparin/HS durch einen Beta-Eliminierungsmechanismus. Dabei entsteht eine ungesättigte Doppelbindung zwischen C4 und C5 des Uronat-Restes. Das C4-C5-ungesättigte Uronat wird als ΔUA oder UA bezeichnet. Es ist ein empfindlicher UV-Chromophor (maximale Absorption bei 232 nm) und ermöglicht es, die Geschwindigkeit eines Enzymverdaus zu verfolgen und die durch den Enzymverdau entstandenen Fragmente auf einfache Weise nachzuweisen. ⓘ
Chemisch
Salpetrige Säure kann verwendet werden, um Heparin/HS chemisch zu depolymerisieren. Salpetrige Säure kann bei einem pH-Wert von 1,5 oder bei einem höheren pH-Wert von 4 verwendet werden. Unter beiden Bedingungen bewirkt die salpetrige Säure eine deaminative Spaltung der Kette.
Sowohl bei einem "hohen" (4) als auch bei einem "niedrigen" (1,5) pH-Wert findet eine deaminative Spaltung zwischen GlcNS-GlcA und GlcNS-IdoA statt, wenn auch bei dem höheren pH-Wert mit einer geringeren Geschwindigkeit. Die Desaminierungsreaktion und damit die Kettenspaltung erfolgt unabhängig von der O-Sulfatierung, die von beiden Monosaccharideinheiten getragen wird. ⓘ
Bei niedrigem pH-Wert führt die deaminative Spaltung zur Freisetzung von anorganischem SO4 und zur Umwandlung von GlcNS in Anhydromannose (aMan). Die Behandlung mit salpetriger Säure bei niedrigem pH-Wert ist eine ausgezeichnete Methode, um N-sulfatierte Polysaccharide wie Heparin und HS von nicht N-sulfatierten Polysacchariden wie Chondroitinsulfat und Dermatansulfat zu unterscheiden, wobei Chondroitinsulfat und Dermatansulfat nicht für die Spaltung durch salpetrige Säure anfällig sind. ⓘ
Nachweis in Körperflüssigkeiten
Die derzeitigen klinischen Labortests für Heparin beruhen auf einer indirekten Messung der Wirkung des Arzneimittels und nicht auf einer direkten Messung seiner chemischen Präsenz. Dazu gehören die aktivierte partielle Thromboplastinzeit (APTT) und die Antifaktor-Xa-Aktivität. Die Probe der Wahl ist in der Regel frisches, nicht hämolysiertes Plasma aus Blut, das mit Citrat, Fluorid oder Oxalat antikoaguliert worden ist. ⓘ
Andere Funktionen
- Reagenzgläser, Vacutainer und Kapillarröhrchen, die das Lithiumsalz von Heparin (Lithiumheparin) als Antikoagulans verwenden, sind in der Regel mit grünen Aufklebern und grünen Verschlüssen gekennzeichnet. Heparin hat gegenüber EDTA den Vorteil, dass es die Konzentrationen der meisten Ionen nicht beeinträchtigt. Allerdings kann die Konzentration von ionisiertem Kalzium verringert werden, wenn die Heparinkonzentration in der Blutprobe zu hoch ist. Heparin kann jedoch mit einigen Immunoassays interferieren. Da in der Regel Lithiumheparin verwendet wird, kann der Lithiumspiegel einer Person nicht mit diesen Röhrchen bestimmt werden; zu diesem Zweck werden royalblaue (und dunkelgrüne) Vacutainer mit Natriumheparin verwendet.
- Für die Verwendung in Herz-Lungen-Maschinen gibt es heparinbeschichtete Blutoxygenatoren. Diese speziellen Oxygenatoren sollen unter anderem die allgemeine Biokompatibilität und die Homöostase des Wirts verbessern, indem sie ähnliche Eigenschaften wie das native Endothel aufweisen.
- Die DNA-Bindungsstellen der RNA-Polymerase können durch Heparin besetzt werden, wodurch die Polymerase an der Bindung an die Promotor-DNA gehindert wird. Diese Eigenschaft wird in einer Reihe von molekularbiologischen Tests ausgenutzt.
- Gängige Diagnoseverfahren erfordern die PCR-Amplifikation der DNA eines Patienten, die sich leicht aus mit Heparin behandelten weißen Blutkörperchen extrahieren lässt. Dies stellt ein potenzielles Problem dar, da Heparin zusammen mit der DNA extrahiert werden kann, und es hat sich herausgestellt, dass es die PCR-Reaktion bereits ab einer Menge von 0,002 U in einer 50-μl-Reaktionsmischung stört.
- Heparin wurde als Chromatographieharz verwendet, das sowohl als Affinitätsligand als auch als Ionenaustauscher fungiert. Seine polyanionische Struktur kann Nukleinsäuren wie DNA und RNA nachahmen, was es für die Reinigung von Nukleinsäure-bindenden Proteinen wie DNA- und RNA-Polymerasen und Transkriptionsfaktoren nützlich macht. Die spezifische Affinität von Heparin für VSV-G, ein virales Hüllglykoprotein, das häufig zur Pseudotypisierung von retroviralen und lentiviralen Vektoren für die Gentherapie verwendet wird, ermöglicht die Verwendung für die nachgeschaltete Reinigung von viralen Vektoren.
- Heparin wird in Form eines Nasensprays als Prophylaxe gegen eine COVID-19-Infektion erprobt. Darüber hinaus wird aus Studien berichtet, dass die Inhalation von Heparin aufgrund seiner antiviralen, entzündungshemmenden und gerinnungshemmenden Wirkung bei Patienten, die aktiv an einer COVID-19-Infektion erkrankt sind, eine Verbesserung von 70 % bewirkt. ⓘ
Gesellschaft und Kultur
Rückrufe wegen Kontamination
In Anbetracht der tierischen Herkunft von pharmazeutischem Heparin ist die Zahl der möglichen Verunreinigungen im Vergleich zu einem rein synthetischen Therapeutikum relativ groß. Die Palette möglicher biologischer Verunreinigungen umfasst Viren, bakterielle Endotoxine, Erreger der transmissiblen spongiformen Enzephalopathie (TSE), Lipide, Proteine und DNA. Bei der Herstellung von Heparin in pharmazeutischer Qualität aus tierischem Gewebe können Verunreinigungen wie Lösungsmittel, Schwermetalle und fremde Kationen eingebracht werden. Die Methoden zur Minimierung des Auftretens und zur Identifizierung und/oder Beseitigung dieser Verunreinigungen sind jedoch gut etabliert und in Leitlinien und Arzneibüchern aufgeführt. Die größte Herausforderung bei der Analyse von Heparinverunreinigungen ist der Nachweis und die Identifizierung von strukturell verwandten Verunreinigungen. Die häufigste Verunreinigung in Heparin ist Dermatansulfat (DS), auch bekannt als Chondroitinsulfat B. Der Baustein von DS ist ein Disaccharid, das aus 1,3-verknüpftem N-Acetylgalactosamin (GalN) und einem Uronsäurerest besteht, die über 1,4-Bindungen miteinander verbunden sind, um das Polymer zu bilden. DS setzt sich aus drei möglichen Uronsäure- (GlcA, IdoA oder IdoA2S) und vier möglichen Hexosamin-Bausteinen (GalNAc, Gal- NAc4S, GalNAc6S oder GalNAc4S6S) zusammen. Das Vorhandensein von Iduronsäure in DS unterscheidet es von Chondroitinsulfat A und C und lässt es mit Heparin und HS vergleichen. DS hat im Vergleich zu Heparin insgesamt eine geringere negative Ladungsdichte. DS ist ein üblicher natürlicher Verunreinigungsstoff, der in Heparin-API in Mengen von 1-7 % vorhanden ist, aber keine nachgewiesene biologische Aktivität hat, die die gerinnungshemmende Wirkung von Heparin beeinflusst. ⓘ
Im Dezember 2007 rief die US-amerikanische Food and Drug Administration (FDA) eine Heparinlieferung zurück, weil in mehreren ungeöffneten Spritzen dieses Produkts Bakterienwachstum (Serratia marcescens) festgestellt wurde. S. marcescens kann zu lebensbedrohlichen Verletzungen und/oder zum Tod führen. ⓘ
Rückruf 2008 wegen Arzneimittelverfälschung in China
Im März 2008 kündigte die FDA einen umfangreichen Rückruf von Heparin an, weil die aus China eingeführten Heparin-Rohbestände verunreinigt waren. Nach Angaben der FDA starben durch das gepanschte Heparin fast 80 Menschen in den Vereinigten Staaten. Das verfälschte Heparin wurde als "übersulfatiertes" Derivat von Chondroitinsulfat identifiziert, einem beliebten, aus Schalentieren gewonnenen Nahrungsergänzungsmittel, das häufig zur Behandlung von Arthritis eingesetzt wird und das in Wirksamkeitstests als Ersatz für Heparin dienen sollte. ⓘ
Dies berichtet die New York Times: "Zu den der Behörde gemeldeten Problemen mit Heparin gehören Atembeschwerden, Übelkeit, Erbrechen, übermäßiges Schwitzen und ein rascher Blutdruckabfall, der in einigen Fällen zu einem lebensbedrohlichen Schock führte". ⓘ
Verwendung bei Tötungsdelikten
Im Jahr 2006 verabreichte Petr Zelenka, ein Krankenpfleger in der Tschechischen Republik, absichtlich hohe Dosen an Patienten, wobei er sieben Menschen tötete und versuchte, zehn weitere zu töten. ⓘ
Probleme bei Überdosierung
2007 verabreichte eine Krankenschwester im Cedars-Sinai Medical Center den 12 Tage alten Zwillingen des Schauspielers Dennis Quaid versehentlich eine Heparindosis, die das 1 000-fache der empfohlenen Dosis für Säuglinge betrug. Zu der Überdosierung kam es angeblich, weil die Beschriftung und das Design der Erwachsenen- und der Säuglingsversion des Produkts ähnlich waren. Die Familie Quaid verklagte daraufhin den Hersteller, die Baxter Healthcare Corp. und einigte sich mit dem Krankenhaus auf 750.000 Dollar. Vor dem Quaid-Unfall wurde sechs Neugeborenen im Methodist Hospital in Indianapolis, Indiana, eine Überdosis verabreicht. Drei der Säuglinge starben nach dem Fehler. ⓘ
Im Juli 2008 starb ein weiteres Paar Zwillinge, die im Christus Spohn Hospital South in Corpus Christi, Texas, geboren wurden, nach einer versehentlich verabreichten Überdosis des Medikaments. Die Überdosierung war auf einen Mischungsfehler in der Krankenhausapotheke zurückzuführen und hatte nichts mit der Verpackung oder Kennzeichnung des Produkts zu tun. Im Juli 2008 wurde die genaue Ursache für den Tod der Zwillinge noch untersucht. ⓘ
Im März 2010 wurde einer zweijährigen Transplantationspatientin aus Texas im University of Nebraska Medical Center eine tödliche Dosis Heparin verabreicht. Die genauen Umstände ihres Todes werden noch untersucht. ⓘ
Herstellung
Heparin in pharmazeutischer Qualität wird aus Schleimhautgeweben von geschlachteten Fleischtieren wie Schweinedärmen oder Rinderlungen gewonnen. Fortschritte bei der synthetischen Herstellung von Heparin wurden in den Jahren 2003 und 2008 erzielt. Im Jahr 2011 wurde über ein chemoenzymatisches Verfahren zur Synthese von Heparinen mit niedrigem Molekulargewicht aus einfachen Disacchariden berichtet. ⓘ
Forschung
Wie in der nachstehenden Tabelle dargelegt, besteht ein großes Potenzial für die Entwicklung heparinähnlicher Strukturen als Arzneimittel zur Behandlung einer Vielzahl von Krankheiten, zusätzlich zu ihrer derzeitigen Verwendung als Antikoagulanzien. ⓘ
| Krankheitszustände, die empfindlich auf Heparin reagieren | Die Wirkung von Heparin in experimentellen Modellen | Klinischer Status ⓘ |
| Erworbenes Immundefizienzsyndrom | Verringert die Fähigkeit des Humanen Immundefizienz-Virus Typ 1 und 2, an kultivierte T4-Zellen zu adsorbieren. | – |
| Atemnotsyndrom bei Erwachsenen | Reduziert die Zellaktivierung und -akkumulation in den Atemwegen, neutralisiert Mediatoren und zytotoxische Zellprodukte und verbessert die Lungenfunktion in Tiermodellen | Kontrollierte klinische Studien |
| Allergische Enzephalomyelitis | Wirksam in Tiermodellen | – |
| Allergische Rhinitis | Wirkungen wie beim Atemnotsyndrom bei Erwachsenen, obwohl kein spezifisches Nasenmodell getestet wurde | Kontrollierte klinische Studie |
| Arthritis | Hemmt Zellakkumulation, Kollagenabbau und Angiogenese | Anekdotischer Bericht |
| Asthma | Wie beim Atemnotsyndrom bei Erwachsenen, aber es hat sich auch gezeigt, dass es die Lungenfunktion in experimentellen Modellen verbessert | Kontrollierte klinische Studien |
| Krebs | Hemmt Tumorwachstum, Metastasierung und Angiogenese und verlängert die Überlebenszeit in Tiermodellen | Mehrere anekdotische Berichte |
| Überempfindlichkeitsreaktionen vom verzögerten Typ | Wirksam in Tiermodellen | – |
| Entzündliche Darmerkrankungen | Hemmt den Transport von Entzündungszellen im Allgemeinen, kein spezifisches Modell getestet | Kontrollierte klinische Studien |
| Interstitielle Blasenentzündung | Wirksam in einem humanen experimentellen Modell der interstitiellen Zystitis | Ähnliches Molekül wird jetzt klinisch verwendet |
| Transplantatabstoßung | Verlängert das Überleben von Allotransplantaten in Tiermodellen | – |
- - gibt an, dass keine Informationen verfügbar sind ⓘ
Aufgrund der Wirkung von Heparin auf so viele verschiedene Krankheitszustände befinden sich in der Tat eine Reihe von Arzneimitteln in der Entwicklung, deren molekulare Strukturen mit denen von Teilen der polymeren Heparinkette identisch oder ihnen ähnlich sind. ⓘ
| Wirkstoffmolekül | Wirkung des neuen Medikaments im Vergleich zu Heparin | Biologische Aktivitäten ⓘ |
| Heparin-Tetrasaccharid | Nicht gerinnungshemmend, nicht immunogen, oral wirksam | Antiallergisch |
| Pentosan-Polysulfat | Pflanzlicher Stoff, geringe gerinnungshemmende Wirkung, entzündungshemmend, oral wirksam | Entzündungshemmend, antiadhäsiv, antimetastatisch |
| Phosphomannopentanose-Sulfat | Starker Inhibitor der Heparanase-Aktivität | Antimetastatisch, antiangiogenetisch, entzündungshemmend |
| Selektiv chemisch O-desulfatiertes Heparin | Fehlt die gerinnungshemmende Wirkung | Entzündungshemmend, antiallergisch, antiadhäsiv |
Struktur
Heparine sind variabel veresterte Glycosaminoglycane, bestehend aus jeweils abwechselnden Folgen von D-Glucosamin und einer Uronsäure (D-Glucuronsäure oder L-Iduronsäure). Viele Monomereinheiten enthalten an Sauerstoff- und Stickstoffatome gebundene Sulfat-Gruppen. ⓘ
Ab einer Kettenlänge von fünf Monosacchariden (drei D-Glucosamine und zwei Uronsäuren) wirken die Glykosaminoglycane gerinnungshemmend. Den Kettenbausteinen entsprechend besitzen sie viele negative Ladungen, über welche sie auch an Antithrombin III koppeln. Natives Heparin wird auch als unfraktioniertes Heparin (UFH), depolymerisierte Heparine mit mittleren relativen Molmassen unterhalb von 8000 (mit mindestens 80 % unterhalb von 8000) als niedermolekulare Heparine (NMH), englisch Low Molecular Weight Heparine (LMWH) bezeichnet. ⓘ
Das arzneilich verwendete, unfraktionierte Heparin (auch Standardheparin genannt) weist eine Molmasse von 6000 bis 30.000 Dalton (Da) auf. Durch chemische oder enzymatische Spaltung und Fraktionierung werden niedermolekulare, therapeutisch verwendbare Heparine mit mittleren Molmassen um die 5000 Dalton gewonnen: Certoparin (5400 Da), Dalteparin (6100 Da), Enoxaparin (4500 Da), Parnaparin (5000 Da), Nadroparin (4300 Da), Reviparin (4400 Da) und Tinzaparin (6500 Da). ⓘ
Biosynthese
Heparin wird primär nicht im Bindegewebe gebildet, sondern fast nur in Mastzellen und dort gespeichert. ⓘ
Pharmakokinetik
Heparin wird intravenös, subkutan oder perkutan verabreicht, wobei die Wirksamkeit der perkutanen Verabreichung umstritten ist. Bei subkutaner Gabe von UFH resultiert eine 30%ige Bioverfügbarkeit. Bei intravenöser Applikation kommt es initial zu einer schnellen Elimination von 40 % des injizierten UFH (schnell ablaufender Sättigungsprozess aufgrund der vielen negativen Ladungen bindet UFH am Endothel und an Makrophagen sowie an Plasmaproteine) mit einer Halbwertszeit von 5–15 Minuten, welche dann in eine langsamere Elimination mit einer HWZ von 60–90 Minuten mündet (renale Elimination über glomeruläre Filtration und tubuläre Sekretion). Erst wenn alle Bindungsstellen abgesättigt sind, wird die Dosis-Wirkungs-Beziehung linear und der therapeutisch wirksame Spiegel erreicht. UFH ist nicht plazentagängig und tritt nicht in die Muttermilch ein, es kann somit in der Schwangerschaft und Stillzeit eingesetzt werden. ⓘ
NMH weisen eine geringere Affinität zu Plasmaproteinen, vaskulären Matrixproteinen, Makrophagen, Thrombozyten und Endothelzellen auf. Daraus erklärt sich eine bessere Bioverfügbarkeit, die längere Eliminationshalbwertszeit und die ausschließlich renale Clearance der NMH. Nach subkutaner Injektion ergibt sich eine 90 % + Bioverfügbarkeit. Bei eingeschränkter Nierenfunktion muss ggf. eine Dosisreduktion erfolgen. NMH ist nicht plazentagängig, ein Übertritt in die Muttermilch ist nicht bekannt. ⓘ
Indikationen

UFH ist unter anderem indiziert:
- Prophylaxe peri- und postoperativer Thrombosen
- Therapie der tiefen Venenthrombose und der Lungenembolie
- Therapie arterieller Embolien
- Antikoagulans bei extrakorporaler Zirkulation (z. B. Dialyse)
- unter besonderen Gesichtspunkten:
- zur Therapie der DIC (= disseminierte intravasale Coagulation)
- zur Begleittherapie der Thrombolyse
- zur Therapie des akuten Myokardinfarktes. ⓘ
NMH ist unter anderem angezeigt:
- zur peri- und postoperativen Prophylaxe von venösen Thrombosen
- Therapie der tiefen Venenthrombose
- Therapie der nicht massiven (normotensiven) Lungenembolie
- Thromboseprophylaxe bei instabiler Angina Pectoris sowie teilweise beim Akuten Koronarsyndrom
- Antikoagulans bei der Hämodialyse. ⓘ
Ferner wird Heparin in Form eines sogenannten Heparinblocks zum Offenhalten von Gefäßkathetern verwendet. Die Zuleitung wird dazu mit heparinisierter NaCl-Lösung gespült, so dass darin keine Koagulation stattfinden kann. ⓘ
In Deutschland besteht für viele NMH noch keine Zulassung für jede dieser Indikationen. ⓘ
Gegenanzeigen und Anwendungsbeschränkungen
Nicht angewendet werden dürfen Heparine bei vermuteter oder bestehender Blutungsneigung, Magen-Darm-Geschwüren und drohender Fehlgeburt. Eine kritische Nutzen-Risiko-Analyse und sorgfältige laboranalytische Überwachung des Patienten sind notwendig bei:
- therapieresistente arterielle Hypertonie und hypertensive Retinopathie
- Leber- und Nierenerkrankungen mit eingeschränkter Funktion, akute Pankreatitis
- schwere Stoffwechselerkrankungen wie Diabetes mellitus
- fortgeschrittenes Malignom
- fortgeschrittenes Alter (mit erhöhter Morbidität)
- Überempfindlichkeit oder vorausgegangene HIT II
hochdosiert:
- bestehende oder drohende innere Blutungen
- Punktion an Arterien und parenchymatösen Organen, intramuskuläre Injektionen (<7 Tage)
- frische Operationen (Abhängig von Dauer und Art des Eingriffs)
- bakterielle Endokarditis
- Mitralklappenfehler mit Vorhofflimmern. ⓘ
Bei rückenmarksnahen Regionalanästhesie-Verfahren (Spinalanästhesie bzw. Periduralanästhesie) sollte unfraktioniertes Heparin (UFH) vier bis sechs Stunden vorher abgesetzt werden und frühestens eine Stunde nach dem Eingriff wieder gegeben werden. Bei NMH-Prophylaxe sollte der Wirkstoff 12 Stunden vorher, bei NMH-Therapie 24 Stunden vorher abgesetzt werden und erst vier Stunden nach dem Eingriff wieder gegeben werden. ⓘ
Kontrolle
Damit weder zu viel (Gefahr der Blutung) noch zu wenig (Gefahr der Thrombose) Heparin gegeben wird, sollte bei Patienten mit UFH die PTT (Partial Thromboplastin Time, partielle Thromboplastinzeit) bestimmt werden. ⓘ
Niedermolekulares Heparin muss normalerweise nicht kontrolliert werden – ein wichtiger Vorteil für den Patienten. Bei Bedarf kann aber die richtige Dosierung durch Messung der Anti-Xa-Aktivität bestimmt werden. Dabei muss die Messung vier Stunden nach der subkutanen Injektion erfolgen, um standardisierte Bedingungen zu schaffen. ⓘ
Niedermolekulare Heparine in der Übersicht
Die Tabelle zeigt eine Übersicht charakteristischer Daten für einige therapeutisch genutzte niedermolekulare Heparine im Vergleich zu Standardheparin. ⓘ
| Name | Mittlere Molmasse (kD) | Sulfatierungsgrad | Verhältnis Anti-Xa- zu Anti-IIa-Aktivität |
HWZ (Stunden) ⓘ |
|---|---|---|---|---|
| Heparin-Natrium | 6,0 – 30,0 | 1,0 (0,9 – 1,1) | 2 | |
| Bemiparin-Natrium | 3,6 (3,0 – 4,2) | 2 | 8 | 5 – 6 |
| Nadroparin-Calcium | 4,3 (3,6 – 5,0) | 2,1 | 2,5 – 4,0 | 3,5 |
| Enoxaparin-Natrium | 4,5 (3,5 – 5,5) | 2 | 3,3 – 5,3 | 5 – 7 |
| Parnaparin-Natrium | 5,0 (4,0 – 6,0) | 2,0 – 2,6 | 1,5 – 3,0 | 6 |
| Certoparin-Natrium | 5,0 – 7,0 4,2 – 6,2 |
2 – 2,5 | 2,2 | 4,3 |
| Dalteparin-Natrium | 6,0 (5,6 – 6,4) | 2,0 – 2,5 | 1,9 – 3,3 | 4 |
| Tinzaparin-Natrium | 6,5 (5,5 – 7,5) | 1,8 – 2,5 | 1,5 – 2,5 | 3,7 |

Fertigarzneimittel
Monopräparate (Standardheparin) ⓘ
Calciparine (CH), Gelparin (CH), Lioton (A, CH), Liquemin (CH), Lyman (CH), Sportino (D), Thrombareduct (D), Thrombophob (D), Vetren (D), zahlreiche Generika (D, A, CH) ⓘ
Monopräparate (niedermolekulare Heparine) ⓘ
Mono-Embolex, Fragmin P, Clexane, Lovenox, Fraxiparin, Clivarin, Innohep ⓘ