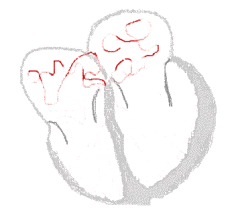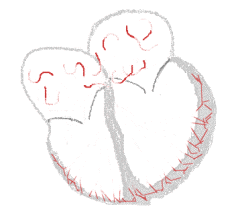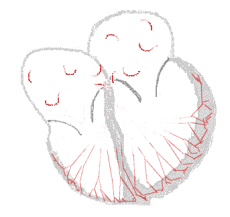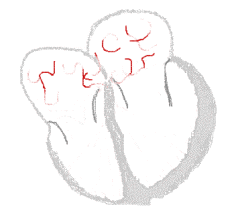Vorhofflimmern
| Vorhofflattern ⓘ | |
|---|---|
| Andere Namen | Vorhofflimmern (Aurikularflimmern) |
 | |
| Die Ableitungen aVL und aVF eines Elektrokardiogramms zeigen Vorhofflimmern. Die Intervalle zwischen den Herzschlägen sind unregelmäßig. Es sind keine P-Wellen zu sehen, und zwischen den QRS-Komplexen ist eine unregelmäßige Grundlinie vorhanden. Die Herzfrequenz beträgt etwa 125 Schläge pro Minute. | |
| Fachgebiet | Kardiologie |
| Symptome | Keine, Herzklopfen, Ohnmacht, Kurzatmigkeit, Brustschmerzen |
| Komplikationen | Herzinsuffizienz, Demenz, Schlaganfall |
| Gewöhnliches Auftreten | > ab 50 Jahren |
| Risikofaktoren | Bluthochdruck, Herzklappenerkrankung, koronare Herzkrankheit, Kardiomyopathie, angeborene Herzkrankheit, COPD, Fettleibigkeit, Rauchen, Schlafapnoe |
| Diagnostische Methode | Fühlen des Pulses, Elektrokardiogramm |
| Differentialdiagnose | Unregelmäßiger Herzschlag |
| Behandlung | Änderung des Lebensstils, Frequenzkontrolle, Rhythmuskontrolle, Antikoagulation |
| Häufigkeit | 2,5 % (Industrieländer), 0,5 % (Entwicklungsländer) |
| Todesfälle | 193.300 mit Vorhofflattern (2015) |
Vorhofflimmern (AF oder A-fib) ist ein abnormer Herzrhythmus (Arrhythmie), der durch schnelles und unregelmäßiges Schlagen der Vorhofkammern des Herzens gekennzeichnet ist. Es beginnt oft mit kurzen Perioden abnormalen Schlagens, die mit der Zeit länger oder kontinuierlich werden. Es kann auch mit anderen Formen von Arrhythmien wie Vorhofflattern beginnen, die dann in Vorhofflattern übergehen. Die Episoden können asymptomatisch sein. Symptomatische Episoden können Herzklopfen, Ohnmacht, Benommenheit, Kurzatmigkeit oder Schmerzen in der Brust sein. Vorhofflimmern ist mit einem erhöhten Risiko für Herzversagen, Demenz und Schlaganfall verbunden. Es handelt sich um eine Form der supraventrikulären Tachykardie. ⓘ
Bluthochdruck und Herzklappenerkrankungen sind die häufigsten modifizierbaren Risikofaktoren für Vorhofflimmern. Weitere herzbezogene Risikofaktoren sind Herzinsuffizienz, koronare Herzkrankheit, Kardiomyopathie und angeborene Herzkrankheiten. In Ländern mit niedrigem und mittlerem Einkommen ist die Herzklappenerkrankung häufig auf rheumatisches Fieber zurückzuführen. Zu den lungenbezogenen Risikofaktoren gehören COPD, Fettleibigkeit und Schlafapnoe. Weitere Risikofaktoren sind übermäßiger Alkoholkonsum, Tabakrauchen, Diabetes mellitus und Thyreotoxikose. Etwa die Hälfte der Fälle steht jedoch in keinem Zusammenhang mit einem der oben genannten Risiken. Das medizinische Fachpersonal kann den Verdacht auf Vorhofflimmern durch das Fühlen des Pulses äußern und die Diagnose durch die Auswertung eines Elektrokardiogramms (EKG) bestätigen. Ein typisches EKG bei Vorhofflimmern zeigt unregelmäßig angeordnete QRS-Komplexe ohne P-Wellen. ⓘ
Eine gesunde Lebensweise, z. B. Gewichtsabnahme bei Übergewichtigen, mehr körperliche Aktivität und weniger Alkoholkonsum, kann das Risiko für Vorhofflimmern senken und die Belastung durch Vorhofflimmern verringern, falls es auftritt. Vorhofflimmern wird häufig mit Medikamenten behandelt, die die Herzfrequenz auf einen nahezu normalen Bereich verlangsamen (so genannte Frequenzkontrolle) oder den Rhythmus in einen normalen Sinusrhythmus umwandeln (so genannte Rhythmuskontrolle). Eine elektrische Kardioversion kann das Vorhofflimmern in einen normalen Herzrhythmus umwandeln und ist bei instabilen Patienten oft als Notfallmaßnahme erforderlich. Die Ablation kann bei manchen Menschen ein erneutes Auftreten verhindern. Bei Personen mit geringem Schlaganfallrisiko ist bei Vorhofflimmern nicht unbedingt eine Blutverdünnung erforderlich, obwohl einige Gesundheitsdienstleister Aspirin oder ein gerinnungshemmendes Medikament verschreiben können. Für Menschen mit einem mehr als geringen Risiko empfehlen Experten im Allgemeinen ein gerinnungshemmendes Medikament. Zu den gerinnungshemmenden Medikamenten gehören Warfarin und direkte orale Antikoagulanzien. Die meisten Menschen haben ein höheres Risiko für einen Schlaganfall. Diese Medikamente verringern zwar das Schlaganfallrisiko, aber sie erhöhen die Rate schwerer Blutungen. ⓘ
Vorhofflimmern ist die häufigste schwere Herzrhythmusstörung und betrifft 2020 weltweit mehr als 33 Millionen Menschen. Im Jahr 2014 waren etwa 2 bis 3 % der Bevölkerung in Europa und Nordamerika davon betroffen. Dies war ein Anstieg von 0,4 bis 1 % der Bevölkerung um 2005. In den Entwicklungsländern sind etwa 0,6 % der Männer und 0,4 % der Frauen betroffen. Der Prozentsatz der Menschen mit Vorhofflimmern nimmt mit dem Alter zu: 0,1 % sind unter 50 Jahren, 4 % zwischen 60 und 70 Jahren und 14 % über 80 Jahren betroffen. Vorhofflimmern und Vorhofflattern führten 2015 zu 193.300 Todesfällen, 1990 waren es noch 29.000. Der erste bekannte Bericht über einen unregelmäßigen Puls stammt von Jean-Baptiste de Sénac aus dem Jahr 1749. Thomas Lewis war der erste Arzt, der dies 1909 mittels EKG dokumentierte. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| I48.0 | Vorhofflimmern, paroxysmal |
| I48.1 | Vorhofflimmern, persistierend |
| I48.2 | Vorhofflimmern, chronisch |
| I48.9 | Vorhofflimmern und Vorhofflattern, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |

Vorhofflimmern, häufigste Form und Ursache der absoluten Arrhythmie, ist eine vorübergehende (paroxysmale oder intermittierende) oder dauerhafte (permanente) Herzrhythmusstörung mit ungeordneter Tätigkeit der Herzvorhöfe. Gebräuchliche Abkürzungen sind AF oder AFib (von englisch Atrial Fibrillation), Vfli, VoFli, VHF und VHFli. ⓘ
Vorhofflimmern ist die häufigste bedeutsame Herzrhythmusstörung, allein in Deutschland weisen etwa 300.000 Menschen ein Vorhofflimmern auf. Etwa 70 % der Vorhofflimmer-Attacken bemerken die Patienten nicht. Die Betroffenen klagen meist über unspezifische Beschwerden wie plötzlichen Leistungsknick, Müdigkeit, Palpitationen oder Schlafstörungen. Herzrasen bemerken 70–80 % der symptomatischen Patienten. ⓘ
Anzeichen und Symptome


Vorhofflimmern wird in der Regel von Symptomen begleitet, die mit einer schnellen Herzfrequenz zusammenhängen. Eine schnelle und unregelmäßige Herzfrequenz kann sich durch das Gefühl bemerkbar machen, dass das Herz zu schnell oder unregelmäßig schlägt oder Schläge auslässt (Herzklopfen), oder durch Unverträglichkeiten bei körperlicher Anstrengung und gelegentlich durch Schmerzen in der Brust (wenn die hohe Herzfrequenz dazu führt, dass der Sauerstoffbedarf des Herzens höher ist als das verfügbare Sauerstoffangebot). Weitere mögliche Symptome sind Symptome der Herzinsuffizienz wie Müdigkeit, Kurzatmigkeit oder Schwellungen. Der abnorme Herzrhythmus (Arrhythmie) wird manchmal erst bei einem Schlaganfall oder einer transitorischen ischämischen Attacke (TIA) festgestellt. Es ist nicht ungewöhnlich, dass eine Person zum ersten Mal bei einer Routineuntersuchung oder einem Elektrokardiogramm auf Vorhofflimmern aufmerksam wird, da es oft keine Symptome verursacht. ⓘ
Da die meisten Fälle von Vorhofflimmern auf andere medizinische Probleme zurückzuführen sind, können Brustschmerzen oder Angina pectoris, Anzeichen und Symptome einer Schilddrüsenüberfunktion wie Gewichtsverlust und Durchfall sowie Symptome, die auf eine Lungenerkrankung hindeuten, auf eine zugrunde liegende Ursache hinweisen. Ein Schlaganfall oder eine TIA in der Vorgeschichte sowie Bluthochdruck, Diabetes, Herzinsuffizienz oder rheumatisches Fieber können darauf hinweisen, ob jemand mit Vorhofflimmern ein höheres Risiko für Komplikationen hat. ⓘ
Schnelle Herzfrequenz
Das Erscheinungsbild ist ähnlich wie bei anderen Formen von Herzrasen und kann asymptomatisch sein. Herzklopfen und Brustbeschwerden sind häufige Beschwerden. Die schnelle, unkoordinierte Herzfrequenz kann zu einer verminderten Pumpleistung des Herzens (Herzzeitvolumen) führen, was eine unzureichende Durchblutung und damit Sauerstoffversorgung des restlichen Körpers zur Folge hat. Häufige Symptome eines unkontrollierten Vorhofflimmerns sind Kurzatmigkeit, Kurzatmigkeit im Liegen, Schwindel und plötzlich auftretende Kurzatmigkeit in der Nacht. Dies kann zu einer Schwellung der unteren Extremitäten führen, die ein Zeichen für eine Herzinsuffizienz ist. Aufgrund der unzureichenden Herzleistung können Personen mit Vorhofflimmern auch über Benommenheit klagen. ⓘ
Vorhofflimmern kann aufgrund von Stauungen in der Lunge zu Atemnot führen. Definitionsgemäß beträgt die Herzfrequenz mehr als 100 Schläge pro Minute. Der Blutdruck kann schwanken und ist oft schwer zu messen, da die Schlag-zu-Schlag-Variabilität bei den meisten digitalen (oszillometrischen) nicht-invasiven Blutdruckmessgeräten Probleme verursacht. Aus diesem Grund wird zur Bestimmung der Herzfrequenz bei Vorhofflimmern eine direkte Herzauskultation empfohlen. Ein niedriger Blutdruck ist äußerst besorgniserregend und ein Zeichen dafür, dass eine sofortige Behandlung erforderlich ist. Viele der Symptome, die mit unkontrolliertem Vorhofflimmern einhergehen, sind Ausdruck einer kongestiven Herzinsuffizienz aufgrund der verminderten Herzleistung. Die Atemfrequenz der Betroffenen erhöht sich häufig, wenn Atemnot vorliegt. Eine Pulsoxymetrie kann bestätigen, dass zu wenig Sauerstoff in die Körpergewebe gelangt, was mit auslösenden Faktoren wie einer Lungenentzündung zusammenhängt. Bei der Untersuchung der Jugularvenen kann ein erhöhter Druck festgestellt werden (Jugularvenendistention). Bei der Untersuchung der Lunge können Knistergeräusche festgestellt werden, die auf ein Lungenödem hindeuten. Bei der Untersuchung des Herzens kann ein schneller, unregelmäßiger Rhythmus festgestellt werden. ⓘ
Ursachen

Vorhofflimmern wird mit verschiedenen Formen von Herz-Kreislauf-Erkrankungen in Verbindung gebracht, kann aber auch bei ansonsten normalen Herzen auftreten. Zu den bekannten kardiovaskulären Faktoren, die mit der Entwicklung von Vorhofflimmern in Verbindung gebracht werden, gehören Bluthochdruck, koronare Herzkrankheiten, Mitralklappenstenose (z. B. aufgrund einer rheumatischen Herzerkrankung oder eines Mitralklappenprolapses), Mitralinsuffizienz, Vergrößerung des linken Vorhofs, hypertrophe Kardiomyopathie (HCM), Perikarditis, angeborene Herzerkrankungen und frühere Herzoperationen. Eine angeborene Herzerkrankung ist ein starker Risikofaktor für die Entwicklung von Vorhofflimmern - ein 20-jähriger Erwachsener mit einer angeborenen Herzerkrankung hat ein vergleichbares Lebenszeitrisiko für die Entwicklung von Vorhofflimmern wie ein 55-jähriger Erwachsener ohne angeborene Herzerkrankung. Menschen mit einer angeborenen Herzerkrankung neigen dazu, in jüngeren Jahren Vorhofflimmern zu entwickeln, das eher rechtsatrial (atypisch) als linksatrial entsteht, und haben ein höheres Risiko, zu permanentem Vorhofflimmern zu werden. ⓘ
Außerdem können Lungenerkrankungen (wie Lungenentzündung, Lungenkrebs, Lungenembolie und Sarkoidose) bei bestimmten Personen eine Rolle spielen. Auch eine Sepsis erhöht das Risiko, neu auftretendes Vorhofflimmern zu entwickeln. Störungen der Atmung während des Schlafs, wie die obstruktive Schlafapnoe (OSA), werden ebenfalls mit Vorhofflimmern in Verbindung gebracht. Fettleibigkeit ist ein Risikofaktor für Vorhofflimmern. Schilddrüsenüberfunktion und subklinische Schilddrüsenüberfunktion werden mit der Entstehung von Vorhofflimmern in Verbindung gebracht. ⓘ
Koffeinkonsum scheint nicht mit Vorhofflimmern in Verbindung zu stehen; übermäßiger Alkoholkonsum ("binge drinking" oder "holiday heart syndrome") wird mit Vorhofflimmern in Verbindung gebracht. Geringer bis mäßiger Alkoholkonsum scheint ebenfalls mit einem erhöhten Risiko für die Entwicklung von Vorhofflimmern verbunden zu sein, obwohl der Anstieg des Risikos bei einem Alkoholkonsum von weniger als zwei Getränken pro Tag gering zu sein scheint. Tabakrauchen und Passivrauchen werden mit einem erhöhten Risiko für Vorhofflimmern in Verbindung gebracht. Langfristiger Ausdauersport, der weit über das empfohlene Maß an Bewegung hinausgeht (z. B. Langstreckenradfahren oder Marathonlauf), scheint bei Menschen mittleren Alters und älteren Menschen mit einem geringfügig erhöhten Risiko für Vorhofflimmern verbunden zu sein. Es gibt Hinweise darauf, dass Nachtschichtarbeit mit der Diagnose von Vorhofflimmern in Verbindung gebracht werden kann. ⓘ
Genetik
Eine familiäre Vorbelastung kann das Risiko für Vorhofflimmern erhöhen. In einer Studie mit mehr als 2 200 Personen wurde ein erhöhter Risikofaktor für Vorhofflimmern von 1,85 für diejenigen festgestellt, bei denen mindestens ein Elternteil an Vorhofflimmern erkrankt war. Verschiedene genetische Mutationen können dafür verantwortlich sein. ⓘ
Vier Arten von genetischen Störungen werden mit Vorhofflimmern in Verbindung gebracht:
- Familiäres Vorhofflimmern als monogenetische Erkrankung
- Familiäres Vorhofflimmern, das im Zusammenhang mit einer anderen vererbten Herzerkrankung auftritt (hypertrophe Kardiomyopathie, dilatative Kardiomyopathie, familiäre Amyloidose)
- Vererbte arrhythmische Syndrome (angeborenes langes QT-Syndrom, kurzes QT-Syndrom, Brugada-Syndrom)
- Nicht familiäres Vorhofflimmern in Verbindung mit einem genetischen Hintergrund (Polymorphismus im ACE-Gen), der zu Vorhofflimmern prädisponieren kann ⓘ
Eine Familienanamnese bei einem Verwandten ersten Grades ist mit einem um 40 % erhöhten Risiko für Vorhofflimmern verbunden. Diese Erkenntnis führte zur Kartierung verschiedener Loci wie 10q22-24, 6q14-16 und 11p15-5.3 und zur Entdeckung von Mutationen, die mit diesen Loci verbunden sind. Fünfzehn Mutationen mit Funktionsgewinn oder -verlust wurden in den Genen der K+-Kanäle gefunden, darunter Mutationen in KCNE1-5, KCNH2, KCNJ5 oder ABCC9. Sechs Variationen in Genen von Na+-Kanälen, darunter SCN1-4B, SCN5A und SCN10A, wurden ebenfalls gefunden. Alle diese Mutationen wirken sich auf die Prozesse der Polarisierung/Depolarisierung des Herzmuskels, die zelluläre Übererregbarkeit und die Verkürzung der effektiven Refraktärzeit aus und begünstigen Wiedereintritte. Andere Mutationen in Genen wie GJA5 betreffen die Gap Junctions und führen zu einer zellulären Entkopplung, die Wiedereintritte und eine langsame Leitungsgeschwindigkeit begünstigt. Mithilfe genomweiter Assoziationsstudien, bei denen das gesamte Genom auf einzelne Nukleotid-Polymorphismen (SNP) untersucht wird, wurden drei Anfälligkeitsloci für Vorhofflimmern gefunden (4q25, 1q21 und 16q22). Auf diesen Loci gibt es SNPs, die mit einem um 30 % erhöhten Risiko für rezidivierende Vorhoftachykardien nach einer Ablation assoziiert sind. Es gibt auch SNPs, die mit dem Funktionsverlust des Gens Pitx2c (das an der zellulären Entwicklung der Pulmonalklappen beteiligt ist) assoziiert sind, das für erneute Eintritte verantwortlich ist. Es gibt auch SNPs in der Nähe von ZFHX3-Genen, die an der Regulierung von Ca2+ beteiligt sind. Eine 2018 durchgeführte GWAS-Metaanalyse ergab die Entdeckung von 70 neuen Loci, die mit AF assoziiert sind. Es wurden verschiedene Varianten identifiziert. Sie sind mit Genen assoziiert, die für Transkriptionsfaktoren wie TBX3 und TBX5, NKX2-5 oder PITX2 kodieren, die an der Regulierung der Erregungsleitung des Herzens, der Modulation von Ionenkanälen und an der Herzentwicklung beteiligt sind. Es wurden auch neue Gene identifiziert, die an Tachykardie (CASQ2) beteiligt sind oder mit einer Veränderung der Kardiomyozytenkommunikation (PKP2) in Verbindung stehen. Seltene Mutationen im Kardiomyopathie-Gen TTN können ebenfalls das Vorhofflimmern-Risiko erhöhen, selbst bei Personen ohne Anzeichen einer Herzinsuffizienz. Kleine genetische Deletionen auf dem X-Chromosom im Bereich des STS-Gens (Steroidsulfatase) werden mit einer erhöhten Rate von Vorhofflimmern bei Männern in Verbindung gebracht. ⓘ
Bewegungsarmer Lebensstil
Eine sitzende Lebensweise erhöht die mit Vorhofflimmern assoziierten Risikofaktoren, wie Übergewicht, Bluthochdruck oder Diabetes mellitus. Dies begünstigt Umbauprozesse des Vorhofs aufgrund von Entzündungen oder Veränderungen der Depolarisation der Kardiomyozyten durch eine erhöhte Aktivität des sympathischen Nervensystems. Eine sitzende Lebensweise ist mit einem erhöhten Risiko für Vorhofflimmern verbunden, verglichen mit körperlicher Aktivität. Sowohl bei Männern als auch bei Frauen wird das Risiko für Vorhofflimmern durch mäßige körperliche Betätigung schrittweise gesenkt; intensive sportliche Betätigung kann das Risiko für die Entwicklung von Vorhofflimmern erhöhen, wie bei Sportlern zu beobachten ist. Dies ist auf einen Umbau des Herzgewebes und eine Erhöhung des Vagustonus zurückzuführen, wodurch die effektive Refraktärzeit (ERP) verkürzt wird, was den Wiedereintritt aus den Lungenvenen begünstigt. ⓘ
Tabakkonsum
Die Häufigkeit von Vorhofflimmern ist bei Rauchern 1,4-mal höher als bei Nichtrauchern. Der Konsum von Snus, der Nikotin in einer Dosis abgibt, die der von Zigaretten entspricht, und der als Produkt zur Schadensminimierung diskutiert wird, steht jedoch nicht mit Vorhofflimmern in Zusammenhang. ⓘ
Alkohol
Akuter Alkoholkonsum kann direkt eine Episode von Vorhofflimmern auslösen. Auch regelmäßiger Alkoholkonsum erhöht das Risiko für Vorhofflimmern in mehrfacher Hinsicht. Der langfristige Konsum von Alkohol verändert die physikalische Struktur und die elektrischen Eigenschaften der Vorhöfe. Dies geschieht durch wiederholte Stimulierung des sympathischen Nervensystems, Verstärkung von Entzündungen in den Vorhöfen, Erhöhung des Blutdrucks, Senkung des Kalium- und Magnesiumspiegels im Blut, Verschlimmerung der obstruktiven Schlafapnoe und Förderung schädlicher struktureller Veränderungen (Remodeling) in den Vorhöfen und Kammern des Herzens. Dieses Remodeling führt zu einem abnorm erhöhten Druck im linken Vorhof, dehnt diesen in unangemessener Weise aus und verstärkt die Narbenbildung (Fibrose) im linken Vorhof. Die genannten strukturellen Veränderungen erhöhen das Risiko, Vorhofflimmern zu entwickeln, wenn sie mit den schädlichen Veränderungen in der Stromleitung des linken Vorhofs zusammenfallen. ⓘ
Hoher Blutdruck
Nach Angaben des CHARGE-Konsortiums sind sowohl der systolische als auch der diastolische Blutdruck Prädiktoren für das Risiko von Vorhofflimmern. Systolische Blutdruckwerte nahe dem Normalwert begrenzen den Anstieg des mit Vorhofflimmern verbundenen Risikos. Eine diastolische Dysfunktion wird ebenfalls mit Vorhofflimmern in Verbindung gebracht, wodurch sich der Druck im linken Vorhof, das Volumen und die Größe des linken Vorhofs sowie die für chronischen Bluthochdruck charakteristische linksventrikuläre Hypertrophie erhöhen. Das gesamte atriale Remodeling steht im Zusammenhang mit einer heterogenen Reizleitung und der Bildung von Reentranten aus den Pulmonalvenen. ⓘ
Andere Krankheiten
Es besteht ein Zusammenhang zwischen Risikofaktoren wie Fettleibigkeit und Bluthochdruck und dem Auftreten von Krankheiten wie Diabetes mellitus und Schlafapnoe-Hypopnoe-Syndrom, insbesondere obstruktiver Schlafapnoe (OSA). Diese Krankheiten sind aufgrund ihrer umbauenden Wirkung auf den linken Vorhof mit einem erhöhten Risiko für Vorhofflimmern verbunden. ⓘ
Medikamente
Mehrere Medikamente werden mit einem erhöhten Risiko für die Entwicklung von Vorhofflimmern in Verbindung gebracht. Nur wenige Studien haben dieses Phänomen untersucht, und die genaue Häufigkeit von medikamenteninduziertem Vorhofflimmern ist nicht bekannt. Zu den Medikamenten, die häufig mit einem erhöhten Risiko für die Entwicklung von Vorhofflimmern in Verbindung gebracht werden, gehören Dobutamin und das Chemotherapeutikum Cisplatin. Zu den Medikamenten, die mit einem mäßig erhöhten Risiko in Verbindung gebracht werden, gehören nichtsteroidale Entzündungshemmer (z. B. Ibuprofen), Bisphosphonate und andere Chemotherapeutika wie Melphalan, Interleukin 2 und Anthracycline. Andere Medikamente, die das Risiko für Vorhofflimmern selten erhöhen, sind Adenosin, Aminophyllin, Kortikosteroide, Ivabradin, Ondansetron und Antipsychotika. Diese Form des Vorhofflimmerns tritt bei Menschen aller Altersgruppen auf, am häufigsten jedoch bei älteren Menschen, bei Personen mit anderen Risikofaktoren für Vorhofflimmern und nach Herzoperationen. ⓘ
Pathophysiologie
Das normale elektrische Reizleitungssystem des Herzens ermöglicht es, dass sich elektrische Impulse, die vom herzinternen Schrittmacher (dem Sinusknoten) erzeugt werden, in der Muskelschicht des Herzens (Myokard) sowohl in den Vorhöfen als auch in den Herzkammern ausbreiten und diese stimulieren. Wenn der Herzmuskel stimuliert wird, zieht er sich zusammen, und wenn dies in geordneter Weise geschieht, kann das Blut in den Körper gepumpt werden. Bei Vorhofflimmern werden die normalen, regelmäßigen elektrischen Impulse, die vom Sinusknoten erzeugt werden, von desorganisierten elektrischen Wellen überlagert, die in der Regel von den Wurzeln der Lungenvenen ausgehen. Diese desorganisierten Wellen leiten intermittierend durch den Atrioventrikularknoten und führen zu einer unregelmäßigen Aktivierung der Herzkammern, die den Herzschlag erzeugen. ⓘ
Pathologie
Die wichtigste pathologische Veränderung bei Vorhofflimmern ist die fortschreitende Fibrose der Vorhöfe. Diese Fibrose ist in erster Linie auf die Vorhofdilatation zurückzuführen; bei einigen Personen können jedoch auch genetische Ursachen und Entzündungen eine Rolle spielen. Die Erweiterung der Vorhöfe kann auf nahezu jede strukturelle Anomalie des Herzens zurückzuführen sein, die einen Druckanstieg im Herzen verursachen kann. Dazu gehören Herzklappenerkrankungen (wie Mitralstenose, Mitralinsuffizienz und Trikuspidalinsuffizienz), Bluthochdruck und kongestive Herzinsuffizienz. Jede Entzündung, die das Herz betrifft, kann eine Fibrose der Vorhöfe verursachen. Dies ist in der Regel auf eine Sarkoidose zurückzuführen, kann aber auch durch Autoimmunerkrankungen verursacht werden, bei denen Autoantikörper gegen schwere Myosinketten gebildet werden. Eine Mutation des Lamin-AC-Gens wird ebenfalls mit einer Fibrose der Vorhöfe in Verbindung gebracht, die zu Vorhofflimmern führen kann. ⓘ
Sobald eine Dilatation der Vorhöfe eingetreten ist, setzt dies eine Kette von Ereignissen in Gang, die zur Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS) und zum anschließenden Anstieg der Matrix-Metalloproteinasen und des Desintegrins führen, was zu einem Umbau der Vorhöfe und einer Fibrose mit einem Verlust an Vorhofmuskelmasse führt. Dieser Prozess vollzieht sich schrittweise, und experimentelle Studien haben gezeigt, dass eine fleckige Vorhoffibrose dem Auftreten von Vorhofflimmern vorausgehen und bei längerer Dauer des Vorhofflimmerns fortschreiten kann. ⓘ
Die Fibrose ist nicht auf die Muskelmasse der Vorhöfe beschränkt und kann im Sinusknoten (SA-Knoten) und im atrioventrikulären Knoten (AV-Knoten) auftreten, was mit dem Sick-Sinus-Syndrom korreliert. Es hat sich gezeigt, dass längere Episoden von Vorhofflimmern mit einer Verlängerung der Erholungszeit des Sinusknotens korrelieren; dies deutet darauf hin, dass die Dysfunktion des SA-Knotens mit längeren Episoden von Vorhofflimmern fortschreitet. ⓘ
Neben der Fibrose wirken sich Veränderungen in den Vorhöfen, die für Vorhofflimmern prädisponieren, auf deren elektrische Eigenschaften sowie auf ihre Reaktionsfähigkeit auf das autonome Nervensystem aus. Das atriale Remodeling, das die oben beschriebenen pathologischen Veränderungen umfasst, wird als atriale Myopathie bezeichnet. ⓘ
Elektrophysiologie
| Erregungsleitung ⓘ | ||
| Sinusrhythmus | Vorhofflattern | |
Es gibt mehrere Theorien über die Ursache von Vorhofflimmern. Eine wichtige Theorie besagt, dass die regelmäßigen Impulse, die der Sinusknoten für einen normalen Herzschlag erzeugt, durch schnelle elektrische Entladungen in den Vorhöfen und den angrenzenden Teilen der Lungenvenen überlagert werden. Die Quellen dieser Störungen sind entweder automatische Herde, die oft an einer der Lungenvenen lokalisiert sind, oder eine kleine Anzahl von lokalisierten Quellen in Form eines reentrierenden Leitkreises oder elektrischer Spiralwellen (Rotoren); diese lokalisierten Quellen können sich im linken Vorhof in der Nähe der Lungenvenen oder an einer Vielzahl anderer Stellen im linken oder rechten Vorhof befinden. Drei grundlegende Komponenten begünstigen die Entstehung eines führenden Kreises oder eines Rotors: eine langsame Leitungsgeschwindigkeit des kardialen Aktionspotenzials, eine kurze Refraktärzeit und eine kleine Wellenlänge. Dabei ist die Wellenlänge das Produkt aus Geschwindigkeit und Refraktärzeit. Wenn das Aktionspotenzial eine schnelle Erregungsleitung mit einer langen Refraktärzeit und/oder einer Erregungsleitung, die kürzer als die Wellenlänge ist, aufweist, kann kein Vorhofflimmern festgestellt werden. Nach der Multiple-Wavelet-Theorie zerfällt eine Wellenfront in kleinere Tochterwellen, wenn sie auf ein Hindernis trifft, und zwar durch einen Prozess, der Wirbelablösung genannt wird. Unter den richtigen Bedingungen können sich solche Wavelets jedoch neu formieren und um ein Zentrum drehen, wodurch ein Vorhofflimmern entsteht. ⓘ
In einem Herzen mit Vorhofflimmern kann die erhöhte Kalziumfreisetzung aus dem sarkoplasmatischen Retikulum und die erhöhte Kalziumempfindlichkeit zu einer Akkumulation von intrazellulärem Kalzium führen und eine Herunterregulierung der L-Typ-Kalziumkanäle bewirken. Dies verkürzt die Dauer des Aktionspotenzials und die Refraktärzeit und begünstigt so die Leitung von Reentrant-Wellen. Eine erhöhte Expression von einwärtsgerichteten Kalium-Ionenkanälen kann zu einer Verkürzung der atrialen Refraktärzeit und Wellenlänge führen. Die abnormale Verteilung von Gap Junction-Proteinen wie GJA1 (auch als Connexin 43 bekannt) und GJA5 (Connexin 40) führt zu einer Ungleichmäßigkeit der elektrischen Leitung und damit zur Arrhythmie. ⓘ
Vorhofflattern kann von Vorhofflattern (AFL) unterschieden werden, das als organisierter elektrischer Kreislauf meist im rechten Vorhof auftritt. AFL erzeugt auf dem EKG charakteristische sägezahnförmige F-Wellen mit konstanter Amplitude und Frequenz, während Vorhofflattern dies nicht tut. Bei der AFL zirkulieren die Entladungen schnell mit einer Rate von 300 Schlägen pro Minute (bpm) um den Vorhof. Beim Vorhofflattern gibt es keine solche Regelmäßigkeit, außer an den Quellen, wo die lokale Aktivierungsrate 500 Schläge pro Minute übersteigen kann. Obwohl Vorhofflattern und Vorhofflattern unterschiedliche Rhythmusstörungen sind, kann Vorhofflattern in Vorhofflattern ausarten, und beide Rhythmusstörungen können bei einer Person zu unterschiedlichen Zeiten auftreten. ⓘ
Obwohl die elektrischen Impulse des Vorhofflatterns mit einer hohen Frequenz auftreten, führen die meisten von ihnen nicht zu einem Herzschlag. Ein Herzschlag entsteht, wenn ein elektrischer Impuls von den Vorhöfen durch den atrioventrikulären (AV) Knoten zu den Herzkammern gelangt und diese zur Kontraktion veranlasst. Würden beim Vorhofflimmern alle Impulse aus den Vorhöfen durch den AV-Knoten geleitet, käme es zu einer schweren ventrikulären Tachykardie, die zu einer starken Verringerung der Herzleistung führt. Diese gefährliche Situation wird durch den AV-Knoten verhindert, da seine begrenzte Leitungsgeschwindigkeit die Geschwindigkeit reduziert, mit der die Impulse während des Vorhofflimmerns die Herzkammern erreichen. ⓘ
Diagnose


Die Bewertung von Vorhofflimmern umfasst die Bestimmung der Ursache der Arrhythmie und die Klassifizierung der Arrhythmie. Die diagnostische Untersuchung von Vorhofflimmern umfasst in der Regel eine vollständige Anamnese und körperliche Untersuchung, ein EKG, ein transthorakales Echokardiogramm, ein komplettes Blutbild und den Serumspiegel des schilddrüsenstimulierenden Hormons. ⓘ
Screening
Zahlreiche Leitlinien empfehlen ein opportunistisches Screening auf Vorhofflimmern bei Personen ab 65 Jahren. Zu diesen Organisationen gehören die: - Europäische Gesellschaft für Kardiologie, - National Heart Foundation of Australia und die Cardiac Society of Australia and New Zealand - Europäische Gesellschaft für Herzrhythmus, - die internationale AF-SCREEN-Zusammenarbeit, - Royal College of Physicians of Edinburgh - Europäische Gesellschaft für kardiovaskuläre Grundversorgung, und - Irische Behörde für Gesundheitsinformation und -qualität. ⓘ
Durch das Screening zu einem einzigen Zeitpunkt wird nicht diagnostiziertes Vorhofflimmern, das häufig asymptomatisch ist, bei etwa 1,4 % der Menschen in dieser Altersgruppe entdeckt. In einer schottischen Untersuchung über Vorhofflimmern wurde geschätzt, dass bis zu einem Drittel der Menschen mit Vorhofflimmern nicht diagnostiziert wird. Dennoch befand die United States Preventive Services Task Force im Jahr 2018, dass es keine ausreichenden Beweise für den Nutzen eines Routine-Screenings gibt. Da es wichtig ist, einen Weg zur Behandlung zu finden, ist die Allgemeinmedizin ein ideales Umfeld für die Durchführung von Vorhofflimmer-Screenings. Die Allgemeinmedizin wurde im AF-SCREEN-Bericht der internationalen Zusammenarbeit als bevorzugtes Umfeld für das Vorhofflimmern-Screening bezeichnet, da dort Pflegepersonal zur Verfügung steht und ein natürlicher Weg zur Behandlung besteht. In einer Reihe von Ländern wurde das Screening in der Primärversorgung bereits erprobt. Dazu gehören: eine aktuelle kanadische Studie, die in 184 Allgemeinarztpraxen durchgeführt wurde; ein Screening-Programm, das parallel zu Grippeimpfungen in 10 niederländischen Praxen durchgeführt wurde; und mehrere australische Studien, die zeigten, dass ein opportunistisches Screening in der Primärversorgung durch Hausärzte und Krankenschwestern unter Verwendung von eHealth-Tools machbar ist. ⓘ
Minimale Bewertung
Im Allgemeinen sollte bei allen Personen mit Vorhofflimmern eine Minimaluntersuchung durchgeführt werden. Ziel dieser Untersuchung ist es, das allgemeine Behandlungsschema für die betreffende Person festzulegen. Wenn die Ergebnisse der allgemeinen Untersuchung dies rechtfertigen, können weitere Untersuchungen durchgeführt werden. ⓘ
Anamnese und körperliche Untersuchung
Die Anamnese der Vorhofflimmern-Episoden des Patienten ist wahrscheinlich der wichtigste Teil der Untersuchung. Es sollte unterschieden werden zwischen Personen, die bei Vorhofflimmern völlig asymptomatisch sind (in diesem Fall wird das Vorhofflimmern als Zufallsbefund bei einem EKG oder einer körperlichen Untersuchung festgestellt), und solchen, die grobe und offensichtliche Symptome aufgrund von Vorhofflimmern haben und genau bestimmen können, wann sie Vorhofflimmern bekommen oder in den Sinusrhythmus zurückkehren. ⓘ
Routinemäßige Blutuntersuchungen
Viele Fälle von Vorhofflimmern haben keine eindeutige Ursache, sondern können die Folge verschiedener anderer Probleme sein. Daher werden routinemäßig die Nierenfunktion und die Elektrolyte bestimmt, ebenso wie das schilddrüsenstimulierende Hormon (das bei einer Schilddrüsenüberfunktion häufig unterdrückt wird und bei der Behandlung mit Amiodaron von Bedeutung ist) und ein Blutbild. ⓘ
Bei akutem Vorhofflimmern, das mit Brustschmerzen einhergeht, können kardiale Troponine oder andere Marker für eine Schädigung des Herzmuskels angeordnet werden. Gerinnungsuntersuchungen (INR/aPTT) werden in der Regel durchgeführt, da eine gerinnungshemmende Medikation eingeleitet werden kann. ⓘ
Elektrokardiogramm

Vorhofflimmern wird durch ein Elektrokardiogramm (EKG) diagnostiziert, eine Untersuchung, die routinemäßig durchgeführt wird, wenn ein unregelmäßiger Herzschlag vermutet wird. Charakteristische Befunde sind das Fehlen von P-Wellen, an deren Stelle eine desorganisierte elektrische Aktivität tritt, und unregelmäßige R-R-Intervalle, die auf eine unregelmäßige Weiterleitung von Impulsen an die Herzkammern zurückzuführen sind. Bei sehr schnellen Herzfrequenzen kann das Vorhofflimmern regelmäßiger aussehen, was die Abgrenzung zu anderen supraventrikulären Tachykardien oder ventrikulären Tachykardien erschweren kann. ⓘ
Die QRS-Komplexe sollten schmal sein, was bedeutet, dass sie durch eine normale Leitung der elektrischen Aktivität des Vorhofs durch das intraventrikuläre Leitungssystem ausgelöst werden. Breite QRS-Komplexe sind besorgniserregend für ventrikuläre Tachykardien, obwohl in Fällen, in denen eine Erkrankung des Reizleitungssystems vorliegt, breite Komplexe bei Vorhofflimmern mit einer schnellen ventrikulären Reaktion vorhanden sein können. ⓘ
Wenn der Verdacht auf paroxysmales Vorhofflimmern besteht, das EKG in der Sprechstunde aber nur einen regelmäßigen Rhythmus zeigt, können Vorhofflimmern-Episoden mit Hilfe eines ambulanten Holter-Monitorings (z. B. für einen Tag) aufgespürt und dokumentiert werden. Wenn die Vorhofflimmern-Episoden zu selten sind, um durch Holter-Monitoring mit hinreichender Wahrscheinlichkeit erkannt zu werden, kann die Person über längere Zeiträume (z. B. einen Monat) mit einem ambulanten Ereignis-Monitor überwacht werden. ⓘ
Echokardiographie
Im Allgemeinen wird bei neu diagnostiziertem Vorhofflimmern sowie bei einer wesentlichen Veränderung des klinischen Zustands des Betroffenen ein nicht-invasives transthorakales Echokardiogramm (TTE) durchgeführt. Diese Ultraschalluntersuchung des Herzens kann helfen, Herzklappenerkrankungen (die das Schlaganfallrisiko stark erhöhen und die Empfehlungen für die geeignete Art der Antikoagulation ändern können), die Größe des linken und rechten Vorhofs (die die Wahrscheinlichkeit eines dauerhaften Vorhofflimmerns vorhersagt), die Größe und Funktion der linken Herzkammer, den Spitzendruck in der rechten Herzkammer (Lungenhochdruck), das Vorhandensein eines Thrombus im linken Vorhof (geringe Empfindlichkeit), das Vorhandensein einer linksventrikulären Hypertrophie und eine Herzbeutelerkrankung zu erkennen. ⓘ
Eine deutliche Vergrößerung sowohl des linken als auch des rechten Vorhofs geht mit lang anhaltendem Vorhofflimmern einher und deutet, wenn sie bei der Erstvorstellung von Vorhofflimmern festgestellt wird, darauf hin, dass das Vorhofflimmern wahrscheinlich länger andauert als die Symptome des Betroffenen. ⓘ
Erweiterte Untersuchung
Im Allgemeinen ist eine erweiterte Untersuchung bei den meisten Personen mit Vorhofflimmern nicht erforderlich und wird nur durchgeführt, wenn bei der begrenzten Untersuchung Anomalien festgestellt werden, wenn eine reversible Ursache für das Vorhofflimmern vermutet wird oder wenn eine weitere Untersuchung den Behandlungsverlauf ändern könnte. ⓘ
Röntgen des Brustkorbs
Im Allgemeinen wird eine Röntgenuntersuchung des Brustkorbs nur dann durchgeführt, wenn eine pulmonale Ursache für das Vorhofflimmern vermutet wird oder wenn andere Herzerkrankungen vermutet werden (insbesondere eine kongestive Herzinsuffizienz). Dadurch kann ein zugrunde liegendes Problem in der Lunge oder den Blutgefäßen im Brustkorb aufgedeckt werden. Insbesondere wenn der Verdacht auf eine Lungenentzündung besteht, kann die Behandlung der Lungenentzündung dazu führen, dass das Vorhofflimmern von selbst aufhört. ⓘ
Transösophageales Echokardiogramm
Ein normales Echokardiogramm (transthorakales Echo/TTE) hat eine geringe Empfindlichkeit für die Erkennung von Blutgerinnseln im Herzen. Besteht der Verdacht darauf (z. B. bei der Planung einer dringenden elektrischen Kardioversion), wird ein transösophageales Echokardiogramm/TEE (oder TOE, wenn die britische Schreibweise verwendet wird) bevorzugt. ⓘ
Mit der TEE lässt sich der linke Vorhofanhang viel besser darstellen als mit der transthorakalen Echokardiographie. Diese Struktur, die sich im linken Vorhof befindet, ist der Ort, an dem sich in mehr als 90 % der Fälle von nicht-valvulärem (oder nicht-rheumatischem) Vorhofflimmern ein Blutgerinnsel bildet. Die TEE hat eine hohe Empfindlichkeit für die Lokalisierung von Thromben in diesem Bereich und kann auch einen langsamen Blutfluss in diesem Bereich feststellen, der auf die Bildung eines Blutgerinnsels hindeutet. ⓘ
Wird bei der TEE ein Blutgerinnsel festgestellt, ist eine Kardioversion aufgrund des Schlaganfallrisikos kontraindiziert, und es wird eine Antikoagulation empfohlen. ⓘ
Ambulante Holter-Überwachung
Ein Holter-Monitor ist ein tragbarer, ambulanter Herzmonitor, der die Herzfrequenz und den Herzrhythmus über einen kurzen Zeitraum, in der Regel 24 Stunden, kontinuierlich überwacht. Bei Personen mit Symptomen wie erheblicher Kurzatmigkeit bei Anstrengung oder regelmäßigem Herzklopfen kann ein Holter-Monitor von Nutzen sein, um festzustellen, ob schnelle Herzfrequenzen (oder ungewöhnlich langsame Herzfrequenzen) während des Vorhofflimmerns die Ursache für die Symptome sind. ⓘ
Belastungstests
Manche Menschen mit Vorhofflimmern kommen mit normaler Aktivität gut zurecht, entwickeln aber bei Anstrengung Kurzatmigkeit. Es kann unklar sein, ob die Kurzatmigkeit auf eine abgestumpfte Reaktion der Herzfrequenz auf Anstrengung zurückzuführen ist, die durch übermäßige Wirkstoffe zur Blockierung des atrioventrikulären Knotens, eine sehr schnelle Herzfrequenz während der Anstrengung oder andere Grunderkrankungen wie chronische Lungenerkrankungen oder koronare Ischämie verursacht wird. Bei einem Belastungstest wird die Reaktion der Herzfrequenz auf Belastung ermittelt und festgestellt, ob die AV-Knoten-Blocker zu den Symptomen beitragen. ⓘ
Klassifizierung
| AF-Kategorie | Definierende Merkmale |
|---|---|
| Erstmals festgestellt | nur eine diagnostizierte Episode |
| Paroxysmal | wiederkehrende Anfälle, die in weniger als sieben Tagen von selbst aufhören |
| Anhaltend | wiederkehrende Episoden, die länger als sieben Tage andauern |
| Lang anhaltend Persistierend | wiederkehrende Anfälle, die länger als zwölf Monate andauern |
| Dauerhaft | Vorhofflimmern, das akzeptiert wurde und für das eine ausschließliche Frequenzkontrollstrategie beschlossen wurde. |
Das American College of Cardiology (ACC), die American Heart Association (AHA) und die European Society of Cardiology (ESC) empfehlen in ihren Leitlinien das folgende Klassifizierungssystem, das auf Einfachheit und klinischer Relevanz beruht. ⓘ
Alle Menschen mit Vorhofflimmern fallen zunächst in die Kategorie des zuerst entdeckten Vorhofflimmerns. Diese Menschen können vorher unentdeckte Episoden gehabt haben oder auch nicht. Wenn eine erste nachgewiesene Episode in weniger als sieben Tagen von selbst aufhört und später eine weitere Episode beginnt, ändert sich die Kategorie in paroxysmales Vorhofflimmern. Obwohl Menschen in dieser Kategorie Anfälle haben, die bis zu sieben Tage dauern, hören die Anfälle in den meisten Fällen von paroxysmalem Vorhofflimmern in weniger als 24 Stunden auf. Hält die Episode länger als sieben Tage an, ist es unwahrscheinlich, dass sie von selbst wieder aufhört, und man spricht dann von persistierendem Vorhofflimmern. In diesem Fall kann eine Kardioversion versucht werden, um einen normalen Rhythmus wiederherzustellen. Hält eine Episode ein Jahr oder länger an, spricht man von lang anhaltendem Vorhofflimmern. Wenn der Betroffene und sein medizinisches Team beschließen, das persistierende Vorhofflimmern zu akzeptieren und nicht zu versuchen, einen normalen Sinusrhythmus wiederherzustellen, sondern das Vorhofflimmern durch einfache Kontrolle der Herzfrequenz zu behandeln, wird der Rhythmus als permanentes Vorhofflimmern bezeichnet. Eine weitere Unterart ist das Vorhofflimmern, das nur durch einen implantierten oder tragbaren Herzmonitor erkannt wird, das so genannte subklinische Vorhofflimmern. ⓘ
Episoden, die weniger als 30 Sekunden andauern, werden in diesem Klassifizierungssystem nicht berücksichtigt. Außerdem gilt dieses System nicht für Fälle, in denen das Vorhofflimmern eine sekundäre Erkrankung ist, die im Zusammenhang mit einer primären Erkrankung auftritt, die möglicherweise die Ursache für das Vorhofflimmern ist. ⓘ
Etwa die Hälfte der Menschen mit Vorhofflimmern hat permanentes Vorhofflimmern, ein Viertel hat paroxysmales Vorhofflimmern und ein Viertel hat persistierendes Vorhofflimmern. ⓘ
Zusätzlich zu den oben genannten Kategorien von Vorhofflimmern, die hauptsächlich durch den Zeitpunkt und die Beendigung der Anfälle definiert sind, beschreiben die ACC/AHA/ESC-Leitlinien weitere Kategorien von Vorhofflimmern in Bezug auf andere Merkmale der Person. Valvuläres Vorhofflimmern bezieht sich auf Vorhofflimmern, das auf eine mittelschwere bis schwere Mitralklappenstenose oder Vorhofflimmern bei Vorhandensein einer mechanischen künstlichen Herzklappe zurückzuführen ist. Diese Unterscheidung kann nützlich sein, da sie Auswirkungen auf die angemessene Behandlung hat, einschließlich unterschiedlicher Empfehlungen für die Antikoagulation, aber die neuesten Leitlinien raten von der Verwendung dieses Begriffs ab, da er verwirrend sein kann. Andere in der Vergangenheit verwendete Definitionen beinhalten einsames Vorhofflimmern - Vorhofflimmern, das bei Personen unter 60 Jahren auftritt, ohne dass andere kardiovaskuläre oder respiratorische Erkrankungen vorliegen. Von dieser Beschreibung wird ebenfalls abgeraten, da anerkannt ist, dass Vorhofflimmern immer eine zugrundeliegende Ursache hat. Sekundäres Vorhofflimmern bezieht sich auf Vorhofflimmern, das im Zusammenhang mit einer anderen Erkrankung auftritt, die das Vorhofflimmern verursacht hat, z. B. akuter Myokardinfarkt, Herzoperation, Perikarditis, Myokarditis, Schilddrüsenüberfunktion, Lungenembolie, Lungenentzündung oder eine andere akute Lungenerkrankung. ⓘ
Vorbeugung
Die Prävention von Vorhofflimmern konzentriert sich in erster Linie auf die Vermeidung oder Kontrolle der Risikofaktoren. Viele der Risikofaktoren, wie Übergewicht, Rauchen, Bewegungsmangel und übermäßiger Alkoholkonsum, lassen sich durch eine Änderung des Lebensstils beeinflussen und verhindern oder können von medizinischem Fachpersonal behandelt werden. ⓘ
Änderung des Lebensstils
Mehrere gesunde Lebensweisen werden mit einer geringeren Wahrscheinlichkeit in Verbindung gebracht, Vorhofflimmern zu entwickeln. Dementsprechend wird in den Konsensleitlinien empfohlen, auf Alkohol und Freizeitdrogen zu verzichten, den Tabakkonsum einzustellen, ein gesundes Gewicht zu halten und regelmäßig an körperlichen Aktivitäten mittlerer Intensität teilzunehmen. Konsequentes aerobes Training mit moderater Intensität (definiert als 3,0-5,9 METs) für mindestens 150 Minuten pro Woche kann das Risiko für neu auftretendes Vorhofflimmern verringern. Nur wenige Studien haben die Rolle spezifischer Ernährungsumstellungen und deren Zusammenhang mit der Prävention von Vorhofflimmern untersucht. ⓘ
Behandlung
Das Hauptziel der Behandlung besteht darin, Kreislaufinstabilität und Schlaganfall zu verhindern. Ersteres wird durch Frequenz- oder Rhythmuskontrolle erreicht, letzteres durch Antikoagulation. Bei kardiovaskulärer Instabilität aufgrund einer unkontrollierten Tachykardie ist eine sofortige Kardioversion angezeigt. Viele Antiarrhythmika erhöhen bei langfristiger Anwendung das Sterberisiko, ohne dass sie einen nennenswerten Nutzen haben. Ein integrierter Behandlungsansatz, der die Prävention von Schlaganfällen, die Kontrolle der Symptome und die Behandlung von Begleiterkrankungen einschließt, führte zu besseren Ergebnissen bei Patienten mit Vorhofflimmern. ⓘ
Änderung des Lebensstils
Regelmäßiges aerobes Training verbessert die Symptome von Vorhofflimmern und die mit Vorhofflimmern verbundene Lebensqualität. Die Wirkung von hochintensivem Intervalltraining auf die Verringerung der Belastung durch Vorhofflimmern ist unklar. Eine Gewichtsabnahme von mindestens 10 % ist bei übergewichtigen oder fettleibigen Personen mit einer geringeren Belastung durch Vorhofflimmern verbunden. ⓘ
Behandlung von Komorbiditäten
Bei Menschen, die sowohl an Vorhofflimmern als auch an obstruktiver Schlafapnoe leiden, deuten Beobachtungsstudien darauf hin, dass die Behandlung mit kontinuierlichem positivem Atemwegsdruck (CPAP) das Risiko eines erneuten Auftretens von Vorhofflimmern nach einer Ablation zu senken scheint. Randomisierte, kontrollierte Studien, die den Einfluss einer Behandlung der obstruktiven Schlafapnoe auf die Häufigkeit und Belastung durch Vorhofflimmern untersuchen, liegen nicht vor. Für Menschen mit Vorhofflimmern und gleichzeitig bestehenden Erkrankungen wie Hyperlipidämie, Diabetes mellitus oder Bluthochdruck werden in Leitlinien empfohlene Lebensstilmaßnahmen und medizinische Interventionen empfohlen, ohne dass jedoch spezifische Blutzucker- oder Blutdruckziele für Menschen mit Vorhofflimmern festgelegt werden. Eine bariatrische Operation kann das Risiko eines neu auftretenden Vorhofflimmerns bei Menschen mit Adipositas ohne Vorhofflimmern und das Risiko eines erneuten Auftretens von Vorhofflimmern nach einem Ablationsverfahren bei Menschen mit gleichzeitiger Adipositas und Vorhofflimmern verringern. Für alle Menschen mit Vorhofflimmern ist es wichtig, alle gleichzeitig bestehenden Erkrankungen, die das Vorhofflimmern verschlimmern können, wie Schilddrüsenüberfunktion, Diabetes, kongestive Herzinsuffizienz, Bluthochdruck, chronisch obstruktive Lungenerkrankung, Konsum von Stimulanzien (z. B. Methamphetaminabhängigkeit) und übermäßiger Alkoholkonsum, optimal zu kontrollieren. ⓘ
Gerinnungshemmende Mittel
Eine Antikoagulation kann das Risiko eines Schlaganfalls durch Vorhofflimmern verringern. Eine Antikoagulation wird bei den meisten Menschen empfohlen, mit Ausnahme derjenigen, die ein geringes Schlaganfallrisiko oder ein hohes Blutungsrisiko haben. Das Risiko von Stürzen und daraus resultierenden Blutungen bei gebrechlichen älteren Menschen sollte kein Hinderungsgrund sein, eine Antikoagulation einzuleiten oder fortzusetzen, da das Risiko einer sturzbedingten Hirnblutung gering ist und der Nutzen der Schlaganfallprävention das Blutungsrisiko oft überwiegt. Auch das Vorhandensein oder Fehlen von Vorhofflimmern entscheidet nicht darüber, ob eine Person eine Antikoagulation benötigt, und ist kein Indikator für das Schlaganfallrisiko. Die orale Antikoagulation wird bei Vorhofflimmern zu wenig eingesetzt, während Aspirin bei vielen Personen, die mit einem direkten oralen Antikoagulans (DOAC) oder Warfarin behandelt werden sollten, zu häufig eingesetzt wird. Im Jahr 2019 wurden DOACs von der American Heart Association häufig gegenüber Warfarin empfohlen. ⓘ
Das Schlaganfallrisiko bei nicht valvulärem Vorhofflimmern kann anhand des CHA2DS2-VASc-Scores abgeschätzt werden. In den AHA/ACC/HRS-Leitlinien 2019 wird eine Antikoagulation bei nicht-valvulärem Vorhofflimmern empfohlen, wenn der Score bei Männern zwei oder mehr und bei Frauen drei oder mehr beträgt, und kann in Betracht gezogen werden, wenn der Score bei Männern eins oder bei Frauen zwei beträgt; der Verzicht auf eine Antikoagulation ist sinnvoll, wenn der Score bei Männern null oder bei Frauen eins beträgt. In den Leitlinien des American College of Chest Physicians, der Asia-Pacific Heart Rhythm Society, der Canadian Cardiovascular Society, der European Society of Cardiology, der Japanese Circulation Society, der Korean Heart Rhythm Society und des National Institute for Health and Care Excellence wird empfohlen, bei einem CHA2DS2-VASc-Score von eins neuartige orale Antikoagulanzien oder Warfarin anstelle von Aspirin zu verwenden, und einige raten direkt von Aspirin ab. Experten sprechen sich im Allgemeinen dafür aus, dass die meisten Menschen mit Vorhofflimmern mit CHA2DS2-VASc-Scores von eins oder mehr eine Antikoagulation erhalten, obwohl Aspirin manchmal auch bei Menschen mit einem Score von eins (mäßiges Schlaganfallrisiko) eingesetzt wird. Es gibt kaum Belege dafür, dass die Einnahme von Aspirin das Schlaganfallrisiko bei Menschen mit Vorhofflimmern signifikant verringert. Außerdem ist das Risiko für schwere Blutungen (einschließlich Blutungen im Gehirn) bei Aspirin ähnlich hoch wie bei Warfarin und DOACs, obwohl es weniger wirksam ist. ⓘ
Die Antikoagulation kann durch verschiedene Mittel erreicht werden, darunter Warfarin, Heparin, Dabigatran, Rivaroxaban, Edoxaban und Apixaban. Im Hinblick auf ihre vergleichende Wirksamkeit sollten viele Aspekte berücksichtigt werden, darunter die Kosten der DOACs, das Schlaganfallrisiko, das Sturzrisiko, Begleiterkrankungen (wie chronische Leber- oder Nierenerkrankungen), das Vorhandensein einer signifikanten Mitralstenose oder mechanischer Herzklappen, die Compliance und die Geschwindigkeit des gewünschten Beginns der Antikoagulation. Die optimale Vorgehensweise bei der Antikoagulation von Menschen mit Vorhofflimmern, die gleichzeitig an anderen Krankheiten leiden (z. B. Leberzirrhose und Nierenerkrankung im Endstadium mit Dialyse), die sowohl für Blutungen als auch für Gerinnungskomplikationen prädisponieren, ist unklar. ⓘ
Bei Personen mit nichtvalvulärem Vorhofflimmern sind DOACs mindestens so wirksam wie Warfarin zur Verhinderung von Schlaganfällen und Blutgerinnseln, die in den Körperkreislauf embolisieren (wenn nicht sogar wirksamer), und werden im Allgemeinen gegenüber Warfarin bevorzugt. DOACs bergen im Vergleich zu Warfarin ein geringeres Risiko von Blutungen im Gehirn, obwohl Dabigatran mit einem höheren Risiko von Darmblutungen verbunden ist. Eine duale Thrombozytenaggregationshemmer-Therapie mit Aspirin und Clopidogrel ist in Bezug auf die Schlaganfallprävention Warfarin unterlegen und hat ein vergleichbares Blutungsrisiko bei Menschen mit Vorhofflimmern. Bei Personen, die auch Aspirin einnehmen, scheinen DOACs jedoch besser zu sein als Warfarin. ⓘ
Warfarin ist das empfohlene Antikoagulans der Wahl für Personen mit valvulärem Vorhofflimmern (Vorhofflimmern bei Vorhandensein einer mechanischen Herzklappe und/oder mittelschwerer Mitralklappenstenose). Eine Ausnahme von dieser Empfehlung besteht bei Personen mit valvulärem Vorhofflimmern, die nicht in der Lage sind, einen therapeutischen INR-Wert unter Warfarin aufrechtzuerhalten; in diesen Fällen wird eine Behandlung mit einem DOAC empfohlen. ⓘ
Frequenz- versus Rhythmuskontrolle
Es gibt zwei Möglichkeiten, Vorhofflimmern medikamentös zu behandeln: Frequenzkontrolle und Rhythmuskontrolle. Beide Methoden führen zu ähnlichen Ergebnissen. Bei der Frequenzkontrolle wird die Herzfrequenz näher an den Normalwert gesenkt, in der Regel auf 60 bis 100 Schläge pro Minute, ohne dass versucht wird, einen regelmäßigen Rhythmus zu erreichen. Bei der Rhythmuskontrolle wird versucht, einen normalen Herzrhythmus durch eine so genannte Kardioversion wiederherzustellen, und der normale Rhythmus wird mit Medikamenten aufrechterhalten. Studien deuten darauf hin, dass die Rhythmuskontrolle bei akutem Vorhofflimmern wichtiger ist, während die Frequenzkontrolle in der chronischen Phase wichtiger ist. ⓘ
Das Schlaganfallrisiko scheint bei einer Frequenzkontrolle geringer zu sein als bei einer versuchten Rhythmuskontrolle, zumindest bei Personen mit Herzinsuffizienz. Vorhofflimmern wird mit einer verminderten Lebensqualität in Verbindung gebracht, und während einige Studien darauf hinweisen, dass die Rhythmuskontrolle zu einer höheren Lebensqualität führt, haben andere keinen Unterschied festgestellt. ⓘ
Weder die Frequenz- noch die Rhythmuskontrolle sind bei Menschen mit Herzinsuffizienz überlegen, wenn sie in verschiedenen klinischen Studien verglichen werden. Dennoch wird die Frequenzkontrolle als erste Behandlungsmethode für Menschen mit Herzinsuffizienz empfohlen. Eine Rhythmuskontrolle wird dagegen nur dann empfohlen, wenn trotz einer angemessenen Therapie zur Frequenzkontrolle anhaltende Symptome auftreten. ⓘ
Bei Personen mit einer schnellen ventrikulären Reaktion erhöht die intravenöse Gabe von Magnesium die Chancen auf eine erfolgreiche Frequenz- und Rhythmuskontrolle in der Notfallsituation ohne größere Nebenwirkungen erheblich. Bei Personen mit schlechten Vitalparametern, Veränderungen des mentalen Status, Präexzitation oder Brustschmerzen wird häufig eine sofortige Behandlung mit synchronisierter DC-Kardioversion durchgeführt. Andernfalls wird die Entscheidung zwischen Frequenzkontrolle und medikamentöser Rhythmuskontrolle getroffen. Diese Entscheidung basiert auf mehreren Kriterien, zu denen auch die Frage gehört, ob die Symptome bei einer Rhythmuskontrolle anhalten oder nicht. ⓘ
Frequenzkontrolle
Bei den meisten Menschen wird eine Frequenzkontrolle auf eine Zielherzfrequenz von weniger als 110 Schlägen pro Minute empfohlen. Bei Personen mit linksventrikulärer Hypertrophie oder eingeschränkter linksventrikulärer Funktion können niedrigere Herzfrequenzen empfohlen werden. Die Kontrolle der Herzfrequenz wird mit Medikamenten erreicht, die den Grad der Blockade auf der Ebene des AV-Knotens erhöhen und so die Anzahl der Impulse, die in die Herzkammern geleitet werden, verringern. Dies kann geschehen durch:
- Betablocker (vorzugsweise die "kardioselektiven" Betablocker wie Metoprolol, Bisoprolol oder Nebivolol)
- Nicht-Dihydropyridin-Kalziumkanalblocker (z. B. Diltiazem oder Verapamil)
- Herzglykoside (z. B. Digoxin) - werden seltener eingesetzt, außer bei älteren Menschen, die sich nicht bewegen. Sie sind nicht so wirksam wie Betablocker oder Kalziumkanalblocker. ⓘ
Patienten mit chronischem Vorhofflimmern wird empfohlen, entweder Betablocker oder Kalziumkanalblocker einzunehmen. ⓘ
Zusätzlich zu diesen Wirkstoffen hat Amiodaron eine gewisse AV-Knoten-blockierende Wirkung (insbesondere bei intravenöser Verabreichung) und kann bei Personen eingesetzt werden, bei denen andere Wirkstoffe kontraindiziert oder unwirksam sind (insbesondere aufgrund von Hypotonie). ⓘ
Kardioversion
Bei der Kardioversion wird versucht, einen unregelmäßigen Herzschlag durch elektrische oder chemische Mittel in einen normalen Herzschlag umzuwandeln.
- Bei der elektrischen Kardioversion wird der normale Herzrhythmus durch die Anwendung eines elektrischen Gleichstromschocks wiederhergestellt. Die genaue Platzierung der Elektroden scheint nicht wichtig zu sein.
- Die chemische Kardioversion wird mit Medikamenten wie Amiodaron, Dronedaron, Procainamid (insbesondere bei vorerregtem Vorhofflimmern), Dofetilid, Ibutilid, Propafenon oder Flecainid durchgeführt. ⓘ
Nach erfolgreicher Kardioversion kann das Herz betäubt sein, was bedeutet, dass ein normaler Rhythmus vorliegt, aber die Wiederherstellung der normalen Vorhofkontraktion noch nicht stattgefunden hat. ⓘ
Chirurgie
Ablation
Die Katheterablation (CA) ist ein Verfahren, das von einem Elektrophysiologen, einem auf Herzrhythmusstörungen spezialisierten Kardiologen, durchgeführt wird, um den normalen Herzrhythmus durch Zerstörung oder elektrische Isolierung bestimmter Teile der Vorhöfe wiederherzustellen. Eine Gruppe von Kardiologen unter der Leitung von Dr. Haïssaguerre vom Universitätskrankenhaus Bordeaux stellte 1998 fest, dass die Lungenvenen eine wichtige Quelle für ektopische Schläge sind, die häufige Paroxysmen von Vorhofflimmern auslösen, wobei diese Herde auf die Behandlung mit der Radiofrequenzablation ansprechen. In den meisten Fällen wird bei der CA der linke Vorhof elektrisch von den Lungenvenen isoliert, wo der Großteil der abnormen elektrischen Aktivität, die das Vorhofflimmern auslöst, ihren Ursprung hat. Die CA ist eine Form der Rhythmuskontrolle, die den normalen Sinusrhythmus wiederherstellt und die mit dem Vorhofflimmern verbundenen Symptome zuverlässiger reduziert als Antiarrhythmika. Elektrophysiologen verwenden im Allgemeinen zwei Formen der Katheterablation - die Hochfrequenzablation oder die Kryoablation. Bei jungen Menschen mit wenig bis gar keiner strukturellen Herzerkrankung, bei denen eine Rhythmuskontrolle erwünscht ist und die nicht durch Medikamente oder Kardioversion aufrechterhalten werden kann, kann die Radiofrequenz-Katheterablation oder die Kryoablation versucht werden und ist möglicherweise einer mehrjährigen medikamentösen Therapie vorzuziehen. Obwohl die Radiofrequenzablation bei ausgewählten jüngeren Menschen inzwischen ein akzeptierter Eingriff ist und die Symptome und die Lebensqualität möglicherweise wirksamer als eine medikamentöse Behandlung verbessert, gibt es keine Belege dafür, dass die Ablation die Gesamtmortalität, Schlaganfälle oder Herzversagen verringert. Einiges deutet darauf hin, dass die CA besonders hilfreich für Menschen mit Vorhofflimmern sein kann, die auch an Herzinsuffizienz leiden. Vorhofflimmern kann bei Patienten, die sich einer CA unterzogen haben, erneut auftreten, und fast die Hälfte der Patienten, die sich einer CA unterzogen haben, benötigen einen erneuten Eingriff, um ihr Vorhofflimmern langfristig zu kontrollieren. Im Allgemeinen ist die CA erfolgreicher bei der Verhinderung des Wiederauftretens von Vorhofflimmern, wenn es sich um paroxysmales Vorhofflimmern handelt und nicht um persistierendes. Da die CA das Schlaganfallrisiko nicht senkt, wird vielen empfohlen, ihre Antikoagulation fortzusetzen. Zu den möglichen Komplikationen gehören häufige, geringfügige Komplikationen wie die Bildung einer Blutansammlung an der Stelle, an der der Katheter in die Vene eingeführt wird (Hämatom an der Zugangsstelle), aber auch gefährlichere Komplikationen wie Blutungen in der Umgebung des Herzens (Herztamponade), Schlaganfall, Schädigung der Speiseröhre (atrio-ösophageale Fistel) oder sogar Tod. ⓘ
Eine Alternative zur Katheterablation ist die chirurgische Ablation. Das Maze-Verfahren, das erstmals 1987 durchgeführt wurde, ist eine wirksame invasive chirurgische Behandlung, die darauf abzielt, elektrische Blockaden oder Barrieren in den Vorhöfen des Herzens zu erzeugen. Dadurch sollen abnormale elektrische Signale gezwungen werden, sich auf einem einzigen, einheitlichen Weg zu den unteren Herzkammern (Ventrikeln) zu bewegen, wodurch der normale Herzrhythmus wiederhergestellt wird. Menschen mit Vorhofflimmern unterziehen sich häufig aus anderen Gründen einer Herzoperation und bekommen häufig eine begleitende Operation angeboten, um die Häufigkeit von kurz- und langfristigem Vorhofflimmern zu verringern. Eine begleitende Vorhofflimmern-Operation führt mit größerer Wahrscheinlichkeit dazu, dass der Betroffene drei Monate nach der Operation frei von Vorhofflimmern ist und keine Medikamente mehr einnehmen muss, aber es ist auch wahrscheinlicher, dass diese Menschen nach dem Eingriff einen Herzschrittmacher benötigen. ⓘ
Vorhofflimmern tritt häufig nach herzchirurgischen Eingriffen auf und ist in der Regel selbstlimitierend. Es steht in engem Zusammenhang mit dem Alter, dem präoperativen Bluthochdruck und der Anzahl der verpflanzten Gefäße. Um das Risiko von Vorhofflimmern zu verringern, sollten präoperativ Maßnahmen zur Kontrolle des Bluthochdrucks ergriffen werden. Auch bei Personen mit einem erhöhten Risiko für Vorhofflimmern, z. B. Personen mit präoperativem Bluthochdruck, mehr als drei transplantierten Gefäßen oder einem Alter von über 70 Jahren, sollte eine prophylaktische Behandlung in Betracht gezogen werden. Auch ein postoperativer Perikarderguss steht im Verdacht, die Ursache für Vorhofflimmern zu sein. Die Prophylaxe kann ein prophylaktisches postoperatives Frequenz- und Rhythmusmanagement umfassen. Einige Autoren führen eine posteriore Perikardiotomie durch, um die Inzidenz von postoperativem Vorhofflimmern zu verringern. Wenn Vorhofflimmern auftritt, sollte die Behandlung in erster Linie in der Frequenz- und Rhythmuskontrolle bestehen. Eine Kardioversion kann jedoch durchgeführt werden, wenn der Patient hämodynamisch instabil ist, starke Symptome aufweist oder das Vorhofflimmern sechs Wochen nach der Entlassung anhält. In hartnäckigen Fällen sollte eine Antikoagulation durchgeführt werden. ⓘ
Operative Embolieprophylaxe

Bei Patienten mit erhöhtem Blutungsrisiko (HAS-BLED-Score >3) oder Kontraindikation gegen Antikoagulantien besteht die Möglichkeit, das Embolierisiko durch Verschluss des linken Vorhofohrs, der eine typische Quelle für die Entstehung von Embolien ist, zu minimieren. Dafür wird ein Vorhof-Implantat (Schirmchen) mit Hilfe eines Katheters über die Punktion einer großen Vene mittels Durchstossung des Vorhofseptums zum linken Vorhof vorgeschoben. Dort wird das Implantat aufgeklappt und direkt am Zugang zum Vorhofohr platziert. In den folgenden Monaten wächst das Vorhof-Schirmchen ein und wird vollständig von der Herzinnenhaut überzogen. Das Vorhofohr ist damit dauerhaft verschlossen, es können dort keine Blutgerinnsel mehr entstehen. Statt Einnahme eines Antikoagulans reicht langfristig die Einnahme von Thrombozytenaggregationshemmern. Bisherige Studien beweisen eine Nicht-Unterlegenheit der Embolieprophylaxe im Vergleich zur oralen Antikoagulation. Eine 2009 veröffentlichte Studie präsentierte ein erhebliches Risiko dieser Prozedur. So kam es bei jedem 20. Patienten zu einem Perikarderguss, jeder 50. Patient benötigte eine offene Herzoperation und 1 % der Patienten erlitt einen durch eine Luftembolie oder ein Blutgerinnsel ausgelösten Schlaganfall. ⓘ
Es gibt immer mehr Hinweise darauf, dass die Therapie des Verschlusses des linken Vorhofohrs das Schlaganfallrisiko bei Menschen mit nichtvalvulärem Vorhofflimmern ebenso stark senken kann wie Warfarin. ⓘ

Nach der Operation
Nach der Katheterablation werden die Patienten auf eine kardiologische Erholungsstation, eine Intensivstation oder eine kardiovaskuläre Intensivstation verlegt, wo sie sich 4-6 Stunden lang nicht bewegen dürfen. Die Einschränkung der Bewegung hilft, Blutungen an der Einstichstelle des Katheters zu verhindern. Die Dauer des Krankenhausaufenthalts variiert zwischen Stunden und Tagen. Dies hängt von der Art des Problems, der Dauer des Eingriffs und davon ab, ob eine Vollnarkose durchgeführt wurde oder nicht. Außerdem sollten die Betroffenen etwa sechs Wochen lang keine anstrengenden körperlichen Aktivitäten unternehmen, um eine niedrige Herzfrequenz und einen niedrigen Blutdruck aufrechtzuerhalten. ⓘ
Prognose
Vorhofflimmern erhöht das Risiko für Herzversagen um 11 pro 1000, für Nierenprobleme um 6 pro 1000, für Tod um 4 pro 1000, für Schlaganfall um 3 pro 1000 und für koronare Herzkrankheit um 1 pro 1000. Frauen haben insgesamt ein schlechteres Ergebnis als Männer. Es gibt zunehmend Hinweise darauf, dass Vorhofflimmern unabhängig davon mit einem höheren Demenzrisiko verbunden ist. ⓘ
Blutgerinnsel
Vorhersage von Embolien
Bei dänischen Männern im Alter von 50 Jahren ohne Risikofaktoren lag das 5-Jahres-Risiko eines Schlaganfalls bei 1,1 % und bei Vorhofflimmern allein bei 2,5 %. Bei Frauen waren die Risiken mit 0,7 % und 2,1 % etwas geringer. Bei Männern im Alter von 70 Jahren lag das 5-Jahres-Risiko für einen Schlaganfall bei 4,8 % und mit Vorhofflimmern allein bei 6,8 %. Bei Frauen im Alter von 70 Jahren war das Risiko ebenfalls niedriger als bei Männern: 3,4 % ohne zusätzlichen Risikofaktor und 8,2 % mit Vorhofflimmern. ⓘ
Die Bestimmung des Risikos einer Embolie, die einen Schlaganfall verursacht, ist wichtig, um den Einsatz von Antikoagulantien zu steuern. Die genauesten klinischen Prognoseregeln sind:
- CHADS2
- CHA2DS2-VASc-Score ⓘ
Sowohl der CHADS2 als auch der CHA2DS2-VASc-Score sagen das künftige Schlaganfallrisiko bei Menschen mit Vorhofflimmern voraus, wobei der CHA2DS2-VASc-Score genauer ist. Einige Personen mit einem CHADS2-Score von null hatten einen CHA2DS2-VASc-Score von drei, was einem jährlichen Schlaganfallrisiko von 3,2 % entspricht. Ein CHA2DS2-VASc-Score von null gilt also als sehr geringes Risiko. ⓘ
Mechanismus der Thrombusbildung
Bei Vorhofflimmern kann das Fehlen einer organisierten Vorhofkontraktion dazu führen, dass das Blut im linken Vorhof (LA) oder im linken Vorhofanhang (LAA) stagniert. Diese mangelnde Bewegung des Blutes kann zur Bildung eines Thrombus (Blutgerinnsel) führen. Wenn das Gerinnsel mobil wird und vom Blutkreislauf mitgerissen wird, spricht man von einem Embolus. Ein Embolus wandert durch immer kleinere Arterien, bis er eine von ihnen verstopft und den Blutfluss in der Arterie verhindert. Dieser Prozess führt zu einer Schädigung der Endorgane durch den Verlust von Nährstoffen, Sauerstoff und den Abtransport von zellulären Abfallprodukten. Embolien im Gehirn können zu einem ischämischen Schlaganfall oder einer transitorischen ischämischen Attacke (TIA) führen. ⓘ
Mehr als 90 % der Thromben, die mit nichtvalvulärem Vorhofflimmern assoziiert sind, entwickeln sich in der linken Vorhofsanhängsel. Die LAA liegt jedoch in enger Beziehung zur freien Wand des linken Ventrikels, so dass die Entleerung und Füllung der LAA, die den Grad der Blutstagnation bestimmt, durch die Bewegung der Wand des linken Ventrikels unterstützt werden kann, wenn eine gute Ventrikelfunktion besteht. ⓘ
Demenz
Eine Herzinsuffizienz als eine wichtige Komplikation des Vorhofflimmerns wird meist anhand der Symptome des Patienten vermutet und dann in der Ultraschalluntersuchung des Herzens (Echokardiografie) bestätigt. Gleichzeitig können bei der Echokardiografie Herzklappenfehler (insbesondere der Mitralklappe), andere Herzfehler oder ein Herzinfarkt als mögliche Ursachen von Vorhofflimmern identifiziert werden. Zudem wird durch die Größeneinschätzung der Vorhöfe die Erfolgswahrscheinlichkeit einer Kardioversion abgeschätzt. Die Laboruntersuchung des Blutes wird benötigt, um eine Überfunktion der Schilddrüse oder Elektrolytstörungen auszuschließen. Als wohl wichtigste Komplikation des Vorhofflimmerns ist die Thrombembolie zu nennen. Dabei handelt es sich um das Loslösen von kleinen Blutgerinnseln aus den Herzvorhöfen mit nachfolgender Verstopfung von Arterien (z. B. von Arterien des Gehirnes mit der Folge eines Schlaganfalls). Kleine Thrombenbildungen könnten bei Vorhofflimmern auch zu embolischen Mikroinfarkten im Gehirn und zu einem damit verbundenen schnelleren kognitiven Abbau führen, zumindest kommt eine neue prospektive Beobachtungsstudie mit über 5.000 Patienten zu diesem Schluss. ⓘ
Vorhofflimmern wurde unabhängig voneinander mit einem höheren Risiko für die Entwicklung von kognitiven Beeinträchtigungen, vaskulärer Demenz und Alzheimer-Krankheit in Verbindung gebracht. Es wurden mehrere Mechanismen für diesen Zusammenhang vorgeschlagen, darunter stille kleine Blutgerinnsel (subklinische Mikrothromben), die ins Gehirn wandern und zu kleinen ischämischen Schlaganfällen ohne Symptome führen, veränderte Durchblutung des Gehirns, Entzündungen, klinisch stille kleine Blutungen im Gehirn und genetische Faktoren. Erste Hinweise deuten darauf hin, dass eine wirksame Antikoagulation mit direkten oralen Antikoagulanzien oder Warfarin in gewissem Maße vor einer durch Vorhofflimmern bedingten Demenz und vor Anzeichen von stummen ischämischen Schlaganfällen im MRT schützen kann, aber dies ist noch Gegenstand aktiver Untersuchungen. ⓘ
Epidemiologie
Vorhofflimmern ist die häufigste Herzrhythmusstörung und betrifft weltweit mehr als 33 Millionen Menschen. In Europa und Nordamerika sind im Jahr 2014 etwa 2 bis 3 % der Bevölkerung davon betroffen. Dies ist ein Anstieg von 0,4 bis 1 % der Bevölkerung um 2005. In den Entwicklungsländern liegt die Rate bei etwa 0,6 % für Männer und 0,4 % für Frauen. Die Zahl der Menschen, bei denen Vorhofflimmern diagnostiziert wird, ist aufgrund der besseren Erkennung von stillem Vorhofflimmern, des zunehmenden Alters und der für Vorhofflimmern prädisponierenden Erkrankungen gestiegen. ⓘ
Ein Drittel der Krankenhauseinweisungen wegen Herzrhythmusstörungen entfallen auf Vorhofflimmern, und die Zahl der Einweisungen wegen Vorhofflimmern hat in den letzten Jahren zugenommen. Vorhofflimmern ist die Ursache für 20 bis 30 % aller ischämischen Schlaganfälle. Nach einer vorübergehenden ischämischen Attacke oder einem Schlaganfall wird bei etwa 11 % eine neue Diagnose von Vorhofflimmern gestellt. 3 bis 11 % der Patienten mit Vorhofflimmern haben ein strukturell normales Herz. Ungefähr 2,2 Millionen Menschen in den Vereinigten Staaten und 4,5 Millionen in der Europäischen Union haben Vorhofflimmern. ⓘ
Die Zahl der jährlichen Neuerkrankungen an Vorhofflimmern nimmt mit dem Alter zu. Bei Menschen, die älter als 80 Jahre sind, sind etwa 8 % betroffen. Im Gegensatz dazu wird die Prävalenz bei jüngeren Menschen auf 0,05 % geschätzt und steht in dieser Bevölkerungsgruppe in Zusammenhang mit angeborenen Herzerkrankungen oder strukturellen Herzkrankheiten. Im Jahr 2001 ging man davon aus, dass die Zahl der Menschen mit Vorhofflimmern in den Industrieländern in den nächsten 50 Jahren aufgrund des wachsenden Anteils älterer Menschen zunehmen wird. ⓘ
Geschlecht
In der europäischen und nordamerikanischen Bevölkerung ist Vorhofflimmern häufiger bei Männern als bei Frauen anzutreffen. Auch in der asiatischen Bevölkerung sowie in Industrie- und Entwicklungsländern ist die Rate bei Männern höher als bei Frauen. Auch die mit Vorhofflimmern verbundenen Risikofaktoren sind je nach Geschlecht unterschiedlich verteilt. Bei Männern sind koronare Erkrankungen häufiger, während bei Frauen ein hoher systolischer Blutdruck und Herzklappenerkrankungen häufiger vorkommen. ⓘ
Ethnische Zugehörigkeit
Die Häufigkeit von Vorhofflimmern ist in Bevölkerungsgruppen afrikanischer Abstammung geringer als in Bevölkerungsgruppen europäischer Abstammung. Afrikanische Abstammung wird mit einem Schutzeffekt für Vorhofflimmern in Verbindung gebracht, was auf die geringere Präsenz von SNPs mit Guanin-Allelen zurückzuführen ist. Bei Menschen europäischer Abstammung sind die Mutationen häufiger. Die Variante rs4611994 für das Gen PITX2 wird in afrikanischen und europäischen Populationen mit dem Risiko für Vorhofflimmern in Verbindung gebracht. Spanische und asiatische Populationen haben ein geringeres Risiko für Vorhofflimmern als europäische Populationen. Das Vorhofflimmern-Risiko in außereuropäischen Bevölkerungsgruppen steht in Zusammenhang mit charakteristischen Risikofaktoren dieser Bevölkerungsgruppen, wie z. B. Bluthochdruck. ⓘ
Junge Menschen
Vorhofflimmern ist bei Kindern eine seltene Erkrankung, tritt aber manchmal in Verbindung mit bestimmten angeborenen und erworbenen Erkrankungen auf. Angeborene Herzkrankheiten und rheumatisches Fieber sind die häufigsten Ursachen für Vorhofflimmern bei Kindern. Andere vererbte Herzerkrankungen, die mit der Entwicklung von Vorhofflimmern bei Kindern in Verbindung gebracht werden, sind das Brugada-Syndrom, das kurze QT-Syndrom, das Wolff-Parkinson-White-Syndrom und andere Formen supraventrikulärer Tachykardien (z. B. AV-Knoten-Reentrant-Tachykardie). Erwachsene, die eine angeborene Herzerkrankung überlebt haben, haben ein erhöhtes Risiko, Vorhofflimmern zu entwickeln. Insbesondere Personen mit Vorhofseptumdefekten, Fallot-Tetralogie oder Ebstein-Anomalie sowie Personen, die sich einer Fontan-Operation unterzogen haben, haben ein höheres Risiko, wobei die Prävalenzrate je nach Anatomie des Herzens und Alter der Person bis zu 30 % beträgt. ⓘ
Anamnese
Da die Diagnose von Vorhofflimmern die Messung der elektrischen Aktivität des Herzens voraussetzt, wurde Vorhofflimmern erst 1874 wirklich beschrieben, als Edmé Félix Alfred Vulpian das unregelmäßige elektrische Verhalten der Vorhöfe, das er als "fremissement fibrillaire" bezeichnete, an Hundeherzen beobachtete. Mitte des 18. Jahrhunderts machte Jean-Baptiste de Sénac auf erweiterte, gereizte Vorhöfe bei Menschen mit Mitralstenose aufmerksam. Der unregelmäßige Puls, der mit Vorhofflimmern einhergeht, wurde erstmals 1876 von Carl Wilhelm Hermann Nothnagel beschrieben und als "Delirium cordis" bezeichnet: "Bei dieser Form der Arrhythmie folgen die Herzschläge in völliger Unregelmäßigkeit aufeinander. Dabei ändern sich Höhe und Spannung der einzelnen Pulswellen ständig". Sir James MacKenzie stellte 1904 einen Zusammenhang zwischen dem Delirium cordis und dem Verlust der Vorhofkontraktion her, der sich im Verlust der A-Wellen im jugularvenösen Puls widerspiegelt. Willem Einthoven veröffentlichte 1906 das erste EKG, das Vorhofflimmern zeigte. Die Verbindung zwischen den anatomischen und elektrischen Manifestationen von Vorhofflimmern und dem unregelmäßigen Puls des Delirium cordis wurde 1909 von Carl Julius Rothberger, Heinrich Winterberg und Sir Thomas Lewis hergestellt. ⓘ
Andere Tiere
Vorhofflimmern tritt auch bei anderen Tieren auf, darunter Katzen, Hunde und Pferde. Anders als beim Menschen treten bei Hunden nur selten Komplikationen auf, die darauf zurückzuführen sind, dass sich Blutgerinnsel aus dem Inneren des Herzens lösen und durch die Arterien zu entfernten Stellen wandern (thromboembolische Komplikationen). Katzen entwickeln selten Vorhofflimmern, scheinen aber ein höheres Risiko für thromboembolische Komplikationen zu haben als Hunde. Katzen und Hunde mit Vorhofflimmern haben häufig eine zugrunde liegende strukturelle Herzerkrankung, die sie für diesen Zustand prädisponiert. Die Medikamente, die bei Tieren zur Behandlung von Vorhofflimmern eingesetzt werden, ähneln weitgehend denen, die beim Menschen verwendet werden. Gelegentlich wird bei diesen Tieren eine elektrische Kardioversion durchgeführt, doch die Notwendigkeit einer Vollnarkose schränkt die Anwendung ein. Standardbred-Pferde scheinen genetisch anfällig für die Entwicklung von Vorhofflimmern zu sein. Pferde, die Vorhofflimmern entwickeln, haben oft nur eine minimale oder gar keine zugrundeliegende Herzerkrankung, und das Vorhofflimmern bei Pferden kann die körperliche Leistungsfähigkeit beeinträchtigen. ⓘ
Klinische Erscheinung
Wesentliche Folgen des Vorhofflimmerns sind:
- Unregelmäßiger Puls (absolute Arrhythmie). Die Brems- und Filterfunktion des AV-Knotens leitet pro Minute von den 350–600 Vorhofimpulsen in unregelmäßigen (manchmal auch in regelmäßigen) Abständen nur etwa 100 bis 160 zu den Kammern über.
- Zu schneller Puls (Tachykardie) im unbehandelten Zustand. Zwar schützt der AV-Knoten die Herzkammern in der Regel vor Pulsfrequenzen von über 200 pro Minute, aber auch die dann typischen Frequenzen von 100 bis 160 pro Minute sind für das Herz auf Dauer nicht ökonomisch und können bei disponierten Patienten innerhalb von Tagen bis Wochen zu einer ausgeprägten Herzmuskelschwäche mit Herzinsuffizienz (Tachykardiomyopathie) führen. Das echokardiographische Bild ähnelt einer dilatativen Kardiomyopathie (DCM)
- Zu langsamer Puls (Bradykardie), häufig durch die herzfrequenzbremsenden Medikamente ausgelöst. Der langsame Herzschlag oder Pausen können Ursachen für Ohnmachtsanfälle (Synkopen) sein. Bei einem häufigen Wechsel zwischen schnellen und langsamen Phasen spricht man von einem Bradykardie-Tachykardie-Syndrom.
- Verlust der geordneten Vorhofkontraktion mit leichter Einschränkung der Pumpleistung des Herzens. Diese fällt bei einem sonst gesunden Herzen meist nicht ins Gewicht und wird dann meist auch nicht wahrgenommen. Bei einem stark vorgeschädigten Herz kann das Fehlen der Vorhofkontraktion zu einer deutlichen Verschlechterung der Belastbarkeit führen.
- Erhöhtes Risiko für Embolien. In den Vorhöfen können sich (bevorzugt im linken Herzohr) auf Grund des veränderten Blutflusses leichter Blutgerinnsel (Thromben) bilden. Diese Thromben wiederum können sich lösen und dann im Körper zu embolischen Gefäßverschlüssen führen. Durch Bildung von Kugelthromben im linken Vorhof kann es zudem zu einer Abflussbehinderung der Lungenvenen mit der möglichen Folge einer pulmonalen Hypertonie kommen. Besonders gefürchtet sind Schlaganfälle durch Hirnembolien. Seltener kommt es auch zu Mesenterialinfarkten durch Verschluss eines Darmgefäßes.
- Schwindel oder Bewusstlosigkeit können beim Aussetzen des Herzschlages nach Beendigung anfallsartigen Vorhofflimmerns (Präautomatische Pause) auftreten. ⓘ
EHRA-Klassifikation
Neu ist die Einteilung entsprechend der Symptomatik nach dem EHRA-Score der European Heart Rhythm Association, angelehnt an die NYHA-Klassifikation bei Herzinsuffizienz. Sie kann als Entscheidungshilfe bei der Frage nach einer rhythmuserhaltenden Therapie zu Hilfe genommen werden. ⓘ
| Stadium | Schwere der Symptome | Definition ⓘ |
|---|---|---|
| EHRA I | keine Beschwerden | Die normale tägliche Aktivität ist nicht eingeschränkt. |
| EHRA II | leichte Beschwerden | |
| EHRA III | schwere Beschwerden | Die normale tägliche Aktivität ist eingeschränkt. |
| EHRA IV | massiv behindernde Beschwerden | Die normale tägliche Aktivität ist unmöglich. |
Diagnostik
Die Diagnostik beim Vorhofflimmern muss klären,
- ob tatsächlich Vorhofflimmern besteht,
- ob Komplikationen eingetreten oder zu erwarten sind,
- ob eine wesentliche Grund- oder Begleiterkrankung vorliegt,
- welche Behandlungsstrategie sinnvoll ist und
- ob und welche Form der Blutgerinnungshemmung (Antikoagulation) notwendig ist. ⓘ
Unverzichtbar für die Beantwortung dieser Fragen ist zunächst die Krankengeschichte (Anamnese), wobei insbesondere
- die bisherige Dauer des Vorhofflimmerns,
- die Dauer und Häufigkeit vorheriger Episoden,
- evtl. auslösende Faktoren wie Alkoholgenuss, Schlafdefizit oder Operationen,
- bekannte Herz- oder Schilddrüsenerkrankungen,
- die aktuellen Beschwerden während der Rhythmusstörung und
- bereits erfolgte Therapien oder Therapieversuche
von Bedeutung sind. ⓘ

Roter Pfeil: „Flimmern“ der Grundlinie
Blauer Pfeil: P-Welle ⓘ
Therapie
Die Therapie von Vorhofflimmern zielt im Wesentlichen auf zwei Kernprobleme,
- die Behandlung der Rhythmusstörung und
- die Vermeidung von Embolien, ab. ⓘ
Embolieprophylaxe, CHADS2-Score
Bei länger als 48 Stunden anhaltendem Vorhofflimmern steigt das Risiko für die Bildung von Blutgerinnseln (Thromben) insbesondere im linken Vorhof des Herzens. Diese Thromben können sich lösen, mit dem Blutstrom in entlegene Gefäße transportiert werden und dort akute Gefäßverschlüsse (Embolien) verursachen. Kritisch dabei ist, dass Erkrankte ein meist länger bestehendes, normofrequentes Vorhofflimmern nicht spüren und erst in einer tachykarden Phase den Arzt aufsuchen. Eine Konversionstherapie birgt die Gefahren einer Thrombembolie, weswegen zuvor mittels TEE (Transösophageale Echokardiografie, „Schluckecho“) oder durch sechswöchige medikamentöse Hemmung der Blutgerinnung (Antikoagulation) dieses Risiko gemindert werden soll. ⓘ
Diese medikamentöse Hemmung der Blutgerinnung (Antikoagulation, fälschlicherweise auch als „Blutverdünnung“ bezeichnet) wird auch bei anhaltendem Vorhofflimmern erwogen; zudem besteht auch nach einer erfolgreichen Kardioversion für etwa vier Wochen die Notwendigkeit zur Antikoagulation, weil der Vorhof so lange noch ein sogenanntes „stunning“ mit herabgesetzter Kontraktion aufweisen kann und sich trotz Sinusrhythmus weiterhin Vorhofthromben bilden können. ⓘ
Die Mehrzahl der Patienten erhält Acetylsalicylsäure (ASS) oder Cumarine in Tablettenform, in Österreich, Deutschland und der Schweiz meist Phenprocoumon. Die zuvor nötige Abwägung der Vorteile dieser Therapie (seltenere Embolien, insbesondere weniger Schlaganfälle) mit den möglichen Nachteilen (vermehrte Blutungsneigung) erfordert eine möglichst genaue Kenntnis des individuellen Embolierisikos. Dieses Risiko steigt statistisch um das 2,5fache bei vorangegangenen Embolien, mit dem Alter um das 1,4fache pro Lebensdekade, um das 1,6fache bei Patienten mit einem Bluthochdruck, um das 1,5fache bei Koronarpatienten und das 1,7fache bei Zuckerkranken. ⓘ
Eine Therapiealternative bei der Prävention von Thrombembolien stellen die „neuen oralen Antikoagulanzien“ [NOAK] wie der orale direkte Thrombininhibitor Dabigatranetexilat oder die oralen Faktor-Xa-Inhibitoren Rivaroxaban, Edoxaban und Apixaban dar, die im Gegensatz zur Standardtherapie mit Cumarinen eine größere therapeutische Breite aufweisen und einfacher in der Handhabung sind, da ein Gerinnungsmonitoring nicht erforderlich ist. Dadurch soll bei gleicher oder besserer Wirksamkeit das Risiko von Blutungskomplikationen reduziert werden. Die vier genannten Substanzen wurden in groß angelegten Phase III-Studien klinisch geprüft. Weitere Wirkstoffe befinden sich derzeit in der klinischen Erprobung. ⓘ
Das Blutungsrisiko auf der anderen Seite hingegen steigt mit dem Alter nur gering an. Die Therapieentscheidung orientiert sich zusammenfassend an den folgenden gemeinsamen Empfehlungen der American Heart Association (AHA), des American College of Cardiology (ACC) und der European Society of Cardiology (ESC) aus dem Jahr 2006. ⓘ
| Empfehlungsklassen und Evidenzlevel im ACC/AHA/ESC-Format ⓘ | |
|---|---|
| Empfehlungsklasse (Class) | |
| I | Nachweis oder allgemeine Übereinstimmung, dass die Empfehlung vorteilhaft, nützlich und effektiv ist. |
| II | Widersprüchliche Nachweise oder Meinungen über den Nutzen und die Effektivität mit entweder überwiegend positiver (Class IIa) oder weniger gut etablierter (Class IIb) Einschätzung. |
| III | Nachweis oder allgemeine Übereinstimmung, dass die Therapie nicht nützlich oder effektiv ist und schädlich sein kann. |
| Evidenzlevel (Level of Evidence) | |
| A | Daten aus mehreren randomisierten Studien oder Metaanalysen. |
| B | Daten aus einer randomisierten Studie oder nicht-randomisierten Untersuchungen. |
| C | Expertenmeinung, Fallstudien oder etablierter Therapiestandard. |
- Außer für Patienten mit lone atrial fibrillation (vor dem 60. Lebensjahr ohne Herzkrankheit) und solche mit Kontraindikation ist eine gerinnungshemmende Therapie für alle Patienten mit Vorhofflimmern empfehlenswert (Class I, Level of Evidence: A).
- Die Art der Gerinnungshemmung (ASS oder Antikoagulation) sollte individuell für jeden Patienten vom Risiko für einen Schlaganfall auf der einen und für eine Blutung auf der anderen Seite abhängig gemacht werden (Class I, Level of Evidence: A).
- Patienten mit einem hohen Schlaganfallrisiko (mit bereits erlittener Embolie oder mit rheumatischer Mitralklappenstenose) ohne künstliche Herzklappe und ohne Kontraindikationen sollten Vitamin-K-Antagonisten in einer Dosis erhalten, die zu einer INR von 2,0 bis 3,0 führt (Class I, Level of Evidence: A).
- Patienten mit mehr als einem „moderaten“ Risikofaktor (Alter über 74 Jahre, Bluthochdruck, Herzinsuffizienz, eingeschränkte Pumpfunktion der linken Herzkammer mit einer Ejektionsfraktion von weniger als 35 % oder Diabetes mellitus) ist eine Antikoagulation mit Vitamin-K-Antagonisten zu empfehlen (Class I, Level of Evidence: A). Liegt nur einer dieser Risikofaktoren vor, so kann in Abhängigkeit von Blutungsrisiko, Zuverlässigkeit der Antikoagulation und Patientenwunsch ASS oder ein Vitamin-K-Antagonist eingesetzt werden (Class IIa, Level of Evidence: A). Gleiches gilt für Patienten mit mindestens einem der weniger gut validierten Risikofaktoren: Koronare Herzkrankheit, Alter über 64 Jahre oder weibliches Geschlecht (Class IIa, Level of Evidence: B).
- Als Alternative zu den Vitamin-K-Antagonisten wird bei Kontraindikationen und für Patienten mit einem geringen Schlaganfallrisiko ASS in einer Dosis von 81 bis 325 mg täglich empfohlen (Class I, Level of Evidence: A).
- Während der Therapie mit Vitamin-K-Antagonisten sollte die INR in der Einstellungsphase mindestens einmal wöchentlich und bei stabiler Einstellung mindestens einmal monatlich kontrolliert werden (Class I, Level of Evidence: A).
- Die Antikoagulation bei Patienten mit mechanischen Herzklappenprothesen mit einer INR von mindestens 2,5 orientiert sich am Prothesentyp (Class I, Level of Evidence: B).
- Es ist vertretbar, die gerinnungshemmende Therapie unabhängig von der Art des Auftretens von Vorhofflimmern (paroxysmal, persistierend oder permanent) auszuwählen (Class IIa, Level of Evidence: B).
- Eine bis zu sieben Tage währende Unterbrechung der Antikoagulation ohne Ersatz durch Heparin für diagnostische oder operative Eingriffe mit erhöhter Blutungsgefahr ist bei Patienten ohne mechanische Herzklappenprothese vernünftig (Class IIa, Level of Evidence: C). Bei einer Unterbrechung von mehr als einer Woche kann überbrückend (englisch: Bridging, Überbrückung) unfraktioniertes oder niedermolekulares Heparin verabreicht werden, auch wenn in dieser Situation die Wirksamkeit dieser Verfahren unsicher ist (Class IIb, Level of Evidence: C).
- Patienten mit Vorhofflimmern können nach einer PTCA oder Bypass-Operation ASS (weniger als 100 mg pro Tag) und Clopidogrel (75 mg pro Tag) zusätzlich zur Antikoagulation erhalten, was allerdings mit einem erhöhten Blutungsrisiko verbunden und nicht gründlich untersucht ist (Class IIb, Level of Evidence: C). Im Zusammenhang mit einer PTCA kann die Antikoagulation vorübergehend unterbrochen werden, sollte aber so früh wie möglich fortgesetzt werden (Class IIb, Level of Evidence: C).
- Bei Patienten unter 60 Jahren ohne Herzkrankheit oder andere Risikofaktoren für eine Embolie ist eine langfristige Antikoagulation nicht empfehlenswert (Class III, Level of Evidence: C). ⓘ
| CHADS2-Score zur Abschätzung des Schlaganfallrisikos bei Vorhofflimmern ⓘ | ||
|---|---|---|
| Bei Vorliegen von … | … ergibt sich | |
| C (congestive heart failure) | Strukturelle Herzerkrankung, die Herzinsuffizienz verursacht |
1 Punkt |
| H (hypertension) | Arterielle Hypertonie (auch behandelt) |
1 Punkt |
| A (age) | Alter ≥ 75 Jahre | 1 Punkt |
| D (diabetes) | Diabetes mellitus | 1 Punkt |
| S (stroke) | Durchgemachter Schlaganfall oder transitorische ischämische Attacke |
2 Punkte |
Antikoagulation und Blutungsrisiko
Zur Abschätzung des Risikos einer Hirnblutung unter Antikoagulation wurde 2010 von der European Society of Cardiology ein Risikoscore vorgestellt, der HAS-BLED-Score. Das Akronym „has bled“ heißt übersetzt „hat geblutet“. ⓘ
| HAS-BLED-Score (ESC guidelines 2010) | ⓘ | |
|---|---|---|
| Ziffer | Klinik | Punkte |
| H | Hypertonie (RR systolisch über 160 mmHg) | 1 |
| A | schwere Leber-/ Nierenfunktionstörung (je 1 Punkt) | 1–2 |
| S | Schlaganfall in der Vorgeschichte | 1 |
| B | stattgehabte Blutung oder Blutungsneigung | 1 |
| L | labile Einstellung (< 60 % der INR-Werte im Zielbereich) | 1 |
| E | Alter über 65 Jahre | 1 |
| D | Drugs (engl.: Medikamente/Drogen) wie NSAR oder Alkoholmissbrauch | 1–2 |
Ab einem Score = 3 besteht eine relevante Blutungsgefahr, die eine besondere Vorsicht bei der Verordnung von Antikoagulantien erfordert. ⓘ
Die Risikofaktoren für eine Blutung überlappen z. T. mit denen für Embolien (Hypertonie, früherer Schlaganfall, Alter). Patienten mit einem hohen HAS-BLED-Score haben i. d. R. auch ein hohes Risiko für einen Schlaganfall. Daher ist ein höherer HAS-BLED-Score nicht als absolute Kontraindikation für eine Antikoagulation zu verstehen, sondern v. a. auch als Hinweis, beeinflussbare Risikofaktoren (labile INR-Einstellung, Begleitmedikation) zu optimieren. ⓘ
Spezielle Situationen
Vorhofflimmern und Genussmittel – Holiday Heart Syndrom
Bei einigen Menschen, auch Herzgesunden, kann Vorhofflimmern durch Alkohol provoziert werden. In einigen Untersuchungen war mehr als die Hälfte der Fälle von paroxysmalem Vorhofflimmern nach Alkoholkonsum aufgetreten. Typischerweise beginnt die Rhythmusstörung wenige Stunden nach Zufuhr einer ungewöhnlich hohen Alkoholdosis, oft in der zweiten Nachthälfte, am Wochenende oder auch nach körperlicher Belastung. Für diese besonders bei jüngeren Männern beobachtete Konstellation wurde in Anlehnung an eine Publikation aus dem Jahr 1983 die Bezeichnung „Holiday Heart Syndrom“ geprägt. Bei fast allen Patienten endet die Rhythmusstörung ohne besondere Behandlung innerhalb von 24 Stunden. In der 2004 veröffentlichten Danish Diet Cancer and Health Study konnte für Männer mit einem Alkoholkonsum von mehr als 20 g pro Tag ein um 44 % erhöhtes Risiko für Vorhofflimmern nachgewiesen werden. Männer, die 12 g pro Tag oder weniger tranken, hatten ebenso wie Frauen ein normales Risiko. In einer kontrollierten Studie aus Australien konnte auch nachgewiesen werden, dass bei Patienten, die regelmäßig Alkohol konsumierten, durch eine weitgehende Alkoholabstinenz die Rezidive von Vorhofflimmern vermindert werden können. Der Arzneimittelbrief empfiehlt daher bei paroxysmalem Vorhofflimmern eine Alkoholkarenz. Dies sei verträglicher als eine Dosissteigerung von Antiarrhythmika oder aufwändige Ablationsprozeduren. ⓘ
Der früher auch als Risiko angesehene Genuss von Kaffee oder Tee hingegen erwies sich in der gleichen Studie im Zusammenhang mit Vorhofflimmern als unbedenklich. Bei regelmäßigem Konsum trat es sogar etwas seltener auf. ⓘ
Vorkommen bei Tieren
Katze
Bei Katzen wird ein Vorhofflimmern wesentlich seltener festgestellt, auch hier im Wesentlichen in der Folge einer übermäßigen Vergrößerung der Vorhöfe, die meist auf einer Kardiomyopathie (meist hypertroph, seltener restriktiv, ganz selten dilatativ) beruht. Die resultierende Herzschlagfrequenz kann 320 pro Minute erreichen. Therapeutisch kommen die oben beschriebenen Medikamente zum Einsatz. Daneben ist eine Embolieprophylaxe (meist mit Acetylsalicylsäure) zwingend nötig, um das bei Katzen hohe Risiko einer Embolie der Aortenendaufzweigung (sogenannter reitender Aortenthrombus, → Ischämische Myopathie der Katze), der Nierengefäße, der Mesenterialgefäße (Arteria mesenterica cranialis und caudalis) oder der rechten Unterschlüsselbeinarterie zu vermeiden. ⓘ