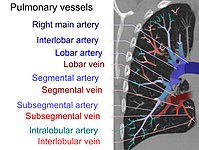
Lungenembolie
| Pulmonale Embolie ⓘ | |
|---|---|
 | |
| Eine Lungenillustration, die eine Lungenembolie zeigt, bei der ein Thrombus (Blutgerinnsel), der aus einer anderen Region des Körpers eingewandert ist, einen Verschluss der Lungenbronchialarterie verursacht, was zu einer arteriellen Thrombose des oberen und unteren Lungenflügels in der linken Lunge führt | |
| Fachgebiet | Hämatologie, Kardiologie, Pulmonologie |
| Symptome | Kurzatmigkeit, Brustschmerzen, Bluthusten |
| Komplikationen | Ohnmacht, abnorm niedriger Blutdruck, plötzlicher Tod; chronisch thromboembolische pulmonale Hypertonie (Langzeitkomplikation) |
| Häufiges Auftreten | Fortgeschrittenes Alter |
| Risikofaktoren | Krebs, längere Bettlägerigkeit, Rauchen, Schlaganfall, bestimmte genetische Erkrankungen, östrogenhaltige Medikamente, Schwangerschaft, Fettleibigkeit, nach Operationen |
| Diagnostische Methode | Anhand der Symptome, D-Dimer, CT-Lungenangiographie, Lungenventilation/Perfusionsscan |
| Behandlung | Antikoagulanzien (Heparin, Warfarin, DOACs) |
| Häufigkeit | ~450.000 pro Jahr (USA), 430.000 (Europa) |
| Todesfälle | >10-12.000 pro Jahr (USA), >30-40.000 pro Jahr (Europa) |
Eine Lungenembolie (PE) ist eine Verstopfung einer Arterie in der Lunge durch eine Substanz, die von einer anderen Stelle des Körpers in den Blutkreislauf gelangt ist (Embolie). Zu den Symptomen einer Lungenembolie gehören Kurzatmigkeit, Schmerzen in der Brust, insbesondere beim Einatmen, und Bluthusten. Es können auch Symptome eines Blutgerinnsels im Bein auftreten, z. B. ein rotes, warmes, geschwollenes und schmerzhaftes Bein. Zu den Anzeichen einer Lungenembolie gehören niedriger Sauerstoffgehalt im Blut, schnelle Atmung, schneller Herzschlag und manchmal leichtes Fieber. Schwere Fälle können zu Ohnmacht, abnorm niedrigem Blutdruck, obstruktivem Schock und plötzlichem Tod führen. ⓘ
Eine Lungenembolie entsteht in der Regel durch ein Blutgerinnsel im Bein, das in die Lunge wandert. Das Risiko von Blutgerinnseln wird durch Krebs, längere Bettruhe, Rauchen, Schlaganfall, bestimmte genetische Erkrankungen, östrogenhaltige Medikamente, Schwangerschaft, Fettleibigkeit und nach bestimmten Operationen erhöht. Ein kleiner Teil der Fälle ist auf die Embolisierung von Luft, Fett oder Fruchtwasser zurückzuführen. Die Diagnose basiert auf Anzeichen und Symptomen in Kombination mit Testergebnissen. Wenn das Risiko gering ist, kann ein Bluttest, ein so genannter D-Dimer-Test, die Erkrankung ausschließen. Andernfalls kann eine CT-Lungenangiographie, eine Lungenventilation/Perfusionsuntersuchung oder eine Ultraschalluntersuchung der Beine die Diagnose bestätigen. Die tiefe Venenthrombose und die Lungenembolie werden zusammen als venöse Thromboembolie (VTE) bezeichnet. ⓘ
Zu den Maßnahmen zur Vorbeugung von PE gehören der frühestmögliche Beginn der Bewegung nach einer Operation, Unterschenkelgymnastik während der Zeit des Sitzens und die Einnahme von Blutverdünnern nach bestimmten Operationen. Die Behandlung erfolgt mit Antikoagulanzien wie Heparin, Warfarin oder einem der direkt wirkenden oralen Antikoagulanzien (DOAC). Diese werden für mindestens drei Monate empfohlen. In schweren Fällen kann eine Thrombolyse mit Medikamenten wie Gewebeplasminogenaktivator (tPA) erforderlich sein, die intravenös oder über einen Katheter verabreicht werden, und in einigen Fällen ist eine Operation (pulmonale Thrombektomie) notwendig. Wenn Blutverdünner nicht geeignet sind, kann ein temporärer Vena-Cava-Filter eingesetzt werden. ⓘ
In Europa sind jedes Jahr etwa 430 000 Menschen von Lungenembolien betroffen. In den Vereinigten Staaten treten jährlich zwischen 300.000 und 600.000 Fälle auf, die zu mindestens 40.000 Todesfällen führen. Die Raten sind bei Männern und Frauen ähnlich hoch. Sie treten mit zunehmendem Alter häufiger auf. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| I26 | Lungenembolie |
| O88 | Embolie während der Gestationsperiode |
| O08.2 | Embolie nach Abort, Extrauteringravidität und Molenschwangerschaft |
| ICD-10 online (WHO-Version 2019) | |
Eine Lungenembolie (kurz: LE) oder Lungenarterienembolie (kurz: LAE) ist eine Verstopfung (Embolie) eines Blutgefäßes in der Lunge bzw. dem Lungenkreislauf. Sie wird meistens durch einen Blutpfropfen (Blutgerinnsel), den sogenannten Thrombus (dann wird sie auch Lungenthrombembolie, pulmonale Thromboembolie oder Pulmonalarterienthrombembolie genannt), seltener durch Gasbläschen, beispielsweise bei einem Tauchunfall oder durch während einer Operation angesaugte Luft, oder durch Fett (Fettembolie, etwa durch Fett aus dem Fettmark bei Knochenbrüchen) verursacht. Da eine Lungenembolie potentiell lebensbedrohlich ist, sind Maßnahmen zur Ersten Hilfe immer erforderlich. Der sinkende Blutdruck (Hypotonie) kann zum obstruktiven Schock mit Kreislaufstillstand führen. ⓘ
Typische Symptome sind akute Luftnot (Dyspnoe) und/oder Brustschmerz beim Einatmen. Der Mangel an Sauerstoff (Hypoxie) verursacht einen Ruhepuls von über 100/min (Tachykardie), der von einer hohen Atemfrequenz (Tachypnoe) begleitet wird. Die weitere Symptomatik ist sehr variabel und kann Husten (lat.: Tussis), Blut im Auswurf (Hämoptyse) sowie Herzrhythmusstörungen beinhalten. Bei einer zusätzlich (Komorbidität) bestehenden tiefen Beinvenenthrombose (Tiefe Venenthrombose – TVT) ist das betroffene Bein meist angeschwollen und schmerzt. Wegen des erhöhten Pumpwiderstandes im Lungenkreislauf (pulmonale Hypertonie) wird die rechte Herzkammer stärker belastet (Cor pulmonale), was zu einer Herzinsuffizienz führen kann. ⓘ
Neben der bedarfsweisen Zufuhr von Sauerstoff wird eine Lysetherapie zur Auflösung des Thrombus durchgeführt. Zur Hemmung der Blutgerinnung (Antikoagulation) dient intravenös appliziertes Heparin. Nach Abklingen der akuten Symptome ist zur Vermeidung erneuter Thrombosen meist eine längerzeitige Therapie mit peroral verabreichten Antikoagulanzien (siehe Medizinische Maßnahmen) erforderlich. ⓘ
In Deutschland sterben jährlich zwischen 40.000 und 100.000 Menschen an einer Lungenembolie. Sie ist damit nach Herzinfarkt und Schlaganfall die dritthäufigste zum Tode führende Herz-Kreislauf-Erkrankung. ⓘ
Anzeichen und Symptome
Die Symptome einer Lungenembolie treten in der Regel plötzlich auf und können eines oder mehrere der folgenden Symptome umfassen: Dyspnoe (Kurzatmigkeit), Tachypnoe (schnelle Atmung), Brustschmerzen pleuritischer" Natur (die sich beim Atmen verschlimmern), Husten und Hämoptyse (Aushusten von Blut). In schwereren Fällen können Anzeichen wie Zyanose (Blaufärbung, meist der Lippen und Finger), Kollaps und Kreislaufinstabilität aufgrund des verminderten Blutflusses durch die Lunge und in die linke Herzhälfte auftreten. Etwa 15 % aller Fälle von plötzlichem Herztod sind auf eine PE zurückzuführen. Eine PE kann zwar mit einer Synkope einhergehen, aber weniger als 1 % der Synkopen sind auf eine PE zurückzuführen. ⓘ
Bei der körperlichen Untersuchung ist die Lunge in der Regel unauffällig. Gelegentlich kann ein Pleurareiben über dem betroffenen Bereich der Lunge hörbar sein (meist bei PE mit Infarkt). Manchmal liegt ein exsudativer Pleuraerguss vor, der durch einen verminderten Perkussionston, hörbare Atemgeräusche und Stimmresonanz nachweisbar ist. Eine Belastung des rechten Ventrikels kann sich durch ein linkes parasternales Heben, eine laute pulmonale Komponente des zweiten Herztons und/oder einen erhöhten Jugularvenendruck bemerkbar machen. Es kann leichtes Fieber auftreten, insbesondere wenn eine Lungenblutung oder ein Lungeninfarkt vorliegt. ⓘ
Da kleinere Lungenembolien dazu neigen, sich in periphereren Bereichen ohne Kollateralkreislauf festzusetzen, verursachen sie mit größerer Wahrscheinlichkeit einen Lungeninfarkt und kleine Ergüsse (die beide schmerzhaft sind), aber keine Hypoxie, Dyspnoe oder hämodynamische Instabilität wie Tachykardie. Größere PEs, die dazu neigen, sich zentral abzusetzen, verursachen typischerweise Dyspnoe, Hypoxie, niedrigen Blutdruck, schnelle Herzfrequenz und Ohnmacht, sind aber oft schmerzlos, da es aufgrund der Kollateralkreisläufe nicht zu einem Lungeninfarkt kommt. Das klassische Bild einer PE mit pleuritischen Schmerzen, Dyspnoe und Tachykardie wird wahrscheinlich durch eine große fragmentierte Embolie verursacht, die sowohl große als auch kleine PEs verursacht. So werden kleine PEs oft übersehen, weil sie nur pleuritische Schmerzen ohne andere Befunde verursachen, und große PEs werden oft übersehen, weil sie schmerzlos sind und andere Erkrankungen imitieren, die oft EKG-Veränderungen und geringfügige Anstiege der Troponin- und Hirnnatriuretikpeptidwerte verursachen. ⓘ
In Abhängigkeit von den klinischen Anzeichen und Symptomen werden PEs manchmal als massiv, submassiv oder nichtmassiv bezeichnet. Obwohl die genauen Definitionen unklar sind, gilt als akzeptierte Definition einer massiven PE eine hämodynamische Instabilität. Dies ist die Ursache für einen obstruktiven Schock, der sich als anhaltend niedriger Blutdruck, verlangsamte Herzfrequenz oder Pulslosigkeit äußert. ⓘ
Der Embolus verstopft einen oder mehrere Äste der Lungenarterien. Dies wiegt umso schwerer, je größer der Innendurchmesser des betroffenen Gefäßes ist. Der Blutstau vor dem Thrombus führt zu einer mehr oder weniger starken Druckerhöhung im Lungenkreislauf (Pulmonale Hypertonie) und damit zur Belastung des rechten Teils des Herzens, wodurch es teilweise oder sogar ganz versagen kann. Versagt die rechte Herzhälfte nicht, so ist dennoch zumindest die Blutmenge vermindert, die die Lunge passieren und zur linken Herzhälfte gelangen kann. Die linke Herzhälfte kann jedoch nur soviel Blut weiterpumpen, wie bei ihr ankommt. Die Folge der herabgesetzten Fördermenge ist eine verminderte Sauerstoffversorgung der wichtigen Organe. Es kann zum (kardiogenen) Schock kommen. In Abhängigkeit von der Ausdehnung kann es zu einem geringeren Sauerstoffgehalt des Blutes – einer Hypoxämie – kommen. ⓘ
Eine plötzlich auftretende schwere Lungenembolie wird als fulminant bezeichnet. Führend in der Symptomatik ist hierbei das Versagen des rechten Herzens (Rechtsherzversagen), begleitet von einer schweren Hypoxämie. ⓘ
Auch kleinere Lungenembolien können zu Rechtsherzproblemen führen. Hier ist die Drucksteigerung im kleinen Kreislauf nicht so schwerwiegend, die akute Überlebensrate der Patienten auch daher deutlich höher. Die Thromben werden in den meisten Fällen abgebaut und das Gefäßsystem dadurch wieder frei. Trotzdem kann sich im weiteren Verlauf bei einigen Patienten (vor allem mit immer wiederkehrenden kleineren Lungenembolien) ein chronischer Lungenhochdruck entwickeln. Es kann sich dann um eine CTEPH handeln. ⓘ
Nachfolgend zum akuten Ereignis kann eine Infektion des nicht mehr ausreichend versorgten Lungengewebes zu einer sogenannten Infarktpneumonie führen. Das hinter dem Embolus gelegene Lungenareal kann insbesondere nach größerer Embolie mit Zerstörung eines Teils des bindegewebigen Lungengrundgerüstes infarzieren. Trotz der an sich hohen Regenerationskraft des Lungengewebes sterben dann ganze Bereiche dauerhaft ab. Übersteht dies der Organismus, entstehen funktionslose Narben. Bei Befall größerer Bereiche mit entsprechender Funktionseinbuße kommt es zu Kurzatmigkeit, reduzierter Belastbarkeit und oft dauerhaftem Husten. Die erleichterte Invasion von Keimen in das anfangs nekrotische, anschließend fibrotisch veränderte – und für Antibiotika weitgehend unzugängliche – narbige Gewebe führt auch später häufiger zu Lungenentzündungen. Die fibrotischen Umbauprozesse erhöhen geringfügig auch das Risiko für späteren Lungenkrebs. Es gibt eine hohe Rate der Spätkomplikationen, insbesondere bei erneuten Embolien. ⓘ
Risikofaktoren

Etwa 90 % der Embolien sind auf eine tiefe Beinvenenthrombose oder eine Beckenvenenthrombose zurückzuführen. Das seltene venöse Thoracic-Outlet-Syndrom kann ebenfalls eine Ursache für tiefe Venenthrombosen sein, insbesondere bei jungen Männern ohne signifikante Risikofaktoren. Bei Thrombosen besteht die Gefahr, dass sie sich lösen und in den Lungenkreislauf wandern. Die Erkrankungen werden im Allgemeinen als ein Kontinuum betrachtet, das als venöse Thromboembolie (VTE) bezeichnet wird. ⓘ
VTE treten viel häufiger bei immungeschwächten Personen sowie bei Personen mit Komorbiditäten auf:
- Personen, die sich ohne Prophylaxe einer orthopädischen Operation an oder unterhalb der Hüfte unterziehen.
- Dies ist auf die Immobilität während oder nach der Operation sowie auf Venenschäden während des Eingriffs zurückzuführen.
- Patienten mit Bauchspeicheldrüsen- und Dickdarmkrebs (andere Krebsarten können ebenfalls eine Rolle spielen, aber diese sind am häufigsten)
- Dies ist auf die Freisetzung von Prokoagulanzien zurückzuführen.
- Das VTE-Risiko ist während der Diagnose und der Behandlung am höchsten, sinkt aber in der Remission.
- Dies ist auf die Freisetzung von Prokoagulanzien zurückzuführen.
- Patienten mit hochgradigen Tumoren
- Schwangere Personen
- Da sich der Körper in einen so genannten "hyperkoagulierbaren Zustand" versetzt, verringert sich das Risiko einer Blutung während der Geburt und wird durch eine erhöhte Expression der Faktoren VII, VIII, X, Von Willebrand und Fibrinogen reguliert.
- Frauen, die Östrogene einnehmen ⓘ
Die Entstehung einer Thrombose ist klassischerweise auf eine Gruppe von Ursachen zurückzuführen, die als Virchow'sche Trias bezeichnet wird (Veränderungen des Blutflusses, Faktoren in der Gefäßwand und Faktoren, die die Eigenschaften des Blutes beeinflussen). Häufig liegt mehr als ein Risikofaktor vor.
- Veränderungen des Blutflusses: Ruhigstellung (nach Operationen, Langstreckenflügen), Verletzungen, Schwangerschaft (auch gerinnungsfördernd), Übergewicht (auch gerinnungsfördernd), Krebs (auch gerinnungsfördernd)
- Faktoren in der Gefäßwand: chirurgische Eingriffe, Katheterisierungen mit direkter Verletzung ("endothelial injury")
- Faktoren, die die Eigenschaften des Blutes beeinflussen (gerinnungsfördernder Zustand):
- Östrogenhaltige Medikamente (Transgender-Hormontherapie, Hormontherapie in den Wechseljahren und hormonelle Verhütungsmittel)
- Genetische Thrombophilie (Faktor-V-Leiden, Prothrombin-Mutation G20210A, Protein-C-Mangel, Protein-S-Mangel, Antithrombin-Mangel, Hyperhomocysteinämie und Plasminogen-/Fibrinolyse-Störungen)
- Erworbene Thrombophilie (Antiphospholipid-Syndrom, nephrotisches Syndrom, paroxysmale nächtliche Hämoglobinurie)
- Krebs (aufgrund der Ausschüttung von gerinnungsfördernden Substanzen)
Obwohl die meisten Lungenembolien auf tiefe Beinvenenthrombosen zurückzuführen sind, gibt es noch viele andere Risikofaktoren, die ebenfalls zu einer Lungenembolie führen können.
- Zu den Risikofaktoren gehören:
- Krampfadern aufgrund von Gefäßschäden
- Pulmonale Hypertonie
- Diabetes
- Traumatische Hüftfrakturen, die den Patienten immobilisieren
- Gelenkfixierungen (vor allem an den Beinen) ⓘ
Grundlegende Ursachen
Nach einer ersten Lungenembolie ist die Suche nach sekundären Ursachen meist kurz. Erst wenn eine zweite Lungenembolie auftritt, und vor allem, wenn dies unter einer gerinnungshemmenden Therapie geschieht, wird eine weitere Suche nach Grunderkrankungen durchgeführt. Dazu gehören Tests ("Thrombophilie-Screening") auf Faktor-V-Leiden-Mutation, Antiphospholipid-Antikörper, Protein-C- und -S-Werte und Antithrombinwerte sowie später Prothrombin-Mutation, MTHFR-Mutation, Faktor-VIII-Konzentration und seltenere vererbte Gerinnungsanomalien. ⓘ
Diagnose
Zur Diagnose einer Lungenembolie wird eine Überprüfung der klinischen Kriterien empfohlen, um die Notwendigkeit von Tests zu bestimmen. Bei Personen mit geringem Risiko, einem Alter von unter 50 Jahren, einer Herzfrequenz von weniger als 100 Schlägen pro Minute, einem Sauerstoffgehalt von mehr als 94 % bei Raumluft und ohne Beinschwellung, Bluthusten, Operationen oder Traumata in den letzten vier Wochen, frühere Blutgerinnsel oder Östrogenkonsum sind in der Regel keine weiteren Tests erforderlich. ⓘ
Bei Personen mit höherem Risiko sind jedoch weitere Tests erforderlich. Ein CT-Pulmonalangiogramm (CTPA) ist die bevorzugte Methode zur Diagnose einer Lungenembolie, da es einfach durchzuführen und genau ist. Obwohl eine CTPA bevorzugt wird, gibt es auch andere Tests, die durchgeführt werden können. So kann beispielsweise ein Kompressionsultraschall der proximalen unteren Gliedmaßen (CUS) durchgeführt werden. Dieser Test wird in erster Linie als Bestätigungstest eingesetzt, d. h. er bestätigt eine frühere Analyse, die das Vorhandensein einer Lungenembolie oder den Verdacht auf eine Lungenembolie ergeben hat. Laut einer Querschnittsstudie hat der CUS-Test eine Sensitivität von 41 % und eine Spezifität von 96 %. ⓘ
Bestehen Bedenken, folgt ein Test, um die Wahrscheinlichkeit zu ermitteln, dass die Diagnose durch eine Bildgebung bestätigt werden kann, gefolgt von einer Bildgebung, wenn andere Tests ergeben haben, dass die Diagnose einer Lungenembolie wahrscheinlich ist. ⓘ
Die Diagnose einer Lungenembolie stützt sich in erster Linie auf validierte klinische Kriterien in Kombination mit selektiven Tests, da das typische klinische Bild (Kurzatmigkeit, Brustschmerzen) nicht eindeutig von anderen Ursachen für Brustschmerzen und Kurzatmigkeit unterschieden werden kann. Die Entscheidung, eine medizinische Bildgebung durchzuführen, basiert auf klinischen Überlegungen, d. h. auf der Anamnese, den Symptomen und den Befunden der körperlichen Untersuchung, gefolgt von einer Bewertung der klinischen Wahrscheinlichkeit. ⓘ
Wahrscheinlichkeitstests
Die am häufigsten verwendete Methode zur Vorhersage der klinischen Wahrscheinlichkeit, der Wells-Score, ist eine klinische Vorhersageregel, deren Anwendung dadurch erschwert wird, dass es mehrere Versionen gibt. Im Jahr 1995 entwickelte Philip Steven Wells zunächst eine Vorhersageregel (auf der Grundlage einer Literaturrecherche), um die Wahrscheinlichkeit einer PE anhand klinischer Kriterien vorherzusagen. Diese Vorhersageregel wurde 1998 überarbeitet. Diese Vorhersageregel wurde weiter überarbeitet, als sie bei einer Validierung durch Wells et al. im Jahr 2000 vereinfacht wurde. In der Veröffentlichung aus dem Jahr 2000 schlug Wells zwei verschiedene Scoring-Systeme mit Cutoffs von 2 oder 4 und derselben Vorhersageregel vor. Im Jahr 2001 veröffentlichte Wells Ergebnisse unter Verwendung des konservativeren Cutoff-Wertes von 2, um drei Kategorien zu bilden. Eine weitere Version, die "modifizierte erweiterte Version", die den neueren Cutoff von 2 verwendet, aber die Ergebnisse der ursprünglichen Studien von Wells einbezieht, wurde vorgeschlagen. Erst kürzlich wurde in einer weiteren Studie zu Wells' früherem Cutoff von 4 Punkten zurückgekehrt, um nur zwei Kategorien zu bilden. ⓘ
Es gibt zusätzliche Vorhersageregeln für PE, wie z. B. die Genfer Regel. Wichtiger ist jedoch, dass die Anwendung jeder Regel mit einer Verringerung der rezidivierenden Thromboembolien verbunden ist. ⓘ
Der Wells-Score:
- klinischer Verdacht auf TVT - 3,0 Punkte
- alternative Diagnose ist weniger wahrscheinlich als PE - 3,0 Punkte
- Tachykardie (Herzfrequenz > 100) - 1,5 Punkte
- Ruhigstellung (≥ 3d)/Operation in den letzten vier Wochen - 1,5 Punkte
- TVT oder PE in der Vorgeschichte - 1,5 Punkte
- Hämoptyse - 1,0 Punkte
- Malignität (mit Behandlung innerhalb von sechs Monaten) oder Palliativmedizin - 1,0 Punkte ⓘ
Traditionelle Auswertung
- Score >6,0 - Hoch (Wahrscheinlichkeit 59% basierend auf gepoolten Daten)
- Punktzahl 2,0 bis 6,0 - Mäßig (Wahrscheinlichkeit 29 % auf der Grundlage gepoolter Daten)
- Punktzahl <2,0 - Gering (Wahrscheinlichkeit 15% auf der Grundlage gepoolter Daten) ⓘ
Alternative Auslegung
- Score > 4 - PE wahrscheinlich. Diagnostische Bildgebung erwägen.
- Score 4 oder weniger - PE unwahrscheinlich. D-Dimer zum Ausschluss einer PE in Betracht ziehen. ⓘ
Empfehlungen für einen Diagnosealgorithmus wurden von den PIOPED-Forschern veröffentlicht; diese Empfehlungen spiegeln jedoch nicht die Forschung mit 64-Schicht-MDCT wider. Diese Prüfer empfahlen:
- Geringe klinische Wahrscheinlichkeit. Wenn D-Dimer negativ ist, wird PE ausgeschlossen. Bei positivem D-Dimer sollte eine MDCT-Untersuchung durchgeführt und die Behandlung von den Ergebnissen abhängig gemacht werden.
- Mäßige klinische Wahrscheinlichkeit. Bei negativen D-Dimeren wird eine PE ausgeschlossen. Die Autoren waren jedoch nicht besorgt darüber, dass ein negatives MDCT mit negativen D-Dimeren in dieser Situation mit einer Wahrscheinlichkeit von 5 % falsch sein könnte. Vermutlich wird die Fehlerquote von 5 % sinken, wenn die 64-Schicht-MDCT häufiger verwendet wird. Bei positiven D-Dimeren sollte ein MDCT angefertigt und die Behandlung von den Ergebnissen abhängig gemacht werden.
- Hohe klinische Wahrscheinlichkeit. Weiter zur MDCT. Bei positivem Ergebnis behandeln, bei negativem Ergebnis sind weitere Tests zum Ausschluss einer PE erforderlich. Ein D-Dimer von weniger als 750 ug/L schließt eine PE bei Personen mit hohem Risiko nicht aus. ⓘ
Kriterien für den Ausschluss einer Lungenembolie
Die Lungenembolie-Ausschlusskriterien (PERC) helfen bei der Beurteilung von Personen, bei denen eine Lungenembolie vermutet wird, aber unwahrscheinlich ist. Anders als der Wells-Score und der Geneva-Score, die als klinische Prognoseregeln zur Risikostratifizierung von Personen mit Verdacht auf Lungenembolie dienen, soll die PERC-Regel das Risiko einer Lungenembolie bei Personen ausschließen, die der Arzt bereits in eine niedrige Risikokategorie eingestuft hat. ⓘ
Personen in dieser niedrigen Risikokategorie, auf die keines der folgenden Kriterien zutrifft, dürfen nicht weiter auf eine Lungenembolie untersucht werden: niedrige Sauerstoffsättigung - SaO2 <95 %, einseitige Beinschwellung, Bluthusten, frühere tiefe Venenthrombose oder Lungenembolie, kürzliche Operation oder Trauma, Alter >50, Hormoneinnahme, schnelle Herzfrequenz. Dieser Entscheidung liegt die Überlegung zugrunde, dass weitere Untersuchungen (insbesondere eine CT-Angiographie des Brustkorbs) mehr Schaden (durch Strahlenbelastung und Kontrastmittel) anrichten können als das Risiko einer PE. Die PERC-Regel hat eine Sensitivität von 97,4 % und eine Spezifität von 21,9 % mit einer falsch-negativen Rate von 1,0 % (16/1666). ⓘ
Blutuntersuchungen
Bei Personen mit geringem oder mäßigem Verdacht auf PE reicht ein normaler D-Dimer-Wert (der in einem Bluttest nachgewiesen wird) aus, um die Möglichkeit einer thrombotischen PE auszuschließen, wobei das Dreimonatsrisiko für thromboembolische Ereignisse 0,14 % beträgt. D-Dimer ist hoch empfindlich, aber nicht spezifisch (Spezifität etwa 50 %). Mit anderen Worten, ein positives D-Dimer ist nicht gleichbedeutend mit einer Lungenembolie, aber ein negatives D-Dimer ist mit ziemlicher Sicherheit ein Hinweis darauf, dass keine Lungenembolie vorliegt. Eine niedrige Vortestwahrscheinlichkeit ist ebenfalls wertvoll für den Ausschluss einer PE. Der typische Grenzwert liegt bei 500 μg/L, wobei dieser Wert je nach Assay variiert. Bei Personen über 50 Jahren wird jedoch empfohlen, den Cut-off-Wert auf das Alter der Person multipliziert mit 10 μg/L (unter Berücksichtigung des verwendeten Assays) zu ändern, da so die Zahl der falsch positiven Tests verringert wird, ohne dass zusätzliche Fälle von PE übersehen werden. ⓘ
Bei Verdacht auf eine Lungenembolie werden mehrere Bluttests durchgeführt, um wichtige sekundäre Ursachen einer Lungenembolie auszuschließen. Dazu gehören ein vollständiges Blutbild, der Gerinnungsstatus (PT, aPTT, TT) und einige Screening-Tests (Erythrozytensenkungsgeschwindigkeit, Nierenfunktion, Leberenzyme, Elektrolyte). Wenn einer dieser Tests abnormal ist, können weitere Untersuchungen zur Klärung des Problems erforderlich sein. ⓘ
Die Troponinwerte sind bei 16 bis 47 % der Fälle von Lungenembolie erhöht. ⓘ
Bildgebung
Bei typischen Personen, bei denen kein erhöhtes Risiko für eine Lungenembolie bekannt ist, ist die Bildgebung hilfreich, um die Diagnose einer Lungenembolie zu bestätigen oder auszuschließen, nachdem einfachere Erstlinientests durchgeführt wurden. Medizinische Fachgesellschaften empfehlen Tests wie den D-Dimer-Test, um die Notwendigkeit einer bildgebenden Untersuchung zu bestätigen, und die bildgebende Untersuchung wird durchgeführt, wenn andere Tests mit mittlerer oder hoher Wahrscheinlichkeit die Diagnose einer PE bestätigen. ⓘ
Die CT-Angiographie der Lunge ist bei den meisten Menschen die empfohlene erste bildgebende Diagnoseuntersuchung. ⓘ
Eine Ultraschalluntersuchung der Beine kann das Vorliegen einer Lungenembolie bestätigen, aber nicht ausschließen. ⓘ
CT-Lungenangiographie
Die CT-Pulmonalangiografie (CTPA) ist ein Lungenangiogramm, das mit Hilfe der Computertomografie (CT) mit Radiokontrastmittel anstelle einer Rechtsherzkatheteruntersuchung erstellt wird. Ihre Vorteile sind, dass sie genau und nicht invasiv ist, dass sie häufiger zur Verfügung steht und dass sie andere Lungenerkrankungen aufdecken kann, wenn keine Lungenembolie vorliegt. Die Genauigkeit und der nicht-invasive Charakter der CTPA machen sie auch für Schwangere vorteilhaft. ⓘ
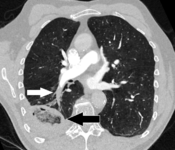
Lungenembolie (weißer Pfeil), die seit langem besteht und einen Lungeninfarkt (schwarzer Pfeil) verursacht hat, der als umgekehrtes Halozeichen zu sehen ist. ⓘ
Die Beurteilung der Genauigkeit der CT-Pulmonalangiographie wird durch die rasche Entwicklung der Anzahl der Detektorreihen bei Multidetektor-CT-Geräten (MDCT) erschwert. Einer Kohortenstudie zufolge kann die Einschicht-Spiral-CT bei Personen mit Verdacht auf Lungenembolie zur Erkennung beitragen. In dieser Studie lag die Sensitivität bei 69 % und die Spezifität bei 84 %. In dieser Studie, die eine Nachweisprävalenz von 32 % aufwies, lag der positive prädiktive Wert bei 67,0 % und der negative prädiktive Wert bei 85,2 %. Die Ergebnisse dieser Studie können jedoch aufgrund einer möglichen Inkorporationsverzerrung verzerrt sein, da die CT-Untersuchung bei Personen mit Lungenembolie das letzte diagnostische Mittel war. Die Autoren wiesen darauf hin, dass ein negativer Single-Slice-CT-Scan allein nicht ausreicht, um eine Lungenembolie auszuschließen. Eine andere Studie mit einer Mischung aus 4- und 16-Schicht-Scannern ergab eine Sensitivität von 83 % und eine Spezifität von 96 %, was bedeutet, dass der Test gut geeignet ist, eine Lungenembolie auszuschließen, wenn sie auf der Bildgebung nicht zu sehen ist, und dass er sehr gut geeignet ist, eine Lungenembolie zu bestätigen, wenn sie gesehen wird. In dieser Studie wurde festgestellt, dass zusätzliche Tests erforderlich sind, wenn die klinische Wahrscheinlichkeit nicht mit den Ergebnissen der Bildgebung übereinstimmt. Die CTPA ist dem VQ-Scan nicht unterlegen und identifiziert im Vergleich zum VQ-Scan mehr Embolien (ohne notwendigerweise das Ergebnis zu verbessern). ⓘ
Beatmungs-/Perfusionsuntersuchung

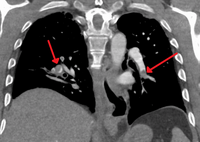
(A) Nach Inhalation von 20 mCi Xenon-133-Gas wurden szintigraphische Bilder in der Rückprojektion aufgenommen, die eine gleichmäßige Belüftung der Lungen zeigen.
(B) Nach intravenöser Injektion von 4 mCi Technetium-99m-markiertem Albumin wurden szintigraphische Bilder in der posterioren Projektion aufgenommen. Diese und andere Ansichten zeigen eine verminderte Aktivität in mehreren Regionen. ⓘ
Ein Ventilation/Perfusion-Scan (oder V/Q-Scan oder Lungenszintigraphie) zeigt, dass einige Bereiche der Lunge zwar belüftet, aber nicht durchblutet werden (aufgrund einer Obstruktion durch ein Gerinnsel). Diese Art der Untersuchung ist genauso genau wie die Mehrschicht-CT, wird aber aufgrund der größeren Verfügbarkeit der CT-Technologie seltener eingesetzt. Sie eignet sich besonders für Personen, die eine Allergie gegen jodhaltige Kontrastmittel haben, deren Nierenfunktion eingeschränkt ist oder die schwanger sind (wegen der geringeren Strahlenbelastung im Vergleich zur CT). Die Untersuchung kann mit planarer zweidimensionaler Bildgebung oder mit der Einzelphotonen-Emissions-Computertomographie (SPECT) durchgeführt werden, die eine dreidimensionale Bildgebung ermöglicht. Hybridgeräte, die SPECT und CT kombinieren (SPECT/CT), ermöglichen darüber hinaus die anatomische Charakterisierung von Anomalien. ⓘ
Diagnostische Tests mit geringer Wahrscheinlichkeit/nicht-diagnostische Tests
Häufig durchgeführte Tests, die nicht sensitiv für PE sind, aber diagnostisch sein können.
- Röntgenaufnahmen des Brustkorbs werden häufig bei Menschen mit Kurzatmigkeit durchgeführt, um andere Ursachen wie Herzinsuffizienz und Rippenfrakturen auszuschließen. Röntgenaufnahmen des Brustkorbs bei PE sind selten normal, weisen aber in der Regel keine Anzeichen auf, die auf die Diagnose einer PE hindeuten (z. B. Westermark-Zeichen, Hamptons Höcker).
- Ultraschall der Beine, auch Beindoppler genannt, auf der Suche nach einer tiefen Venenthrombose (TVT). Das Vorhandensein einer tiefen Venenthrombose im Ultraschall der Beine reicht bereits aus, um eine Antikoagulation zu rechtfertigen, ohne dass eine V/Q- oder Spiral-CT-Untersuchung erforderlich ist (wegen des starken Zusammenhangs zwischen tiefer Venenthrombose und Lungenembolie). Diese Vorgehensweise kann in der Schwangerschaft sinnvoll sein, da die anderen Untersuchungsmethoden das Risiko von Geburtsschäden beim ungeborenen Kind erhöhen würden. Eine negative Ultraschalluntersuchung schließt jedoch eine Lungenembolie nicht aus, und eine Untersuchung mit niedriger Strahlendosis kann erforderlich sein, wenn bei der Mutter ein hohes Risiko für eine Lungenembolie besteht. Die Ultraschalluntersuchung der Beine wird daher in erster Linie bei klinischen Symptomen eingesetzt, die auf eine tiefe Venenthrombose hindeuten. ⓘ
Fluoroskopische Pulmonalangiographie

In der Vergangenheit war der Goldstandard für die Diagnose die pulmonale Angiographie mittels Durchleuchtung, die jedoch mit der zunehmenden Verfügbarkeit nicht-invasiver Techniken, die eine ähnliche diagnostische Genauigkeit bieten, in Vergessenheit geraten ist. ⓘ
Elektrokardiogramm

Das EKG dient in erster Linie dazu, andere Ursachen für Brustschmerzen auszuschließen. Ein Elektrokardiogramm (EKG) wird routinemäßig bei Personen mit Brustschmerzen durchgeführt, um Myokardinfarkte (Herzinfarkte) schnell zu diagnostizieren, was eine wichtige Differenzialdiagnose bei Personen mit Brustschmerzen darstellt. Zwar können bei einer PE bestimmte EKG-Veränderungen auftreten, doch sind diese weder spezifisch genug, um die Diagnose zu bestätigen, noch sensitiv genug, um sie auszuschließen. Ein EKG kann Anzeichen einer Rechtsherzbelastung oder eines akuten Cor pulmonale bei großen PEs zeigen - die klassischen Anzeichen sind eine große S-Welle in Ableitung I, eine große Q-Welle in Ableitung III und eine invertierte T-Welle in Ableitung III (S1Q3T3), die bei 12-50 % der Personen mit der Diagnose auftritt, aber auch bei 12 % ohne diese Diagnose. ⓘ
Dies kommt gelegentlich vor (bei bis zu 20 % der Betroffenen), kann aber auch bei anderen akuten Lungenerkrankungen auftreten und hat daher nur einen begrenzten diagnostischen Wert. Die häufigsten Anzeichen im EKG sind Sinustachykardie, Rechtsachsenabweichung und Rechtsschenkelblock. Eine Sinustachykardie findet sich jedoch nur bei 8-69 % der Menschen mit PE. ⓘ
EKG-Befunde im Zusammenhang mit einer Lungenembolie können auf eine schlechtere Prognose hindeuten, da die sechs Befunde, die im EKG mit einer RV-Belastung identifiziert wurden (Herzfrequenz > 100 Schläge pro Minute, S1Q3T3, invertierte T-Wellen in den Ableitungen V1-V4, ST-Hebung in der aVR, kompletter Rechtsschenkelblock und Vorhofflimmern), mit einem erhöhten Risiko für Kreislaufschock und Tod verbunden sind. ⓘ
Bei Fällen mit invertierten T-Wellen in den Ableitungen V1-3 besteht der Verdacht auf eine PE oder einen inferioren Myokardinfarkt. PE-Fälle weisen in den Ableitungen II und aVF invertierte T-Wellen auf, während Fälle von inferiorem Myokardinfarkt keine invertierten T-Wellen in II und aVF aufweisen. ⓘ
Echokardiographie
Bei massiver und submassiver Lungenembolie kann in der Echokardiographie eine Funktionsstörung der rechten Herzhälfte festgestellt werden, was darauf hindeutet, dass die Lungenarterie stark verschlossen ist und der rechte Ventrikel, eine Niederdruckpumpe, dem Druck nicht gewachsen ist. Einige Studien (siehe unten) legen nahe, dass dieser Befund eine Indikation für eine Thrombolyse sein kann. Nicht bei jeder Person mit einer (vermuteten) Lungenembolie ist ein Echokardiogramm erforderlich, aber Erhöhungen der kardialen Troponine oder des natriuretischen Hirnpeptids können auf eine Herzbelastung hinweisen und ein Echokardiogramm rechtfertigen und für die Prognose wichtig sein. ⓘ
Das spezifische Erscheinungsbild des rechten Ventrikels in der Echokardiographie wird als McConnell-Zeichen bezeichnet. Dabei handelt es sich um den Befund einer Akinese der mittleren freien Wand, aber einer normalen Bewegung des Apex. Dieses Phänomen hat eine Sensitivität von 77 % und eine Spezifität von 94 % für die Diagnose einer akuten Lungenembolie im Rahmen einer rechtsventrikulären Dysfunktion. ⓘ

Ultraschalluntersuchung des Herzens mit Anzeichen einer PE
Ultraschalluntersuchung des Herzens mit Anzeichen einer PE ⓘ
Vorbeugung
Eine Lungenembolie kann bei Personen mit Risikofaktoren vermieden werden. Personen, die ins Krankenhaus eingeliefert werden, können vorbeugende Medikamente erhalten, darunter unfraktioniertes Heparin, niedermolekulares Heparin (LMWH) oder Fondaparinux, sowie Antithrombosestrümpfe, um das Risiko einer tiefen Beinvenenthrombose zu verringern, die sich lösen und in die Lunge wandern könnte. ⓘ
Nach Beendigung der Antikoagulation bei Patienten mit früherer Lungenembolie ist eine Langzeitbehandlung mit Aspirin sinnvoll, um ein erneutes Auftreten zu verhindern. ⓘ
Behandlung
Die gerinnungshemmende Therapie ist die Hauptstütze der Behandlung. In der Akutphase können unterstützende Maßnahmen wie Sauerstoff oder Analgesie erforderlich sein. In der Anfangsphase der Behandlung werden die Betroffenen häufig ins Krankenhaus eingewiesen und bleiben in der Regel stationär, bis der INR-Wert therapeutische Werte erreicht hat (wenn Warfarin verwendet wird). In zunehmendem Maße werden jedoch Fälle mit geringem Risiko zu Hause behandelt, wie es bereits bei der Behandlung von TVT üblich ist. Es gibt nur wenige Belege dafür, dass der eine oder der andere Ansatz besser ist als der andere. ⓘ
Gerinnungshemmung
Die Antikoagulanzientherapie ist die Hauptstütze der Behandlung. Viele Jahre lang waren Vitamin-K-Antagonisten (Warfarin oder seltener Acenocoumarol oder Phenprocoumon) der Eckpfeiler der Behandlung. Da Vitamin-K-Antagonisten nicht sofort wirken, erfolgt die Anfangsbehandlung mit schnell wirkenden injizierbaren Antikoagulantien: unfraktioniertes Heparin (UFH), niedermolekulares Heparin (LMWH) oder Fondaparinux, während orale Vitamin-K-Antagonisten eingeleitet und (in der Regel im Rahmen der stationären Krankenhausbehandlung) auf das internationale normalisierte Verhältnis titriert werden, ein Test, der die Dosis bestimmt. Bei den injizierbaren Behandlungen kann LMWH im Vergleich zu UFH die Blutungen bei Menschen mit Lungenembolie verringern. Derselben Untersuchung zufolge verringerte LMWH im Vergleich zu Heparin die Häufigkeit wiederkehrender thrombotischer Komplikationen und reduzierte die Größe des Thrombus. Bei der Gesamtmortalität gab es keinen Unterschied zwischen den mit LMWH und den mit unfraktioniertem Heparin behandelten Teilnehmern. Vitamin-K-Antagonisten erfordern eine häufige Dosisanpassung und die Überwachung der internationalen normalisierten Ratio (INR). Bei einer PE gilt ein INR-Wert zwischen 2,0 und 3,0 im Allgemeinen als ideal. Tritt unter der Warfarin-Behandlung eine weitere PE auf, kann das INR-Fenster auf z. B. 2,5-3,5 erhöht werden (sofern keine Kontraindikationen vorliegen), oder die Antikoagulation kann auf ein anderes Antikoagulans, z. B. LMWH, umgestellt werden. ⓘ
In den letzten Jahren wurden viele Antikoagulanzien eingeführt, die ähnlich wie Warfarin wirken, jedoch ohne die Notwendigkeit einer INR-Titration. Diese als direkt wirkende orale Antikoagulanzien bekannten Behandlungen werden in den amerikanischen Leitlinien inzwischen gegenüber Vitamin-K-Antagonisten bevorzugt. Zwei von ihnen (Rivaroxaban und Apixaban) erfordern keine anfängliche Heparin- oder Fondaparinux-Behandlung, Dabigatran und Edoxaban dagegen schon. Eine Cochrane-Überprüfung ergab, dass es keine Belege für einen Unterschied zwischen oralen DTIs (Dabigatran, Rivaroxaban, Edoxaban, Apixaban) und der Standard-Antikoagulation bei der Vorbeugung von wiederkehrenden Lungenembolien gibt. ⓘ
Bei Krebspatienten, die eine Lungenembolie entwickeln, wird eine Behandlung mit LMWH gegenüber Warfarin oder anderen oralen Antikoagulantien bevorzugt. In ähnlicher Weise werden schwangere Frauen bis nach der Entbindung mit niedermolekularem Heparin behandelt, um die bekannten teratogenen Wirkungen von Warfarin zu vermeiden, insbesondere in den frühen Stadien der Schwangerschaft, aber es kann auch während der Stillzeit verwendet werden. ⓘ
Die Antikoagulationstherapie wird in der Regel für 3 bis 6 Monate fortgesetzt, oder "lebenslang", wenn bereits früher eine TVT oder PE aufgetreten ist oder keiner der üblichen vorübergehenden Risikofaktoren vorliegt. Bei Patienten ohne bekannte Ursache, die rückgängig gemacht werden kann, kann eine 2-jährige Behandlung besser sein als eine 6-monatige. Bei kleinen Lungenembolien (so genannten subsegmentalen Lungenembolien) ist die Wirkung der Antikoagulation nicht bekannt, da sie bis 2020 noch nicht ausreichend untersucht wurde. ⓘ
Thrombolyse
Eine massive Lungenembolie, die eine hämodynamische Instabilität verursacht (Schock und/oder niedriger Blutdruck, definiert als systolischer Blutdruck <90 mmHg oder ein Druckabfall von 40 mmHg für >15 Minuten, sofern nicht durch neu auftretende Arrhythmie, Hypovolämie oder Sepsis verursacht), ist eine Indikation für die Thrombolyse, die enzymatische Zerstörung des Gerinnsels durch Medikamente. In dieser Situation ist sie die beste verfügbare Behandlung, wenn keine Kontraindikationen vorliegen, und wird von den klinischen Leitlinien unterstützt. Sie wird auch bei Patienten mit Herzstillstand und bekannter Lungenembolie empfohlen. Die kathetergezielte Thrombolyse (CDT) ist eine neue Technik, die sich bei massiven Lungenembolien als relativ sicher und wirksam erwiesen hat. Dabei wird ein Katheter in eine Vene in der Leiste eingeführt und mit Hilfe von Röntgendurchleuchtung durch die Venen geführt, bis er in der Nähe der Lungenembolie im Lungenkreislauf liegt. Über den Katheter werden Medikamente, die Blutgerinnsel auflösen, so freigesetzt, dass sich ihre höchste Konzentration direkt neben der Lungenembolie befindet. Die CDT wird von interventionellen Radiologen oder Gefäßchirurgen durchgeführt. In medizinischen Zentren, die die CDT anbieten, kann sie als Erstbehandlung eingesetzt werden. Die kathetergestützte ultraschallunterstützte Thrombolyse wird derzeit untersucht. ⓘ
Der Einsatz der Thrombolyse bei nicht massiven Lungenembolien ist noch umstritten. Einige haben festgestellt, dass die Behandlung das Sterberisiko senkt und das Risiko von Blutungen, einschließlich intrakranieller Blutungen, erhöht. Andere haben keinen Rückgang des Sterberisikos festgestellt. ⓘ
Inferiorer Vena-Cava-Filter

Es gibt zwei Situationen, in denen ein inferiorer Vena-Cava-Filter als vorteilhaft angesehen wird, und zwar wenn eine gerinnungshemmende Therapie kontraindiziert ist (z. B. kurz nach einer größeren Operation) oder wenn eine Person trotz Antikoagulation eine Lungenembolie hat. In diesen Fällen kann das Gerät implantiert werden, um zu verhindern, dass neue oder bestehende Thrombosen in die Lungenarterie gelangen und sich mit einer bereits bestehenden Blockade verbinden. Trotz des theoretischen Vorteils des Geräts, Lungenembolien zu verhindern, gibt es keine Belege für seine Wirksamkeit. ⓘ
Inferiore Vena-Cava-Filter sollten entfernt werden, sobald eine Antikoagulation gefahrlos durchgeführt werden kann. Obwohl moderne Filter so konzipiert sind, dass sie wieder entfernt werden können, kann es zu Komplikationen kommen, die eine Entfernung verhindern. Das langfristige Sicherheitsprofil eines Filters, der dauerhaft im Körper verbleibt, ist nicht bekannt. ⓘ
Chirurgie
Die chirurgische Behandlung der akuten Lungenembolie (pulmonale Thrombektomie) ist unüblich und wurde wegen der schlechten Langzeitergebnisse weitgehend aufgegeben. In jüngster Zeit hat sie jedoch mit der Überarbeitung der chirurgischen Technik einen neuen Aufschwung erlebt, und man geht davon aus, dass sie für bestimmte Personen von Nutzen sein kann. Chronische Lungenembolien, die zu pulmonaler Hypertonie führen (so genannte chronische thromboembolische Hypertonie), werden mit einem chirurgischen Eingriff behandelt, der als pulmonale Thromboendarteriektomie bezeichnet wird. ⓘ
Epidemiologie
Jährlich gibt es etwa 10 Millionen Fälle von Lungenembolie. In den Vereinigten Staaten sind Lungenembolien die Hauptursache für mindestens 10.000 bis 12.000 Todesfälle pro Jahr und eine mitwirkende Ursache für mindestens 30.000 bis 40.000 Todesfälle pro Jahr. Die tatsächliche Inzidenz von Lungenembolien ist nicht bekannt, da sie häufig nicht diagnostiziert werden oder bis zur Autopsie unbemerkt bleiben. Von 1993 bis 2012 stieg die Zahl der Krankenhauseinweisungen aufgrund von Lungenembolien von 23 Fällen pro 100.000 Einwohner auf 65 Fälle pro 100.000 Einwohner. Trotz dieses Anstiegs ist die Sterblichkeit im gleichen Zeitraum aufgrund des medizinischen Fortschritts zurückgegangen. ⓘ
Venöse Thromboembolien (VTE), ein häufiger Risikofaktor, treten bei über 70-Jährigen wesentlich häufiger auf (dreimal so häufig wie bei 45- bis 69-Jährigen). Dies ist wahrscheinlich darauf zurückzuführen, dass ältere Menschen im Allgemeinen weniger aktiv sind, was zu einer höheren Rate an Immobilität und Übergewicht führt. VTE haben eine hohe und ständig steigende Sterblichkeitsrate. Nach 30 Tagen liegt diese Rate bei etwa 10 %, nach drei Monaten bei 15 % und nach einem Jahr bei bis zu 20 %. Lungenembolien allein (wenn sie zu Krankenhausaufenthalten führen) haben eine Sterblichkeitsrate von etwa 5 % bis 10 %, so dass VTE einen großen Einfluss auf die Schwere der Embolien haben können. ⓘ
Betrachtet man alle Fälle, so ist die Rate der tödlichen Lungenembolien in den letzten 25 Jahren in den Vereinigten Staaten von 6 % auf 2 % gesunken. In Europa wurden zwischen 2013 und 2015 durchschnittlich etwa 40 000 Todesfälle pro Jahr mit einer Lungenembolie als Hauptursache gemeldet, wobei es sich hierbei um eine vorsichtige Schätzung handelt, da möglicherweise eine Unterdiagnose vorliegt. ⓘ
Prognose

Weniger als 5 bis 10 % der symptomatischen Lungenembolien verlaufen innerhalb der ersten Stunde nach Auftreten der Symptome tödlich. ⓘ
Es gibt mehrere Marker für die Risikostratifizierung, die auch unabhängige Prädiktoren für ungünstige Ergebnisse sind. Dazu gehören Hypotonie, kardiogener Schock, Synkope, Anzeichen einer Rechtsherzdysfunktion und erhöhte Herzenzyme. Einige EKG-Veränderungen, darunter S1Q3T3, korrelieren ebenfalls mit einer schlechteren Kurzzeitprognose. Es gibt weitere patientenbezogene Faktoren wie COPD und chronische Herzinsuffizienz, von denen angenommen wird, dass sie ebenfalls eine Rolle für die Prognose spielen. ⓘ
Die Prognose hängt von der Größe der betroffenen Lunge und dem Vorliegen anderer Erkrankungen ab; eine chronische Embolie in der Lunge kann zu pulmonaler Hypertonie führen. Nach einer massiven Lungenembolie muss der Embolus irgendwie aufgelöst werden, wenn der Patient überleben soll. Bei einer thrombotischen Lungenembolie kann das Blutgerinnsel durch Fibrinolyse aufgelöst werden, oder es kann organisiert und rekanalisiert werden, so dass sich ein neuer Kanal durch das Gerinnsel bildet. Der Blutfluss wird in den ersten ein bis zwei Tagen nach einer PE am schnellsten wiederhergestellt. Danach verlangsamt sich die Besserung, und einige Defizite können dauerhaft sein. Es ist umstritten, ob kleine subsegmentale Lungenembolien überhaupt behandelt werden müssen, und es gibt Hinweise darauf, dass Patienten mit subsegmentalen Lungenembolien auch ohne Behandlung gut zurechtkommen können. ⓘ
Sobald die Antikoagulation abgesetzt wird, liegt das Risiko einer tödlichen Lungenembolie bei 0,5 % pro Jahr. ⓘ
Die Sterblichkeit bei unbehandelten Lungenembolien wurde mit 26 % angegeben. Diese Zahl stammt aus einer 1960 von Barrit und Jordan veröffentlichten Studie, in der die Behandlung der Lungenembolie mit Antikoagulation und Placebo verglichen wurde. Barritt und Jordan führten ihre Studie 1957 im Bristol Royal Infirmary durch. Diese Studie ist die einzige placebokontrollierte Studie, die jemals den Stellenwert von Antikoagulantien bei der Behandlung der Lungenembolie untersucht hat. Die Ergebnisse waren so überzeugend, dass die Studie nie wiederholt wurde, da eine Wiederholung als unethisch angesehen werden würde. Abgesehen davon ist die angegebene Sterblichkeitsrate von 26 % in der Placebogruppe wahrscheinlich eine Übertreibung, wenn man bedenkt, dass mit der damaligen Technologie möglicherweise nur schwere PEs erkannt wurden. ⓘ
Vorhersage der Sterblichkeit
Mit dem PESI- und dem sPESI-Score (= vereinfachter Pulmonalembolie-Schweregrad-Index) lässt sich die Sterblichkeit der Patienten abschätzen. Anhand der Genfer Vorhersageregeln und der Wells-Kriterien wird eine Vorhersagewahrscheinlichkeit für Patienten mit einer Lungenembolie berechnet. Diese Scores sind Instrumente, die zusammen mit dem klinischen Urteilsvermögen bei der Entscheidung über diagnostische Tests und die Art der Therapie eingesetzt werden. Der PESI-Algorithmus umfasst 11 routinemäßig verfügbare klinische Variablen. Er teilt die Betroffenen in eine von fünf Klassen (I-V) ein, wobei die 30-Tage-Sterblichkeit zwischen 1,1 % und 24,5 % liegt. Personen der Klassen I und II haben ein geringes Risiko, Personen der Klassen III-V ein hohes Risiko. ⓘ
Der PESI (Pulmonary Embolism Severity Index) ist ein Scoring-System zur Risikostratifizierung nicht-massiver Lungenembolien (systolischer Blutdruck > 90 mmHg). Anhand von 11 Kriterien werden die Patienten in fünf Risikoklassen eingeteilt. Bei einer PESI-Risikoklasse von I oder II ist die Sterblichkeitsrate niedrig und eine ambulante Therapie kann in Erwägung gezogen werden. ⓘ
| Prädiktor | Punkte ⓘ |
|---|---|
| Alter | Anzahl Jahre |
| männliches Geschlecht | 10 |
| Krebs | 30 |
| Herzinsuffizienz | 10 |
| Puls ≥ 110/min | 20 |
| systolischer Blutdruck < 100 mmHg | 30 |
| Atemfrequenz ≥ 30/min | 20 |
| Temperatur < 36 °C | 20 |
| verminderter Bewusstseinszustand | 60 |
| Sauerstoffsättigung < 90 % | 20 |
| PESI-Risikoklasse | Punkte |
| I | ≤ 65 |
| II | 66–85 |
| III | 86–105 |
| IV | 106–125 |
| V | ≥ 125 |
Ursachen und Auslöser
Es gibt bestimmte Risikopatienten, die zu Thrombosen und damit zu Lungenembolien neigen. ⓘ
Disponierende Faktoren sind in der Vorgeschichte des Patienten: Fraktur (Hüfte oder Bein), Hüft- oder Knie-Totalendoprothese, große Operation, Lungenerkrankung, Hormonersatztherapie, bösartiger Tumor, orale Kontrazeption, Schlaganfall, Schwangerschaft, Phase kurz nach der Geburt, vorangegangene venöse Embolie, Störung der Blutgerinnung, hohes Alter, hohe Homocysteinspiegel. ⓘ
Bei entsprechender Prädisposition kann dann jede Immobilisierung –, besonders der unteren Gliedmaßen –, zum Auslöser werden, die durch Stase des Blutes das Anwachsen eines Thrombus (ähnlich „Kondensation“) begünstigen: Blutstauung bei lange angewinkeltem Knie, etwa bei langen Busfahrten oder beim Langstreckenfliegen, Reisethrombose, nach Brüchen und Verstauchungen sowie Bettlägerigkeit jeder Art. ⓘ
Den Zeitpunkt des akuten Eintritts bestimmt dagegen erst das spätere Ablösen eines Thrombus und dessen Einschwemmen in die Lunge. Das geschieht typisch durch Mobilisierung nach dem Ruhen, also teilweise deutlich nach dem Aufstehen, beim Pressen (Stuhlgang) und anderen ersten körperlichen Anstrengungen danach. Ihnen allen ist die plötzliche Blutdruckänderung im venösen System mit einer Dilatation der Gefäße nach Inaktivität gemeinsam. (Quellen unter) ⓘ
Symptomatik
Typische Anzeichen einer Lungenembolie sind akute Luftnot und/oder Brustschmerz beim Einatmen. Die weitere Symptomatik ist sehr variabel und oft gekennzeichnet durch die Erhöhung von Ruhepuls (über 100/min, Tachykardie mit Herzrhythmusstörungen) und Atemfrequenz (Tachypnoe). Auftretender Husten ist vereinzelt mit Blut im Auswurf verbunden. Der niedrige Blutdruck (Hypotonie) kann zum Schock führen. ⓘ
Bei 20 bis 55 % der Fälle von Lungenembolie besteht ein Pleuraerguss. ⓘ
Führt eine plötzlich einsetzende (fulminante) Lungenembolie zum Kreislaufstillstand, dann sind im Rahmen von Reanimationsmaßnahmen häufig gestaute Halsvenen (als Zeichen einer oberen Einflussstauung bei bestehendem „Vorwärtsversagen“ des Herzens) erkennbar. Bedingt durch die Unterversorgung des Blutes mit Sauerstoff wird klassisch die sogenannte „Kranzzyanose“ (oder auch „schwedischer Kragen“) erkennbar: Hals und Dekolleté wirken dunkel marmoriert. ⓘ
Schweregradeinteilung
Nach Grosser
| Schweregrad I | Schweregrad II | Schweregrad III | Schweregrad IV ⓘ | |
|---|---|---|---|---|
| Klinik | diskret, in 80 % klinisch stumm | Akute Dyspnoe, Tachypnoe, thorakaler Schmerz, Angst, Hämoptysen, Fieber, Pleuraerguss (durch Transsudat oder Exsudat) | Zusätzlich Schocksymptomatik | |
| Blutdruck | normal | evtl. leicht erniedrigt | erniedrigt | stark erniedrigt |
| Gefäßverschluss | periphere Äste | Segmentarterien | PA-Ast oder mehrere Lappenarterien | Ein PA-Ast und mehrere Lappenarterien |
Nach ESC (Europäische Gesellschaft für Kardiologie) 2008
| Frühsterblichkeit ⓘ | |||
|---|---|---|---|
| niedrig (< 1 %) | mittel (3–15 %) | hoch (> 15 %) | |
| Schock oder Hypotonie | nein | nein | ja (triggert Therapie) |
| RV-Dysfunktion | nein | nein/ja* | möglich |
| Troponin erhöht | nein | nein/ja* | möglich |
| *mind. eines der beiden Kriterien | |||
| Therapie | frühe Entlassung | Krankenhausbehandlung | Thrombolyse oder Embolektomie |
Diagnostik
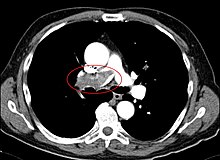
Bei klinischem Verdacht auf eine Lungenembolie, der sich nach sorgfältiger Anamnese und Hilfestellung durch den Wells-Score oder Geneva-Score ergibt, kann die Diagnose am schnellsten mit einer kontrastmittelverstärkten Computertomographie gesichert werden. Im konventionellen Röntgenbild gibt es zwar beschriebene Röntgenzeichen für eine Lungenembolie (Hampton hump, Westermark- und Fleishner-Zeichen), jedoch sind diese eher selten vorhanden und oft nicht eindeutig. ⓘ
Eine Lungenembolie lässt sich laborchemisch bei unauffälligen Dimeren mit hoher Sicherheit ausschließen. Erhöhte D-Dimere lassen keine Aussage zu, da sie leicht falsch positiv werden. So sind die D-Dimere nach Operationen, Sport oder Unfällen oft erhöht. ⓘ
Rechtsherzbelastungszeichen als indirekte Zeichen einer Lungenembolie lassen sich im EKG (sog. SIQIII-Typ) und in der Echokardiographie nachweisen. In der Blutgasanalyse zeigt sich ein vermindertes pO2 bei einem gleichzeitig verminderten pCO2 als Folge der Hyperventilation bei Hypoxämie. ⓘ
Kleinere Embolien, die der CT entgehen könnten, lassen sich mittels Lungenszintigraphie nachweisen. Dieses Verfahren kommt jedoch wegen der geringen Verfügbarkeit und der im Verhältnis zu modernen CT langen Untersuchungsdauer seltener zum Einsatz. In vielen Fällen kann die Nuklearmedizin mit der Lungenperfusions- und -inhalationsszintigraphie allerdings einen wertvollen Beitrag zur Diagnose einer Lungenembolie leisten: Bei Patienten mit Kontrastmittelallergie, mit Überfunktion der Schilddrüse oder mit schlechten Nierenwerten (erhöhtes Kreatinin) kann eine Computertomographie mit Kontrastmittel nicht durchgeführt werden; in diesen Fällen kann die exakte Diagnose nur nuklearmedizinisch gestellt werden. Die Lungenperfusionszintigrafie zeigt auf, ob der in eine Vene applizierte radioaktive Tracer regelmäßig in beiden Lungen dargestellt wird oder ob es keilförmige Abschwächungen bis Defekte in der Lunge gibt, was Hinweis für eine Lungenembolie sein kann. Bei der Inhalationsszintigraphie wird der Tracer eingeatmet und anschließend verglichen, ob die Darstellungen beider Untersuchungen gleich sind (gleich: kein Hinweis auf Lungenembolie) oder ob ein Unterschied besteht (Unterschied zwischen Perfusions- und Inhalationsszintigraphie: Beweis für eine Lungenembolie). ⓘ
Auch die Magnetresonanztomografie (MRT) bietet die Möglichkeit zur Diagnostik der Lungenembolie. Diese kommt jedoch bei der gegenwärtigen Verbreitung geeigneter Geräte nur selten mit dieser Fragestellung zum Einsatz. ⓘ
Die früher häufig durchgeführte konventionelle Angiografie der Lungenstrombahn liefert gute Ergebnisse. Sie wird jedoch wegen des damit verbundenen technischen Aufwandes, der erheblichen Belastung des Patienten und des Risikos, das mit der Einführung eines Katheters in den Lungenkreislauf des Patienten verbunden ist, seltener durchgeführt. ⓘ
Erschwert wird die Symptombeurteilung und Diagnostik oft, weil mehrere, auch kleine Thromben in zeitlichen Abständen beteiligt sein können. Eine Hilfe bei der Diagnostik ist der Wells-Score, ein Punktesystem für die Wahrscheinlichkeit einer Embolie, der gut mit dem Ergebnis des D-Dimer-Tests kombiniert werden kann. ⓘ
Differentialdiagnose
Bei den Leitsymptomen einer schwerwiegenden Lungenembolie (Luftnot, Brustschmerz, Kreislaufinstabilität) kommt als Differentialdiagnose in erster Linie der Herzinfarkt in Frage, eventuell auch eine Lungenentzündung, ein Pneumothorax oder eine Aortendissektion. ⓘ
Therapie
Erste Hilfe
Die Prognostizierung einer Lungenembolie für einen Ersthelfer ist meist recht schwierig und erfordert Vorwissen. Wenn man jedoch einen Verdacht auf eine solche hat, muss man als Ersthelfer schnell handeln. Maßnahmen, die man als Ersthelfer durchführen kann, sind:
- Sofort den Rettungsdienst über die Rufnummer 112 (in Europa) oder eine andere örtliche Notrufnummer alarmieren
- Den Erkrankten mit erhöhtem Oberkörper lagern
- Den Patienten beruhigen und zur ruhigen Atmung auffordern
- Den Erkrankten keine körperliche Anstrengung vornehmen lassen
- Für frische Luft sorgen und beengende Kleidungsstücke öffnen
- Weiter allgemeine Maßnahmen im Rahmen der Ersten Hilfe ⓘ
Medizinische Maßnahmen
Eine Lungenembolie kann lebensbedrohlich sein. Kleine Lungenembolien bei stabilen Patienten können unter Umständen aber auch ambulant behandelt werden. ⓘ
Neben der Sauerstoffzufuhr wird in jedem Fall eine Lysetherapie mit intravenös appliziertem Heparin zur Hemmung der Blutgerinnung (Antikoagulation) durchgeführt. Nach Abklingen akuter Symptome wird längerzeitig eine Thromboseprophylaxe mit direkten oralen Antikoagulanzien (DOAK) zur Vermeidung erneuter Thrombosen durchgeführt. Entsprechende Präparate sind Apixaban (Handelsname Eliquis; Hersteller: Bristol-Myers Squibb/Pfizer), Rivaroxaban (Handelsname Xarelto; Hersteller: Bayer) oder Dabigatran (Handelsname Pradaxa; Hersteller: Boehringer Ingelheim). Bereits sehr viel länger auf dem Markt sind die Cumarinpräparate Phenprocoumon (Handelsnamen Marcumar bzw. Falithrom) und Warfarin (Handelsname Coumadin). ⓘ
Bei schweren Lungenembolien mit Schocksymptomen und beschriebener schwerer Rechtsherzbelastung sind Kreislaufstabilisierung und rasch „rekanalisierende“ Maßnahmen nötig. Neben der Lysetherapie werden als akut lebensrettende Maßnahme dann kathetertechnische mechanische „Zertrümmerung“ von lokalisierten Thromben wie auch eine operative Entfernung (Embolektomie) zu erwägen sein. Bei der operativen Ausräumung des Embolie-Materials existieren Verfahren ohne Einsatz der Herz-Lungen-Maschine und solche mit deren Einsatz. Gegebenenfalls erfolgt die Operation unter andauernder Wiederbelebung des Patienten als sogenannte Ultima Ratio (eine hochriskante, aber vielleicht lebensrettende Maßnahme). ⓘ
Wenn eine künstliche Beatmung des Patienten wegen Sauerstoffmangels im Blut notwendig wird, sollte am Beatmungsgerät ein möglichst geringer Druck in der Ausatmungsphase (PEEP) sowie in der Einatmungsphase eingestellt werden. Ein zu hoher Beatmungsdruck würde den bereits durch die Lungenembolie belasteten rechten Teil des Herzens zusätzlich belasten. ⓘ
Die gerinnungshemmenden Stoffe müssen nach einer Lungenembolie für einige Monate, in manchen Fällen (bei bestimmten angeborenen Störungen des Gerinnungssystems sowie bei rezidivierenden Lungenembolien) lebenslang eingenommen werden, um erneute Thrombosen und Lungenembolien zu vermeiden. ⓘ
Die beste Schutzmaßnahme ist die Thromboseprophylaxe, die vor allem bei bettlägerigen Patienten und postoperativ angewendet wird. Hierbei erhält der Patient ein gerinnungshemmendes Medikament (meist ein sogenanntes niedermolekulares Heparin) in das Unterhautfettgewebe gespritzt oder in Tablettenform verabreicht. Auch das Tragen von Kompressionsstrümpfen hat sich bewährt. Wichtig für die Prophylaxe ist auch eine rasche Mobilisation der Patienten. ⓘ
Gesundheitsökonomie
Die Zahl der durch Lungenembolien verursachten Todesfälle innerhalb der Europäischen Union wird auf rund 370.000 jährlich geschätzt. Die geschätzten Kosten der Behandlung für durch tiefe Beinvenenthrombosen verursachte Lungenembolien werden auf rund drei Milliarden Euro europaweit geschätzt. ⓘ