Adenosintriphosphat

| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Adenosin-5′-(Tetrahydrogentriphosphat)
| |||
| Bevorzugter IUPAC-Name
O1-{[(2R,3S,4R,5R)-5-(6-Amino-9H-purin-9-yl)-3,4-dihydroxyoxolan-2-yl]methyl}-Tetrahydrogentriphosphat | |||
| Bezeichner | |||
| |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C10H13N5O13P3 | ||
| Molekulare Masse | 507,18 g/mol | ||
| Dichte | 1,04 g/cm3 (Dinatriumsalz) | ||
| Schmelzpunkt | 187 °C (369 °F; 460 K) Dinatriumsalz; zersetzt sich | ||
| Acidität (pKa) | 0.9, 1.4, 3.8, 6.5 | ||
| UV-vis (λmax) | 259 nm | ||
| Absorption | ε259 = 15,4 mM-1 cm-1 | ||
Sofern nicht anders angegeben, gelten die Daten für Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Adenosintriphosphat (ATP) ist eine organische Verbindung und ein Hydrotrop, das als Energielieferant für viele Prozesse in lebenden Zellen dient, z. B. für die Muskelkontraktion, die Weiterleitung von Nervenimpulsen, die Auflösung von Kondensaten und die chemische Synthese. ATP kommt in allen bekannten Lebensformen vor und wird oft als "molekulare Währungseinheit" des intrazellulären Energietransfers bezeichnet. Wenn es in Stoffwechselprozessen verbraucht wird, wandelt es sich entweder in Adenosindiphosphat (ADP) oder in Adenosinmonophosphat (AMP) um. Andere Prozesse regenerieren ATP, so dass der menschliche Körper jeden Tag das Äquivalent seines eigenen Körpergewichts an ATP recycelt. Es ist auch eine Vorstufe von DNA und RNA und wird als Coenzym verwendet. ⓘ
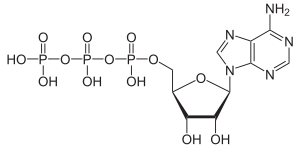
Aus der Sicht der Biochemie wird ATP als Nukleosidtriphosphat klassifiziert, was bedeutet, dass es aus drei Komponenten besteht: einer stickstoffhaltigen Base (Adenin), dem Zucker Ribose und dem Triphosphat. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Adenosintriphosphat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H16N5O13P3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 507,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Adenosintriphosphat, kurz ATP, ist ein Nukleotid, nämlich das Triphosphat des Nucleosids Adenosin. ⓘ
Adenosintriphosphat ist der universelle und unmittelbar verfügbare Energieträger in Zellen und wichtiger Regulator energieliefernder Prozesse. Das Molekül des Adenosintriphosphats besteht aus einem Adeninrest, dem Zucker Ribose und drei Phosphaten (α bis γ) in Ester- (α) bzw. Anhydridbindung (β und γ). ⓘ
Aufbau
ATP besteht aus einem Adenin, das über das 9-Stickstoffatom an das 1′-Kohlenstoffatom eines Zuckers (Ribose) gebunden ist, der wiederum am 5'-Kohlenstoffatom des Zuckers mit einer Triphosphatgruppe verbunden ist. Bei den zahlreichen Reaktionen im Zusammenhang mit dem Stoffwechsel bleiben die Adenin- und die Zuckergruppe unverändert, aber das Triphosphat wird in Di- und Monophosphat umgewandelt, wobei die Derivate ADP bzw. AMP entstehen. Die drei Phosphorylgruppen werden als alpha (α), beta (β) und, für das terminale Phosphat, als gamma (γ) bezeichnet. ⓘ
In neutraler Lösung liegt ionisiertes ATP hauptsächlich als ATP4- vor, mit einem geringen Anteil an ATP3-. ⓘ
Bindung von Metallkationen an ATP
Da ATP polyanionisch ist und eine potenziell chelatbildende Polyphosphatgruppe aufweist, bindet es Metallkationen mit hoher Affinität. Die Bindungskonstante für Mg2+
beträgt (9554). Die Bindung eines zweiwertigen Kations, bei dem es sich fast immer um Magnesium handelt, wirkt sich stark auf die Interaktion von ATP mit verschiedenen Proteinen aus. Aufgrund der Stärke der ATP-Mg2+-Wechselwirkung liegt ATP in der Zelle meist als Komplex mit Mg2+
gebunden an die Phosphatsauerstoffzentren. ⓘ
Ein zweites Magnesiumion ist für die ATP-Bindung in der Kinasedomäne entscheidend. Die Anwesenheit von Mg2+ reguliert die Kinaseaktivität. ⓘ
Chemische Eigenschaften
ATP-Salze können als farblose Feststoffe isoliert werden. ⓘ

ATP ist in wässrigen Lösungen bei einem pH-Wert zwischen 6,8 und 7,4 stabil, wenn keine Katalysatoren vorhanden sind. Bei extremeren pH-Werten wird es schnell zu ADP und Phosphat hydrolysiert. Lebende Zellen halten das Verhältnis von ATP zu ADP an einem Punkt aufrecht, der zehn Größenordnungen vom Gleichgewicht entfernt ist, wobei die ATP-Konzentration fünfmal höher ist als die ADP-Konzentration. Im Zusammenhang mit biochemischen Reaktionen werden die P-O-P-Bindungen häufig als hochenergetische Bindungen bezeichnet. ⓘ
Reaktive Aspekte
Bei der Hydrolyse von ATP in ADP und anorganisches Phosphat werden 20,5 kJ/mol an Enthalpie frei. Die Werte der freien Energie, die durch die Abspaltung einer Phosphat- (Pi) oder einer Pyrophosphateinheit (PPi) von ATP bei einer Standardkonzentration von 1 mol/L bei pH 7 freigesetzt wird, sind:
- ATP + H
2O → ADP + Pi ΔG°' = -30,5 kJ/mol (-7,3 kcal/mol) - ATP + H
2O → AMP + PPi ΔG°' = -45,6 kJ/mol (-10,9 kcal/mol)
Diese abgekürzten Gleichungen können bei einem pH-Wert nahe 7 expliziter geschrieben werden (R = Adenosyl):
- [RO-P(O)2-O-P(O)2-O-PO3]4- + H
2O → [RO-P(O)2-O-PO3]3- + [HPO4]2- + H+ - [RO-P(O)2-O-P(O)2-O-PO3]4- + H
2O → [RO-PO3]2- + [HO3P-O-PO3]3- + H+ ⓘ
Unter zytoplasmatischen Bedingungen, wo das ADP/ATP-Verhältnis 10 Größenordnungen vom Gleichgewicht entfernt ist, beträgt das ΔG etwa -57 kJ/mol. ⓘ

Herstellung aus AMP und ADP
Produktion, aerobe Bedingungen
Eine typische intrazelluläre ATP-Konzentration ist schwer zu bestimmen, Berichten zufolge liegt sie jedoch bei 1-10 μmol pro Gramm Gewebe in einer Vielzahl von Eukaryoten. Die Dephosphorylierung von ATP und die Rephosphorylierung von ADP und AMP treten im Verlauf des aeroben Stoffwechsels wiederholt auf. ⓘ
ATP kann durch eine Reihe verschiedener zellulärer Prozesse erzeugt werden; die drei wichtigsten Wege in Eukaryonten sind (1) Glykolyse, (2) der Zitronensäurezyklus/oxidative Phosphorylierung und (3) Beta-Oxidation. Der Gesamtprozess der Oxidation von Glukose zu Kohlendioxid, die Kombination der Wege 1 und 2, die als Zellatmung bezeichnet wird, erzeugt etwa 30 Äquivalente ATP aus jedem Glukosemolekül. ⓘ
Die ATP-Produktion durch einen nicht-photosynthetischen aeroben Eukaryoten findet hauptsächlich in den Mitochondrien statt, die fast 25 % des Volumens einer typischen Zelle ausmachen. ⓘ
Glykolyse
Bei der Glykolyse werden Glucose und Glycerin zu Pyruvat verstoffwechselt. Die Glykolyse erzeugt zwei Äquivalente ATP durch Substratphosphorylierung, die durch zwei Enzyme, PGK und Pyruvatkinase, katalysiert wird. Außerdem werden zwei Äquivalente NADH erzeugt, die über die Elektronentransportkette oxidiert werden können und zur Erzeugung von zusätzlichem ATP durch ATP-Synthase führen. Das als Endprodukt der Glykolyse entstehende Pyruvat ist ein Substrat für den Krebs-Zyklus. ⓘ
Die Glykolyse wird in zwei Phasen mit jeweils fünf Schritten unterteilt. In Phase 1, der "Vorbereitungsphase", wird die Glukose in 2 d-Glyceraldehyd-3-phosphat (g3p) umgewandelt. Ein ATP wird in Schritt 1 und ein weiteres ATP in Schritt 3 investiert. Die Schritte 1 und 3 der Glykolyse werden als "Priming-Schritte" bezeichnet. In Phase 2 werden zwei Äquivalente von g3p in zwei Pyruvate umgewandelt. In Schritt 7 werden zwei ATP gebildet. In Schritt 10 werden zwei weitere ATP-Äquivalente gebildet. In den Schritten 7 und 10 wird ATP aus ADP erzeugt. Im Glykolysezyklus werden netto zwei ATP gebildet. Der Glykolyse-Weg ist später mit dem Zitronensäurezyklus verbunden, der weitere ATP-Äquivalente erzeugt. ⓘ
Regelung
Bei der Glykolyse wird die Hexokinase direkt durch ihr Produkt, das Glukose-6-Phosphat, gehemmt, und die Pyruvatkinase wird durch ATP selbst gehemmt. Der wichtigste Kontrollpunkt des glykolytischen Weges ist die Phosphofructokinase (PFK), die durch hohe ATP-Konzentrationen allosterisch gehemmt und durch hohe AMP-Konzentrationen aktiviert wird. Die Hemmung der PFK durch ATP ist ungewöhnlich, da ATP auch ein Substrat in der von der PFK katalysierten Reaktion ist; die aktive Form des Enzyms ist ein Tetramer, das in zwei Konformationen vorliegt, von denen nur eine das zweite Substrat Fructose-6-Phosphat (F6P) bindet. Das Protein hat zwei Bindungsstellen für ATP - die aktive Stelle ist in beiden Proteinkonformationen zugänglich, aber die ATP-Bindung an die Inhibitorstelle stabilisiert die Konformation, die F6P schlecht bindet. Eine Reihe anderer kleiner Moleküle kann die ATP-induzierte Verschiebung der Gleichgewichtskonformation ausgleichen und die PFK reaktivieren, darunter zyklisches AMP, Ammoniumionen, anorganisches Phosphat und Fructose-1,6- und -2,6-biphosphat. ⓘ
Zitronensäurezyklus
Im Mitochondrium wird Pyruvat durch den Pyruvat-Dehydrogenase-Komplex zur Acetylgruppe oxidiert, die durch den Zitronensäurezyklus (auch als Krebszyklus bekannt) vollständig zu Kohlendioxid oxidiert wird. Bei jeder "Umdrehung" des Zitronensäurezyklus entstehen zwei Moleküle Kohlendioxid, ein Äquivalent ATP Guanosintriphosphat (GTP) durch Phosphorylierung auf Substratebene, die von der Succinyl-CoA-Synthetase katalysiert wird, wenn Succinyl-CoA in Succinat umgewandelt wird, drei Äquivalente NADH und ein Äquivalent FADH2. NADH und FADH2 werden durch oxidative Phosphorylierung recycelt (zu NAD+ bzw. FAD), wodurch zusätzliches ATP erzeugt wird. Die Oxidation von NADH führt zur Synthese von 2-3 Äquivalenten ATP, und die Oxidation von einem FADH2 ergibt 1-2 Äquivalente ATP. Der Großteil des zellulären ATP wird durch diesen Prozess erzeugt. Obwohl am Zitronensäurezyklus selbst kein molekularer Sauerstoff beteiligt ist, handelt es sich um einen obligat aeroben Prozess, da O2 für das Recycling von NADH und FADH2 verwendet wird. In Abwesenheit von Sauerstoff kommt der Zitronensäurezyklus zum Stillstand. ⓘ
Die Erzeugung von ATP durch das Mitochondrium aus zytosolischem NADH beruht auf dem Malat-Aspartat-Shuttle (und in geringerem Maße auf dem Glycerin-Phosphat-Shuttle), da die innere Mitochondrienmembran für NADH und NAD+ undurchlässig ist. Anstatt das erzeugte NADH zu übertragen, wandelt ein Malatdehydrogenase-Enzym Oxalacetat in Malat um, das in die Mitochondrienmatrix transloziert wird. Eine weitere Malatdehydrogenase-katalysierte Reaktion findet in umgekehrter Richtung statt, wobei Oxalacetat und NADH aus dem neu transportierten Malat und dem internen NAD+-Speicher des Mitochondriums entstehen. Eine Transaminase wandelt das Oxalacetat in Aspartat um, das durch die Membran in den Intermembranraum zurücktransportiert wird. ⓘ
Bei der oxidativen Phosphorylierung wird durch den Durchgang von Elektronen aus NADH und FADH2 durch die Elektronentransportkette die Energie freigesetzt, um Protonen aus der Mitochondrienmatrix in den Intermembranraum zu pumpen. Dieses Pumpen erzeugt eine Protonenmotivationskraft, die der Nettoeffekt eines pH-Gradienten und eines elektrischen Potentialgradienten über die innere Mitochondrienmembran ist. Durch den Fluss der Protonen entlang dieses Potenzialgradienten - d. h. vom Intermembranraum zur Matrix - wird durch die ATP-Synthase ATP erzeugt. Pro Umdrehung werden drei ATP produziert. ⓘ
Obwohl der Sauerstoffverbrauch für die Aufrechterhaltung der Protonenantriebskraft von grundlegender Bedeutung zu sein scheint, trägt im Falle von Sauerstoffmangel (Hypoxie) die intrazelluläre Azidose (vermittelt durch erhöhte glykolytische Raten und ATP-Hydrolyse) zum mitochondrialen Membranpotenzial bei und treibt die ATP-Synthese direkt an. ⓘ
Der größte Teil des in den Mitochondrien synthetisierten ATP wird für zelluläre Prozesse im Zytosol verwendet; daher muss es von seinem Syntheseort in der mitochondrialen Matrix exportiert werden. Die Bewegung von ATP nach außen wird durch das elektrochemische Potenzial der Membran begünstigt, da das Zytosol im Vergleich zur relativ negativen Matrix eine relativ positive Ladung aufweist. Für jedes ATP, das nach außen transportiert wird, kostet es 1 H+. Die Herstellung von einem ATP kostet etwa 3 H+. Für die Herstellung und den Export von einem ATP werden also 4 H+ benötigt. Die innere Membran enthält einen Antiporter, die ADP/ATP-Translokase, ein integrales Membranprotein, das zum Austausch von neu synthetisiertem ATP in der Matrix gegen ADP im Intermembranraum dient. Diese Translokase wird durch das Membranpotential angetrieben, da sie dazu führt, dass etwa 4 negative Ladungen durch die Mitochondrienmembran nach außen transportiert werden, im Austausch für 3 negative Ladungen, die nach innen bewegt werden. Sie ist jedoch auch notwendig, um Phosphat in das Mitochondrium zu transportieren; der Phosphatcarrier bewegt mit jedem Phosphat ein Proton hinein, wodurch der Protonengradient teilweise abgebaut wird. Nach Abschluss der Glykolyse, des Zitronensäurezyklus, der Elektronentransportkette und der oxidativen Phosphorylierung werden pro Glukose etwa 30-38 ATP-Moleküle erzeugt. ⓘ
Regelung
Der Zitronensäurezyklus wird hauptsächlich durch die Verfügbarkeit von Schlüsselsubstraten reguliert, insbesondere durch das Verhältnis von NAD+ zu NADH und die Konzentrationen von Calcium, anorganischem Phosphat, ATP, ADP und AMP. Citrat - das Ion, das dem Zyklus seinen Namen gibt - ist ein Feedback-Inhibitor der Citrat-Synthase und hemmt auch die PFK, wodurch eine direkte Verbindung zwischen der Regulierung des Zitronensäurezyklus und der Glykolyse hergestellt wird. ⓘ
Beta-Oxidation
In Anwesenheit von Luft und verschiedenen Cofaktoren und Enzymen werden Fettsäuren in Acetyl-CoA umgewandelt. Dieser Weg wird als Beta-Oxidation bezeichnet. Jeder Zyklus der Beta-Oxidation verkürzt die Fettsäurekette um zwei Kohlenstoffatome und erzeugt jeweils ein Äquivalent Acetyl-CoA, NADH und FADH2. Das Acetyl-CoA wird durch den Zitronensäurezyklus verstoffwechselt, um ATP zu erzeugen, während das NADH und FADH2 durch oxidative Phosphorylierung zur Erzeugung von ATP verwendet werden. Dutzende von ATP-Äquivalenten werden durch die Beta-Oxidation einer einzigen langen Acylkette erzeugt. ⓘ
Regelung
Bei der oxidativen Phosphorylierung ist der wichtigste Kontrollpunkt die von der Cytochrom-c-Oxidase katalysierte Reaktion, die durch die Verfügbarkeit ihres Substrats - der reduzierten Form von Cytochrom c - reguliert wird. Die Menge an verfügbarem reduziertem Cytochrom c steht in direktem Zusammenhang mit den Mengen anderer Substrate:
was diese Gleichung direkt impliziert:
Ein hohes Verhältnis von [NADH] zu [NAD+] oder ein hohes Verhältnis von [ADP][Pi] zu [ATP] impliziert also eine hohe Menge an reduziertem Cytochrom c und eine hohe Cytochrom-c-Oxidase-Aktivität. Eine zusätzliche Regulierungsebene wird durch die Transportraten von ATP und NADH zwischen der Mitochondrienmatrix und dem Zytoplasma geschaffen. ⓘ
Ketose
Ketonkörper können als Brennstoffe verwendet werden und liefern 22 ATP- und 2 GTP-Moleküle pro Acetoacetat-Molekül, wenn sie in den Mitochondrien oxidiert werden. Ketonkörper werden von der Leber zu anderen Geweben transportiert, wo Acetoacetat und Beta-Hydroxybutyrat über den Zitronensäurezyklus wieder in Acetyl-CoA umgewandelt werden können, um reduzierende Äquivalente (NADH und FADH2) zu erzeugen. Ketonkörper können von der Leber nicht als Brennstoff verwendet werden, da der Leber das Enzym β-Ketoacyl-CoA-Transferase, auch Thiolase genannt, fehlt. Acetoacetat in niedrigen Konzentrationen wird von der Leber aufgenommen und über den Methylglyoxalweg entgiftet, der mit Laktat endet. Acetoacetat in hohen Konzentrationen wird von anderen Zellen als denen der Leber aufgenommen und gelangt über 1,2-Propandiol in einen anderen Stoffwechselweg. Obwohl dieser Weg eine andere Reihe von Schritten umfasst, die ATP erfordern, kann 1,2-Propandiol in Pyruvat umgewandelt werden. ⓘ
Produktion, anaerobe Bedingungen
Unter Fermentation versteht man den Stoffwechsel organischer Verbindungen unter Ausschluss von Luft. Sie beinhaltet eine Phosphorylierung auf Substratebene in Abwesenheit einer respiratorischen Elektronentransportkette. Die Gleichung für die Reaktion von Glukose zu Milchsäure lautet:
- C
6H
12O
6 + 2 ADP + 2 Pi → 2 CH
3CH(OH)COOH + 2 ATP + 2 H
2O ⓘ
Anaerobe Atmung ist Atmung in Abwesenheit von O
2. Prokaryoten können eine Vielzahl von Elektronenakzeptoren nutzen. Dazu gehören Nitrat, Sulfat und Kohlendioxid. ⓘ
ATP-Ergänzung durch Nukleosiddiphosphat-Kinasen
ATP kann auch durch mehrere so genannte "Auffüllreaktionen" synthetisiert werden, die von den Enzymfamilien der Nukleosiddiphosphatkinasen (NDKs), die andere Nukleosidtriphosphate als energiereichen Phosphatdonator verwenden, und der ATP:Guanidophosphotransferase-Familie katalysiert werden. ⓘ
ATP-Produktion während der Photosynthese
In Pflanzen wird ATP in der Thylakoidmembran des Chloroplasten synthetisiert. Dieser Vorgang wird Photophosphorylierung genannt. Die "Maschinerie" ähnelt der in den Mitochondrien, mit dem Unterschied, dass die Lichtenergie dazu verwendet wird, Protonen durch die Membran zu pumpen, um eine protonenmotorische Kraft zu erzeugen. Anschließend erfolgt die ATP-Synthase genau wie bei der oxidativen Phosphorylierung. Ein Teil des in den Chloroplasten produzierten ATP wird im Calvin-Zyklus verbraucht, der Triosezucker produziert. ⓘ
ATP-Recycling
Die Gesamtmenge an ATP im menschlichen Körper beträgt etwa 0,1 mol/L. Der größte Teil des ATP wird durch die oben erwähnten Prozesse aus ADP recycelt. Somit bleibt die Gesamtmenge an ATP + ADP zu jedem Zeitpunkt ziemlich konstant. ⓘ
Die von den menschlichen Zellen eines Erwachsenen verbrauchte Energie erfordert die Hydrolyse von 100 bis 150 mol/l ATP pro Tag, was bedeutet, dass ein Mensch im Laufe eines Tages in der Regel sein Körpergewicht an ATP verbraucht. Jedes ATP-Äquivalent wird an einem einzigen Tag 1000-1500 Mal recycelt (150 / 0,1 = 1500), und zwar mit etwa 9×1020 Molekülen pro Sekunde. ⓘ
Biochemische Funktionen
Intrazelluläre Signalübertragung
ATP ist an der Signaltransduktion beteiligt, indem es als Substrat für Kinasen dient, Enzyme, die Phosphatgruppen übertragen. Kinasen sind die am häufigsten vorkommenden ATP-bindenden Proteine. Sie haben eine kleine Anzahl gemeinsamer Falten. Die Phosphorylierung eines Proteins durch eine Kinase kann eine Kaskade wie die Mitogen-aktivierte Proteinkinase-Kaskade aktivieren. ⓘ
ATP ist auch ein Substrat der Adenylatzyklase, vor allem in Signalübertragungswegen von G-Protein-gekoppelten Rezeptoren, und wird in einen zweiten Botenstoff, zyklisches AMP, umgewandelt, der an der Auslösung von Kalziumsignalen durch die Freisetzung von Kalzium aus intrazellulären Speichern beteiligt ist. Diese Form der Signaltransduktion ist besonders wichtig für die Gehirnfunktion, obwohl sie auch an der Regulierung einer Vielzahl anderer zellulärer Prozesse beteiligt ist. ⓘ
DNA- und RNA-Synthese
ATP ist eines der vier Monomere, die für die RNA-Synthese benötigt werden. Dieser Prozess wird durch RNA-Polymerasen gefördert. Ein ähnlicher Prozess findet bei der Bildung von DNA statt, nur dass ATP zunächst in das Desoxyribonukleotid dATP umgewandelt wird. Wie viele Kondensationsreaktionen in der Natur verbrauchen auch die DNA-Replikation und die DNA-Transkription ATP. ⓘ
Aminosäureaktivierung bei der Proteinsynthese
Die Enzyme der Aminoacyl-tRNA-Synthetase verbrauchen ATP bei der Bindung von tRNA an Aminosäuren und bilden Aminoacyl-tRNA-Komplexe. Die Aminoacyltransferase bindet die AMP-Aminosäure an die tRNA. Die Kopplungsreaktion läuft in zwei Schritten ab:
- aa + ATP ⟶ aa-AMP + PPi
- aa-AMP + tRNA ⟶ aa-tRNA + AMP ⓘ
Die Aminosäure ist an das vorletzte Nukleotid am 3′-Ende der tRNA (das A in der Sequenz CCA) über eine Esterbindung gekoppelt (Rollover in der Abbildung). ⓘ
ATP-Bindungskassetten-Transporter
Der Transport von Chemikalien aus einer Zelle gegen ein Gefälle ist häufig mit ATP-Hydrolyse verbunden. Der Transport wird durch ATP-bindende Kassettentransporter vermittelt. Das menschliche Genom kodiert für 48 ABC-Transporter, die für den Export von Medikamenten, Lipiden und anderen Verbindungen verwendet werden. ⓘ
Extrazelluläre Signalübertragung und Neurotransmission
Zellen schütten ATP aus, um mit anderen Zellen zu kommunizieren, ein Prozess, der als purinerge Signalübertragung bezeichnet wird. ATP dient in vielen Teilen des Nervensystems als Neurotransmitter, moduliert den Zilienschlag, beeinflusst die Sauerstoffversorgung der Gefäße usw. ATP wird entweder durch Kanalproteine direkt über die Zellmembran ausgeschieden oder in Vesikel gepumpt, die dann mit der Membran verschmelzen. Die Zellen erkennen ATP über die purinergen Rezeptorproteine P2X und P2Y. ⓘ
Löslichkeit von Proteinen
Kürzlich wurde vorgeschlagen, dass ATP als biologisches Hydrotropikum wirkt und nachweislich die Löslichkeit von Proteomen beeinflusst. ⓘ
ATP-Analoga
In biochemischen Labors werden häufig In-vitro-Studien durchgeführt, um ATP-abhängige molekulare Prozesse zu untersuchen. ATP-Analoga werden auch in der Röntgenkristallographie verwendet, um die Struktur eines Proteins im Komplex mit ATP zu bestimmen, oft zusammen mit anderen Substraten. ⓘ
Enzyminhibitoren von ATP-abhängigen Enzymen wie Kinasen werden benötigt, um die an ATP-abhängigen Reaktionen beteiligten Bindungsstellen und Übergangszustände zu untersuchen. ⓘ
Die meisten nützlichen ATP-Analoga können nicht wie ATP hydrolysiert werden; stattdessen halten sie das Enzym in einer Struktur gefangen, die dem ATP-gebundenen Zustand sehr ähnlich ist. Adenosin-5′-(γ-thiotriphosphat) ist ein sehr häufig vorkommendes ATP-Analogon, bei dem eines der Gamma-Phosphat-Sauerstoffatome durch ein Schwefelatom ersetzt ist; dieses Anion wird wesentlich langsamer hydrolysiert als ATP selbst und wirkt als Hemmstoff für ATP-abhängige Prozesse. In kristallographischen Studien werden die Übergangszustände der Hydrolyse durch das gebundene Vanadat-Ion modelliert. ⓘ
Bei der Interpretation der Ergebnisse von Experimenten, bei denen ATP-Analoga verwendet werden, ist Vorsicht geboten, da einige Enzyme sie bei hohen Konzentrationen mit nennenswerten Raten hydrolysieren können. ⓘ
Medizinische Anwendung
ATP wird intravenös bei einigen Herzkrankheiten eingesetzt. ⓘ
Geschichte
ATP wurde 1929 von Karl Lohmann und Jendrassik sowie unabhängig davon von Cyrus Fiske und Yellapragada Subba Rao von der Harvard Medical School entdeckt, wobei beide Teams gegeneinander antraten, um einen Nachweis für Phosphor zu finden. ⓘ
Fritz Albert Lipmann schlug 1941 vor, Phosphor als Vermittler zwischen energieliefernden und energieaufwendigen Reaktionen in den Zellen einzusetzen. ⓘ
Im Jahr 1948 wurde es erstmals von Alexander Todd im Labor synthetisiert, der 1957 unter anderem für diese Arbeit den Nobelpreis für Chemie erhielt. ⓘ
Der Nobelpreis für Chemie 1978 wurde Dr. Peter Dennis Mitchell für die Entdeckung des chemiosmotischen Mechanismus der ATP-Synthese verliehen. ⓘ
Der Nobelpreis für Chemie 1997 wurde geteilt, eine Hälfte gemeinsam an Paul D. Boyer und John E. Walker "für die Aufklärung des enzymatischen Mechanismus, der der Synthese von Adenosintriphosphat (ATP) zugrunde liegt" und die andere Hälfte an Jens C. Skou "für die erste Entdeckung eines ionentransportierenden Enzyms, der Na+, K+ -ATPase". ⓘ

Adenosintriphosphat wurde 1929 von dem deutschen Biochemiker Karl Lohmann entdeckt. Eine chemische Synthese von ATP wurde erstmals 1949 von James Baddiley und Alexander Robertus Todd veröffentlicht. Die Rolle als Hauptenergiequelle in Zellen wurde 1939 bis 1941 von Fritz Lipmann aufgeklärt, nachdem schon Wladimir Alexandrowitsch Engelhardt 1935 gezeigt hatte, dass ATP für Muskelkontraktionen notwendig ist, und Herman Moritz Kalckar 1937 den Zusammenhang der Zellatmung mit der Biosynthese von ATP nachgewiesen hatte. Untereinheiten der dafür zuständigen ATP-Synthase wurden erstmals von Efraim Racker ab 1960 isoliert. ⓘ
Energieträger
Auch Prozesse in Zellen benötigen Energie, um chemische Arbeit wie Synthese organischer Moleküle, osmotische Arbeit wie aktiven Stofftransport durch Biomembranen und mechanische Arbeit wie bei der Muskelkontraktion zu leisten. Als Überträger von Energie wird vornehmlich ATP genutzt. Die Phosphatreste dieses Nukleosidtriphosphats sind über Phosphoranhydrid-Bindungen (Säureanhydrid-Bindungen) miteinander verbunden. Durch enzymkatalysierte Hydrolyse können eine oder zwei Phosphatgruppen abgespalten werden und es entsteht Adenosindiphosphat (ADP) und Monophosphat oder Adenosinmonophosphat (AMP) und Pyrophosphat. Bei der Spaltung der Phosphatbindungen wird unter Standardbedingungen jeweils 32,3 kJ/mol bei Spaltung einer Bindung oder 64,6 kJ/mol bei Spaltung beider Bindungen für Arbeitsleistungen nutzbar. ⓘ
Signalmolekül
Intrazellulär
ATP ist ein Cosubstrat der Kinasen, einer Gruppe von phosphatübertragenden Enzymen, die im Metabolismus und bei der Stoffwechselregulation eine Schlüsselrolle spielen. Bedeutende Mitglieder der letzteren Gruppe sind die Proteinkinasen, die je nach ihrem Aktivierungsmechanismus als Proteinkinase A (PKA, cAMP-abhängig), Proteinkinase C (PKC, Calcium-abhängig), Calmodulin-abhängige Kinase, oder Insulin-stimulierte Proteinkinase (ISPK) bezeichnet werden, um nur einige Beispiele zu nennen. Unter Blutzucker werden einige Grundprinzipien angesprochen, nach denen eine Serie von Kinasen zu einer Enzymkaskade zusammengeschaltet sein kann. ⓘ
Extrazellulär
ATP (wie auch ADP und Adenosin) ist Agonist purinerger Rezeptoren, die sowohl im zentralen als auch im peripheren Nervensystem eine Rolle spielen. Somit ist es beteiligt an Prozessen wie der Durchblutungsregulation oder der Vermittlung von Entzündungsreaktionen. Es wird nach neuronalen Verletzungen ausgeschüttet und kann die Proliferation von Astrozyten und Neuronen stimulieren. ⓘ
Regeneration
Kurzzeitregeneration in Muskelzellen
Da die oxidative Phosphorylierung in der Atmungskette ein relativ langsamer Prozess ist, muss der ATP-Vorrat in stark beanspruchten Zellen (Muskelzellen) auch kurzfristig wieder aufgefüllt werden. Der ATP-Vorrat (in der Muskelzelle ca. 6 mmol/kg Muskel) reicht bei maximaler Kontraktion nur etwa 2–3 Sekunden. Eine Reserve stellen hier Moleküle mit höherem Gruppenübertragungspotenzial als ATP dar. Säugetiermuskelzellen halten einen Vorrat an Kreatinphosphat (21 mmol/kg Muskel; 0,08 % pro Körpergewicht) bereit. Die Creatin-Kinase katalysiert die Übertragung der Phosphorylgruppe vom Kreatinphosphat an das ADP. Ist dieser Vorrat nach 6–10 Sekunden verbraucht, müssen die oben genannten Mechanismen die ATP-Regeneration allein tragen. ⓘ
Energiebereitstellung in Muskelzellen
Während starker Muskelbeanspruchung bauen Muskelzellen Glucose zu Lactat in der Milchsäuregärung ab, um schnell ATP zu erzeugen. Lactat selbst wird in der Leber wieder zu Pyruvat und dann zu Glucose unter ATP-Verbrauch aufgebaut (Gluconeogenese). Diese Glucose wird dann wieder dem Muskel als Energiequelle zur Verfügung gestellt. Dieser Kreislauf wird auch als Cori-Zyklus bezeichnet. ⓘ
Im Notfall werden zur Energieerzeugung auch körpereigene Proteine abgebaut. Proteine werden in Aminosäuren zerlegt, und diese meistens zu Pyruvat abgebaut. In einem dem Cori-Zyklus ähnlichen Weg wird Pyruvat zunächst zu Alanin transaminiert und zur Leber transportiert. Dort kehren sich diese Schritte um und die Leber erzeugt aus Pyruvat wieder Glucose, die dem Muskel bereitgestellt wird. Dieser Zyklus wird auch als Glucose-Alanin-Zyklus bezeichnet. ⓘ
Energiebereitstellung im Herzmuskel
Der Herzmuskel nutzt Fettsäuren als Brennstoff, diese werden in der β-Oxidation in den zahlreichen Mitochondrien abgebaut. Des Weiteren können auch Glucose, Lactat (über Reoxidation zu Pyruvat), Ketonkörper und Glykogen abgebaut werden. Bei hoher Belastung können bis zu 60 % der Energie aus der Oxidation von Lactat gewonnen werden. ⓘ
Konzentrationen
In der Zelle ist die ATP-Konzentration eine Regelgröße: Das Absinken unter 4–5 mmol/l aktiviert energieliefernde Reaktionen (siehe Phosphofructokinase); das Übersteigen des Schwellenwertes bewirkt Energiespeicherung, z. B. durch Bildung von Kreatinphosphat als schnell verfügbaren (ATP-liefernden) Speicher im Muskel oder Aufbau von Glykogen als „Energiepolster“ in der Leber. Kohlenhydrat- und Proteinspeicher sind allerdings limitiert. Weiterer Energieüberschuss führt (über Acetyl-CoA) zur Speicherung von Fett. ⓘ
Umsatz
Bei einem durchschnittlichen Erwachsenen entspricht die Menge ATP, die täglich in seinem Körper auf- und abgebaut wird, etwa seiner halben Körpermasse. So setzt ein 80 kg schwerer Mann etwa 40 kg ATP am Tag um, was etwa 78,8 mol oder 1025 Molekülen entspricht, die wieder neu gebildet werden. Bei intensiver körperlicher Arbeit kann der ATP-Umsatz auf 0,5 kg pro Minute ansteigen. ⓘ


![{\displaystyle {\frac {[\mathrm {cyt~c_{red}} ]}{[\mathrm {cyt~c_{ox}} ]}}=\left({\frac {[\mathrm {NADH} ]}{[\mathrm {NAD} ]^{+}}}\right)^{\frac {1}{2}}\left({\frac {[\mathrm {ADP} ][\mathrm {P_{i}} ]}{[\mathrm {ATP} ]}}\right)K_{\mathrm {eq} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/baed008d658c507750599ae155a9a1c11da873e7)
